基于刺梨果渣制备抗结肠炎的提取物及其制备方法和应用
1.本发明涉及一种抗结肠炎的提取物,特别是一种基于刺梨果渣制备抗结肠炎的提取物及其制备方法和应用。
背景技术:
2.随着社会的不断发展,生活节奏也变的越来越快,生活压力随之增加,越来越多的人处于亚健康状态。导致亚健康的原因很多,其中,不良的生活方式是主要原因之一。其表现有:饮酒频繁,肝损伤和酒精肝;饮食没规律、久坐、运动量少,胃肠道疾病,大便不正常,肠炎频发;工作压力大,生活没规律,心烦、睡觉不好、抑郁,等等。人的亚健康现已经是一种常态。因此,各种保健品逐渐盛行、备受青睐。源于天然原料的保健品,安全有保障,药效明显,市场认可度高。因此,从药食同源植物、食材中提取、精制、研制出对人体无损害,且具有功效健康养生的产品显得尤为重要。
3.刺梨(rosa roxbughii tratt)为蔷薇科落叶灌木植物。刺梨果被誉“维c之王”、“中国登义果”以及“炎黄圣果”,是第三代水果(3g)代表的珍贵水果资源。刺梨已被列入卫健委批准的食品新资源名单品种,现为普通食品;1994和2003版《贵州省中药材、民族药材质量标准》均将刺梨收录其中,刺梨具有药用和食用的双重属性。
4.刺梨作为一种食药用经济作物,主产于我国西南地区,已有大量栽培,鲜榨刺梨汁是刺梨果加工的主要方式,产生的刺梨果渣量大,不完全统计,每年果渣有几十万吨,除了少量用于袋泡茶、饲料添加等,大部分没有资源化利用。果渣中含有丰富的黄酮和刺梨三萜类化合物等活性物质,但一直以来对刺梨果渣活性化学成分缺乏系统性研究和开发,资源浪费严重。
技术实现要素:
5.本发明的目的在于,提供一种基于刺梨果渣制备抗结肠炎的提取物及其制备方法和应用。本发明充分利用刺梨果渣,有效提取刺梨果渣中的有效成分,节约资源,且提取到的提取物具有显著的抗结肠炎作用。
6.本发明的技术方案:基于刺梨果渣制备抗结肠炎的提取物,所述提取物含有总三萜和总黄酮,其中总三萜的含量为10%~45%;总黄酮的含量为1%~3%。
7.前述的基于刺梨果渣制备抗结肠炎的提取物中,所述总三萜包括蔷薇酸、2
‑
氧代坡模醇酸、kajiichigoside f1和刺梨酸;所述总黄酮包括槲皮素、儿茶素、二氢杨梅素和芦丁。
8.前述的基于刺梨果渣制备抗结肠炎的提取物中,所述总三萜的含量为蔷薇酸、2
‑
氧代坡模醇酸、kajiichigoside f1和刺梨酸的含量总和,总黄酮的含量为槲皮素、儿茶素、二氢杨梅素和芦丁的含量总和。
9.前述的基于刺梨果渣制备抗结肠炎的提取物中,所述总三萜的含量是以熊果酸为对照品,利用香草醛
‑
冰醋酸
‑
高氯酸显色比色法测定得到;所述总黄酮的含量是以槲皮素、
儿茶素、二氢杨梅素和芦丁为对照品,利用高效液相色谱法测定得到。
10.上述的基于刺梨果渣制备抗结肠炎的提取物的制备方法,包括以下步骤:取刺梨鲜榨果渣或干燥果渣,用重量为果渣重量的10
‑
20倍的50
‑
95%乙醇水溶液回流提取2
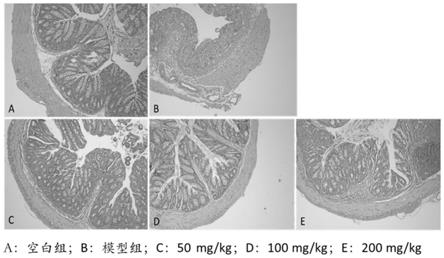
‑
4次,每次1.5
‑
3小时,过滤,合并滤液,回收乙醇,在滤液中加体积为滤液体积的0.5
‑
1倍的水进行分散,抽滤,水洗沉淀2
‑
4次,然后用石油醚或正己烷洗沉淀2
‑
4次,干燥沉淀得提取物。
11.前述的制备方法中,所述干燥为冷冻干燥或真空减压干燥。
12.上述的基于刺梨果渣制备抗结肠炎的提取物的应用,所述提取物具有抗结肠炎作用。
13.前述的应用中,所述提取物通过保护结肠黏膜、调节氧化应激通路的nrf2靶点发挥抗结肠炎作用。
14.前述的应用中,所述提取物用于制备预防或治疗结肠炎的药物、药物原料或者食品添加剂。
15.前述的应用中,所述提取物制备药物或功能食品时,直接使用或者以组合物的形式使用;所述组合物包括0.1
–
99%的提取物,其余为载体或赋形剂;所述药物或功能食品的剂型为硬胶囊、片剂、口服液、颗粒剂、软胶囊或滴丸剂。
16.其中,刺梨果渣活性提取物鉴定方法为:向提取物样品中加入1ml70%的甲醇内标提取液,斡旋5min混匀,离心(1200r/min,4℃)10min,取上清液用微孔滤膜(0.22μm)过滤,保存于进样瓶中,用于lc
‑
ms/ms检测。
17.色谱质谱采集条件:使用thermo fisher scientific公司生产的dionex ultimate 3000rslc(hpg)液相色谱仪与thermo scientific q exactive focus质谱仪进行检测,hesi
‑
ii离子源,thermo fisher hypersil gold a q(100*2.1mm,1.9μm)色谱柱。离子源参数设置为spray voltage(3.0kv(+)/2.5kv(
‑
));capillary temperature(320℃);sheath gas(35arb);aux gas(10arb);sweep gas(0arb);probe heater temperature(350℃);s
‑
lens(60)。流动相中a相为乙腈(0.1%甲酸)、b相为0.1%甲酸水,梯度洗脱0~50min a为5%~95%,流速为0.3ml/min,柱温为40℃。质谱扫描参数设置scan mode(full ms
‑
ddms2),full ms scan range(100to 1500m/z),spectrum data type(profile),resolution(full ms:70,000,ms/ms:17,500),agc target(full ms:1e6,ms/ms:2e5),maximum it(full ms:100ms,ms/ms:50ms),isolation width(1.5m/z),dynamic exclution(5s),nce(stepped nce):20,40,60。对得到的提取物进行质谱分析,如图1
‑
5所示。图1
‑
5分别为刺梨果渣活性提取物中槲皮素、刺梨酸、蔷薇酸、2
‑
氧代坡模醇酸、kajiichigoside f1的质谱图。
18.与现有技术相比,本发明提供的从刺梨果渣中提取富含三萜和黄酮的制备方法不仅有效浓缩、富集了刺梨果渣中的三萜、黄酮活性成分,且该工艺经济、成本低、简单易行、无环境压力,易于实现工业化、规模化生产;以废弃的刺梨果渣进行提取,所得活性提取物具有显著的抗结肠炎活性,可用于制备预防或者治疗结肠炎的药物、辅助药物、保健品、食品添加剂(营养补充剂)或酒原料等,对刺梨产业废弃物刺梨果渣进行了充分的资源化利用,填补市场上对于刺梨果渣提取物制备和应用的空白,减少资源浪费现象,为抗结肠炎的医药和食品行业提供活性中间体或添加剂原料,为抗结肠炎的药物或者食品的研发提供一种新的技术支持,具有较高的应用价值和市场前景。
19.通过动物试验,表明了刺梨果渣活性提取物对小鼠体重影响不大;对结肠和脾脏有明显的保护作用,通过调节氧化应激通路的nrf2靶点发挥抗炎作用,能有效保护结肠黏膜。
附图说明
20.图1为刺梨果渣活性提取物中槲皮素的质谱图;
21.图2为刺梨果渣活性提取物中刺梨酸的质谱图;
22.图3为刺梨果渣活性提取物中蔷薇酸的质谱图;
23.图4为刺梨果渣活性提取物中2
‑
氧代坡模醇酸的质谱图;
24.图5为刺梨果渣活性提取物中kajiichigoside f1的质谱图;
25.图6为各组小鼠体重、结肠长度、结肠湿重指数及脾脏重量检测图;
26.图7为各组小鼠结肠h&e染色(
×
100)光镜图;
27.图8为刺梨果渣活性提取物对小鼠结肠组织中keap1及nrf2蛋白含量表达的影响效果图。
具体实施方式
28.下面结合实施例对本发明作进一步的说明,但并不作为对本发明限制的依据。
29.实施例1:
30.一种基于刺梨果渣制备抗结肠炎的提取物,所述提取物中含有总三萜和总黄酮,其中总三萜的含量为20%;总黄酮的含量为1.5%。
31.上述提取物的制备方法为:取刺梨鲜榨果渣1.0kg,用10l的60%乙醇水溶液回流提取2次,每次1.5小时,过滤,合并滤液,回收乙醇无醇味,加0.5~1倍体积水进行分散,抽滤,水洗沉淀2~4次,再用石油醚(沸程为60
‑
90℃)洗沉淀2~4次,干燥沉淀得活性提取物80g。
32.实施例2:
33.一种基于刺梨果渣制备抗结肠炎的提取物,所述提取物中含有总三萜和总黄酮,其中总三萜的含量为10%;总黄酮的含量为3%。
34.上述提取物的制备方法为:取干燥刺梨果渣1.0kg,用10l的80%乙醇水溶液回流提取4次,每次3小时,过滤,合并滤液,回收乙醇无醇味,加0.5~1倍体积水进行分散,抽滤,水洗沉淀2~4次,再用正己烷洗沉淀2~4次,干燥沉淀得活性提取物100g。
35.实施例3:
36.一种基于刺梨果渣制备抗结肠炎的提取物,所述提取物中含有总三萜和总黄酮,其中总三萜的含量45%;总黄酮的含量为1%。
37.上述提取物的制备方法为:取刺梨鲜榨果渣1.0kg,用20l的90%乙醇水溶液回流提取2次,每次1.5小时,过滤,合并滤液,回收乙醇无醇味,加0.5~1倍体积水进行分散,抽滤,水洗沉淀2~4次,再用正己烷洗沉淀2~4次,干燥沉淀得活性提取物85g。
38.实施例4:
39.一种基于刺梨果渣制备抗结肠炎的提取物,所述提取物中含有总三萜和总黄酮,其中总三萜的含量为30%;总黄酮的含量为1.5%。
40.上述提取物的制备方法为:取干燥刺梨果渣1.0kg,用20l的90%乙醇水溶液回流提取4次,每次3小时,过滤,合并滤液,回收乙醇无醇味,加0.5~1倍体积水进行分散,抽滤,水洗沉淀2~4次,再用正己烷洗沉淀2~4次,干燥沉淀得活性提取物106g。
41.本发明提取物的应用,将提取物制备成药物或者功能食品,下述实施例5
‑
11为药物或功能食品的剂型(片剂、软胶囊、硬胶囊、口服液、颗粒剂或滴丸剂)的实施例。每种剂型均为口服,一日1
‑
3次,每日服用量以活性提取物计不超过100mg。
42.实施例5:
43.取实施例1制得的活性提取物,按活性提取物与赋形剂的重量比为1:1的比例,按常规方法制粒压片。
44.按照重量份数计,片剂包括以下含量的成分:活性提取物10份、淀粉200份、18%的淀粉浆30份、滑石粉15份。
45.实施例6:
46.取实施例1制得的活性提取物,按活性提取物与赋形剂的重量比为1:1的比例,按常规硬胶囊制剂方法制成硬胶囊。
47.硬胶囊剂包括以下含量的成分:活性提取物10份、淀粉150份、滑石粉15份。
48.硬胶囊制剂方法为:将活性提取物与辅料混合,过筛,在合适的容器中均匀混合得到混合物,把混合物装入空心胶囊。
49.实施例7:
50.取实施例1制得的活性提取物,按常规软胶囊制剂方法制成软胶囊。
51.制备方法:将活性提取物与辅料混合,在合适的容器中均匀混合得到混合物,把混合物装入空心软胶囊。
52.实施例8:
53.取实施例1制得的活性提取物制成口服剂。
54.口服剂的制备方法:取100mg的活性提取物溶解于0.5ml的聚乙二醇400中,加入纯水适量,过滤(0.45μm),滤液在无菌条件下装入安瓿瓶中。
55.实施例9:
56.取实施例1制得的活性提取物制成颗粒剂。
57.制备方法:将100mg的活性提取物经粉碎、过筛,与辅料混合均匀,加入适量的黏合剂制软材;将软材挤压通过筛网,得湿颗粒;干燥、整粒与分级;获得具有一定粒度分布的颗粒,制得的颗粒经质量检查后,按剂量分装、包装,颗粒剂应密封、置于干燥处贮存。
58.实施例10:
59.取实施例1制得的活性提取物制成滴丸剂。
60.制备方法:将基质加热熔融,然后将100mg的活性提取物溶解、混悬或乳化于熔融的基质中,保温下滴入不相混溶的液状石蜡、植物油、二甲硅油、水或不同浓度的乙醇等冷却液里,在表面张力的作用下,熔融基质收缩成球状,冷却固化成丸。
61.实施例11:
62.取实施例1制得的活性提取物制成酒剂。
63.配制酒剂:将活性提取物200mg,溶解在500ml酱香型白酒(53度)中,摇动或超声波助溶,封装即可。
64.为进一步验证本发明基于刺梨果渣制备的提取物抗结肠炎作用效果,采用实施例1所制备的活性提取物做药理活性实验,试验方法如下。
65.1.实验材料
66.葡聚糖硫酸钠(dss)购自mpbiomedicals公司(美国);
67.裂解液(ripa)、bca蛋白浓度测定试剂盒、marker、β
‑
actin多克隆抗体、山羊抗兔igg、山羊抗小鼠igg:江苏碧云天生物技术研究所;
68.甲苯胺蓝溶液:北京索莱宝科技有限公司;
69.tris、sds及甘氨酸:solarbio science公司;
[0070]5×
上样品缓冲液:北京庄盟生物基因公司;
[0071]
pvdf膜:millipore trading co.ltd;nrf2(ab156883),keap1(ab119403)购买于英国abcam公司。
[0072]
供试样品:刺梨果渣活性提取物(实施例1制备的活性提取物,其中总三萜20%,总黄酮1.5%)。
[0073]
2.实验仪器
[0074]
max
‑
190型酶标仪(molecular devices公司,美国)、恒温培养箱(上海博泰实验设备有限公司,中国)、96孔板细胞购自corning costar(cambridge ma公司,美国)。
[0075]
3试验方法
[0076]
将试验小鼠随机分为5组,分别空白组、模型组、活性提取物低剂量组、中剂量组和高剂量组,其中空白组及模型组给生理盐水,刺梨果渣活性提取物低剂量组、中剂量组、高剂量组分别给50mg/kg、100mg/kg及200mg/kg,各组连续灌胃给药7天,一天1次。同时模型组及活性提取物各组以3%dss替代蒸馏水,各组自由饮食。7天后,各小鼠解剖,打开腹腔,分离结肠,取出结肠全段及脾脏,测定结肠长度并精密称量结肠及脾脏重量。统计并分析各组小鼠结肠长度、结肠湿重指数及脾脏重量的差别,对小鼠结肠组织进行h&e染色,采用western blot检测刺梨果渣活性提取物对小鼠结肠组织中keap1及nrf2蛋白含量表达的影响。
[0077]
4.实验结果
[0078]
4.1动物实验结果
[0079]
与空白组相比,其中“#”表示p<0.05,“##”表示p<0.01,“###”表示p<0.001,与模型组相比,“*”表示p<0.05,“**”表示p<0.01,“***”表示p<0.001。从图6a可以看出空白组小鼠体重逐渐增加,自由饮用3%dss溶液的模型组4天后出现明显体重减轻。刺梨果渣活性提取物低剂量组体重在第四天减轻后有所回升,第7天呈下降趋势,刺梨果渣活性提取物中剂量组、高剂量组给药第4天后体重有所下降,第5天开始呈上升趋势。图6b显示dss模型组小鼠结肠与空白组相比,结肠长度明显减小(p<0.001),刺梨果渣活性提取物组与模型组相比,结肠长度有所增加,其中活性提取物100mg/kg的中剂量组效果最明显(p<0.01),200mg/kg的高剂量组效果比较明显(p<0.05)。图6c显示dss模型组小鼠结肠与空白组相比,结肠湿重指数增加(p<0.05),活性提取物组与模型组相比,结肠湿重指数有所减小,其中活性提取物为100mg/kg的中剂量组效果最明显(p<0.001),200mg/kg的高剂量组效果比较明显(p<0.01)。图6d显示dss模型组小鼠与空白组相比,脾脏重量明显增加(p<0.01),活性提取物组与模型组相比,脾脏重量有所减小,其中活性提取物为100mg/kg的中
剂量组效果最明显(p<0.05)。以上试验结果说明刺梨果渣活性提取物对小鼠体重影响不大;对结肠和脾脏有明显的保护作用。
[0080]
4.2h&e染色实验结果
[0081]
图7b为dss模型组小鼠结肠h&e染色显示图,显示结肠黏膜不完整,可见多灶性浅溃疡。大部分上皮细胞和腺体破坏,大量炎症细胞浸润,黏膜下层水肿,可见到淋巴细胞聚集形成淋巴滤泡,而正常对照组小鼠结肠黏膜完整,腺体排列整齐,未见炎性细胞浸润,如图7a所示。活性提取物各组小鼠结肠石蜡病理切片h&e染色后光镜下观察,观察图见图7c
‑
7d,结肠黏膜相对完整,少数可见浅溃疡。大部分上皮细胞和腺体结构完整,少量炎症细胞浸润,黏膜下层未见水肿,未见淋巴细胞聚集及淋巴滤泡形成。以上结果说明刺梨果渣活性提取物能有效保护结肠黏膜。
[0082]
4.3western blot实验结果
[0083]
图8中模型组与空白组相比,结肠组织中keap1的表达水平升高(p<0.01),各剂量活性提取物给药组中keap1的表达水平下调(与模型组相比,50mg/kg的低剂量组p<0.001,100mg/kg的中剂量组及200mg/kg的高剂量组p<0.01);模型组与空白组相比,结肠组织中nrf2的表达水平下调(p<0.001),活性提取物为50mg/kg的低剂量组对nrf2的表达水平几乎没有影响,活性提取物分别为100mg/kg的中剂量组及200mg/kg的高剂量组能显著上调nrf2的表达水平(p<0.001)。说明刺梨果渣的活性提取物通过调节氧化应激通路的nrf2靶点发挥抗炎作用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1