豆甾醇在制备改善心肌肥厚的药物中的应用
本发明属于生物医药技术领域。更具体地,涉及豆甾醇在制备改善心肌肥厚的药物中的应用。
背景技术:
大量研究显示大豆油具有很强的抗氧化活性,能有效的清除自由基、改善血脂、保护血管,食用大豆油能预防肥胖、心血管疾病等很多疾病的发生。豆甾醇是大豆油中一种重要营养物质,属于植物甾醇,研究显示它具有降低胆固醇、治疗脂肪肝、抗炎、抗肿瘤等很多活性;另外复方大豆甾醇片(豆甾醇与其他药物成分的混合物)能降低血脂水平,抑制动脉粥样硬化的发展,对高血脂症、冠症动脉硬化性心脏病、胸闷、心悸等均有治疗作用。
心肌肥厚是多种心血管疾病中的一种病理改变,它包括心肌细胞肥大、非心肌细胞增生和间质纤维化。传统观念认为,心肌肥厚是高血压等常见心血管疾病的最常见并发症之一,它是由于心脏负荷过大而引起的代偿性增生的结果。然而随着临床流行病学研究的发展,越来越多的证据表明心肌肥厚不仅是很多心血管疾病的并发症,而且是一个独立的危险因素,能成倍地增加心血管疾病的死亡率。
研究显示,高血压、儿茶酚胺、血管活性肽、细胞因子、机械性因素、神经体液因素、血流动力学等都能诱导心肌肥厚的发生。目前临床上针对心肌肥厚的治疗主要是根据病因进行的。例如高血压引起心脏肥厚时,往往采用降压药治疗,干预后可将血压控制于正常范围,但是对心肌肥厚的治疗效果不太好,心肌肥厚仍将不可避免地逐渐发展为慢性心力衰竭,患者猝死几率增加。因此,使用药物干预和逆转心肌细胞的肥大增生不仅成为近年来的研究热点,更是临床的迫切需要。
中国专利cn102633852a公开了一种亚胺类豆甾醇衍生物及其在抗癌药物中的应用;中国专利cn110051674a公开了豆甾醇在制备治疗胃癌的药物中的用途;中国专利cn102421304a还公开了一种用于治疗阿尔茨海默病的豆甾醇。但目前还未见豆甾醇用于制备改善心肌肥厚药物的相关报道。
技术实现要素:
本发明要解决的技术问题是克服现有技术中存在的上述缺陷和不足,提供豆甾醇在制备改善心肌肥厚的药物中的应用。
本发明上述目的通过以下技术方案实现:
本发明所用豆甾醇其化学结构式如式(i)所示:
本发明分别通过体外和体内实验发现豆甾醇具有改善心肌肥厚的效果。体外通过异丙肾上腺素(iso)诱导h9c2心肌细胞构建了心肌肥厚细胞模型,用豆甾醇处理后发现,豆甾醇能减轻iso诱导的h9c2细胞肥大,抑制iso诱导的h9c2细胞内的氧化应激反应,进而起到抑制心肌细胞肥大的效果。体内通过腹腔注射异丙肾上腺素(iso)构建了心肌肥厚小鼠模型,用豆甾醇对小鼠进行治疗或预防后发现,豆甾醇能明显减轻iso诱导的小鼠心肌重构,抑制小鼠心肌组织纤维化,进而改善心肌肥厚。
因此,本发明请求保护豆甾醇在以下几个方面的应用:
豆甾醇在制备改善心肌肥厚药物中的应用。
豆甾醇在制备抑制心肌细胞氧化应激的药物中的应用。
豆甾醇在制备抑制心肌细胞肥大的药物中的应用。
豆甾醇在制备防治心肌重构的药物中的应用。
豆甾醇在制备抑制心肌组织纤维化的药物中的应用。
优选地,在制备改善心肌肥厚药物中的应用中,所述豆甾醇剂量为1.6~6.4mg/kg。
更优选地,所述豆甾醇剂量为3.2~6.4mg/kg。
优选地,在制备抑制心肌细胞氧化应激的药物以及在制备抑制心肌细胞肥大的药物中的应用中,所述豆甾醇的浓度为2.5~10μg/ml。
更优选地,所述豆甾醇浓度为5μg/ml。
优选地,所述药物的剂型为胶囊剂、片剂、混悬剂和颗粒剂。
优选地,所述药物中豆甾醇的含量为10%~50%。
本发明还提供一种用于改善心肌肥厚的药物,所述药物包括如式(i)所示的化合物及其药学上可接受的药用载体。
优选地,所述药物的剂型为胶囊剂、片剂、混悬剂和颗粒剂。
优选地,式(i)所示化合物在药物中的重量百分含量为10%~50%。
优选地,所述胶囊剂采用如下方法进行制备:将式(i)所示化合物与微晶纤维素、羧甲基淀粉钠和十二烷基硫酸钠按质量比45~50∶40~50∶2~10∶2~8充分混合后采用辊压法进行干法制粒,再与适量硬脂酸镁混匀,填充入空心胶囊制成规格为80~100mg/粒胶囊剂供口服使用。
更优选地,所述胶囊剂采用如下方法进行制备:将式(i)所示化合物与微晶纤维素、羧甲基淀粉钠和十二烷基硫酸钠按质量比50∶40∶5∶4充分混合后采用辊压法进行干法制粒,再与适量硬脂酸镁混匀,填充入3#空心胶囊制成规格为100mg/粒胶囊剂供口服使用。
优选地,所述片剂采用如下方法进行制备:将式(i)所示化合物与淀粉、交联pvp和羧甲基淀粉钠按质量比45~50∶40~50∶1~4∶1~5充分混合均匀,用含3%~5%pvp的75%乙醇溶液作为粘合剂,制软材,以18~20目筛制粒,55℃~65℃干燥1h后,18~20目整粒加入适量滑石粉,混匀,压片,制成规格为80~100mg/片的片剂供口服使用。
更优选地,所述片剂采用如下方法进行制备:将式(i)所示化合物与淀粉、交联pvp和羧甲基淀粉钠按质量比50∶40∶2∶3充分混合均匀,用含5%pvp的75%乙醇溶液作为粘合剂,制软材,以18目筛制粒,60℃干燥1h后,20目整粒加入适量滑石粉,混匀,压片,制成规格为100mg/片的片剂供口服使用。
优选地,所述颗粒剂采用如下方法进行制备:将式(i)所示化合物与糖粉和糊精按质量比1~2∶3~5∶1~2充分混合,再加入80%的乙醇制成软材,挤压过筛制成湿颗粒,60℃~80℃干燥30min后制成整粒供口服使用。
更优选地,所述颗粒剂采用如下方法进行制备:将式(i)所示化合物与糖粉和糊精按质量比1∶3∶1充分混合,再加入80%的乙醇制成软材,挤压过筛制成湿颗粒,60℃~80℃干燥30min后制成整粒供口服使用。
优选地,所述混悬剂采用如下方法进行制备:取1.5g式(i)所示化合物置于乳钵中,加5ml甘油研匀成糊状,另外将0.25g羧甲基纤维素钠胶浆加入研匀,再缓缓加入硫酸锌水溶液研匀,然后缓缓加入12.5ml樟脑醑等其他成分,边加边研磨,最后补加蒸馏水至50.0ml混匀,制成混悬剂供口服和注射。
本发明具有以下有益效果:
本发明提供了豆甾醇在制备改善心肌肥厚、抑制心肌细胞氧化应激、抑制心肌细胞肥大、防治心肌重构以及抑制心肌组织纤维化的药物中的新应用。本发明通过体外细胞实验和进一步的体内实验,首先发现了豆甾醇具有改善心肌肥厚的作用,这将为心肌肥厚的治疗提供新的思路和理论依据,同时,植物甾醇类药物豆甾醇的功能研究尚未完全明确,本发明对丰富甾醇类化合物的应用具有重要意义。
附图说明
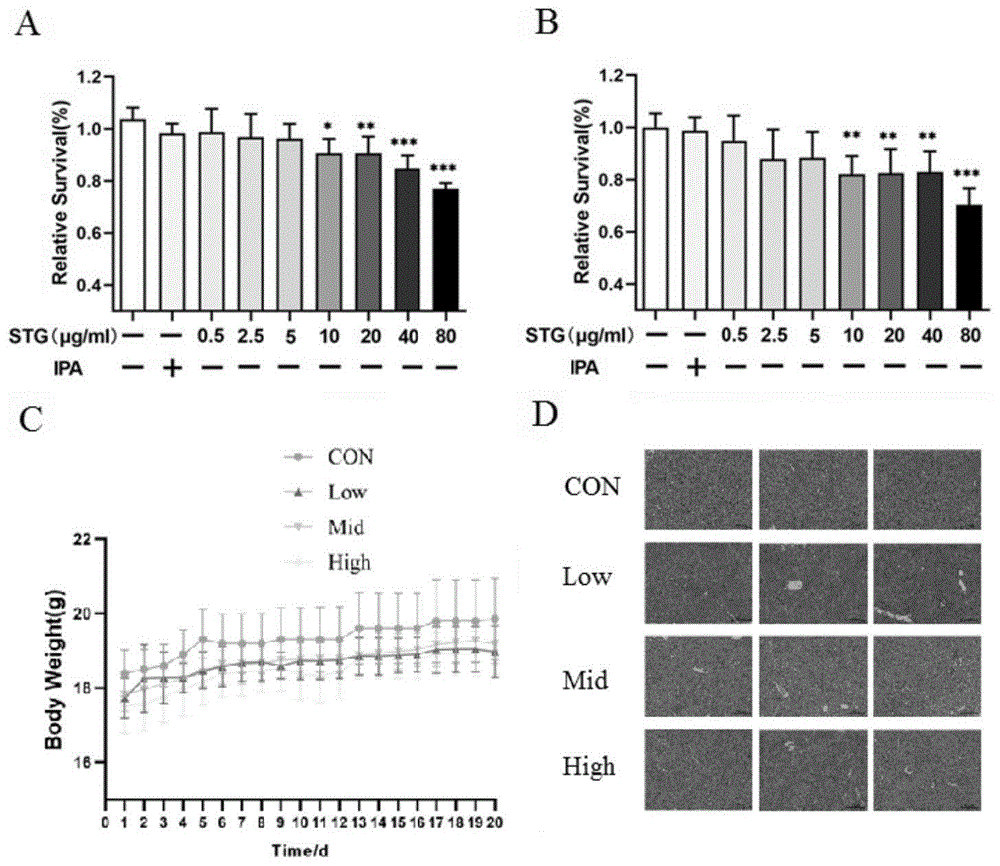
图1为不同浓度豆甾醇在体外和体内的毒性检测,其中图a为不同浓度豆甾醇作用h9c2细胞24小时细胞存活率的变化;图b为不同浓度豆甾醇作用h9c2细胞48小时细胞存活率的变化;图c为不同剂量豆甾醇对小鼠体重的影响;图d为不同剂量的豆甾醇对小鼠肝脏组织的影响;*p<0.05,**p<0.01,***p<0.001。
图2为豆甾醇对iso诱导的h9c2细胞肥大模型的影响,其中图a为细胞免疫荧光检测细胞表面积结果图;图b为细胞表面积统计结果;图c为细胞蛋白含量的变化统计图;图d~f分别为实时荧光定量pcr检测anp、bnp和β-mhc的mrna表达水平统计结果图;*p<0.05,**p<0.01,***p<0.001。
图3为豆甾醇对iso诱导的h9c2细胞氧化应激的影响,其中图a为不同浓度豆甾醇对iso诱导的h9c2细胞sod水平的影响;图b为不同浓度豆甾醇对iso诱导的h9c2细胞mda水平的影响;**p<0.01,***p<0.001。
图4为豆甾醇减轻iso诱导的小鼠心肌肥厚,其中图a为iso诱心肌导肥厚心脏直观图;图b为小鼠心脏比胫骨长度的变化统计图;图c为小鼠心脏比体重体质比的变化统计图;图d为心脏扫描图;图e为心脏he染色;图f为wga染色测心肌细胞表面积;图g为wga染色细胞表面积统计图;图h为天狼猩红染色检测心肌纤维化面积;图i为心肌纤维化面积统计图;*p<0.05,**p<0.01,***p<0.001。
图5为各组小鼠超声心动图及心脏功能指标的变化,其中图a为小鼠心脏的超声心动图;图b为左心室舒张末期前壁厚度统计图;图c为左心室收缩末期前壁厚度统计图;图d为左心室舒张末期后壁厚度统计图;图e为左心室收缩末期后壁厚度统计图;图f为左心室舒张末期内径统计图;图g为左心室收缩末期内径统计图;图h为左心室收缩末期容积变化统计图;图i为左心室舒张末期容积变化统计图;图j为小鼠心脏射血分数的变化统计图;图k为小鼠心脏缩短分数的变化统计图;*p<0.05,**p<0.01。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
本发明实施例所用豆甾醇为德斯特生物科技有限公司产品(货号:dst-003180309),其化学结构式如式(i)所示:
实施例1豆甾醇的细胞毒性检测
1、h9c2细胞的培养及传代
在保持恒定温度和湿度的培养箱中,用适当比例的达尔伯克(氏)改良伊格尔(氏)培养基(dmem)进行培养。当细胞状态良好且细胞密度达到80~90%时进行传代,吸弃培养上清,用移液枪吸取高压后的磷酸盐缓冲液(pbs)清洗2次,吸取1ml的胰酶进行消化,当在显微镜下观察到大部分细胞回缩时,在超净台中加入2ml培养基终止消化,用移液枪将贴壁细胞吹打下来,转移至5mlep管中1500rpm/min离心5min。弃上清,加入2ml培养基进行重悬,按1∶3比例进行传代。
2、细胞活性检测
采用黄色的噻唑兰(mtt)测定法检测豆甾醇处理后细胞的活性。所述豆甾醇为成都德斯特生物科技有限公司产品,货号:dst-003180309。具体操作步骤如下:取细胞状态良好的细胞消化、离心、重悬后接种到每孔含100μl,浓度为10%的fbs培养基的96孔板中,调节细胞密度为8000个/孔。培养12小时后,换为低糖的dmem培养基进行饥饿处理。处理12~24h后分别加入不同浓度(0~80μg/ml)的豆甾醇作用24h和48h后,吸取各孔培养基换为mtt溶液(0.5mg/ml)作用4~5h后,用注射器弃去mtt溶液,加入100μl二甲基亚砜(dmso)。在水平摇床上轻轻晃动10min使甲瓒结晶充分溶于dmso溶液中,用酶联检测仪在540nm处检测吸光度值,细胞存活率(%)=(实验组od值/空白组od值)*100%。
3、体内实验毒性检测
将32只6~7周龄,体重18~22g左右的雌性c57/bl小鼠随机分为4组,即:空白、给药低剂量(1.6mg/kg)、中剂量(3.2mg/kg)、高剂量(6.4mg/kg),每组8只。给药组分别连续灌胃不同剂量的豆甾醇,空白组注射等量生理盐水;每日对小鼠称重并记录,观察小鼠的体重和状态变化。20天后,将小鼠脱臼处死,取出肝脏,并进行he染色。
体外毒性检测结果分别如图1a和1b所示,0.5μg/ml、2.5μg/ml和5μg/ml的豆甾醇分别处理h9c2细胞24小时和48小时后,都没有引起细胞活性的降低(所有p>0.05),即没有表现出明显的细胞毒性;而用10~80μg/ml的豆甾醇处理h9c2细胞24小时和48小时则能明显降低细胞活性,即表现出明显的细胞毒性作用。因此,后续体外实验选用0~5μg/ml作为豆甾醇的检测剂量,48小时作为处理时间。
体内毒性检测结果分别如图1c和1d所示,分别采用低(1.6mg/kg)、中(3.2mg/kg)和高(6.4mg/kg)三个剂量的豆甾醇灌胃20天后,c57/bl小鼠的体重和肝脏组织形态学都没有发生明显的变化,即检测药物的这三个剂量对小鼠没产生明显的毒性作用。因此,后续体内实验选用0~6.4mg/kg作为豆甾醇的检测剂量,20天作为处理时间。
实施例2体外探究实验
1、细胞免疫荧光
分别用0.5μg/ml(低)、2.5μg/ml(中)和5μg/ml(高)的豆甾醇(stg)预处理h9c2细胞30min后,加入iso刺激48小时,观察豆甾醇对iso诱导h9c2心肌细胞表面积的影响,具体步骤如下:
(1)取生长状态良好的h9c2心肌细胞,消化重悬为细胞悬液,调节细胞密度为每孔6000个,种于48孔板中(孔板中装有半径4mm的小圆玻片),约12h待细胞完全贴壁后,分为空白、模型、给药组(给药组豆甾醇提前至少30min加入),模型和给药组每孔加入10μm的iso作用48小时;
(2)药物处理后,取出孔板,去除培养基,加入pbs清洗3遍,最后一次尽量去除残余的液体。加入75μl细胞固定液,在水平摇床上缓缓摇动,固定细胞15min;
(3)固定完毕后,去除固定液,每孔加入适量的pbs按120~130的转速洗3次,每次5min;
(4)清洗完成后,每孔加入90μl的免疫染色封闭液,室温下封闭60min;
(5)封闭结束,用小镊子轻轻夹出小圆玻片进行爬片,细胞面扣在含有一抗的载玻片上,放置于湿盒中4℃孵育过夜;
(6)第二天将小圆玻片再次夹回原孔中(细胞面朝上),用pbs再次清洗3次,每次5分钟;
(7)洗毕,吸尽pbs,在孔板内加入相应的二抗,避光孵育1h;
(8)回收二抗,每孔加入60μl的细胞核染色剂(dapi),室温避光孵育3min;
(9)吸弃dapi,避光条件下加入适量pbs洗3次;
(10)清洗完成后,在载玻片上做好相应记号,加入5μl抗免疫荧光淬灭剂,夹出玻片进行封片;
(11)待封片完成,在荧光显微镜下选取适当的视野进行拍摄,结果用imagepro-plus软件进行处理统计分析。
结果如图2a和图2b所示,iso能明显诱导h9c2心肌细胞表面积增加(p<0.001,isovscon);低剂量的豆甾醇预处理并不能影响iso诱导的细胞表面积的增加[p>0.05,iso+stg(0.5μg/ml)vsiso];而中、高剂量的豆甾醇预处理则能明显降低iso诱导的h9c2细胞表面积地增加(p<0.01,iso+stg(2.5μg/ml)vsiso和p<0.001,iso+stg(5μg/ml)vsiso)。
2、细胞总蛋白的提取与测定
为进一步观察豆甾醇对iso刺激后h9c2细胞总蛋白的影响,采用bradford法测定细胞总蛋白含量,具体步骤如下:
将细胞按2×105的密度种于6孔板中,分别用0.5μg/ml、2.5μg/ml和5μg/ml的豆甾醇(stg)预处理h9c2细胞30min后,加入iso刺激48小时。处理完成后,取出6孔板,弃去培养基,用pbs洗涤细胞2次,加入预先配制好的细胞裂解混合液(蛋白裂解液∶pmsf∶蛋白酶抑制剂∶磷酸酶抑制剂=97∶1∶1∶1),冰上裂解5min后,用细胞刮尽可能多的将细胞刮下,转移细胞悬液至1.5mlep管内做好标记,冰上裂解15min,12000r/min离心15min,上清即为所提蛋白。取上清5μl加入250μl的g250测定液在570nm处测定蛋白浓度,记录各组吸光度值,根据标准曲线a=0.457c+0.507(a为吸光度值,c为蛋白浓度)计算各组蛋白浓度。
结果如图2c所示,iso能明显诱导h9c2细胞内蛋白含量增加(p<0.05,isovscon);低、中剂量的豆甾醇预处理48小时并不能明显改变这种现象[bothp>0.05,iso+stg(0.5μg/ml)vsisooriso+stg(2.5μg/ml)vsiso];而高剂量的豆甾醇预处理则能明显降低iso诱导的h9c2细胞内蛋白水平的增加(p<0.05,iso+stg(5μg/ml)vsiso)。
3、实时定量pcr
取生长状态良好的h9c2心肌细胞,按前述方法种板分组给药;药物处理完细胞后,取出6孔板,弃去培养基,用预冷的pbs缓冲溶液清洗细胞3次,最后一次洗细胞将残余的液体尽量吸干,然后每孔加入0.5mltrizol,裂解3min,用细胞刮尽量将细胞刮下,转移细胞悬液至高压灭菌后的1.5ml离心管内,按照trizol法提取h9c2心肌细胞的总rna并进行逆转录。
按照逆转录试剂盒(toyobo公司,货号qps-201)说明书建议的程序和反应条件配制逆转录所需的体系,然后用appliedbiosystems公司2720型pcr仪进行逆转录,逆转录产物于-20℃保存。
以上述逆转录产物为模板,用表1所示引物进行实时荧光定量pcr反应。
表1大鼠实时荧光定量pcr引物序列
实时荧光定量pcr反应体系按照sybr试剂盒(toyobo公司,货号qpk-201)说明书进行配制,全程冰上操作。配制完成后,用移液枪轻轻吹打混匀,低速离心后按下列条件进行荧光定量pcr:①95℃,30s;②95℃,5s;③60℃,30s;④plateread;⑤重复步骤②~④40次;⑥meltcurve55℃~95℃,每间隔0.5s,维持2s;⑦95℃,1min;⑧60℃,1min。实验中使用管家基因gapdh作为校正,用于比较靶基因的表达变化情况,采用2-△△ct法进行计算。
结果如图2d~f所示,iso能明显上调h9c2细胞内几个常见的心肌肥厚的标志性因子心房钠尿肽(anp)、脑钠肽(bnp)和β-肌凝蛋白重链(β-mhc)的mrna水平(p<0.01或p<0.001,isovscon);尽管低、中剂量的豆甾醇预处理并没有表现出下调这些基因的水平[bothp>0.05,iso+stg(0.5μg/ml)vsisooriso+stg(2.5μg/ml)vsiso],但高剂量的豆甾醇能明显抑制iso诱导的这三个基因的mrna表达水平(p<0.05或p<0.01,iso+stg(5μg/ml)vsiso)。
综上,体外实验结果表明豆甾醇能减轻iso诱导的h9c2细胞肥大。
实施例3豆甾醇抑制iso诱导的h9c2肥大细胞的氧化应激
大量研究表明,心肌肥大发生的过程中常常伴随着氧化应激的增加。因此,本发明采用南京建成公司生产的丙二醛mda试剂盒(货号a003-2)和超氧化物歧化酶sod试剂盒(货号a001-3),分别检测了iso对h9c2细胞氧化应激的影响以及豆甾醇对iso引起的氧化应激的干预作用,具体步骤参照说明书进行。结果如图3a和3b所示,与con组相比,iso组细胞内mda的水平明显增加,而sod的水平明显降低;与iso组相比,豆甾醇预处理组,特别是高剂量处理组(5μg/ml),能明显抑制iso诱导的h9c2细胞内mda水平的增加和sod水平的降低。以上结果暗示着豆甾醇能减轻iso诱导的h9c2细胞肥大,可能与其抑制氧化应激有关。
实施例4体内探究实验
1、建立心肌肥厚动物模型并给药
将40只6~7周龄,体重18~22g左右的雌性c57/bl小鼠随机分为5组,即:空白、模型、给药低剂量(1.6mg/kg)、中剂量(3.2mg/kg)、高剂量(6.4mg/kg),每组8只。模型组腹腔注射10mg/ml的异丙肾上腺素(iso),连续10天;给药组分别提前10天灌胃不同剂量的豆甾醇,随后连续腹腔注射异丙肾上腺素10天,空白组注射等量生理盐水;每日对小鼠称重并记录,观察小鼠的状态变化。10天后,对各组小鼠进行超声心动图,测定心脏功能的变化。然后将小鼠脱臼处死(处死前称重),沿着腹腔剪开,从胸骨处垂直向上打开胸腔,小心的剥离出心脏,用预先高压的pbs尽量清洗干净心脏中的血液,然后再在纸上吸干pbs,对心脏称重记录,随后用固定液固定,室温保存,并进行he染色、wga染色心脏扫描图及天狼猩红染色等实验。
he染色:
(1)脱蜡:将石蜡切片提前3小时放入烘箱内烘烤,取出后依次按照二甲苯i、二甲苯ii、无水乙醇i、无水乙醇ii、不同梯度乙醇、超纯水的顺序进行脱蜡操作;
(2)苏木素染细胞核:将苏木素滴到载玻片上覆盖住组织,染色3min后,流水冲洗后在显微镜下观察染色情况;
(3)反蓝:用预先配制好的1%盐酸酒精分化约3秒,然后用水冲洗数秒,然后用0.6%的氨水反蓝30min;
(4)伊红素染细胞质:将伊红素滴到载玻片覆盖住组织,染色3min后,流水冲洗;
(5)脱水封片:将切片依次放入从低到高浓度的乙醇和二甲苯中脱水至透明,然后将切片从二甲苯中取出后进行封片;
wga染色、心脏扫描图及天狼猩红染色等实验均外包给武汉赛维尔生物科技有限公司进行。
本发明采用豆甾醇预处理c57小鼠,而后腹腔注射iso建立小鼠心肌肥厚模型,进一步探讨豆甾醇对iso诱导的c57小鼠心肌肥厚的保护作用。结果如图4a、4b、4c和4d所示,iso能明显诱导小鼠心脏体积的增加,提高心脏体质比,提升心脏重量与胫骨长度的比值,表明心肌肥厚小鼠模型建立成功,而高剂量的豆甾醇处理能明显抑制小鼠这些指标的增加。
he染色和wga染色结果(如图4e、4f和4g)所示,iso能诱导小鼠心脏组织细胞的体积增加,心肌肌束排列异常,细胞破裂,发生明显重构;而豆甾醇处理能明显诱导心肌细胞明显变小,肌束排列紧密规则,表明豆甾醇能明显减轻iso诱导的小鼠心脏组织重构。
同时考虑到心肌肥厚常常发生发展为心肌纤维化,本发明进一步采用天狼猩红对胶原纤维进行染色,观察豆甾醇对iso诱导的小鼠心肌纤维化的影响。如图4h和4i所示,iso能明显诱导小鼠心肌组织纤维化(红色加深),而不同浓度的豆甾醇处理后,小鼠心脏组织纤维化程度均明显降低,表明豆甾醇对iso诱导的小鼠心肌组织纤维化具有明显的抑制作用。
超声心动图结果如图5a~k所示,与con组相比,iso组小鼠的心脏腔变窄,室壁增厚,射血分数和缩短分数减小,说明小鼠心脏发生肥厚,心脏功能异常;而不同剂量豆甾醇处理后,小鼠的心脏功能的各项指标如射血分数和缩短分数等逐渐恢复,室壁厚度减少。以上结果表明,豆甾醇对iso诱导的心肌肥厚及心脏功能的损伤具有明显的改善作用。
实施例5药物胶囊剂的制备
取5000mg豆甾醇与4000mg微晶纤维素、500mg羧甲基淀粉钠、400mg十二烷基硫酸钠等辅料充分混合,采用辊压法进行干法制粒,再与适量硬脂酸镁混匀,填充入3#空心胶囊,制成规格为100mg/粒的胶囊剂供口服使用。
实施例6药物片剂的制备
取5000mg豆甾醇与4000mg淀粉、200mg交联pvp、300mg羧甲基淀粉钠混合均匀,用含5%pvp的75%乙醇溶液作为粘合剂,制软材,以18目筛制粒,60℃干燥1h后,20目整粒加入适量滑石粉,混匀,压片,制成规格为100mg/片的片剂供口服使用。
实施例7药物颗粒剂的制备
取豆甾醇、糖粉和糊精按照1:3:1的比例混合,再加入80%的乙醇制成软材,然后挤压过筛,制成湿颗粒,然后60~80℃干燥30min,制成整粒供口服使用。
实施例8药物混悬剂的制备
取1.5g豆甾醇置于乳钵中,加5ml甘油研匀成糊状,另外将0.25g羧甲基纤维素钠胶浆加入,研匀,再缓缓加入硫酸锌水溶液,研匀,然后缓缓加入12.5ml樟脑醑等其他成分,边加边研磨,最后补加蒸馏水至50.0ml混匀,制成混悬剂供口服和注射。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!