PLGA-PEG-PolyI:C纳米颗粒的制备及其在结核亚单位疫苗中的应用
本发明涉及生物工程领域,尤其是应用化学修饰构建纳米颗粒佐剂,构建新型疫苗。
背景技术:
结核病是长期危害人类健康的严重疾病之一,全世界仍有近1/3的人感染过结核分枝杆菌(mycobacteriumtuberculosis,mtb)[1],有的结核感染者在大约2-5年内会发展为肺结核病人,其余的有可能会形成结核病的潜伏感染者。我国是结核病高负担的国家之一,每年约有13万人因结核病而死亡。
目前,卡介苗(bacilluscalmette-guérin,bcg)的接种是有效预防结核病的重要措施。然而,不同研究显示,bcg在不同人群中的保护性不稳定,尤其是对成人肺结核的保护效价于0-80%不等。因此,研制和开发全面高效的抗结核疫苗是控制结核病的重要途径。目前抗结核的免疫保护机制尚不清楚[2],一般认为抗原特异性的cd4+th1细胞和cd8+t细胞在预防mtb感染中起着重要的作用。th1型细胞因子如ifn-γ和il-2是目前评估免疫保护性的重要指标[3]。毫无疑问,t细胞介导的免疫反应对于消除mtb的感染至关重要。此外,抗原特异性抗体最近也受到越来越多的关注[4]。buschm等研究表明,iga可以在体外阻止mtb对细胞的入侵[5]。kozakiewiczl等也发现b细胞耗尽导致感染mtb的非人类灵长类动物mtb载量增加[6]。因此,有效的疫苗应同时激发细胞免疫和体液免疫。
目前可供研究的结核疫苗形式有:亚单位疫苗,重组bcg疫苗,减毒活疫苗等。亚单位疫苗又包括蛋白疫苗、dna疫苗和以病毒为载体的疫苗,其中蛋白疫苗具有成分明确,使用安全等优点,易于被人们接受[7]。联合佐剂的蛋白亚单位疫苗具有广阔的应用前景。然而,目前临床常用的佐剂为铝佐剂,该佐剂主要诱导th2型体液免疫反应[8]。为了提高结核疫苗的保护效应,研究新型的可以诱导th1型细胞免疫的佐剂至关重要。目前,一些新的可诱导细胞免疫的脂质体佐剂as01和caf01已进入临床试验阶段。caf01的核心成分是阳离子脂质体二甲基双十八烷基溴化铵(dimethyldioctadecylammonium,dda),阳离子脂质体不仅可提高抗原提呈效率,保护抗原在体内不被降解,还可以诱导树突状细胞的成熟,从而增强免疫效应[9]。
我们实验室之前制备了由dda和polyi:c组成的dp佐剂,经动物实验证实其具有良好的佐剂激活以及保护效应[10]。大量研究表明,粘膜接种疫苗对结核病有预防作用[11,12]。然而,由于dda难以用于粘膜免疫[13,14],故迫切需要开发生物安全性高的佐剂来刺激粘膜免疫应答。
聚乳酸-羟基乙酸共聚物(polylactic-co-glycolicacid,plga)是一种具有高生物相容性和生物降解性的聚合物。plga因其优异的安全性已被fda正式作为药用辅料收录进美国药典[15]。已有研究证明,基于plga的纳米颗粒表现出持续缓慢的释放性能。然而,由于plga纳米颗粒疏水性强、稳定性差,其应用受到限制[16]。聚乙二醇(polyethyleneglycol,peg)是fda批准的一种亲水性聚合物,可以通过化学键稳定地修饰在plga上,提高plga的亲水性[17]。此外,一些研究表明,peg修饰的plga纳米颗粒可以刺激抗原产生交叉反应,改善其免疫效应[18]。toll样受体3(toll-like-receptor3,tlr3)是tlr家族成员之一,在病原体识别和天然免疫激活中发挥重要作用。polyi:c是一种合成的双链rna,可以作为tlr3受体的激动剂,诱导天然免疫和适应性免疫[19]。观察到polyi:c联合佐剂能促进恒河猴对恶性疟原虫环子孢子蛋白(circumsporozoiteprotein,csp)产生较强的保护性th1免疫应答和高滴度的抗原特异性igg抗体应答。dda与polyi:c的结合也提高了结核亚单位疫苗的免疫保护效果。本研究制备了一种新型结核纳米颗粒融合蛋白亚单位疫苗,研究了其鼻腔免疫小鼠后的特异性免疫原性,并与bcg组,融合蛋白m4组,dp/m4组进行了比较。
参考文献
[1]s.h.kaufmann,j.weiner,c.f.vonreyn,novelapproachestotuberculosisvaccinedevelopment,intjinfectdis56(2017)263-267.
[2]paim,behrma,dowdyd,dhedak,divangahim,boehmecc,ginsberga,swaminathans,spigelmanm,getahunh,menziesd,raviglionem.tuberculosis.natrevdisprimers.2016oct27;2:16076.doi:10.1038/nrdp.2016.76.pmid:27784885.
[3]ryndakmb,laals.mycobacteriumtuberculosisprimaryinfectionanddissemination:acriticalroleforalveolarepithelialcells.frontcellinfectmicrobiol.2019aug21;9:299.doi:10.3389/fcimb.2019.00299.pmid:31497538;pmcid:pmc6712944.
[4]siajk,rengarajanj.immunologyofmycobacteriumtuberculosisinfections.microbiolspectr.2019jul;7(4):10.1128/microbiolspec.gpp3-0022-2018.doi:10.1128/microbiolspec.gpp3-0022-2018.pmid:31298204;pmcid:pmc6636855.
[5]buschm,herzmannc,kallerts,zimmermanna,
[6]kozakiewiczl,phuahj,flynnj,chanj.theroleofbcellsandhumoralimmunityinmycobacteriumtuberculosisinfection.advexpmedbiol.2013;783:225-50.doi:10.1007/978-1-4614-6111-1_12.pmid:23468112;pmcid:pmc4184189.
[7]bertholets,iretongc,ordwaydj,windishhp,pineso,kahnm,phant,ormeim,vedvickts,baldwinsl,colerrn,reedsg.adefinedtuberculosisvaccinecandidateboostsbcgandprotectsagainstmultidrug-resistantmycobacteriumtuberculosis.scitranslmed.2010oct13;2(53):53ra74.doi:10.1126/scitranslmed.3001094.pmid:20944089;pmcid:pmc3110937
[8]principin,espositos.aluminuminvaccines:doesitcreateasafetyproblem?vaccine.2018sep18;36(39):5825-5831.doi:10.1016/j.vaccine.2018.08.036.epub2018aug20.pmid:30139653.
[9]nordlyp,aggerem,andersenp,nielsenhm,fogedc.incorporationofthetlr4agonistmonophosphoryllipidaintothebilayerofdda/tdbliposomes:physico-chemicalcharacterizationandinductionofcd8+t-cellresponsesinvivo.pharmres.2011mar;28(3):553-62.doi:10.1007/s11095-010-0301-9.epub2010nov2.pmid:21042837.
[10]x.liu,z.da,y.wang,h.niu,r.li,h.yu,s.he,m.guo,y.wang,y.luo,x.ma,b.zhu,anovelliposomeadjuvantdpcmediatesmycobacteriumtuberculosissubunitvaccinewelltoinducecell-mediatedimmunityandhighprotectiveefficacyinmice,vaccine34(11)(2016)1370-8.
[11]a.rodriguez,a.tjarnlund,j.ivanji,m.singh,i.garcia,a.williams,p.d.marsh,m.troye-blomberg,c.fernandez,roleofigainthedefenseagainstrespiratoryinfectionsigadeficientmiceexhibitedincreasedsusceptibilitytointranasalinfectionwithmycobacteriumbovisbcg,vaccine23(20)(2005)2565-72.
[12]a.tjarnlund,a.rodriguez,p.j.cardona,e.guirado,j.ivanyi,m.singh,m.troye-blomberg,c.fernandez,polymericigrknockoutmicearemoresusceptibletomycobacterialinfectionsintherespiratorytractthanwild-typemice,intimmunol18(5)(2006)807-16.
[13]p.nordly,e.m.agger,p.andersen,h.m.nielsen,c.foged,incorporationofthetlr4agonistmonophosphoryllipidaintothebilayerofdda/tdbliposomes:physico-chemicalcharacterizationandinductionofcd8+t-cellresponsesinvivo,pharmres28(3)(2011)553-62.
[14]n.feltelius,i.persson,j.ahlqvist-rastad,m.andersson,l.arnheim-dahlstrom,p.bergman,f.granath,c.adori,t.hokfelt,s.kuhlmann-berenzon,p.liljestrom,m.maeurer,t.olsson,a.ortqvist,m.partinen,t.salmonson,b.zethelius,acoordinatedcross-disciplinaryresearchinitiativetoaddressanincreasedincidenceofnarcolepsyfollowingthe2009-2010pandemrixvaccinationprogrammeinsweden,jinternmed278(4)(2015)335-53.
[15]allahyarim,mohite.peptide/proteinvaccinedeliverysystembasedonplgaparticles.humvaccinimmunother.2016mar3;12(3):806-28.doi:10.1080/21645515.2015.1102804.pmid:26513024;pmcid:pmc4964737.
[16]koles,qadirissn,shinsm,kimws,leej,jungsj.plgaencapsulatedinactivated-viralvaccine:formulationandevaluationofitsprotectiveefficacyagainstviralhaemorrhagicsepticaemiavirus(vhsv)infectioninoliveflounder(paralichthysolivaceus)vaccinatedbymucosaldeliveryroutes.vaccine.2019feb8;37(7):973-983.doi:10.1016/j.vaccine.2018.12.063.epub2019jan17.pmid:30661835.
[17]cruzlj,tackenpj,fokkinkr,figdorcg.theinfluenceofpegchainlengthandtargetingmoietyonantibody-mediateddeliveryofnanoparticlevaccinestohumandendriticcells.biomaterials.2011oct;32(28):6791-803.doi:10.1016/j.biomaterials.2011.04.082.epub2011jul2.pmid:21724247.
[18]hafneram,corthésyb,textorm,merklehp.surface-assembledpoly(i:c)onpegylatedplgamicrospheresasvaccineadjuvant:apcactivationandbystandercellstimulation.intjpharm.2016nov30;514(1):176-188.doi:10.1016/j.ijpharm.2016.07.042.pmid:27863662.
[19]spethmt,repniku,müllere,spanierj,kalinkeu,corthaya,griffithsg.poly(i:c)-encapsulatingnanoparticlesenhanceinnateimmuneresponsestothetuberculosisvaccinebacillecalmette-guérin(bcg)viasynergisticactivationofinnateimmunereceptors.molpharm.2017nov6;14(11):4098-4112.doi:10.1021/acs.molpharmaceut.7b00795.epub2017oct19.pmid:28974092.
技术实现要素:
本发明提供了联合plga与polyi:c制备plga-peg-polyi:c新型纳米颗粒佐剂的方法。采用本发明所提供的新型佐剂与本实验室制备的m4融合蛋白联合构建结核亚单位疫苗,该疫苗可以在小鼠体内有效诱导结核抗原特异性的细胞和体液免疫应答反应。该纳米颗粒有望成为一种新型的结核疫苗佐剂。
本发明的技术方案为:
1.np纳米颗粒的制备:
(1)将0.02mmol的plga溶于8ml的二氯甲烷(dichloromethane,dcm)中,待完全溶解后加入0.2mmol的1-甲基-(3-二甲基氨基丙基)碳二亚胺(n-(3-dimethylaminppropyl)-n-ethylcarbodiimidehydrochloride,edc),0.2mmol的n-羟基琥珀酰亚胺(n-hydroxysccinimide,nhs),充入氮气,缓慢搅拌反应24h;待反应结束后,用冰乙醚沉淀反应物,然后用甲醇溶液反复洗涤产物;用dcm进行复溶,最后用冰乙醚再次沉淀得到产物,低温冷冻干燥。
(2)nh2-peg与活化plga的合成:
将活化的0.01mmol的plga溶于3ml的dcm中,将0.03mmol的nh2-peg溶于1ml的dcm中;待完全溶解后,将nh2-peg逐滴加入plga溶液中,加入0.05mmol的edc,加入0.05mmol的4-二甲基吡啶(4-dimethylaminopyridine,dmap),加入三乙胺50μl;向体系中缓缓通入氮气,密闭,缓慢匀速搅拌,反应24h;待反应结束后,用冰乙醚沉淀反应物,用甲醇溶液反复洗涤产物;用dcm进行复溶,最后用冰乙醚再次沉淀得到产物,待低温冷冻干燥。
(3)蛋白-纳米球的制备过程:
将250mgplga-peg溶于5ml的dcm中,再将4mg融合蛋白融于1ml的pbs中;将plga-peg溶液缓慢倒入融合蛋白溶液中,用超声破碎仪制备初乳(初乳600w,2min,开3s,停3s);初乳制备完成后与15倍体积的2%的聚乙烯醇(poly(vinylalcohol),pva)溶液混合,在匀浆机中进行复乳(300bar,4min);过夜搅拌挥发dcm,之后用ddh2o洗涤三遍。
(4)纳米球的修饰过程:
将新制备的纳米颗粒溶解于5ml的tris缓冲液中(盐浓度为10mm,ph为8.5);同时将盐酸多巴胺(polydopamine,pd)和polyi:c分别溶于tris缓冲液中,使其终浓度分别为0.5mg/ml,0.2mg/ml。室温闭盖温和搅拌2.5h,14000rpm进行离心收集沉淀,即得到聚多巴胺、polyi:c修饰的plga纳米颗粒。
2.np纳米颗粒在结核亚单位疫苗中的应用
结核分枝杆菌融合蛋白为基础的亚单位疫苗需要佐剂辅助诱导细胞免疫应答;plga纳米颗粒是一种新型的疫苗佐剂系统,具有较好的生物相容性和安全性高等优点,其稳定性和佐剂效应有待进一步提高。本发明的目的是研制出一种新型的plga纳米载体来提高结核亚单位疫苗的效力。本发明先化学合成plga-nh2共聚物,然后用复乳溶剂挥发法将本实验构建的两个结核分枝杆菌融合蛋白esat6-rv2626c和mtb10.4-hspx(用m4表示)包裹在纳米颗粒中,进而应用聚多巴胺和polyi:c进行修饰,形成包裹结核分枝杆菌融合蛋白抗原(m4)的plga-peg-polyi:c纳米颗粒,简称为m4/np。用6-8周龄c57bl/6雌性小鼠进行滴鼻免疫,初免间隔8周,共免疫2次。末次免疫后6周,通过检测脾脏淋巴细胞ifn-γ和il-2的分泌水平,检测肺泡灌洗液中siga、血清igg、igg1和igg2c的滴度来评价m4/np的免疫原性。
采用本发明所提供的新型纳米颗粒结核亚单位疫苗免疫c57bl/6雌性小鼠。将pbs、bcg、m4、np/m4、dp/m4五组结果进行比较,结果显示;np/m4组在hspx蛋白,rv2626c蛋白刺激后,脾脏淋巴细胞分泌ifn-γ和il-2的水平明显高于pbs,bcg和m4组,统计学差异显著(p<0.001),表明np/m4组可产生较高水平的ifn-γ和il-2。针对抗原hpsx和rv2626c蛋白所产生的特异性抗体igg和siga的水平明显高于pbs、bcg和m4组。
附图说明
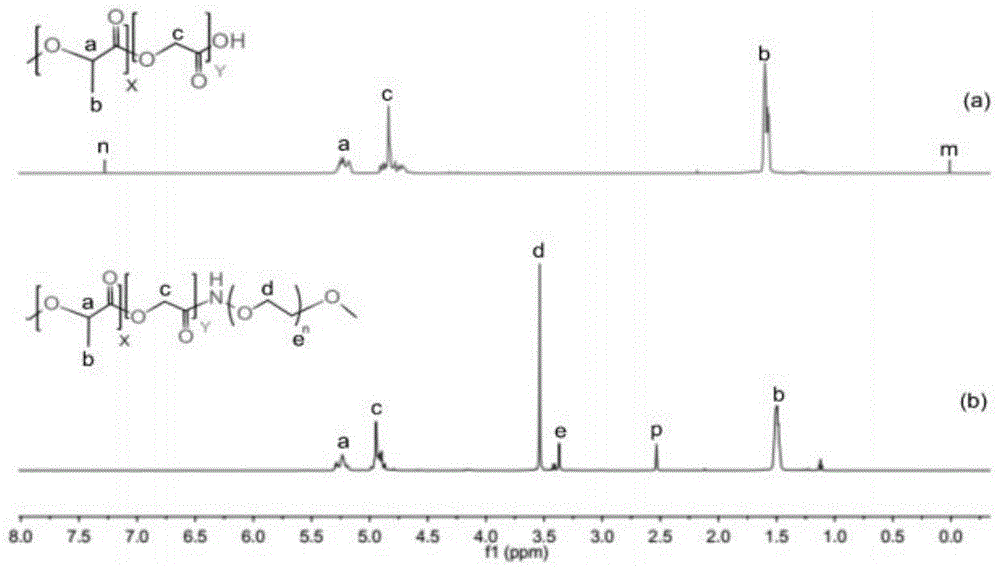
图1为plga(a)和plga-peg共聚物(b)的核磁共振1h谱图。
图2为plga(a)和plga-peg共聚物(b)的红外光谱图。
图3为plga-peg纳米颗粒粒径及zeta电位模拟曲线测定图。
(a)plga-peg纳米颗粒的粒径;(b)zeta电位模拟曲线。
图4为不同阶段纳米颗粒的zeta电位检测图。
图5为plga-peg-poly(i:c)纳米颗粒扫描电镜图。
图6为np纳米颗粒对thp-1细胞的作用图。
将不同浓度np与thp-1细胞孵育24小时和48小时后,通过mtt法测定thp-1细胞的细胞活力。
图7为疫苗免疫后第6周抗原特异性il-2和ifn-γ的表达检测图。
在最后一次疫苗免疫后6周,检测cd4+t细胞和cd8+t细胞产生il-2和ifn-γ的能力(a-d)。(e)淋巴细胞培养上清液中ifn-γ的含量。means±sd,*p<0.05,**p<0.01,***p<0.001。
图8为疫苗末次免疫后第6周肺泡灌洗液中抗原特异性siga检测图。
疫苗末次免疫后第6周肺泡灌洗液中抗原特异性siga抗体水平。(a)肺泡灌洗液中抗原特异性siga的检测量,1:1和1:3分别为肺泡灌洗液的稀释度,np/m4组rv2626c特异性siga水平显著高于pbs,bcg和m4组。;(b)不同稀释度肺泡灌洗液(1:4至1:128,100升/孔)对v2626c的反应性。means±sd,*p<0.05,**p<0.01,***p<0.001。
具体实施方式
实施例1plga-peg-polyi:c纳米颗粒的制备
1.将250mgplga-peg共聚物溶于5ml的dcm中,再将4mg融合蛋白融于1ml的pbs中,初乳600w,2min,开3s,停3s,复乳在匀浆机中进行,300bar,4min;
2.过夜挥发dcm(磁力搅拌器,400rpm),之后用ddh2o进行洗涤,去除未包裹的蛋白和多余的pva。
3.将新制备的纳米颗粒溶解于5ml的tris缓冲液中(盐浓度为10mm,ph为8.5);同时将pd和polyi:c分别溶于tris缓冲液中,使其终浓度分别为0.5mg/ml,0.2mg/ml。室温闭盖温和搅拌2.5h,14000rpm进行离心收集沉淀,即得到聚多巴胺、polyi:c修饰的plga纳米颗粒。
实施例2纳米颗粒的性能及表征
1.plga-peg共聚物的核磁氢谱测定
采用600mhz液体超导核磁共振波谱仪进行验证。结果发现存在plga及nh2-peg的特征性吸收峰,证明该共聚物偶连成功,核磁氢谱见图1。在1.53,4.83和5.23ppm处检测到了plga的典型吸收峰,此外我们在3.54和3.42ppm处检测到了共聚物中nh2-peg的特征吸收峰,对应其中-och3和-ch2-基团。这些观察结果侧面证明了plga和peg的成功耦合。(图1)
2.plga-peg共聚物的红外光谱图测定
采用傅里叶变换红外光谱仪进行验证,也同样证实了聚合物中酰胺键的生成,如图2。分别在1561.3cm-1(νc=o)和1646.0cm-1(βnh)吸收峰处证实了plga与nh2-peg的偶联。并且在1093.9cm-1处可观察到νc-n吸收峰,说明nh2-peg存在。plga的吸收峰分别在2950.3cm-1和2995.7cm-1处。(图2)
3.plga-peg纳米颗粒的粒径分布
采用brookhaveninstrument测定包载蛋白的plga-peg纳米颗粒的粒径分布。结果发现该纳米颗粒尺寸平均直径为200.21±1.07nm(图3a),检测的结果很好地模拟了正弦函数(图3b),表明结果真实可靠。
4.不同阶段纳米颗粒的电位检测
采用brookhaveninstrument分别测定plga-peg纳米颗粒,plga-peg修饰多巴胺后的纳米颗粒,以及plga-peg修饰多巴胺并包裹polyi:c后纳米颗粒的zeta电位。发现经多巴胺修饰后,纳米颗粒的zeta电位由20mv降至约-24mv,最后修饰polyi:c后zeta电位降至约-33mv,说明polyi:c被成功修饰。(图4)
5.纳米颗粒载药和包封率
通过离心后检测上清中含有的蛋白量,用总的蛋白量减去未包封的蛋白量,计算出了纳米颗粒实际的蛋白包封率和载药率。最终得出;蛋白包封率为73.25%,载药率为6.81%。
6.扫描电镜
采用扫描电镜sem观察纳米颗粒的表面形态,扫描电镜图见图5,可以看出制备的纳米颗粒呈圆形且均匀度良好。
实施例3plga-peg-poly(i:c)纳米颗粒的体外毒性试验
使用thp-1细胞通过mtt实验检测了纳米颗粒疫苗的细胞毒性。首先在96孔板中加入100μl系列稀释的纳米颗粒样品(浓度从6.25μg/ml至800μg/ml),然后加入用佛波酯分化为巨噬细胞的密度为1×104cells/well的thp-1细胞,将细胞板培养24h至48h,然后添加20μlmtt(5mg/ml)。孵育4小时后,添加100μldmso,并使用酶标仪在490nm下测量吸光度。(图6)
实施例4疫苗免疫活性检测方法
1.实验材料:融合蛋白(m4)、hspx蛋白、rv2626c蛋白、poly(i:c)、bcg、磷酸盐缓冲液pbs。
2.实验动物:c57bl/6小鼠
3.实验动物分组(共五组):
a:pbs
b:bcg
c:m4
d:np/m4
e:dp/m4
4.免疫动物:
bcg组在第0周注射一次(5×106cfu,100μl)。所有3种m4疫苗组(m4,dp/m4和np/m4)均通过滴鼻接种100ul,m4含量为10ug。pbs对照组(仅pbs)和m4组分别在第0周和第8周通过滴鼻进行二次免疫。
5.免疫指标测定方法
(1)细胞免疫检测
①用elisa法检测小鼠脾脏淋巴细胞ifn-γ的表达
小鼠末次免疫6周后无菌分离脾脏淋巴细胞,将hspx蛋白及rv2626c蛋白和脾脏淋巴细胞在24孔细胞培养板中共同孵育68小时后,收集细胞培养上清,用elisa法检测脾脏淋巴细胞在hspx蛋白,rv2626c蛋白刺激后ifn-γ的表达。
具体步骤:无菌摘除脾脏,研磨后经200目尼龙网过滤,用淋巴细胞分离液分离淋巴细胞。将分离出的淋巴细胞加入到24孔细胞培养板中,终浓度为5×106/well,分别给予hspx蛋白(5ug/ml),rv2626c蛋白(5ug/ml)刺激。在37℃、5%co2条件下共同孵育68时后,收集细胞培养上清。将细胞培养上清加入到96孔elisa板中,100u1/孔,按elisa说明书依次加入检测抗体等试剂,洗板、显色、终止反应、酶标仪读板、根据标准曲线求的ifn-γ的含量(pg/ml)。
结果显示:将pbs、bcg、m4、np/m4、dp/m4五组结果进行比较,np/m4组在hspx蛋白和rv2626c蛋白刺激后,脾脏淋巴细胞分泌ifn-γ的水平明显高于pbs,bcg和m4组,表明np/m4组可产生较高水平的ifn-γ。(结果见图7e)
②胞内细胞因子染色法检测小鼠脾脏淋巴细胞ifn-γ、il-2的表达
小鼠末次免疫6周后无菌分离脾脏淋巴细胞,使用rv2626c抗原(5ug/ml)和hspx抗原(5ug/ml)体外刺激4h,加入1ul蛋白转运抑制剂,孵育8h后,检测cd4+t细胞与cd8+t细胞ifn-γ与il-2的分泌水平。
结果显示:将pbs、bcg、m4、np/m4、dp/m4五组进行比较。在hspx蛋白,rv2626c蛋白刺激后,np/m4组cd4+t与cd8+t细胞il-2分泌水平均高于其他四组,cd4+t与cd8+t细胞ifn-γ分泌水平均高于pbs、bcg和m4组。结果证明本发明的纳米颗粒结核亚单位蛋白疫苗可引起较强的细胞免疫反应。(结果见图7a-d)
(2)体液免疫反应
①用elisa法检测小鼠血清igg抗体表达水平。
分别用hspx、rv2626c(5ug/ml)包被96孔板,4℃过夜;用pbst溶液300u1/we11洗板5次;用5%的脱脂奶粉进行封闭,洗板。加入100u1倍比稀释的血清样品,37℃放置1h。洗板后,加入100u1/we11的1:5000稀释的羊抗鼠igg,37℃放置lh。洗板后,加入100u1/we11tmb显色液,室温避光反应15分钟显色后,加入50u1/we11终止液(2m的h2so4)终止反应;在450nm检测od值。
②用elisa法检测小鼠肺泡灌洗液siga抗体表达水平。
分别用hspx蛋白、rv2626c蛋白(5ug/ml)包被96孔板,4℃过夜;用pbst溶液300u1/we11洗板5次;用5%的脱脂奶粉进行封闭,洗板。将包被hspx的肺泡灌洗液进行1:1稀释;将包被rv2626c蛋白的肺泡灌洗液进行1:3稀释,37℃放置1h。洗板后,加入100u1/we11的1:3000羊抗鼠siga,37℃放置1h。洗板后,加入100u1/we11tmb显色液,室温避光反应15分钟显色后,加入50u1/we11终止液(2m的h2so4,)终止反应;在450nm检测od值。
结果显示:pbs、bcg、m4、np/m4、dp/m4五组结果进行比较,np/m4组和dp/m4组,hpsx和rv2626c蛋白特异性igg和siga抗体水平明显高于pbs、bcg和m4组。
此结果显示本发明所提供的纳米颗粒结核亚单位疫苗可刺激机体产生hspx以及rv2626c蛋白的特异性抗体,具有较强的体液免疫反应,说明融合蛋白与纳米联合应用后,经滴鼻免疫后显著增强了蛋白的粘膜及全身体液和细胞免疫应答。(结果见图8和
表1)
表1疫苗免疫后特异性抗体表达水平检测
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!