一种阳离子诱导自组装正电荷金纳米颗粒材料的制备方法
1.本发明涉及自组装材料制备技术领域,涉及一种阳离子诱导自组装正电荷金纳米颗粒材料的制备方法。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.自组装技术作为一种新兴的纳米技术,可制备较大尺寸的纳米颗粒,满足被动靶向得要求,减少对正常细胞或组织的毒副作用。采用自组装纳米技术制备的金纳米颗粒,有望成为适应肿瘤微环境并具有靶向作用的药物输送载体。
4.纳米材料与细胞膜之间的静电相互作用也会影响细胞的摄取。一般来说,细胞膜表面带有弱负电荷,会排斥阴离子纳米粒子进入细胞,导致细胞对这些纳米粒子摄取效率较低。阳离子纳米粒子由于静电作用,容易与细胞膜结合,从而增强细胞内在化摄取。随着对金纳米团簇结构和理化性质研究的逐渐深入,可以通过对其结构和尺寸的精确控制,改变表面性质及荧光性能,使其在病灶部位积累,达到生物学成像,诊断及靶向治疗的目的,满足肿瘤治疗的应用。
技术实现要素:
5.为了解决现有技术的不足,本发明的目的是提供一种阳离子诱导自组装正电荷金纳米颗粒材料的制备方法,本发明提供的金纳米颗粒材料继承了金纳米团簇类似小分子的性质,表现出聚集诱导发光效应。
6.为了实现上述目的,本发明的技术方案为:
7.一方面,一种自组装正电荷金纳米颗粒材料,由牛血清蛋白稳定的金纳米团簇自组装形成自组装纳米颗粒,所述自组装纳米颗粒为球形颗粒,所述球形颗粒的平均粒径为85~95nm,所述自组装纳米颗粒的表面电荷为+17.1~+18.5mv。
8.另一方面,一种阳离子诱导自组装正电荷金纳米颗粒材料的制备方法,以牛血清蛋白作为稳定剂制备金纳米团簇,将金纳米团簇的水溶液与乙二胺
‑
盐酸溶液混合,然后加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐,搅拌稳定后获得自组装正电荷金纳米颗粒材料。
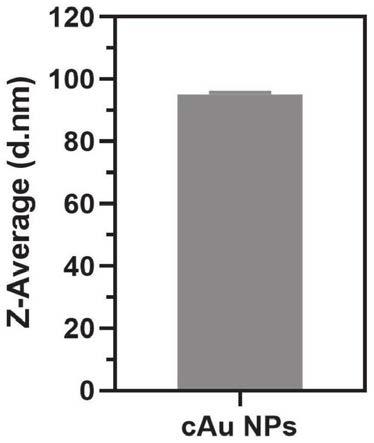
9.牛血清蛋白稳定的金纳米团簇表面存在丰富的官能团,容易被伯胺基团修饰,将金纳米团簇表面负电荷转变为正电荷,自组装后的纳米粒子尺寸和电荷可控。
10.本发明通过实验表明,向牛血清蛋白稳定的金纳米团簇中先加入乙二胺
‑
盐酸溶液,搅拌稳定,再加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐搅拌稳定后能够使金纳米团簇自组装形成平均粒径为85~95nm、表面电荷为+17.1~+18.5mv的球形颗粒。
11.第三方面,一种上述自组装正电荷金纳米颗粒材料在生物成像制剂或肿瘤治疗药
物中的应用。
12.本发明的有益效果为:
13.(1)本发明制备的阳离子诱导正电荷自组装金纳米颗粒,可作为药物运输载体,满足被动靶向要求,减少对正常细胞或组织的毒副作用。
14.(2)本发明制备的阳离子诱导正电荷自组装金纳米颗粒,可增加细胞对纳米材料的摄取作用。
15.(3)本发明制备的阳离子诱导正电荷自组装金纳米颗粒,以金纳米团簇为阳离子诱导自组装技术的前驱体,继承了金纳米团簇类似分子性质。
16.(4)本发明制备的阳离子诱导正电荷自组装金纳米颗粒,在阳离子诱导的作用下,破坏金纳米团簇亲水壳层,形成致密的自组装聚集体,分子内部发生强相互作用,发射出更强的荧光,即存在聚集诱导发射现象。
附图说明
17.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
18.图1为本发明实施例1制备的正电荷自组装金纳米颗粒tem图。
19.图2为本发明实施例1制备的金纳米团簇和正电荷自组装金纳米颗粒尺寸大小分布柱状图。
20.图3为本发明实施例1制备的金纳米团簇和正电荷自组装金纳米颗粒电荷柱状图。
21.图4为本发明实施例1制备的金纳米团簇和正电荷自组装金纳米颗粒的紫外
‑
可见光谱图。
22.图5为本发明实施例1制备的金纳米团簇和正电荷自组装金纳米颗粒的傅里叶变换红外光谱图。
23.图6为本发明实施例1制备的金纳米团簇和正电荷自组装金纳米颗粒的荧光光谱图。
具体实施方式
24.应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
25.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
26.本发明的一种典型实施方式,提供了一种自组装正电荷金纳米颗粒材料,由牛血清蛋白稳定的金纳米团簇自组装形成自组装纳米颗粒,所述自组装纳米颗粒为球形颗粒,所述球形颗粒的平均粒径为85~95nm,所述自组装纳米颗粒的表面电荷为+17.1~+18.5mv。
27.该实施方式的一些实施例中,平均粒径为88~92nm,表面电荷为+17.7~+17.9mv。
28.该实施方式的一些实施例中,金纳米团簇的尺寸为2~4nm,表面电荷为
‑
22.9~
‑
22.8mv。
29.本发明的另一种实施方法,提供了一种阳离子诱导自组装正电荷金纳米颗粒材料的制备方法,以牛血清蛋白作为稳定剂制备金纳米团簇,将金纳米团簇的水溶液与乙二胺
‑
盐酸溶液混合,然后加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐,搅拌稳定后获得自组装正电荷金纳米颗粒材料。
30.本发明向牛血清蛋白稳定的金纳米团簇中先加入乙二胺
‑
盐酸溶液,搅拌稳定,再加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐搅拌稳定后能够使金纳米团簇自组装形成平均粒径为85~95nm、表面电荷为+17.1~+18.5mv的球形颗粒。形成的球形颗粒内部发生强相互作用,能够发射出比金纳米团簇更强的荧光。
31.该实施方式的一些实施例中,金纳米团簇的水溶液与乙二胺
‑
盐酸溶液的体积比为4:0.9~1.1。乙二胺
‑
盐酸溶液为0.5m,ph=4.75。
32.该实施方式的一些实施例中,金纳米团簇与乙二胺
‑
盐酸、1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐的添加比例为50:0.4~0.5:9~10,mg:mmol:mg。
33.该实施方式的一些实施例中,将金纳米团簇制备成自组装正电荷金纳米颗粒材料的过程中,在搅拌条件下进行。
34.在一种或多种实施例中,将金纳米团簇制备成自组装正电荷金纳米颗粒材料的过程中的搅拌速率为700~800rpm。
35.该实施方式的一些实施例中,将金纳米团簇制备成自组装正电荷金纳米颗粒材料的过程中在室外条件下进行。所述室温是指室内环境的温度,一般为15~30℃。
36.该实施方式的一些实施例中,将金纳米团簇的水溶液与乙二胺
‑
盐酸溶液混合25~35s后加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐。
37.该实施方式的一些实施例中,加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐后搅拌稳定的时间为15~25min。
38.该实施方式的一些实施例中,加入1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐后搅拌稳定后进行透析。
39.在一种或多种实施例中,透析时间为24~48h,每隔2~3h换一次超纯水。
40.在一种或多种实施例中,透析过程中采用透析袋的尺寸为mwco=8000
‑
14000da。
41.该实施方式的一些实施例中,以牛血清蛋白作为稳定剂制备金纳米团簇的过程为:将氯金酸水溶液加入至牛血清蛋白水溶液中,进行剧烈搅拌,搅拌稳定后,添加碱(例如氢氧化钠)调节ph至11.6~12.4,升温稳定后,透析,得到金纳米团簇水溶液。
42.所述剧烈搅拌是指搅拌转速不低于750rpm。金纳米团簇更好的分散,不易发生团聚现象。
43.在一种或多种实施例中,氯金酸与牛血清蛋白的加入比为0.1:450~550,mmol:mg。
44.在一种或多种实施例中,氯金酸水溶液加入至牛血清蛋白水溶液时,温度为36.5~37.5℃。可保证牛血清的最大还原能力以及螯合金原子的能力。
45.在一种或多种实施例中,剧烈搅拌1.5~2.5min后添加碱。
46.在一种或多种实施例中,加入碱后升温至66~74℃,搅拌稳定50~70min。
47.在一种或多种实施例中,金纳米团簇透析时间为48~72h,每隔2~4h换一次超纯水。去除有机溶剂。
48.在一种或多种实施例中,透析过程中采用透析袋的尺寸为mwco=8000
‑
14000da。
49.本发明的第三种实施方式,提供了一种上述自组装正电荷金纳米颗粒材料在生物成像制剂或肿瘤治疗药物中的应用。
50.具体的,在肿瘤治疗药物运输载体中的应用。
51.为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
52.实施例1
53.一种阳离子诱导正电荷自组装金纳米颗粒的制备方法,包括如下步骤:
54.(1)在37℃温度和强力搅拌(1000rpm)条件下,将10ml 10mm四氯金酸水溶液快速加入到10ml 50mg/ml牛血清蛋白水溶液中,稳定2分钟后,加入1ml 1m氢氧化钠水溶液,调节溶液酸碱度至ph=12。将温度升高到70℃,在强烈搅拌(1000rpm)条件下保温60min。溶液颜色由亮黄色变为浅棕色,最后变为深棕色,表明金纳米团簇形成。使用透析袋(mwco=14000da)将金纳米团簇溶液在超纯水中完全透析48h,每4h更换一次超纯水,以去除过量未反应的四氯金酸和氢氧化钠,获得金纳米团簇(记为au
‑
ncs)水溶液(浓度为12.5mg/ml)。
55.(2)在750rpm搅拌速率下,将4ml透析后金纳米团簇溶液加入乙二胺
‑
盐酸溶液中(0.5m,1ml,ph=4.75),在室温下搅拌30s后,加入10mg 1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐粉末,稳定20min。将样品进行透析(透析袋尺寸为mwco=14000da,透析时间24h,每隔2h换一次超纯水),得到纯化正电荷自组装金纳米颗粒(记为cau
‑
nps)。
56.参考图1、图2和图3,分别为本实施例制备的正电荷自组装金纳米颗粒的tem图、金纳米团簇和金纳米颗粒尺寸大小分布图、金纳米团簇和金纳米颗粒电荷柱状图。图1中,正电荷自组装金纳米颗粒在电镜下呈圆球形,且平均粒径为90nm左右;图2中,正电荷自组装金纳米颗粒的水动力学直径为95nm左右,且分散指数较窄,表明制备的颗粒尺寸集中分布;图3中,金纳米团簇和正电荷自组装金纳米颗粒zeta电位分别为
‑
22.9mv和+17.8mv,表明阳离子诱导自组装过程,改变了蛋白质表面性质,将负电荷表面转变为正电荷。
57.特性表征
58.以实施例1制备的金纳米团簇和正电荷自组装金纳米颗粒为测试对象,对其结构进行表征,并检测其荧光性能。首先配制5mg/ml样品溶液,并进行多次稀释测量,在250nm
‑
650nm的范围内得到样品的紫外可见吸收光谱,结果如图4所示。将制备的金纳米团簇和正电荷自组装金纳米颗粒溶液冻干,将2mg冻干粉末与100mg干燥的溴化钾粉末在玛瑙研钵中进行充分的研磨,在压片机上压制成片进行测试,检测的波长范围为400
‑
4000cm
‑1,得到傅里叶变换红外吸收光谱,结果如图5所示。图4,图5说明正电荷自组装金纳米颗粒表现出与金纳米团簇相似的特征,继承了金纳米团簇类似分子的性质,表明金纳米团簇是正电荷自组装金纳米颗粒的主要构建单元,自组装过程保留了金纳米团簇类似于分子的结构。
59.将20mg冻干材料溶于5ml超纯水中,超声20min,使粉末完全溶解,取3ml材料溶液于比色皿中,以505nm激发波长获得样品的荧光发射光谱,并以654nm的发射波长获得样品的荧光激发光谱,结果如图6所示。图6说明,阳离子诱导正电荷自组装金纳米颗粒表现出聚集诱导发射现象,即在同一波长激发下,发射出更强荧光。
60.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1