一种含有哌柏西利的药物组合物及其制备方法与流程
1.本发明涉及药物制剂技术领域,提供一种速释药物制剂,具体涉及一种含有哌柏西利的药物组合物及其制备方法,本药物组合物展现出较好的溶出性质及稳定性。
背景技术:
2.根据世界卫生组织(world health organization,who)下属组织国际癌症研究中心(international agency for research on cancer,iarc)的数据显示,2012年世界乳腺癌的年龄标化发病率(43.1/10万人)位列女性癌症之首,遥遥领先于位列第二的结直肠癌(14.3/10万人),占女性新发肿瘤的35.3%,死亡人数占女性所有癌种死亡人数的20.8%。中国国家癌症中心新发表的数据也揭示,在2015年乳腺癌依然会是女性发病率最高的癌种,同时位居女性所有癌种死亡率排名的第6位。
3.手术治疗仍为乳腺癌的主要治疗手段之一,方式有多种,对其选择尚乏统一意见。放射治疗是治疗乳腺癌的主要组成部分,是局部治疗手段之一,与手术治疗相比较少,受解剖学病人体质等因素的限制。目前,化疗已成为继手术治疗后最为重要的治疗手段,随着化疗新药不断的研制成功,其治疗效果得到明显提高,减少了早期乳腺癌术后复发转移的风险,提高了乳腺癌患者的5年生存率,缓解了复发转移乳腺癌的病情,提高了患者的生存质量。
4.哌柏西利是一种cdk4/6抑制剂,能够选择性抑制细胞周期蛋白依赖性激酶4和6(cdk4/6),恢复细胞周期控制,阻断肿瘤细胞增殖。与标准治疗药物来曲唑(letrozole)治疗组相比,哌柏西利+来曲唑联合用药组疾病无进展生存期(pfs)取得了统计学意义的显著延长(20.2个月vs 10.2个月,p=0.0004)。
5.在临床试验中发现,哌柏西利的不良反应能够得到有效控制。哌柏西利产品的上市为乳腺癌患者的治疗增加了一种更为有效的方式。
6.哌柏西利胶囊2019年全球销售额约49.6亿美元,市场前景较好,但哌柏西利胶囊的生物利用度会受患者的进食或空腹状态、所使用的某些药品,如质子泵抑制剂(ppi)或h2受体拮抗剂以及某些医学症状的影响,导致患者间和患者自身的临床疗效差异较大。
7.因此,需要找到基本无ph依赖的哌柏西利制剂,同时没有显著的食物效应或与ppi的不利相互作用,达到上述目的的首要任务是制备出在体外不同ph值的溶出介质中均具有较好溶出曲线的制剂,并且该制剂具有良好的贮存稳定性。
8.发明专利cn107666914a披露了一种制备含有哌柏西利的药物制剂的方法,该方法中使用了水溶性酸琥珀酸,用于提高药物在ph5.5醋酸盐缓冲液和ph6.5磷酸盐缓冲液中的溶出度。本发明人经过研究发现当使用富马酸、枸橼酸、草酸、或维生素c作为水溶性酸时,采用特定的制备工艺,可以达到与琥珀酸一致的技术效果,从而提供一种较好的现有技术的替代方案。
9.哌柏西利为溶解度ph依赖型药物,人体内生物利用度与胃肠道的ph值有关,同时受所服用的碱性药物(如质子泵抑制剂类药物)影响,为了改善上述情况,哌柏西利片在处
方中加入水溶性酸,但哌柏西利容易与酸生成加成物,影响产品稳定性,因此,一方面需要寻找合适的水溶性酸,既能提高药物溶解度,又能在产品有效期内生成较少的酸加成物,另一方面,还需要开发合适的制备工艺,从工艺方面进一步解决稳定性问题。
技术实现要素:
10.本发明的目的是提供一种采用富马酸、枸橼酸、草酸和/或维生素c作为水溶性酸且包含哌柏西利的药物组合物,可以作为现有技术的良好的替代技术方案,本发明还提供该药物组合物的制备方法。本发明所得药物制剂在不同ph值的溶出介质中均具有较好溶出曲线,并且具有良好的贮存稳定性。
11.本发明提供一种含有哌柏西利的药物组合物,包含10wt%至35wt%的哌柏西利、3wt%至25wt%的水溶性酸,以及药学上可接受的载体,其中所述水溶性酸选自富马酸、枸橼酸、草酸、维生素c中的一种或多种。
12.本发明的药物组合物,在一些优选的技术方案中,所述药学上可接受的载体包含稀释剂,选自:微晶纤维素、乳糖、淀粉、预胶化淀粉、甘露醇、山梨醇、木糖醇、碳酸镁、碳酸钙、磷酸氢钙和磷酸钙中的一种或多种,所述稀释剂占所述药物组合物的10wt%至80wt%。
13.本发明的药物组合物,在一些优选的技术方案中,所述药学上可接受的载体包含粘合剂,选自:聚维酮、羟丙甲纤维素、羟丙基纤维素、甲基纤维素和羧甲基纤维素钠中的一种或多种,所述粘合剂占所述药物组合物的0wt%至5wt%。
14.本发明的药物组合物,在一些优选的技术方案中,所述药学上可接受的载体包含成膜材料,选自:聚乙烯醇、羟丙甲纤维素、羟丙基纤维素、甲基纤维素、聚乙二醇、玉米朊、丙烯酸树脂和羧甲基纤维素钠中的一种或多种,所述成膜材料占所述药物组合物的0wt%至10wt%。
15.本发明的药物组合物,在一些优选的技术方案中,所述药学上可接受的载体包含润滑剂,选自:硬脂酸镁、硬脂酸钙、硬脂酸锌和硬脂富马酸钠,所述润滑剂占所述药物组合物的0.5wt%至10wt%。
16.本发明的药物组合物,在一些优选的技术方案中,所述药学上可接受的载体包含助流剂,选自二氧化硅,所述助流剂占所述药物组合物的0wt%至5wt%;所述药学上可接受的载体还包含崩解剂,选自:交联聚维酮、交联羧甲基纤维素钠、低取代羟丙纤维素和羧甲淀粉钠,所述崩解剂占所述药物组合物的3wt%至15wt%。
17.本发明的含有哌柏西利的药物组合物,优选处方组成如下:
[0018][0019]
本发明的药物组合物,在一些优选的技术方案中,为片剂形式,比如单层片或双层片。
[0020]
本发明的药物组合物,在一些优选的技术方案中,在37℃的500毫升ph6.5磷酸盐缓冲液的溶出介质中,所述药物组合物中溶出:
[0021]
(a)在15分钟内不少于30%的哌柏西利;或
[0022]
(b)在30分钟内不少于35%的哌柏西利;或
[0023]
(c)在45分钟内不少于40%的哌柏西利;或
[0024]
(d)同时满足(a)、(b)、(c)中的任意两种或三种。
[0025]
本发明的药物组合物,在一些优选的技术方案中,在40℃及75%rh条件下贮存3个月,所述药物组合物显示出总的有关物质的量少于哌柏西利的0.5%。
[0026]
本发明还提供一种含有哌柏西利的药物组合物的制备方法,包含如下步骤:
[0027]
(1)采用高剪切湿法制粒或流化床一步制粒将哌柏西利和药学上可接受的载体进行初步制粒;
[0028]
(2)将步骤(1)所得颗粒用含有成膜材料的水溶液进行包衣、干燥,得干颗粒,所述成膜材料选自:聚乙烯醇、羟丙甲纤维素、羟丙基纤维素、甲基纤维素、聚乙二醇、玉米朊、丙烯酸树脂和羧甲基纤维素钠中的一种或多种;
[0029]
(3)将步骤(2)所得干颗粒与含有水溶性酸的外加辅料混合均匀后压片,制备得到含有哌柏西利的药物组合物。
[0030]
哌柏西利原料粘附性极强,且处方中主药含量较高,采用普通的湿法制粒或干法制粒工艺均出现非常严重的粘冲现象,无法实现工业化大生产,本发明人发现采用高剪切湿法制粒或流化床一步制粒联合流化床颗粒包衣工艺可以很好地解决粘冲问题。同时,为解决稳定性问题,采用将哌柏西利原料和部分辅料先进行制粒及颗粒包衣,再与水溶性酸混合的工艺,在保证产品溶出度的前提下,最大限度的减少原料与水溶性酸的接触,采用该方法制备的制剂同时满足了溶出度、稳定性及放大生产可行性三方面的要求。
附图说明
[0031]
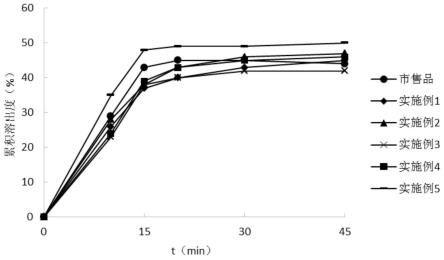
图1是实施例1-5所得产品与市售品的溶出行为对比图;
[0032]
图2是对比例2中所得产品与市售品的溶出行为对比图。
具体实施方式
[0033]
下面通过实施例来进一步说明本发明。应当理解为:本发明的实施例仅仅是用于说明本发明而给出,而不是对本发明的限制,在本发明技术方案的前提下对本发明的简单改进均属于本发明的保护范围。
[0034]
下面结合实施例,进一步阐述本发明。
[0035]
本发明实施例中所述“市售品”是指:pfizer inc公司美国上市的哌柏西利片,商品名ibrance。
[0036]
实施例1:流化床制粒/包衣工艺制备含有哌柏西利和枸橼酸的片剂
[0037]
批量:700片 批号:200522-3
[0038][0039]
注:*在加工过程中被除去。
[0040]
(1)流化床一步制粒及颗粒包衣:
[0041]
将处方量2.2%的羟丙甲纤维素e5边搅拌边加入纯化水中,配制成浓度为5%(w/w)的溶液,备用。
[0042]
将称量好的内加部分原辅料置流化床中,进风温度50~70℃,进风风量10-30m3/h,雾化压力0.5~1.0bar,向上述颗粒喷入hpmc溶液,制粒过程控制物料温度20~35℃,喷完后进行干燥,物料温度达到40~60℃时取样测定水分,控制水分≤2.0%。
[0043]
(2)干整粒:
[0044]
上述干燥后的颗粒用u5整粒机进行干整粒,1.5mm圆孔筛,转速1000rpm。
[0045]
(3)非润滑混合1:
[0046]
将枸橼酸采用粉碎机进行粉碎后,过30目筛,取30目筛以下枸橼酸备用。
[0047]
按要求安装料斗混合机,将除硬脂酸镁外的其他外加辅料置料斗混合机中,进行混合,设定转速15rpm,混合5min。将上述物料用u5整粒机进行过筛,筛网孔径1.2mm圆孔筛,转速500
±
50rpm。
[0048]
(4)非润滑混合2:
[0049]
将非润滑混合1的物料与干整粒后的含药颗粒一起加入料斗混合机内混合,设置混合转速15rpm,混合时间15min,开启设备进行混合。
[0050]
(5)总混:
[0051]
将硬脂酸镁过40目筛后加入料斗混合机内,设置混合转速15rpm,混合时间5min,开启设备进行混合。
[0052]
(6)压片:
[0053]
设定压片机压片速度0.96-1.44万片/小时,控制片芯硬度10-15kg。
[0054]
(7)包衣:
[0055]
配制包衣液,设置包衣机的进风温度50-70℃,包衣过程中控制片芯温度40-55℃。目标增重3%,增重控制范围2%-4%。
[0056]
实施例2:高剪切湿法制粒联合流化床颗粒包衣工艺制备含有哌柏西利和富马酸的片剂
[0057]
批量:1200片 批号:200224-3
[0058][0059]
注:*在加工过程中被除去。
[0060]
(1)高剪切湿法制粒
[0061]
将处方量0.64%的羟丙甲纤维素e3边搅拌边加入纯化水中,配制成浓度为4%(w/w)的溶液,备用。
[0062]
将哌柏西利、内加微晶纤维素ph102、内加交联聚维酮xl置湿法混合制粒机内,设定搅拌速度150rpm和切刀速度1000rpm,进行预混合5min,预混结束后设定搅拌速度150rpm、切刀速度1000rpm,在搅拌状态下加入上述粘合剂溶液,制粒时间5min。制粒结束后,进行湿整粒。
[0063]
(2)流化床颗粒包衣:
[0064]
将处方量1.28%的羟丙甲纤维素e3边搅拌边加入纯化水中,配制成浓度为5%(w/w)的溶液,备用。
[0065]
设定进风温度50~70℃,进风风量10-30m3/h,雾化压力0.5~1.0bar,向上述颗粒喷入hpmc溶液,制粒过程控制物料温度20~35℃,喷完后进行干燥,物料温度达到40~60℃时取样测定水分,控制水分≤2.0%。
[0066]
(3)干整粒:上述干燥后的颗粒用u5整粒机进行干整粒,1.5mm圆孔筛,转速1000rpm。
[0067]
(4)含药层总混:
[0068]
将硬脂酸镁过40目筛后与干整粒后的含药颗粒一起加入料斗混合机内,设置混合转速15rpm,混合时间5min,开启设备进行混合。
[0069]
(5)酸层非润滑混合:
[0070]
将富马酸采用粉碎机进行粉碎后,过30目筛,取30目筛以下富马酸备用。
[0071]
将酸层除硬脂酸镁外的所有辅料加入料斗混合机内混合,设置混合转速15rpm,混合时间15min,开启设备进行混合。
[0072]
(6)酸层总混:将硬脂酸镁过40目筛后加入料斗混合机内,设置混合转速15rpm,混合时间5min,开启设备进行混合。
[0073]
(7)压片:将含药层和酸层物料进行双层片压片,控制片芯硬度10-15kg。
[0074]
(8)包衣:
[0075]
配制包衣液,设置包衣机的进风温度50-70℃,包衣过程中控制片芯温度40-55℃。目标增重3%,增重控制范围2%-4%。
[0076]
实施例3:高剪切湿法制粒联合流化床颗粒包衣工艺制备含有哌柏西利和草酸的片剂
[0077]
批量:1000片 批号:200323-4
[0078][0079]
注:*在加工过程中被除去。
[0080]
(1)高剪切湿法制粒
[0081]
将处方量0.64%的羟丙甲纤维素e3边搅拌边加入纯化水中,配制成浓度为5%(w/w)的溶液,备用。
[0082]
将哌柏西利、内加微晶纤维素ph102、内加交联聚维酮xl置湿法混合制粒机内,设定搅拌速度150rpm和切刀速度1000rpm,进行预混合5min,预混结束后设定搅拌速度150rpm、切刀速度1000rpm,在搅拌状态下加入上述粘合剂溶液,制粒时间5min。制粒结束后,进行湿整粒。
[0083]
(2)流化床颗粒包衣:
[0084]
将处方量1.28%的羟丙甲纤维素e3边搅拌边加入纯化水中,配制成浓度为7%(w/w)的溶液,备用。
[0085]
设定进风温度50~70℃,进风风量10-30m3/h,雾化压力0.5~1.0bar,向上述颗粒喷入hpmc溶液,制粒过程控制物料温度20~35℃,喷完后进行干燥,物料温度达到40~60℃时取样测定水分,控制水分≤2.0%。
[0086]
(3)干整粒:上述干燥后的颗粒用u5整粒机进行干整粒,1.5mm圆孔筛,转速1000rpm。
[0087]
(4)含药层非润滑混合:
[0088]
将干整粒后的含药颗粒与除硬脂酸镁外的其他含药层外加辅料一起加入料斗混合机内,设置混合转速15rpm,混合时间15min,开启设备进行混合。
[0089]
(5)含药层总混:
[0090]
将硬脂酸镁过40目筛后加入料斗混合机内,设置混合转速15rpm,混合时间5min,开启设备进行混合。
[0091]
(6)酸层非润滑混合:
[0092]
将草酸采用粉碎机进行粉碎后,过30目筛,取30目筛以下草酸备用。
[0093]
将酸层除硬脂酸镁外的所有辅料加入料斗混合机内混合,设置混合转速15rpm,混合时间15min,开启设备进行混合。
[0094]
(7)酸层总混:将硬脂酸镁过40目筛后加入料斗混合机内,设置混合转速15rpm,混合时间5min,开启设备进行混合。
[0095]
(8)压片:将含药层和酸层物料进行双层片压片,控制片芯硬度10-15kg。
[0096]
(9)包衣:配制包衣液,设置包衣机的进风温度50-70℃,包衣过程中控制片芯温度40-55℃。目标增重3%,增重控制范围2%-4%。
[0097]
实施例4:高剪切湿法制粒联合流化床颗粒包衣工艺制备含有哌柏西利和枸橼酸的片剂
[0098]
批量:1000片 批号:200309-2
[0099][0100]
注:*在加工过程中被除去。
[0101]
(1)高剪切湿法制粒
[0102]
将处方量0.64%的羟丙甲纤维素e5边搅拌边加入纯化水中,配制成浓度为3.5%(w/w)的溶液,备用。
[0103]
将哌柏西利、内加微晶纤维素ph102、内加交联聚维酮xl置湿法混合制粒机内,设定搅拌速度150rpm和切刀速度1000rpm,进行预混合5min,预混结束后设定搅拌速度150rpm、切刀速度1000rpm,在搅拌状态下加入上述粘合剂溶液,制粒时间5min。制粒结束后,进行湿整粒。
[0104]
(2)流化床颗粒包衣:
[0105]
将处方量2.56%的羟丙甲纤维素e5边搅拌边加入纯化水中,配制成浓度为6%(w/w)的溶液,备用。
[0106]
将上述湿颗粒加入流化床中,设定进风温度50~70℃,进风风量10-30m3/h,雾化压力0.5~1.0bar,向上述颗粒喷入hpmc溶液,制粒过程控制物料温度20~35℃,喷完后进行干燥,物料温度达到40~60℃时取样测定水分,控制水分≤2.0%。
[0107]
(3)干整粒:上述干燥后的颗粒用u5整粒机进行干整粒,1.5mm圆孔筛,转速1000rpm。
[0108]
(4)非润滑混合:
[0109]
将枸橼酸采用粉碎机进行粉碎后,过30目筛,取30目筛以下枸橼酸备用。
[0110]
按要求安装料斗混合机,将干整粒后的含药颗粒与除硬脂酸镁以外的外加辅料置料斗混合机中,进行混合,设定转速15rpm,混合15min。
[0111]
(5)总混:将硬脂酸镁过40目筛后加入料斗混合机内,设置混合转速15rpm,混合时间5min,开启设备进行混合。
[0112]
(6)压片:设定压片机压片速度0.96-1.44万片/小时,控制片芯硬度10-15kg。
[0113]
(7)包衣
[0114]
配制包衣液,设置包衣机的进风温度50-70℃,包衣过程中控制片芯温度40-55℃。目标增重3%,增重控制范围2%-4%。
[0115]
实施例5:流化床一步制粒及颗粒包衣制备含有哌柏西利和维生素c的片剂
[0116]
批量:800片 批号:200228
[0117][0118]
注:*在加工过程中被除去。
[0119]
(1)流化床一步制粒及颗粒包衣:
[0120]
将处方量1.8%的羟丙甲纤维素e5边搅拌边加入纯化水中,配制成浓度为5%(w/w)的溶液,备用。
[0121]
将称量好的内加部分原辅料置流化床中,设定进风温度50~70℃,进风风量10-30m3/h,雾化压力0.5~1.0bar,向上述颗粒喷入hpmc溶液,制粒过程控制物料温度20~35℃,喷完后进行干燥,物料温度达到40~60℃时取样测定水分,控制水分≤2.0%。
[0122]
(2)干整粒:上述干燥后的颗粒用u5整粒机进行干整粒,1.5mm圆孔筛,转速1000rpm。
[0123]
(3)非润滑混合:
[0124]
将维生素c采用粉碎机进行粉碎后,过30目筛,取30目筛以下维生素c备用。
[0125]
按要求安装料斗混合机,将干整粒后的含药颗粒与除硬脂酸镁以外的外加辅料置料斗混合机中,进行混合,设定转速15rpm,混合15min。
[0126]
(4)总混:将硬脂酸镁过40目筛后加入料斗混合机内,设置混合转速15rpm,混合时
间5min,开启设备进行混合。
[0127]
(5)压片:设定压片机压片速度0.96-1.44万片/小时,控制片芯硬度10-15kg。
[0128]
(6)包衣:配制包衣液,设置包衣机的进风温度50-70℃,包衣过程中控制片芯温度40-55℃。目标增重3%,增重控制范围2%-4%。
[0129]
对比例1:高剪切湿法制粒制备含哌柏西利和富马酸的片剂
[0130]
批量:500片 批号:200411
[0131][0132]
注:*在加工过程中被除去。
[0133]
(1)高剪切湿法制粒
[0134]
将处方量的聚维酮k30边搅拌边加入纯化水中,配制成浓度为10%(w/w)的溶液,备用。
[0135]
将哌柏西利、内加微晶纤维素ph102、内加交联聚维酮xl置湿法混合制粒机内,设定搅拌速度250rpm和切刀速度1000rpm,进行预混合5min,预混结束后设定搅拌速度250rpm、切刀速度1000rpm,在搅拌状态下加入上述粘合剂溶液,制粒时间5min。制粒结束后,进行湿整粒。
[0136]
(2)流化床干燥:
[0137]
将上述湿颗粒加入流化床中,设定进风温度50~70℃,进风风量10-30m3/h,进行干燥,物料温度达到40~60℃时取样测定水分,控制水分≤2.0%。
[0138]
(3)干整粒:上述干燥后的颗粒用u5整粒机进行干整粒,1.5mm圆孔筛,转速1000rpm。
[0139]
(4)非润滑混合:
[0140]
将富马酸采用粉碎机进行粉碎后,过30目筛,取30目筛以下富马酸备用。
[0141]
按要求安装料斗混合机,将干整粒后的含药颗粒与除硬脂酸镁以外的外加辅料置
料斗混合机中,进行混合,设定转速15rpm,混合15min。
[0142]
(5)总混:
[0143]
将硬脂酸镁过40目筛后加入料斗混合机内,设置混合转速15rpm,混合时间5min,开启设备进行混合。
[0144]
(6)压片:设定压片机压片速度0.96-1.44万片/小时,控制片芯硬度10-15kg。
[0145]
(7)包衣:配制包衣液,设置包衣机的进风温度50-70℃,包衣过程中控制片芯温度40-55℃。目标增重3%,增重控制范围2%-4%。
[0146]
对比例2:不含水溶性酸的哌柏西利片剂
[0147]
批量:500片 批号:200522-6
[0148][0149]
注:*在加工过程中被除去。
[0150]
(1)高剪切湿法制粒:
[0151]
将处方量0.64%的羟丙甲纤维素e5边搅拌边加入纯化水中,配制成浓度为3.5%(w/w)的溶液,备用。
[0152]
将哌柏西利、内加微晶纤维素ph102、内加交联聚维酮xl置湿法混合制粒机内,设定搅拌速度250rpm和切刀速度1000rpm,进行预混合5min,预混结束后设定搅拌速度250rpm、切刀速度1000rpm,在搅拌状态下加入上述粘合剂溶液,制粒时间5min。制粒结束后,进行湿整粒。
[0153]
(2)流化床颗粒包衣:
[0154]
将处方量1.28%的羟丙甲纤维素e5边搅拌边加入纯化水中,配制成浓度为5%(w/w)的溶液,备用。
[0155]
将上述湿颗粒加入流化床中,设定进风温度50~70℃,进风风量10-30m3/h,雾化压力0.5~1.0bar,向上述颗粒喷入hpmc溶液,制粒过程控制物料温度20~35℃,喷完后进行干燥,物料温度达到40~60℃时取样测定水分,控制水分≤2.0%。
[0156]
(3)干整粒:上述干燥后的颗粒用u5整粒机进行干整粒,1.5mm圆孔筛,转速1000rpm。
[0157]
(4)非润滑混合1:
[0158]
按要求安装料斗混合机,将除硬脂酸镁外的其他外加辅料置料斗混合机中,进行混合,设定转速15rpm,混合5min。将上述物料用u5整粒机进行过筛,筛网孔径1.2mm圆孔筛,转速500
±
50rpm。
[0159]
(5)非润滑混合2:
[0160]
将非润滑混合1的物料与干整粒后的含药颗粒一起加入料斗混合机内混合,设置混合转速15rpm,混合时间15min,开启设备进行混合。
[0161]
(6)总混:将硬脂酸镁过40目筛后加入料斗混合机内,设置混合转速15rpm,混合时间5min,开启设备进行混合。
[0162]
(7)压片:设定压片机压片速度0.96-1.44万片/小时,控制片芯硬度10-15kg。
[0163]
(8)包衣:配制包衣液,设置包衣机的进风温度50-70℃,包衣过程中控制片芯温度40-55℃。目标增重3%,增重控制范围2%-4%。
[0164]
实验例
[0165]
(1)溶出度测定
[0166]
照溶出度与释放度测定法(中国药典2020年版四部通则0931第二法)。
[0167]
其中哌柏西利对照品为含量99.7%的哌柏西利,山东安弘制药有限公司生产。
[0168]
溶出条件:以ph6.5缓冲液(取磷酸二氢钾0.68g,加0.1mol/l氢氧化钠溶液15.2ml,用水稀释至100ml)500ml为溶出介质,转速为每分钟50转,依法操作,分别于10、15、20、30、45分钟取溶液5ml(自动溶出仪,设置自动取样仪器润洗体积不少于5ml),同时补液5ml。
[0169]
供试品溶液:精密量取溶出液1ml,置10ml量瓶中,用溶出介质稀释至刻度,摇匀。
[0170]
对照品溶液:取哌柏西利对照品约25mg,精密称定,置100ml量瓶中,用0.1mol/l盐酸溶液溶解并稀释至刻度,摇匀,精密量取5ml,置50ml量瓶中,用溶出介质稀释至刻度,摇匀,即得。
[0171]
系统适用性要求:对照品溶液连续测定的相对标准偏差应不得过2.0%。
[0172]
测定法:取供试品溶液与对照品溶液,照紫外-可见分光光度法(中国药典2020年版通则0401),检测池规格为1cm,在288nm的波长处测定吸光度,计算出每片的溶出量。
[0173]
实施例1-5中自制品的溶出行为与市售品的对比数据参见表1所示;对比例2中自制品的溶出行为与市售品的对比数据参见表2所示。
[0174]
表1实施例1-5中自制品的溶出行为与市售品进行对比
[0175][0176]
表2对比例2中自制品的溶出行为与市售品进行对比
[0177][0178]
(2)稳定性
[0179]
将实施例1-4和对比例1制备的样品用聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片和药用铝箔进行包装,置于温度40℃
±
2℃、相对湿度75%
±
5%的条件下放置3个月,实施例1-4的样品有关物质与0天比较,均无明显变化,均符合标准规定,对比例1的样品有关物质与0天比较,有明显增加,数据参见表3所示。
[0180]
表3实施例1-4和对比例1的样品加速3个月稳定性数据
[0181]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1