药物缀合物及其应用的制作方法
1.本发明涉及药学领域,具体的,本发明涉及药物缀合物、含有药物缀合物的药物组合物、药物缀合物在对活性药物分子进行活性研究中的用途以及对活性药物分子进行无创体内显像的方法。
背景技术:
2.糖类物质作为除蛋白质和核酸之外的第3类生物大分子,是生物体能量的来源和物质循环的中心,也是维持细胞形态和构架的重要骨架和支撑单元。
3.糖类以寡糖、多糖、糖蛋白、糖脂等游离或复合物的形式直接参与细胞的分化、增殖、免疫、衰老、信息传递、迁移等几乎所有生命活动。因此,糖类物质与人类多种疾病密切相关。
4.目前,全球糖类药物的研发日益活跃,批准上市的糖类药物数量和销售量不断上升。以六元环的吡喃糖、五元环的呋喃糖、氮杂糖和高碳糖唾液酸等为结构骨架进行药物信息检索,可查到糖类化学药物有150多种,其中已上市药物70种。这些药物被广泛应用于感染性疾病、肿瘤、心脑血管疾病、内分泌和代谢疾病、呼吸系统疾病、皮肤病、神经系统疾病、肌肉骨骼和结缔组织疾病、消化系统疾病、血液系统疾病等领域。恩格列净、达格列净、依诺肝素、布瑞亭等“重磅炸弹”级糖类药物2019年全球销售额均超过10亿美元。
5.然而,目前针对药物尤其是多糖药物的体内分布研究手段仍有待改进。
技术实现要素:
6.本发明旨在至少在一定程度上解决相关技术中的技术问题之一。为此,本发明的一个目的旨在提出一种能够有效实现对药物活性分子进行无创体内显像检测的手段。
7.具体的,在本发明的一个方面,本发明提出了一种药物缀合物,根据本发明的实施例,所述缀合物具有下式所示结构:
8.dt-(r0-lg-nu)n9.式i
10.其中,
11.r0表示-o-、-c(=o)o-或任选被取代的c1~4亚烷基,
12.dt表示活性药物分子,所述活性药物分子携带第一连接基团,
13.nu表示可在生物活体内被无创检测的放射性同位素,所述放射性同位素适于释放包括正电子、β-射线或γ射线辐射的至少之一,
14.lg表示连接单元,所述连接单元携带第二连接基团,所述第二连接基团与所述第一连接基团适于形成含有r0的共价连接,所述连接单元适于与所述放射性同位素形成共价连接或通过螯合结构连接,和
15.n表示至少为1的整数。
16.根据本发明的实施例,发明人发现,通过采用该缀合物,能够有效地利用放射性同
位素所产生的正电子、β-射线、γ射线,对活性药物分子进行进行无创体内显像检测,由此能够更加真实地反映活性药物分子在体内的分布,可以进一步利用该药物缀合物对活性药物分子进行活性研究,有助于药物的开发,尤其是糖类药物,例如多糖类药物的开发。
17.根据本发明的实施例,本发明提供的药物缀合物还具有以下附加技术特征:
18.根据本发明的实施例,n表示2~10的整数。
19.根据本发明的实施例,r0表示-o-、-c(=o)o-或任选取代的亚甲基。
20.根据本发明的实施例,所述亚甲基任选被选自c1~10烷基、c2~10烯基、c3~10炔基、卤素的取代基中的至少之一取代。
21.根据本发明的实施例,所述第一连接基团含有选自氨基、羧基、羟基、羟甲基、半缩醛基的至少之一。
22.根据本发明的实施例,所述第二连接基团含有选自任选取代的胺基、亚胺基、异硫氰酸酯基、马来酰亚胺基或者
23.根据本发明的实施例,所述放射性同位素包括选自
131
i、
125
i、
123
i、
124
i、
18
f、
89
zr、
76
br、
52
mn、
64
cu、
99m
tc、
68
ga、
177
lu和
188
re的至少之一,
24.其中,
25.当所述放射性同位素为选自
131
i、
125
i、
123
i、
124
i、
18
f、
76
br的至少之一时,所述连接单元适于与所述放射性同位素形成共价连接。
26.根据本发明的实施例,所述连接单元为任选取代的亚烯基。
27.根据本发明的实施例,所述亚烯基为c2~12,优选c2~8的亚烯基。
28.根据本发明的实施例,所述亚烯基任选被选自c1~10烷基、c2~10烯基、c3~10炔基、卤素的取代基中的至少之一取代
29.根据本发明的实施例,所述连接单元为任选取代的c5-18芳基。
30.根据本发明的实施例,所述c5-18芳基任选被选自c1~10烷基、c2~10烯基、c3~10 炔基、卤素的取代基中的至少之一取代。
31.根据本发明的实施例,所述连接单元含有任选取代的苯环。
32.根据本发明的实施例,所述苯环任选被选自c1~10烷基、c2~10烯基、c3~10炔基、卤素的取代基中的至少之一取代。
33.根据本发明的实施例,当所述放射性同位素为选自
89
zr、
52
mn、
64
cu、
99m
tc、
68
ga、
177
lu 和
188
re的至少之一时,所述连接单元含有与所述放射性同位素形成螯合结构的第二连接基团。
34.根据本发明的实施例,所述连接单元含有选自ota、dtpa、nota、dota、hbed、 dfo、edta、h2dedpa、柠檬酸及其衍生物的至少之一。
35.根据本发明的实施例,所述螯合结构为四或六配位结构。
36.根据本发明的实施例,所述活性药物分子包括糖、单糖、寡糖、多糖、氨基酸、寡肽、多肽、蛋白质、脂肪酸、脂肪、核酸、糖脂、糖蛋白、蛋白多糖、肽聚糖、糖-核酸。
37.根据本发明的实施例,所述活性药物分子包括多糖类药物。
38.根据本发明的实施例,所述多糖类药物为粘多糖类、香菇多糖、裂褶菌多糖、灵芝多糖、茯苓多糖、黄芪多糖、人参多糖、糖蛋白、糖脂或其衍生物。
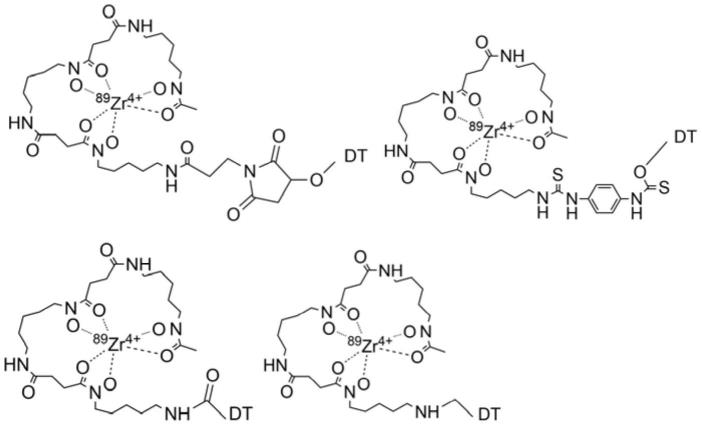
39.根据本发明的实施例,所述药物缀合物具有以下结构之一:
40.41.42.[0043][0044]
在本发明的第二方面,本发明提出了一种药物组合物,其包含:
[0045]
有效量的第一方面所述的药物缀合物;和
[0046]
任选的药学上可接受的载体、稀释剂、辅料。
[0047]
本发明的第三方面提出了前面所描述的药物缀合物或药物组合物在生物体内对活性药物分子进行活性研究中的用途,可选的,所述活性研究包括下列的至少之一:
[0048]
所述活性研究包括下列的至少之一:
[0049]
所述活性药物分子的在生物体内的分布、代谢或降解;和/或
[0050]
所述活性药物分子在生物体内的吸收、分布、代谢和排泄;和/或
[0051]
所述活性药物分子的离体血液、体液中的代谢、离体组织分布;和/或
[0052]
所述活性药物分子的活体内无创显像。
[0053]
在本发明的第四方面,本发明提出了一种对活性药物分子进行无创体内检测的方法,包括:
[0054]
对哺乳动物施用可检测量的第一方面所述的药物缀合物、或第二方面所述药物组合物;
[0055]
基于所述药物缀合物或药物组合物所释放的放射性辐射进行所述检测。
[0056]
根据本发明的实施例,所述检测方法包括实施正电子发射断层扫描(pet)显像、单光子发射计算机断层扫描(spect)、核磁共振显像或放射自显影。
[0057]
根据本发明的实施例,本发明可以实现采用常规正电子/单光子同位素标记药物活性分子尤其是多糖类药物分子,弥补了目前多糖物质(尤其是中药多糖类药物、氧化纤维素类医疗器械)在传统技术下,较难进行代谢、组织分布、靶向性等研究的问题。根据本发明的实施例,采用
89
zr(78.4h)、
124
i(100h)等同位素标记多糖可实现更长时间(1个月) 的多糖代谢检测,且可以进行高定量精度的pet活体显像;此外根据本发明的实施例,采用
125
i同位素,可实现12个月的多糖代谢检测,也可进行spect活体显像。另外,根据本发明的实施例,采用本发明的缀合物可以用于离体血药代、组织分布研究,也可进行活性显像研究,获得其代谢生物半衰期、代谢途径、组织分布等数据,进行相关机理研究,充实新药及医疗器械申报数据。由此,采用根据本发明实施例所述的方法可为新药/医疗器械开发过程中的早期机理机制研究、中期注册申报及临床用药提供大量可靠数据。
[0058]
根据本发明的实施例,通过含静脉注射、肌内注射、皮下注射、腹腔注射、口服、灌胃或十二指肠给药方式进行给药。
[0059]
根据本发明的实施例,所述哺乳动物包括选自小鼠、大鼠、犬、兔、猪、灵长类的至少之一。
[0060]
根据本发明的实施例,所述灵长类包含猴类及人类。
[0061]
根据本发明的实施例,在进行所述施用之前,预先包括:
[0062]
对活性药物分子进行修饰,以便使所述活性药物分子携带第一连接基团,
[0063]
可选的,所述第一连接基团含有选自氨基、羧基、羟基、羟甲基、半缩醛基的至少之一;和
[0064]
使经过修饰的所述药物分子与具有下式的化合物反应,以便获得所述药物缀合物:
[0065]
lg-nu,
[0066]
其中,lg和nu如第一方面所述。
[0067]
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
[0068]
图1显示了根据本发明一个实施例制备放射性标记的糖缀合物的方法流程;
[0069]
图2显示了一个实施例的大鼠micro pet/ct扫描冠状位层面图的影像分析结果;
[0070]
图3显示了根据本发明另一个实施例静脉给药后的大鼠micro pet扫描图以及相应的影像分析结果以及十二指肠给药后的大鼠micro pet扫描图以及相应的影像分析结果。
具体实施方式
[0071]
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均
为可以通过市购获得的常规产品。
[0072]
本发明是基于发明人的下列发现而完成的:现有对药物的体内药代或组织分布的分析,主要采用
13
c进行标记,即将活性药物分子中的特定碳原子进行置换后进行研究,而
13
c标记法一般不能提供足够的灵敏度来实现无创体内显像,往往需要通过抽取血液等复杂操作,并且不能真实反应活性药物分子的体内分布或者体内药代行为。本发明的发明人在研究过程中发现,多糖类药物通常携带多个反应基团例如羟基等,这些反应基团可以进一步与携带放射性同位素的连接单元形成共价连接,从而可以借助放射性同位素对活性药物分子例如多糖类药物的体内行为进行示踪或者无创体内显像检测。在此基础上,本发明的发明人进行了深入研究和优化,完成了本发明。
[0073]
定义
[0074]
应当理解的是,本文采用的术语用于描述具体实施方案的目的,而不意在限制。进一步,尽管与本文所述的那些相似或等效的任何方法、装置和材料可用于本发明的实践或测试中,但现在描述优选的方法、装置和材料。除了上述内容以外,如说明书和所附权利要求中所使用,除非相反地指出,否则以下术语具有所示的含义:
[0075]“烷基”是指具有1至10个碳原子、优选1至8个碳原子或1至6个碳原子且通过单键连接至分子的剩余部分的直链、饱和、无环、单价烃基或支链、饱和、无环、单价烃基,例如甲基、乙基、正丙基、1-甲基乙基(异丙基)、正丁基、正戊基、1,1-二甲基乙基(叔丁基)、 3-甲基己基、2-甲基己基等。
[0076]“烯基”是指含有1、2或3个或更多个碳-碳双键、具有2至10个碳原子、优选2至 8个碳原子且通过单键连接至分子的剩余部分的直链、无环、单价烃基或支链、无环、单价烃基,例如乙烯基、丙-1-烯基、丁-1-烯基、戊-1-烯基、戊-1,4-二烯基等。
[0077]“亚烷基”是指具有1至4个碳原子的直链、无环、饱和、二价烃链或支链、无环、饱和、二价烃链,例如亚甲基、亚乙基、亚丙基、正亚丁基等。亚烷基链通过单键连接。亚烷基链的连接点可以在亚烷基链内的同一碳原子上或不同碳原子上。任选取代的亚烷基链是任选地被1、2、3、4或5个取代基取代(价态允许)的亚烷基链,所述取代基独立地选自由以下组成的组:c1~10烷基、c2~10烯基、c3~10炔基、卤素。
[0078]“亚烯基”是指含有1、2或3个碳-碳双键且具有2至12个碳原子的直链、无环、二价烃链或支链、无环、二价烃链,例如,亚乙烯基、亚丙烯基、正亚丁烯基等。亚烯基链通过单键连接。亚烯基链的连接点可以在亚烯基链内的同一碳原子上或不同碳原子上。任选取代的亚烯基链是任选地被1、2、3、4或5个取代基取代(价态允许)的亚烯基链,所述取代基独立地选自由以下组成的组:c1~10烷基、c2~10烯基、c3~10炔基、卤素。
[0079]“芳基”是指含有5至18个碳原子的芳族单环或多环烃环系统基团,其中多环芳环系统是双环、三环或四环环系统。芳基包括但不限于诸如芴基、苯基和萘基的基团。任选取代的芳基是任选地被1、2、3、4或5个取代基取代的芳基,所述取代基独立地选自由以下组成的组:c1~10烷基、c2~10烯基、c3~10炔基、卤素。
[0080]“卤素”是指卤素取代基:溴、氯、氟和碘。
[0081]“哺乳动物”包括人,以及家养动物(诸如实验室动物和家庭宠物(例如猫、狗、猪、牛、绵羊、山羊、马、兔)和非家养动物(诸如野生动物)等。
[0082]“药学上可接受的载体、稀释剂、辅料”包括但不限于已通过食品和药品管理局批
准可被接受用于人或家养动物的任何助剂、载体、赋形剂、助流剂、增甜剂、稀释剂、防腐剂、染料/着色剂、香味增强剂、表面活性剂、湿润剂、分散剂、悬浮剂、稳定剂、等渗剂、溶剂或乳化剂。
[0083]
本发明中所用的“dt-oh”、“dt-c(=o)-h”、“dt-c(=o)oh”是指携带羟基、醛基、羧基的多糖药物,这里所显示的羟基、醛基、羧基等,仅仅是为了描述方便,并不限制该多糖药物所含羟基、醛基、羧基的数目。
[0084]
本文所用术语“有效量”定义为将本发明中药物缀合物或含有药物缀合物的药物组合物施用于待检测对象之后,利用现有显像技术,例如电子发射断层扫描(pet)显像、单光子发射计算机断层扫描(spect)、核磁共振显像或放射自显影等能够对待检测对象中药物缀合物中的活性药物分子进行无创体内显像检测所需的量。
[0085]
药物缀合物
[0086]
具体的,在本发明的一个方面,本发明提出了一种药物缀合物,根据本发明的实施例,所述缀合物具有下式所示结构:
[0087]
dt-(r0-lg-nu)n[0088]
式i
[0089]
其中,
[0090]
r0表示-o-、-c(=o)o-或任选被取代的c1~4亚烷基,
[0091]
dt表示活性药物分子,所述活性药物分子携带第一连接基团,
[0092]
nu表示可在生物活体内被无创检测的放射性同位素,所述放射性同位素适于释放包括正电子、β-射线或γ射线辐射的至少之一,
[0093]
lg表示连接单元,所述连接单元携带第二连接基团,所述第二连接基团与所述第一连接基团适于形成含有r0的共价连接,所述连接单元适于与所述放射性同位素形成共价连接或通过螯合结构连接,和
[0094]
n表示至少为1的整数,
[0095]
根据本发明的实施例,发明人发现,通过采用该缀合物,能够有效地利用放射性同位素所产生的β-射线、γ射线,对活性药物分子进行无创体内显像检测,由此能够更加真实地反映活性药物分子在体内的分布,可以进一步利用该药物缀合物对活性药物分子进行活性研究,有助于药物的开发,尤其是糖类药物,例如多糖类药物的开发。在本发明的一些实施例中,r0表示-o-、-c(=o)o-或任选被取代的c1~4亚烷基,其中,c1~4亚烷基可以为任选被取代的亚甲基。这里可以采用的取代基包括但不限于c1~10烷基、c2~10烯基、 c3~10炔基、卤素等。
[0096]
根据本发明的实施例,活性药物分子可以与连接单元形成含有前面所定义r0的共价结合,换句话说,活性药物分子含有至少一个第一连接基团作为反应性基团,该反应性基团可以与连接单元的第二连接基团形成共价连接。根据本发明的一些具体实例,发明人通过实验发现,活性药物分子尤其是多糖药物上携带的多种常见的基团可以作为该第一连接基团,诸如第一连接基团含有选自氨基、羧基、羟基、羟甲基、半缩醛基的至少之一。在后面的具体实施例中,本发明的发明人针对不同的基团实现了活性药物分子与连接单元的共价连接。并且本发明的发明人发现,针对多糖类药物,针对上述第一连接基团与连接单元形成共价连接,对于该药物分子的生物活性,并未造成显著影响,因此,可以有效地应用于对药
物分子自身的活性研究,有助于药物的开发,例如可以用于离体血药代、组织分布研究,也可进行活性显像研究,获得其代谢生物半衰期、代谢途径、组织分布等数据,进行相关机理研究。
[0097]
另外,根据本发明的实施例,可以采用的第二连接基团可以含有选自任选取代的胺基、亚胺基、异硫氰酸酯基、马来酰亚胺基或者这里可以采用的取代基包括但不限于c1~10烷基、c2~10烯基、c3~10炔基、卤素等。由此,采用这些连接基团,其具有活泼基团,可以与多种反应基团反应形成共价连接,由此,采用这类第二连接基团,可以提高本发明的方案针对多用活性药物分子的适用性。
[0098]
根据本发明的实施例,所述放射性同位素包括选自
131
i、
125
i、
123
i、
124
i、
18
f、
89
zr、
76
br、
52
mn、
64
cu、
99m
tc、
68
ga、
177
lu和
188
re的至少之一,这些放射性同位素的半衰期相对较长,能够释放足够的正电子、β-射线或γ射线,可以有效地进行活性显像,并且能够进行长期观察。根据本发明的实施例,例如,
89
zr(78.4h)、
124
i(100h)等同位素标记多糖药物可实现更长时间(1个月)的多糖药物的代谢检测,且可以进行高定量精度的pet活体显像;另外,根据本发明实施例,在采用
125
i同位素进行标记时,可实现12个月的多糖药物的代谢检测,也可进行spect活体显像。
[0099]
另外,根据本发明的实施例,当所述放射性同位素为选自
131
i、
125
i、
123
i、
124
i、
18
f、
76
br 的至少之一时,所述连接单元适于与所述放射性同位素形成共价连接,可选的,所述连接单元为任选取代的c5-10芳香族化合物,可选的,所述连接单元含有任选取代的苯环。由此,可以通过常规的卤素取代反应,实现放射性同位素与连接单元的稳定结合。
[0100]
当所述放射性同位素为选自
89
zr、
52
mn、
64
cu、
99m
tc、
68
ga、
177
lu和
188
re的至少之一时,所述连接单元与所述放射性同位素形成螯合结构,可选的,所述连接单元含有选自 ota、dtpa、nota、dota、hbed、dfo、edta、h2dedpa、柠檬酸及其衍生物的至少之一,可选的,所述螯合结构为六齿结构,优选的是连接单元含有dfo作为螯合剂,从而可以有效地与金属类放射性同位素形成更稳定的螯合结构。
[0101]
需要说明的是,本领域技术人员能够理解,活性药物分子例如多糖药物可以连接的放射性标记物的种类或数量均没有特别的限制,即n的数目并不受特别限制,可以连接一个放射性标记物,也可以连接多个相同的或不同的放射性标记物。放射性标记物与糖的连接方式也没有特别的限制,可以与活性药物分子例如多糖药物上的任意反应基团进行共价键结合进而连接在活性药物分子例如多糖药物上,活性药物分子例如多糖药物上连接的放射性标记物可以通过与活性药物分子例如多糖药物上的一个或多个相同的或不同的反应基团共价键结合至所述活性药物分子例如多糖药物上的。
[0102]
根据本发明的实施例,n不超过10,例如1、2、3、4、5、6、7、8、9或10,其中,可选的,n为1、2、3、4或5。基于本发明发明人的发现,活性药物分子尤其是多糖药物,其中含有较多的羟基结构,从而,缀合物可以含有多个连接单元,即活性药物分子可以和多个连接单元结合,例如连接单元可能与活性药物分子中的多个位置共价连接,换句话说药物缀合物式i中n值可以是2或大于2的整数。另外发明人还发现,可以通过控制活性药物分子与连接单元的共价连接的反应时间以及反应物之间的比例来容易地控制n值。本领域技术人员可以根据本发明所披露的方法进行制备。
[0103]
另外,发明人发现,当n值≥2时,特别是在2~10,进一步优选2~5时,将该药物缀合物施用于受试者后,利用体内无创显像技术,检测药物分子的组织分布、代谢途径时,显像效果可以得到进一步提高。
[0104]
根据本发明的实施例,药物缀合物中活性药物分子的分子量远大于n个连接单元的分子量,例如根据本发明的实施例,活性药物分子的分子量与n个连接单元分子量的分子量比例可以为(5~100):1,例如(10~90):1、(20~80):1、(30~70):1、(40~60):1,且 n值为2~10时,利用本发明方法获得的药物缀合物不会影响活性药物分子本身的生物活性,并且显像效果更好,更利于进行观察检测,能够真实反映活性药物的生物活性行为。
[0105]
根据本发明的实施例,可以针对含有连接单元的药物缀合物与活性药物进行平行实验,进行生物活性的比较,来确认药物缀合物和活性药物是否具有相同或者相似的生物活性,从而,确认连接单元的数目是否影响药物缀合物的生物活性行为。
[0106]
根据本发明的实施例,所述活性药物分子包括糖、单糖、寡糖、多糖、氨基酸、寡肽、多肽、蛋白质、脂肪酸、脂肪、核酸、糖脂、糖蛋白、蛋白多糖、肽聚糖、糖-核酸,可选的,所述活性药物分子包括多糖类药物,可选的,所述多糖类药物为粘多糖类、香菇多糖、裂褶菌多糖、灵芝多糖、茯苓多糖、黄芪多糖、人参多糖、糖蛋白、糖脂或其衍生物。
[0107]
由此,根据本发明的实施例,本发明提供了一种放射性标记的糖缀合物,所述糖缀合物包括:糖;和通过与糖上的反应基团共价键结合形成连接基团进而连接在糖上的一个或多个放射性标记物,所述放射性标记物含有放射性同位素。换句话说,所述糖缀合物是糖和所述放射性标记物与糖上的反应基团共价键结合形成连接基团制备得到的产物。
[0108]
根据本发明的实施例,在本发明中,所述糖缀合物的糖上还可以连接有一些非糖基团,包括但不限于:氨基酸、多肽、蛋白质、脂肪酸、脂肪、核酸,或其任意组合。糖可以与所述非糖基团共价结合形成结合糖、糖复合物或复合糖,例如糖脂(glycolipids)、糖蛋白 (glycoproteins)、蛋白多糖(proteoglycans)、肽聚糖(peptidoglycan),糖—核酸等。
[0109]
根据本发明的实施例,所述糖上连接的放射性标记物的种类或数量均没有特别的限制,糖上可以连接一个放射性标记物,也可以连接多个相同的或不同的放射性标记物。根据本发明的实施例,放射性标记物与糖的连接方式也没有特别的限制,可以与糖上的任意反应基团进行共价键结合进而连接在糖上,所述糖上连接的放射性标记物可以通过与糖上的一个或多个相同的或不同的反应基团共价键结合至所述糖上的。
[0110]
根据本发明的实施例,所述糖上的反应基团选自下组:羟基、羟甲基、氨基、羧基、半缩醛基,或其任意组合。优选地,所述放射性标记物与糖上的反应基团共价键结合形成的连接基团为酯基或酰胺基
[0111]
根据本发明的实施例,所述放射性元素包括但不限于:
131
i、
125
i、
123
i、
124
i、
18
f、
89
zr、
76
br、
52
mn、
64
cu、
99m
tc、
68
ga、
177
lu、
188
re。优选地,所述放射性元素选自下组:
124
i、
125
i、
123
i、
18
f、
89
zr、
64
cu、
76
br。
[0112]
根据本发明的实施例,在优选地实施方式中,所述糖缀合物含有下列任意一种结构:
[0113][0114]
其中,
[0115]
其中,s表示糖;n表示0-10的整数,优选为0-5的整数;y表示放射性元素或放射性元素取代的c5-10芳香环或
89
zr的有机鳌合物,优选地,所述有机螯合物具有结构
[0116]
y的定义如本说明书中所述。
[0117]
优选地,所述芳香环还被选自下组的取代基取代:卤素、氨基、羟基、甲氧基、羟甲基、硝基、羧基、磺酸基、硼酸基、硼酸酯基、c1-c10烷基、c2-c10烯基、c2-c10炔基、或其任意组合。优选地,所述芳香环为苯环。放射性元素取代的苯环的取代位置没有特别的限制,当苯环为间位取代时,y可表示为当苯环为对位取代时,y可表示为或其中,ra为本发明中所述的放射性元素。
[0118][0119]
由此,根据本发明的实施例,本发明提出一种放射性标记的糖缀合物的结构示意如结构式a所示,所述糖缀合物由放射性标记物1、放射性标记物2和糖上的羟甲基共价结合形成;
[0120]
所述放射性标记物1具有结构:
[0121]
所述放射性标记物2具有结构:
[0122][0123]
根据本发明的实施例,本发明还提出一种放射性标记的糖缀合物的结构示意如结构式b所示,所述糖缀合物由放射性标记物3和糖上的羟甲基共价结合形成;
[0124]
所述放射性标记物3具有结构:
[0125][0126]
根据本发明的实施例,本发明还提出一种放射性标记的糖缀合物的结构示意如结构式c所示,所述糖缀合物由放射性标记物4、放射性标记物5和糖上的羟甲基共价结合形成;
[0127]
所述放射性标记物4具有结构:
[0128]
所述放射性标记物5具有结构:
[0129][0130]
根据本发明的实施例,本发明还提出一种放射性标记的糖缀合物的结构示意如结
构式d所示,所述糖缀合物由放射性标记物6、放射性标记物7分别和糖上的羟甲基、半缩醛基共价结合形成;
[0131]
所述放射性标记物6具有结构:
[0132]
所述放射性标记物7具有结构:
[0133]
根据本发明的实施例,上述药物缀合物具有下列之一的结构:
[0134]
[0135]
[0136][0137]
需要说明的是,在上述采用dt表示药物的结构中,同位素标记的数目可以为1个,也可以为两个(或以上),为了描述方便,均以一个作为示例列出。
[0138]
药物组合物
[0139]
本发明还涉及一种药物组合物,可将根据本发明所述的药物缀合物优选配制成通过各种途径施用的药物组合物。所述药物组合物及其实际制备方法对于本领域技术人员来说是已知的、或者将是清晰的;而对此类药物组合物的充分讨论可参见、例如《雷明顿:药物科学与实践》(remington:the science and practice of pharmacy),第23版,a.adejare编辑,academic press出版(2020)。本专利申请说明书将其公开内容全文引入作为参考。
[0140]
根据本发明的实施例,所述药物组合物包含有效量的至少一种上述化药物缀合物和药学上可接受的载体、稀释剂和辅料。组合物可包括但不限于一种或多种缓冲剂、润湿剂、乳化剂、混悬剂、润滑剂、吸附剂、表面活性剂、防腐剂等。组合物可配制为固体、液体、凝胶或混悬液,用于口服施用(例如,灌注、推注、片剂、粉末、胶囊、口腔喷雾、乳液);十二指肠给药;肠胃外施用(例如,皮下、肌内、静脉内、硬膜外注射);局部施用(例如,乳膏、软膏、控释贴剂、喷雾);直肠内、透皮、眼部或鼻部施用。
[0141]
药物缀合物的应用
[0142]
在本发明的第三方面,本发明提出了前面所描述的药物缀合物或药物组合物在对活性药物分子进行活性研究中的用途,可选的,所述活性研究包括下列的至少之一:
[0143]
所述活性研究包括下列的至少之一:
[0144]
所述活性药物分子的在生物体内的分布、代谢或降解;和/或
[0145]
所述活性药物分子在生物体内的吸收、分布、代谢和排泄;和/或
[0146]
所述活性药物分子的离体血液、体液中的代谢、离体组织分布;和/或
[0147]
所述活性药物分子的活体内无创显像。
[0148]
在本发明的第四方面,本发明提出了一种对活性药物分子在哺乳动物活体中进行无创性体内检测的方法,包括:
[0149]
对哺乳动物施用可检测量的第一方面所述的药物缀合物、或第二方面所述药物组合物;
[0150]
基于所述药物缀合物或药物组合物所释放的放射性辐射进行所述检测,
[0151]
所述检测方法包括但不限于实施正电子发射断层扫描(pet)显像、单光子发射计算机断层扫描(spect)、核磁共振显像或放射自显影。
[0152]
根据本发明的实施例,通过静脉注射或十二指肠给药方式进行所述给药。
[0153]
根据本发明的实施例,所述哺乳动物包括选自小鼠、大鼠、犬、猴、兔、猪的至少之一。
[0154]
根据本发明的实施例,在进行所述给药之前,预先包括:
[0155]
对活性药物分子进行修饰,以便使所述活性药物分子携带第一连接基团,可选的,所述第一连接基团含有选自氨基、羧基、羟基、羟甲基、半缩醛基的至少之一;和
[0156]
使经过修饰的所述药物分子与具有下式的化合物反应,以便获得所述药物缀合物:
[0157]
lg-nu,
[0158]
其中,lg和nu是如前面所限定的。
[0159]
由此,针对不含适当反应基团的药物,也可以形成药物缀合物进行相应的分析,此时,可以考虑在药物分子与第一连接基团之间设置长度为大约5~10个碳原子的直链烷基
连接臂,以避免对药物分子活性的显著影响。
[0160]
根据本发明的实施例,本发明可以实现采用常规正电子/单光子同位素标记药物活性分子尤其是多糖类药物分子,弥补了目前多糖物质(尤其是中药多糖类药物、氧化纤维素类医疗器械)在传统技术下,较难进行代谢、组织分布、靶向性等研究的问题。根据本发明的实施例,采用
89
zr(78.4h)、
124
i(100h)等同位素标记多糖可实现更长时间(1个月) 的多糖代谢检测,且可以进行高定量精度的pet活体显像;此外根据本发明的实施例,采用
125
i同位素,可实现12个月的多糖代谢检测,也可进行spect活体显像。另外,根据本发明的实施例,采用本发明的缀合物可以用于离体血药代、组织分布研究,也可进行活性显像研究,获得其代谢生物半衰期、代谢途径、组织分布等数据,进行相关机理研究,充实新药及医疗器械申报数据。由此,采用根据本发明实施例所述的方法可为新药/医疗器械开发过程中的早期机理机制研究、中期注册申报及临床用药提供大量可靠数据。
[0161]
放射性标记的糖缀合物的制备方法
[0162]
根据本发明的实施例,本发明还提供了一种放射性标记的糖缀合物的制备方法,参考
[0163]
图1,所述方法包括步骤:
[0164]
(a)放射性同位素标记标记物前体得到所述放射性标记物;(b)通过糖和所述放射性标记物得到所述放射性标记的糖缀合物;或
[0165]
(b)通过糖与标记物前体制备糖缀合物前体;(d)标记所述糖缀合物前体得到所述放射性标记的糖缀合物。
[0166]
根据本发明的实施例,所述步骤a)还包括:在预先涂布氧化剂的反应管中,加入缓冲液、标记物前体、放射性碘原料,得到所述放射性标记物。所述氧化剂涂布于所述碘标管管底,所述氧化剂选自下组:1,3,4,6-四氯-3α,6α-二苯基甘脲、iodogen、氯胺-t、乳过氧化物酶。
[0167]
根据本发明的实施例,所述氧化剂与标记物前体的当量比没有特别的限制,优选为1-10:2-1000,更优选为1-10:2-500、1-10:2-400、1-10:2-300、1-10:2-200、1-10:2-100。
[0168]
根据本发明的实施例,所述缓冲液的ph优选为6-8。
[0169]
根据本发明的实施例,优选的所述步骤a)的反应温度为0-80摄氏度,更优选为0-50 摄氏度。
[0170]
根据本发明的实施例,所述放射性碘原料没有特别的限制,优选地包括na
125
i、na
131
i、 na
123
i、na
124
i,或其任意组合。
[0171]
根据本发明的实施例,所述步骤b)还包括:所述糖和放射性标记物在惰性溶剂中反应,调节ph为8-10,纯化,得到所述糖缀合物。优选地,所述放射性标记物具有结构:该n为0~5的整数。
[0172]
根据本发明的实施例,所述步骤b)还包括:在-15-30℃的条件下,向放射性标记物的惰性溶液中滴加草酰氯或二氯亚砜,加入糖,反应得到所述糖缀合物。优选地,所述放射
性标记物具有结构:该n为0~5的整数。优选地,步骤b)在-5-10℃的条件下反应。
[0173]
根据本发明的实施例,所述步骤b)还包括:在20-60℃条件下,所述放射性标记物、糖在ph=8-10的水溶液中溶解,加入还原剂,得到所述糖缀合物。优选地,所述醋酸钠为 5%的醋酸钠溶液。优选地,所述还原剂包括:氰基硼氢化钠、硼氢化钠或氢化铝锂。
[0174]
根据本发明的实施例,所述步骤b)还包括:将多糖氧化得到氧化多糖,反应溶媒,加入活化剂,室温反应,调节ph为8-10,与所述放射性标记物反应,得到所述糖缀合物。优选的活化剂包括:edc、nhs、hatu、hbtu、tstu或cdi。优选的反应溶媒包括: mes缓冲液、pbs缓冲液、dmf或二氯甲烷。所述放射性标记物具有结构:该n为0~5的整数。
[0175]
根据本发明的实施例,所述步骤c)还包括步骤:糖和标记物前体在惰性溶剂中,调节 ph为8-10,反应,纯化,得到所述糖缀合物前体。优选地,所述标记物前体具有结构:
[0176]
根据本发明的实施例,所述步骤c)还包括:在-15-30℃的条件下,向标记物前体的惰性溶液中滴加草酰氯或二氯亚砜,加入糖,反应得到所述糖缀合物前体,其中所述标记物前体具有结构:该n为0~5的整数。优选地步骤c)在-5-10℃的条件下反应。
[0177]
根据本发明的实施例,所述步骤c)还包括:在20-60℃条件下,所述标记物前体、糖在醋酸钠、hepes、mes)中溶解,加入还原剂,得到所述糖缀合物前体。优选地,所述醋酸钠为5%的醋酸钠溶液。优选地,所述还原剂包括:氰基硼氢化钠、硼氢化钠、氢化铝锂。
[0178]
根据本发明的实施例,所述步骤c)还包括:将多糖氧化得到氧化多糖,反应溶媒,加入活化剂,室温反应,调节ph为8-10,与所述标记物前体反应,得到所述糖缀合物前体。优选的活化剂包括:edc、nhs、hatu、hbtu、tstu或cdi。优选的反应溶媒包括: mes缓冲液、pbs缓冲液、dmf或二氯甲烷,所述标记物前体具有结构:该n为0~5的整数。
[0179]
根据本发明的实施例,所述步骤c)反应温度为0-100℃,优选为25-80℃。所述步骤c) 反应时间为1-72h。
[0180]
根据本发明的实施例,所述步骤d)还包括:在预先涂布氧化剂的反应管中,加入缓冲液、糖缀合物前体、放射性碘原料,得到所述放射性标记物。
[0181]
根据本发明的实施例,所述氧化剂涂布于所述碘标管管底,所述氧化剂选自下组: 1,3,4,6-四氯-3α,6α-二苯基甘脲、iodogen、氯胺-t、乳过氧化物酶。
[0182]
根据本发明的实施例,所述氧化剂与标记物前体的当量比为1-10:2-1000,优选地
为 1-10:2-500、1-10:2-400、1-10:2-300、1-10:2-200、1-10:2-100。
[0183]
根据本发明的实施例,所述缓冲液的ph为6-8。
[0184]
根据本发明的实施例,所述步骤d)的反应温度为-10-100摄氏度,优选为0-80摄氏度。
[0185]
根据本发明的实施例,所述放射性碘原料没有特别的限制,优选的包括:na
125
i、na
131
i、 na
123
i、na
124
i,或其任意组合。
[0186]
为了方便理解,下面对可以适用于本发明技术方案的前体结构进行描述:
[0187]
糖缀合物前体
[0188]
根据本发明的实施例,可以采用的糖缀合物前体含有以下任一结构:
[0189][0190]
其中,
[0191]
s表示糖;
[0192]
n表示0-10的整数,优选为0-5的整数;
[0193]
w表示r1或r1取代的c5-10芳香环,所述r1选自下组的取代基:叠氮、炔基/三烷基锡基或
[0194]
在优选的实施方案中,所述芳香环还被选自下组的取代基取代:卤素、氨基、羟基、甲氧基、羟甲基、硝基、羧基、磺酸基、硼酸基、硼酸酯基、c1-c10烷基、c2-c10烯基、 c2-c10炔基、或其任意组合。优选地,所述芳香环为苯环。
[0195]
当所述苯环为间位取代时,w可表示为
[0196]
当所述苯环为对位取代时,w可表示为或
[0197]
所述三烷基锡基没有特别的限制,优选地,包括:三甲基锡基、三乙基锡基、三丙基锡基、三丁基锡基、三戊基锡基、三己基锡基、三庚基锡基、三辛基锡基、三壬基锡基、三葵基锡基。
[0198][0199]
一种糖缀合物前体的结构示意如结构式e所示,所述糖缀合物前体由标记物前体1、标记物前体2、标记物前体3和糖上的羟甲基共价结合形成;
[0200]
所述标记物前体1具有结构:
[0201]
所述标记物前体2具有结构:
[0202]
所述标记物前体3具有结构:
[0203][0204]
一种糖缀合物前体的结构示意如结构式f所示,所述糖缀合物前体由标记物前体4 和糖上的羟甲基共价结合形成;所述标记物前体4具有结构:和糖上的羟甲基共价结合形成;所述标记物前体4具有结构:
[0205]
一种糖缀合物前体的结构示意如结构式g所示,所述糖缀合物前体由标记物前体5 和糖上的羟甲基共价结合、标记物前体6和糖上的半缩醛基共价结合形成;
[0206]
所述标记物前体5具有结构:
[0207]
所述标记物前体6具有结构:
[0208]
放射性标记物及其前体
[0209]
本发明提供了一种放射性标记物,所述放射性标记物具有结构:
[0210]r2-(ch2)
n-y;其中
[0211]
n表示0-10的整数,优选为0-5的整数;r2表示羧基、酰氯或氨基;
[0212]
y的定义如本发明中所述。
[0213]
优选地,所述放射性标记物具有结构:
[0214]
优选地,所述放射性标记物具有结构:
[0215]
优选地,所述放射性标记物具有结构:
[0216]
本发明还提供了另一种放射性标记物,所述放射性标记物具有结构:
[0217]
上述放射性标记物结构中ra表示本发明所述的放射性元素。
[0218]
本发明还提供了上述放射性标记物的标记物前体,通过标记所述标记物前体可以得到放射性标记物。所述标记物前体具有结构:
[0219]r2-(ch2)
n-w;其中
[0220]
n表示0-10的整数,优选为0-5的整数;
[0221]
r2表示羧基、酰氯或氨基;
[0222]
w的定义如本说明书中所述。
[0223]
优选地,所述标记物前体具有结构:
[0224]
优选地,所述标记物前体具有结构:
[0225]
优选地,所述标记物前体具有结构:
[0226]
优选地,所述标记物前体具有结构:
[0227]
以下结合具体实施例,进一步说明本发明。需理解,以下的描述仅为本发明的最优选实施方式,而不应当被认为是对于本发明保护范围的限制。在充分理解本发明的基础上,下列实施例中未注明具体条件的实验方法,通常按照常规条件,本领域技术人员可以对本发明的技术方案做出非本质的改动,这样的改动应当被视为包括于本发明的保护范围之中的。
[0228]
实施例1标记物前体2-(3-(三甲基甲锡烷基)苯基)乙酸 (2-(3-(trimethylstannyl)phenyl)acetic acid)的制备
[0229][0230]
在反应器中加入3-碘苯乙酸(1eq)、双三甲基锡(5eq),四(三苯基膦)钯(0.1eq),加入甲苯作溶剂,氮气保护条件下,95℃反应4h。反应结束后除去溶剂,随后硅胶柱纯化,纯化条件为乙醇/正己烷=4/6,得到2-(3-(三甲基甲锡烷基)苯基)乙酸,最终产率69%。
[0231]
实施例2标记物前体2-(3-(三甲基甲锡烷基)苯基)乙酰氯的制备
[0232][0233]
向反应瓶中加入2-(3-(三甲基甲锡烷基)苯基)乙酸(1eq)和dmf,在冰浴条件下缓慢滴加草酰氯(1.1eq),反应2h。反应结束后加入水和二氯甲烷萃取,得到2-(3-(三甲基甲锡烷基)苯基)乙酰氯。
[0234]
实施例3标记物前体(3-(三甲基锡烷基)苯基)甲胺的制备
[0235][0236]
在反应器中加入3-碘苯乙酸(1eq)、双三甲基锡(5eq),四(三苯基膦)钯(0.1eq),加入甲苯作溶剂,氮气保护条件下,95℃反应4h。反应结束后除去溶剂,随后硅胶柱纯化,纯化条件为乙醇/正己烷=4/6,最终拿到3-(三甲基甲锡烷基)苄基氨基甲酸叔丁酯,产率69%。将3-(三甲基甲锡烷基)苄基氨基甲酸叔丁酯溶于盐酸甲醇中,搅拌2h,旋干甲醇,加入 1m nahco3溶解,再加入乙酸乙酯萃取三次,除去溶剂后硅胶柱纯化,纯化条件为乙醇/ 正己烷=4/6,得到(3-(三甲基锡烷基)苯基)甲胺,产率60%。
[0237]
实施例4放射性标记物
125
i标记2-(3-(三甲基甲锡烷基)苯基)乙酸
[0238]
取一支预制备的iodogen碘标管(预先涂布1,3,4,6-四氯-3α,6α-二苯基甘脲于管
底),先加入0.3ml 0.02m磷酸盐缓冲溶液于管中,再加入0.1mg溶于dmso中的2-(3-(三甲基甲锡烷基)苯基)乙酸溶液,反应10min后,经radio-itlc检测标记率后,用2ml灭菌注射用水稀释反应液,经c-18柱吸附后,再用无水乙醇洗脱,获得2-碘[
125
i]-苯基乙酸。
[0239]
实施例5糖缀合物前体2-(3-(三甲基甲锡烷基)苯基)乙酰氯修饰香菇多糖
[0240]
将香菇多糖(1eq)溶于干燥dmf中,在25℃,反应瓶中加入吡啶(20mmol)和酰氯 (1.1eq)并将溶液搅拌4h。反应结束后,加入二氯甲烷氯/水溶液(10eq)萃取三次。用硫酸钠干燥并过滤。在真空下除去溶剂,并将粗品纯化柱层析(乙酸乙酯/己烷4:1);分离得到2-(3-(三甲基甲锡烷基)苯基)乙酰氯修饰的香菇多糖(产率83%)。
[0241]
实施例6糖缀合物前体(3-(三甲基锡烷基)苯基)甲胺还原胺化修饰多糖
[0242]
在反应器中加入多糖(1eq)、(3-(三甲基锡烷基)苯基)甲胺、加入5%醋酸钠溶解,常温搅拌反应24h,加入氰基硼氢化钠(10eq),继续反应24h,反应结束经过pd10 柱纯化得到(3-(三甲基锡烷基)苯基)甲胺修饰的多糖。
[0243]
实施例7糖缀合物前体3-(三甲基锡烷基)苯基)甲胺修饰氧化多糖
[0244]
称取氧化香菇多糖溶于ph 5.0mes缓冲液,加入edc、nhs活化,室温反应3h。用磷酸盐缓冲液调节反应体系ph到7.2,并加入3-(三甲基锡烷基)苯基)甲胺,室温反应过夜。反应混合物过pd10柱,流动相为去离子水,旋转蒸发浓缩得到3-(三甲基锡烷基) 苯基)甲胺修饰的氧化多糖。
[0245]
实施例8放射性标记的糖缀合物
125
i标记香菇多糖
[0246]
向反应瓶中加入2-碘[
125
i]-苯基乙酸(1eq)和dmf,在冰浴条件下缓慢滴加草酰氯(1.1 eq),反应2h,反应结束后加入多糖,继续反应2h,结束后经过pd10柱纯化,得到
125
i 标记多糖。
[0247]
实施例9放射性标记的糖缀合物
125
i标记修饰氧化多糖
[0248]
取一支预制备的iodogen碘标管(预先涂布1,3,4,6-四氯-3α,6α-二苯基甘脲于管底),先加入0.3ml 0.02m磷酸盐缓冲溶液与管中,再加入0.1mg溶于水中的修饰多糖(氧化多糖)溶液,反应10min后,经radio-itlc检测标记率后,经pd10柱纯化获得
125
i标记修饰氧化多糖。
[0249]
实施例10马来酰亚胺-dfo法制备
89
zr标记携带羟基的多糖药物
[0250]
按照下列合成路线进行合成
[0251][0252]
称取携带羟基的多糖溶于pbs(ph=7.4)中,加入马来酰亚胺-dfo,50℃震荡反应2h,反应结束后醇沉纯化,固体溶于生理盐水中获得dfo-多糖溶液,取
89
zr草酸溶液加入到一个5-ml ep管,加入hepes、na2co3溶液调节溶液ph至6.8-7.2,加入dfo-多糖室温下反应60min。经pd10柱纯化获得
89
zr标记修饰多糖(产率80%)。
[0253]
实施例11 ncs-dfo法制备
89
zr标记携带羟基的多糖药物
[0254]
按照下列合成路线进行合成
[0255][0256]
称取携带羟基的多糖于5ml ep管中,取dmso、吡啶、催化剂、ncs-dfo于ep管中,95℃震荡反应2h,反应结束后醇沉纯化,固体溶于生理盐水中获得dfo-多糖溶液,取
89
zr草酸溶液加入到一个5-ml ep管,加入hepes、na2co3溶液调节溶液ph至6.8-7.2,加入dfo-多糖室温下反应60min。经pd10柱纯化获得
89
zr标记修饰多糖(产率80%)。
[0257]
实施例12 dfo标记羧基法制备
89
zr标记携带羟基的多糖药物
[0258]
按照下列合成路线进行合成
[0259][0260]
称取氧化多糖溶于ph 5.0mes缓冲液,加入edc、nhs活化,室温反应3h。用磷酸盐缓冲液调节反应体系ph到7.2,并加入dfo-nh2,室温反应过夜。反应混合物过pd10 柱,流动相为去离子水,旋转蒸发浓缩得到dfo修饰的氧化多糖。取
89
zr草酸溶液加入到一个5-ml ep管,加入hepes、na2co3溶液调节溶液ph至6.8-7.2,加入dfo-多糖,室温下反应60min。经pd10柱纯化获得
89
zr标记修饰多糖(产率70%)。
[0261]
实施例13 dfo标记半缩醛基制备
89
zr标记携带羟基的多糖药物
[0262]
按照下列合成路线进行合成
[0263][0264]
在反应器中加入多糖(1eq)、dfo-nh2、加入5%醋酸钠溶解,常温搅拌反应24h,加入氰基硼氢化钠(10eq),继续反应24h,反应结束经过pd10柱纯化得到dfo修饰的多糖。取89zr草酸溶液加入到一个5-ml ep管,加入hepes、na2co3溶液调节溶液ph至 6.8-7.2,加入dfo-多糖室温下反应60min。经pd10柱纯化获得89zr标记修饰多糖(产率 50%)。
[0265]
实施例14三正丁基锡-ncs法制备
125
i标记修饰携带羟基的多糖
[0266]
按照下列合成路线进行合成
[0267][0268]
称取多糖于5ml ep管中,用移液器移取dmso、吡啶、催化剂、三丁基(3-异硫氰酸苯基)锡烷于ep管中,95℃震荡反应2h,反应结束后醇沉纯化,固体溶于pbs(ph=7.4) 中备用,取一支预制备的iodogen碘标管(预先涂布1,3,4,6-四氯-3α,6α-二苯基甘脲于管底),先加入0.3ml 0.02m磷酸盐缓冲溶液与管中,再加入0.1mg溶于水中的修饰多糖溶液,反应10min后,经radio-itlc检测标记率后,经pd10柱纯化获得
125
i标记修饰多糖 (产率60%)。
[0269]
实施例15三正丁基锡-马来酰亚胺法制备
125
i标记修饰携带羟基的多糖
[0270]
按照下列合成路线进行合成
[0271][0272]
称取多糖溶于pbs(ph=7.4)中,加入马来酰亚胺-三正丁基锡,50℃震荡反应2h,反应结束后醇沉纯化,固体溶于pbs(ph=7.4)中备用,取一支预制备的iodogen碘标管(预先涂布1,3,4,6-四氯-3α,6α-二苯基甘脲于管底),先加入0.3ml 0.02m磷酸盐缓冲溶液与
125
i于管中,再加入0.1mg溶于水中的修饰多糖溶液,反应10min后,经radio-itlc检测标记率后,经pd10柱纯化获得
125
i标记修饰多糖(产率80%)。
[0273]
实施例16酪胺标记羧基法制备
125
i标记修饰携带羧基的多糖
[0274]
按照下列合成路线进行合成
[0275][0276]
称取氧化多糖溶于ph 5.0mes缓冲液,加入edc、nhs活化,室温反应3h。用磷酸盐缓冲液调节反应体系ph到7.2,并加入酪胺,室温反应过夜。反应混合物过pd10柱,流动相为去离子水,旋转蒸发浓缩得到酪胺修饰的氧化多糖。取一支预制备的iodogen碘标管(预先涂布1,3,4,6-四氯-3α,6α-二苯基甘脲于管底),先加入0.3ml 0.02m磷酸盐缓冲溶液与
125
i于管中,再加入0.1mg溶于水中的修饰多糖(氧化多糖)溶液,反应10min 后,经radio-itlc检测标记率后,经pd10柱纯化获得
125
i标记修饰氧化多糖(产率70%)。
[0277]
实施例17酪胺标记半缩醛基制备
125
i标记修饰携带半缩醛基的多糖
[0278]
按照下列合成路线进行合成
[0279][0280]
在反应器中加入多糖(1eq)、酪胺、加入5%醋酸钠溶解,常温搅拌反应24h,加入氰基硼氢化钠(10eq),继续反应24h,反应结束经过pd10柱纯化得到酪胺修饰的多糖。取一支预制备的iodogen碘标管(预先涂布1,3,4,6-四氯-3α,6α-二苯基甘脲于管底),先加入0.3ml 0.02m磷酸盐缓冲溶液与
125
i于管中,再加入0.1mg溶于水中的修饰多糖(氧化多糖)溶液,反应10min后,经radio-itlc检测标记率后,经pd10柱纯化获得
125
i标记修饰氧化多糖(产率50%)。
[0281]
实施例18
89
zr标记肝素类似物及其pet影像实验
[0282]
按照实施例10所述合成路线,以马来酰亚胺-dfo法合成制备
89
zr标记软骨类似物(重均分子量约为11000-12000da),反应产物经pd10柱纯化获得
89
zr标记软骨类似物(产率70-80%),经hplc检测,其放射性化学纯度为》99%,并且在2~8℃条件下放置5h 后,其放射性化学纯度仍为》92%(故其体外稳定性符合动物试验要求)。其生物活性经检测也满足
试验要求。
[0283]
取适量
89
zr标记软骨类似物与未标记的软骨类似物混合,对异氟烷麻醉下的4t1荷瘤鼠(n=6,均为雌性)按约200μci/只的放射剂量(和约100mg/kg的总给药量),经静脉注射及十二指肠给药,并于给药后0h、1h、2h、4h、6h、24h进行pet扫描,典型所得影像结果(pet/ct融合)见图3。
[0284]
实施例19
89
zr标记软骨类似物a、b及其pet影像实验
[0285]
按照实施例10所述合成路线,以马来酰亚胺-dfo法合成制备
89
zr标记软骨类似物a (重均分子量约为6000da),反应产物经pd10柱纯化获得
89
zr标记软骨类似物(产率 70-80%),经hplc检测,所得产物的放射性化学纯度为》86%,并且其生物活性经检测也满足试验要求。
[0286]
另,按照实施例10所述合成路线,以马来酰亚胺-dfo法合成制备
89
zr标记软骨类似物b(重均分子量约为30000da),反应产物经pd10柱纯化获得
89
zr标记软骨类似物(产率70-80%),经hplc检测,所得产物的放射性化学纯度为》85%,其生物活性经检测也满足试验要求。
[0287]
取适量
89
zr标记软骨类似物a、b分别与相应未标记的软骨类似物a、b混合,所得二混合物各对雄性sd大鼠按约100μci/只的放射剂量(和约100mg/kg的总给药量),经皮下注摄给药,并于给药后0.5h、1h、2h、4h、6h、24h进行pet扫描,所得影像结果(pet/ct 融合)见图2。
[0288]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
[0289]
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1