MDM2抑制剂在调控结肠癌化疗药物敏感性中的应用
本发明涉及生物医药
技术领域:
,具体涉及mdm2抑制剂与结肠癌化疗药物联合使用,用于增加结肠癌化疗敏感性。
背景技术:
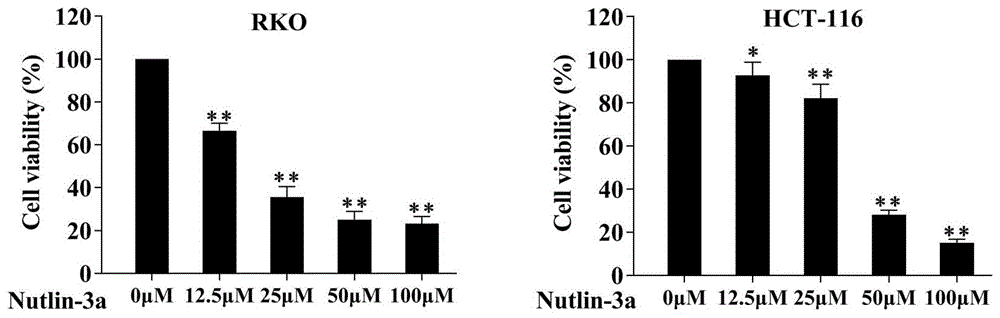
:结直肠癌(colorectalcancer,crc)是一种常见的胃肠道恶性肿瘤,是造成人类癌症相关死亡的第二大原因。目前对于结直肠癌的治疗仍以手术结合放化疗的方案为主,其中辅助化疗的敏感性是影响患者生存期的主要因素之一。研究显示,大多数患者在各种辅助化疗后3-12个月就会出现药物敏感性低、化疗耐受等现象。因此迫切需要寻找和补充新的更有效的克服耐药策略,从而实现更好的治疗效果。mdm2(murinedoubleminute2,鼠双微体基因2)mdm2是一种e3泛素连接酶,通过与靶蛋白结合对其进行泛素化修饰介导蛋白质的降解,从而参与多种细胞生物学行为的调控。当细胞中mdm2高表达时,p53活性受到强烈抑制,导致p53无法发挥作用,造成细胞持续增殖从而诱导肿瘤的发生。对此,人们研发了多种mdm2抑制剂,其中nutlin-3a是研究最为深入和广泛的一个靶向mdm2-p53相互作用的小分子抑制剂。5-氟脲嘧啶(5-fluorouracil,5-fu)作为胃肠道恶性肿瘤的一线治疗药物,单药或联合用药在结直肠癌的临床治疗中取得良好效果。然而,5-fu治疗的临床获益往往是短暂的,使用5-fu的患者易对其产生耐药性而使得总体有效率较低,大大降低化疗效果。肿瘤坏死因子相关凋亡诱导配体(tumornecrosisfactorrelatedapoptosisinducingligand,trail)能够选择性地诱导肿瘤细胞凋亡而对正常细胞无毒性作用,具有极大的临床应用前景。然而,相当多的肿瘤细胞对trail具耐药阻碍了trail的应用。技术实现要素:本发明的目的是提供临床治疗结肠癌的新的用药趋势。发明人在临床实践中,发现mdm2抑制剂可改善结肠癌化疗药物的敏感性。在同等浓度下,将mdm2抑制剂与结肠癌化疗药物(5-fu及trail)联合使用,可增强化疗药物对肿瘤细胞的抑制能力。第一方面,本发明提供mdm2抑制剂在调控结肠癌对化疗药物敏感性中的应用。第二方面,本发明提供mdm2抑制剂在制备提高结肠癌对化疗药物敏感性药物中的应用。所述mdm2抑制剂可用于制备提高结肠癌对trail敏感性的药物;所述mdm2抑制剂用于制备提高结肠癌对5-氟脲嘧啶敏感性的药物。在本发明所提供的应用中,nutlin-3a通过诱导内质网应激从而增加结肠癌化疗敏感性,或nutlin-3a通过诱导自噬增加结肠癌化疗敏感性。第三方面,本发明提供一种组合物在制备治疗结肠癌药物中的应用,所述组合物包含mdm2抑制剂、5-氟脲嘧啶和/或肿瘤坏死因子相关凋亡诱导配体(trail);在本发明所提供的药物组合物中,所述mdm2抑制剂为nutlin-3a。本发明提供的组合物,可抑制结肠癌细胞的生长、增殖或克隆;也可诱导结肠癌细胞的凋亡。本发明提供的组合物,可抑制人结肠癌细胞rko或人结肠癌细胞hct116的生长、增殖或克隆;或抑制裸鼠结肠癌皮下实体瘤的生长。第四方面,本发明还提供上述应用在制备提高结肠癌治疗效果的药物中的应用。具体地,为了制备提高结肠癌治疗效果的药物,将mdm2抑制剂与5-氟脲嘧啶或肿瘤坏死因子相关凋亡诱导配体联合使用。本发明的有益效果至少在于:(1)本发明通过实验证明,将nutlin-3a和5-fu联合使用,可以显著增强5-fu的治疗效果;将nutlin-3a和trail联合使用,可以显著增强trail的治疗效果,联合使用后显著抑制结肠癌细胞的生长、增殖,诱导结肠癌细胞的凋亡;(2)本发明通过体外实验证实,将nutlin-3a和5-fu联合使用或nutlin-3a和trail联合使用增强了裸鼠皮下瘤模型中的抗肿瘤效果,实现了协同增效的作用;(3)本发明提供的nutlin-3a和5-fu联用以及nutlin-3a和trail联合用药治疗结肠癌的新方案,为结肠癌的治疗提供了一种新的治疗药物和治疗途径,解决了临床治疗中结直肠癌患者经常发生化疗敏感性差的问题,还为mdm2抑制剂nutlin-3a的应用提供了新的领域。附图说明图1为实施例1中不同浓度nutlin-3a处理下的人结肠癌细胞存活率图。图2为实施例1中不同浓度nutlin-3a处理下的人结肠癌细胞克隆形成图。图3为实施例1中不同浓度nutlin-3a处理下的人结肠癌细胞凋亡情况图。图4为实施例1中不同浓度nutlin-3a处理人结肠癌细胞后的凋亡相关蛋白cleaved-caspase-3的westernblotting结果图。图5为实施例2中应用compusyn软件分析得到的rko细胞各联合实验组的联合指数ci图。图6为实施例2中应用compusyn软件分析得到的hct116细胞各联合实验组的联合指数ci图。图7为实施例2中nutlin-3a单独用药或联合5-fu或联合trail处理时,人结肠癌rko细胞中凋亡相关蛋白cleavedcaspase-3的westernblotting结果图。图8为实施例2中nutlin-3a单独用药或联合5-fu或联合trail处理时,人结肠癌hct116细胞中凋亡相关蛋白cleavedcaspase-3的westernblotting结果图。图9为实施例2中mdm2抑制剂nutlin-3a单独用药或联合5-fu或联合trail处理下的结肠癌细胞rko细胞凋亡情况图。图10为实施例2中mdm2抑制剂nutlin-3a单独用药或联合5-fu或联合trail处理下的结肠癌细胞hct116细胞凋亡情况图。图11为实施例3中nutlin-3a单独用药或分别与5-fu、trail联合用药处理下,结肠癌细胞增殖情况图。图12为实施例3中nutlin-3a单独用药或分别与5-fu、trail联合用药处理下,结肠癌细胞成瘤图。图13为实施例3中nutlin-3a单独用药或分别与5-fu、trail联合用药处理下裸鼠皮下结肠癌模型实体瘤tunel检测凋亡情况图,图示标尺为100μm。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。下面结合具体实施例对本申请作出详细说明。本发明使用针对于mdm2的小分子抑制剂nutlin-3a以及化疗药物5-fu以及trail,以下所述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径获得,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。本发明具体实施例中主要说明nutlin-3a能够增强结肠癌细胞对化疗药物5-fu以及trail的敏感性,为临床癌症治疗提供新型的药物联合使用的范例。本发明进行实验所要用到的材料与试剂:细胞来源:人源结肠癌细胞hct116细胞和rko细胞购自美国americantypeculturecollection(atcc)公司。本研究中用到的细胞有人结肠癌hct1160细胞和rko细胞,两种细胞用dmem培养基培养。细胞培养基购买于gibco公司,用于培养细胞前加入10%胎牛血清和1%的青霉素与链霉素。本研究用到的抗体详细信息见表1。表1抗体信息表抗体名称抗体厂家抗体货号tublinsigmat8203cleavedcaspase3cellsignaling9661scleavedcaspase8cellsignaling9496santi-rabbitabmsh026anti-mouseabmsh024药物来源:mdm2抑制剂nutlin-3a购自sigma公司;5-fu和trail均购自mce公司。mdm2抑制剂nutlin-3a粉末用dmso配成10mm初浓度,从mce公司购买的5-fu粉末用dmso配成10mm初浓度,trail粉末用dmso配成1mm初浓度。使用时加到培养基中的nutlin-3a浓度范围为12.5-100μm,联合用药时,其中nutlin-3a固定使用浓度为45um,5-fu固定使用浓度为50ug/ml,trail固定使用浓度为100ng/ml。实施例1mdm2抑制剂nutlin-3a对结肠癌细胞存活、增殖和凋亡的影响1、mdm2抑制剂nutlin-3a对结肠癌细胞存活率的影响选取人的结肠癌细胞hct-116和人结肠癌细胞rko,用含有10%fbs和1%双抗的dmem培养基,常规培养于37℃、5%co2的湿润培养箱中。待细胞长势良好时,将细胞消化后以1.2×104个细胞/每孔接种于96孔板中,每种细胞设6个副孔,共设置5组,待细胞完全贴壁后,用dmem培养基稀释nutlin-3a至浓度为12.5μm、25μm、50μm、100μm;每孔100μl,加入相应的96孔板中,对照组加100μldmem培养基;连续观察20h小时,每孔加入10μlcck8,将96孔板避光放于孵箱中孵育2h后,用酶标仪测定450nm的吸光值,并根据公式计算细胞存活率。细胞存活率(cellviabilityrate)=a用药组/a对照组×100%。结果如图1所示,结肠癌细胞rko和hct116经过不同浓度mdm2抑制剂nutlin-3a后,细胞存活率明显下降。nutlin-3a浓度为12.5μm时,人结肠癌细胞rko的存活率平均值为66.51%;nutlin-3a浓度为25μm时,人结肠癌细胞rko的存活率平均值为35.55%;nutlin-3a浓度为50μm时,人结肠癌细胞rko的存活率平均值为24.97%;nutlin-3a浓度为100μm时,人结肠癌细胞rko的存活率平均值为23.28%。nutlin-3a浓度为12.5μm时,人结肠癌细胞hct-116的存活率平均值为92.77%;nutlin-3a浓度为25μm时,人结肠癌细胞hct-116的存活率平均值为82.16%;nutlin-3a浓度为50μm时,人结肠癌细胞hct-116的存活率平均值为28.08%;nutlin-3a浓度为100μm时,人结肠癌细胞hct-116的存活率平均值为15.09%。表明mdm2抑制剂nutlin-3a能够有效降低结肠癌细胞的存活率并且呈浓度依赖性。2、mdm2抑制剂nutlin-3a对结肠癌细胞增殖的影响将处于对数生长期的结直肠癌细胞rko、hct-116弃去培养瓶中培养液,加入1ml0.25%胰蛋白酶消化细胞1~2分钟,制成细胞悬液,取每孔500个细胞均匀铺到六孔板中,待细胞完全贴壁后,更换含不同浓度nutlin-3a的培养基,继续在37℃培养箱中孵育细胞,孔板中出现肉眼可见克隆时终止培养,吸去培养基,用pbs小心清洗,4%的组织固定液固定细胞20分钟,弃去固定液,用结晶紫染色20分钟,pbs清洗,在空气中风干后拍照。结果如图2所示,结肠癌细胞rko和hct116经过不同浓度mdm2抑制剂nutlin-3a后,克隆形成数目明显下降,表明mdm2抑制剂nutlin-3a可以显著抑制结肠癌细胞rko和hct116克隆形成能力,抑制其增殖能力。3、mdm2抑制剂nutlin-3a对结肠癌细胞凋亡的影响将对数生长期的rko和hct116细胞用胰酶消化后,取5×105细胞均匀铺到六孔板中,待细胞贴壁后,更换成含有0μm、35μm、50um、75umnutlin-3a的培养基孵育结肠癌细胞;孵育20小时以后消化细胞,根据凋亡检测试剂盒的方法处理细胞,annexinv和pi染色完成以后,在1小时以内通过利用流式细胞仪分析各组处于正常存活、早期凋亡及晚期凋亡的细胞比例;q1-lr代表早期凋亡,q1-ur代表晚期凋亡和坏死细胞,q1-ul代表损伤细胞数,q1-ll代表正常活细胞数。图3结果显示,对照组人结肠癌细胞rko凋亡率为1.98%;nutlin-3a浓度为35μm时,人结肠癌细胞rko的凋亡率为3.73%;nutlin-3a浓度为50μm时,人结肠癌细胞rko的凋亡率为4.6%;nutlin-3a浓度为75μm时,人结肠癌细胞rko的凋亡率为14.43%;对照组人结肠癌细胞hct116凋亡率为2.48%;nutlin-3a浓度为35μm时,人结肠癌细胞hct116的凋亡率为3.13%;nutlin-3a浓度为50μm时,人结肠癌细胞hct116的凋亡率为8.72%;nutlin-3a浓度为75μm时,人结肠癌细胞hct116的凋亡率为11.13%。nutlin-3a处理组凋亡率高于对照组,并呈现剂量的依懒性。取对数生长期的结肠癌细胞,常规胰酶消化细胞,消化后均匀接种到6cm的皿里,等到细胞完全贴壁后,换新鲜培养基并加药,nutlin-3a浓度设置为:0μm、35μm、50μm、75μm;在显微镜下观察细胞形态,约20小时后,观察到最大加药浓度细胞大概有50%细胞皱缩、漂浮时,收集细胞,加入适量的裂解液使沉淀充分裂解,离心后取上清。按照说明书上的方法用bca法测量蛋白浓度,根据蛋白浓度计算出上样体积,剩余蛋白样品加入适量5×的蛋白上样缓冲液,使5×的蛋白上样缓冲液在蛋白中稀释成1×,混匀,置于金属浴中,100℃加热10min变性,根据标准方法进行免疫印迹分析,相关抗体见抗体信息表。结果如图4所示,nutlin-3a浓度为0μm、35um、50um、75um时,人结肠癌细胞rko凋亡相关蛋白cleavedcaspase-3灰度值与tublin灰度比值分别为:0.20、0.51、0.75、0.95。人结肠癌细胞hct116凋亡相关蛋白cleavedcaspase-3灰度值与tublin灰度比值分别为:0.06、0.13、0.57、1.52。随着药物浓度的增加,nutlin-3a诱导结肠癌细胞rko和hct116凋亡相关蛋白cleavedcaspase-3表达逐渐增强。实施例2mdm2抑制剂nutlin-3a分别与5-fu、trail联合用药对结肠癌细胞存活、增殖和凋亡的影响常规培养结肠癌细胞rko、hct116,消化后并将细胞以1.2×104个细胞/每孔接种于96孔板中,每种细胞设3个副孔,共设置15组,分别为对照组、5-fu组(50μg/ml)、5-fu组(60μg/ml)、trail组(80ng/ml)、trail组(100ng/ml)、nutlin-3a(45μm)、nutlin-3a(55μm)、5-fu+nutlin-3a组(5-fu(50μm),nutlin-3a(45μm))),5-fu+nutlin-3a组(5-fu(50μm),nutlin-3a(55μm))),5-fu+nutlin-3a组(5-fu(60μm),nutlin-3a(45μm))),5-fu+nutlin-3a组(5-fu(60μm),nutlin-3a(55μm))),trail+nutlin-3a组(trail(80ng/ml),nutlin-3a(45μm))),trail+nutlin-3a组(trail(80ng/ml),nutlin-3a(55μm))),trail+nutlin-3a组(trail(100ng/ml),nutlin-3a(45μm))),trail+nutlin-3a组(trail(100ng/ml),nutlin-3a(55μm))),根据不同分组应用药物作用细胞,作用20小时后,每孔加入10μlcck8,将96孔板避光放于孵箱中孵育2h后,用酶标仪测定450nm的吸光值,为了明确探索5-fu/trail与nutlin-3a联合使用是否具有协同效果,应用compusyn软件分析各联合实验组的联合指数(combinationindex,ci),结果如表2及图5所示。表2rko细胞不同药物处理组的联合指数ci图5及表2结果显示,在rko细胞中,5-fu与nutlin-3a联用,其中给药浓度5-fu50ug/ml和nutlin-3a55um时,ci<0.9,药物联合具有协同效果;trail与nutlin-3a联用,其中给药浓度trail100ng/ml和nutlin-3a55um时,ci<0.9,药物协同效率最高。因此nutlin-3a与5fu/trail联用能够协同抑制rko细胞的增殖,其中给药浓度为5-fu50ug/ml、trail100ng/ml和nutlin-3a55um。这表明在结肠癌细胞rko中nutli-3a对5-fu和trail有很强的药物增敏作用。nutlin-3a与5fu/trail联用在hct116细胞中的协同增效探究结果如图6和表3所示。表3结肠癌细胞hct116不同药物处理组的联合指数ci图6及表3结果显示,在hct116细胞中5-fu与nutlin-3a联用,大部分ci<0.9,因此5-fu与nutlin-3a联用能够协同抑制hct116细胞的存活率,其中给药浓度为5-fu60ug/ml和nutlin-3a55um时,药物协同效率最高。trail与nutlin-3a联用,其中给药浓度trail100ng/ml和nutlin-3a55um时,ci<0.9,二者具有协同作用。因此nutlin-3a与5fu/trail联用能够协同抑制hct116细胞的增殖,其中给药浓度为5-fu60ug/ml、trail100ng/ml和nutlin-3a55um。这表明在结肠癌细胞hct116中nutli-3a对5-fu和trail有很强的药物增敏作用。将rko和hct116细胞以5×106/皿均匀铺到8个6cm小皿中,共设置8组,分别为为对照组,5-fu(45μm),nutlin-3a(55μm),nutlin-3a+5-fu(nutlin-3a(45μm),5-fu(50μm));对照组,trail(100ng/ml),nutlin-3a(55μm),nutlin-3a+trail(nutlin-3a(45μm),trail(100ng/ml));根据实验分组分别加药处理细胞,待合加药组30-40%细胞皱缩、漂浮时收样提取蛋白,用westernblot的方法检测每组细胞中凋亡相关蛋白cleavedcaspase-3的表达量,以tublin作为蛋白表达量的内参。结果如图7及图8。图7结果显示,结肠癌rko中:对照组,5-fu,nutlin-3a,nutlin-3a+5-fu凋亡相关蛋白cleavedcaspase-3灰度值与tublin灰度比值分别为:0.04、0.07、0.18、1.05;对照组,trail,nutlin-3a,nutlin-3a+trail凋亡相关蛋白cleavedcaspase-3灰度值与tublin灰度比值分别为:0.05、0.03、0.35、1.08。图8结果显示结肠癌hct116中:对照组,5-fu,nutlin-3a,nutlin-3a+5-fu凋亡相关蛋白cleavedcaspase-3灰度值与tublin灰度比值分别为:0.06、0.22、0.28、1.12;对照组,trail,nutlin-3a,nutlin-3a+trail凋亡相关蛋白cleavedcaspase-3灰度值与tublin灰度比值分别为:0.09、0.33、0.16、0.77。合加药组结肠癌rko和hct116细胞的凋亡相关蛋白cleavedcaspase-3蛋白水平均比单独加药组明显要高,这提示nutlin-3a与5-fu和trail联合使用能够显著增强5-fu和trail诱导结肠癌细胞凋亡的能力。将rko和hct116细胞用胰酶消化,以4×105个/孔均匀铺到六孔板的6个孔中,待细胞完全贴壁后,按照上诉实验分组分别加相应浓度药物处理细胞,孵育16小时以后收集细胞,并按照凋亡试剂盒说明书分组进行annexinv和pi染色,在1小时以内利用流式细胞仪检测各组细胞凋亡率,结果如图9及图10所示。图9结果显示,结肠癌rko中:对照组,5-fu,trail,nutlin-3a,nutlin-3a+5-fu,nutlin-3a+trail分别处理细胞后,rko的凋亡率分别为:2.41%、10.18%、4.95%、5.9%,17.59%,17.69%。图10结果显示,结肠癌hct116中:对照组,5-fu,trail,nutlin-3a,nutlin-3a+5-fu,nutlin-3a+trail分别处理细胞后,hct116的凋亡率分别为:2.49%、5.36%、4.72%、10.85%,23.75%,18.24%。5-fu和trail联合药物组结肠癌rko和hct116细胞的凋亡相关蛋白cleavedcaspase-3蛋白水平均比单独加药组明显要高,这提示nutlin-3a与5-fu和trail联合使用,显著增强了5-fu和trail诱导细胞凋亡的效果。实施例3nutlin-3a分别与5-fu和trail联合使用在动物水平的抗肿瘤作用实施例2的体外实验证明了在细胞水平上,nutlin-3a分别与5-fu和trail联合使用对rko细胞和hct116细胞具有明显的肿瘤杀伤作用。本实施例进行动物水平的实验,具体步骤如下:大量培养hct116细胞,通过皮下注入约5周大的裸鼠体内,每只裸鼠皮下约注射1×107个细胞,注射体积为200μl。约7天左右将裸鼠随机分为5组(pbs组,5-fu组、trail组、5-fu+nutlin-3a组、trail+nutlin-3a组),分别应用相应药物治疗:pbs组:腹腔注射200ulpbs/天、5-fu组:腹腔注射5-fu(23mg/kg/天)、trail组:瘤内注射trail(1μg/天)、5-fu+nutlin-3a组:口服nutlin-3a(150mg/kg/天)同时腹腔注射5-fu(23mg/kg/天)、trail+nutlin-3a组:口服nutlin-3a(150mg/kg/天)同时瘤内注射trail(1μg/天)。每隔三天用游标卡尺测量肿瘤的长(a)和宽(b),并通过以下公式:体积v=0.5ab2计算肿瘤体积并记录。图11的结果显示随着注射药物天数的增加,pbs组的裸鼠肿瘤体积增长的最快,其次是5-fu组,再是trail组,而nutlin-3a与5-fu和trail药物联合组经过15天的测量,肿瘤体积几乎没有增长,说明药物联合处理对裸鼠体内的肿瘤具有很好的抑制作用。待药物处理15天时,我们把每组每只裸鼠的肿瘤组织切下并按组按大小排好,可以清楚的看到药物联合组对肿瘤的抑制作用非常明显(图12)。肿瘤的石蜡组织切片tunel染色显示药物联用的肿瘤组织中tunel荧光强度明显增强,凋亡率增加(图13)。这些与体外的细胞实验结果一致。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1