一种金黄色葡萄球菌疫苗的生产方法及应用与流程
1.本发明属于生物医药领域,具体涉及一种金黄色葡萄球菌疫苗的生产方法及应用。
背景技术:
2.金黄色葡萄球菌(staphylococcus aureus)是一种重要的条件致病菌。在成年群体中,大约有20%的人持续携带金葡菌,另有30%的人间歇性携带。金葡菌可引起皮肤和软组织感染,还可导致威胁生命的肺炎、菌血症及包括心内膜炎、脓毒性关节炎、骨髓炎等在内的严重并发症。金葡菌的外毒素还可以引起食物中毒、表皮松弛征和中毒性休克综合征。
3.感染金黄色葡萄球菌,通常可选用红霉素、青霉素、庆大霉素、万古霉素或先锋霉素vi治疗,但由于抗生素的滥用,出现多种耐受抗生素的新菌株,特别是耐甲氧西林菌株(methicillin-resistant s.aureus,mrsa)的迅速蔓延使得单纯依靠抗生素治疗金黄色葡萄球菌引发的相关疾病变得越来越不可靠。mrsa导致的感染用抗生素疗法很难治愈且致死率高。因此,针对金葡菌疫苗和免疫治疗的研究现已广泛开展。
4.金黄色葡萄球菌疫苗包括全菌灭活疫苗、基因工程疫苗、亚单位疫苗、dna疫苗等。现有金黄色葡萄球菌疫苗的制备方法包括:1)提取金黄色葡萄球菌的一个或多个组份作为抗原来制备,主要采用原核表达金葡菌的一种或多种抗原,并利用佐剂吸附后制成疫苗;2)提取并纯化金葡菌的荚膜多糖,并加入表达的一种或多种金葡菌抗原蛋白,或者其它外源载体蛋白以提高其免疫原性;3)表达并纯化金葡菌分泌的一种或多种外毒素作为抗原,与载体蛋白结合以增强其免疫原性;4)将金葡菌的一种或多种蛋白抗原决定簇编码序列插入质粒,构建金葡菌dna疫苗。以上列举的方法制备得到的疫苗的免疫原性均不如全菌体疫苗,未涵盖大部分毒性蛋白、保守抗原、保护性抗原、荚膜多糖等,因此存在覆盖性不够,适用范围窄等问题。而全菌体灭活疫苗可以克服这些问题,并刺激机体产生大量的免疫球蛋白。因此亟待研究一种免疫性和覆盖性提高,适用范围更广的金黄色葡萄球菌疫苗,可以补充和弥补现有技术的不足。
技术实现要素:
5.有鉴于此,本发明的目的在于提供一种工业化生产金黄色葡萄球菌疫苗的方法,以及所述疫苗的应用。
6.一种金黄色葡萄球菌疫苗的生产方法,包括以下步骤:
7.1)将金黄色葡萄球菌菌株制成种子液;
8.2)将所述种子液进行发酵;
9.3)将发酵后的菌液进行离心以收集菌体,将所述菌体用生理盐水重悬调整浓度并用射线辐照灭活;
10.4)将辐照后的菌液再用所述生理盐水调整浓度得到所述金黄色葡萄球菌疫苗。
11.进一步,步骤1)包括以下步骤:
12.a.将所述金黄色葡萄球菌菌株接种到tsa平板培养,得到一级种子;
13.b.将所述一级种子接种到tsb培养基中继续逐级扩大培养,扩大次数不少于2次,每次扩大培养时接种的菌浓度为0.01-0.1od/ml,接种的体积不超过培养体积的10%,培养的每级种子液的终浓度为0.8
±
0.2od/ml。
14.进一步,所述步骤1)的具体操作步骤为:a.将所述金黄色葡萄球菌菌株接种到tsa平板培养,得到一级种子;b.将所述一级种子接种到tsb培养基中,调整菌浓度为0.01-0.1od/ml,然后扩大培养至对数生长期,得到二级种子液;c.再将所述二级种子液接种到新鲜tsb培养基中,调整菌浓度为0.01-0.1od/ml,继续扩大培养至对数生长期,得到三级种子液。在实际操作中,可根据最终工艺放大要求调整各步放大的体积(例如,理论上从100ml到1000ml,从1000ml到10l)。从原始菌株开始计算通常放大3次(即,一级种子、二级种子、三级种子),放大次数不能太多(次数太多污染风险增大,1、2次太少延展性不够)。
15.进一步,所述金黄色葡萄球菌菌株包括atcc25923、atcc33591、scph-18或scph-25。
16.进一步,步骤2)中将所述种子液接种于含有1l-20l发酵液的发酵罐内进行发酵,接种的菌浓度为0.01-0.1od/ml。实际的发酵体积一般为发酵罐体积的1/3-1/2。作为一种优选,选择10l的发酵罐进行发酵。
17.进一步,发酵参数为:通气量3-5l/min,转速200-300rpm,温度35-39℃,在线监测ph值和溶氧值,培养菌体至对数生长期(1.5
±
0.3od/ml)。
18.进一步,步骤3)中所述离心的参数为2000-4000
×
g室温离心10-30min,离心完成后弃掉上清液收集菌体。
19.进一步,用所述生理盐水重悬收集的所述菌体,调整菌液浓度为0.5-1
×
10
10
cfu/ml。
20.进一步,所述菌液用射线辐照灭活,灭活参数为:剂量率约5-100gy/min,总剂量约1500-2500gy。
21.进一步,所述射线为x射线、γ射线或同位素放射源co
60
产生的射线。作为一种优选,所述射线为x射线。
22.进一步,步骤4)中用所述生理盐水调整辐照后的菌体使其终浓度为0.5-1
×
108/ml。
23.上述任一项所述生产方法制备得到的金黄色葡萄球菌疫苗。
24.进一步,所述疫苗为金黄色葡萄球菌全菌体疫苗。
25.进一步,所述疫苗还含有佐剂。
26.进一步,所述佐剂包括铝佐剂、mf59、as01、as04、cpg或isa51。本发明所述的金黄色葡萄球菌疫苗可以制备成不含佐剂的类型,也可以根据需要制备成添加佐剂的类型。
27.进一步,所述疫苗的剂型为皮下注射制剂、肌肉注射制剂、口服制剂或鼻腔吸入制剂。
28.进一步,同未经射线辐照的金黄色葡萄球菌相比,所述金黄色葡萄球菌疫苗的胞外核酸提高约20%;2-8℃存放4周后,与辐照完成时相比,所述金黄色葡萄球菌疫苗的胞外核酸提高5-15倍。
29.上述任一项所述的金黄色葡萄球菌疫苗在制备预防或治疗金黄色葡萄球菌引起
的菌血症药物中的应用。
30.进一步,所述金黄色葡萄球菌疫苗的免疫程序包括:皮下接种0.2ml,接种3针,每针间隔2周。
31.进一步,所述金黄色葡萄球菌疫苗含有金黄色葡萄球菌全菌体1
×
107/针-2
×
107/针。
32.上述任一项所述的金黄色葡萄球菌疫苗在制备预防或治疗金黄色葡萄球菌引起的肺炎药物中的应用。
33.进一步,所述金黄色葡萄球菌疫苗的免疫程序包括:皮下接种0.2ml,接种3针,每针间隔2周。
34.进一步,所述金黄色葡萄球菌疫苗含有金黄色葡萄球菌全菌体1
×
107/针-2
×
107/针。
35.有益效果
36.本发明提供了一种金黄色葡萄球菌全菌体疫苗的制备方法。首先通过发酵的方式扩增菌株,能在较短时间内获得大量的纯度较高的单一菌体。然后通过辐照的方式灭活,灭活效果好,同时由于保持了菌体的完整性因此不会破坏最后制成的疫苗的免疫性。本发明提供的制备方法操作便利,质量稳定可控,适用于工业化生产。
37.本发明制得的金黄色葡萄球菌全菌体疫苗经过实验验证,对由金黄色葡萄球菌引发的肺炎和菌血症均有良好的防治效果。本发明所制得的金黄色葡萄球菌疫苗采用x射线灭活的方式,该灭活方式使细菌核酸的释放增多,由此为疫苗带来了更多的免疫原性,使疫苗的效果更好。
附图说明
38.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作一简单地介绍。显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。
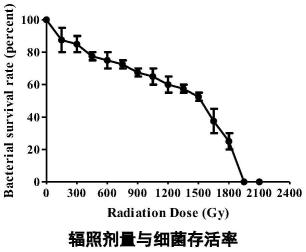
39.图1为辐照剂量与细菌存活率图;
40.图2为不同灭活方式下的核酸释放情况图;
41.图3为灭活后菌体的扫描电镜(sem)图和透射电镜(tem)图;
42.图4为金葡菌疫苗在菌血症模型中的保护力图;
43.图5为金葡菌疫苗在肺炎模型中的保护力图。
具体实施方式
44.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
45.需要说明的是,在本文中,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者装置不仅包括那些要素,而
且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者装置所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括该要素的过程、方法、物品或者装置中还存在另外的相同要素。
46.如在本说明书中使用的,术语“大约”,典型地表示为所述值的+/-5%,更典型的是所述值的+/-4%,更典型的是所述值的+/-3%,更典型的是所述值的+/-2%,甚至更典型的是所述值的+/-1%,甚至更典型的是所述值的+/-0.5%。
47.在本说明书中,某些实施方式可能以一种处于某个范围的格式公开。应该理解,这种“处于某个范围”的描述仅仅是为了方便和简洁,且不应该被解释为对所公开范围的僵化限制。因此,范围的描述应该被认为是已经具体地公开了所有可能的子范围以及在此范围内的独立数字值。例如,范围的描述应该被看作已经具体地公开了子范围如从1到3,从1到4,从1到5,从2到4,从2到6,从3到6等,以及此范围内的单独数字,例如1,2,3,4,5和6。无论该范围的广度如何,均适用以上规则。
48.实施例一
49.金黄色葡萄球菌疫苗制备方法
50.1.培养基及试剂
51.胰蛋白胨大豆肉汤(tryptic soy broth,tsb)
52.胰蛋白胨大豆琼脂(tryptic soy agar,tsa)
53.氯化钠注射液(0.9%)
54.2.疫苗制备过程
55.1)一级种子制备
56.从-80℃超低温冰箱中取出甘油菌种,划线接种于tsa平板,于37
±
1℃培养16
±
1h。在本实施例中,使用的菌种为atcc25923。
57.2)二级种子液制备
58.刮取适量菌体于10ml tsb中,用分光光度计测定菌液浓度,接种适当体积菌液至100mltsb中,终浓度约为0.05od/ml,于37
±
1℃220rpm振荡培养至0.8
±
0.2od/ml(对数生长期)。
59.3)三级种子液制备
60.取二级种子液,用分光光度计测定菌液浓度,接种适当体积菌液至1000ml tsb中,终浓度约为0.05od/ml,于37
±
1℃220rpm振荡培养至0.8
±
0.2od/ml(对数生长期)。
61.4)发酵罐培养
62.取三级种子液,用分光光度计测定菌液浓度,接种适当体积菌液至4l tsb中,终浓度约为0.05od/ml。发酵参数设置为:通气量3~5l/min,转速250
±
20rpm,温度37
±
1℃进行培养,并进行在线ph、溶氧监测,培养至1.5
±
0.3od/ml(对数生长期)。
63.5)菌体收获
64.将菌液装入离心桶,3000
×
g室温离心20min,20ml氯化钠注射液(0.9%)重悬菌体,离心洗涤1次,20ml氯化钠注射液(0.9%)重悬。
65.6)调整浓度
66.调整菌液浓度至0.5~1
×
10
10
cfu/ml。
67.7)x射线灭活
68.将菌液分装于可密封的容器中(如50ml离心管),液面高度不超过1cm,灭活参数为:剂量率约7gy/min,150gy/次,共辐照14次,间隔5~10min,总剂量2100gy。
69.8)原液
70.辐照完成后,取1/100体积菌液,涂布于tsa板,37
±
1℃培养48h,确定无菌生长。同时取1/100体积菌液按《中国药典》(通则1101)进行无菌检查。
71.9)疫苗成品
72.用氯化钠注射液(0.9%)调整疫苗菌体浓度至0.5~1
×
108/ml,即疫苗成品。成品于2~8℃保存。
73.实施例二
74.灭活剂量考察
75.在本实施例中,采用x射线对金葡菌种进行灭活。
76.方法:辐照前对制备好的菌液进行稀释涂板计数,每次辐照完成后,取样稀释涂板计数,每次取样取3份分别进行计数,计算每次辐照后细菌存活率。
[0077][0078]
结果:x射线具有独特的杀菌机制,即诱导dna损伤,对细菌进行灭活。如图1可知,金黄色葡萄球菌atcc25923采用x射线的灭活剂量为≥2.1kgy。
[0079]
实施例三
[0080]
不同灭活方式对疫苗核酸释放水平影响考察
[0081]
方法:
[0082]
1.同一批次制备一批菌液,均分为5份,按下列操作处理。
[0083]
2.活菌对照:不作任何处理,室温放置;
[0084]
3.半灭活剂量:按照x射线灭活程序进行处理,总剂量1050gy;
[0085]
4.灭活剂量:按照x射线灭活程序进行处理,总剂量2100gy;
[0086]
5.甲醛灭活:用加入甲醛溶液至终浓度为1%,37
±
1℃灭活处理24h,灭活完成后用氯化钠注射液(0.9%)进行换液洗涤3~5次;
[0087]
6.热灭活:采用121℃高压蒸汽灭菌15min;
[0088]
7.核酸释放测定:所有样品灭活处理完成后,立即取样(0week)离心,取上清,采用紫外分光光度计测定核酸浓度(a260)。2周、4周后再次进行取样测定。
[0089]
结果:如图2所示。x射线灭活后诱导了金葡菌胞外核酸水平的上升,随着时间的延长,这种核酸释放的过程仍在持续。核酸释放是x射线灭活区别于甲醛灭活和热灭活方式的重要特征之一,可能为疫苗带来更多的免疫原性,激活更多免疫信号通路,如sting、tlr9等。
[0090]
sting通路的激活,有利于促进免疫系统对细菌感染的识别,促进i型干扰素的产生(增强细胞免疫),在免疫阶段利于疫苗抗原成分的呈递和免疫系统识别,在感染阶段有利于对细菌的清除。tlr9通路是免疫系统中识别细菌cpg dna的主要受体从而诱导产生一系列促炎细胞因子和趋化因子,最终引起th1样炎症反应。细菌疫苗主要以体液免疫为主,细胞免疫较薄弱,通过细菌核酸激活的sting和tlr9通路均有利于增强th1型细胞免疫,促进免疫效果提高。
[0091]
实施例四
[0092]
x射线灭活后的菌体电镜观察
[0093]
扫描电镜样品制备方法:
[0094]
1.样品制备:按照金黄色葡萄球菌疫苗制备流程,将金黄色葡萄球菌灭活后,取原液进行扫描电镜样品制备。
[0095]
2.固定:取200μl灭活后的疫苗原液,3000
×
g离心10min弃上清,加入1ml 2%-3%戊二醛4℃固定过夜。
[0096]
3.洗涤:0.1m pbs洗涤3次。
[0097]
4.脱水:之后依次用30%、50%、70%、80%、90%的乙醇梯度脱水各一次,100%的无水乙醇脱水3次,每次脱水仅可能将菌体轻轻吹散,每次处理10min,3000
×
g离心5min。
[0098]
5.干燥:co2临界点干燥法,35℃干燥1h。
[0099]
6.粘托和镀膜:用特制的双面胶将样品粘贴到金属样品台上,采用离子溅射法将样品镀上一层金膜。
[0100]
7.扫描成像。
[0101]
结果:如图3扫描电镜结果所示。x射线灭活并未对金葡菌菌体结构造成明显的破坏,即x射线对金葡菌灭活的同时维持了菌体结构(抗原)的完整,可能使之成为更有效的免疫抗原。
[0102]
透射电镜样品制备方法:
[0103]
1.样品制备:按照金黄色葡萄球菌疫苗制备流程,将金黄色葡萄球菌灭活后,取原液进行透射电镜样品制备。
[0104]
2.前固定:取200μl灭活后的疫苗原液,3000
×
g离心10min弃上清,加入1ml 2%-3%戊二醛4℃固定过夜。
[0105]
3.洗涤:0.1m pbs洗涤3次。
[0106]
4.后固定:1%锇酸固定液固定2h。
[0107]
5.洗涤:0.1m pbs洗涤3次。
[0108]
6.脱水:之后依次用30%、50%、70%、80%、90%的丙酮梯度脱水各一次,100%的纯丙酮脱水3次,每次脱水仅可能将菌体轻轻吹散,每次处理30min,3000
×
g离心5min。
[0109]
7.渗透:纯丙酮+包埋液(1:2)室温过夜。
[0110]
8.包埋:将渗透好的样品挑到包埋板中,37℃过夜,45℃12h,60℃48h。
[0111]
9.超薄切片。
[0112]
10.负染色:滴1滴1%的磷钨酸染色1~2min,滤纸吸去染色液,滴1滴纯水,滤纸吸去,反复两三次,洗去多于的磷钨酸,静置干燥。
[0113]
11.透射电镜成像。
[0114]
结果:如图3透射电镜结果所示。x射线对金葡菌灭活的同时维持了菌体结构(抗原)的完整。
[0115]
实施例五
[0116]
金葡疫苗在金葡菌菌血症(血行感染)模型中的保护力考察
[0117]
方法:
[0118]
1.试验分组:本试验选用了4株金黄色葡萄球菌分别对疫苗免疫组进行了挑战试
验:包括甲氧西林敏感金葡菌(methicillin sensitive staphylococcus aureus,mssa)atcc25923,耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,mrsa)atcc33591,以及两株临床分离多药耐药(multi-drug resistant,mdr)金黄色葡萄球菌scph-18和scph-25。其中对照组(unimmunized)和免疫组(immunized),每组各10只。
[0119]
2.免疫:取疫苗成品(0.5~1
×
108/ml),免疫6~8周龄的c57bl/6小鼠,腹股沟皮下接种0.2ml(1~2
×
107/针),免疫3针,间隔2周。末次免疫2周后进行攻毒挑战。
[0120]
3.血行感染模型建立
[0121]
3.1将攻毒挑战菌株(atcc25923、atcc33591、scph-18、scph-25)复苏于血平板,37
±
1℃培养16
±
1h。
[0122]
3.2挑取单克隆接种于3ml tsb中,37
±
1℃培养16
±
1h。
[0123]
3.3用分光光度计测定菌液浓度,接种适当体积菌液至20ml tsb中,终浓度约为0.05od/ml,于37
±
1℃220rpm振荡培养至0.8
±
0.2od/ml(对数生长期)。
[0124]
3.4 3000
×
g室温离心10min,2ml氯化钠注射液(0.9%)重悬菌体,调整菌液浓度至0.5~1
×
109cfu/ml。
[0125]
3.5小鼠尾静脉注射菌液0.1ml/只(0.5~1
×
108cfu/只)。
[0126]
3.6观察统计免疫组和对照组小鼠1周内的生存率。
[0127]
结果:如图4所示,对照组小鼠在各挑战菌株攻毒后72~120h内全部死亡,免疫组对各挑战菌株攻毒小鼠的免疫保护率分别是100%(atcc25923)、60%(atcc33591)、70%(scph-18)、80%(scph-25),即金葡菌疫苗对金葡菌菌血症的保护率在60%及以上。
[0128]
实施例六
[0129]
金葡疫苗在金葡菌肺炎(气道感染)模型中的保护力考察
[0130]
方法:
[0131]
1.试验分组:本试验选用了4株金黄色葡萄球菌分别对疫苗免疫组进行了挑战试验:包括甲氧西林敏感金葡菌(methicillin sensitive staphylococcus aureus,mssa)atcc25923,耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,mrsa)atcc33591,以及两株临床分离多药耐药(multi-drugresistant,mdr)金黄色葡萄球菌scph-18和scph-25。其中对照组(unimmunized)和免疫组(immunized),每组各35只,每时间点3~5只。
[0132]
2.免疫:取疫苗成品(0.5~1
×
108/ml),免疫6~8周龄的c57bl/6小鼠,腹股沟皮下接种0.2ml(1~2
×
107/针),免疫3针,间隔2周。末次免疫2周后进行攻毒挑战。
[0133]
3.肺炎(气道感染)模型建立
[0134]
3.1将攻毒挑战菌株(atcc25923、atcc33591、scph-18、scph-25)复苏于血平板,37
±
1℃培养16
±
1h。
[0135]
3.2挑取单克隆接种于3ml tsb中,37
±
1℃培养16
±
1h。
[0136]
3.3用分光光度计测定菌液浓度,接种适当体积菌液至20ml tsb中,终浓度约为0.05od/ml,于37
±
1℃220rpm振荡培养至0.8
±
0.2od/ml(对数生长期)。
[0137]
3.4 3000
×
g室温离心10min,2ml氯化钠注射液(0.9%)重悬菌体,调整菌液浓度至2~4
×
108cfu/ml。
[0138]
3.5小鼠气道注射菌液0.05ml/只(1~2
×
107cfu/只)。
[0139]
3.6观察统计免疫组和对照组小鼠肺部1周内每天的细菌荷载量。
[0140]
结果:如图5所示,各挑战菌株攻毒后,对照组小鼠肺部细菌荷载量呈明显的增长趋势,并且对照组小鼠72~120h内全部死亡;免疫组对挑战菌株呈现了明显的清除趋势,甚至是完全清除。
[0141]
上面结合附图对本发明的实施例进行了描述,但是本发明并不局限于上述的具体实施方式,上述的具体实施方式仅仅是示意性的,而不是限制性的,本领域的普通技术人员在本发明的启示下,在不脱离本发明宗旨和权利要求所保护的范围情况下,还可做出很多形式,这些均属于本发明的保护之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1