一种动物非灭活疫苗冷冻干燥保护剂及其使用方法与流程
本专利申请是基于专利申请号为2018106368852,发明创造名称为一种动物非灭活疫苗冷冻干燥保护剂及其使用方法的分案申请。
本发明属生物医学技术领域,具体涉及一种用于动物疫苗活性保护的冷冻干燥保护剂及其制备方法。
背景技术:
疫苗免疫可诱导机体产生针对特定病原体的特异性免疫反应,从而增强机体抵御病原体感染的能力。随着畜牧业的发展以及宠物市场的繁荣,我国2015年动物疫苗市场规模已经超过100亿,且逐年增加,其中非灭活疫苗(包括病毒载体疫苗、减毒活疫苗、蛋白质疫苗及核酸疫苗等)约占动物疫苗的80%,市场占有率大。
疫苗效果的影响因素除了疫苗自身的免疫原性与递送载体系统以外,疫苗产品的制剂工艺、储存与运输过程中的保藏条件也至关重要。例如温度、ph值、冻结效应和脱水效应等因素均能影响疫苗的稳定性。非灭活疫苗在常温储存环境中十分不稳定,因此,多数非灭活疫苗主要是直接储存于抗冻剂中,于4°c或4°c以下或经冷冻干燥后,采用冷链运输至使用终端。
目前,保持疫苗稳定性的探索主要是在低温环境下加入冷冻干燥剂,制备疫苗冻干制剂后低温储存运输。冷链储存及运输耗费大量的人力、物力、财力,特别是在畜牧业为主的部分经济不发达地区可及性与可行性都存在极大的挑战性。如何在常温环境中保持非灭活疫苗的稳定性,降低其活性损失,控制疫苗制备的经济成本,已经成为疫苗产业的一大挑战。
研究表明,冷冻干燥过程中影响非灭活疫苗活性的因素主要包括(1)内环境和外环境如渗透压、内环境中冰晶形成和ph值的改变;(2)核酸降解;蛋白质聚合作用、氧化作用、脱酰胺基作用和蛋白质变性;(3)机械损伤、脂质氧化作用等,以上因素均可导致疫苗活性降低。
冷冻干燥保护剂是为了保证冻干过程中将ph值调整到活性物质最稳定区域,防止活性组分发生变性从而降低冷冻干燥对动物疫苗活性的影响而采用的一类组合试剂。常见的冷冻干燥保护剂成分主要包括糖类、多元醇类、聚合物类、表面活性剂类、氨基酸类及盐类六大类。在对疫苗冷冻干燥保护剂的研究中发现组分单一的保护剂其热稳定性和保护效果较差,多种保护组分组成的冷冻干燥保护剂保护效果显著增强。目前保护效果较好的保护剂配方为:spga(蔗糖、磷酸盐、谷氨酸和白蛋白);lgs(乳糖酸、明胶、山梨醇和hepes缓冲液);bugs(磷酸钾缓冲液、水解明胶和山梨醇);ls(乳白蛋白水解物和蔗糖),对冷链运输的一种或多种疫苗具有良好的保护效果。
如何在室温储存的条件下,提高动物疫苗活性的热稳定性及保护效果成为疫苗制剂的一大技术难点,目前的研究均集中在如何降低冷链运输过程中病毒载体疫苗稳定性的损失,对室温储存的病毒稳定性研究尚无报道。聚乙二醇具有良好的水溶性,保湿性好,较为稳定,常用于临床药物的冷冻干燥保护;葡聚糖是低聚糖的一种,能在低温及干燥失水等情况下在病毒表面形成保护膜,有效的保护病毒活性结构不被破坏,常用于乳酸菌的冷冻干燥保护;牛血清白蛋白是一类酶稳定剂,能有效防止酶的分解及特异性吸附,能减轻酶的变性,常用于微生物的冷冻干燥保护;l-谷氨酸是一类氨基酸,氨基酸离子具有酸碱两性,能够在生物制品的低温保存和冷冻干燥过程中抑制溶液的ph变化,达到保护活性组分的目的,l-谷氨酸作为冷冻干燥保护剂的组分尚无报道。目前尚无上述四种组分相互组合配制成冷冻干燥保护剂的报道。我们选取其中的两种或三种成分进行组合,配制成组分不同的冷冻干燥保护剂,探究不同组分的冷冻干燥保护剂的保护效果。此外,大量的研究均显示冷冻干燥保护剂在冷链运输中对疫苗的活性有保护效果,但对疫苗免疫原性的保护效果研究较少,本发明进一步探究了本发明所述冷冻干燥保护剂对非灭活疫苗免疫原性的影响。
技术实现要素:
本发明所要解决的技术问题是:寻求一种新型动物非灭活疫苗冷冻干燥保护剂组合,用以解决在室温条件下,提高疫苗活性的热稳定性及保护效果,并且不损伤疫苗的免疫原性,降低动物疫苗在冷冻干燥以及常温储存运输的过程中活性组分的损失。
为解决上述技术问题,本发明提供一种针对非囊膜病毒疫苗的冷冻干燥保护剂由聚乙二醇,l-谷氨酸组成,其配比为聚乙二醇0-50份,l-谷氨酸0-50份。
进一步,针对非囊膜病毒疫苗的冷冻干燥保护剂其成分除聚乙二醇,l-谷氨酸外,还包含葡聚糖。
所述非囊膜病毒疫苗包括但不限于腺病毒疫苗、逆转录病毒疫苗、细小病毒疫苗。
优选的,非囊膜病毒冷冻干燥保护剂的配比关系为聚乙二醇:l-谷氨酸=50:9。
所述动物非灭活疫苗冷冻干燥保护剂的使用方法是:将所述冷冻干燥保护剂与动物非灭活疫苗按49:1的体积比混合,于-80°c储存过夜,冷冻干燥机预先预冷至-20°c以下,将上述冷冻干燥保护剂与动物非灭活疫苗混合物放入冷冻干燥离心机中进行低温冷冻干燥后,即可用于常温运输。
本发明的有益效果为:本发明所述用于保护动物疫苗活性的冷冻干燥保护剂包括以下原料的两种及以上:聚乙二醇、葡聚糖、l-谷氨酸。首次将l-谷氨酸作为冷冻干燥保护剂的组分,较现有的多种组分组成的冷冻干燥保护剂能有效保护冷链运输过程非灭活疫苗的活性组分,本发明提供了一种能在室温储存条件下对非灭活疫苗有良好保护效果的冷冻干燥保护剂配制新方法。
附图说明
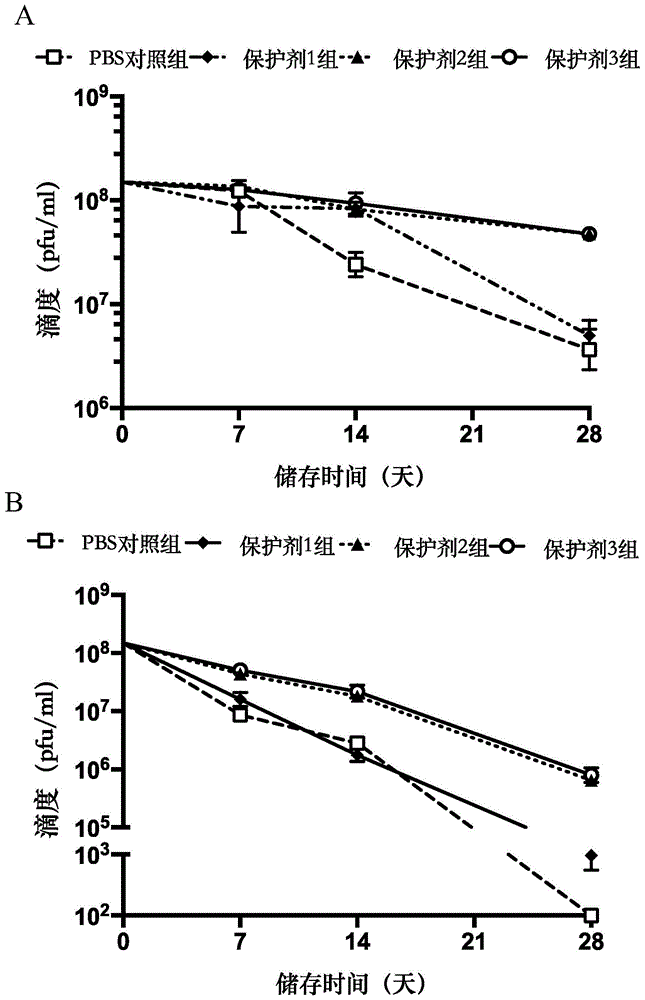
图1显示在不同储存条件下,重组痘病毒载体疫苗的滴度下降速率。4°c储存滴度变化情况(a)和25°c储存滴度变化情况(b)。
图2显示在不同储存条件下,重组腺病毒载体疫苗的滴度下降速率。4°c储存滴度变化情况(a)和25°c储存滴度变化情况(b)。
图3显示重组痘病毒载体疫苗免疫小鼠,小鼠体内特异性t细胞的数量(a)和结合抗体抗体滴度(b)。
图4显示重组腺病毒载体疫苗免疫小鼠,小鼠体内特异性t细胞的数量(a)和结合抗体抗体滴度(b)。
具体实施方式
本发明提供了一种配方简单、对动物活疫苗保护效果好且适用于大规模生产的冷冻干燥保护剂的新的配制方法。囊膜病毒如痘病毒、疱疹病毒、流感病毒、冠状病毒等病毒的病毒结构相似,冷冻干燥保护剂对这类病毒的保护原理相似;非囊膜病毒如腺病毒、逆转录病毒、细小病毒等病毒的病毒结构类似,冷冻干燥保护剂对这类病毒的保护机理也较为类似。所以本发明以非灭活疫苗常用的两种代表性疫苗病毒载体,包括痘病毒(囊膜病毒代表)和腺病毒(非囊膜病毒代表)为模型,探究不同组分构成的冷冻干燥保护剂对非灭活疫苗的保护效果。我们发现聚乙二醇和l-谷氨酸组合后能显著保护腺病毒的滴度。有文献显示单纯使用聚乙二醇保护腺病毒时,在25°c储存5天后腺病毒滴度下降0.6个log值;尚无文献探究l-谷氨酸对腺病毒的保护效果。我们的实验数据显示聚乙二醇和l-谷氨酸联合使用,腺病毒正在25°c储存28天后滴度下降0.6个log值,大大延长了在25°c储存时间。
下面结合具体实施例,进一步阐述本发明。
实施例1不同构成组分的冷冻干燥保护剂及其制备方法
冷冻干燥保护剂1由聚乙二醇,葡聚糖组成。
冷冻干燥保护剂2由聚乙二醇,牛血清白蛋白组成。
冷冻干燥保护剂3由聚乙二醇,葡聚糖,牛血清白蛋白组成。
冷冻干燥保护剂4由聚乙二醇,l-谷氨酸组成。
冷冻干燥保护剂5由聚乙二醇,葡聚糖,l-谷氨酸组成。
其配比为聚乙二醇0-50份、葡聚糖0份-50份、牛血清白蛋白0份-50份、l-谷氨酸0份-50份。囊膜病毒的最适配比关系为聚乙二醇:葡聚糖:牛血清白蛋白=50:5:4,非囊膜病毒的最适配比关系为聚乙二醇:l-谷氨酸=50:9
用高压后的ddh2o配制如上所示的冷冻干燥保护剂1、2、3、4、5。将上述冷冻干燥保护剂或pbs,分别与疫苗(重组痘病毒载体上插入荧光素酶报告基因(ttv-luci)或重组腺病毒载体上插入gfp报告基因(ad5-gfp))。按冷冻干燥保护剂:疫苗=(体积比)49:1的比例混合后装入2ml密封玻璃瓶中(1ml/瓶分装),于-80°c储存过夜。冷冻干燥机预先预冷20min,待温度稳定至-50°c左右,用干冰运输样品,打开样品瓶盖,将样品放入冷冻干燥离心机中。低温冷冻干燥24小时后,取出样品,密封后于4°c、25°c分别储存7天、14天、28天。储存完成后进行滴度检测。
实施例2:冷冻干燥保护剂能有效保护囊膜病毒疫苗的滴度
以重组痘病毒载体疫苗为例,按上述实验方法将冷冻干燥保护剂1、2、3或pbs和ttv-luci混合后分装,每瓶初始ttv-luci滴度为1.50×108pfu/ml。储存完成后进行ttv-luci滴度检测。检测结果如图1所示:
pbs添加ttv-luci对照组,经冷冻干燥后于4°c储存,检测的的三个时间点的滴度为1.23×108pfu/ml(7天)、2.42×107pfu/ml(14天)、3.67×106pfu/ml(28天)。于25°c储存后,三个时间点相应的滴度分别为8.63×106pfu/ml、2.63×106pfu/ml、1.00×102pfu/ml。
冷冻干燥保护剂1添加的ttv-luci组,与pbs对照组相比,于4°c储存后测定滴度仅在14天(8.33×107pfu/ml)显示有2.47倍的提升(p=0.024),另外2个时间点未见显著差异;于25°c储存后测定的滴度相比于pbs对照组虽然略有提升,但未见明显统计学差异。
冷冻干燥保护剂2添加的ttv-luci组,与pbs对照组相比,于4°c储存后测得滴度分别提升了0.11倍(1.37×108pfu/ml)、2.42倍(8.20×107pfu/ml,p=0.0026)和11.91倍(4.37×107pfu/ml,p<0.001);于25°c储存后稳定性保护效果更佳明显,三个时间点测定的滴度分别提高4.06倍(4.37×107pfu/ml),5.35倍(1.80×107pfu/ml,p=0.0014)和6500倍(6.50×105pfu/ml,p<0.001)。
冷冻干燥保护剂3添加的ttv-luci组,与pbs对照组相比,于4°c储存后测得滴度分别提高0.027倍(1.27×108pfu/ml)、2.88倍(9.33×107pfu/ml,p<0.001)和11.91倍(4.73×107pfu/ml,p<0.001)。于25°c储存后稳定性保护效果更佳,三个时间点测得滴度分别提高4.87(5.07×107pfu/ml)倍、6.65倍(2.17×107pfu/ml,p<0.001)和8000倍(8.00×105pfu/ml,p<0.001)。
本组实验结果显示:冷冻干燥保护剂1、2、3无论在冷链运输还是在室温储存均对ttv-luci滴度有良好的保护作用,能减缓重组痘病毒载体活性损失速率。在室温储存条件下,冷冻干燥保护剂3对痘滴度的保护效果最好。且随储存时间的延长,对ttv-luci的保护效果增强。
实施例3:冷冻干燥保护剂能有效保护非囊膜病毒疫苗的滴度
以重组腺病毒载体疫苗为例,按上述实验方法将冷冻干燥保护剂4、5或pbs和ad5-gfp混合后分装,每瓶ad5-gfp滴度为5.00×108tcid50/ml。储存完成后进行ad5-gfp滴度检测。实验结果如图2所示:
pbs添加的ad5-gfp对照组,经冷冻干燥后于4°c储存,测得三个时间点的滴度分别为3.23×108tcid50/ml(7天)、1.37×108tcid50/ml(14天)、1.87×105tcid50/ml(28天)。于25°c储存三个时间点后测得滴度分别为4.50×106tcid50/ml、1.63×106tcid50/ml、1.00×102tcid50/ml。
冷冻干燥保护剂4添加的ad5-gfp组,与pbs对照组相比,于4°c储存后测得的滴度分别提高0.31倍(4.23×108tcid50/ml,p<0.001)、1.82倍(3.87×108tcid50/ml,p<0.001)和1838倍(3.43×108tcid50/ml,p<0.001)于25°c储存后,腺病毒载体疫苗的稳定性随保护时间的延长,保护效果更佳。三个时间点测得的滴度分别较pbs对照组提高53倍(2.43×108tcid50/ml,p<0.001)、101倍(1.67×108tcid50/ml,p<0.001)和573000倍(5.73×107tcid50/ml,p<0.001)。
冷冻干燥保护剂5添加的ad5-gfp组,与pbs对照组相比,于4°c储存后测得滴度分别提高0.26倍(4.07×108tcid50/ml,p=0.002)、1.40倍(3.30×108tcid50/ml,p<0.001)和624倍(1.17×108tcid50/ml,p<0.001)。于25°c储存后较4°c储存保护效果更好,测得的滴度分别提高34.55倍(1.60×108tcid50/ml,p<0.001)、35.80倍(6.00×107tcid50/ml,p<0.001)和4000倍(4.00×106tcid50/ml,p<0.001。
本组实验结果显示:冷冻干燥保护剂4、5无论在冷链运输还是在室温储存均对ad5-gfp滴度有良好的保护作用,但冷冻干燥保护剂4的保护效果优于冷冻干燥保护剂5。且随储存时间的延长,对ad5-gfp的保护效果越好。与4°c储存环境相比,储存于25°c的ad5-gfp滴度能得到冷冻干燥保护剂更好的保护。
实施例4:冷冻干燥保护剂不会降低病毒疫苗的免疫原性
以痘病毒疫苗为例,本实施例采用6周雌性c57小鼠(n=6/组),将小鼠随机分为5组。
对照组:在第0天、第14天和第28天,分别给予小鼠肌肉注射100µl(1mg/ml)空白质粒(psv1.0)。
未经冻干组:在第0天、第14天,分别给予小鼠肌肉注射100µl(1mg/ml)psv1.0-ova(psv1.0载体中插入ova基因的重组质粒)。第28天小鼠肌肉注射100µl未经冷冻干燥的插入ova基因的痘病毒(ttv-ova)(1x107pfu)。
保护剂2组:在第0天、第14天,分别给予小鼠肌肉注射100µl(1mg/ml)psv1.0-ova。第28天小鼠肌肉注射100µl的经冷冻干燥保护剂2保护的冷冻干燥后的ttv-ova(1x107pfu)。
保护剂3组:在第0天、第14天,分别给予小鼠肌肉注射100µl(1mg/ml)psv1.0-ova。第28天小鼠肌肉注射100µl的经冷冻干燥保护剂3保护的冷冻干燥后的ttv-ova(1x107pfu)。
第三次免疫结束后14天,检测小鼠体内特异性免疫反应情况。分离小鼠脾细胞,用针对ova的2条单肽刺激,elispot检测小鼠体内特异性t细胞数量,观察细胞免疫的强弱变化。elisa检测小鼠体内特异性结合抗体的滴度,观察体液免疫的变化情况。
实验结果如图3所示:
对照组针对ova的特异性t细胞反应强度<50sfc/10e6脾细胞,视作无特异性t细胞反应。100倍稀释后对ova的特异性总igg其效价以2为底取对数,抗体效价为1.83±0.83。
未经冻干组特异性t细胞反应强度为(259.17±79.17)sfc/10e6脾细胞,显著高于对照组(p<0.001)。抗体效价为6.33±0.67,显著高于对照组(p<0.001)。
保护剂2组特异性t细胞反应强度为(202.20±62.80)sfc/10e6脾细胞,与未经冻干免疫组相比,无统计学差异。抗体效价为6.83±0.83,与未经冻干免疫组相比,无统计学差异。
保护剂3组特异性t细胞反应强度为(246.00±140.00)sfc/10e6脾细胞,与未经冻干免疫组相比,无统计学差异。抗体效价为6.50±0.50,与未经冻干免疫组相比,无统计学差异。
本组实验结果显示:与对照组相比,两针dna免疫,一针重组痘病毒载体疫苗能有效激活特异性t细胞和特异性b细胞反应。保护剂2、3添加后冻干免疫组与未经冻干组相比,ttv-ova的特异性t细胞免疫反应和特异性b细胞免疫反应均无统计学差异,ttv-ova的免疫原性得到良好的维持。冷冻干燥保护剂2、3能保护冷冻干燥过程ttv-ova免疫原性不受损伤,且冷冻干燥保护剂2、3自身不会损伤ttv-ova的免疫原性。
实施例4:冷冻干燥保护剂不会降低非囊膜病毒疫苗的免疫原性
以腺病毒疫苗为例,本实施例采用6周雌性c57小鼠(n=6/组),将小鼠随机分为5组。
对照组:在第0天、第14天和第28天,分别给予小鼠肌肉注射100µl(1mg/ml)空白质粒(psv1.0)。
未经冻干组:在第0天、第14天,分别给予小鼠肌肉注射100µl(1mg/ml)psv1.0-env(psv1.0载体中插入env基因的重组质粒)。第28天小鼠肌肉注射100µl未经冷冻干燥的插入env基因的腺病毒(ad5-env)(1x108tcid50)。
保护剂4组:在第0天、第14天,分别给予小鼠肌肉注射100µl(1mg/ml)psv1.0-env。第28天小鼠肌肉注射100µl的经冷冻干燥保护剂4保护的冷冻干燥后的ad5-env(1x108tcid50)。
保护剂5组:在第0天、第14天,分别给予小鼠肌肉注射100µl(1mg/ml)psv1.0-env。第28天小鼠肌肉注射100µl的经冷冻干燥保护剂5保护的冷冻干燥后的ad5-env(1x108tcid50)。
第三次免疫结束后14天,检测小鼠体内特异性免疫反应情况。env肽库刺激后用elispot检测小鼠体内特异性t细胞数量,观察细胞免疫的强弱变化;elisa检测小鼠体内特异性结合抗体的滴度,观察体液免疫的变化情况。
实验结果如图4所示:
对照组针对env的特异性t细胞反应强度(176.25±118.75)sfc/10e6脾细胞。100倍稀释后对env的特异性总igg其效价以2为底取对数,抗体效价为2.33±1.67。
未经冻干免疫组针对env的特异性t细胞反应强度为(425.00±250.00)sfc/10e6脾细胞,高于对照组(p<0.001)。抗体效价为6.16±0.84,显著高于对照组(p<0.001)。
保护剂4免疫组针对env的特异性t细胞反应强度为(463.82±238.18)sfc/10e6脾细胞,与未经冻干免疫组相比,无统计学差异。抗体效价为6.40±0.60,与未经冻干免疫组相比,无统计学差异。
保护剂5免疫组针对env的特异性t细胞反应强度为(452.92±172.92)sfc/10e6脾细胞,与未经冻干免疫组相比,无统计学差异。抗体效价为5.50±0.50,较未经冻干免疫组稍有下降(p=0.038)。
本组实验结果显示:与对照组相比,两针dna免疫,一针重组腺病毒载体疫苗能有效激活特异性t细胞和特异性b细胞反应。在冷冻干燥保护剂4保护下ad5-env经过冷冻干燥程序后与未经冻干免疫组相比,ad5-env的特异性t细胞免疫反应和特异性b细胞免疫反应均无统计学差异,不影响ad5-env免疫原性。冷冻干燥保护剂5对特异性t细胞免疫反应没有影响。
综上所述,我们所配制的冷冻干燥保护剂能有效保护囊膜病毒疫苗(痘病毒)和非囊膜病毒疫苗(腺病毒)的滴度,在不同温度中均能有效保护病毒,降低病毒失活速率,其中对25°c(室温储存)的病毒疫苗保护效果最好。囊膜病毒和非囊膜病毒的最适冷冻干燥保护剂配方不同,冷冻干燥保护剂3对囊膜病毒的保护效果最好,而冷冻干燥保护剂4对非囊膜病毒的保护效果最好。在冷冻干燥保护剂的保护下,非灭活疫苗经冷冻干燥保护剂保护后,冷冻干燥程序不会损伤疫苗的免疫原性,且冷冻干燥保护剂自身不会损伤疫苗的免疫原性。
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!