木聚糖衍生物作为亲水性缓释材料在制备药物缓释片中的应用
1.本发明涉及木聚糖衍生物作为亲水性缓释材料在制备药物缓释片中的应用,属于药辅材料技术领域。
背景技术:
2.多糖类天然高分子化合物是药用辅料中的重要成员,尤其以纤维素及其衍生物为代表的一些列化合物在医药工业中,尤其在缓释、控释药物的研发和应用中扮演了重要的角色。近年来,随着木聚糖尤其是水不溶性木聚糖的生产技术逐渐成熟,以及其在肠道微生物领域的重要作用,木聚糖产品开始逐渐出现。但木聚糖的不溶性又限制了其应用范围,尤其作为药辅材料,不溶性严重限制了加工性能和用途。因此对木聚糖进行适当的衍生化便成为必然。
3.木聚糖是一种直链型的天然聚糖高分子,也是自然界中唯一的五碳糖聚糖。与其它六碳糖聚糖相比,木聚糖每个糖单元上均只有两个羟基,因此可供衍生化的位点也比六碳糖少一个,衍生之后同样也缺少一个能够形成氢键的作用位点。因而在水溶液中高分子链相互间以及跟水分子之间的作用力也相对于同类型六碳聚糖弱,所以包括羧甲基化、羟乙基化和羟丙基化的木聚糖衍生物均表现出一个突出的共同特点,即溶胀小、粘度低。正因为这样的结构特点,导致这些木聚糖衍生物并不能直接套用其它同类型多糖衍生物的应用方式。
4.鉴于此,有必要提供木聚糖衍生物在药辅材料领域新的应用,以解决现有技术的不足。
技术实现要素:
5.本发明的目的是克服现有技术的不足,提供木聚糖衍生物作为亲水性缓释材料在制备药物缓释片中的应用。
6.本发明解决上述技术问题的技术方案如下:木聚糖衍生物作为亲水性缓释材料在制备药物缓释片中的应用。
7.本发明的木聚糖衍生物作为亲水性缓释材料在制备药物缓释片中的应用的有益效果是:
8.本技术的发明人经过多年研究发现,木聚糖衍生物可以作为亲水性缓释材料,用于制备药物缓释片,既开辟了木聚糖衍生物新的应用领域,也开辟了新的亲水性缓释材料,具有积极的药学价值和广泛的社会意义。
9.在上述技术方案的基础上,本发明还可以做如下改进。
10.进一步,所述木聚糖衍生物为羧甲基木聚糖、羟乙基木聚糖和羟丙基木聚糖中的任意一种。
11.采用上述进一步的有益效果是:本发明经过研究发现,上述三种木聚糖衍生物均
可作为亲水性缓释材料,用于制备药物缓释片。
12.进一步,所述药物缓释片包括木聚糖衍生物、疏水性缓释材料、溶剂和药物,其中,所述疏水性缓释材料为乙基纤维素,所述溶剂为水和/或乙醇。
13.采用上述进一步的有益效果是:本发明基于背景技术里木聚糖的结构特点,经过多年研究发现,木聚糖衍生物作为亲水性缓释材料,既起到骨架作用又起到溶蚀作用。乙基纤维素作为疏水性缓释材料,与木聚糖衍生物有高的相容性,既是骨架又是阻滞剂。亲水性缓释材料和疏水性缓释材料配伍后形成亲疏水双骨架,从而提供一种适应性广泛的通用型药物缓释体系。该药物缓释体系具有如下优势:一是适应性强,仅需木聚糖衍生物和疏水性缓释材料这两种主要材料即可适应多种溶解度的药物;木聚糖衍生物和疏水性缓释材料可调整范围大,无需担心木聚糖衍生物过多导致溶胀和提前崩解的问题。二是载药量大,片剂载药量可达30%
‑
50%(w/w)。三是可以避免其它类似多糖高分子(比如羧甲基纤维素、羟丙基甲基纤维素和海藻酸等)作为缓释材料的缺点,即高溶胀高粘度特性导致在制备缓释片剂时辅料中水溶性多糖比例需要严格控制,否则容易“撑爆”药片导致突释效应的问题。
14.药物缓释片在释放的时候,木聚糖衍生物在人体肠道里的水中,或者在体外试验的水中,能够形成凝胶并缓慢溶解。利用这一特性,使之与疏水材料通过一定方式融合可以形成疏水骨架和凝胶孔道相互交融贯穿的结构体系。对水溶性好的药物可以通过调控凝胶通道的大小控制水的渗入速度进而控制药物释放的速度和量;对水溶性较差的药物可以通过亲水材料本身的溶解,逐渐溶蚀崩裂药片释放药物。通过调整木聚糖衍生物和疏水性缓释材料的质量配比即可控制药物的释放时间。并且针对不同药物,利用木聚糖衍生物和疏水性缓释材料不同的溶解性能,采用不同的溶剂(水和/或乙醇),部分溶解其中的一种或两种材料,又可以使其作为粘合剂。水可以溶解木聚糖衍生物,乙醇可以溶解乙基纤维素,溶解后的木聚糖衍生物和/或乙基纤维素可以同时起到粘合作用,混合包覆更均匀,在干燥后片剂也更结实。
15.更进一步,在所述药物缓释片中,所述木聚糖衍生物与所述疏水性缓释材料的质量比为10:1
‑
2:1,所述药物占所述药物缓释片的质量百分比为20%
‑
50%。
16.采用上述进一步的有益效果是:采用上述参数,有助于调整木聚糖衍生物形成凝胶孔道的大小,进而控制药物释放的速度。
17.更进一步,所述药物缓释片的制备方法为:将药物和木聚糖衍生物分别粉碎过筛后,混合均匀,加水制粒,烘干后再与经过筛的疏水性缓释材料混合均匀,用≥75%体积浓度的乙醇再次制粒,压片,即得。
18.采用上述更进一步的有益效果是:上述制备方法适用于水溶性较好的药物,比如双氯芬酸钠、茶碱、美托洛尔、二甲双胍、愈创甘油醚、噻唑烷二酮和氟伐他汀等。
19.更进一步,在所述药物缓释片中,还包括增粘剂,所述木聚糖衍生物与所述疏水性缓释材料的质量比为6:1
‑
1:2,所述增粘剂占所述药物缓释片的质量百分比为0%
‑
10%,所述药物占所述药物缓释片的质量百分比为20%
‑
50%。
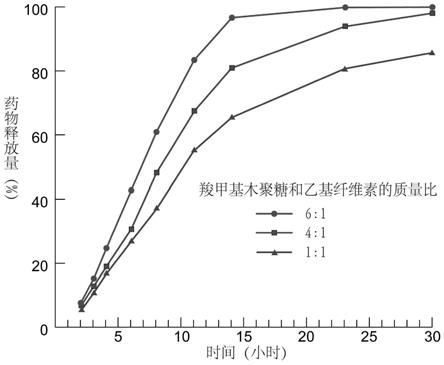
20.采用上述更进一步的有益效果是:采用上述参数,可以解决某些水溶性特别好或碱性水溶性药物在胃酸中过量释放的问题,比如茶碱、美托洛尔、二甲双胍、愈创甘油醚和噻唑烷二酮等。
21.更进一步,所述增粘剂为羧甲基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲
基纤维素和海藻酸和聚乙二醇中的任意一种。
22.采用上述更进一步的有益效果是:采用上述增粘剂,对于水溶性特别好的药物,可以减少在胃酸里面的释放量。
23.更进一步,所述药物缓释片的制备方法为:将木聚糖衍生物、疏水性缓释材料、增粘剂和药物分别粉碎过筛后,混合均匀,用≥75%体积浓度的乙醇制粒,压片,即得。
24.采用上述更进一步的有益效果是:上述制备方法适用于水溶性较差的药物,比如5
‑
氨基水杨酸、萘普生、洛伐他汀、硝苯地平和氢氯噻嗪等。
附图说明
25.图1为本发明的实施例1中,双氯芬酸钠缓释片的释放曲线。
26.图2为本发明的实施例1中,双氯芬酸钠缓释片释放完毕的照片。
27.图3为本发明的实施例1中,双氯芬酸钠缓释片释放完毕干燥后的照片。
28.图4为本发明的实施例2中,愈创甘油醚缓释片的释放曲线。
29.图5为本发明的实施例3中,茶碱缓释片的释放曲线。
30.图6为本发明的实施例4中,5
‑
氨基水杨酸缓释片的释放曲线。
31.图7为本发明的实施例5中,布洛芬缓释片的释放曲线。
具体实施方式
32.以下结合具体附图对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
33.实施例1
34.本实施例是将木聚糖衍生物用于制备酸性水溶药物——双氯芬酸钠缓释片。
35.第一种情况:该双氯芬酸钠缓释片由如下质量百分数的原料制成:双氯芬酸钠40%、羧甲基木聚糖51.4%和乙基纤维素8.6%(即羧甲基木聚糖和乙基纤维素的质量比为6:1)。
36.第二种情况:该双氯芬酸钠缓释片由如下质量百分数的原料制成:双氯芬酸钠40%、羧甲基木聚糖48%和乙基纤维素12%(即羧甲基木聚糖和乙基纤维素的质量比为4:1)。
37.第三种情况:该双氯芬酸钠缓释片由如下质量百分数的原料制成:双氯芬酸钠40%、羧甲基木聚糖30%和乙基纤维素30%(即羧甲基木聚糖和乙基纤维素的质量比为1:1)。
38.将上述上述三种情况的三种原料粉碎过100目筛,充分搅拌混合均匀,用95%体积浓度的乙醇喷湿,过16目筛造粒,将湿粒于50℃干燥2小时。向烘干后的颗粒中加入颗粒总质量1%的硬脂酸镁作为润滑剂并混匀,送入压片机压片,即得双氯芬酸钠缓释片。
39.将得到的双氯芬酸钠缓释片按照《中国药典》2015版方法进行溶出度测试。
40.双氯芬酸钠缓释片的释放曲线,如图1所示。
41.双氯芬酸钠缓释片释放完毕的照片,如图2所示。
42.双氯芬酸钠缓释片释放完毕,再干燥后的照片,如图3所示。
43.由图1
‑
图3可见,基于疏水骨架和凝胶孔道交融贯穿结构的释药体系在药物释放
完成后仍然保留完整的疏水骨架。而且,通过调整木聚糖衍生物和疏水性缓释材料的质量配比即可控制药物的释放时间。
44.实施例2
45.本实施例是将木聚糖衍生物用于制备中性水溶性药物——愈创甘油醚缓释片。该愈创甘油醚缓释片由如下质量百分数的原料制成:愈创甘油醚30%、羧甲基木聚糖41%、乙基纤维素21%和羟丙基甲基纤维素8%。将上述四种原料粉碎过100目筛,充分搅拌混合均匀,用75%体积浓度的乙醇喷湿,过16目筛造粒,将湿粒于50℃干燥2小时。向烘干后的颗粒中加入颗粒总质量1%的硬脂酸镁作为润滑剂并混匀,送入压片机压片,即得愈创甘油醚缓释片。
46.愈创甘油醚缓释片的释放曲线,如图4所示。
47.实施例3
48.本实施例是将木聚糖衍生物用于制备碱性水溶性药物——茶碱缓释片。该茶碱缓释片由如下质量百分数的原料制成:茶碱25%、羟丙基木聚糖23%、乙基纤维素42%和羧甲基纤维素10%。将上述四种原料粉碎过100目筛,充分搅拌混合均匀,用75%体积浓度的乙醇喷湿,过16目筛造粒,将湿粒于50℃干燥2小时。向烘干后的颗粒中加入颗粒总质量1%的硬脂酸镁作为润滑剂并混匀,送入压片机压片,即得茶碱缓释片。
49.茶碱缓释片的释放曲线,如图5所示。
50.实施例4
51.本实施例是将木聚糖衍生物用于制备难溶性药物——5
‑
氨基水杨酸缓释片。该5
‑
氨基水杨酸缓释片由如下质量百分数的原料制成:5
‑
氨基水杨酸50%、羟乙基木聚糖40%和乙基纤维素10%。将5
‑
氨基水杨酸和羟乙基木聚糖粉碎过100目筛,充分搅拌混合均匀,用纯水喷湿,过24目筛造粒,将湿粒于100℃干燥1小时,再将过100目筛的乙基纤维素加入并充分混合,用95%体积浓度的乙醇喷湿,过16目筛造粒,将湿粒于50℃干燥2小时。向烘干后的颗粒中加入颗粒总质量1%的硬脂酸镁作为润滑剂并混匀,送入压片机压片,即得5
‑
氨基水杨酸缓释片。
[0052]5‑
氨基水杨酸缓释片的释放曲线,如图6所示。
[0053]
实施例5
[0054]
本实施例是将木聚糖衍生物用于制备难溶性药物——布洛芬缓释片。该布洛芬缓释片由如下质量百分数的原料制成:布洛芬45%、羧甲基木聚糖42%和乙基纤维素13%。将布洛芬和羟乙基木聚糖粉碎过100目筛,充分搅拌混合均匀,用纯水喷湿,过30目筛造粒,将湿粒100℃干燥1小时,再将过100目筛的乙基纤维素加入并充分混合,用95%体积浓度的乙醇喷湿,过16目筛造粒,将湿粒于50℃干燥2小时。向烘干后的颗粒中加入颗粒总质量1%的硬脂酸镁作为润滑剂并混匀,送入压片机压片,即得5
‑
氨基水杨酸缓释片。
[0055]
布洛芬缓释片的释放曲线,如图7所示。
[0056]
由实施例1
‑
实施例5可知,药物缓释片在释放的时候,木聚糖衍生物在人体肠道里的水中,或者在体外试验的水中,能够形成凝胶并缓慢溶解。利用这一特性,使之与疏水材料通过一定方式融合可以形成疏水骨架和凝胶孔道相互交融贯穿的结构体系。对水溶性好的药物可以通过调控凝胶通道的大小控制水的渗入速度进而控制药物释放的速度和量;对水溶性较差的药物可以通过亲水材料本身的溶解,逐渐溶蚀崩裂药片释放药物。通过调整
木聚糖衍生物和疏水性缓释材料的质量配比即可控制药物的释放时间。并且针对不同药物,利用木聚糖衍生物和疏水性缓释材料不同的溶解性能,采用不同的溶剂(水和/或乙醇),部分溶解其中的一种或两种材料,又可以使其作为粘合剂。水可以溶解木聚糖衍生物,乙醇可以溶解乙基纤维素,溶解后的木聚糖衍生物和/或乙基纤维素可以同时起到粘合作用,混合包覆更均匀,在干燥后片剂也更结实。
[0057]
因此,木聚糖衍生物可以作为亲水性缓释材料,用于制备药物缓释片,既开辟了木聚糖衍生物新的应用领域,也开辟了新的亲水性缓释材料,具有积极的药学价值和广泛的社会意义。
[0058]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1