无细胞脂肪提取物及其制备方法、分析方法与流程
1.本发明涉及细胞工程技术领域,特别涉及一种无细胞脂肪提取物及其制备方法、分析方法。
背景技术:
2.脂肪抽吸术所得脂肪的再次利用,根据不同技术手段可以从脂肪组织中提取脂肪间充质干细胞(adipose mesenchymal stem cells,adscs)、颗粒脂肪、纳米脂肪(nanofat)、基质血管成分(stromal vascular fraction, svf)。
3.脂肪间充质干细胞培养可收获脂肪间充质干细胞上清液,其中脂肪间充质干细胞、基质血管成分细胞、脂肪间充质干细胞上清液可通过注射回输方式治疗缺血性疾病、骨关节退行性疾病、代谢性疾病、毛发再生等,也能在抗皱纹、瘢痕治疗、皮肤再生、皮肤年轻化、脂肪移植等医美领域发挥作用。源自外周血的富血小板血浆(platelet
‑
rich plasma,prp)在上述方面也有类似作用,其含有多种生长因子,如tgf
‑
珀.pdgf、血管内皮生长因子、碱性成纤维细胞生长因子和表皮生长因子等。
4.但上述脂肪组织提取物及衍生物和prp在质量控制、安全性、技术保存、疗效、反复注射方面均有不同程度问题。脂肪间充质干细胞(adscs) 是一种由脂肪组织经历多次消化分离的干细胞,在培养时需要消化酶和培养基等外源性物质,有致瘤、栓塞的风险,再次利用前需要二甲基亚砜等冻存保护液冷冻保存。svf的制备是由脂肪组织经胶原酶震荡消化离心获得沉淀物,沉淀物再离心获得的混合产物,需要经胶原酶消化离心等步骤,含有大量除脂肪干细胞外的其他细胞和细胞因子构成微环境,也有栓塞风险,保存需要保护剂。adscs/svf在异体移植注射时均有排斥风险,需要采用自体脂肪制备避免,再次注射时需要复苏,或者再次抽取脂肪制备,步骤繁琐。adscs上清液,因为源自adscs,因此避免不了接触酶和化学物质,在保存时需要和使用后的培养液共同保存,细胞因子浓度被培养液稀释,浓度降低。prp是外周血经体外离心、分离,获取的一种富含血小板的血浆,其主要物质为血小板、白细胞及纤粘蛋白,具有细胞安全问题,不可保存,制备完成后即需使用。
5.以上现有技术在治疗缺血性疾病、骨关节退行性疾病、代谢性疾病、毛发再生、抗皱纹、瘢痕治疗、皮肤再生、皮肤年轻化、脂肪移植各方面均有不同程度问题,且无法通过现有技术解决。因此,业界对于能够发挥以上治疗作用且对于人体安全无刺激性的组成物,仍存在有殷切的需求。
技术实现要素:
6.为解决上述技术问题,本发明提供了一种无细胞脂肪提取物及其制备方法、分析方法,具有制备过程简便且安全性高的优点。
7.为达到上述目的,本发明的技术方案如下:
8.一种无细胞脂肪提取物的制备方法,包括:
9.步骤一、将去除血细胞和其他杂质的脂肪抽吸物离心分层后,取中间脂肪层得到
脂肪细胞液;
10.步骤二、将所述脂肪细胞液进行机械乳化后,通过冻融或震荡的方式将脂肪细胞完全破碎;
11.步骤三、将破碎后的脂肪细胞液离心分层后,取第三层得到提取物混合液;
12.步骤四、对提取物混合液进行过滤处理以最终得到无细胞脂肪提取物;
13.步骤五、将无细胞脂肪提取物注液使用或者冻存。
14.作为本发明的一种优选方案,所述步骤一中,通过生理盐水对脂肪抽吸物反复洗涤以去除血细胞和其他杂质;所述步骤一中的离心条件为:于 1200rpm转速条件下离心3min。
15.作为本发明的一种优选方案,所述步骤二中机械乳化过程为:将两个注射器通过2mm的鲁尔锁连接器连接后,使脂肪细胞液在两个注射器之间往复移动。
16.作为本发明的一种优选方案,所述步骤二中冻融方式具体为:将乳化后的脂肪细胞液在
‑
80℃条件下冷冻12h后,在37℃下解冻,完成一次冻融。
17.作为本发明的一种优选方案,所述步骤二中震荡方式具体为:在乳化后的脂肪细胞液加入无菌破碎棒后置于超声震荡仪中,以震荡时长5min、 90%功率、间隔周期30s的条件,循环震荡3次。
18.作为本发明的一种优选方案,所述步骤三中的离心条件为:于1200rpm 转速条件下离心5min;所述步骤四中,通过0.22μm的过滤器对提取物混合液进行过滤处理;所述步骤五中冻存温度为
‑
20℃。
19.作为本发明的一种优选方案,所述步骤五之前还通过bca法测定无细胞脂肪提取物中的蛋白质浓度。
20.另一方面,本发明还提供一种无细胞脂肪提取物,其通过上述任一技术方案所述的制备方法制得。
21.另一方面,本发明还提供一种分析上述技术方案所述的无细胞脂肪提取物对脂肪移植物存活率影响的方法,包括:
22.步骤一、配置四组处理液
23.磷酸盐缓冲液组:取500μl脂肪和50μl磷酸盐缓冲液混合;
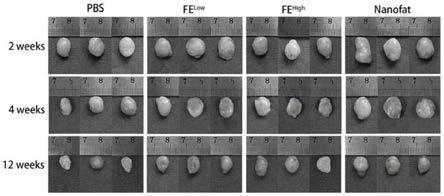
24.纳米脂肪组:取500μl脂肪和50μl纳米脂肪混合;
25.fe
‑
low组:取500μl脂肪、7.5μl无细胞脂肪提取物和42.5μl磷酸盐缓冲液混合;
26.fe
‑
high组:取500μl脂肪、37.5μl无细胞脂肪提取物和12.5μl 磷酸盐缓冲液混合;
27.步骤二、选取36只实验小鼠,将实验小鼠分为两组,在每组实验小鼠中的每只实验小鼠的背部区域选取两处注射点分别注射两种处理液;
28.步骤三、将每组注射完成的实验小鼠均分为三批,分别在第2周、第 4周和第12周处死小鼠,获得脂肪移植物进行称重;
29.步骤四、选取12只实验小鼠,在每只实验小鼠背部区域的左右两侧分别注射纳米脂肪组处理液,在注射后的第1、7、14、21、28天,分别在实验小鼠背部左侧注入磷酸盐缓冲液组处理液、在实验小鼠背部右侧注入 fe
‑
high组处理液,并在注射后第12周处死小鼠,获得脂肪移植物进行称重;
30.步骤五、分别取步骤三和步骤四获得的脂肪移植物,进行he染色分析、 massion染色分析、免疫组化染色分析、anti
‑
cd31染色分析、tunel染色分析、脂周蛋白染色分析和anti
‑
ki67染色分析。
31.作为本发明的一种优选方案,所述步骤四中,注射磷酸盐缓冲液组处理液及fe
‑
high组处理液时,分别在纳米脂肪组处理液注射点的周围4点及正上方点五个点位各注射10μl。
32.综上所述,本发明具有如下有益效果:
33.本发明通过实施例提供一种无细胞脂肪提取物及其制备方法、分析方法,该无细胞脂肪提取物中包含igf
‑
1、tgf
‑
β1、hgf、vegf、pdgf、bfgf、 bdnf、gdnf等多种细胞因子,在脂肪填充时,将颗粒脂肪与无细胞脂肪提取物按比例混合移植可以提高脂肪移植成活率,减少回填脂肪坏死、溶解、吸收、纤维化、钙化、囊肿结节等问题,大幅度降低术后肿胀的程度,缩短术后恢复期;与已有的脂肪组织提取物及其衍生物和prp技术在质量控制、安全性、技术保存、疗效、反复注射方面均有不同程度问题相比,本发明为避免类似问题,通过蛋白检测确定因子浓度、数量,且在制备过程中无需经过细胞培养,在产物不存在细胞,可以避免伦理安全问题,不会产生异体排斥反应,长期保存不需要冻存保护剂,不引入外源性物质,且因为可以准确检测因子数量,可以安全、定量反复注射治疗。
附图说明
34.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
35.图1a为本发明实施例三中脂肪细胞存活率测试中在第2周、第4周和第12周获得的脂肪移植物的大小对比图。
36.图1b为本发明实施例三中脂肪细胞存活率测试中在第2周获得的脂肪移植物的重量对比图。
37.图1c为本发明实施例三中脂肪细胞存活率测试中在第4周获得的脂肪移植物的重量对比图。
38.图1d为本发明实施例三中脂肪细胞存活率测试中在第12周获得的脂肪移植物的重量对比图。
39.图2a为本发明为本发明实施例三组织学评估中经he染色后的对照图。
40.图2b为本发明为本发明实施例三组织学评估中he染色后的统计图。
41.图2c为本发明为本发明实施例三组织学评估中经脂周蛋白染色后的对照图。
42.图2d为本发明为本发明实施例三组织学评估中经脂周蛋白染色后的统计图。
43.图3a为本发明为本发明实施例三无细胞脂肪提取物促进作用分析中经tunel染色后每视野cd31阳性血管数的统计图。
44.图3b为本发明为本发明实施例三无细胞脂肪提取物促进作用分析中经anti
‑
cd31染色后每视野cd31阳性血管数的对比图。
45.图3c为本发明为本发明实施例三无细胞脂肪提取物促进作用分析中经anti
‑
cd31
染色后每组平均凋亡细胞数的统计图。
46.图3d为本发明为本发明实施例三无细胞脂肪提取物促进作用分析中经tunel染色后每组平均凋亡细胞数的对照图。
47.图3e为本发明为本发明实施例三无细胞脂肪提取物促进作用分析中经anti
‑
ki67染色后阳性增殖细胞数的统计图一。
48.图3f为本发明为本发明实施例三无细胞脂肪提取物促进作用分析中经anti
‑
ki67染色后阳性增殖细胞数的统计图二。
49.图3g为本发明为本发明实施例三无细胞脂肪提取物促进作用分析中经anti
‑
ki67染色后阳性增殖细胞数的统计图三。
50.图3h为本发明为本发明实施例三无细胞脂肪提取物促进作用分析中经anti
‑
ki67染色后阳性增殖细胞数的统计图四。
51.图4a为本发明为本发明实施例三无细胞脂肪提取物和纳米脂肪协同作用分析中移植后第12周获得的脂肪移植物的大小对比图。
52.图4b为本发明为本发明实施例三无细胞脂肪提取物和纳米脂肪协同作用分析中移植后第12周获得的脂肪移植物的重量对比图。
53.图4c为本发明为本发明实施例三无细胞脂肪提取物和纳米脂肪协同作用分析中组织分析对照图。
54.图4d为本发明为本发明实施例三无细胞脂肪提取物和纳米脂肪协同作用分析中组织分析统计图。
具体实施方式
55.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
56.实施例
57.一种无细胞脂肪提取物的制备方法,包括:
58.步骤一、将去除血细胞和其他杂质的脂肪抽吸物离心分层后,取中间脂肪层得到脂肪细胞液。
59.在该步骤中,通过生理盐水对脂肪抽吸物反复洗涤以去除血细胞和其他杂质,其离心条件具体为:于1200rpm转速条件下离心3min,离心后脂肪抽吸物在离心管中分为三层,由上至下分别为上层油层、中间脂肪层及底层流体层,去除上层油层和底层流体层,收集中间脂肪层即得脂肪细胞液。
60.步骤二、将脂肪细胞液进行机械乳化后,通过冻融或震荡的方式将脂肪细胞完全破碎。
61.其中,机械乳化过程为:将两个注射器通过内径为2mm的鲁尔锁连接器连接后,使脂肪细胞液在两个注射器之间往复移动若干次,即可对脂肪细胞液进行乳化,注射器的规格可选用10ml,其中具有30个通道。
62.冻融方式具体为:将乳化后的脂肪细胞液在
‑
80℃条件下冷冻12h后,在37℃下解
冻,完成一次冻融,即可对脂肪细胞进行完全破碎。
63.震荡方式具体为:在乳化后的脂肪细胞液加入无菌破碎棒后置于超声震荡仪中,以震荡时长5min、90%功率、间隔周期30s的条件,循环震荡3 次,也可对脂肪细胞进行完全破碎。
64.步骤三、将破碎后的脂肪细胞液离心分层后,取第三层得到提取物混合液,其离心条件为:于1200rpm转速条件下离心5min,离心后脂肪细胞液在离心中分为四层,由上至下分别为第一层油层、第二层脂肪层、第三层水层及第四层细胞碎片沉淀,取第三层水层即的提取物混合液。
65.步骤四、对提取物混合液进行过滤处理以最终得到无细胞脂肪提取物 (cell
‑
free fat extract,ceffe),具体为,通过0.22μm的过滤器对提取物混合液进行过滤处理,过滤出其中的杂质后,即得无细胞脂肪提取物。
66.步骤五、通过bca法测定无细胞脂肪提取物中的蛋白质浓度及因子数量。
67.步骤六、将无细胞脂肪提取物注液使用或者冻存,具体冻存温度可选用
‑
20℃。
68.通过本发明的制备方法制得的无细胞脂肪提取物中包含igf
‑
1、tgf
‑ꢀ
β1、hgf、vegf、pdgf、bfgf、bdnf、gdnf等多种细胞因子,在脂肪填充时,将颗粒脂肪与无细胞脂肪提取物按比例混合移植可以提高脂肪移植成活率,减少回填脂肪坏死、溶解、吸收、纤维化、钙化、囊肿结节等问题,大幅度降低术后肿胀的程度,缩短术后恢复期;与已有的脂肪组织提取物及其衍生物和prp技术在质量控制、安全性、技术保存、疗效、反复注射方面均有不同程度问题相比,本发明为避免类似问题,通过蛋白检测确定因子浓度、数量,且在制备过程中无需经过细胞培养,在产物不存在细胞,可以避免伦理安全问题,不会产生异体排斥反应,长期保存不需要冻存保护剂,不引入外源性物质,且因为可以准确检测因子数量,可以安全、定量反复注射治疗。
69.实施例二
70.一种无细胞脂肪提取物,其通过实施例一所述的制备方法制得,本技术的无细胞脂肪提取物与传统使用的其他脂肪提取物相比,各性能如下表所示:
71.[0072][0073]
实施例三
[0074]
一种分析实施例二所述的无细胞脂肪提取物对脂肪移植物存活率影响的方法,包括:
[0075]
步骤一、配置四组处理液
[0076]
磷酸盐缓冲液组:取500μl脂肪和50μl磷酸盐缓冲液混合;
[0077]
纳米脂肪组:取500μl脂肪和50μl纳米脂肪混合;
[0078]
fe
‑
low组:取500μl脂肪、7.5μl无细胞脂肪提取物(fe)和42.5 μl磷酸盐缓冲液混合;
[0079]
fe
‑
high组:取500μl脂肪、37.5μl无细胞脂肪提取物(fe)和12.5 μl磷酸盐缓冲液混合。
[0080]
步骤二、选取36只实验小鼠,实验小鼠优选6周龄雄性balb/c
‑
nu裸鼠,将实验小鼠分为两组,在每组实验小鼠中的每只实验小鼠的背部区域选取两处注射点分别注射两种处理液;每个注射点移植的总体积为550μl,纳米脂肪与无细胞脂肪提取物的平均输出比为15%,在fe
‑
low组中加入了 7.5μl的无细胞脂肪提取物,这相当于在纳米脂肪组中加入了50μl的纳米脂肪,fe
‑
high组的无细胞脂肪提取物含量是fe
‑
low组的5倍。
[0081]
步骤三、将每组注射完成的实验小鼠均分为三批,分别在第2周、第4周和第12周处死小鼠,获得脂肪移植物进行称重。
[0082]
步骤四、选取12只实验小鼠,在每只实验小鼠背部区域的左右两侧分别注射纳米脂肪组处理液,在注射后的第1、7、14、21、28天,分别在实验小鼠背部左侧注入磷酸盐缓冲液组处理液、在实验小鼠背部右侧注入 fe
‑
high组处理液,在注射磷酸盐缓冲液组处理液及fe
‑
high组处理液时,分别在纳米脂肪组处理液注射点的周围4点及正上方点五个点位各注射10 μl,并在注射后第12周处死小鼠,获得脂肪移植物进行称重。
[0083]
步骤五、分别取步骤三和步骤四获得的脂肪移植物,进行he染色分析、 massion染色分析、免疫组化染色分析、anti
‑
cd31染色分析、tunel染色分析、脂周蛋白染色分析和anti
‑
ki67染色分析。
[0084]
具体实验结果如下:
[0085]
1、无细胞脂肪提取物和纳米脂肪提高了脂肪移植物的存活率
[0086]
在步骤二中,为了确定无细胞脂肪提取物对脂肪移植的影响,将人脂肪组织与磷酸盐缓冲液、纳米脂肪或无细胞脂肪提取物一起移植到实验小鼠体内,分别在第2周、第4周和第12周处死小鼠后获得脂肪移植物,其中各组具有代表性移植物的实验情况如图1a所示,在所有组中观察到移植物大小从第2周到第12周逐渐减小,这可以通过测量每个脂肪移植物的重量来证实,具体如图1b至图1d所示。由图示可知,纳米脂肪组、fe
‑
low 组和fe
‑
high组中脂肪移植物重量显著高于pbs组(p<0.05),且纳米脂肪组脂肪移植物的重量显著高于fe
‑
low组和fe
‑
high组(p<0.05),而fe
‑
low 组和fe
‑
high组之间未观察到显著差异。
[0087]
2、脂肪移植物的组织学评估
[0088]
在移植后第12周,将获得脂肪移植物用于组织学分析。经he染色分析,如图2a所示,fe
‑
high组和纳米脂肪组可见更多的小脂肪细胞;通过脂肪完整性、空泡和纤维化的统计分析证实,如图2b所示,在fe
‑
high组和纳米脂肪组中观察到的脂肪完整性高于磷酸盐缓冲液组和fe
‑
low组,且空泡更少、纤维化更少;通过脂周蛋白染色进一步分析每份样本中脂肪细胞的活力,如图2c所示,fe
‑
high组和纳米脂肪组观察到更多的脂周阳性活脂肪细胞,这两组与磷酸盐缓冲液组之间观察到具有显著差异,如图2d 所示。这些结果表明,无细胞脂肪提取物和纳米脂肪能够有效的提高脂肪移植物的存活率。
[0089]
3、无细胞脂肪提取物在体内的促血管生成、抗凋亡和促增殖作用
[0090]
采集移植后12周的脂肪移植物进行anti
‑
cd31染色分析,采集移植后 2周的脂肪移植物进行tunel染色分析和anti
‑
ki67染色分析。如图3a和图3b所示,fe
‑
high组(38.29
±
4.06)和纳米脂肪组(40.41
±
8.61)每视野中的cd31阳性血管数明显高于对照组磷酸盐缓冲液组(22.96
±
4.16)和 fe
‑
low组(26.32
±
6.28)(p<0.05),而fe
‑
high组和纳米脂肪组之间未观察到显著差异,由此表明无细胞脂肪提取物和纳米脂肪均可促进新生血管的形成。
[0091]
经tunel染色分析显示,磷酸盐缓冲液组、fe
‑
low组、fe
‑
high组和纳米脂肪组每组平均凋亡细胞数分别为27.25
±
4.53、18.89
±
6.08、12.52
ꢀ±
4.64和10.96
±
5.20,如图3c和图3d所示,fe
‑
low组、fe
‑
high组和纳米脂肪组凋亡细胞明显少于磷酸盐缓冲液组,由此表明无细胞脂肪提取物和纳米脂肪可能通过其抗凋亡活性提高脂肪移植物的存活率。
[0092]
通过anti
‑
ki67染色分析脂肪移植物中的增殖细胞。如图3e至图3h 所示,磷酸盐缓冲液组、fe
‑
low组、fe
‑
high组和纳米脂肪组中ki67阳性增殖细胞数分别为17.67
±
4.69、27.00
±
7.23、22.73
±
6.22、29.00
±
6.35 个/视野,由此可见fe
‑
low组、fe
‑
high组和纳米脂肪组的增殖细胞数量明显高于磷酸盐缓冲液组。
[0093]
4、无细胞脂肪提取物和纳米脂肪辅助脂肪移植的协同作用
[0094]
为了确定无细胞脂肪提取物和纳米脂肪是否具有协同作用以促进脂肪移植物存活,在裸鼠中用纳米脂肪移植颗粒脂肪,然后在移植后第1、7、 14、21和28天进行无细胞脂肪提取物的移植物内注射。移植后12周获得的脂肪移植物显示fe
‑
low组和fe
‑
high组中脂肪移植物的大小大于磷酸盐缓冲液中脂肪移植物的大小,这可以通过测量移植物的重量得到证实。如图4a和图4b所示,纳米脂肪+fe组(0.458
±
0.105g)的个体质量显著高于纳米脂肪+磷酸盐缓冲液组(0.295
±
0.052g)(p<0.05)。经组织学分析显示,与纳米脂肪+磷酸盐缓冲液组组相比,纳米脂肪+fe组的脂肪完整性更高,纤维化更少。如图4c和图4d所示,两组比较,差异无统计学意义。
[0095]
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1