(5R)-5-羟基雷公藤内酯醇在制备药物中的应用
(5r)-5-羟基雷公藤内酯醇在制备药物中的应用
技术领域
1.本发明属于化学制药领域,涉及(5r)-5-羟基雷公藤内酯醇在制备药物中的应用,具体涉及(5r)-5-羟基雷公藤内酯醇在制备治疗和/或预防肺动脉高压的药物中的应用。
背景技术:
2.肺动脉高压(pulmonary hypertension,ph)是指由多种异源性疾病(病因)和不同发病机制所致肺血管结构或功能改变,引起肺血管阻力和肺动脉压力升高的临床和病理生理综合征,继而发展成右心衰竭甚至死亡。
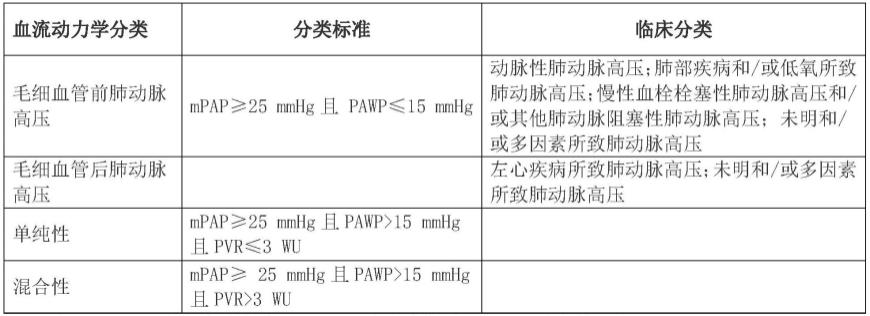
3.ph是指海平面、静息状态下,经右心导管检查(right heart catheterization,rhc)测定的肺动脉平均压(mean pulmonary artery pressure,mpap)≥25mmhg(1mmhg=0.133kpa)。根据中国肺动脉高压诊断与治疗指南2021版(中华医学杂志,2021,101(1):11-51)描述,ph的血流动力学定义及分类见如下表1:
4.表1
5.肺动脉高压(ph)的血流动力学分类
[0006][0007]
注:mpap:肺动脉平均压;pawp:肺动脉楔压;pvr:肺血管阻力。1mmhg=0.133kpa
[0008]
临床上将ph分为5大类(表2):(1)动脉性ph(pulmonary arterial hypertension,pah);(2)左心疾病所致ph;(3)肺部疾病和/或低氧所致ph;(4)慢性血栓栓塞性ph(chronic thromboembolic pulmonary hypertension,cteph)和/或其他肺动脉阻塞性病变所致ph;(5)未明和/或多因素所致ph。
[0009]
表2
[0010]
肺动脉高压(ph)的临床分类
[0011][0012]
肺动脉高压常见的治疗药物为内皮素受体拮抗剂(如波生坦、安立生坦、马昔腾坦)、pde5抑制剂(如西地那非、他达拉非、伐地那非)、可溶性鸟苷酸环化酶激动剂(如利奥西呱)、前列环素类似物和前列环素受体激动剂(如依前列醇、伊洛前列素、曲前列尼尔、司来帕格)。
[0013]
雷公藤是卫矛科雷公藤属木质藤本植物,生于山地林缘阴湿处,分布于长江流域以南各地及西南地区,其化学成分主要是二萜、三萜、倍半萜、生物碱等。近二十年来的研究表明雷公藤具有抗炎、免疫抑制、抗生育、抗肿瘤、抗菌等活性,特别是在免疫抑制作用方面,雷公藤中的雷公藤内酯醇(triptolide)具有很强的药理活性。但是雷公藤内酯醇的毒副作用,限制了其在临床上的应用。中国专利cn1223595c中发明人通过对雷公藤内酯醇构效关系的潜心研究,对雷公藤内酯醇的结构进行改造和修饰,公开了一批新型的低毒雷公藤内酯醇衍生物,可作为抗炎免疫抑制剂,用于预防和治疗自身免疫性疾病、感染性疾病等,特别是(5r)-5-羟基雷公藤内酯醇(lldt-8,其结构式如下),在多种体外试验系统和体内实验动物模型的研究中证实具有广泛的抗炎免疫抑制活性,表现为高效低毒,具有很好的安全治疗指数。
[0014][0015]
wo2019157854a1公开了(5r)-5-羟基雷公藤内酯醇在治疗和/或预防艾滋病异常免疫激活或者艾滋病免疫重建不全的药物中的应用。目前尚未有(5r)-5-羟基雷公藤内酯醇在治疗肺动脉高压方面的相关报道。
技术实现要素:
[0016]
本发明提供一种(5r)-5-羟基雷公藤内酯醇在制备药物中的应用,特别是治疗和/或预防肺动脉高压的药物中的应用。
[0017]
一方面,本发明提供了(5r)-5-羟基雷公藤内酯醇在制备治疗和/或预防肺动脉高压的药物中的应用。
[0018]
在一个实施方式中,所述的肺动脉高压为中度肺动脉高压。
[0019]
在另一个实施方式中,所述的肺动脉高压为严重的肺动脉高压。
[0020]
中度和严重的肺动脉高压的定义可以在以下文献中找到:carman,b.l.,et all.plexiform arteriopathy in rodent models of pulmonary arterial hypertension.am.j.pathol.189,1133
–
1144(2019);sztuka k,jasinka-stronchein m.animal models of pulmonary arterial hypertension:a systematic review and meta-analysis of data from 6126animals.pharmacol res.2017;125:201-214;chew m,batres sa,rios blanco jj.update on pulmonary arterial hypertension pharmacotherapy.rev clin esp.2016;216(8):436-444.1;tuder rm,et al.the pathobiology of pulmonary hypertension endothelium.clin chest med.2001;22(3)。
[0021]
本发明应用中,对中度肺动脉高压的治疗具有以下一个或多个技术效果:
[0022]
a)减弱肺动脉高压中的血管重塑;
[0023]
b)降低肺动脉高压模型中的血管内侧壁厚度;
[0024]
c)降低ph发展过程中α-sma和pcna蛋白表达;
[0025]
d)降低涉及血管重构的肺动脉高压中促炎蛋白的表达。
[0026]
本发明应用中,对严重的肺动脉高压的治疗具有以下一个或多个技术效果:
[0027]
a)防止严重pah中新内膜形成并减弱血管重塑;
[0028]
b)减少ki67染色;
[0029]
c)减少肺小动脉上骨桥蛋白的表达;
[0030]
d)减少了与新内膜形成和血管重塑有关的蛋白质表达;
[0031]
e)下调与血管重构和炎症反应有关基因转录的mrna表达;
[0032]
f)抑制microrna 181a-5p的下调。
[0033]
本发明应用中,所述的药物的形式无特殊限制,可以为固体片剂、液体、凝胶、半流质或者气雾等各种物质形式,较佳地为固体片剂。
[0034]
本发明应用中,优选地,所述的(5r)-5-羟基雷公藤内酯醇为所述药物的有效成分之一或者唯一有效成分。
[0035]
另一方面,本发明提供了(5r)-5-羟基雷公藤内酯醇在制备减弱肺动脉高压中的血管重塑的药物中的应用。
[0036]
本发明应用中,优选地,所述的(5r)-5-羟基雷公藤内酯醇为所述药物的有效成分之一或者唯一有效成分。
[0037]
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
[0038]
本发明所用试剂和原料均市售可得。
[0039]
本发明的积极进步效果在于:
[0040]
本发明使用(5r)-5-羟基雷公藤内酯醇(lldt-8)进行实验后发现,其在多种体内试验的研究中证实可以减轻中度肺动脉高压的发展和减轻严重肺动脉高压的发展。
[0041]
在上文中已经详细地描述了本发明,但是上述实施方式本质上仅是例示性,且并不欲限制本发明。此外,本文并不受前述现有技术或发明内容或以下实施例中所描述的任何理论的限制。
[0042]
除非另有明确说明,在整个申请文件中的数值范围包括其中的任何子范围和以其中给定值的最小子单位递增的任何数值。除非另有明确说明,在整个申请文件中的数值表示对包括与给定值的微小偏差以及具有大约所提及的值以及具有所提及的精确值的实施方案的范围的近似度量或限制。除了在详细描述最后提供的工作实施例之外,本技术文件(包括所附权利要求)中的参数(例如,数量或条件)的所有数值在所有情况下都应被理解为被术语“大约”修饰,不管“大约”是否实际出现在该数值之前。“大约”表示所述的数值允许稍微不精确(在该值上有一些接近精确;大约或合理地接近该值;近似)。如果“大约”提供的不精确性在本领域中没有以这个普通含义来理解,则本文所用的“大约”至少表示可以通过测量和使用这些参数的普通方法产生的变化。例如,“大约”可以包括小于或等于10%,小于或等于5%,小于或等于4%,小于或等于3%,小于或等于2%,小于或等于1%或者小于或等于0.5%的变化。
附图说明
[0043]
图1显示连续施用lldt-8对中度肺动脉高压的发展影响图。其中,a和b分别为第14天和第28天的血流动力学评估中t-8(mct+lldt8)、vh(mct+空白治疗(mct+vh(赋形剂)))与正常对照组的比较图;c和d分别显示了通过富尔顿指数(rv/lv+s)评估的右心室肥大(rvh)。数据表示为均值和标准差。每条n=5。n.s.=不显著;*p《0.05,**p《0.01,***p《0.001(单向anova)。
[0044]
图2显示lldt-8治疗对ph模型中的血管内侧壁厚度的影响。其中,a-c为来自正常对照的肺动脉的免疫组织化学染色,以α-平滑肌肌动蛋白(α-sma)阳性染色作为参考,以与相似大小的动脉进行比较;d-f为来自vh(mct+空白治疗(mct+vh,野百合碱加赋形剂
(dmso)))的大鼠的肺小动脉的免疫组织化学染色;g-i为来自t-8(mct+lldt8(野百合碱加lldt-8))治疗的大鼠的肺小动脉的免疫组织化学染色。j为在小于100μm的动脉中,比较mct+空白治疗和lldt-8处理的大鼠,血管内侧壁厚度的百分比。k为每组4只大鼠的30个连续的内肺动脉(《60μm)的血管闭塞评分。动脉的分类如下:占总管腔闭塞的1级(《50%管腔闭塞),2级(》50%且《95%的管腔闭塞)和3级(占总管腔的闭塞》95%)。数据通过单向anova和未配对的t-test进行评估。n.s.=不显著;***p《0.001。
[0045]
图3显示lldt-8对ph发展过程中α-sma和pcna蛋白表达的影响。其中,a和b分别为第14天和第28天肺组织中α-sma和增殖细胞核抗原(pcna)蛋白表达的蛋白质印迹分析;c和d分别为调整后的α-sma相对密度,并在两个时间点用β-actin归一化pcna。每条n=5。n.s.=不显著;通过anova测试,**p《0.01,***p《0.001。
[0046]
图4显示lldt-8对涉及血管重构的肺动脉高压中促炎蛋白的表达的影响。其中,a和b分别为第14天和第28天肺组织中骨桥蛋白(opn)、p38丝裂原活化蛋白激酶(p38 mapk)、肿瘤坏死因子-α(tnf-α)和干扰素-γ(ifn-γ)蛋白表达的蛋白质印迹分析。c-f分别为调整后的opn、p38、tnf-α和ifn-γ相对密度,并在两个时间点用β-actin归一化pcna。每条n=5。n.s.=不显著;通过anova测试,**p《0.01,***p《0.001。
[0047]
图5显示连续施用lldt-8对严重的肺动脉高压的发展的影响。其中,a和b分别为在第14天和第28天用环孢菌素a(csa)、t-8(mct+lldt-8)和vh(mct+赋形剂)处理的大鼠治疗后的右心室收缩压(rvsp)。c和d为富尔顿指数(右心室/左心室+室间隔)。数据表示为平均值和标准差,每条n=5。n.s.=不显著;*p《0.05,**p《0.01,***p《0.001,通过单向方差分析。
[0048]
图6显示lldt-8对严重pah中新内膜形成以及血管重塑的影响。其中,a为用α-sma、血管内皮生长因子受体2(vegf-r2)和von willebrand因子(vwf)进行ihc染色;b为肺动脉内侧壁厚度,以百分比表示;c为肺动脉的血管闭塞评分(《60μm)。血管的评估如下:1级:《50%的管腔闭塞,没有新内膜形成;2级:》50%且《95%的管腔闭塞,有新内膜形成的证据;3级:》95%的总管腔闭塞,以及4级:存在丛状病变。数据表示为30条动脉的平均值和sd,每条n=4。n.s.=不显著;***p《0.001,通过单向方差分析。
[0049]
图7显示lldt-8在血管新生内膜增生中的作用。其中,a-d为mct注射四周后肺动脉中ki67的免疫组织化学(ihc),作为肺内皮层和内壁增生的标志物;e为ki67阳性染色/面积,以百分比(%)绘制,有30条动脉,每条n=4。所有值均表示为平均值,sd。**p《0.01;***p《0.001(单向anova)。
[0050]
图8显示lldt-8对肺动脉上的蛋白质表达以及血管周炎症的影响。其中,a为大鼠正常肺组织中骨桥蛋白(opn)的免疫组织化学(ihc)染色;b为opn的ihc在新内膜层和内壁呈阳性染色(短箭头),此外,新的微血管内皮对opn也呈阳性(长箭头),在外膜的免疫细胞也呈阳性(箭头);c和d为opn染色完全减少,伴随血管周围炎症反应,在侧面残留的ii型肺细胞(箭头)中观察到opn染色较弱。20个动脉的显微照片代表(每组n=3)。
[0051]
图9显示lldt-8对参与新内膜形成和血管重塑的蛋白质的蛋白质表达的影响。其中,a和b分别为治疗两周和四周后肺组织中α-sma、opn、vegf-r2和vwf蛋白表达的蛋白质印迹分析;c-f为用β-肌动蛋白归一化的调整后的α-sma、opn、vegf-r2和vwf的相对密度。所有值均表示为均值和标准差;每个小节中n=4。通过anova测试,*p《0.05,**p《0.01,***p《
0.001。
[0052]
图10显示lldt-8对严重肺动脉高压中与血管重塑和炎症反应有关基因转录的mrna和microrna的影响。其中,a为vegf-r2 mrna表达,b为nfκb p65 mrna表达,c为microrna 181a-5p表达,它们通过肺组织的半定量rt-pcr分析。用gapdh标准化每个靶mrna的表达。对于用u6标准化的microrna(一式三份,n=3),结果表示为倍数变化(2-δδct
)。所有值均表示为均值和标准差;n=3。通过anova测试,*p《0.05,**p《0.01,***p《0.001。
具体实施方式
[0053]
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
[0054]
以下(5r)-5-羟基雷公藤内酯醇(lldt-8)按照专利cn1223595c中描述的方法制备所得。
[0055]
实施例1(5r)-5-羟基雷公藤内酯醇减弱肺动脉高压中的血管重塑试验方法如下:
[0056]
动物:无特定病原体的sprague-dawley雄性大鼠(9周龄,体重200-250g)购自湖南湖景精达实验动物有限公司,并饲养在标准12小时反向昼/夜循环且温度为26℃的环境中,可自由饮水摄食。
[0057]
实验分组:将大鼠随机分为vh组(mct+空白治疗组(mct+vh))(n=10),t-8组(mct+lldt-8)(n=10)和正常对照组(dmso的生理盐水)(n=8)。
[0058]
给药:将60mg monocrotaline(mct,野百合碱,购买自sigma-aldrich)溶解于1ml二甲亚砜(dmso,wellbiology,中国长沙)中,并用生理盐水稀释,直到浓度达到10mg/ml。vh组:将上述溶解于dmso中的mct给予大鼠单次皮下注射给药(60mg/kg体重),之后每天注射dmso生理盐水给药4周。t-8组:将5mg lldt-8溶解于0.5ml dmso中,并用生理盐水稀释,直至达到1mg/ml的浓度,然后如上所述从注射mct当天开始每天给予大鼠腹膜内注射给药lldt-8 4周(5mg/kg体重)。正常对照组:dmso的生理盐水由0.5ml dmso+4.5ml无菌生理盐水组成,每天给予大鼠腹膜内注射给药dmso的生理盐水4周(5ml/kg体重)。
[0059]
血流动力学测量:注射给药后的第14天和第28天,所有组均进行右心导管检查(rhc),以测量右心室收缩压(rvsp)。在用水合氯乙酰胆碱(中国长沙韦尔生物科学公司)腹膜内注射(300mg/kg)镇静下,用6fr插管进行气管插管。使用经肝素/盐溶液(中国长沙韦尔生物科学公司)处理过的3f pe-50(taobao.com/中国新航店铺/)通过右颈外静脉进入右心室,并连接到压力传感器(ypj01,成都仪器厂,中国成都),偶联血液动力学监测仪(xinsoft mdt infotech,中国上海)以持续记录5分钟rvsp。然后通过放血对所有大鼠进行安乐死,并收集右肺(用于组织学和形态测量)和心脏。解剖右肺下叶,速冻并保存在-80℃的温度下直至进行分析。
[0060]
组织学检测样本制备:右心室(rv)与左心室(lv)分开,且使室间隔(is)仍附着在lv上。rv重量与lv+s重量之比(富尔顿指数)被认为是右心室肥大的指数。
[0061]
肺组织用4%多聚甲醛固定,石蜡包埋并修整至5μm,用于免疫组织化学,将玻片在3%过氧化氢中淬灭,然后使用微波炉在ph 9.0的10mm柠檬酸盐缓冲液中回收抗原(bbi生命科学,上海,中国)。在一抗孵育前,先将玻片用5%山羊血清封闭,然后用一抗(抗α-sma抗
体,1:200稀释)于4℃孵育过夜;在使用hrp修饰的山羊抗兔igg二抗孵育后,用dab显色后在室温下用显微镜进行检测。用苏木精复染;脱水槽增加了酒精和二甲苯的百分比,并被覆盖。所有显微照片均由两名不了解研究目的的病理学家进行了评估。
[0062]
蛋白质印迹分析:将冷冻的肺组织匀浆并以13,000rpm离心30分钟。使用bca蛋白质测定试剂盒(cwbiotech,中国)测量上清液的蛋白质含量。取含有20μg蛋白质的提取物上清,变性后在10%和12%(sds-page)凝胶上电泳分离。将凝胶上的蛋白在湿转条件下电转至聚偏二氟乙烯膜上(280ma电转90分钟)。封闭后,将膜在封闭缓冲液中用兔多克隆抗体4℃孵育过夜(抗体稀释条件如下:α-sma1:1000;opn 1:1000;tnf-α1:1000,ifn-γ1:1000,β-肌动蛋白1:5000)。然后将膜与在封闭缓冲液中用1:2000稀释的山羊抗兔hrp-igg在室温下孵育1小时。使用增强的化学发光检测系统(美国加利福尼亚州bio-rad)显色,并通过光密度法进行定量。
[0063]
数据分析:使用graphpad棱镜v7.00进行数据分析。(graphpad软件,美国加利福尼亚)使用单向方差分析和未配对的t检验来确定组平均值之间的差异。显著性水平设定为p≤0.05。数据报告为平均值
±
标准差。
[0064]
实验结果:
[0065]
1.连续服用lldt-8可减轻中度肺动脉高压的发展
[0066]
与正常对照(nc)大鼠相比,空白治疗的大鼠(mct+vh,vh组)的rvsp持续显著增加(图1:a和b;42
±
1.5mmhg和53.5
±
4mmhg对26.67
±
0.57mmhg;p《0.001)。尽管空白治疗组早期富尔顿指数和正常对照组之间没有差异(图1:c,0.30
±
0.1vs.0.31
±
0.03;p=0.097),但在第28天,空白治疗组的富尔顿指数较正常对照组显著升高(图1:d,0.5
±
0.2vs 0.3
±
0.1;p《0.001)。从mct处理当日开始连续给药lldt-8(5mg/kg,qd)14天的大鼠,与正常对照组相比,明显减少了rvsp的增长(图1:a和b;38
±
1.6vs.42
±
1.5mmhg;p=0.049)。此外,在第28天,与空白治疗组大鼠相比,用lldt-8治疗的大鼠(t-8组)继续减弱了rvsp的增加(图1:b,42.5
±
2.5vs.53.5
±
4.04mmhg;p《0.003)。
[0067]
2.lldt-8治疗可降低ph模型中的血管内侧壁厚度
[0068]
经α-sma阳性染色后可以看出,与nc大鼠相比,造模-空白治疗组大鼠的肺小动脉(》100μm)内侧壁厚度增加(图2:a和d),而不会引起血管闭塞。此外,与nc动物相比,造模-空白治疗组(vh组)大鼠的远端肺小动脉(《60μm)显示出明显的内壁肌肉化(图2:b和e;c和f),在此水平上,更经常观察到血管闭塞:与nc大鼠相比,造模-空白治疗组(vh组)中血管闭塞评分显示3级(76%),2级(21%)和1级(3%)的小动脉百分比显著增加(附图2:k)。而在每天用lldt-8治疗四周后(在第28天),t-8组中》100μm和《60μm的肺小动脉的血管内侧壁肌肉化明显减弱(附图2:g-i)。从数量上讲,与造模-空白治疗组(vh组)大鼠相比,用lldt-8治疗后显著降低了内侧壁厚度百分比(附图2:j;分别为下降77.29%和98.25%,p《0.001)。这种降低也明显影响了血管闭塞评分(图2:k),表明lldt-8治疗增加了1级血管的数量(91%;p《0.001),并减少了2级血管的数量(4%);p《0.001)。另外,肺小动脉没有发展出完全的管腔阻塞。
[0069]
3.lldt-8降低ph发展过程中α-sma和pcna蛋白表达
[0070]
western-blot结果显示:在造模后的第14天和第28天,与nc相比(图3:a和b),造模-空白治疗大鼠(vh组)中肺组织蛋白中α-sma和pcna蛋白表达显著增加(图3:c和d;p《
0.001)。同样,在用lldt-8治疗后的早期四个星期即可显著减弱α-sma(p《0.001)和pcna(p《0.001)的蛋白表达,且在4周之后α-sma1(p《0.001)和pcna(p《0.001)蛋白表达仍能保持较低水平(图3:c和d)。
[0071]
4.lldt-8降低肺动脉高压血管重构中促炎症相关蛋白的表达
[0072]
pah的病理生理涉及炎症反应失调。肺组织的蛋白质印迹显示,与nc组大鼠相比,造模-空白治疗组大鼠(vh组)的主要促炎蛋白(图4:a和b)例如opn(p《0.001),p38-mapk(p《0.001),tnf-α(p《0.01)和ifn-γ(p《0.001)均增加(图4:c-f)。而用lldt-8治疗后,opn、p38 mapk、ifn-γ和tnf-α(图4:c-f;p<0.001;p<0.001;p<0.001;p<0.05)的蛋白表达均减少。
[0073]
结论:以上结果表明,lldt-8可通过抗炎和抗增殖机制最小化ph的发展并减弱血管重塑,下调opn、tnf-α、ifn-γ和p38mapk的蛋白表达。
[0074]
实施例2:(5r)-5-羟基雷公藤内酯醇通过减少血管重塑和防止新内膜形成而减轻严重肺动脉高压的发生
[0075]
动物:无特定病原体的sprague-dawley雄性大鼠(体重200-250g)购自湖南湖景精达实验动物有限公司,并饲养在标准的12小时昼/夜循环且20℃的环境温度中,并可自由饮水摄食。
[0076]
实验组:将大鼠随机分为正常对照组(n=8)和造模组(n=30)。正常对照组进行假手术和dmso注射。造模组大鼠接受了左肺切除术,一周后接受了一次野百合碱皮下注射。造模组大鼠随机分成三组,从造模当天开始每天接受腹膜内注射(i.p.)lldt-8(t-8;n=10),环孢霉素a(csa;n=10)或空白(vh;n=10)。
[0077]
左肺切除术:为了进行左肺切除术,将大鼠用3-5%的异氟烷麻醉(rwd生命科学,中国)。1.5-2%的诱导/维护(美国midmark corporation,matrx),然后使用6f套管与啮齿动物呼吸机(中国成都市成都泰盟软件有限公司)相连,经口气管插管,潮气量为10ml/kg/bw;呼吸频率80/min;pep 1cm h2o,o2流量2l/min。在常规准备好手术区域之后,通过第4前肋间隙进入胸腔。将左肺从其韧带上释放出来并从腔中抽出。短暂中断通气30s,用3-0可吸收缝合线(上海浦东金环医学中心,中国上海)缝合整块左肺门,然后切开左肺。通过第6肋间隙将24g血管导管引入到横隔膜上方的左胸腔中,以在闭合后使胸腔内压力相等。胸腔以第4和第5肋骨周围的3-0可吸收缝线以及肌肉层闭合。停止异氟烷给药后,将大鼠拔管,腹膜内注射无菌生理盐水(ns,3ml),并在温暖的垫子上恢复。
[0078]
给药:将60mg野百合碱溶于1ml二甲亚砜(dmso,well-biology,中国长沙)中,并用生理盐水溶液稀释,直到浓度达到10mg/ml。vh组:将上述溶解于dmso中的野百合碱给予大鼠单次皮下注射给药(60mg/kg体重),之后每天注射dmso给药4周。t-8组:将5mg lldt-8溶解在0.5ml dmso中,并用生理盐水溶液稀释直至达到1mg/ml的浓度,然后如上所述从注射野百合碱当天开始每天给予大鼠腹腔注射lldt-8 4周(qd)(5mg/kg体重)。csa组:将25mg csa(美国密苏里州圣路易斯的sigma-aldrich)溶于0.5ml dmso中,并用生理盐水溶液稀释直至浓度达到1mg/ml,然后如上所述从注射野百合碱当天开始每天给予大鼠每日腹腔注射csa(25mg/kg体重)。正常对照组:dmso的生理盐水由0.5ml dmso+4.5ml无菌生理盐水组成,每天给予大鼠腹膜内注射给药dmso的生理盐水4周(5ml/kg体重)。
[0079]
血流动力学测量:注射mct后的第14天和第28天,所有组均进行右心导管检查
(rhc),以测量右心室收缩压(rvsp)。在用水合氯乙酰胆碱进行腹膜内麻醉镇静下,并用6fr插管进行气管插管。使用3f pe-50(已预先用肝素/盐溶液冲洗(中国长沙韦尔生物科学公司)与压力传感器(ypj01,成都仪表厂)接触,通过右颈外静脉进入右心室,偶联血流动力学监测仪(xinsoft mdt infotech,中国上海)以记录持续5分钟的rvsp。然后通过放血对所有大鼠进行安乐死,并收集右肺(用于组织学和生化检查)和心脏。解剖右肺下叶,速冻并保存在-80℃的温度下直至进行分析。
[0080]
组织学准备:右心室(rv)从左心室(lv)切开,室间隔(is)仍附着在lv上。rv重量/lv+s重量之间的比率(富尔顿指数)被认为是右心室肥大的指数。
[0081]
肺组织用4%多聚甲醛固定,石蜡包埋并修整至5μm,苏木精-伊红染色和免疫组织化学(ihc)。对于ihc,将玻片在3%过氧化氢中淬灭,然后使用微波容器在ph 9.0的10mm柠檬酸盐缓冲液中回收抗原(bbi life sciences,上海,中国)。对于一抗孵育,首先将玻片用5%正常山羊血清封闭,然后用一抗(α-sma,1:200稀释;vegfr-2,1:200稀释;vwf,1:200稀释;opn,1:50稀释;和ki67 1:200稀释)于4℃孵育过夜。用hrp-偶联的山羊抗兔igg作为二抗孵育,并用dab显色后在室温下用显微镜进行检测。用苏木精复染;脱水槽增加了酒精和二甲苯的百分比,并被覆盖。所有显微照片均由两名不了解研究目的的病理学家进行了评估。
[0082]
蛋白质印迹分析:将冷冻的肺组织匀浆并以13,000rpm离心30分钟。使用bca蛋白质测定试剂盒(cwbiotech,中国)测量上清液的蛋白质含量。取含有20μg蛋白的上清变性,并在10%和12%的sds-page凝胶上分离。将分离的蛋白质湿转至聚偏二氟乙烯膜上(280ma,90min)。封闭印迹,并用兔多克隆抗作为一抗在4℃孵育过夜,抗体稀释如下:α-平滑肌肌动蛋白(α-sma)1:1000;α-平滑肌肌动蛋白(α-sma)1:1000。骨桥蛋白(opn)1:1000;血管内皮生长因子受体2(vegf-r2)1:1000,血管性血友病因子(vwf)1:1000,β-肌动蛋白(β-actin)1:5000(abcam ltd.,cambridge,uk)。然后将膜与在封闭缓冲液中稀释的1:2000(abcam ltd.,cambridge,uk)稀释的山羊抗兔ig hrp一起在室温下孵育1小时。使用增强的化学发光检测系统(美国加利福尼亚州bio-rad)对条带进行显色,并通过光密度法进行定量。
[0083]
半定量逆转录pcr:用trizol试剂从肺组织中分离出总rna。使用高效cdna反转录试剂盒将提取的rna反转录为cdna。使用sybr green荧光定量pcr预混液(servicebio,武汉,中国)进行实时pcr。扩增后,确定阈值循环(ct)(applied biosystems,termo,美国)。基于2
‑△△
ct
法,以甘油醛3-磷酸脱氢酶(gapdh)为内部对照,计算各基因的表达倍数变化。将microrna(mir)的表达水平标准化为通用引物mir(u6)的表达水平。引物序列列于表3。
[0084]
数据分析:使用graphpad棱镜v7.00进行数据分析。(graphpad软件,美国加利福尼亚)使用单向方差分析(anova)和未配对的t检验来确定组平均值之间的差异。显著性水平设定为p≤0.05。数据报告为平均值
±
标准差。
[0085]
实验结果:
[0086]
1.连续服用lldt8-可减轻严重肺动脉高压的发展
[0087]
与nc组大鼠相比,左肺切除术加mct注射的造模-空白治疗大鼠(vh组)出现严重的ph,第14天(50
±
3mmhg,p《0.001)和第28天(72.3
±
2.3mmhg,p《0.001)的rvsp显著升高(图5:a和b;正常对照组为27
±
1mmhg)。同样,富尔顿指数(f.i)随时间显著增加(f.i 0.40
±
0.02和0.56
±
0.12vs.0.29;p《0.006。和p《0.001)。此外,从mct注射之日(肺切除术后一周)开始,每天用lldt-8(t-8组)和csa(csa组)治疗的动物显示出较低的rvsp(图5:a;31
±
1.7mmhg和30.5
±
3.6mmhg;p《0.001)。另外,在第28天(图5:b),与造模-空白治疗组(vh组)相比,用csa(34.68
±
4.3mmhg)或lldt-8(44
±
2.1mmhg)处理的动物维持较低的rvsp(分别为p《0.001;p《0.001)。此外,与造模-空白治疗组(vh组)大鼠相比,两种治疗(lldt-8或csa)的早期,f.i维持在较低水平(分别为0.27和0.32,p《0.001)(图5:c)。
[0088]
2.lldt-8的使用可防止严重pah中新内膜形成并减弱血管重塑
[0089]
通过α-sma,vegf-r2和vwf阳性的不同免疫组织化学染色方法,相比nc组,造模-空白治疗组(vh组)大鼠在相似大小的肺动脉中具有广泛的内壁增厚和新内膜形成(图6:a)。此外,造模-空白治疗组(vh组)大鼠的内皮区室迁移到血管内侧壁(箭头,图6:a),这可被血管内侧壁的vegf-r2阳性染色所证实(箭头,图6:a),以表明血管重塑。与造模-空白治疗(vh组)大鼠相比,用lldt-8或csa处理的动物血管内侧壁厚度显著降低(图6:a和b;分别为
↓
67.98%和
↓
67.49%vs.97.31%;p《0.001)。此外,与nc组相比,造模-空白治疗组(vh组)大鼠的一级动脉比例很小(1.85%),二级动脉(43.37%),和三级动脉(48.78%)的比例很高,并且有更大的丛状病变的存在(4级;9%)血管闭塞评分(图6:c)。此外,用lldt-8或csa处理的动物显示出2级(分别为24.07%和15.38%,p《0.001)和3级(分别为22.22%和19.23%,p《0.001)的动脉百分比显著降低;并增加1级动脉的百分比(53.70%和65.38%;p《0.001)。此外,与造模-空白治疗组相比,两种治疗均抑制了丛状病变的形成。
[0090]
3.lldt-8减少ki67染色
[0091]
在第28天,用ki67进行的免疫组织化学染色显示,与nc相比,造模-空白治疗组(vh组)大鼠的内皮区室染色阳性(百分比/面积)增加,而血管内侧壁的染色强度较弱(箭头,图7:a和b)。这表明血管内膜和内壁增生。用lldt-8或csa治疗4周后(箭头,图7:c和d),两种处理均降低了ki67染色的百分比(p《0.001,附图7:e)。
[0092]
4.lldt-8减少肺小动脉上骨桥蛋白的表达
[0093]
多篇研究报告表明,opn由ecs和免疫细胞表达,并且还参与了pah的血管重塑。造模-空白治疗组(vh组)大鼠的肺小动脉中的ihc在新内膜层,新微血管的内皮以及内壁中均显示opn阳性染色(图8:b,长短箭头)。此外,在造模-空白治疗组的大鼠中,在血管周区域发生了重要的炎症反应,并伴有被opn染色阳性的免疫细胞(图8:b,箭头)。用lldt-8或csa处理后,pa中opn的表达与血管周围炎症反应完全相同(图8:c和d)。
[0094]
5.lldt-8减少了与新内膜形成和血管重塑有关的蛋白质表达
[0095]
肺组织匀浆的western-blot结果显示,造模-空白治疗组(vh组)大鼠增加了参与血管重塑,新内膜形成和炎症的蛋白质的表达,例如α-sma(p《0.001),opn(p《0.001),vegf-r2(与nc相比,p《0.005)和vwf(p《0.001)(图9:a和b)。此外,在用lldt-8治疗两周后(第14天),α-sma(p《0.001),opn(p=0.006),vegf-r2(p=0.002)和vwf(p《0.001)的蛋白表达显著下调。但是,用csa处理仅显著下调了opn蛋白的表达(图9:d;p《0.001)。用lldt-8(图9:c-f)治疗4周后,α-sma(p=0.001)、opn(p=0.02)、vegf-r2(p《0.001)和vwf(p《0.001)的蛋白表达与造模空白组和用csa治疗的大鼠相比较低。
[0096]
6.lldt-8下调严重肺动脉高压中与血管重构和炎症反应有关基因转录的mrna表达
[0097]
在第28天,相对于nc(0.28和0.02倍),来自造模-空白治疗组(vh组)大鼠的肺组织的半定量rt-pcr显示vegf-r2 mrna表达(图10:a;0.78倍变化;p《0.003)和nf-κb mrna表达(图10:b;0.75倍变化;p<0.001)显著增加。用lldt-8处理后,vegf-r2 mrna表达显著下调(图10:a,0.30倍变化,p=0.003),同样用csa处理(0.36倍变化,p=0.006)。此外,nf-κbp65mrna表达被lldt-8(图10:b;0.03倍变化,p=0.002)和csa(0.01倍变化,p=0.002)降低。
[0098]
7.lldt-8抑制了严重ph患者中microrna 181a-5p的下调
[0099]
micro rna-181(mir-181)家族通过控制关键信号传导途径(例如nf-κb信号传导的负调节,内皮细胞激活和免疫细胞稳态)在血管炎症中发挥作用。结果显示,与nc大鼠相比(3.97倍变化),造模-空白治疗组(vh组)大鼠中mir-181a-5p的表达显著下调(图10:c;1.20倍变化,p=0.001)。与造模-空白治疗组处理的动物相比,用lldt-8治疗四周后,mir-181a-5p表达的下调减弱了(2.10倍变化,p=0.009)。同时,用csa治疗并没有使mir-181a-5p表达的下调被抑制(图10:c;1.49倍变化;p=0.37)。
[0100]
实验结论:
[0101]
lldt-8显示出可通过减少血管壁重塑来减少严重的肺动脉高压的发展,方法是减少内侧壁的厚度,通过下调vegfr-r2 mrna表达和opn,α-sma,vegf-r2和ki67蛋白表达来预防新内膜和丛状病变的形成。
[0102]
最终,lldt-8可以通过靶向其mrna表达和其基因调控因子mir-181-a5p来参与nf-κb激活的转录调控,而后者参与体内实验性严重肺动脉高压的血管重塑和炎症反应。
[0103]
表3.用于rt-pcr的引物的寡核苷酸序列:
[0104][0105]
r=mrna;s=sense;a=antisense;mir=micro rna
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1