一种纳米颗粒组合物递送系统的制备方法与流程
一种纳米颗粒组合物递送系统的制备方法
1.本技术是申请日为2019年05月22日,申请号为201910428250.8,发明名称为“一种纳米颗粒组合物递送系统、制备方法及其用途”的中国专利申请的分案申请。
技术领域
2.本发明属于纳米生物材料领域,涉及一种纳米颗粒组合物递送系统的制备方法。
背景技术:
3.肿瘤的发生机制十分复杂,通常是由于某些原癌基因的异常激活、抑癌基因或凋亡相关基因的失活而导致细胞恶性增殖和凋亡失调,这种复杂性使得肿瘤的有效治疗一直难以取得突破性进展。
4.不同作用机制的化学药物和治疗基因的联合使用,不仅可以协同性的提高治疗效果,还可以增加癌细胞突变所需要克服的遗传障碍,并延迟肿瘤细胞对药物的适应性。同时可以有希望解决癌症化疗药物的多药抗药性问题,因此,近年来,众多基础研究将焦点转移到构建化疗药物与治疗基因的联合递送体系。目前,构建药物与基因共递送系统的常见策略包括:将疏水性药物与基因通过胶束同时包裹于核心,或将药物键合到阳离子载体材料上,然后与基因压缩得到共递送体系。这些策略能够将药物与基因装载于同一纳米递送系统中,具有良好的药物与基因协同治疗作用,但存在许多缺点,如组装过程复杂,使用有机溶剂,不易控制药物与基因的负载比例等。
5.中国发明专利cn 103179952 b公开了基于纳米颗粒的肿瘤靶向药物递送,提供包含脂质体纳米颗粒的水性分散体的水性肿瘤靶向性脂质体纳米颗粒组合物。所述纳米颗粒优选包封抗癌化疗剂,可将其加至预形成的脂质体组合物或者可在脂质体形成期间掺入脂质体内。脂质体纳米颗粒包含与一种或更多种其它形成胶束或小泡的脂质材料混合的legumain靶向性脂质,所述组合物呈分散在水性载体中的纳米颗粒脂质体形式。优选的肿瘤靶向性脂质体纳米颗粒组合物包含(a)legumain靶向性脂质组分,(b)两性离子脂质组分;(c)氨基取代的脂质组分;(d)中性脂质组分和(e)聚乙二醇
‑
缀合的脂质组分。所述legumain靶向性脂质组分包含与legumain
–
结合部分共价连接的疏水脂质部分。
技术实现要素:
6.本发明的目的在于提供一种纳米颗粒组合物递送系统的制备方法,制得的递送系统具有包封率高、稳定性好、药物及基因的载量大、粒径变化较小、细胞摄取效率和摄取率高等优点,有效降低递送系统与血清中蛋白的相互作用,提高血清作用下的细胞转染效率以及延长体内循环时间,利于递送系统到特定靶位置及细胞的摄取,从而发挥疗效作用。
7.本发明为实现上述目的所采取的技术方案为:
8.提供一种纳米颗粒组合物递送系统的制备方法,包括如下步骤:
9.采用薄膜分散法将阳离子脂质体原料与抗肿瘤药物制成载抗肿瘤药物的阳离子脂质体;
10.采用混合孵育法将所述载抗肿瘤药物的阳离子脂质体和gapdh
‑
sirna混合制备纳米颗粒组合物递送系统;
11.上述阳离子脂质体原料包含2
‑
二油酰基羟丙基
‑3‑
n,n,n
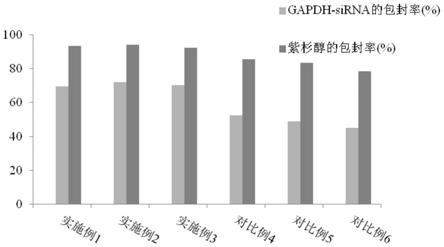
‑
三甲铵氯、植物固醇、双丙酮
‑
d
‑
半乳糖和二油酰基磷脂酰乙醇胺;
12.上述阳离子脂质体原料中2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯、植物固醇、双丙酮
‑
d
‑
半乳糖和二油酰基磷脂酰乙醇胺的摩尔比为1:0.8
‑
1.2:0.2
‑
0.5:2.8
‑
3.2。
13.脂质体的制备方法包括逆向蒸发法、乙醇注入法、薄膜分散法等,乙醇注入法中的乙醇不易除尽,且不适于大量制备;逆向蒸发法适用于水溶性药物。本发明制备方法将阳离子脂质体内部装载药物,同时阳离子脂质可压缩sirna形成带正电的脂质体/sirna复合物,自组装过程,过程简单,易于操作和放大生产。
14.攻克癌症的难题之一就是肿瘤的多药耐药性,肿瘤中耐药细胞多在低氧环境之中,而在低氧环境下肿瘤细胞生存所需的atp主要来源于糖酵解,而且大部分多药耐药蛋白皆属于atf结合型转运体家族,其对紫杉醇分子的外排作用同样依赖于atp的供给,因此控制低氧条件下肿瘤细胞的糖酵解就能够抑制耐药蛋白功能的启动。3
‑
磷酸甘油醛脱氢酶(gapdh)在糖酵解中具有关键作用,而且在低氧环境中能够高度表达,gapdh
‑
sirna能够抑制gapdh的表达从而达到基因治疗的作用。阳离子脂质体(cationc liposome,cl)是目前研究的最多的药物与sirna共递送载体之一。以阳离子脂质体作为药物与sirna的共载载体,其中,脂质体内部装载抗肿瘤药物,阳离子脂质可以压缩sirna形成带正电的脂质体与sirna复合物,组装过程简单。脂质体的膜材、比例、用量对于稳定性与包封率有着关键的作用,长链的脂质可増强双分子层间的凝聚力,促进膜稳定,减小药物渗漏。不同于其他磷脂,二油酰基磷脂酰乙醇胺的头部为比较疏水且体积小的伯胺基,两条疏水端为较长的c18不饱和脂肪链,这种特殊的结构既能够使其用于基因转染,又能包裹难溶性药物并促进溶酶体逃逸。2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯的头部为亲水的季胺基,体积较大。2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯插入到二油酰基磷脂酰乙醇胺中有利于磷脂双分子层的形成,提高阳离子脂质体的亲水能力,除此之外,还能提供大量的表面正电荷,增强黏度,减少脂质体间发生融合和絮凝的概率,提高脂质体的物理稳定性。本发明阳离子脂质体用原料植物固醇和双丙酮
‑
d
‑
半乳糖一方面能够嵌入到二油酰基磷脂酰乙醇胺中,阻碍其相邻分子间的相互作用力,有利于调节脂质体的刚性和流动性,提高脂质体的包封率和稳定性,且降低了双分子层膜的弯曲常数及曲率自由能,稳定阳离子脂质体的双层膜结构的同时使纳米颗粒组合物递送系统趋向于形成更小的半径,提高细胞对纳米颗粒组合物递送系统的摄取率;另一方面能提高阳离子脂质体带有的正电荷量,达到较高的电位,使递送系统相互之间产生的较强静电排斥作用,从而避免递送系统的融合、聚集,使制得的递送系统的粒径变化较小,稳定性高,且正电荷量的提高使得脂质体能够携带更多的gapdh
‑
sirna,进而提高递送系统的载药量;此外,还能够提高脂质体与抗肿瘤药物尤其是紫杉醇的结合程度,由此提高递送系统中的抗肿瘤药物的载药量,最终提高细胞摄取效率。胆固醇在人体正常细胞膜上摩尔比为0.3左右,胆固醇含量的过高或过低影响细胞膜的物理性质,使细胞不能维持正常的生命活动,本发明采用植物固醇和双丙酮
‑
d
‑
半乳糖替换胆固醇,还能减少胆固醇对人体的危害,尤其能提高胆固醇过高患者的用药安全。
15.本发明利用同一载体装载抗肿瘤药物和gapdh
‑
sirna进行联合给药,本发明制得
的递送系统具有包封率高、稳定性好、载药量大、粒径变化较小、细胞摄取效率和摄取率高等优点,能够实现两者药物动力学的同步化,该药物传递系统可以同时将抗肿瘤药物和gapdh
‑
sirna送至细胞内部,使抗肿瘤药物和gapdh
‑
sirna在同一细胞中协同起效,提高抗癌的效果。
16.在一些实施方式中,抗肿瘤药物与脂质体原料中二油酰基磷脂酰乙醇胺的质量比为1:6
‑
7。在一定范围内,药物包封率随着药物和脂质的质量比的降低而升高,二油酰基磷脂酰乙醇胺作为主要的脂质成分,当药物的质量大于二油酰基磷脂酰乙醇胺时,水化后便出现部分聚沉的现象;当药物与二油酰基磷脂酰乙醇胺的比例在1:6
‑
7时,包封率较高;继续增加二油酰基磷脂酰乙醇胺的用量,包封率的增长趋缓,且水化时间增长,难度增加。
17.在一些实施方式中,阳离子脂质体与gapdh
‑
sirna的质量比为18
‑
22:1。在脂质体递送sirna的过程中,复合物的粒径大小和表面电荷的数量能够影响最终的转染效率。当阳离子脂质体质量较低时,复合物的结构松散,粒径大,结构不稳定,sirna结合率不高。随着阳离子脂质体质量的增加,脂质体吸附sirna,形成多层脂质体结构,复且合物粒径小,sirna结合率显著提高,正电荷在表面均匀分布,又有利于与带负电荷的细胞膜结合并且被摄入胞内;阳离子脂质体质量过高时,sirna与多层脂质结合的很紧密,粒径的増加趋缓,但表面分布过多的正电荷会加快复合物与细胞之间的非特异性离子相互作用,引发细胞毒性。
18.在一些实施方式中,抗肿瘤药物为紫杉醇。肿瘤的p
‑
糖蛋白(p
‑
gp)和多药耐药相关蛋白(mrp)家族对紫杉醇药物具有排外排作用,该纳米颗粒组合物递送系统可以同时将gapdh
‑
sirna和紫杉醇递送到细胞内,抑制gapdh的表达,进一步减少糖酵解产生的atp,消除耐药性,从而提高肿瘤细胞对紫杉醇的敏感性。
19.在一些实施方式中,阳离子脂质体的表面有烷基糖苷和胍基乙酸所修饰。阳离子脂质体的靶向特异性差,导致基因传递率比较低,但其结构的表面易于修饰,使用非离子表面活性剂烷基糖苷和胍基乙酸进行表面修饰,可以通过影响其物理化学性质而提高基因的载量及传递率,一方面能更进一步提高阳离子脂质体带有的正电荷量,进而提高+/
‑
电荷比例,有效提高阳离子脂质体与gapdh
‑
sirna之间的静电力的吸附作用,且使得更多的gapdh
‑
sirna进入脂质体内部,最终提高递送系统中gapdh
‑
sirna的载量;另一方面可在阳离子脂质体表面形成一个有效的水化层,有效降低递送系统与血清中蛋白的相互作用,提高血清作用下的细胞转染效率以及延长体内循环时间,且可有效地保护抵抗酶的降解,进而提高递送系统的细胞摄取效率,同时利于递送系统到特定靶位置,从而发挥疗效作用。
20.在一些实施方式中,纳米颗粒组合物递送系统的平均粒径为159.1
‑
193.7nm。200nm粒径以下的纳米粒子具有如下优点:能够减少人体网状内皮系统的吞噬;能够提高药物的靶向性,提高疗效并且降低毒性;毛细血管内皮细胞之间的间隙大于200nm,通过毛细血管时,能够被细胞组织所吸收;有利于药物运输与储藏。
21.在一些实施方式中,烷基糖苷的亲水疏水平衡值为4.5
‑
5.2。烷基糖苷对阳离子脂质体进行表面修饰,通过作用于阳离子脂质体的表面疏水性及细胞膜的通透性,来影响细胞的摄取;细胞表面有水化层和亲水糖蛋白,当疏水性过强时,会阻碍脂质体接近细胞表面当疏水性过低时,不利于细胞的粘附和内吞。使用该范围的烷基糖苷对阳离子脂质体的表面进行修饰,有利于递送系统内吞进入细胞。
22.本发明的有益效果为:
23.1)本发明制得的递送系统利用同一载体装载抗肿瘤药物和gapdh
‑
sirna进行联合给药,具有包封率高、稳定性好、载药量大、粒径变化较小、细胞摄取效率和摄取率高等优点,能够实现两者药物动力学的同步化,该药物传递系统可以同时将抗肿瘤药物和gapdh
‑
sirna送至细胞内部,使抗肿瘤药物和gapdh
‑
sirna在同一细胞中协同起效,提高抗癌的效果;
24.2)本发明用烷基糖苷和胍基乙酸修饰阳离子脂质体的表面,使得更多的gapdh
‑
sirna进入脂质体内部,且可在阳离子脂质体表面形成一个有效的水化层,有效降低递送系统与血清中蛋白的相互作用,提高血清作用下的细胞转染效率以及延长体内循环时间,同时可有效地保护抵抗酶的降解,最终提高了基因的载量及传递率,利于递送系统到特定靶位置及细胞的摄取,从而发挥疗效作用。
附图说明
25.图1为本发明方法制得的gapdh sirna
‑
紫杉醇脂质体的凝胶电泳示意图;
26.图2为本发明制得的gapdh sirna
‑
紫杉醇脂质体的包封率示意图;
27.图3为本发明制得的gapdh sirna
‑
紫杉醇脂质体的载药量示意图;
28.图4为本发明制得的gapdh sirna
‑
紫杉醇脂质体的细胞转染效果示意图;
29.图5为本发明制得的gapdh sirna
‑
紫杉醇脂质体的基因转染率示意图;
30.图6为本发明阳离子脂质体的细胞毒性示意图;
31.图7为不同治疗剂给药后的肿瘤体积变化示意图;
32.图8为不同治疗剂给药结束后的肿瘤质量和不同治疗剂的肿瘤抑制率示意图;
33.图9为用发明制得的gapdh sirna
‑
紫杉醇脂质体给药后荷瘤裸鼠体重变化示意图。
具体实施方式
34.本技术提供一种纳米颗粒组合物递送系统的制备方法,包括采用薄膜分散法制备抗肿瘤药物阳离子脂质体;采用混合孵育法制备抗肿瘤药物和gapdh
‑
sirna共载阳离子脂质体复合物。制得的纳米颗粒组合物递送系统能够提高抗肿瘤药物的敏感性,因此可用于治疗癌症。
35.利用荷瘤裸鼠模型,显示纳米颗粒组合物递送系统,即抗肿瘤药物和gapdh
‑
sirna共载阳离子脂质体复合物每隔一天经尾静脉注射一次,共给药12次后,具有非常高效的抗肿瘤效果。gapdh
‑
sirna能够控制肿瘤中gapdh
‑
sirna的表达一直处于较低水平,间接地消除或减少了肿瘤细胞对药物的低氧耐药性,从而充分发挥抗肿瘤药物的作用。
36.因此,本技术提供本文中描述的纳米颗粒组合物递送系统的制备方法,包括采用薄膜分散法制备抗肿瘤药物阳离子脂质体;采用混合孵育法制备抗肿瘤药物和gapdh
‑
sirna共载阳离子脂质体复合物。
37.本文中在纳米颗粒组合物递送系统的制备方法的上下文中描述了许多实施方式。本领域普通技术人员将认识到,以下实施方式的详细描述仅是示例性的,而非旨在以任何方式进行限制。在本公开内容的教导下,对于本领域技术人员而言提出其他实施方式是容
易的。在本文中提及“实施方式”或“实施例”表示这样描述的本发明之实施方案可包括特定特征、结构或特性,但并非每个实施方式都必然包括所述特定特征、结构或特性。此外,重复使用短语“在一个实施方式中”尽管可以指同一实施方式,但并非必然指同一实施方式。
38.为了清楚起见,本文中并未示出和描述本文所述实施或方法的全部常规特征。当然将理解,在研发任何这样的实际实施时,将作出许多实施特异性的决定以实现具体目标,例如依从施用、治疗和对象相关的限制,而且这些具体的目的将在实施之间不同并且在使用者之间不同。此外,将理解,这样的开发工作可能是复杂且耗时的,但在本公开内容的教导下,这对于本领域普通技术人员而言不过是常规工作。
39.本技术在一些实施方式中提供纳米颗粒组合物递送系统的制备方法,包括:
40.采用薄膜分散法制备抗肿瘤药物阳离子脂质体:将阳离子脂质体原料与抗肿瘤药物溶于无水乙醇,将溶液放入茄形瓶中,40
‑
44℃(例如40℃、41℃、42℃、43℃、44℃等)的水浴条件下减压旋转蒸发,待瓶内形成均匀分布的脂质膜后,抽真空约1
‑
1.3h(例如1h、1.1h、1.2h、1.3h等)除去残留的溶剂,然后在瓶内加入无rna酶水,40
‑
42℃(例如40℃、41℃、42℃等)的条件下水化30
‑
35min(例如30min、31min、32min、33min、34min、35min等),用450
‑
480nm(例如450nm、451nm、452nm、453nm、454nm、456nm、458nm、460nm、462nm、464nm、465nm、466nm、467nm、468nm、470nm、471nm、472nm、476nm、478nm、479nm、480nm等)的滤膜挤出一次后,再用脂质体挤出器经过200
‑
220nm(例如200nm、201nm、202nm、203nm、204nm、205nm、206nm、207nm、208nm、209nm、210nm、211nm、212nm、213nm、214nm、215nm、216nm、217nm、218nm、219nm、220nm,120
‑
140nm(例如120nm、121nm、122nm、123nm、124nm、125nm、126nm、127nm、128nm、129nm、130nm、131nm、132nm、133nm、134nm、135nm、136nm、137nm、138nm、139nm、140nm等)的滤膜挤出5
‑
6次,例如5次,6次,放于2
‑
4℃,例如2℃、3℃、4℃的条件下保存。脂质体的制备方法包括逆向蒸发法、乙醇注入法、薄膜分散法等,乙醇注入法中的乙醇不易除尽,且不适于大量制备;逆向蒸发法适用于水溶性药物。薄膜分散法易于操作和放大生产。
41.采用混合孵育法制备抗肿瘤药物和gapdh
‑
sirna共载阳离子脂质体复合物:按一定比例,取gapdh
‑
sirna溶解于无rna酶水中,将载抗肿瘤药物阳离子脂质体与gapdh
‑
sirna混合,室温静置30
‑
35min(例如30min、31min、32min、33min、34min、35min等)后,得到抗肿瘤药物和gapdh
‑
sirna共载阳离子脂质体复合物。抗肿瘤药物和sirna共载阳离子脂质体复合物的制备是阳离子脂质体与sirna的自组装过程,过程简单。
42.上述阳离子脂质体原料包含2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯、植物固醇、双丙酮
‑
d
‑
半乳糖和二油酰基磷脂酰乙醇胺;上述阳离子脂质体原料中2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯、植物固醇、双丙酮
‑
d
‑
半乳糖和二油酰基磷脂酰乙醇胺的摩尔比为1:0.8
‑
1.2:0.2
‑
0.5:2.8
‑
3.2,优选地,例如1:0.82:0.22:2.8、1:0.82:0.25:2.81、1:0.85:0.30:2.83、1:0.9:0.35:2.84、1:0.94:0.38:2.85、1:1:0.4:2.86、1:1:0.4:2.87、1:1:0.4:2.88、1:1.05:0.42:2.89、1:1.08:0.45:2.89、1:1.1:0.4:2.9、1:1.1:0.43:2.92、1:1.1:0.43:2.97、1:1.15:0.45:3.04、1:1.15:0.45:3.06、1:1.2:0.5:3.08、1:1.2:0.5:3.1、1:1.2:0.5:3.13、1:1.2:0.5:3.15等。攻克癌症的难题之一就是肿瘤的多药耐药性,肿瘤中耐药细胞多在低氧环境之中,而在低氧环境下肿瘤细胞生存所需的atp主要来源于糖酵解,而且大部分多药耐药蛋白皆属于atf结合型转运体家族,其对紫杉醇分子的外排作用同样依赖于
atp的供给,因此控制低氧条件下肿瘤细胞的糖酵解就能够抑制耐药蛋白功能的启动。3
‑
磷酸甘油醛脱氢酶(gapdh)在糖酵解中具有关键作用,而且在低氧环境中能够高度表达,gapdh
‑
sirna能够抑制gapdh的表达从而达到基因治疗的作用。阳离子脂质体(cationc liposome,cl)是目前研究的最多的药物与sirna共递送载体之一。以阳离子脂质体作为药物与sirna的共载载体,其中,脂质体内部装载抗肿瘤药物,阳离子脂质可以压缩sirna形成带正电的脂质体与sirna复合物,组装过程简单。脂质体的膜材、比例、用量对于稳定性与包封率有着关键的作用,长链的脂质可増强双分子层间的凝聚力,促进膜稳定,减小药物渗漏。不同于其他磷脂,二油酰基磷脂酰乙醇胺的头部为比较疏水且体积小的伯胺基,两条疏水端为较长的c18不饱和脂肪链,这种特殊的结构既能够使其用于基因转染,又能包裹难溶性药物并促进溶酶体逃逸。2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯的头部为亲水的季胺基,体积较大。2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯插入到二油酰基磷脂酰乙醇胺中有利于磷脂双分子层的形成,提高阳离子脂质体的亲水能力,除此之外,还能提供大量的表面正电荷,增强黏度,减少脂质体间发生融合和絮凝的概率,提高脂质体的物理稳定性。本发明阳离子脂质体用原料植物固醇和双丙酮
‑
d
‑
半乳糖一方面能够嵌入到二油酰基磷脂酰乙醇胺中,阻碍其相邻分子间的相互作用力,有利于调节脂质体的刚性和流动性,提高脂质体的包封率和稳定性,且降低了双分子层膜的弯曲常数及曲率自由能,稳定阳离子脂质体的双层膜结构的同时使纳米颗粒组合物递送系统趋向于形成更小的半径,提高细胞对纳米颗粒组合物递送系统的摄取率;另一方面能提高阳离子脂质体带有的正电荷量,达到较高的电位,使递送系统相互之间产生的较强静电排斥作用,从而避免递送系统的融合、聚集,使制得的递送系统的粒径变化较小,稳定性高,且正电荷量的提高使得脂质体能够携带更多的gapdh
‑
sirna,进而提高递送系统的载药量;此外,还能够提高脂质体与抗肿瘤药物尤其是紫杉醇的结合程度,由此提高递送系统中的抗肿瘤药物的载药量,最终提高细胞摄取效率。胆固醇在人体正常细胞膜上摩尔比为0.3左右,胆固醇含量的过高或过低影响细胞膜的物理性质,使细胞不能维持正常的生命活动,本发明采用植物固醇和双丙酮
‑
d
‑
半乳糖替换胆固醇,还能减少胆固醇对人体的危害,尤其能提高胆固醇过高患者的用药安全。本技术递送系统利用同一载体装载抗肿瘤药物和gapdh
‑
sirna进行联合给药,本发明制得的递送系统具有包封率高、稳定性好、载药量大、粒径变化较小、细胞摄取效率和摄取率高等优点,能够实现两者药物动力学的同步化,该药物传递系统可以同时将抗肿瘤药物和gapdh
‑
sirna送至细胞内部,使抗肿瘤药物和gapdh
‑
sirna在同一细胞中协同起效,提高抗癌的效果。
43.在一些实施方式中,抗肿瘤药物与阳离子脂质体原料中二油酰基磷脂酰乙醇胺的质量比为1:6
‑
7,优选地,例如1:6、1:6.1、1:6.2、1:6.3、1:6.4、1:6.5、1:6.6、1:6.7、1:6.8、1:6.9、1:7等。在一定范围内,药物包封率随着药物和脂质的质量比的降低而升高,二油酰基磷脂酰乙醇胺作为主要的脂质成分,当药物的质量大于二油酰基磷脂酰乙醇胺时,水化后便出现部分聚沉的现象;当药物与二油酰基磷脂酰乙醇胺的比例在1:6
‑
7时,包封率较高;继续增加二油酰基磷脂酰乙醇胺的用量,包封率的增长趋缓,且水化时间增长,难度增加。
44.在一些实施方式中,阳离子脂质体与gapdh
‑
sirna的质量比为18
‑
22:1,优选地,例如18:1、18.1:1、18.2:1、18.3:1、18.4:1、18.5:1、18.6:1、18.7:1、18.8:1、18.9:1、19:1、19.1:1、19.2:1、19.3:1、19.4:1、19.5:1、19.6:1、19.7:1、20:1、20.2:1、20.3:1、20.5:1、
20.8:1、21:1、21.1:1、21.2:1、21.4:1、21.7:1、21.8:1、22:1等。在脂质体递送sirna的过程中,复合物的粒径大小和表面电荷的数量能够影响最终的转染效率。当阳离子脂质体质量较低时,复合物的结构松散,粒径大,结构不稳定,sirna结合率不高。随着阳离子脂质体质量的增加,脂质体吸附sirna,形成多层脂质体结构,复且合物粒径小,sirna结合率显著提高,正电荷在表面均匀分布,又有利于与带负电荷的细胞膜结合并且被摄入胞内;阳离子脂质体质量过高时,sirna与多层脂质结合的很紧密,粒径的増加趋缓.但表面分布过多的正电荷会加快复合物与细胞之间的非特异性离子相互作用,引发细胞毒性。
45.在一些实施方式中,提供的抗肿瘤药物为紫杉醇。肿瘤的p
‑
糖蛋白(p
‑
gp)和多药耐药相关蛋白(mrp)家族对紫杉醇药物具有排外排作用,该纳米颗粒组合物递送系统可以同时将gapdh
‑
sirna和紫杉醇递送到细胞内,抑制gapdh的表达,进一步减少糖酵解产生的atp,消除耐药性,从而提高肿瘤细胞对紫杉醇的敏感性。
46.在一些实施方式中,阳离子脂质体的表面有烷基糖苷和胍基乙酸所修饰。阳离子脂质体的靶向特异性差,导致基因传递率比较低,但其结构的表面易于修饰,使用非离子表面活性剂烷基糖苷和胍基乙酸进行表面修饰,可以通过影响其物理化学性质而提高基因的载量及传递率,一方面能更进一步提高阳离子脂质体带有的正电荷量,进而提高+/
‑
电荷比例,有效提高阳离子脂质体与gapdh
‑
sirna之间的静电力的吸附作用,且使得更多的gapdh
‑
sirna进入脂质体内部,最终提高递送系统中gapdh
‑
sirna的载量;另一方面可在阳离子脂质体表面形成一个有效的水化层,有效降低脂质体与血清中蛋白的相互作用,提高血清作用下的细胞转染效率以及延长体内循环时间,且可有效地保护抵抗酶的降解,进而提高递送系统的细胞摄取效率,同时利于递送系统到特定靶位置,从而发挥疗效作用。
47.在一些实施方式中,纳米颗粒组合物递送系统的平均粒径为159.1
‑
193.7nm,优选地,例如159.1、159.4、159.7、159.9、160.5、161、161.4、161.7、161.8、162、163、164、165、166、167、168、169、170、171、172、173、174、175、176、177、178、179、180、181、182、183、184、185、186、187、188、189、190、191、192、193、193.7等。200nm粒径以下的纳米粒子具有如下优点:能够减少人体网状内皮系统的吞噬;能够提高药物的靶向性,提高疗效并且降低毒性;毛细血管内皮细胞之间的间隙大于200nm,通过毛细血管时,能够被细胞组织所吸收;有利于药物运输与储藏。
48.在一些实施方式中,烷基糖苷的亲水疏水平衡值为4.5
‑
5.2,优选地,例如4.5、4.51、4.52、4..53、4.54、4.55、4.56、4.57、4.58、4.59、4.6、4.61、4.63、4.64、4.67、4.68、4.69、4.7、4.72、4.74、4.75、4.78、4.8、4.85、4.86、4.9、4.92、4.93、4.95、4.96、4.98、5、5.01、5.02、5.04、5.05、5.08、5.1、5.11、5.12、5.13、5.14、5.17、5.18、5.19、5.2等。烷基糖苷对阳离子脂质体进行表面修饰,通过作用于阳离子脂质体的表面疏水性及细胞膜的通透性,来影响细胞的摄取;细胞表面有水化层和亲水糖蛋白,当疏水性过强时,会阻碍脂质体接近细胞表面当疏水性过低时,不利于细胞的粘附和内吞。使用该范围的烷基糖苷对阳离子脂质体的表面进行修饰,有利于递送系统内吞进入细胞。
49.在根据上述实施方式中任一种的一些实施方式中,纳米颗粒组合物递送系统对肿瘤的抑制率不小于94.8%。
50.以下结合实施例对本发明作进一步详细描述:
51.实施例1:
52.一种制备纳米颗粒组合物递送系统的方法:
53.采用薄膜分散法制备抗肿瘤药物阳离子脂质体:将摩尔比1:0.8:0.2:2.8
‑
3.2的2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯、植物固醇、双丙酮
‑
d
‑
半乳糖和二油酰基磷脂酰乙醇、与二油酰基磷脂酰乙醇胺的质量比为1:6的紫衫醇,亲水疏水平衡值为4.5的烷基糖苷和胍基乙酸,溶于无水乙醇,将溶液放入茄形瓶中,水浴条件下减压旋转蒸发,形成均匀分布的脂质膜后,除去残留的溶剂,加入无rna酶水,水化,挤出。
54.采用混合孵育法制备gapdh sirna
‑
紫杉醇脂质体:取cy3标记gapdh
‑
sirna溶解于无rna酶水中,将阳离子脂质体与cy3标记gapdh
‑
sirna按质量比18:1混合,室温静置后,得到cy3标记gapdh sirna
‑
紫杉醇脂质体,平均粒径在159.1
‑
163nm,zeta电位在36.5
‑
38.1mv。
55.实施例2:
56.一种制备纳米颗粒组合物递送系统的方法:
57.采用薄膜分散法制备抗肿瘤药物阳离子脂质体:将摩尔比1:1.05:0.32:2.89的2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯、植物固醇、双丙酮
‑
d
‑
半乳糖和二油酰基磷脂酰乙醇、与二油酰基磷脂酰乙醇胺的质量比为1:6.6的紫衫醇,亲水疏水平衡值为4.8的烷基糖苷和胍基乙酸,溶于无水乙醇,将溶液放入茄形瓶中,水浴条件下减压旋转蒸发,形成均匀分布的脂质膜后,除去残留的溶剂,加入无rna酶水,水化,挤出。
58.采用混合孵育法制备gapdh sirna
‑
紫杉醇脂质体:取cy3标记gapdh
‑
sirna溶解于无rna酶水中,将阳离子脂质体与cy3标记gapdh
‑
sirna按质量比19.3:1混合,室温静置后,得到cy3标记gapdh sirna
‑
紫杉醇脂质体,平均粒径在161.1
‑
165nm,zeta电位在38.6
‑
40.5mv。
59.实施例3:
60.一种制备纳米颗粒组合物递送系统的方法:
61.采用薄膜分散法制备抗肿瘤药物阳离子脂质体:将摩尔比1:1.2:0.5:3.2的2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯、植物固醇、双丙酮
‑
d
‑
半乳糖和二油酰基磷脂酰乙醇、与二油酰基磷脂酰乙醇胺的质量比为1:7的紫衫醇,亲水疏水平衡值为5.2的烷基糖苷和胍基乙酸,溶于无水乙醇,将溶液放入茄形瓶中,水浴条件下减压旋转蒸发,形成均匀分布的脂质膜后,除去残留的溶剂,加入无rna酶水,水化,挤出。
62.采用混合孵育法制备gapdh sirna
‑
紫杉醇脂质体:取cy3标记gapdh
‑
sirna溶解于无rna酶水中,将阳离子脂质体与cy3标记gapdh
‑
sirna按质量比22:1混合,室温静置后,得到cy3标记gapdh sirna
‑
紫杉醇脂质体,平均粒径在179
‑
183.7nm,zeta电位在35.2
‑
37.6mv。
63.上述gapdh sirna
‑
紫杉醇脂质体的粒径和zeta电位的测定方法为:取一定比例的gapdh sirna
‑
紫杉醇脂质体分散于双蒸水中,调节体积至1ml,采用malvren zetasizer3000hs测定其粒径和zeta电位,参数设置选取水作为介质,25℃的测定温度,2min的平衡时间。
64.实施例1、实施例2、实施例3制得的gapdh sirna
‑
紫杉醇脂质体的平均粒径均小于200nm,zeta电位均为正电荷,且在实施例2的条件下,平均粒径最小,zeta电位38.6
‑
40.5mv,动力学稳定性高。
65.实施例4:
66.未加入紫杉醇,其余部分和实施例2完全一致。
67.对比例1:
68.未加入烷基糖苷进行表面修饰,其余部分和实施例2完全一致。
69.对比例2:
70.未加入胍基乙酸进行表面修饰,其余部分和实施例2完全一致。
71.对比例3:
72.未加入烷基糖苷和胍基乙酸进行表面修饰,其余部分和实施例2完全一致。
73.对比例4:
74.阳离子脂质体用原料不包含植物固醇,其余部分和实施例2完全一致。
75.对比例5:
76.阳离子脂质体用原料不包含双丙酮
‑
d
‑
半乳糖,其余部分和实施例2完全一致。
77.对比例6:
78.阳离子脂质体用原料不包含植物固醇和双丙酮
‑
d
‑
半乳糖,其余部分和实施例2完全一致。
79.对比例7:
80.阳离子脂质体用原料为2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯、胆固醇和二油酰基磷脂酰乙醇,其余部分和实施例2完全一致。
81.对比例8:
82.以2
‑
二油酰基羟丙基
‑3‑
n,n,n
‑
三甲铵氯、胆固醇和二油酰基磷脂酰乙醇作为阳离子脂质体原料,其余部分和实施例4完全一致。
83.试验例1:
84.琼脂糖凝胶电泳:
85.利用琼脂糖凝胶电泳实验考察阳离子脂质体与gapdh
‑
sirna的结合能力。
86.将0.45g琼脂糖放入锥形瓶中,加入1
×
tae电泳缓冲液20ml,加热至完全溶解,冷却至60℃后,加入2μl goldview轻轻摇匀。将凝胶溶液倒入电泳点样槽中,插入点样梳,待凝胶充分冷却后拔出,放入装满1
×
tae电泳缓冲液的电泳槽中。取6
×
loading buffer加入待测样品中,混匀,上样,电泳条件为:电压95v,时间12min。采用凝胶成像系统对凝胶进行拍照。结果见图1。
87.实施例2、对比例1
‑
7分别按照不同质量比的阳离子脂质体和cy3标记gapdh
‑
sirna制得gapdh sirna
‑
紫杉醇脂质体。由图1可以看出,与游离sirna相比,gapdh sirna
‑
紫杉醇脂质体在相同位置电泳条带的亮度明显减弱,在实验例2的条件下,阳离子脂质体与游离gapdh sirna结合的最充分。对比实施例2与对比例1
‑
3的结果可以看出,阳离子脂质体的表面有烷基糖苷和胍基乙酸共同修饰时,才能有效提高递送系统中gapdh
‑
sirna的载量;对比实施例2与对比例4
‑
6的结果可以看出,阳离子脂质体用原料包括植物固醇、双丙酮
‑
d
‑
半乳糖时,才能使得脂质体能够携带更多的gapdh
‑
sirna;对比实施例2与对比例7的结果可以看出,植物固醇、双丙酮
‑
d
‑
半乳糖用于替换胆固醇,能够使得脂质体能够携带更多的gapdh
‑
sirna。
88.试验例2:
89.包封率的测定:
90.1)脂质体中gapdh
‑
sirna的含量测定
91.取制备的gapdh sirna
‑
紫杉醇脂质体的溶液99μl,加入破乳剂10%triton x
‑
100 1μl,涡旋混合,加入100μl的hbs稀释,混合均匀,取150μl加入黑色96孔板中。按照同样的方法配制标准曲线溶液。本法主要以cy3为荧光标记物,因此测定时使用的激发波长为550nm,发射波长为570nm。
92.2)脂质体中紫杉醇的含量测定
93.取制备的gapdh sirna
‑
紫杉醇脂质体的溶液200μl,加入9.8ml的甲醇进行稀释,室温条件下水浴并超声10min,用0.45μm的滤膜进行过滤,采用hplc法(乙腈:水=60:40,流速1.0ml/min,波长227nm,柱温25℃,进样量10μl)测定阳离子脂质体中紫杉醇的含量。
94.3)脂质体包封率和载药量的计算
95.计算公式如下:
96.包封率=脂质体中药物的含量/投入的药物总量
×
100%;
97.载药量=脂质体中药物的含量/阳离子脂质体的总质量
×
100%。
98.结果见图2、图3。
99.由图2、图3可以看出,本发明实施例1
‑
3中gapdh
‑
sirna的包封率在69%以上,载药量在0.28%以上;紫杉醇的包封率在92%以上,载药量在1.91%以上。其中,在实施例2的条件下gapdh
‑
sirna的包封率和载药量与紫杉醇的包封率和载药量均达到最优。对比例实施例2和对比例4
‑
6,实施例2的包封率和载药量均优于对比例4
‑
6,这表明阳离子脂质体用原料植物固醇和双丙酮
‑
d
‑
半乳糖能提高递送系统的包封率和载药量。
100.试验例3:
101.gapdh sirna
‑
紫杉醇脂质体体外细胞摄取情况的检测:
102.将液氮罐中冻存的人宫颈癌细胞(hela)取出并进行复苏,将细胞复苏以后,以含10%胎牛血清的rpmi
‑
1640培养基重悬,在37℃,5%co2培养箱中静置培养。
103.hela细胞以每孔1.5
×
104的密度接种于12孔板中,在37℃,5%co2培养箱中培养过夜。移去原有培养基,加入pbs冲洗细胞2次,采用不含有血清的rpmi
‑
1640培养基将游离cy3
‑
gapdh
‑
sirna和gapdh sirna
‑
紫杉醇脂质体稀释后分别加入相应孔中,用lipofectamin
‑
2000作阳性对照,每孔cy3
‑
gapdh
‑
sirna的终浓度为20nm,体积为1ml。37℃条件下孵育4h,pbs冲洗细胞3次,置于共聚焦显微镜下观察并拍摄照片。移去pbs,用0.25%的胰蛋白酶消化细胞,然后收集到流式管中,加入pbs,在1500rpm/min的条件下离心5min,除去上清,重复2次。在每管中加入200μl的pbs重悬细胞。用游离cy3
‑
gapdh
‑
sirna作阴性对照,收集10000个细胞,利用流式细胞仪进行检测。实施例1、实施例2、实施例3分别用不同亲水疏水平衡值的烷基糖苷进行表面修饰,制得gapdh sirna
‑
紫杉醇脂质体,与hela细胞共混后,通过流式细胞仪进行检测。结果见图4。
104.由图4可以看出,实施例1、实施例2、实施例3均出现荧光,说明实施例1、实施例2、实施例3制得的gapdh sirna
‑
紫杉醇脂质体均可以有效地被hela细胞摄取,在实施例2的条件下,即烷基糖苷值为4.8时,荧光强度最高,几乎相当于阳性对照lipo2000。
105.试验例4:
106.gapdh sirna
‑
紫杉醇脂质体介导的体外细胞转染效果的测定:
107.向96孔板的每个孔中种约7500个细胞,根据细胞生长速度控制转染实验时每孔细胞的密度在30%
‑
50%。24h后,取50μl的opti
‑
mem减血清培养基来稀释gapdh sirna制得游离sirna阴性对照制剂。
108.吸去96孔板中的培养液后,将10nm、25nm、50nm的不同浓度的gapdh sirna
‑
紫杉醇脂质体以及相应浓度的阴性对照制剂加入相应的孔中转染。4个小时后吸除制剂,添加新鲜培养液继续孵育。48个小时后将培养液吸除,加入gapdh酶活性测定试剂盒中的细胞裂解液,4℃条件下孵育20min,然后用移液枪上下吹打4
‑
5次至。每孔取10μl样品到黑色96孔板,加入90μl kdalert
tm master混合发光剂,置于多功能酶标仪中,室温条件下测定随着时间延长而增加的荧光变化值,激发波长550nm、发射波长600nm。
109.总蛋白的测定:将10μl上述每孔裂解后的样品加入96孔板中,加入90μl ripa稀释10倍,再加入bca试剂盒中的显色剂,37℃的条件下孵育1h,放入酶标仪,测定562nm处的吸光值。以牛血清白蛋白作为标准品,按照上述方法计算出标准曲线。计算样品的总蛋白量。为了避免每孔细胞总蛋白数的不同而带来的误差,根据测出的总蛋白值将gapdh酶活性对应的荧光变化值换算成δflu/mg蛋白。结果见图5。
110.由图5可以看出,由实施例2制得的gapdh sirna
‑
紫杉醇脂质体进行给药,hela细胞中gapdh的表达量与阴性对照组相比,显著下降;用对比例1
‑
3制得的gapdh sirna
‑
紫杉醇脂质体进行给药,hela细胞中gapdh的表达量与阴性对照组相比有一定的下降,但与实施例2的相比明显较高,因此,实施例2具有更好的基因转染能力。这说明烷基糖苷和胍基乙酸共同修饰阳离子脂质体的表面,能够提高血清作用下的细胞转染效率,进而提高递送系统的细胞摄取效率,同时利于递送系统到特定靶位置,从而发挥疗效作用。
111.试验例5:
112.阳离子脂质体的细胞毒性的测定:
113.取对数生长周期的hela细胞,用0.25%的胰蛋白酶消化细胞后离心除去上清,加入不含有血清的dmem培养液重悬,计数,按照每化4500个细胞密度,150μl不含有血清的dmem培养液接种于96孔板中,置于37℃,5%co2培养箱培养过夜。待细胞达到60
‑
80%融合后,加入50μl不同浓度的gapdh sirna脂质体,同时设置空白的无血清dmem培养基为空白调零组、未转染细胞为阴性对照组,培养24h,再向每个孔中加入20μl浓度为5mg/ml的mtt,在37℃下孵育4h。除去上清,在每个孔中加入150μl的dmso溶解甲臜结晶,在20min内用酶标仪测定490nm处的吸光度值,按下列公式计算hela的存活率,重复3次。
114.细胞存活率=(样本吸光度值
‑
空白调零组吸光度值)/(阴性对照组吸光度值
‑
空白调零组吸光度值)
×
100%
115.结果见图6。
116.由图6可以看出,实施例4与对比例8对hela细胞均表现出一定的细胞毒性,对比例8中以胆固醇代替咔唑制备阳离子脂质体,用制得的gapdh sirna脂质体给药,hela细胞存活率与实施例4的相比较低,对比例8的阳离子脂质体表现出较大的细胞毒性。
117.试验例6:
118.gapdh sirna
‑
紫杉醇脂质体的体内药效评价:
119.1)荷瘤裸鼠模型的建立
120.取生长良好处于对数期的hela细胞,用0.1%的胰蛋白酶消化细胞后,加入dmem细
胞培养液终止消化,离心,移去细胞培养液,用无血清dmem细胞培养液重悬,计数,离心收集细胞。加入4℃的pbs使其均匀分散,待其浓度为1
×
107cells/ml时,放入冰盒中保存。先用碘伏对小鼠的皮肤消毒,经皮下注射将0.2ml的hela细胞接种至裸鼠的左侧腋下,建立人宫颈癌(hela)荷瘤裸鼠动物模型。
121.2)给药方案
122.接种大约3周后,荷瘤裸鼠身上的肿瘤体积长至约100mm3,随机分组,每组6只小鼠,共5组。通过尾静脉注射生理盐水、紫杉醇脂质体、利用本发明实施例2制得的gapdh sirna
‑
紫杉醇脂质体。gapdh sirna的给药剂量为75nm/kg,紫杉醇给药剂量为3mg/kg,每隔一天给药1次,共给药12次。
123.3)体内药效评价指标
124.第一次给药后,每天测量肿瘤的长径和短径,按照下式计算肿瘤体积,绘制肿瘤体积生长曲线。结果见图7。
125.肿瘤体积=(短径的平方
×
长径)/2
126.最后一次给药结束后,将全部的荷瘤裸鼠称重,然后处死,取出肿瘤组织,进行称重,以生理盐水组作为对照组,按下式计算肿瘤抑制率。结果见图8。
127.肿瘤抑制率=对照组肿瘤组织的重量
‑
治疗组肿瘤组织的重量/对照组肿瘤组织的重量
128.4)安全性评价
129.从第一次给药开始,每天测量荷瘤裸鼠的体重,绘制体重的变化曲线,评价给药后荷瘤裸鼠的体重变化。结果见图9。
130.由图7、图8可以看出,gapdh sirna
‑
紫杉醇脂质体有显著的抗肿瘤效率,给药结束后,荷瘤裸鼠的肿瘤组织变得非常小,肿瘤抑制率高达94.8%,而紫杉醇脂质体只是在一定程度内抑制了肿瘤的生长,且肿瘤抑制率只有72.4%。
131.由图9可以看出,与生理盐水对照组相比,连续静脉注射gapdh sirna
‑
紫杉醇脂质体给药12次后,荷瘤裸鼠体重没有较大的减轻,没有表现出明显的系统毒性。
132.上述实施例中的常规技术为本领域技术人员所知晓的现有技术,故在此不再详细赘述。
133.以上实施方式仅用于说明本发明,而并非对本发明的限制,本领域的普通技术人员,在不脱离本发明的精神和范围的情况下,还可以做出各种变化和变型。因此,所有等同的技术方案也属于本发明的范畴,本发明的专利保护范围应由权利要求限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1