用于细胞免疫治疗的方法和组合物
1.本发明属于免疫治疗领域。更具体地,本发明涉及使用表达靶向cd7的嵌合抗原受体的细胞治疗疾病,尤其是与cd7表达相关的疾病,例如t-all或t-lbl的方法和组合物。
背景技术:
2.过继细胞疗法已越来越多地被用于治疗疾病。例如,用表达对待治疗疾病具有特异性的重组受体的免疫细胞(例如car-t细胞、tcr-t细胞、car-nk细胞等)来治疗癌症或肿瘤已被证明具有良好的疗效和可控制的副作用。本发明提供用于向受试者施用或重复施用car-t细胞的方法、组合物和制品。本发明的方法能够提供改善的或更持久的应答或疗效以及较低的毒性风险或其他副作用。
附图说明
3.图1示出了本发明ucar-t细胞的示例性施用方案。
4.图2示出了通过qpcr检测的应答者(a)和无应答者(b)外周血中的car的拷贝数量。
5.图3示出了通过流式细胞术检测的应答者(a)和无应答者(b)外周血中的ucar-t细胞数量。
6.图4示出了通过流式细胞术检测的应答者(a1、b1、c1)和无应答者(a2、b2、c2)中的il-6、il-2和ifn-γ的水平。
7.图5示出了接受多个剂量的受试者的外周血中的car的拷贝数量,其中箭头示出了施用第二剂量的时机。
8.图6示出了通过qpcr(a)和流式细胞术(b)检测的受试者的外周血中的ucar-t扩增及持续情况。
技术实现要素:
9.本发明涉及用于治疗疾病,例如与cd7表达相关的癌症和肿瘤的方法,其包括向受试者施用表达嵌合抗原受体的工程化免疫细胞,所述嵌合抗原受体特异性结合cd7抗原并导致免疫应答。本发明提供的方法具有的特征,例如施用时机、施用剂量、治疗方案等能够提供改善的或更持久的应答或疗效以及较低的毒性风险或其他副作用。本发明还提供可用于上述治疗方法的组合物、制品。
10.i用工程化免疫细胞进行细胞治疗
11.在第一个方面,本发明提供一种用于治疗与cd7表达相关的疾病的方法,其包括向受试者施用第一剂量的工程化免疫细胞,所述工程化免疫细胞包含特异性结合cd7的嵌合抗原受体,所述第一剂量为0.1x106至1x108个car+细胞/kg,其中在施用所述第一剂量之前使所述受试者接受淋巴细胞清除方案,所述方案包括环磷酰胺、氟达拉滨、依托泊苷、马法兰或其组合。
12.a施用方案
13.如本文所述,术语“剂量”是指一个疗程内向受试者施用的工程化免疫细胞的总量。剂量可以是以重量为基础计算的剂量,例如以受试者体重为基础计算的向受试者施用的量,以mg/kg或细胞个数/kg等表示;也可以是以体表面积(bsa)为基础计算的剂量,例如以患者的表面积为基础计算的向受试者施用的量,以mg/m2或细胞个数/m2等表示;还可以是以施用的工程化免疫细胞的数量为基础计算的剂量,以细胞个数表示。在本发明中,施用给定剂量的工程化免疫细胞,涵盖以单一组合物单次瞬时和/或单次不间断施用的方式(例如,以单次注射或单次连续输注的方式)施用给定量的细胞,还涵盖在不超过3天的时间内在多个组合物中以分剂量的方式施用给定量的细胞。在后一种情况中,多次施用的分剂量的总和被认为是单一剂量。因此,在一些实施方案中,在一个疗程内,以单次或连续施用的方式在单一时间点施用或开始施用给定剂量的工程化免疫细胞;或者,以多次注射或输注的方式在不超过3天的时间内将给定剂量的工程化免疫细胞分成多个分剂量进行施用,例如每天一次或隔天一次,或一天多次。
14.如本文所用,术语“第一剂量”用于描述施用给定剂量的本发明定义的工程化免疫细胞的时机,即,在第一个疗程施用的剂量。该剂量可以是治疗过程中唯一的剂量,也可以在其之后施用一次或多次额外的剂量(即,后续剂量)。因此,本发明的方法还可以包括,向受试者施用至少一次后续剂量的包含特异性结合cd7的嵌合抗原受体的工程化免疫细胞。
15.在本发明的方法包括多个剂量的情况下,第一剂量与后续剂量可以相同或不同。在一个实施方案中,后续剂量可以高于或低于第一剂量。例如,后续剂量比第一剂量高2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍或更多倍,或者比第一剂量低2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍或10倍或更多倍。对受试者是否施用后续剂量以及具体的施用方案由医生根据受试者的具体情况确定,包括但不限于受试者的年龄、性别、体重、整体健康情况、疾病严重程度、接受的先前疗法、对同疗程前次施用剂量的反应、对先前疗程的反应、联合用药情况、毒性反应程度、并发症、癌症转移情况等,以及医生认为会影响确定适于向受试者施用的工程化免疫细胞的量的任何其他因素。
16.在一个实施方案中,所述第一剂量或后续剂量选自0.1x106至1x108个car+细胞/kg、0.5x106至1x108个car+细胞/kg、1x106至1x108个car+细胞/kg、2x106至1x108个car+细胞/kg、3x106至1x108个car+细胞/kg、4x106至1x108个car+细胞/kg、5x106至1x108个car+细胞/kg、6x106至1x108个car+细胞/kg、7x106至1x108个car+细胞/kg、8x106至1x108个car+细胞/kg、9x106至1x108个car+细胞/kg、1x107至1x108个car+细胞/kg、1.5x107至1x108个car+细胞/kg、1.8x107至1x108个car+细胞/kg、2x107至1x108个car+细胞/kg、3x107至1x108个car+细胞/kg、4x107至1x108个car+细胞/kg、5x107至1x108个car+细胞/kg、6x107至1x108个car+细胞/kg、7x107至1x108个car+细胞/kg,或8x107至1x108个car+细胞/kg。在一个实施方案中,所述第一剂量或后续剂量选自0.1x106至1x108个car+细胞/kg、0.5x106至5x107个car+细胞/kg、1x106至5x107个car+细胞/kg、2x106至5x107个car+细胞/kg、3x106至5x107个car+细胞/kg、4x106至5x107个car+细胞/kg、5x106至5x107个car+细胞/kg、5x106至4x107个car+细胞/kg,或5x106至3x107个car+细胞/kg。在一个优选的实施方案中,所述第一剂量或后续剂量选自1x106至5x107个car+细胞/kg,或5x106至3x107个car+细胞/kg,例如可以是3x106个car+细胞/kg、4x106个car+细胞/kg、5x106个car+细胞/kg、6x106个car+细胞/kg、7x106个car+细胞/kg、8x106个car+细胞/kg、9x106个car+细胞/kg、1x107个car+细胞/kg、1.5x107个
car+细胞/kg、1.8x107个car+细胞/kg、2x107个car+细胞/kg、2.5x107个car+细胞/kg、3x107个car+细胞/kg、4x107个car+细胞/kg,或5x107个car+细胞/kg。
17.在一个实施方案中,所述第一剂量或后续剂量中施用的car+细胞数目总计为约5x106至10x109个car+细胞、7.5x106至5x109个car+细胞、1x107至5x109个car+细胞、2.5x107至5x109个car+细胞、5x107至5x109个car+细胞、7.5x107至5x109个car+细胞、1x108至5x109个car+细胞、约2x108至4x109个car+细胞、或约2x108至3x109个car+细胞。
18.在一个实施方案中,可以向受试者施用1个或多个剂量,例如2、3、4、5、6或更多个剂量。在施用多个剂量的情况下,在施用前一剂量(例如第一剂量)后至少5-90天(例如,至少5-80、5-70、5-60、5-50、5-40、5-30或5-25天)的时间点施用后续剂量(例如第二剂量)的工程化免疫细胞,例如在施用前一剂量后第5天、第7天、第9天、第12天、第15天、第18天、第22天、第25天、第30天、第40天、第50天、第60天、第70天、第80天或第90天施用后续剂量的工程化免疫细胞。
19.在一个实施方案中,以分剂量的形式施用给定剂量,例如第一剂量或后续剂量。可以在2天或3天内以相同或不同的分剂量的形式向受试者施用给定剂量。例如,在第一天施用25%的分剂量并在第二天施用剩余的75%的分剂量;或者在第一天施用50%的分剂量,并且在第二天施用剩余的50%的分剂量;或者在第一天施用10%的分剂量,在第二天施用30%的分剂量,并且在第三天施用60%的分剂量。
20.在一些实施方案中,施用第一剂量的工程化免疫细胞后,所述受试者的肿瘤负荷稳定或减少。优选地,在用第一剂量稳定或减少肿瘤负荷后,但在适应性宿主免疫应答(即,机体对car-t细胞产生的免疫排斥反应)产生之前,施用一个或多个后续剂量。在这种条件下,后续剂量可以安全有效地提供免疫监测、清除残留肿瘤细胞或预防残留肿瘤细胞的增殖或转移。因此,在一些实施方案中,后续剂量是疾病巩固剂量。
21.如本文所用,术语“肿瘤负荷”包括但不限于肿瘤体积大小或分化程度,或转移类型、阶段,和/或中晚期癌症常见的并发症的出现与消失,和/或肿瘤标志物出现或表达水平的变化,和/或受试者发生毒性结果(例如crs、巨噬细胞活化综合征、肿瘤溶解综合征、神经毒性和/或针对施用的细胞产生的宿主免疫应答)的可能性或发生率。在一些实施方案中,肿瘤的大小通过pet(正电子发射型计算机断层显像)和ct(计算机x线断层扫描)自带的标尺进行测量。
22.肿瘤标志物是指特征性存在于恶性肿瘤细胞,或由恶性肿瘤细胞异常产生的物质,或是宿主对肿瘤的刺激反应而产生的物质,并能反映肿瘤发生、发展,监测肿瘤对治疗反应的一类物质。肿瘤标志物存在于肿瘤患者的组织、体液和排泄物中,能够用免疫学、生物学及化学的方法检测到,包括甲胎蛋白(afp)、ca125、ca15-3、鳞状细胞癌抗原(scc)、细胞角蛋白19的可溶性片段(cyfra21-1)、癌胚抗原(cea)、ca199、ca724等。
23.在一个实施方案中,当受试者接受第一剂量的工程化免疫细胞之后具有以下特征时,施用所述后续剂量的工程化免疫细胞:
24.(i)指示细胞因子释放综合征(crs)的因子的受试者中血清水平倍数比在施用所述第一剂量之前即刻的受试者中的水平小约10倍、小约25倍、和/或小约50倍;
25.(ii)没有显示出3级或更高的神经毒性;
26.(iii)与施用第一剂量的工程化免疫细胞后的神经毒性或crs水平的峰值水平相
比,神经毒性或crs水平降低;或者
27.(iv)所述受试者没有显示出针对由所述第一剂量的工程化免疫细胞表达的car的可检测的免疫应答(例如体液或细胞介导的免疫应答)。
28.在另一个实施方案中,当受试者接受第一剂量的工程化免疫细胞之后,定期向受试者施用后续剂量的工程化免疫细胞,例如每隔5周、6周、7周、8周、9周或10周向受试者施用后续剂量的工程化免疫细胞。在该实施方案中,受试者总计接受3、4、5、6、7、8、9或10个剂量的工程化免疫细胞。在一个优选的实施方案中,每次施用后续剂量之前,受试者均接受淋巴细胞清除方案。
29.在一个实施方案种,可检测的免疫应答是指可以通过任何已知方法检测到的对特定抗原和细胞的特异性免疫应答。例如,可以通过对受试者的血清进行elispot、elisa或抗体检测(例如,通过流式细胞术)来检测是否存在特异性结合细胞表面抗原的抗体,进而检测特定类型的免疫应答。
30.在一个实施方案中,每次向受试者施用的工程化免疫细胞的剂量,以及多个剂量之间的间隔时间由医生根据受试者的具体情况确定,包括但不限于受试者的年龄、性别、体重、整体健康情况、疾病严重程度、接受的先前疗法、对同疗程前次施用剂量的反应、对先前疗程的反应、联合用药情况、毒性反应程度、并发症、癌症转移情况等,以及医生认为会影响确定适于向受试者施用的工程化免疫细胞的量的任何其他因素。
31.b淋巴细胞清除方案
32.在所有实施方案中,本发明的方法包括在第一剂量之前使受试者接受淋巴细胞清除方案。在一些实施方案中,当受试者接受后续剂量时,所述方法包括在向受试者施用所述后续剂量之前施用淋巴细胞清除方案(即,在施用第一剂量和后续剂量之间,再次使受试者接受淋巴细胞清除方案)。在另一些实施方案中,向受试者施用所述后续剂量之前不再额外施用淋巴细胞清除方案(即,受试者仅在第一剂量之前接受淋巴细胞清除方案,在施用后续剂量时直接施用工程化免疫细胞而不再进行额外的淋巴细胞清除)。本发明还提供一种用于清除淋巴细胞的组合物。
33.在一个实施方案中,所述淋巴细胞清除方案或者用于清除淋巴细胞的组合物包括环磷酰胺、氟达拉滨、依托泊苷、马法兰或其组合。在一个实施方案中,所述淋巴细胞清除方案或者用于清除淋巴细胞的组合物包括环磷酰胺、氟达拉滨和依托泊苷。在一个实施方案中,所述淋巴细胞清除方案或者用于清除淋巴细胞的组合物包括环磷酰胺、氟达拉滨和马法兰。
34.在某些实施方案中,淋巴细胞清除方案或者用于清除淋巴细胞的组合物包括剂量为约10-60mg/m2/天、10-50mg/m2/天、15-40mg/m2/天、或15-35mg/m2/天,例如为约10mg/m2/天、15mg/m2/天、20mg/m2/天、25mg/m2/天、30mg/m2/天、35mg/m2/天、40mg/m2/天、45mg/m2/天、50mg/m2/天55mg/m2/天、或65mg/m2/天的氟达拉滨;和/或剂量为约100-700mg/m2/天、150-650mg/m2/天、200-600mg/m2/天、250-600mg/m2/天、或300-600mg/m2/天,例如为约100mg/m2/天、150mg/m2/天、200mg/m2/天、250mg/m2/天、300mg/m2/天、325mg/m2/天、350mg/m2/天、375mg/m2/天、400mg/m2/天、425mg/m2/天、450mg/m2/天、475mg/m2/天、500mg/m2/天、550mg/m2/天、600mg/m2/天、650mg/m2/天、或700mg/m2/天的环磷酰胺;和/或剂量为约50-150mg/天、50-125mg/天、50-100mg/天,例如为约50mg/天、60mg/天、70mg/天、80mg/天、
90mg/天、100mg/天、125mg/天、或150mg/天的依托泊苷;和/或剂量为约50-150mg/m2/天、50-125mg/m2/天、或50-100mg/m2/天,例如为约50mg/m2/天、60mg/m2/天、70mg/m2/天、80mg/m2/天、90mg/m2/天、100mg/m2/天、125mg/m2/天、或150mg/m2/天的马法兰。
35.在某些实施方案中,施用的氟达拉滨的总剂量为约30-250mg/m2、50-200mg/m2、60-180mg/m2、75-175mg/m2、或75-100mg/m2,例如为约30mg/m2、50mg/m2、60mg/m2、75mg/m2、90mg/m2、100mg/m2、125mg/m2、150mg/m2、175mg/m2、180mg/m2、200mg/m2、225mg/m2、或250mg/m2。在某些实施方案中,施用的环磷酰胺的总剂量为约300-3500mg/m2、500-3000mg/m2、750-2500mg/m2、1000-2500mg/m2、或1000-2000mg/m2,例如为约300mg/m2、500mg/m2、750mg/m2、1000mg/m2、1100mg/m2、1200mg/m2、1300mg/m2、1400mg/m2、1500mg/m2、1600mg/m2、1700mg/m2、1800mg/m2、1900mg/m2、2000mg/m2、2250mg/m2、2500mg/m2、2750mg/m2、3000mg/m2、3250mg/m2、或3500mg/m2。在某些实施方案中,施用的依托泊苷的总剂量为约150-750mg、200-700mg、250-600mg、或300-500mg,例如为约150mg、200mg、250mg、300mg、350mg、400mg、450mg、500mg、550mg、600mg、650mg、700mg、或750mg。在某些实施方案中,施用的马法兰的总剂量为约50-750mg/m2、50-600mg/m2、50-500mg/m2、50-400mg/m2、或50-300mg/m2,例如为约50mg/m2、75mg/m2、100mg/m2、200mg/m2、300mg/m2、400mg/m2、500mg/m2、600mg/m2、或700mg/m2。
36.将施用工程化免疫细胞的时间(例如施用第一剂量或后续剂量的时间)定为第0日(d0),因此例如d-2是指在施用工程化免疫细胞之前的第2天,d2是指在施用工程化免疫细胞之后的第2天。在某些实施方案中,在施用工程化免疫细胞(例如第一剂量或后续剂量)之前至少1、2、3、4、5、6、7、8、9、10、11或12天开始施用淋巴细胞清除方案,包括环磷酰胺、氟达拉滨、依托泊苷和/或马法兰。优选地,在施用第一剂量或后续剂量之前7(即d-7)、8、9、10、11或12天开始施用淋巴细胞清除方案,包括环磷酰胺、氟达拉滨、依托泊苷和/或马法兰。
37.在某些实施方案中,淋巴细胞清除方案(包括环磷酰胺、氟达拉滨、依托泊苷和/或马法兰)间断施用或连续施用1、2、3、4、5、6或7天。例如,在一些实施方案中,每天施用环磷酰胺,连续施用2天、3天、4天或5天;每天施用氟达拉滨,连续施用3天、4天或5天;每天施用依托泊苷,连续施用3天、4天或5天;每天施用马法兰,施用1天或连续施用2天或3天。
38.在某些实施方案中,环磷酰胺、氟达拉滨、依托泊苷和/或马法兰可在同日或不同日施用。在某些实施方案中,环磷酰胺、氟达拉滨、依托泊苷和/或马法兰可同时或依次施用。可利用任何合适的途径施用环磷酰胺、氟达拉滨、依托泊苷和/或马法兰,例如通过静脉注射或静脉输注途径。
39.c受试者筛选和评估
40.在一个实施方案中,受试者在接受本发明所述治疗方法前,已经接受过一种或更多种,例如2种、3种、4种、5种、6种、7种或8种先前治疗。这种先前治疗包括但不限于干细胞移植、放疗、化疗、抗体治疗、小分子靶向治疗、或其他工程化免疫细胞治疗等。
41.在施用第一剂量或后续剂量后,评估受试者体内的细胞动力学和细胞因子动力学。例如,可以通过定量pcr或流式细胞术来评估受试者血液或器官或组织中表达嵌合抗原受体的细胞(即,car+细胞)的量,进而评估工程化免疫细胞在受试者体内的增殖水平和持久性。在一个实施方案中,还通过流式细胞术评估与细胞因子释放综合征(crs)相关的细胞因子,例如il6、il2、ifn-γ等的释放水平。
42.在施用第一剂量或后续剂量后,评估受试者的疾病状态以评估其对ucar-t细胞的
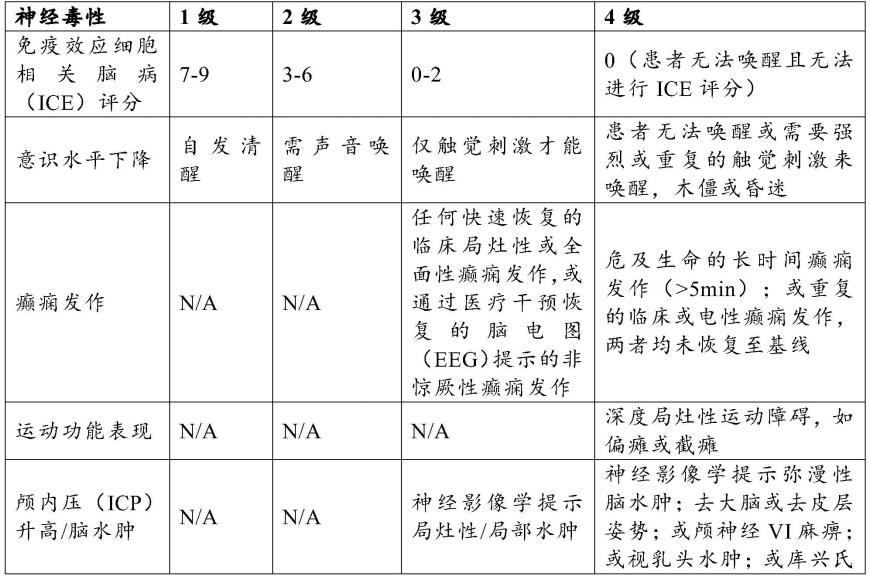
应答反应。例如,根据美国移植和细胞治疗学会(astct)标准评估免疫效应细胞相关神经毒性(icans)和细胞因子释放综合征(crs)的发生率和等级,具体如表1和表2所示。还根据美国国家综合癌症网络(nccn)标准评估移植物抗宿主病(gvhd)。
43.表1.icans的示例性分级标准
[0044][0045][0046]
表2.crs的示例性分级标准
[0047][0048]
d适应症
[0049]
在一个实施方案中,与cd7表达相关的疾病包括cd7阳性的血液学肿瘤(例如白血
病和淋巴瘤)和实体瘤。血液学肿瘤是血液或骨髓的癌症,包括但不限于急性白血病,诸如急性淋巴细胞白血病(all,例如t-all、nk-all)、急性髓细胞白血病(aml)、急性骨髓性白血病和成髓细胞性、前髓细胞性、粒-单核细胞型、单核细胞性和红白血病;慢性白血病,诸如慢性粒细胞性白血病、慢性骨髓性白血病和慢性淋巴细胞白血病;非霍奇金淋巴瘤(无痛和高等级形式),例如t淋巴母细胞性淋巴瘤(t-lbl)、外周t细胞淋巴瘤(ptcl)、结外nk/t细胞淋巴瘤、γδt细胞淋巴瘤;t细胞大颗粒淋巴细胞白血病(t-lgl)、真性红细胞增多症、淋巴瘤、霍奇金淋巴瘤、血管免疫母细胞t细胞淋巴瘤(aitl)、间变性大细胞淋巴瘤(alcl)、多发性骨髓瘤、瓦尔登斯特伦氏巨球蛋白血症、骨髓增生异常综合征、多毛细胞白血病、伯基特淋巴瘤、弥漫性大细胞淋巴瘤、套细胞淋巴瘤、早期前t淋巴母细胞白血病(etp-all)、小淋巴细胞淋巴瘤(sll)和脊髓发育不良。实体瘤是通常不包含囊肿或液体区的组织的异常肿块,其可以是良性或恶性的。不同类型的实体瘤以形成它们的细胞类型命名(诸如肉瘤、癌和淋巴瘤)。实体瘤的实例包括但不限于纤维肉瘤、粘液肉瘤、脂肪肉瘤间皮瘤、胰腺癌、卵巢癌、腹膜、大网膜和肠系膜癌、咽癌、前列腺癌、直肠癌、肾癌、皮肤癌、小肠癌、黑素瘤、肾癌,喉癌、软组织癌、胃癌、睾丸癌、结肠癌,食道癌,宫颈癌、腺泡型横纹肌肉瘤、膀胱癌、骨癌、脑癌、乳腺癌、肛门癌、眼癌、肝内胆管癌、关节癌、颈癌、胆囊癌、胸膜癌、鼻癌、中耳癌、口腔癌、外阴癌、甲状腺癌和输尿管癌。
[0050]
在一个实施方案中,与cd7表达相关的疾病优选选自cd7阳性的急性淋巴细胞白血病(all,例如t-all、nk-all)、急性髓细胞白血病(aml)、慢性粒细胞性白血病、慢性淋巴细胞白血病、慢性骨髓性白血病、t细胞大颗粒淋巴细胞白血病(t-lgl)、非霍奇金淋巴瘤(例如t淋巴母细胞性淋巴瘤(t-lbl)、外周t细胞淋巴瘤(ptcl)、结外nk/t细胞淋巴瘤、γδt细胞淋巴瘤)和早期前t淋巴母细胞白血病(etp-all)。
[0051]
ii嵌合抗原受体
[0052]
本发明提供的工程化免疫细胞包含特异性结合cd7抗原的嵌合抗原受体。
[0053]
如本文所用,术语“嵌合抗原受体”或“car”是指人工构建的杂合多肽,该杂合多肽一般包括抗原结合区(例如抗体或其抗原结合部分)、跨膜结构域、任选的共刺激结构域和初级信号传导结构域,各个结构域之间通过接头连接。car能够利用抗体的抗原结合特性以非mhc限制性的方式将t细胞和其它免疫细胞的特异性和反应性重定向至所选择的靶标。非mhc限制性的抗原识别给予表达car的免疫细胞与抗原处理无关的识别抗原的能力,因此绕过了肿瘤逃逸的主要机制。
[0054]
在一个实施方案中,本发明提供的工程化免疫细胞表达的car包含靶向cd7的抗原结合区、跨膜结构域和胞内信号传导区,所述胞内信号传导区包含共刺激结构域和初级信号传导结构域。在一个优选的实施方案中,本发明的嵌合抗原受体的胞内信号传导区进一步包含γc链或其胞内区。还更优选地,在一个实施方案中,所述胞内信号传导区由共刺激结构域、初级信号传导结构域,和γc链或其胞内区组成;即,嵌合抗原受体的胞内信号传导区除了共刺激结构域、初级信号传导结构域,以及γc链或其胞内区之外,并不包含其他具有信号传导作用的结构。
[0055]
如本文所用,“抗原结合区”是指可以与抗原结合的任何结构或其功能性变体。抗原结合区可以是抗体或其抗原结合部分。如本文所用,术语“抗体”具有本领域技术人员所理解的最广泛的含义,并且包括单克隆抗体(包含完整抗体)、多克隆抗体、多价抗体、多特
异性抗体(例如双特异性抗体)、和能够表现期望的生物活性的携带一个或多个cdr序列的抗体片段或合成多肽。本发明的抗体也包含重组抗体、人抗体、人源化抗体、鼠源抗体、嵌合抗体及其抗原结合部分。“抗体片段”或“抗原结合部分”是指完整抗体的一部分,一般包含完整抗体的抗原结合位点并因此保留结合抗原的能力。本发明中的抗体片段的实例包括但不限于:fab、fab'、f(ab')2、fd片段、fd
′
、fv片段、scfv、二硫键-连接的fv(sdfv)、抗体的重链可变区(vh)或轻链可变区(vl)、线性抗体、具有两个抗原结合位点的“双体”、单结构域抗体、纳米抗体、所述抗原的天然配体或其功能性片段等。因此,本发明的“抗体”涵盖如上定义的抗体片段或抗原结合部分。
[0056]
因此,在一个实施方案中,本发明的靶向cd7的抗原结合区选自igg、fab、fab'、f(ab')2、fd、fd
′
、fv、scfv、sdfv、线性抗体、单结构域抗体、纳米抗体和双体,优选选自fab、scfv、单结构域抗体和纳米抗体,最优选是scfv。在本发明中,抗原结合区可以是单价或二价,且可以是单特异性、双特异性或多特异性的抗体。
[0057]“fab”是指免疫球蛋白分子被木瓜蛋白酶裂解后产生的两个相同片段中的任一个,由通过二硫键连接的完整轻链和重链n端部分组成,其中重链n端部分包括重链可变区和ch1。与完整的igg相比,fab没有fc片段,流动性和组织穿透能力较高,并且无需介导抗体效应即可单价结合抗原。
[0058]“单链抗体”和“scfv”在本文中可互换使用,是指由抗体重链可变区(vh)和轻链可变区(vl)通过接头连接而成的抗体。接头的最佳长度和/或氨基酸组成可以根据需要确定。接头的长度会明显影响scfv的可变区折叠和相互作用情况。事实上,如果使用较短的接头(例如在5-10个氨基酸之间),则可以防止链内折叠。关于接头的大小和组成的选择,参见例如,hollinger等人,1993procnatl acad.sci.u.s.a.90:6444-6448;美国专利申请公布号2005/0100543、2005/0175606、2007/0014794;以及pct公布号wo2006/020258和wo2007/024715,其全文通过引用并入本文。常用的接头例如gstsgsgkpgsgegstkg(seq id no:43)、ggggsggggsggggs(seq id no:44)。scfv可以包含以任何顺序连接的vh和vl,例如vh-接头-vl或vl-接头-vh。
[0059]“单结构域抗体”或“sdab”是指一种天然缺失轻链的抗体,该抗体只包含一个重链可变区(vhh)和两个常规的ch2与ch3区,也称为“重链抗体”。
[0060]“纳米抗体”或“nb”是指单独克隆并表达出来的vhh结构,其具有与原重链抗体相当的结构稳定性以及与抗原的结合活性,是目前已知的可结合目标抗原的最小单位。
[0061]
术语“功能性变体”或“功能性片段”是指基本上包含亲本的氨基酸序列但与该亲本氨基酸序列相比含有至少一个氨基酸修饰(即取代、缺失或插入)的变体,条件是所述变体保留亲本氨基酸序列的生物活性。在一个实施方案中,所述氨基酸修饰优选是保守型修饰。
[0062]
如本文所用,术语“保守性修饰”是指不会明显影响或改变含有该氨基酸序列的抗体或抗体片段的结合特征的氨基酸修饰。这些保守修饰包括氨基酸取代、添加及缺失。修饰可以通过本领域中已知的标准技术,如定点诱变和pcr介导的诱变而引入本发明的嵌合抗原受体中。保守氨基酸取代是氨基酸残基被具有类似侧链的氨基酸残基置换的取代。具有类似侧链的氨基酸残基家族已在本领域中有定义,包括碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷极性侧链(例如甘氨酸、天冬酰胺、谷氨
酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-分支侧链(例如苏氨酸、缬氨酸、异亮氨酸)及芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。保守性修饰可以例如基于极性、电荷、溶解度、疏水性、亲水性和/或所涉及残基的两亲性质的相似性来进行选择。
[0063]
因此,“功能性变体”或“功能性片段”与亲本氨基酸序列具有至少75%,优选至少76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性,并且保留亲本氨基酸的生物活性,例如结合活性。
[0064]
如本文所用,术语“序列同一性”表示两个(核苷酸或氨基酸)序列在比对中在相同位置处具有相同残基的程度,并且通常表示为百分数。优选地,同一性在被比较的序列的整体长度上确定。因此,具有完全相同序列的两个拷贝具有100%同一性。本领域技术人员将认识到,一些算法可以用于使用标准参数来确定序列同一性,例如blast(altschul等(1997)nucleic acids res.25:3389-3402)、blast2(altschul等(1990)j.mol.biol.215:403-410)、smith-waterman(smith等(1981)j.mol.biol.147:195-197)和clustalw。
[0065]
在一个实施方案中,本发明的嵌合抗原受体包含的靶向cd7的抗原结合区是抗cd7抗体或其抗原受体,其包含如seq id no:1、2、和3所示的cdr-l1、cdr-l2和cdr-l3,和如seq id no:4、5和6所示的cdr-h1、cdr-h2和cdr-h3。优选地,本发明的靶向cd7的抗体包含与选自seq id no:7所示的氨基酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%、98%、99%或100%序列同一性的轻链可变区和与选自seq id no:8所示的氨基酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%、98%、99%或100%序列同一性的重链可变区。更优选地,本发明的嵌合抗原受体包含抗cd7抗体,其氨基酸序列如seq id no:9所示。
[0066]
如本文所用,术语“跨膜结构域”是指能够使嵌合抗原受体在免疫细胞(例如淋巴细胞、nk细胞或nkt细胞)表面上表达,并且引导免疫细胞针对靶细胞的细胞应答的多肽结构。跨膜结构域可以是天然或合成的,也可以源自任何膜结合蛋白或跨膜蛋白。当嵌合受体多肽与靶抗原结合时,跨膜结构域能够进行信号传导。特别适用于本发明中的跨膜结构域可以源自例如tcrα链、tcrβ链、tcrγ链、tcrδ链、cd3ζ亚基、cd3ε亚基、cd3γ亚基、cd3δ亚基、cd45、cd4、cd5、cd8α、cd9、cd16、cd22、cd33、cd28、cd37、cd64、cd80、cd86、cd134、cd137、cd154及其功能性片段。或者,跨膜结构域可以是合成的并且可以主要地包含疏水性残基如亮氨酸和缬氨酸。优选地,所述跨膜结构域源自人cd8α链,其与seq id no:19所示的氨基酸序列或与seq id no:20所示的核苷酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%或99%或100%的序列同一性。
[0067]
在一个实施方案中,本发明的嵌合抗原受体还可以包含位于抗原结合区和跨膜结构域之间的铰链区。如本文所用,术语“铰链区”一般是指作用为连接跨膜结构域至抗原结合区的任何寡肽或多肽。具体地,铰链区用来为抗原结合区提供更大的灵活性和可及性。铰链区可以包含最多达300个氨基酸,优选10至100个氨基酸并且最优选25至50个氨基酸。铰链区可以全部或部分源自天然分子,如全部或部分源自cd8、cd4或cd28的胞外区,或全部或部分源自抗体恒定区。或者,铰链区可以是对应于天然存在的铰链序列的合成序列,或可以是完全合成的铰链序列。在优选的实施方式中,所述铰链区包含cd8α链、cd28、fcγriiiα受
体、igg4或igg1的铰链区部分,更优选cd8α、cd28或igg4铰链,其与seq id no:33、35或37所示的氨基酸序列或与seq id no:34、36或38所示的核苷酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%或99%或100%的序列同一性。
[0068]
如本文所用,术语“初级信号传导结构域”是指转导效应子功能信号并指导细胞进行指定功能的蛋白质部分。初级信号传导结构域负责在抗原结合区结合抗原以后的细胞内初级信号传递,从而导致免疫细胞和免疫反应的活化。换言之,初级信号传导结构域负责活化其中表达car的免疫细胞的正常的效应子功能的至少一种。例如,t细胞的效应子功能可以是细胞溶解活性或辅助活性,包括细胞因子的分泌。
[0069]
在一个实施方案中,本发明的嵌合抗原受体包含的初级信号传导结构域可以是t细胞受体和共受体的细胞质序列,其在抗原受体结合以后一同起作用以引发初级信号传导,以及这些序列的任何衍生物或变体和具有相同或相似功能的任何合成序列。初级信号传导结构域可以包含许多免疫受体酪氨酸激活基序(immunoreceptor tyrosine-based activation motifs,itam)。本发明的初级信号传导结构域的非限制性施例包括但不限于源自fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd3ζ、cd22、cd79a、cd79b和cd66d的那些。在优选的实施方式中,本发明car的初级信号转导结构域可以包含cd3ζ信号传导结构域,该信号传导结构域与seq id no:27所示的氨基酸序列或seq id no:28所示的核苷酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%或99%或100%的序列同一性。
[0070]
在一个实施方案中,本发明的嵌合抗原受体包含一个或多个共刺激结构域。共刺激结构域可以是来自共刺激分子的细胞内功能性信号传导结构域,其包含所述共刺激分子的整个细胞内部分,或其功能片段。“共刺激分子”是指在t细胞上与共刺激配体特异性结合,由此介导t细胞的共刺激反应(例如增殖)的同源结合配偶体。共刺激分子包括但不限于1类mhc分子、btla和toll配体受体。本发明的共刺激结构域的非限制性施例包括但不限于源自以下蛋白质的胞内区:tlr1、tlr2、tlr3、tlr4、tlr5、tlr6、tlr7、tlr8、tlr9、tlr10、card11、cd2、cd7、cd8、cd18、cd27、cd28、cd30、cd40、cd54、cd83、cd134(ox40)、cd137(4-1bb)、cd270(hvem)、cd272(btla)、cd276(b7-h3)、cd278(icos)、cd357(gitr)、dap10、lat、nkg2c、slp76、pd-1、light、trim以及zap70。
[0071]
在一个优选的实施方案中,所述共刺激结构域包含一个或多个选自以下蛋白质的胞内区:dap10、dap12、cd27、cd28、cd134、4-1bb或cd278。例如,在一个实施方案中,所述共刺激结构域包含4-1bb的胞内区。在一个实施方案中,所述共刺激结构域包含cd28的胞内区。在一个实施方案中,所述共刺激结构域包含4-1bb的胞内区和cd28的胞内区。
[0072]
在一个实施方案中,4-1bb的胞内区与seq id no:25所示的氨基酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%或99%或100%的序列同一性,或其编码序列与seq id no:26所示的核苷酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%或99%或100%的序列同一性。在一个实施方案中,cd28的胞内区与seq id no:23所示的氨基酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%或99%或100%的序列同一性,或其编码序列与seq id no:24所示的核苷酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%或99%或100%的序列同一性。
[0073]
在一个实施方案中,除了共刺激结构域和细初级信号传导结构域用作信号传导之外,本发明的嵌合抗原受体还可以包含γc链或其胞内区以增强信号传导。
[0074]
在一个更优选的实施方案中,本发明的嵌合抗原受体的胞内信号传导区(即,用于信号传导的结构)由共刺激结构域、初级信号传导结构域,和γc链或其胞内区这三种信号传导结构组成。这意味着在该实施方案中,嵌合抗原受体不包含第四种信号传导结构,例如其他细胞因子的信号传导区,如il-2ra、il2ra、il2rb、il4ra、il7ra、il9ra、il15ra、il21ra等的胞内区。
[0075]
在一个实施方案中,可用于本发明的γc链与seq id no:40所示的氨基酸序列或seq id no:39所示的核苷酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%或99%或100%的序列同一性。在一个实施方案中,可用于本发明的γc链胞内区与seq id no:42所示的氨基酸序列或seq id no:41所示的核苷酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%或99%或100%的序列同一性。优选地,本发明的γc链如seq id no:40所示,其胞内区如seq id no:42所示。
[0076]
在一个实施方案中,本发明的car还可以包含信号肽,使得当其在细胞例如t细胞中表达时,新生蛋白质被引导至内质网并随后引导至细胞表面。信号肽的核心可以含有长的疏水性氨基酸区段,其具有形成单个α-螺旋的倾向。在信号肽的末端,通常有被信号肽酶识别和切割的氨基酸区段。信号肽酶可以在移位期间或完成后切割,以产生游离信号肽和成熟蛋白。然后,游离信号肽被特定蛋白酶消化。可用于本发明的信号肽是本领域技术人员熟知的,例如衍生自cd8α、igg1、gm-csfrα等的信号肽。
[0077]
在一个实施方案中,本发明的car还可以包含开关结构,以调控car的表达时间。例如,开关结构可以是二聚化结构域的形式,通过与其相应配体的结合引起构象变化,暴露胞外的抗原结合区,使其与被靶向抗原结合,从而激活信号传导通路。或者,也可以使用开关结构分别连接抗原结合区和信号传导结构域,仅当开关结构互相结合(例如在诱导化合物的存在下)时,抗原结合区和信号传导结构域才能通过二聚体连接在一起,从而激活信号通路。开关结构还可以是掩蔽肽的形式。掩蔽肽可以遮蔽胞外的抗原结合区,阻止其与被靶向抗原的结合,当通过例如蛋白酶切割掩蔽肽后,就可以暴露胞外的抗原结合区,使其成为一个“普通”的car结构。本领域技术人员知晓的各种开关结构均可用于本发明。
[0078]
在一个实施方案中,本发明的car还可以包含自杀基因,即,使其表达一个可通过外源物质诱导的细胞死亡信号,以在需要时(例如产生严重的毒副作用时)清除car细胞。例如,自杀基因可以是插入的表位的形式,例如cd20表位、rqr8等,当需要时,可以通过加入靶向这些表位的抗体或试剂来消除car细胞。自杀基因也可以是单纯疱疹病毒胸苷激酶(hsv-tk),该基因可使细胞在接受更昔洛韦治疗诱导下死亡。自杀基因还可以是icaspase-9,可以通过化学诱导药物如ap1903、ap20187等诱导icaspase-9发生二聚化,从而激活下游的caspase3分子,导致细胞凋亡。本领域技术人员知晓的各种自杀基因均可用于本发明。
[0079]
iii工程化免疫细胞
[0080]
a.免疫细胞
[0081]
如本文所用,术语“免疫细胞”是指免疫系统的具有一种或多种效应子功能(例如,细胞毒性细胞杀伤活性、分泌细胞因子、诱导adcc和/或cdc)的任何细胞。例如,免疫细胞可以是t细胞、巨噬细胞、树突状细胞、单核细胞、nk细胞和/或nkt细胞。在一个实施方案中,免疫细胞衍生自干细胞,例如成体干细胞、胚胎干细胞、脐带血干细胞、祖细胞、骨髓干细胞、诱导多能干细胞、全能干细胞或造血干细胞等。优选地,免疫细胞是t细胞。t细胞可以是任
何t细胞,如体外培养的t细胞,例如原代t细胞,或者来自体外培养的t细胞系例如jurkat、supt1等的t细胞,或获得自受试者的t细胞。受试者的实例包括人、狗、猫、小鼠、大鼠及其转基因物种。t细胞可以从多种来源获得,包括外周血单核细胞、骨髓、淋巴结组织、脐血、胸腺组织、来自感染部位的组织、腹水、胸膜积液、脾组织及肿瘤。t细胞也可以被浓缩或纯化。t细胞可以是任何类型的t细胞并且可以处于任何发育阶段,包括但不限于,cd4+/cd8+双阳性t细胞、cd4+辅助t细胞(例如th1和th2细胞)、cd8+t细胞(例如,细胞毒性t细胞)、肿瘤浸润细胞、记忆t细胞、幼稚t细胞、γδ-t细胞、αβ-t细胞等。在一个优选的实施方案中,免疫细胞是人t细胞。可以使用本领域技术人员已知的多种技术,如ficoll分离从受试者的血液获得t细胞。在本发明中,免疫细胞被工程化以表达嵌合抗原受体多肽。
[0082]
在一个实施方案中,向受试者施用的工程化免疫细胞包含多种细胞群或亚型(例如cd4+和cd8+细胞或亚型)。例如,工程化免疫细胞可以包含一定比例的cd4+和cd8+细胞,所述比例(cd4+细胞:cd8+细胞)在1:5至5:1之间、1:3至3:1之间、或1:2至2:1之间,例如为5:1、4.5:1、4:1、3.5:1、3:1、2.5:1、2:1、1.9:1、1.8:1、1.7:1、1.6:1、1.5:1、1.4:1、1.3:1、1.2:1、1.1:1、1:1、1:1.1、1:1.2、1:1.3、1:1.4、1:1.5、1:1.6、1:1.7、1:1.8、1:1.9、1:2、1:2.5、1:3、1:3.5、1:4、1:4.5或1:5。
[0083]
b.内源性基因的抑制或沉默
[0084]
在一个实施方案中,本发明提供的工程化免疫细胞的内源性cd7、至少一种tcr/cd3基因和至少一种mhc-ii类相关基因的表达被抑制或沉默。
[0085]
在一个实施方案中,至少一种tcr/cd3基因选自:trac、trbc、cd3γ、cd3δ、cd3ε、cd3ζ,优选trac或trbc。
[0086]
在一个实施方案中,至少一种mhc-ii类相关基因包括mhc-ii类基因本身,以及与mhc-ii类基因相互作用或调控其表达的基因。例如,至少一种mhc-ii类相关基因选自:hla-dpa、hla-dq、hla-dra、rfx5、rfxap、rfxank和ciita,优选选自rfx5、rfxap、rfxank和ciita。
[0087]
在一个实施方案中,car-t细胞中的内源性mhc-i类基因(例如hla-a、hla-b、hla-c、b2m等)是功能性的。在另一个实施方案中,car-t细胞中的内源性mhc-i类基因的表达也被抑制或沉默。
[0088]
在一个实施方案中,除了cd7、mhc-ii类相关基因和tcr/cd3基因,本发明的工程化免疫细胞还可以包含至少一种选自以下的基因的表达被抑制或沉默:cd52、gr、dck和免疫检查点基因,如pd1、lag3、tim3、ctla4、ppp2ca、ppp2cb、ptpn6、ptpn22、pdcd1、havcr2、btla、cd160、tigit、cd96、crtam、tnfrsf10b、tnfrsf10a、casp8、casp10、casp3、casp6、casp7、fadd、fas、tgfbrii、tgfrbri、smad2、smad3、smad4、smad10、ski、skil、tgif1、il10ra、il10rb、hmox2、il6r、il6st、eif2ak4、csk、pag1、sit、foxp3、prdm1、batf、gucy1a2、gucy1a3、gucy1b2和gucy1b3。
[0089]
抑制基因表达或使基因沉默的方法是本领域技术人员熟知的,包括但不限于例如通过大范围核酸酶、锌指核酸酶、tale核酸酶或crispr系统中的cas酶介导dna断裂、或通过反义寡核苷酸、rnai、shrna等技术使基因失活。
[0090]
c.nk抑制性分子的表达
[0091]
在一个实施方案中,为了抑制患者体内nk细胞对car-t细胞的杀伤,所述工程化免疫细胞进一步表达nk抑制性分子,所述nk抑制性分子包含一个或多个nk抑制性配体、跨膜
结构域和共刺激结构域。例如,所述nk抑制性分子包含一个或两个nk抑制性配体、跨膜结构域和共刺激结构域。
[0092]
在一个实施方案中,nk抑制性分子不包含初级信号传导结构域。在另一个实施方案中,nk抑制性分子进一步包含初级信号传导结构域。
[0093]
nk抑制性分子中包含的跨膜结构域、共刺激结构域和初级信号传导结构域的定义与上述“嵌合抗原受体”章节中包含的跨膜结构域、共刺激结构域和初级信号传导结构域的定义相同。
[0094]
在一个实施方案中,所述nk抑制性配体是靶向nk抑制性受体的抗体,所述nk抑制性受体选自nkg2/cd94组分(例如nkg2a、nkg2b、cd94);杀伤细胞ig样受体(kir)家族成员(例如kir2dl1、kir2dl2/3、kir2dl5a、kir2dl5b、kir3dl1、kir3dl2和kir3dl3);白细胞ig样受体(lir)家族成员(例如lir1、lir2、lir3、lir5和lir8);nk细胞受体蛋白1(nkr-p1)家族成员(例如nkr-p1b和nkr-p1d);免疫检查点受体(如pd-1、tigit和cd96、tim3、lag3);癌胚抗原相关的细胞黏附分子1(ceacam1);唾液酸结合性免疫球蛋白样凝集素(siglec)家族成员(例如siglec7和siglec9);白细胞相关的免疫球蛋白样受体1(lair1);ly49家族成员(例如ly49a、ly49c、ly49f、ly49g1和ly49g4)和杀伤细胞凝集素样受体g1(klrg1)。优选地,所述nk抑制性受体优选自nkg2a、nkg2b、cd94、lir1、lir2、lir3、lir5、lir8、kir2dl1、kir2dl2/3、kir2dl5a、kir2dl5b、kir3dl1、kir3dl2、kir3dl3、ceacam1、lair1、nkr-p1b、nkr-p1d、pd-1、tigit、cd96、tim3、lag3、siglec7、siglec9、ly49a、ly49c、ly49f、ly49g1、ly49g4和klrg1。更优选地,所述nk抑制性受体选自nkg2a、nkg2b、cd94、lir1、lir2、lir3、kir2dl1、kir2dl2/3、kir3dl1、ceacam1、lair1和klrg1。还更优选地,所述nk抑制性受体选自nkg2a、nkg2b、lir1、kir2dl1、kir2dl2/3、kir3dl1、ceacam1、lair1和klrg1。
[0095]
在一个实施方案中,nk抑制性配体是靶向nk抑制性受体的抗体,所述抗体是完整抗体、fab、fab’、f(ab’)2、fv片段、scfv抗体片段、线性抗体、sdab或纳米抗体。
[0096]
在一个优选的实施方案中,nk抑制性配体是靶向nkg2a的抗体。更优选地,所述靶向nkg2a的抗体包含如seq id no:10、11、和12所示的cdr-l1、cdr-l2和cdr-l3,和如seq id no:13、14和15所示的cdr-h1、cdr-h2和cdr-h3。更优选地,所述靶向nkg2a的抗体包含与seq id no:16所示的氨基酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%、99%或100%序列同一性的轻链可变区序列和与seq id no:17所示的氨基酸序列具有至少70%,优选至少80%,更优选至少90%、95%、97%、99%或100%序列同一性的重链可变区序列。更优选地,所述靶向nkg2a的抗体的氨基酸序列如seq id no:18所示。本领域已知的其他靶向nkg2a的抗体也可用于本发明,例如z270(可获自immunotech,france)、z199(可获得自beckman coulter,usa)、20d5(可获得自bd biosciences pharmingen,usa)、p25(可获自morettaetal,univ.genova,italy)等。
[0097]
iv组合物和制品
[0098]
本发明提供的工程化免疫细胞一般以药物组合物的形式向受试者施用,所述药物组合物包含上述定义的工程化免疫细胞作为活性剂,和一种或多种药学上可接受的赋型剂。
[0099]
如本文所用,术语“药学上可接受的赋型剂”是指在药理学和/或生理学上与受试者和活性成分相容(即,能够引发所需的治疗效果而不会引起任何不希望的局部或全身作
用)的载体和/或赋形剂,其是本领域公知的(参见例如remington'spharmaceutical sciences.edited by gennaro ar,19th ed.pennsylvania:mack publishing company,1995)。药学上可接受的赋型剂的实例包括但不限于填充剂、粘合剂、崩解剂、包衣剂、吸附剂、抗粘附剂、助流剂、抗氧化剂、调味剂、着色剂、甜味剂、溶剂、共溶剂、缓冲剂、螯合剂、表面活性剂、稀释剂、润湿剂、防腐剂、乳化剂、包覆剂、等渗剂、吸收延迟剂、稳定剂和张力调节剂。本领域技术人员已知选择合适的赋型剂以制备本发明期望的药物组合物。通常,合适的赋形剂的选择尤其取决于所使用的活性剂、待治疗的疾病和药物组合物的期望剂型。
[0100]
在一个具体的实施方案中,赋形剂包括选自以下的一种或多种:防腐剂,例如十八烷基二甲基苄基氯化铵、六甲氯铵、苯扎氯铵、苄索氯铵、苯酚、丁醇或苄醇、烷基对羟基苯甲酸酯(例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯)、儿茶酚、间苯二酚、环己醇、3-戊醇、间甲酚;缓冲剂,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,例如抗坏血酸和甲硫氨酸;低分子量(少于约10个残基)多肽;蛋白质,例如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂例如edta;糖类,例如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐抗衡离子例如钠;金属络合物(例如,锌-蛋白质络合物);和/或非离子表面活性剂如聚乙二醇(peg)。
[0101]
组合物还可含有多种活性成分,其可用于用工程化免疫细胞预防或治疗的特定适应症、疾病或病况,其中各自的活性不会相互产生不利影响。这种活性成分适合以对预期目的有效的量组合存在。因此,在一些实施方案中,药物组合物除工程化免疫细胞之外进一步包含其他活性成分,如化学治疗剂,例如天冬酰胺酶、白消安、卡铂、顺铂、柔红霉素、多柔比星、氟尿嘧啶、吉西他滨、羟基脲、甲氨蝶呤、紫杉醇、利妥昔单抗、长春碱、长春新碱等。
[0102]
活性成分(例如工程化免疫细胞和/或其他活性成分)可以包埋在微胶囊、胶体药物递送系统(例如,脂质体、白蛋白微球、微乳液、纳米颗粒和纳米胶囊)或粗乳液中。在某些实施方案中,将药物组合物配制为包合复合物,或配制为脂质体。脂质体可用于将活性成分(例如,工程化的t细胞或nk细胞)靶向特定组织。
[0103]
在一些方面,药物组合物可以采用定时释放、延迟释放和持续释放递送系统,使得组合物的递送发生在待治疗部位的致敏之前,并且有足够的时间引起致敏。许多类型的释放递送系统是已知的。
[0104]
可以通过任何合适的方式施用药物组合物,例如通过输注,通过注射例如静脉内或皮下注射、眼内注射、眼周注射、视网膜下注射、玻璃体内注射、经中隔注射、巩膜下注射、脉络膜内注射、前房注射、结膜下注射、结膜下注射、眼球筋膜囊下注射、球后注射、球周注射或后巩膜递送。在一些实施方案中,通过肠胃外、肺内和鼻内施用以及(如果需要用于局部治疗的话)病灶内施用。肠胃外施用包括肌肉内、静脉内、动脉内、腹膜内或皮下施用。
[0105]
在一些实施方案中,组合物是无菌液体制剂,例如等渗水溶液、悬浮液、乳液、分散体或粘性组合物,其在一些方面可以缓冲至选择的ph。液体制剂通常比凝胶、其他粘性组合物和固体组合物更容易制备。另外,液体组合物稍微更方便施用,特别是通过注射。在另一方面,粘性组合物可以配制在适当的粘度范围内,以提供与特定组织的更长的接触时间。液体或粘性组合物可包含载体,该载体可以是含有例如水、盐水、磷酸盐缓冲盐水、多元醇(例如甘油、丙二醇、液体聚乙二醇)及其合适的混合物的溶剂或分散介质。
250mg/m2)+环磷酰胺(总剂量范围约300mg-3500mg/m2)+依托泊苷(总剂量范围约150-750mg))或fcm方案(氟达拉滨(总剂量范围约30mg-250mg/m2)+环磷酰胺(总剂量范围约300mg-3500mg/m2)+马法兰(总剂量范围约50-750mg/m2))对待治疗的患有cd7阳性肿瘤的受试者进行清除淋巴细胞的预处理。
[0116]
在d0,向受试者施用第一剂量的靶向cd7的通用型ucar-t细胞。
[0117]
在输注后约第1天至约第90天(d1至d90),评估受试者对施用第一剂量的ucar-t细胞的应答反应。通过流式细胞术或qpcr等技术确定经治疗的受试者的外周血和骨髓中car-t细胞的扩增和持续性。肿瘤微小残留病(mrd)阳性或car-t持续性丧失提示ucar-t细胞的后续施用。一般而言,在施用第一剂量之后的第5-90天,优选第5-60天之间施用后续剂量(例如,第二剂量)。在另一个实施方案中,也可以在受试者接受第一剂量的工程化免疫细胞之后,定期向受试者施用后续剂量的工程化免疫细胞,例如每隔5周、6周、7周、8周、9周或10周向受试者施用后续剂量的工程化免疫细胞。在该实施方案中,受试者总计接受3、4、5、6、7、8、9或10个剂量的工程化免疫细胞。
[0118]
在ucar-t细胞的后续施用之前,基于肿瘤负荷、骨髓抑制程度、crs反应、患者自体t淋巴细胞恢复的情况等因素,确定受试者是否接受清除淋巴细胞的二次预处理。在接受二次预处理的情况下,后续剂量在完成二次预处理后的2-14天内向受试者施用。
[0119]
后续剂量的大小是受试者特异性的,并且基于肿瘤负荷、ucar-t细胞的扩增情况和持久性、crs程度、神经毒性程度、gvhd程度、受试者骨髓毒性恢复等进行确定。通过流式细胞术或qpcr等技术确定经治疗的受试者的外周血和骨髓中ucar-t细胞的扩增和持续性。可以向一些受试者施用多个剂量的通用型ucar-t细胞,直到达到mrd阴性。
[0120]
在施用第一剂量或后续剂量后,评估受试者的疾病状态以评估其对ucar-t细胞的应答反应。具体地,除了根据美国移植和细胞治疗学会(astct)标准评估免疫效应细胞相关神经毒性(icans)和细胞因子释放综合征(crs)的发生率和等级,还根据lugano2014版淋巴瘤治疗反应标准评估car-t细胞对复发/难治性t细胞淋巴母细胞淋巴瘤(t-lbl)的疗效(表3),并根据美国国家综合癌症网络(nccn)标准评估car-t细胞对复发/难治性t细胞急性淋巴细胞白血病的疗效(表4)。
[0121]
表3.复发/难治性t-lbl的示例性疗效评价标准
[0122]
[0123][0124]
表4.复发/难治性t-all的示例性疗效评价标准
[0125][0126]
实施例3.用靶向cd7的通用型ucar-t细胞治疗具有cd7+复发/难治性t-all或t-lbl的成人受试者
[0127]
向患有cd7+复发/难治性t细胞急性淋巴细胞性白血病(t-all)或t细胞淋巴母细胞淋巴瘤/白血病(t-lbl)的8名成人受试者施用实施例1制备的靶向cd7的通用型ucar-t细胞。
[0128]
受试者的年龄范围为26岁至66岁,平均年龄45岁。受试者先前均接受过重度治疗,既往治疗管线中位数4.5,范围为2至8条管线;距离最近一次复发中位时间2.34个月,范围为0.53至5.53个月;其中两例受试者为既往接受过造血干细胞移植后复发;2例受试者伴有高风险基因损害,其中一例为tel-abl及idh2高危基因损害,另一例为bcor及ezh2高危基因损害。预处理前骨髓原始细胞比例中位数为29%,极差为0%至95%。8例受试者中7例伴有骨髓病变,1例为单纯的髓外复发;4例伴有髓外病变,包括1例存在中枢神经系统白血病,cnsl分级为3级。受试者的人口统计学和基线特征如表5所示。
[0129]
表5.人口统计学和基线特征
[0130][0131]
8例受试者的预处理方案以及ucar-t细胞施用方案及其对car-t细胞治疗的响应结果如表6所示,其中响应结果包括疗效评价,以及是否存在严重的crs和神经毒性。在8例受试者中,1例受试者在获得可评估结果前死亡。在剩余的7例可评估受试者中,观察到5例对治疗有应答,总orr为71.4%(5/7),其中4例受试者获得mrd-,比例为80%(4/5)。此外,在7例可评估受试者中,6例受试者存在骨髓病变,其均获得骨髓形态学cr/cri;其中5例获得骨髓mrd-,1例获得mrd+。值得注意的是,所有受试者均没有观察到任何级别的icans,并且仅发生1-2级的crs,而没有产生3级或更严重的crs,这表明本发明所述剂量方案在治疗成人患者方面的安全性非常好。
[0132]
表6的结果表明,使用本发明所述的剂量方案,向具有形态学疾病的受试者施用第一剂量的ucar-t细胞,并根据需要在肿瘤负荷稳定或已经减少或进展后施用更高或相当的后续剂量,可以使毒性最小化且功效最大化,并且没有严重的crs或神经毒性风险。在某些情况下,一些受试者对第一剂量不具有反应性(nr)甚至发生疾病进展(pd)(参见2号和6号受试者),从而未能实现肿瘤负荷水平的稳定或降低,但在这些受试者中也没有观察到严重的crs或神经毒性风险。这表明,即使某些受试者没有对第一剂量或第二剂量产生反应,再次施用后续剂量后发生严重crs或神经毒性的风险也较低。
[0133]
为了进一步评估在施用第一剂量和后续剂量后的ucar-t细胞在体内的扩增和持
久性,定期通过qpcr和流式细胞术检测外周血中的ucar-t细胞的扩增及持续情况,结果如图2(qpcr)和图3(流式细胞术)所示。可以看出,在所有受试者中均检测到ucar-t细胞的扩增,并且获得cr/cri的应答者(图2a和图3a)和无应答者(图2b和图3b)均在7-21天左右达到扩增峰值。此外,还通过流式细胞术检测了il-6、il-2和ifn-γ的水平,结果如图4所示。可以看出,在接受ucar-t细胞治疗后,在获得cr/cri的受试者中均观察到这三种细胞因子的升高,而在无应答的受试者中,细胞因子的水平则快速降低(2号受试者)或者一直维持在较低水平(6号受试者)。
[0134]
表6.car-t细胞在成人受试者中的安全性和功效
[0135]
[0136][0137]
f:氟达拉滨;c:环磷酰胺;v:依托泊苷;m:马法兰;
[0138]
cr/cri:完全缓解/cr伴血细胞不完全恢复(cri);nr:无反应;pd:疾病进展;mrd:微小残留病灶
[0139]
※
在获得可评估疗效前,该患者死亡。
[0140]
实施例4.用靶向cd7的通用型ucar-t细胞治疗具有cd7+复发/难治性t-all或t-lbl的儿童受试者
[0141]
向患有cd7+复发/难治性t细胞急性淋巴细胞性白血病(t-all)或t细胞淋巴母细胞淋巴瘤/白血病(t-lbl)的2名儿童受试者施用实施例1制备的靶向cd7的通用型ucar-t细胞。
[0142]
两例受试者均为原发难治性疾病,基线骨髓原始细胞比例分别为8.5%及14.7%,其中一例受试者为t-lbl伴有髓系表达。2例受试者的施用方案及其对car-t细胞治疗的响应结果如表7所示,其中响应结果包括疗效评价,以及是否存在严重的crs和神经毒性。经治疗,1例受试者获得pr,1例受试者无反应,orr为50%。在2例受试中者均没有观察到任何级
别的icans,并且仅在1例受试者中发生1级crs,这表明本发明所述剂量方案在治疗儿童患者方面的安全性非常好。
[0143]
表7.car-t细胞在儿童受试者中的安全性和功效
[0144][0145]
f:氟达拉滨;c:环磷酰胺;v:依托泊苷;m:马法兰;
[0146]
实施例5.治疗具有cd7+复发/难治性t-all或t-lbl受试者的重复施用方案
[0147]
1号受试者患有复发/难治性cd7+t细胞急性淋巴细胞白血病。在施用ucar-t细胞之前,使患者接受fcv方案的淋巴细胞清除预处理方案,包括氟达拉滨30mg/m2/天x3天(d-7、d-6、d-5)、环磷酰胺500mg/m2/天x2天(d-6、d-5)和依托泊苷100mg/天x3天(d-5、d-4、d-3)。然后,在d0向该受试者单次注射第一剂量(约5
×
106个car+t细胞/kg)的ucar-t细胞。施用第一剂量后,观察到受试者在第2天发生2级crs反应,没有发生神经毒性。此外,通过qpcr检测ucar-t细胞的扩增水平,发现虽然在d3即可检测到ucar-t细胞水平略微升高,并在d5达到一个峰值(此时crs反应已消失),但随即在d7检测到ucar-t细胞拷贝数大幅下降且低于施用前的水平(图5)。在d7施用第二剂量(1
×
107个car+t细胞/kg),观察到受试者发生2级crs反应但没有发生神经毒性,并且ucar-t细胞数在d14达到第二峰值。该受试者最终获得cr(mrd-)。
[0148]
2号受试者患有复发/难治性cd7+t细胞急性淋巴细胞白血病,且其骨髓和髓外均发生肿瘤病变。在施用ucar-t细胞之前,使患者接受fcv方案的淋巴细胞清除预处理方案,包括氟达拉滨30mg/m2/天x3天(d-5、d-4、d-3)、环磷酰胺300mg/m2/天x3天(d-5、d-4、d-3)和依托泊苷100mg/天x3天(d-5、d-4、d-3)。然后,在d0向该受试者单次注射第一剂量(约1
×
107个car+t细胞/kg)的ucar-t细胞。施用第一剂量后,没有观察到受试者发生crs或神经毒性反应。此外,通过qpcr检测ucar-t细胞的扩增水平,发现ucar-t细胞水平扩增不明显且在d14下降(图5),因此决定施用第二剂量。在施用第二剂量之前,该受试者接受第二次fcv方案的淋巴细胞清除预处理,包括氟达拉滨30mg/m2/天x5天(d15、d16、d17、d18、d19)、环磷酰胺300mg/m2/天x5天(d15、d16、d17、d18、d19)和依托泊苷100mg/天x5天(d15、d16、d17、d18、d19)。在d22施用第二剂量(1
×
107个car+t细胞/kg),没有观察到受试者发生crs或神经毒性反应,并且ucar-t细胞数在d28达到峰值(图5)。该受试者的骨髓病灶最终获得mrd-,但髓外病灶未获得缓解。
[0149]
以上结果表明,在输注第一剂量的ucar-t细胞后,在没有严重的crs和神经毒性的
情况下,如果ucar-t细胞在体内扩增不明显或者数量持续下降,施用后续剂量将有助于疾病缓解。
[0150]
实施例6.用靶向cd7的通用型ucar-t细胞治疗具有cd7+复发/难治性t细胞淋巴瘤
[0151]
11号受试者是患有复发/难治性cd7+外周t细胞淋巴瘤,非特型(ptcl,nos)的男性患者,并且同时存在骨髓病灶和髓外病灶。在施用ucar-t细胞之前,使患者接受fcv方案的淋巴细胞清除预处理方案,包括氟达拉滨25mg/m2/天x5天(d-7、d-6、d-5、d-4、d-3)、环磷酰胺500mg/m2/天x5天(d-7、d-6、d-5、d-4、d-3)和依托泊苷100mg/天x5天(d-7、d-6、d-5、d-4、d-3)。然后,在d0向该受试者单次注射第一剂量(约2
×
107个car+t细胞/kg)的ucar-t细胞。施用后,观察到受试者在d9出现1级crs反应,但没有发生神经毒性。通过qpcr和流式细胞术检测外周血中的ucar-t细胞扩增水平,发现其扩增较快,并在d14左右达到峰值(图6)。该受试者的骨髓病灶最终获得cr,髓外病灶获得cr。
[0152]
12号受试者患有复发/难治性cd7+结外nk/t细胞淋巴瘤,鼻型(nktl)的女性患者,并且同时存在骨髓病灶和髓外病灶。在施用ucar-t细胞之前,使患者接受fcv方案的淋巴细胞清除预处理方案,包括氟达拉滨30mg/m2/天x5天(d-7、d-6、d-5、d-4、d-3)、环磷酰胺300mg/m2/天x5天(d-7、d-6、d-5、d-4、d-3)和依托泊苷100mg/天x5天(d-7、d-6、d-5、d-4、d-3)。然后,在d0向该受试者单次注射第一剂量(约2
×
107个car+t细胞/kg)的ucar-t细胞。施用后,受试者没有发生crs和神经毒性。通过qpcr和流式细胞术检测外周血中的ucar-t细胞扩增水平,发现其扩增较快,并在d14左右达到峰值(图6)。该受试者的骨髓病灶最终获得cr,髓外病灶获得pr。
[0153]
实施例7.患者的不良反应统计
[0154]
统计前述实施例中总计12例受试者的不良反应,包括crs、icans、gvhd以及其他不良事件,其中crs和icans根据美国移植和细胞治疗学会(astct)标准进行评估,gvhd根据美国国家综合癌症网络(nccn)标准进行评估,其他不良事件根据美国国家癌症研究所不良事件通用术语标准(ctcae 5.0)进行评估。统计结果如下表8所示。
[0155]
表8.不良反应统计
[0156][0157][0158]
以上结果表明,本发明中靶向cd7的ucar-t的施用方案在获得良好疗效的同时可以大幅降低发生不良事件的风险,安全性非常好。其中值得注意的是,在所有经治疗的受试者中,完全没有观察到icans和gvhd,并且发生的crs比例较低且多为轻微级别,而这些均是细胞免疫治疗尤其是car-t细胞治疗中最常发生的不良反应。
[0159]
需要说明的是,以上仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。本领域技术人员理解的是,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1