二鹅掌菜酚在作为和/或制备铁死亡抑制剂中的应用的制作方法
1.本发明属于药物技术领域,具体涉及二鹅掌菜酚在作为和/或制备铁死亡抑制剂中的应用。
背景技术:
2.铁死亡(ferroptosis)是一种新发现的不同于凋亡和坏死的细胞死亡方式,由铁依赖的脂质过氧化积累所引发,最早被用来描述小分子erastin诱导的细胞死亡形式,主要表现为细胞体积收缩,线粒体膜密度增加,并且无典型的凋亡和坏死表现。据报道,铁死亡与多种疾病有关,在癌症、炎症性疾病、神经退行性疾病以及糖尿病等疾病中都发挥着重要作用。
3.炎症反应是机体重要的生理过程,炎症的本质是机体对各种损伤性刺激的防御反应,适度的炎症反应对机体有利,过度的炎症反应则会对机体造成损害。目前,越来越多的证据表明,铁死亡在炎症中起着重要作用,参与多种炎症性疾病的发生和发展。一些化合物作为铁死亡抑制剂在某些疾病的实验模型中已显示出抗炎活性。例如,研究发现,脂多糖(lps)诱导的急性肺损伤小鼠模型中可发生与铁死亡相关的炎症反应,并且抑制铁死亡可有效减轻急性肺损伤小鼠的病情。因此,铁死亡抑制剂可能是一种有前景的治疗炎症性疾病的药物。
4.褐藻,在工业上多用作藻酸的来源,但在许多国家也被广泛用作食品。二鹅掌菜酚是一种根单宁,广泛存在于褐藻中。目前二鹅掌菜酚作为铁死亡抑制剂对炎症方面的作用在国内外尚未见报道。
技术实现要素:
5.本发明第一个方面的目的,在于提供二鹅掌菜酚或其衍生物在作为和/或制备铁死亡抑制剂中的应用。
6.本发明的第二方面的目的,在于提供二鹅掌菜酚或其衍生物在作为和/或制备铁积累抑制剂中的应用。
7.本发明的第三方面的目的,在于提供二鹅掌菜酚或其衍生物在作为和/或制备活性氧抑制剂中的应用。
8.本发明的第四方面的目的,在于提供二鹅掌菜酚或其衍生物在作为和/或制备铁死亡相关蛋白抑制剂中的应用。
9.本发明的第五方面的目的,在于提供二鹅掌菜酚或其衍生物在作为和/或制备slc7a11促进剂中的应用。
10.本发明的第六方面的目的,在于提供二鹅掌菜酚或其衍生物在制备抗炎药物中的应用。
11.本发明的第七方面的目的,在于提供二鹅掌菜酚或其衍生物在作为和/或制备cox
‑
2抑制剂中的应用。
12.本发明的第八方面的目的,在于提供二鹅掌菜酚或其衍生物在作为和/或制备inos抑制剂中的应用。
13.本发明的第九方面的目的,在于提供二鹅掌菜酚或其衍生物在制备预防和/或治疗铁死亡相关疾病的药物中的应用。
14.本发明的第十方面的目的,在于提供一种药物。
15.为了实现上述目的,本发明所采取的技术方案是:
16.本发明的第一个方面,提供二鹅掌菜酚或其衍生物在作为和/或制备铁死亡抑制剂中的应用。
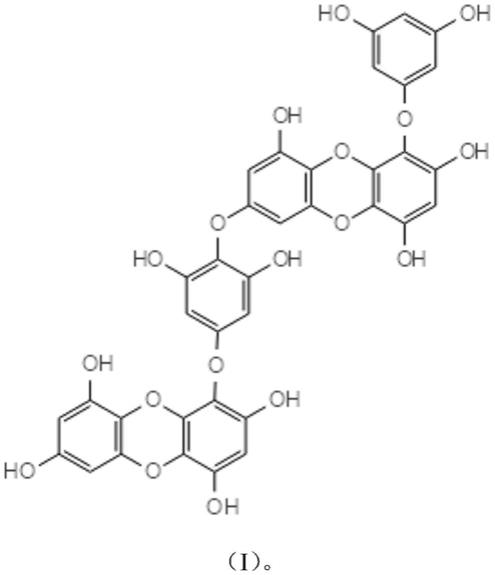
17.二鹅掌菜酚(dieckol)的分子式为c
36
h
22
o
18
,分子量为742.55,cas号为88095
‑
77
‑
6,化学结构式如式(i)所示。
[0018][0019]
优选地,所述衍生物包括二鹅掌菜酚在药学上可以接受的盐、酯、水合物、溶剂化物、多晶型物、互变异构体和前药。
[0020]
本发明的第二个方面,提供二鹅掌菜酚或其衍生物在作为和/或制备铁积累抑制剂中的应用。
[0021]
二鹅掌菜酚(dieckol)的分子式为c
36
h
22
o
18
,分子量为742.55,cas号为88095
‑
77
‑
6,化学结构式如式(i)所示。
[0022]
优选地,所述衍生物包括二鹅掌菜酚在药学上可以接受的盐、酯、水合物、溶剂化物、多晶型物、互变异构体和前药。
[0023]
优选地,所述铁积累抑制剂为亚铁离子蓄积抑制剂。
[0024]
本发明的第三个方面,提供二鹅掌菜酚或其衍生物在作为和/或制备活性氧抑制剂中的应用。
[0025]
二鹅掌菜酚(dieckol)的分子式为c
36
h
22
o
18
,分子量为742.55,cas号为88095
‑
77
‑
6,化学结构式如式(i)所示。
[0026]
优选地,所述衍生物包括二鹅掌菜酚在药学上可以接受的盐、酯、水合物、溶剂化物、多晶型物、互变异构体和前药。
[0027]
优选地,所述活性氧抑制剂为抑制活性氧的产生及累积的抑制剂。
[0028]
优选地,所述活性氧为脂质活性氧。
[0029]
本发明的第四个方面,提供二鹅掌菜酚或其衍生物在作为和/或制备铁死亡相关蛋白抑制剂中的应用。
[0030]
优选地,所述铁死亡相关蛋白为前列腺素内过氧化物合酶2(ptgs2)和/或转铁蛋白(tf)。
[0031]
二鹅掌菜酚(dieckol)的分子式为c
36
h
22
o
18
,分子量为742.55,cas号为88095
‑
77
‑
6,化学结构式如式(i)所示。
[0032]
优选地,所述衍生物包括二鹅掌菜酚在药学上可以接受的盐、酯、水合物、溶剂化物、多晶型物、互变异构体和前药。
[0033]
优选地,所述铁死亡相关蛋白抑制剂为抑制铁死亡相关蛋白表达的抑制剂。
[0034]
本发明的第五个方面,提供二鹅掌菜酚或其衍生物在作为和/或制备slc7a11促进剂中的应用。
[0035]
二鹅掌菜酚(dieckol)的分子式为c
36
h
22
o
18
,分子量为742.55,cas号为88095
‑
77
‑
6,化学结构式如式(i)所示。
[0036]
优选地,所述衍生物包括二鹅掌菜酚在药学上可以接受的盐、酯、水合物、溶剂化物、多晶型物、互变异构体和前药。
[0037]
优选地,所述slc7a11促进剂为促进slc7a11表达的促进剂。
[0038]
优选地,所述slc7a11通过介导胱氨酸摄取和谷氨酸释放促进谷胱甘肽的合成,保护细胞免受氧化应激,维持细胞的氧化还原平衡,阻止脂质过氧化诱导的细胞死亡。
[0039]
本发明的第六个方面,提供二鹅掌菜酚或其衍生物在制备抗炎药物中的应用。
[0040]
二鹅掌菜酚(dieckol)的分子式为c
36
h
22
o
18
,分子量为742.55,cas号为88095
‑
77
‑
6,化学结构式如式(i)所示。
[0041]
优选地,所述衍生物包括二鹅掌菜酚在药学上可以接受的盐、酯、水合物、溶剂化物、多晶型物、互变异构体和前药。
[0042]
优选地,所述药物还包含药学上可接受的辅料。
[0043]
优选地,所述药学上可接受的辅料为缓释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂和润滑剂中的至少一种。
[0044]
优选地,所述药物的剂型为固体制剂、液体制剂和半固体制剂中的至少一种。
[0045]
优选地,所述固体制剂包括片剂、颗粒剂、粉剂和胶囊剂。
[0046]
优选地,所述液体制剂包括注射剂。
[0047]
优选地,所述半固体制剂包括软膏剂和霜剂。
[0048]
本发明的第七个方面,提供二鹅掌菜酚或其衍生物在作为和/或制备cox
‑
2抑制剂中的应用。
[0049]
二鹅掌菜酚(dieckol)的分子式为c
36
h
22
o
18
,分子量为742.55,cas号为88095
‑
77
‑
6,化学结构式如式(i)所示。
[0050]
优选地,所述衍生物包括二鹅掌菜酚在药学上可以接受的盐、酯、水合物、溶剂化
物、多晶型物、互变异构体和前药。
[0051]
优选地,所述cox
‑
2抑制剂为抑制cox
‑
2表达的抑制剂。
[0052]
本发明的第八个方面,提供二鹅掌菜酚或其衍生物在作为和/或制备inos抑制剂中的应用。
[0053]
二鹅掌菜酚(dieckol)的分子式为c
36
h
22
o
18
,分子量为742.55,cas号为88095
‑
77
‑
6,化学结构式如式(i)所示。
[0054]
优选地,所述衍生物包括二鹅掌菜酚在药学上可以接受的盐、酯、水合物、溶剂化物、多晶型物、互变异构体和前药。
[0055]
优选地,所述inos抑制剂为抑制inos表达的抑制剂。
[0056]
本发明的第九个方面,提供二鹅掌菜酚或其衍生物在制备预防和/或治疗铁死亡相关疾病的药物中的应用。
[0057]
二鹅掌菜酚(dieckol)的分子式为c
36
h
22
o
18
,分子量为742.55,cas号为88095
‑
77
‑
6,化学结构式如式(i)所示。
[0058]
优选地,所述衍生物包括二鹅掌菜酚在药学上可以接受的盐、酯、水合物、溶剂化物、多晶型物、互变异构体和前药。
[0059]
优选地,所述药物还包含药学上可接受的辅料。
[0060]
优选地,所述药学上可接受的辅料为缓释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂和润滑剂中的至少一种。
[0061]
优选地,所述药物的剂型为固体制剂、液体制剂和半固体制剂中的至少一种。
[0062]
优选地,所述固体制剂包括片剂、颗粒剂、粉剂和胶囊剂。
[0063]
优选地,所述液体制剂包括注射剂。
[0064]
优选地,所述半固体制剂包括软膏剂和霜剂。
[0065]
优选地,所述铁死亡相关疾病包括急性肺损伤、脑卒中、脑外伤、脏器纤维化、缺血再灌注损伤、神经退行性疾病、肝肾衰竭和心脏病。
[0066]
本发明的第十个方面,提供一种药物,包含以下组分:
[0067]
(1)二鹅掌菜酚和/或其衍生物;和
[0068]
(2)药学上可接受的辅料。
[0069]
二鹅掌菜酚(dieckol)的分子式为c
36
h
22
o
18
,分子量为742.55,cas号为88095
‑
77
‑
6,化学结构式如式(i)所示。
[0070]
优选地,所述衍生物包括二鹅掌菜酚在药学上可以接受的盐、酯、水合物、溶剂化物、多晶型物、互变异构体和前药。
[0071]
优选地,所述药学上可接受的辅料为缓释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂和润滑剂中的至少一种。
[0072]
优选地,所述药物的剂型为固体制剂、液体制剂和半固体制剂中的至少一种。
[0073]
优选地,所述固体制剂包括片剂、颗粒剂、粉剂和胶囊剂。
[0074]
优选地,所述液体制剂包括注射剂。
[0075]
优选地,所述半固体制剂包括软膏剂和霜剂。
[0076]
本发明的有益效果是:
[0077]
本发明首次公开了二鹅掌菜酚或其衍生物在作为和/或制备铁死亡抑制剂中的应
用,这是基于发明人发现二鹅掌菜酚或其衍生物可以抑制铁积累、活性氧及脂质活性氧堆积、铁死亡相关蛋白ptgs2和tf的表达,以及促进slc7a11的表达,而铁积累是铁死亡发生的必要条件,铁离子主要通过催化脂质过氧化过程参与铁死亡的发生,脂质活性氧堆积是诱发铁死亡的重要标志,铁死亡相关蛋白ptgs2和tf能促进铁死亡的发生,slc7a11可以通过介导胱氨酸摄取和谷氨酸释放促进谷胱甘肽的合成,保护细胞免受氧化应激,维持细胞的氧化还原平衡,阻止脂质过氧化诱导的细胞死亡,因此,二鹅掌菜酚或其衍生物可以作为铁死亡抑制剂,并用于预防和/或治疗铁死亡相关疾病。
[0078]
本发明还公开了二鹅掌菜酚或其衍生物在制备抗炎药物中的应用,这是基于发明人发现二鹅掌菜酚或其衍生物可以抑制cox
‑
2和inos的表达,从而抑制no等炎症介质的产生,起到抗炎的作用。
附图说明
[0079]
图1是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中cox
‑
2和inos表达的影响图:其中,a是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中cox
‑
2和inos表达影响的免疫印迹图;b是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中cox
‑
2表达影响的统计结果图;c是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中inos表达影响的统计结果图;其中,***表示脂多糖组与空白对照组对比,p<0.001;**表示脂多糖组与空白对照组对比,p<0.01;###表示脂多糖+二鹅掌菜酚组与脂多糖组对比,p<0.001。
[0080]
图2是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中cox
‑
2表达影响的免疫荧光图。
[0081]
图3是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中一氧化氮产生的影响图;其中,****表示脂多糖组与空白对照组对比,p<0.0001;####表示脂多糖+二鹅掌菜酚组与脂多糖组对比,p<0.0001。
[0082]
图4是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中亚铁离子蓄积的影响图。
[0083]
图5是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中活性氧的影响图:其中,a是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中活性氧影响的流式细胞图;b是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中活性氧影响的统计结果图;其中,**表示脂多糖组与空白对照组对比,p<0.01;#表示脂多糖+二鹅掌菜酚组与脂多糖组对比,p<0.05;###表示脂多糖+二鹅掌菜酚组与脂多糖组对比,p<0.001。
[0084]
图6是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中脂质活性氧的影响图:其中,a是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中脂质活性氧影响的流式细胞图;b是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中脂质活性氧影响的统计结果图;其中,**表示脂多糖组与空白对照组对比,p<0.01;#表示脂多糖+二鹅掌菜酚组与脂多糖组对比,p<0.05。
[0085]
图7是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中slc7a11、ptgs2和tf表达的影响图:其中,a是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中slc7a11、ptgs2和tf表达影响的免疫印迹图;b是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中slc7a11表达影响的统计结果图;c是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中ptgs2表达影响的统计结果图;d是二鹅掌菜酚对脂多糖(lps)刺激的raw264.7细胞中tf表达影响的统计
结果图;其中,*表示脂多糖组与空白对照组对比,p<0.05;**表示脂多糖组与空白对照组对比,p<0.01;***表示脂多糖组与空白对照组对比,p<0.001;#表示脂多糖+二鹅掌菜酚组与脂多糖组对比,p<0.05;##表示脂多糖+二鹅掌菜酚组与脂多糖组对比,p<0.01。
具体实施方式
[0086]
以下通过具体的实施例对本发明的内容作进一步详细的说明。
[0087]
本实施例中所采用的原料,除特殊说明外,均通过常规手段制备或者通过商业渠道购买。
[0088]
本实施例中的试剂或试剂的制备方法如下:
[0089]
二鹅掌菜酚储存液配制:用电子天平称取二鹅掌菜酚粉末放置于无菌离心管中,然后加入二甲基亚砜(dmso)进行溶解,配制成浓度为10mg/ml的储存液。
[0090]
实施例1二鹅掌菜酚抑制lps刺激的raw264.7细胞中cox
‑
2和inos的表达及一氧化氮的产生
[0091]
1)western blot检测cox
‑
2和inos的表达
[0092]
将raw264.7细胞置于含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基中,并于5%co2的37℃培养箱中培养,将raw264.7细胞以2
×
105/ml的密度接种于12孔板中,每孔接入1ml,分别进行如下处理:空白对照组(control,加入1ml含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基)、脂多糖(lps)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps为溶质的溶液,lps的终浓度为250ng/ml)、脂多糖+二鹅掌菜酚(lps+dieckol)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps、dieckol为溶质的溶液,lps的终浓度为250ng/ml,二鹅掌菜酚(dieckol)的终浓度分别为12.5、25、50μg/ml),每种处理2个复孔,具体如下:lps+给药组先用二鹅掌菜酚预处理半小时,半小时后在lps组、lps+dieckol组用lps共刺激24小时,24h后用预冷的pbs洗涤细胞两次,随后用ripa裂解液裂解,收集细胞蛋白。将收集的蛋白样品进行sds
‑
page电泳,置于转膜仪转膜。转膜后分别孵育一抗(cox
‑
2抗体(cell signaling technology(cst),12282s);inos抗体(cst,13120s)),4℃孵育过夜;第二天洗膜后加入稀释(1:4000)的二抗(anti
‑
rabbit igg,hrp
‑
linked antibody,cst,7074s),室温孵育1h;二抗孵育完成后,显影仪显影;最后使用image j软件通过光密度法对印迹进行定量分析。结果如图1所示:二鹅掌菜酚可抑制lps刺激的raw264.7细胞中cox
‑
2和inos的表达。
[0093]
2)免疫荧光法检测cox
‑
2蛋白的表达
[0094]
将raw264.7细胞以2
×
105个/ml的密度铺于6孔板中,在37℃,5%co2培养箱内培养过夜,在铺细胞之前将无菌的方形盖玻片加入6孔板。第二天分别进行如下处理:空白对照组(control,加入1ml含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基)、脂多糖(lps)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps为溶质的溶液,lps的终浓度为250ng/ml)、脂多糖+二鹅掌菜酚(lps+dieckol)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps、dieckol为溶质的溶液,lps的终浓度为250ng/ml,二鹅掌菜酚(dieckol)的终浓度为50μg/ml),每种处理3个复孔,具体如下:lps+dieckol组先用二鹅掌菜酚预处理半小时,半小时后在lps组、lps+dieckol组用lps共刺激24小时,24小时后弃去培养基,用pbs洗三次,然后加入4%多聚甲醛
(pfa)室温固定20min;弃掉pfa,用pbs在室温浸洗3次,每次5min;然后加500μl 0.5%triton x
‑
100(pbs配制)室温破膜15min,再用pbs浸洗3次,每次5min;之后用山羊血清封闭0.5h;去除封闭液后加入pbs浸洗3次,每次5min;加入相应的一抗(抗cox
‑
2抗体(cst,12282s)),稀释液(5%bsa稀释1:300),静置4℃冰箱过夜;第二天回收一抗,加入pbs浸洗3次,每次5min;然后加入对应的荧光二抗稀释液((thermo fisher scientific,35552,pbs稀释1:1000))室温避光1h;再用pbs避光清洗3次,每次5min;接着加入dapi染色液(pbs稀释1:2000)室温避光10min;去除dapi并加入pbs避光清洗3次,每次5min;最后,准备好载玻片,并于每个样品处加50μl抗淬灭封片液,将玻片倒扣于之封片液上,4℃避光保存。在激光共聚焦显微镜下观察,并拍照记录结果,结果如图2所示:二鹅掌菜酚可抑制lps刺激的raw264.7细胞中cox
‑
2的表达。
[0095]
3)细胞培养液上清一氧化氮含量检测
[0096]
将raw264.7细胞置于含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基中,并于5%co2的37℃培养箱中培养,将raw264.7细胞以2
×
105/ml的密度接种于12孔板中,每孔体积为1ml,分别进行如下处理:空白对照组(control,加入1ml含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基)、脂多糖(lps)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps为溶质的溶液,lps的终浓度为250ng/ml)、脂多糖+二鹅掌菜酚(lps+dieckol)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps、dieckol为溶质的溶液,lps的终浓度为250ng/ml,二鹅掌菜酚(dieckol)的终浓度分别为12.5、25、50μg/ml),每种处理3个复孔,具体如下:lps+dieckol组先用二鹅掌菜酚预处理半小时,半小时后在lps组、lps+dieckol组用lps共刺激24小时,24小时后收集细胞培养液上清,并根据一氧化氮检测试剂盒(碧云天,上海)进行检测,最后根据标准曲线计算出一氧化氮浓度。结果如图3所示:二鹅掌菜酚可抑制lps刺激的raw264.7细胞中一氧化氮的产生。
[0097]
综上所述,二鹅掌菜酚对lps诱导的raw264.7细胞炎症具有抑制作用。
[0098]
实施例2二鹅掌菜酚抑制lps刺激的raw264.7细胞中亚铁离子蓄积、活性氧及脂质活性氧的产生、铁死亡相关蛋白的表达
[0099]
1)细胞内亚铁离子含量检测:将raw264.7细胞以2
×
105个/ml的密度接种于6孔板中,在37℃,5%co2培养箱内培养过夜,第二天分别进行如下处理:空白对照组(control,加入1ml含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基)、脂多糖(lps)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps为溶质的溶液,lps的终浓度为250ng/ml)、脂多糖+二鹅掌菜酚(lps+dieckol)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps、dieckol为溶质的溶液,lps的终浓度为250ng/ml,二鹅掌菜酚(dieckol)的终浓度为50μg/ml),每种处理3个复孔,具体如下:lps+dieckol组先用二鹅掌菜酚预处理半小时,半小时后在lps组、lps+dieckol组用lps共刺激24小时,24小时后将含有ferroorange(1μmol/ml,dojindo,japan)的无血清培养基添加到细胞中,37℃,5%co2培养箱中孵育30分钟,最后在荧光共聚焦显微镜(fv3000,olympus,japan)下观察细胞。结果如图4所示:在lps刺激下,raw264.7细胞内亚铁离子含量增加,给予二鹅掌菜酚预处理后细胞内亚铁离子含量显著降低,铁积累是铁死亡发生的必要条件,铁离子主要通过催化脂质过氧化过程参与铁死亡的发生;表明二鹅掌菜酚可有效抑制lps
刺激引起的raw264.7细胞内亚铁离子的蓄积。
[0100]
2)流式细胞术检测细胞内活性氧及脂质活性氧
[0101]
荧光探针dcfh
‑
da(碧云天,上海)检测细胞内活性氧的形成:将raw264.7细胞以2
×
105/ml的密度接种于12孔板中,每孔体积为1ml,并于5%co2的37℃培养箱中培养过夜,第二天分别进行如下处理:空白对照组(control,加入1ml含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基)、脂多糖(lps)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps为溶质的溶液,lps的终浓度为250ng/ml)、脂多糖+二鹅掌菜酚(lps+dieckol)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps、dieckol为溶质的溶液,lps的终浓度为250ng/ml,二鹅掌菜酚(dieckol)的终浓度分别为12.5、25、50μg/ml),每种处理3个复孔,具体如下:lps+给药组先用二鹅掌菜酚预处理半小时,半小时后在lps组、lps+dieckol组用lps共刺激24小时,24小时后将细胞与终浓度为10μm的活性氧荧光探针(dcfh
‑
da)在37℃、5%co2培养箱中孵育30min;最后用pbs清洗细胞,重悬细胞后在流式细胞仪上检测荧光并分析。
[0102]
荧光探针c11
‑
bodipy 581/591(爱博泰克,武汉)检测细胞内脂质活性氧的形成:将raw264.7细胞以2
×
105/ml的密度接种于12孔板中,每孔体积为1ml,并于5%co2的37℃培养箱中培养过夜,第二天分别进行如下处理:空白对照组(control,加入1ml含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基)、脂多糖(lps)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps为溶质的溶液,lps的终浓度为250ng/ml)、脂多糖+二鹅掌菜酚(lps+dieckol)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps、dieckol为溶质的溶液,lps的终浓度为250ng/ml,二鹅掌菜酚(dieckol)的终浓度分别为12.5、25、50μg/ml),每种处理3个复孔,具体如下:lps+给药组先用二鹅掌菜酚预处理半小时,半小时后在lps组、lps+给药组用lps共刺激24小时,24小时后将细胞与终浓度为10μm的脂质过氧化荧光探针(c11
‑
bodipy 581/591)于37℃、5%co2培养箱中孵育1小时。孵育结束后,用pbs清洗细胞两次以去除多余的染料;然后用胰蛋白酶消化细胞,并将细胞重悬于含5%的pbs中,最后通过流式细胞术检测荧光并分析。
[0103]
结果如图5、图6所示:在lps刺激下,raw264.7细胞内活性氧及脂质活性氧含量增加,给予二鹅掌菜酚预处理后细胞内活性氧及脂质活性氧含量降低,脂质活性氧堆积是诱发铁死亡的重要标志,表明二鹅掌菜酚可有效抑制lps刺激引起的raw264.7细胞内活性氧及脂质活性氧堆积,抑制铁死亡发生。
[0104]
3)western blot检测slc7a11、ptgs2和tf的表达
[0105]
将raw264.7细胞置于含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基中,并于5%co2的37℃培养箱中培养,将raw264.7细胞以2
×
105/ml的密度接种于12孔板中,分别进行如下处理:空白对照组(control,加入1ml含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基)、脂多糖(lps)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps为溶质的溶液,lps的终浓度为250ng/ml)、脂多糖+二鹅掌菜酚(lps+dieckol)组(加入1ml以含10%胎牛血清和1%青霉素/链霉素的dmem高糖培养基为溶剂、lps、dieckol为溶质的溶液,lps的终浓度为250ng/ml,二鹅掌菜酚(dieckol)的终浓度分别为12.5、25、50μg/ml),每种处理2个复孔,具体如下:lps+dieckol组先用二鹅掌菜酚预处理半小时,半小时后在lps组、lps+dieckol组用lps共刺激24小时,24h后用预冷的pbs洗涤细
胞两次,随后用ripa裂解液裂解,收集细胞蛋白。将收集的蛋白样品进行sds
‑
page电泳,置于转膜仪转膜。转膜后分别孵育一抗(slc7a11(abclonal,a13685);ptgs2(cst,12282s);tf(abclonal,a1448)),4℃孵育过夜;第二天洗膜后加入稀释(1:4000)的二抗(anti
‑
rabbit igg,hrp
‑
linked antibody,cst,7074s),室温孵育1h;二抗孵育完成后,显影仪显影;最后使用image j软件通过光密度法对印迹进行定量分析。结果如图7所示:二鹅掌菜酚可抑制铁死亡相关蛋白ptgs2和tf的表达,以及增加slc7a11(slc7a11通过介导胱氨酸摄取和谷氨酸释放促进谷胱甘肽的合成,保护细胞免受氧化应激,维持细胞的氧化还原平衡,阻止脂质过氧化诱导的细胞死亡)的表达。
[0106]
综上所述,二鹅掌菜酚可抑制lps刺激引起的raw264.7细胞铁死亡,可作为铁死亡抑制剂应用。
[0107]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1