脂肪酸/脂肪醇-抗肿瘤物质前药及其自组装纳米粒的制备方法
脂肪酸/脂肪醇
‑
抗肿瘤物质前药及其自组装纳米粒的制备方法
技术领域:
1.本发明属于药物制剂新辅料和新剂型技术领域,具体涉及脂肪酸/脂肪醇
‑
抗肿瘤物质前药及其自组装纳米粒的制备方法。
背景技术:
2.癌症是高致死率的恶性疾病,严重威胁着人类的生命健康。化疗是目前癌症治疗中的主要策略之一。然而,目前临床上使用的大多数抗肿瘤药物存在稳定性差、药动学性质不佳、缺乏靶点特异性等问题,导致治疗效果较差且毒副作用严重。例如,紫杉醇(paclitaxel,ptx)是临床上常用的抗癌药物,被用于多种癌症的治疗,抗癌效果显著。然而,紫杉醇在体内的非特异性分布会造成严重的骨髓抑制与神经毒性。此外,由于紫杉醇的水溶性极差,临床制剂(泰素)不得不使用聚氧乙烯蓖麻油与乙醇作为其增溶剂和助溶剂,但是,聚氧乙烯蓖麻油的使用也带来了严重的过敏反应,且泰素的稳定性较差,制剂需要现用现配。这些缺点严重地限制了紫杉醇的临床应用。
3.近年来,前药策略与纳米技术在药物递送领域的应用,极大地改善了化疗药物递送效率差的问题。前药策略能够改善化疗药物的溶解度、稳定性和肿瘤选择性等。纳米技术可以改善化疗药物的体内药动学行为和肿瘤靶向性。基于前药的自组装纳米药物递送系统,结合了前药策略和纳米技术的优点,近年来受到越来越多的关注。由于前药作为纳米结构的主体,前药自组装纳米药物递送系统具有超高载药量,可达50%。此外,前药自组装纳米药物递送系统避免了生物不相容材料的使用,有助于提高药物安全性。
4.前药的侧链结构对前药的自组装、纳米粒的稳定性、药物释放、体内命运和抗肿瘤活性有很大影响。为了获得能够自组装的小分子前药,常用的方法是将化疗药物与脂肪酸或脂肪醇相连。化疗药物的结构具有很强的刚性,不具备自组装能力,在水中容易形成长程有序的堆积,导致析出沉淀。
技术实现要素:
5.本发明的目的是克服上述现有技术存在的不足,提供一种脂肪酸/脂肪醇
‑
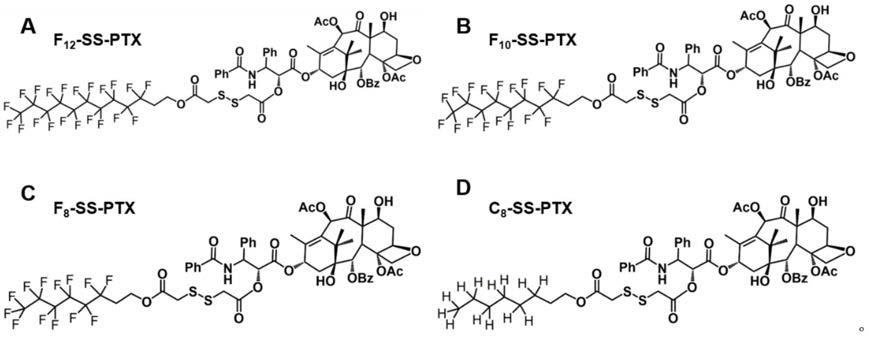
抗肿瘤物质前药及其自组装纳米粒的制备方法,该前药为含有血液循环稳定型敏感键的氧化还原双敏感前药,通过将该前药用于自组装纳米粒,从而实现载药量高、稳定性好、毒副作用低的效果,进而提高抗肿瘤活性。探讨碳链取代基对前药自组装纳米粒的自组装能力、纳米粒稳定性、药物释放、细胞毒性、药动学、组织分布、药效学产生的影响以及抗肿瘤活性等方面的差异,为开发稳定的肿瘤微环境智能响应型药物递送系统提供新的策略和更多的选择,满足临床中对高效化疗制剂的迫切需求。
6.本发明中碳链的引入使得前药的灵活性有了很大的改善,其可以在自组装过程中自由旋转,使整个体系处于一个能量最低的状态,形成稳定的纳米粒。通过碳链的取代基影响前药的自组装能力,进而影响纳米粒的稳定性、体内命运和抗肿瘤活性。
7.为实现上述目的,本发明采用以下技术方案:
8.脂肪酸/脂肪醇
‑
抗肿瘤物质前药为通过血液循环稳定型敏感键桥连的氧化还原双敏感小分子前药,该前药以抗肿瘤物质作为模型药物,脂肪酸/脂肪醇为侧链,以含有硫族元素碲、硒、硫的敏感键为中间桥连键,通过脂肪酸/脂肪醇与抗肿瘤物质的c(2')位羟基形成酯键连接在一起形成,其中,所述的抗肿瘤药物为含有活性羟基/氨基的抗癌药物。
9.所述的脂肪酸/脂肪醇
‑
抗肿瘤物质前药为小分子前药。
10.所述的“/”为或的意思。
11.所述的侧链当为脂肪醇时,具体取辛醇;所述的以脂肪醇为侧链桥连的前药作为对照。
12.所述的侧链为含有氟原子的脂肪酸/脂肪醇。
13.所述的含有氟原子的脂肪酸为全氟十八酸、全氟十六酸、全氟十四酸、全氟十二酸、全氟癸酸或全氟辛酸中的一种。
14.所述的含有氟原子的脂肪醇为全氟十六醇、全氟十四醇、全氟十二醇、全氟癸醇或全氟辛醇中的一种。
15.当所述的侧链为全氟十二醇、全氟十醇、全氟辛醇或辛醇时,所述的前药分别命名为f
12
‑
ss
‑
ptx、f
10
‑
ss
‑
ptx、f8‑
ss
‑
ptx和c8‑
ss
‑
ptx,其结构式对应如下式abcd所示:
16.所述的含有活性羟基/氨基的抗癌药物为紫杉烷类化合物、核苷类化合物、蒽环类化合物或喜树碱类化合物。
17.所述的含有活性羟基/氨基的抗癌药物为紫杉醇。
18.所述的桥连键为单硫键、二硫键、三硫键、单硒键、二硒键、单碲键或二碲键中的一种。
19.所述的桥连键为二硫键。
20.脂肪酸/脂肪醇
‑
抗肿瘤物质前药自组装纳米粒的制备方法,包括以下步骤:
21.步骤1,敏感键桥联的脂肪酸/脂肪醇
‑
抗肿瘤物质前药合成,首先将脂肪酸/脂肪醇与含敏感键二元酸成酯得到中间产物,然后中间产物再与抗肿瘤物质成酯,得到终产物;具体的:
22.(1)将含敏感键二元酸溶于乙酸酐中,室温下搅拌2h,将乙酸酐通过旋转蒸发除去,加入与2,2'
‑
二硫代二乙酸等量的脂肪醇,获得中间产物;
23.(2)按摩尔比,中间产物:抗肿瘤物质:1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐:4
‑
二甲氨基吡啶=1:1:1:1,向中间产物中加入抗肿瘤物质、1
‑
乙基
‑
(3
‑
二甲基氨基
丙基)碳酰二亚胺盐酸盐和4
‑
二甲氨基吡啶,室温条件下搅拌24h,所得产物经液相分离纯化,制得敏感键桥连的脂肪酸/脂肪醇
‑
抗肿瘤物质前药;
24.步骤2,前药自组装纳米粒的制备,所述的纳米粒包括非peg化的纳米粒或peg修饰的纳米粒,具体包括以下步骤:
25.(1)将一定量的脂肪酸/脂肪醇
‑
抗肿瘤物质前药或脂肪酸/脂肪醇
‑
抗肿瘤物质前药与peg修饰剂的混合物溶解于适量的乙醇中,混合均匀获得前药乙醇溶液,搅拌条件下,将该前药乙醇溶液缓缓滴加到水中,前药自发形成含有均匀纳米粒的溶液;其中,当为脂肪酸/脂肪醇
‑
抗肿瘤物质前药与peg修饰剂的混合物时,二者按质量比(90
‑
70):(10
‑
30)混合;
26.(2)采用减压旋转蒸发法除去含有均匀纳米粒的溶液中的乙醇,得到不含任何有机溶剂的纳米胶体溶液。
27.所述的步骤1(1)中,含敏感键二元酸为2,2'
‑
二硫代二乙酸。
28.所述的步骤1中,前药合成全程在氮气保护下进行。
29.所述的步骤2(1)中,peg修饰剂为tpgs、dspe
‑
peg、plga
‑
peg和pe
‑
peg等,所述peg修饰剂的分子量为1000、2000和5000。
30.所述的步骤2(1)中,peg修饰剂优选为dspe
‑
peg,分子量为2000。
31.所述的步骤2(1)中,前药与peg修饰剂在(90
‑
70):(10
‑
30)质量比范围内,抗肿瘤物质可以发挥最好的抗肿瘤效果。
32.所述的步骤2(1)中,经检测,前药自组装过程的结合能为
‑
6~
‑
8kcal/mol。
33.所述的步骤2(2)中,经检测,制备的均匀纳米粒使母药抗肿瘤物质的药时曲线下面积提高7
‑
8倍,纳米粒为球状,粒径为65.5
‑
85.1nm,室温放置48h后,当为f8
‑
ss
‑
ptx纳米粒时,粒径变化率≤10%,而c8
‑
ss
‑
ptx纳米粒的粒径变化率在60
‑
70%。
34.所述的脂肪酸/脂肪醇
‑
抗肿瘤物质前药或脂肪酸/脂肪醇
‑
抗肿瘤物质前药自组装纳米粒在药物传递系统中的应用。
35.所述的脂肪酸/脂肪醇
‑
抗肿瘤物质前药或脂肪酸/脂肪醇
‑
抗肿瘤物质前药自组装纳米粒在制备抗肿瘤药物中的应用。
36.所述的脂肪酸/脂肪醇
‑
抗肿瘤物质前药或脂肪酸/脂肪醇
‑
抗肿瘤物质前药自组装纳米粒在注射给药、口服给药或局部给药系统中的应用。
37.本发明的有益效果:
38.(1)本发明设计合成了敏感键桥连的脂肪酸/脂肪醇
‑
抗肿瘤物质小分子前药,合成方法简单易行;该前药能够在血液循环中保持稳定,且具有氧化还原双敏感性质;
39.(2)进一步制备了包含敏感键桥连的脂肪酸/脂肪醇
‑
抗肿瘤物质小分子前药的自组装纳米粒,制备方法简单易行,稳定性好,实现抗肿瘤物质的高效包载;
40.(3)考察了氟化作用对氧化还原敏感响应能力以及抗肿瘤活性,以及对前药自组装纳米粒的稳定性、药物释放、细胞毒性、药动学、组织分布以及药效学产生的影响。结果表明,氟化作用能够增强小分子前药自组装纳米粒的稳定性,进而改善其体内药动学行为,增强其抗肿瘤效果,为开发肿瘤微环境智能响应型药物递送系统提供新的策略和更多的选择,满足临床中对高效低毒化疗制剂的迫切需求。
附图说明:
41.图1为本发明实施例1制备的二硫键桥连的氟化十二醇
‑
紫杉醇前药(f
12
‑
ss
‑
ptx)的质谱图和1hnmr谱图,其中a为质谱图,b为1hnmr谱图;
42.图2为本发明实施例2制备的二硫键桥连的氟化癸醇
‑
紫杉醇前药(f
10
‑
ss
‑
ptx)的质谱图和1hnmr谱图,其中a为质谱图,b为1hnmr谱图;
43.图3为本发明实施例3制备的二硫键桥连的氟化辛醇
‑
紫杉醇前药(f8‑
ss
‑
ptx)的质谱图和1hnmr谱图,其中a为质谱图,b为1hnmr谱图;
44.图4为本发明实施例4制备的二硫键桥连的辛醇
‑
紫杉醇前药(c8‑
ss
‑
ptx)的质谱图和1hnmr谱图,其中a为质谱图,b为1hnmr谱图;
45.图5为本发明实施例5制备的非peg化小分子前药自组装纳米粒在室温放置48h后的粒径变化图;
46.图6为本发明实施例6的小分子前药自组装纳米粒的自组装机制图,其中a为紫杉醇以及两种前药(f8
‑
ss
‑
ptx、c8
‑
ss
‑
ptx)的油水分配系数图;b为两种前药(f8
‑
ss
‑
ptx、c8
‑
ss
‑
ptx)的分子动态模拟图,c为两种前药(f8
‑
ss
‑
ptx、c8
‑
ss
‑
ptx)回转半径变化图,d为前药c8
‑
ss
‑
ptx自组装构象图,e为前药f8
‑
ss
‑
ptx自组装构象图;
47.图7为本发明实施例7制备的peg修饰的小分子前药自组装纳米粒的粒径图和透射电子显微镜图;
48.图8为本发明实施例8的peg修饰的小分子前药自组装纳米粒在室温放置48h后的粒径变化图;
49.图9为本发明实施例9的peg修饰的小分子前药自组装纳米粒的体外释放试验图,其中a为1mm dtt浓度下释放介质中纳米粒释放情况图,b为10mm dtt浓度下释放介质中纳米粒释放情况图,c为1mm h2o2浓度下释放介质中纳米粒释放情况图,d为10mm h2o2浓度下释放介质中纳米粒释放情况图;
50.图10为本发明实施例10的peg修饰的小分子前药自组装纳米粒的血药浓度
‑
时间曲线图;
51.图11为本发明实施例11的peg修饰的小分子前药自组装纳米粒的组织分布图;
52.图12为本发明实施例12的peg修饰的小分子前药自组装纳米粒的在体抗肿瘤实验图。
具体实施方式
53.下面通过实施例的方式进一步说明本发明,但并不因此将发明限制在所述的实施例范围之中。
54.实施例1:二硫键桥连的氟化十二醇
‑
紫杉醇小分子前药(f
12
‑
ss
‑
ptx)的合成
55.将适量二硫代二乙酸与乙酸酐在室温下反应2h。通过旋转蒸发的方法除去乙酸酐。随后加入二氯甲烷、4
‑
二甲氨基吡啶,并滴入全氟十二醇,室温下反应1h。用硅胶柱层析法分离获得中间产物。将所得中间产物加入等量紫杉醇、1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐和4
‑
二甲氨基吡啶,室温条件下搅拌24h,所得产物经制备液相分离纯化,上述反应全程都在氮气保护下进行。
56.采用质谱法以及核磁共振氢谱法来确定实施例1中前药的结构,结果如图1所示。
核磁共振选用的溶剂为氘代二甲基亚砜(dmso
‑
d6),波谱解析结果如下:
57.ms(esi)m/z for f
12
‑
ss
‑
ptx[m+na]
+
=1586.6.1h nmr(400mhz,dmso
‑
d6)δ7.979(d,j=7.6hz,ar
‑
h,2h),7.850(d,j=7.6hz,ar
‑
h,2h),7.734(d,j=7.2hz,ar
‑
h,1h),7.668
‑
7.176(ar
‑
h,10h),6.293(s,10
‑
ch,1h),5.801(d,j=9.9hz,13
‑
ch,1h),5.526(t,j=8.8hz,3
’‑
ch,1h),4.878(d,j=7.7hz,2
’‑
ch,1h),4.585(s,5
‑
ch,1h),4.106(s,7
‑
ch,1h),4.010(q,j=8.4hz,20
‑
ch2,2h),3.899
‑
3.686(ch2ssch2,4h),3.578(d,j=7.1hz,3
‑
ch,1h),2.644(d,j=19.8hz,f12
‑
ch2,2h),2.324(f12
‑
ch2,2h),2.236(s,4
‑
coch3,3h),2.095(s,10
‑
coch3,3h),1.782(s,18
‑
ch3,3h),1.635(t,j=12.7hz,6
‑
ch2
‑
αh,1h),1.496(s,19
‑
ch3,3h),1.459(s,6
‑
ch2
‑
βh,1h),1.025(s,17
‑
ch3,3h),0.999(s,16
‑
ch3,3h).
[0058]
实施例2:二硫键桥连的氟化癸醇
‑
紫杉醇小分子前药(f
10
‑
ss
‑
ptx)的合成
[0059]
将适量二硫代二乙酸与乙酸酐在室温下反应2h。通过旋转蒸发的方法除去乙酸酐。随后加入二氯甲烷、4
‑
二甲氨基吡啶,并滴入全氟癸醇,室温下反应1h。用硅胶柱层析法分离获得中间产物。将所得中间产物加入等量紫杉醇、1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐和4
‑
二甲氨基吡啶,室温条件下搅拌24h,所得产物经制备液相分离纯化,上述反应全程都在氮气保护下进行。
[0060]
采用质谱法以及核磁共振氢谱法来确定实施例2中前药的结构,结果如图2所示。核磁共振选用的溶剂为氘代二甲基亚砜(dmso
‑
d6),波谱解析结果如下:
[0061]
ms(esi)m/z for f
10
‑
ss
‑
ptx[m+na]
+
=1486.4.1h nmr(400mhz,dmso
‑
d6)δ7.979(d,j=7.1hz,ar
‑
h,2h),7.851(d,j=7.1hz,ar
‑
h,2h),7.743(t,j=7.2hz,ar
‑
h,1h),7.668
‑
7.176(ar
‑
h,10h),6.293(s,10
‑
ch,1h),5.813(t,j=9.1hz,13
‑
ch,1h),5.526(t,j=8.7hz,3
’‑
ch,1h),4.877(d,j=7.1hz,2
’‑
ch,1h),4.585(s,5
‑
ch,1h),4.112(d,j=7.4hz,7
‑
ch,1h),4.010(q,j=8.3hz,20
‑
ch2,2h),3.898
‑
3.681(ch2ssch2,4h),3.578(d,j=7.1hz,3
‑
ch,1h),2.778
‑
2.561(f10
‑
ch2,2h),2.324(f10
‑
ch2,2h),2.236(s,4
‑
coch3,3h),2.097(s,10
‑
coch3,3h),1.782(s,18
‑
ch3,3h),1.635(t,j=12.6hz,6
‑
ch2
‑
αh,1h),1.496(s,19
‑
ch3,3h),1.466(m,6
‑
ch2
‑
βh,1h),1.025(s,17
‑
ch3,3h),0.998(s,16
‑
ch3,3h).
[0062]
实施例3:二硫键桥连的氟化辛醇
‑
紫杉醇小分子前药(f8‑
ss
‑
ptx)的合成
[0063]
将适量二硫代二乙酸与乙酸酐在室温下反应2h。通过旋转蒸发的方法除去乙酸酐。随后加入二氯甲烷、4
‑
二甲氨基吡啶,并滴入全氟辛醇,室温下反应1h。用硅胶柱层析法分离获得中间产物。将所得中间产物加入等量紫杉醇、1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐和4
‑
二甲氨基吡啶,室温条件下搅拌24h,所得产物经制备液相分离纯化,上述反应全程都在氮气保护下进行。
[0064]
采用质谱法以及核磁共振氢谱法来确定实施例3中前药的结构,结果如图3所示。核磁共振选用的溶剂为氘代二甲基亚砜(dmso
‑
d6),波谱解析结果如下:
[0065]
ms(esi)m/z for f8‑
ss
‑
ptx[m+h]
+
=1364.3286.1h nmr(400mhz,dmso
‑
d6)δ7.979(d,j=7.1hz,ar
‑
h,2h),7.851(d,j=7.2hz,ar
‑
h,2h),7.743(t,j=7.3hz,ar
‑
h,1h),7.668
‑
7.058(ar
‑
h,10h),6.292(s,10
‑
ch,1h),5.813(t,j=9.1hz,13
‑
ch,1h),5.525(t,j=8.7hz,3
’‑
ch,1h),4.892(dd,j=12.1,7.3hz,2
’‑
ch,1h),4.584(s,5
‑
ch,1h),4.112(d,j=7.0hz,7
‑
ch,1h),4.010(q,j=8.3hz,20
‑
ch2,2h),3.871
‑
3.720(ch2ssch2,4h),3.578
(d,j=7.1hz,3
‑
ch,1h),2.697
‑
2.311(f8
‑
ch2,4h),2.237(s,4
‑
coch3,3h),2.099(s,10
‑
coch3,3h),1.782(s,18
‑
ch3,3h),1.635(t,j=12.6hz,6
‑
ch2
‑
αh,1h),1.496(s,19
‑
ch3,3h),1.479(m,6
‑
ch2
‑
βh,1h),1.025(s,17
‑
ch3,3h),0.998(s,16
‑
ch3,3h).
[0066]
实施例4:二硫键桥连的辛醇
‑
紫杉醇小分子前药(c8‑
ss
‑
ptx)的合成
[0067]
将二硫代二乙酸与乙酸酐在室温下反应2h。通过旋转蒸发的方法除去乙酸酐。随后加入二氯甲烷、4
‑
二甲氨基吡啶,并滴入辛醇,室温下反应1h。用硅胶柱层析法分离获得中间产物。将所得中间产物加入等量紫杉醇、1
‑
乙基
‑
(3
‑
二甲基氨基丙基)碳酰二亚胺盐酸盐和4
‑
二甲氨基吡啶,室温条件下搅拌24h,所得产物经制备液相分离纯化,上述反应全程都在氮气保护下进行。
[0068]
采用质谱法以及核磁共振氢谱法来确定实施例4中前药的结构,结果如图4所示。核磁共振选用的溶剂为dmso
‑
d6,波谱解析结果如下:
[0069]
ms(esi)m/z for c8‑
ss
‑
ptx[m+na]
+
=1168.37671.1h nmr(400mhz,dmso
‑
d6)δ7.980(d,j=7.1hz,ar
‑
h,2h),7.852(d,j=7.1hz,ar
‑
h,2h),7.743(t,j=7.3hz,ar
‑
h,1h),7.668
‑
7.186(ar
‑
h,10h),6.294(s,10
‑
ch,1h),5.818(t,j=9.2hz,13
‑
ch,1h),5.522(t,j=8.7hz,3
’‑
ch,1h),4.818(q,j=6.4hz,2
’‑
ch,1h),4.586(s,5
‑
ch,1h),4.096(m,7
‑
ch,1h),4.010(q,j=8.3hz,20
‑
ch2,2h),3.868
‑
3.650(ch2ssch2,4h),3.580(d,j=7.1hz,3
‑
ch,1h),2.235(s,4
‑
coch3,3h),2.100(s,10
‑
coch3,3h),1.784(s,18
‑
ch3,3h),1.692
‑
1.538(m,6
‑
ch2,2h),1.495(s,19
‑
ch3,3h),1.240(s,c8
‑
ch2,10h),1.154(d,j=6.2hz,c8
‑
ch3,3h),1.025(s,17
‑
ch3,3h),1.000(s,16
‑
ch3,3h),0.844(t,j=5.9hz,c8
‑
ch2,4h)。
[0070]
实施例5:非peg化小分子前药自组装纳米粒稳定性评价
[0071]
精密称取前药(f8‑
ss
‑
ptx、c8‑
ss
‑
ptx)1mg,用200μl乙醇将其溶解,搅拌下,将该乙醇溶液缓缓滴加到2ml去离子水中。在25℃的条件下减压旋转蒸发除去纳米制剂中的有机溶剂。为了便于比较,我们将所制备的f8‑
ss
‑
ptx纳米粒与c8‑
ss
‑
ptx纳米粒在室温放置48h,并且在预定的时间点通过动态光散射法测定其粒径变化。如图5所示,f8‑
ss
‑
ptx纳米粒在室温放置48h后,粒径基本不变,而c8‑
ss
‑
ptx纳米粒在室温放置48h后,粒径显著增加。
[0072]
实施例6:小分子前药自组装纳米粒的自组装机制
[0073]
利用marvinsketch软件计算了紫杉醇以及两种前药(f8‑
ss
‑
ptx、c8‑
ss
‑
ptx)的油水分配系数(logp)。结果如图6a所示,紫杉醇、c8‑
ss
‑
ptx和f8‑
ss
‑
ptx的logp分别是3.54、7.60和9.23。两种前药的logp都远大于紫杉醇,所以两种前药的自组装驱动力都要大于紫杉醇,又由于碳链可以在前药自组装过程中自由转动而使前药达到能量最低的状态,所以两种前药能够自组装,形成均一的纳米粒。另外,f8‑
ss
‑
ptx的油水分配系数大于c8‑
ss
‑
ptx,所以f8‑
ss
‑
ptx分子间的疏水作用力更强,使得f8‑
ss
‑
ptx在自组装过程中结合的更紧密,纳米粒的稳定性更好。通过分子动态模拟技术,考察氟化烷烃链修饰的小分子前药的自组装机制。如图6b所示,f8‑
ss
‑
ptx拥有更多的氢键,使纳米粒的稳定性得到提升。且由两个前药的自组装构象图6d、6e和回转半径变化图6c可知,f8‑
ss
‑
ptx在约10ns时就已组装成功,而c8‑
ss
‑
ptx在90ns后才开始聚集稳定,由此可知f8‑
ss
‑
ptx的自组装能力明显强于c8‑
ss
‑
ptx。另外,通过分子对接,对小分子前药自组装过程的结合能进行了计算,如图6所示,相比于c8‑
ss
‑
ptx(
‑
4.89kcal/mol),f8‑
ss
‑
ptx的结合能更负(
‑
7.06kcal/mol),说明氟化作用有助于前药自组装时构建最优构象,降低体系自由能,提高体系的稳定性。
[0074]
实施例7:peg修饰的小分子前药自组装纳米粒的制备
[0075]
精密称取dspe
‑
peg
2k 0.5mg和前药(f8‑
ss
‑
ptx、c8‑
ss
‑
ptx)2mg,用200μl乙醇将其溶解,搅拌下,将该乙醇溶液缓缓滴加到2ml去离子水中,自发形成均匀的peg修饰的纳米粒(f
12
‑
ss
‑
ptx纳米粒、f
10
‑
ss
‑
ptx纳米粒、f8‑
ss
‑
ptx纳米粒、c8‑
ss
‑
ptx纳米粒)。在25℃的条件下减压旋转蒸发除去纳米制剂中的有机溶剂。
[0076]
如表1所示,f
12
‑
ss
‑
ptx纳米粒的粒径为67.84
±
2.18nm,f
10
‑
ss
‑
ptx纳米粒的粒径为82.79
±
0.74nm,f8‑
ss
‑
ptx纳米粒的粒径为83.65
±
1.45nm,c8‑
ss
‑
ptx纳米粒的粒径为99.34
±
1.75nm,f8‑
ss
‑
ptx纳米粒的粒径为83.65
±
1.45nm,粒径分布均小于0.2,表面电荷在
‑
20mv左右,载药量都在50%以上。通过透射电子显微镜测定实施例4中制备的小分子前药自组装纳米粒的粒径和形态,结果如图7,透射电镜图表明载药纳米粒为均一的球形,粒径在80nm左右。
[0077]
表1.peg修饰的小分子前药自组装纳米粒的粒径、粒径分布、表面电荷和载药量
[0078][0079]
实施例8:peg修饰的小分子前药自组装纳米粒的胶体稳定性试验
[0080]
将实施例7中制备的peg修饰的小分子前药自组装纳米粒(f8‑
ss
‑
ptx纳米粒、c8‑
ss
‑
ptx纳米粒)室温下放置48h,并且在预定的时间点通过动态光散射法测定其粒径变化。结果如图8所示,f8‑
ss
‑
ptx纳米粒在室温放置48h后,粒径基本不变,而c8‑
ss
‑
ptx纳米粒在室温放置48h后,粒径显著增加。
[0081]
实施例9:peg修饰的小分子前药自组装纳米粒的体外释放试验。
[0082]
以含30%乙醇的ph 7.4或ph 5.0的磷酸盐缓冲液(pbs)为释放介质,考察小分子前药自组装纳米粒的体外释放情况。将实施例7中制备的peg修饰的小分子前药自组装纳米粒(f8‑
ss
‑
ptx纳米粒、c8‑
ss
‑
ptx纳米粒,紫杉醇含量为200nmol/ml)加入到30ml释放介质中,在37℃条件下,于设定的时间点取样,通过高效液相色谱测定释放出的紫杉醇浓度。向释放介质中加入一定浓度的双氧水(h2o2,1mm或10mm)或二硫苏糖醇(dtt,1mm或10mm),以分别考察纳米粒在氧化条件和还原条件下的释放情况。
[0083]
该peg修饰的小分子前药自组装纳米粒的体外释放试验图结果如图9所示,酸性条件下,酯键水解受阻,因此会抑制紫杉醇的释放。ph 7.4条件下,两种前药纳米粒在dtt存在下均能快速释放出紫杉醇,且两种前药纳米粒在还原条件下的释放速率基本一致。因为dtt进攻二硫键,使二硫键断裂,生成巯基中间体,增加了体系的亲水性,进而促进与紫杉醇连接的酯键的水解,释放出紫杉醇。由于两种前药断裂生成的亲水性的巯基中间体相同,所以两种前药在还原条件下的释放速率基本一致。两种前药纳米粒也展现出了明显的氧化敏感
性,且氟化烷基链对氧化响应药物释放速率有一定的影响。氧化条件下,c8‑
ss
‑
ptx nps释放出紫杉醇的速率更快。是由于f8‑
ss
‑
ptx的疏水性比c8‑
ss
‑
ptx大,疏水性大,会阻碍水分子对氧化中间体的酯键的进攻,使得酯键水解速率变慢,延缓紫杉醇的释放。
[0084]
实施例10:peg修饰的小分子前药自组装纳米粒的药代动力学研究
[0085]
取体重在180
‑
200g之间的sd大鼠,随机分成3组,给药前禁食12h,自由饮水。分别静脉注射泰素以及实施例7中制备的peg化的小分子前药自组装纳米粒(f8‑
ss
‑
ptx纳米粒、c8‑
ss
‑
ptx纳米粒)。紫杉醇的剂量为5mg/kg。于规定的时间点眼眶取血,分离获得血浆,通过液相色谱
‑
质谱联用仪测定血浆中的药物浓度。
[0086]
实验结果如图10所示,泰素的紫杉醇在血液中迅速被清除。相比之下,小分子前药自组装纳米粒显著地改善了紫杉醇的体内药动学行为。c8‑
ss
‑
ptx纳米粒使紫杉醇的药时曲线下面积提高了1.34倍,f8‑
ss
‑
ptx纳米粒使紫杉醇的药时曲线下面积提高了7.80倍,相比于c8‑
ss
‑
ptx纳米粒,f8‑
ss
‑
ptx纳米粒的体内药动学行为更好,是由于f8‑
ss
‑
ptx纳米粒的胶体稳定性更好,故在血液循环中依然能保持纳米粒的结构完整性,亲水性的peg层依然能够完好地包裹着纳米粒,阻碍了血浆中的调理素对纳米粒的吸附,从而降低了网状内皮系统的吞噬。对比之下,c8‑
ss
‑
ptx纳米粒的胶体稳定性较差,故在血液循环中,peg化的前药自组装纳米粒逐渐解体,暴露出疏水性的前药分子,与血浆中的调理素相结合,然后被网状内皮系统吞噬。这一结果说明氟化作用对改善前药自组装纳米粒的体内命运起着重要作用。
[0087]
实施例11:peg修饰的小分子前药自组装纳米粒的组织分布研究
[0088]
dir标记的前药自组装纳米粒的制备方法如下:精密称量dir 2mg,用1ml无水乙醇将其溶解。精密称量前药4mg,dspe
‑
peg2k 1mg,溶于200μl上述dir溶液中,搅拌下(1000转/分钟)缓慢滴加到4ml去离子水中,搅拌5min,室温下,利用旋转蒸发仪除去乙醇。
[0089]
将100μl的浓度为5
×
107cells/ml的ct26细胞悬液皮下注射进balb/c小鼠的右后背部。当肿瘤长到约400mm3时,将荷瘤小鼠随机分为3组(n=9)。将dir溶液或dir标记的前药自组装纳米粒(dir等效剂量为1mg/kg)经尾静脉注射进小鼠体内。然后于给药后4h、12h和24h,每组处死三只小鼠,分离出心、肝、脾、肺、肾和肿瘤组织,利用小动物活体成像仪确定组织中的荧光强度。
[0090]
实验结果如图11所示,静脉注射dir溶液剂后,dir溶液主要蓄积在肺部,在肿瘤组织中几乎无分布。作为对比,dir标记的纳米粒主要蓄积在肿瘤组织,且随着时间的延长,荧光强度逐渐增强。这得益于所制备纳米粒的良好的体内药动学行为以及增强渗透与滞留(epr)效应介导的肿瘤靶向作用。值得注意的是,两种前药纳米粒之间也有明显的区别,f8‑
ss
‑
ptx纳米粒组的肿瘤组织的荧光强度明显强于c8‑
ss
‑
ptx纳米粒组的肿瘤组织的荧光强度,与药动学结果一致,f8‑
ss
‑
ptx纳米粒的胶体稳定性最好,药动学行为最好,因此其在肿瘤部位的蓄积最多。
[0091]
实施例12:peg修饰的小分子前药自组装纳米粒的在体抗肿瘤实验
[0092]
考察了peg修饰的小分子前药自组装纳米粒对ct26异位瘤模型的抗肿瘤活性。将100μl的细胞终浓度为5
×
107cells/ml的ct26细胞悬液通过皮下给药的方式打入balb/c小鼠的右后背部。待肿瘤体积长到约100mm3时,将荷瘤小鼠随机分成5组(n=5),分别尾静脉注射生理盐水(saline)、泰素(taxol)、紫杉醇白蛋白纳米粒(abraxane)、c8‑
ss
‑
ptx纳米粒
或f8‑
ss
‑
ptx纳米粒(紫杉醇等效剂量为8mg/kg)。每隔一天给药一次,总共给药5次。每天测量并记录肿瘤的长径、短径以及小鼠的体重,并计算肿瘤体积。肿瘤体积的计算方法为:长径
×
短径
×
短径
×
0.5。最后一次给药后一天将小鼠处死,分离出肿瘤组织,称重拍照,并计算荷瘤率(肿瘤重量/小鼠体重
×
100%)。
[0093]
实验结果如图12所示,saline组的肿瘤体积最后达到了1300mm3左右,taxol溶液剂虽然在一定程度上也能够抑制肿瘤的生长,但其肿瘤体积也达到了800mm3左右,abraxane、c8‑
ss
‑
ptx纳米粒与f8‑
ss
‑
ptx纳米粒都显示出比taxol溶液更强的抗肿瘤效果,这是由纳米粒相对于溶液剂的制剂学优势决定的:(1)细胞摄取效率高;(2)体内药动学行为好;(3)肿瘤蓄积能力强;(4)肿瘤细胞内快速释药。且f8‑
ss
‑
ptx纳米粒展现出了最强的抗肿瘤效果,给药后荷瘤鼠的肿瘤体积几乎没有增长,并且荷瘤率显著低于其它制剂组。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1