稳定的抗TNFα单克隆抗体的液体制剂的制作方法
稳定的抗tnf
α
单克隆抗体的液体制剂
技术领域
1.本发明涉及生物制药领域,具体地,涉及一种稳定的抗tnfα单克隆抗体的液体制剂。
背景技术:
2.类风湿关节炎(rheumatoid arthritis,ra)是由炎性细胞浸润及其释放的炎性介质所致的全身性自身免疫性疾病。其病理改变为关节滑膜的慢性炎症、血管翳形成,并逐渐出现关节软骨和骨破坏、骨纤维化,最终可能导致关节畸形和功能丧失。ra的发病机制比较复杂,但是对ra病理研究和细胞生物学的平行研究都发现,肿瘤坏死因子α(tnfα)是类风湿关节炎相关的关键炎症介质,被认为是治疗ra的有效靶点位置。tnfα在ra炎症发展过程中起着非常重要的作用。tnfα抑制剂可抑制滑膜细胞增生,减少软骨细胞、纤维细胞和软骨细胞释放基质金属蛋白酶,抑制滑膜细胞、内皮细胞、巨噬细胞释放前列腺素,阻止炎性细胞的迁移和聚集,减少白细胞介素(interleuin,il)-1、il-6、il-8释放,能缓解关节炎性症状和防止关节破坏。临床上应用tnfα抑制剂对ra患者进行治疗,已取得良好的效果。英夫利昔(infliximab)、依那西普(etanercept)、阿达木单抗(adalimumab)、戈利木(golimumab)等tnfα抑制剂生物制剂已上市多年,在ra治疗中均显示出了良好的疗效和耐受性。
3.治疗性单克隆抗体作为一种具有独特优势的生物靶向治疗药物,已成为目前全球药物研发的热点。中国发明专利cn102037012b中公开了一种抗tnfα单克隆抗体,采用基因重组技术由兔抗人tnfα单克隆抗体经过人源化改造获得,能够以高亲和力结合其作用靶点人tnfα,有效阻断tnfα的生物学功能并通过代谢有效降低tnfα的浓度,属于tnfα抑制剂。单克隆抗体本质是蛋白质,与传统化药小分子药物相比,复杂大分子蛋白药物的稳定性差,易导致结构和功能改变,进而影响药物的有效性和安全性。因此,开发稳定的制剂配方,是蛋白类药物开发的重要环节。
技术实现要素:
4.本发明的目的在于提供一种稳定的抗tnfα单克隆抗体的液体制剂,该制剂包含抗tnfα单克隆抗体、缓冲剂、稳定剂、非离子表面活性剂,可起到稳定和保护目的抗体蛋白的作用,可使目的抗体蛋白在2~8℃下稳定保存至少36个月。
5.为了实现本发明的目的,本发明采用了以下技术方案:
6.本发明的第一个方面提供了一种抗tnfα单克隆抗体的液体制剂,所述液体制剂包含:
7.30~100mg/ml抗tnfα单克隆抗体、10~50mm缓冲剂、0.02~0.5mg/ml非离子表面活性剂、及稳定剂;
8.所述稳定剂选自非还原糖、多元醇、氨基酸中的一种或多种的混合物,其中非还原糖浓度为10~80mg/ml,多元醇浓度为5~40mg/ml,氨基酸浓度为2~300mm;
9.所述液体制剂的ph为5.0~6.5,渗透压为260~340mosmol/kg。
10.本发明中,所述缓冲剂起到缓冲外来ph变化的作用,使溶液的ph值保持在一定的范围内。
11.在一个优选的实施方案中,所述缓冲剂选自枸椽酸盐缓冲剂、磷酸盐缓冲剂、醋酸盐缓冲剂中的一种或多种的混合物;更优选的,所述缓冲剂为磷酸盐缓冲剂。
12.在一个优选的实施方案中,所述缓冲剂浓度为10~50mm;更优选的,所述缓冲剂浓度为20~30mm。
13.本发明中,所述稳定剂起到对抗氨基酸降解的稳定作用。由于单克隆抗体的分子量较大,氨基酸发生降解的情况也较多,各种物理化学作用能够引发氨基酸发生去氨基化、环化、化学键断裂等变化,通常为糖类、醇类、氨基酸等。具体的,所述的稳定剂为非还原糖、多元醇、氨基酸中的一种或多种的混合物。
14.在一个优选的实施方案中,所述非还原糖选自蔗糖或海藻糖;所述多元醇为甘露醇;所述氨基酸选自甘氨酸或精氨酸;更优选的,所述海藻糖浓度为10~60mg/ml,所述蔗糖浓度为15~80mg/ml,所述甘露醇浓度为6~12mg/ml,所述精氨酸浓度为5~10mm,所述甘氨酸浓度为5~10mm。
15.在一个优选的实施方案中,所述稳定剂选自非还原糖和氨基酸的混合物或多元醇和氨基酸的混合物;更优选的,所述稳定剂选自海藻糖与甘氨酸的混合物、蔗糖与甘氨酸的混合物、或甘露醇与精氨酸的混合物。
16.本发明中,所述非离子表面活性剂起到增溶作用。单克隆抗体注射液蛋白浓度通常较高,为了防止药物在振荡过程中药物间聚合,与内包材、空气、胶塞接触时吸附或者析出,在单克隆抗体液体制剂中加入非离子表面活性剂。
17.在一个优选的实施方案中,所述非离子表面活性剂选自聚山梨酯20、聚山梨酯80、或聚山梨酯20与聚山梨酯80的混合物;更优选的,所述非离子表面活性剂的浓度为0.05~0.1mg/ml。
18.在一个优选的实施方案中,所述抗tnfα单克隆抗体的液体制剂还包含等渗调节剂;更优选的,所述等渗调节剂为氯化钠。
19.所述等渗调节剂用于将液体制剂调节为等渗溶液,以利于临床使用。例如将所述液体制剂的渗透压调节至260~340mosmol/kg。
20.存在于本发明制剂中的抗体的含量是通过考虑需要的剂量体积和施用模式决定的。在一个优选的实施方案中,所述抗tnfα单克隆抗体浓度为40~60mg/ml;更优选的,所述抗tnfα单克隆抗体浓度为50mg/ml。
21.在一个优选的实施方案中,所述抗tnfα单克隆抗体是全长抗体。
22.在一个优选的实施方案中,所述抗tnfα单克隆抗体的重链可变区氨基酸序列如seq id no:1所示,轻链可变区氨基酸序列如seq id no:2所示。
23.在一个优选的实施方案中,所述抗tnfα单克隆抗体的重链氨基酸序列如seq id no:3所示,轻链氨基酸序列如seq id no:4所示;或包含氨基酸序列与seq id no:3具有至少98%同源性的重链,和包含氨基酸序列与seq id no:4具有至少98%同源性的轻链。
24.在一个优选的实施方案中,所述液体制剂包含:
25.40~60mg/ml抗tnfα单克隆抗体;
26.10~50mm磷酸盐缓冲剂、枸椽酸盐缓冲剂或醋酸盐缓冲剂;
27.0.1mg/ml聚山梨酯80;
28.及选自以下的任一种或其混合物:
29.10~60mg/ml海藻糖、15~80mg/ml蔗糖、6~12mg/ml甘露醇、5~10mm精氨酸、或5~10mm甘氨酸;
30.所述液体制剂的ph为5.5~6.5,渗透压为260~340mosmol/kg;
31.更优选的,所述磷酸盐缓冲剂浓度为20~30mm;进一步更优选的,所述液体制剂的ph为5.9~6.1。
32.在一个优选的实施方案中,所述液体制剂包含:
33.50mg/ml抗tnfα单克隆抗体;
34.20~30mm磷酸盐缓冲剂;
35.0.1mg/ml聚山梨酯80;
36.及选自以下的任一种:
37.60mg/ml海藻糖、80mg/ml蔗糖、12mg/ml甘露醇、或12mg/ml甘露醇与5mm精氨酸的混合物;
38.所述液体制剂的ph为5.9~6.1,渗透压为260~340mosmol/kg。
39.在一个优选的实施方案中,所述液体制剂包含:
40.a)50mg/ml抗tnfα单克隆抗体、1.29mg/ml磷酸氢二钠十二水合物、3.64mg/ml磷酸二氢钠一水合物、80mg/ml蔗糖、0.1mg/ml聚山梨酯80,ph6.0;或,
41.b)50mg/ml抗tnfα单克隆抗体、1.29mg/ml磷酸氢二钠十二水合物、3.64mg/ml磷酸二氢钠一水合物、1.46mg/ml氯化钠、60mg/ml海藻糖,0.1mg/ml聚山梨酯80,ph5.9;或,
42.c)50mg/ml抗tnfα单克隆抗体、0.21mg/ml磷酸氢二钠十二水合物、2.68mg/ml磷酸二氢钠一水合物、5.84mg/ml氯化钠、0.87mg/ml精氨酸、12mg/ml甘露醇、0.1mg/ml聚山梨酯80,ph6.1;或,
43.d)50mg/ml抗tnfα单克隆抗体、1.25mg/ml磷酸氢二钠十二水合物、2.28mg/ml磷酸二氢钠一水合物、8.18mg/ml氯化钠、12mg/ml甘露醇、0.1mg/ml聚山梨酯80,ph6.0。
44.在一个优选的实施方案中,所述液体制剂用于注射给药;更优选的,所述液体制剂用于皮下注射给药。
45.本发明的第二个方面提供了上述的抗tnfα单克隆抗体的液体制剂在制备治疗或预防tnfα相关自身免疫类疾病的药物中的用途。
46.在一个优选的实施方案中,所述tnfα相关自身免疫类疾病为类风湿关节炎。
47.本发明的制剂可采用本领域公知的方法将各种组分按一定的浓度进行组合制备。
48.本发明提到的上述特征,或实施例提到的特征可以任意组合。
49.本发明包括使用上述任意值的组合作为上限和/或下限的值的范围。
50.上述液体制剂具有优良的稳定性,特别是化学稳定性。其在高达约40℃下稳定至少1周、2周、3周、4周、5周、6周,或在高达约40℃下稳定至少10天、20天、30天;和/或在2~8℃条件稳定至少3个月、6个月、12个月、24个月、36个月。优选的,所述制剂在40℃稳定至少30天;和/或在2~8℃稳定至少36个月。多种用于测量抗体稳定性的分析技术是本领域所公知的(如sec-hplc纯度检测)。
51.本发明提供了一种稳定的抗tnfα单克隆抗体的液体制剂,包含抗tnfα单克隆抗体、缓冲剂、稳定剂、非离子表面活性剂。其有益效果在于:在2~8℃的条件下,本发明的抗tnfα单克隆抗体液体制剂可稳定保存36个月,sec-hplc纯度检测显示抗tnfα单克隆抗体纯度98.0%以上,符合长期保存及运输的质控要求。因此,应用本发明优选的液体制剂配方能够为抗tnfα单克隆抗体提供长期的稳定性保护,具有广泛的工业应用前景。
具体实施方式
52.下面结合具体实施例,进一步详细阐述本发明。
53.本发明中,术语“单克隆抗体”指从一类基本均一的群体中获得的抗体,除少数可能存在的天然突变外,该群体中包含的单个抗体是相同的。单克隆抗体针对抗原上的单个决定簇,对单个抗原位点高特异。单克隆抗体可以通过杂交瘤培养来合成,不会被其它免疫球蛋白污染。
54.本发明中,术语“全长抗体”是指有相同结构特征的约150000道尔顿的异四聚糖蛋白,包含可变区(v)和恒定区(c),其由两条相同的重链(hc)和两条相同的轻链(lc)组成。每条重链的一端有重链可变区(vh),其后是重链恒定区,重链恒定区由三个结构域ch1、ch2、以及ch3构成。每条轻链的一端有轻链可变区(vl),另一端有轻链恒定区,轻链恒定区包括一个结构域cl;轻链恒定区与重链恒定区的ch1结构域配对,轻链可变区与重链可变区配对。恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体依赖的细胞介导的细胞毒性作用(adcc,antibody-dependent cell-mediated cytotoxicity)等。重链恒定区包括igg1、igg2、igg3、igg4亚型;轻链恒定区包括κ(kappa)或λ(lambda)。抗体的重链和轻链通过重链的ch1结构域和轻链的cl结构域之间的二硫键共价连接在一起,抗体的两条重链通过铰链区之间形成的多肽间二硫键共价连接在一起。
55.本发明中,术语“盐”包括但不仅限于钠盐和钾盐,并且包含其盐的水合物形式,如磷酸氢二钠十二水合物。
56.本发明中,术语“水”是指符合药典标准的水,包括纯化水、注射用水,或任何适用于药物制剂的水。
57.本发明中,术语“稳定”指液体制剂在保存时,其中的活性成分抗体基本上能保持它的化学稳定性和/或物理稳定性和/或生物稳定性。例如,在给定储存期结束时,制剂中抗体蛋白的纯度大于90%、91%、92%、93%、94%、95%、96%、97%、98%、99%。
58.本发明中,术语“pb”为“phosphate buffer”的缩写,指磷酸缓冲液或缓冲剂。
59.本发明中,术语“多种”指两种或两种以上。
60.以下实施例中所使用的活性成分抗tnfα单克隆抗体可参照中国发明专利cn102037012b中披露的制备方法制备获得,也可参照本领域公知的抗体制备方法制备获得。其重链可变区vh的氨基酸序列如seq id no:1所示,其轻链可变区vl的氨基酸序列如seq id no:2所示。其重链(heavy chain,hc)氨基酸序列如seq id no:3所示,其轻链(light chain,lc)氨基酸序列如seq id no:4所示。
61.seq id no:1:
62.qqlqesgpglvkpsetlsltcavsgfslsryginwvrqapgsglewigaigetgrayyaswaksrstisrdtsknqvslkmssvtaadtavyfcargelfnngwgafniwgpgtmvtvss
63.seq id no:2:
64.ayqmtqspsslsasvgdrvtikcqasesiysslawyqqkpgkppklliysastlasgvpsrfsgsgsgtdftltisslqpedfatyycqqgfgtsnvenpfgggtkveik
65.seq id no:3:
66.qqlqesgpglvkpsetlsltcavsgfslsryginwvrqapgsglewigaigetgrayyaswaksrstisrdtsknqvslkmssvtaadtavyfcargelfnngwgafniwgpgtmvtvssastkgpsvfplapsskstsggtaalgclvkdyfpepvtvswnsgaltsgvhtfpavlqssglyslssvvtvpssslgtqtyicnvnhkpsntkvdkkvepkscdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk
67.seq id no:4:
68.ayqmtqspsslsasvgdrvtikcqasesiysslawyqqkpgkppklliysastlasgvpsrfsgsgsgtdftltisslqpedfatyycqqgfgtsnvenpfgggtkveikrtvaapsvfifppsdeqlksgtasvvcllnnfypreakvqwkvdnalqsgnsqesvteqdskdstyslsstltlskadyekhkvyacevthqglsspvtksfnrgec
69.示例性的,以下实施例中使用的磷酸盐缓冲剂为磷酸氢二钠-磷酸二氢钠缓冲剂;使用的枸椽酸盐缓冲剂为枸椽酸-枸椽酸钠缓冲剂;使用的醋酸盐缓冲剂为醋酸-醋酸钠缓冲剂。
70.以下实施例中使用的检测方法说明如下:
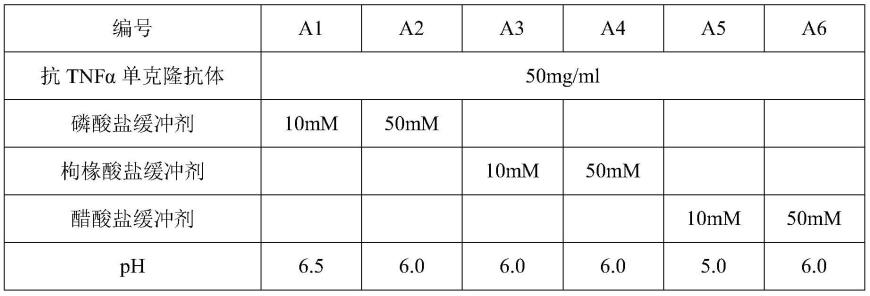
71.sec-hplc检测方法:waters高效液相色谱仪e2695,紫外/可见光检测器2489,色谱柱tsk-gel g3000sw,流动相20mm pb-150mm nacl,流速1ml/min,上样体积50μl,样品室温度2~8℃,检测时间40min,吸收波长280nm。
72.uv检测方法:backman du640检测器,检测波长280nm、260nm,样品用量100μl,计算公式为蛋白含量=280nm吸收值/1.43
×
稀释倍数。
73.cex-hplc检测方法:waters高效液相色谱仪e2695,紫外/可见光检测器2489,色谱柱propac wcx-10(4
×
250mm),流动相a为20mm mes-60mm nacl,流动相b为20mm mes-240mm nacl,流速1ml/min,上样体积15μl,样品室温度2~8℃,柱温室温,吸收波长280nm,洗脱梯度如下。
74.表1洗脱梯度
75.时间mina%b%0752527525374060380100430100447525547525
76.以下实施例中未注明具体条件的实验方法,通常按照常规条件以及手册中所述的条件,或按照制造厂商所建议的条件实施。实施例中所使用的通用设备、试剂、耗材、辅料等,均可从商业途径获得。所有试剂、辅料均符合中国药典药用标准。
77.实施例1缓冲剂对液体制剂稳定性的影响
78.本实施例的主要目的为评估不同浓度和组成的缓冲剂(枸椽酸盐缓冲剂、磷酸盐缓冲剂、醋酸盐缓冲剂)对液体制剂稳定性的影响。
79.将表2所示的配方在40℃条件下放置10天,然后对其进行sec-hplc和uv检测,分析其中抗tnfα单克隆抗体sec-hplc纯度和uv变化率(即检测时间点与零点的蛋白含量比值)的变化,测试结果如表3所示。
80.表2缓冲剂选择实验条件
[0081][0082]
表3缓冲剂选择实验检测结果
[0083]
编号sec-hplc纯度uv变化率a197.7%98.7%a297.6%99.3%a396.0%99.0%a495.8%97.8%a594.4%97.3%a695.3%98.1%
[0084]
结果表明,对于抗tnfα单克隆抗体而言,磷酸盐缓冲剂(a1和a2)相较于枸椽酸盐缓冲剂(a3和a4)以及醋酸盐缓冲剂(a5和a6)能够提供更高的sec-hplc纯度和更小的uv变化率,具有更好的稳定性。因此,优选磷酸盐缓冲体系进行后续探索。
[0085]
实施例2稳定剂对液体制剂稳定性的影响
[0086]
本实施例的主要目的为评估不同浓度和组成的稳定剂(海藻糖、蔗糖、甘露醇、精氨酸、甘氨酸)对液体制剂稳定性的影响。
[0087]
按表4配制不同辅料成分的配方,在40℃条件下放置6周,然后分别在1周、2周、4周和6周时对其进行sec-hplc检测,分析其中抗tnfα单克隆抗体纯度的变化,测试结果如表5所示。
[0088]
表4稳定剂选择实验条件
[0089][0090]
表5稳定剂选择实验检测结果
[0091][0092][0093]
结果显示,对于抗tnfα单克隆抗体而言,b07、b08和b12所示的液体制剂在40℃下放置6周之后,其sec-hplc纯度仍然高于94%,相较于包含其他稳定剂组成的液体制剂具有更好的稳定性。因此,综合考虑以上检测结果和目的抗体蛋白性质,优选b07、b08和b12液体制剂配方进行下一步实验。
[0094]
实施例3抗tnfα单克隆抗体液体制剂配制
[0095]
抗tnfα单克隆抗体经切向流超滤,更换至磷酸盐缓冲体系,其中抗tnfα单克隆抗
体浓度为50mg/ml。配制由稳定剂(蔗糖)和非离子表面活性剂(聚山梨酯80)组成的制剂稀释液,与上述包含磷酸盐缓冲体系以及抗tnfα单克隆抗体的样品混合均匀,最终液体制剂中各组分与含量如表6所示。
[0096]
表6抗tnfα单克隆抗体液体制剂
[0097]
抗tnfα单克隆抗体50mg/ml磷酸氢二钠十二水合物1.29mg/ml磷酸二氢钠一水合物3.64mg/ml蔗糖80mg/ml聚山梨酯800.1mg/mlph6.0
[0098]
实施例4抗tnfα单克隆抗体液体制剂配制
[0099]
抗tnfα单克隆抗体经切向流超滤,更换至磷酸盐缓冲体系,其中抗tnfα单克隆抗体浓度为50mg/ml。配制由稳定剂(海藻糖)、非离子表面活性剂(聚山梨酯80)和等渗调节剂(氯化钠)组成的制剂稀释液,与上述包含磷酸盐缓冲体系以及抗tnfα单克隆抗体的样品混合均匀,最终液体制剂中各组分与含量如表7所示。
[0100]
表7抗tnfα单克隆抗体液体制剂
[0101]
抗tnfα单克隆抗体50mg/ml磷酸氢二钠十二水合物1.29mg/ml磷酸二氢钠一水合物3.64mg/ml氯化钠1.46mg/ml海藻糖60mg/ml聚山梨酯800.1mg/mlph5.9
[0102]
实施例5抗tnfα单克隆抗体液体制剂配制
[0103]
抗tnfα单克隆抗体经切向流超滤,更换至磷酸盐缓冲体系,其中抗tnfα单克隆抗体浓度为50mg/ml。配制由稳定剂(精氨酸、甘露醇)、非离子表面活性剂(聚山梨酯80)和等渗调节剂(氯化钠)组成的制剂稀释液,与上述包含磷酸盐缓冲体系以及抗tnfα单克隆抗体的样品混合均匀,最终液体制剂中各组分与含量如表8所示。
[0104]
表8抗tnfα单克隆抗体液体制剂
[0105]
抗tnfα单克隆抗体50mg/ml磷酸氢二钠十二水合物0.21mg/ml磷酸二氢钠一水合物2.68mg/ml氯化钠5.84mg/ml精氨酸0.87mg/ml甘露醇12mg/ml聚山梨酯800.1mg/mlph6.1
[0106]
实施例6抗tnfα单克隆抗体液体制剂配制
[0107]
抗tnfα单克隆抗体经切向流超滤,更换至磷酸盐缓冲体系,其中抗tnfα单克隆抗体浓度为50mg/ml。配制由稳定剂(甘露醇)、非离子表面活性剂(聚山梨酯80)和等渗调节剂(氯化钠)组成的制剂稀释液,与上述包含磷酸盐缓冲体系以及抗tnfα单克隆抗体的样品混合均匀,最终液体制剂中各组分与含量如表9所示。
[0108]
表9抗tnfα单克隆抗体液体制剂
[0109]
抗tnfα单克隆抗体50mg/ml磷酸氢二钠十二水合物1.25mg/ml磷酸二氢钠一水合物2.28mg/ml氯化钠8.18mg/ml甘露醇12mg/ml聚山梨酯800.1mg/mlph6.0
[0110]
实施例7抗tnfα单克隆抗体液体制剂的稳定性检测
[0111]
将实施例3、实施例4、实施例5和实施例6制备获得的抗tnfα单克隆抗体制剂在40℃条件下放置30天,然后分别在0天、15天和30天时对其进行sec-hplc和高效阳离子交换色谱(cex-hplc)检测,分析其中抗tnfα单克隆抗体纯度和cex-hplc主峰含量的变化,测试结果如表10和表11所示。
[0112]
表10 sec-hplc检测实验结果
[0113][0114]
表11 cex-hplc检测实验结果
[0115][0116]
结果显示,对于抗tnfα单克隆抗体而言,在40℃的条件下,本发明的抗tnfα单克隆抗体液体制剂可稳定保存30天,sec-hplc纯度检测显示抗tnfα单克隆抗体纯度下降不超过10%,cex-hplc检测显示抗tnfα单克隆抗体主峰含量下降不超过10%,具有良好的化学稳定性。
[0117]
实施例8抗tnfα单克隆抗体液体制剂的长期稳定性检测
[0118]
将实施例3、实施例4、实施例5和实施例6制备获得的抗tnfα单克隆抗体液体制剂在2~8℃条件下放置36个月,然后分别在0天、3个月、6个月、12个月、24个月和36个月时对其进行sec-hplc纯度检测,分析其中抗tnfα单克隆抗体纯度的变化,测试结果如表12所示。
[0119]
表12 sec-hplc检测实验结果
[0120][0121]
结果显示,对于抗tnfα单克隆抗体而言,在2~8℃的条件下,本发明的抗tnfα单克隆抗体液体制剂可稳定保存36个月,sec-hplc纯度检测显示抗tnfα单克隆抗体纯度高于98.0%以上,符合长期保存及运输的质控要求。因此,应用本发明优选的液体制剂配方能够提供抗tnfα单克隆抗体长期的化学稳定性,具有广泛的工业应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1