线粒体移植在治疗牙周炎中的应用
1.本发明涉及牙周炎治疗药物技术领域,更具体地,涉及线粒体移植在治疗牙周炎中的应用。
背景技术:
2.牙周炎是发生于牙周支持组织的一种慢性炎症性疾病,由牙菌斑微生物始动、宿主免疫反应参与,表现为牙龈炎症,牙周袋形成,牙槽骨吸收和牙齿松动,最终导致牙齿丧失。牙周病不仅是导致成人牙齿缺失的主要原因,也与全身系统性疾病关系密切,如动脉粥样硬化、糖尿病、慢性肾病、老年性肺炎、类风湿性关节炎、阿尔兹海默病等,这更增加了牙周炎的治疗难度。牙周炎的治疗方式主要是通过非手术或牙周组织再生的手术治疗,有效控制牙周炎。目前临床上牙周病的治疗方法包括:(1)菌斑控制,通过刷牙或含化学药物的漱口剂清除致病因素菌斑生物膜。(2)机械治疗,通过机械手段如龈上洁治,龈下刮治等方式去除龈上,龈下菌斑,是目前治疗牙周炎最有效,最广泛的方法。(3)药物治疗,对于窄而深的骨下袋,跟分叉病变,将药物置于器械难以到达的病变部位,控制菌斑,减轻炎症。(4)激光治疗,分为光生物刺激疗法和光动力疗法,光生物刺激疗法主要以组织修复、消除炎症、减轻疼痛等为主,对靶组织不产生不可逆性损伤。光动力疗法则以光化学效应为原理,在牙周疾病中主要发挥杀菌效应。尽管牙周炎治疗的方法多样,新技术、新药物不断发展和更新,但是现存治疗手段对已经发生的牙周支持组织丧失仍无法有效修复。因此,需要制定一种替代策略,应对牙周炎症中牙周组织持续丧失的困境。
3.线粒体移植(mitochondrial transplantation)是指从正常组织或细胞中分离线粒体,然后植入线粒体损伤或缺失的部位,是损伤细胞获得救治、器官功能得以恢复的全新干预技术,其正作为一种新兴治疗方案在一些疾病的干预治疗的基础研究中崭露头角。目前线粒体移植的主要方法为共培养法、显微注射法、脂质体转运法。
4.在体外将坐骨神经与线粒体共培养的一项研究中发现,在线粒体移植后,改善了受损坐骨神经外植体的细胞骨架,降低了细胞ros水平。电生理学的研究结果也表明,将线粒体转移到神经束膜中可以改善肌肉的功能和神经的传导能力(kuo cc,su hl,chang tl,chiang cy,sheu ml,cheng fc,chen cj,sheehan j,pan hc.prevention of axonal degeneration by perineurium injection of mitochondria in a sciatic nerve crush injury model.neurosurgery.2017;80(3):475
‑
488.)。huang等人将从仓鼠细胞中分离的线粒体注射到脑缺血的大鼠模型中,发现接受外源性线粒体的大鼠脑组织凋亡细胞和梗塞面积显著减少,缺血性受损的脑功能得到改善。这项研究强调异种外源性线粒体也可以有效地对抗中枢神经系统中的急性缺血性损伤。研究还发现,细胞中分离的外源性线粒体不仅能对抗急性损伤,也能对脑组织有长期保护作用(huang pj,kuo cc,lee hc,shen ci,cheng fc,wu sf,chang jc,pan hc,lin sz,liu cs,su hl.transferring xenogenic mitochondria provides neural protection against ischemic stress in ischemic rat brains.cell transplant.2016;25(5):913
‑
27.)。在chang等人进行的另一项研究中,
他们将外源性和同种异体肽标记的线粒体移植到6
‑
羟基多巴胺诱导的帕金森病动物模型中,发现外源性线粒体对黑质和黑质回路中的神经元有明显保护作用(chang jc,wu sl,liu kh,chen yh,chuang cs,cheng fc,su hl,wei yh,kuo sj,liu cs.allogeneic/xenogeneic transplantation of peptide
‑
labeled mitochondria in parkinson's disease:restoration of mitochondria functions and attenuation of 6
‑
hydroxydopamine
‑
induced neurotoxicity.transl res.2016apr;170:40
‑
56.e3);他们又将分离的线粒体移植到帕金森模型小鼠的内侧前束中,在随后的三个月发现帕金森模型的小鼠运动功能得到改善,6
‑
羟基多巴胺的细胞毒作用降低。在气道疾病模型中,进行气管内线粒体移植,结果显示代谢活动增加,肺损伤改善和疾病结局与线粒体转移到肺泡上皮有关(su y,zhu l,yu x,cai l,lu y,zhang j,li t,li j,xia j,xu f,hu q.mitochondrial transplantation attenuates airway hyperresponsiveness by inhibition of cholinergic hyperactivity.theranostics.2016;6(8):1244
‑
60)。目前尚无将线粒体移植用于治疗牙周炎的相关报道。
技术实现要素:
5.本发明的目的在于克服现有技术中存在的上述缺陷和不足,应用线粒体制剂研发牙周炎治疗药物。
6.本发明的上述目的是通过以下技术方案给予实现的:
7.本发明首先通过试剂盒和差速离心法从健康的人牙周膜干细胞中提取线粒体,所得的线粒体具备线粒体结构和功能完整性。进一步,利用所得线粒体研究线粒体对炎症微环境中人牙周膜干细胞(hpdlscs)成骨分化能力的影响、对炎症损伤的hpdlscs免疫调节功能的影响、及对小鼠牙周炎的治疗效果。结果表明,所述线粒体可被炎症损伤的人牙周膜干细胞捕获,增强人牙周膜干细胞成骨分化能力,可调节炎症微环境中牙周膜干细胞的免疫调节功能,促进巨噬细胞向m2型分化,减轻微环境中炎症程度;牙周炎动物模型研究表明,线粒体移植可以减轻炎症牙周组织损伤,促进牙周组织成骨,可用于牙周炎等炎症疾病的治疗,解决了现存治疗手段对已经丧失的牙周组织无法有效恢复的困境。
8.因此,本发明请求保护关于线粒体制剂的以下用途:
9.线粒体制剂在制备治疗牙周炎药物中的应用。
10.具体地,线粒体制剂增强炎症微环境中牙周膜干细胞成骨分化能力。
11.具体地,线粒体制剂通过调节炎症微环境中牙周膜干细胞的免疫调节功能,促进炎症微环境中巨噬细胞向m2型分化,减轻炎症。
12.本发明还提供线粒体制剂在制备促进炎症组织修复的药物中的应用;所述炎症组织包括但不限于牙周组织。
13.线粒体制剂在制备治疗急性和慢性炎症性疾病中的应用。
14.优选地,所述线粒体为自体或异体来源的线粒体。
15.所述线粒体可根据不同的适应症选取合适的分离组织或细胞;优选地,当用于治疗牙周炎时,所述线粒体分离自健康的人牙周膜干细胞。
16.进一步优选地,所述线粒体制剂含有pbs。
17.进一步优选地,所述线粒体制剂的浓度为每20μl中含有0.3~0.5μg(优选0.4μg)
线粒体。
18.使用线粒体这种细胞器疗法降低了细胞疗法的免疫原性。相较于间充质干细胞在体外培养过程中常常会遇到一些常见问题,如难以预料的分化,衰老和干性丧失等将降低其治疗的有效性,线粒体移植避免了这一问题。
19.与现有技术相比,本发明具有以下有益效果:
20.本发明提供了线粒体移植在治疗牙周炎中的应用。本发明研究表明线粒体可被炎症损伤的人牙周膜干细胞捕获,增强人牙周膜干细胞成骨分化潜能,并可调节炎症微环境中人牙周膜干细胞的免疫调节功能,促进巨噬细胞向m2型分化,减轻炎症;牙周炎动物模型研究表明,通过线粒体移植可以减轻炎症牙周组织损伤,促进牙周组织成骨,解决了现存治疗手段对已经丧失的牙周组织无法有效恢复的困境,具有较大的应用前景。
附图说明
21.图1为提取分离的线粒体的透射电镜结果。
22.图2为提取分离的线粒体的粒径分布结果。
23.图3为提取分离的线粒体的基于膜电位染料mito
‑
tracker red cmxros标记的结果。
24.图4为线粒体对炎症微环境中hpdlscs成骨分化能力的影响。a为hpdlscs成骨分化形成矿化结节的茜素红染色结果;b为茜素红染色半定量结果。
25.图5为线粒体对炎症损伤hpdlscs成骨相关基因表达的影响。
26.图6为线粒体对炎症损伤的hpdlscs免疫调节功能的影响。a为流式细胞术结果的展示,b为流式细胞术结果的统计分析。
27.图7为线粒体对小鼠牙周炎的治疗效果(micro
‑
ct检测结果)。
28.图8为线粒体对小鼠牙周炎的治疗效果(he染色结果)。
具体实施方式
29.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
30.除非特别说明,以下实施例所用试剂和材料均为市购。
31.实施例1线粒体分离及电镜观察和活性测试
32.1、线粒体分离
33.将健康的人牙周膜干细胞(hpdlscs)线粒体提取出来用于后续实验。具体方法如下:
34.(1)原代培养hpdlscs,将处于生长对数期的hpdlscs接种于150mm培养皿中,当细胞密度达到90%时,按照线粒体提取试剂盒说明书提取线粒体。
35.(2)常规消化离心上述hpdlscs细胞,收集细胞沉淀,2ml pbs重悬细胞沉淀,将细胞悬液转移至一个新的2ml ep管;
36.(3)1200rpm离心5min后小心弃掉上清,加入800μl线粒体提取试剂a。将ep管放在涡旋仪上以最大速度涡旋5s后,立刻放在冰上孵育2min(严格控制时间,不可超过2min);
37.(4)在上述ep管内的细胞悬液中加入10μl线粒体提取试剂b,以最大速度涡旋10s;
38.(5)冰上孵育5min,每分钟内以最大速度涡旋10s;
39.(6)向ep管内加入800μl线粒体提取试剂c,上下颠倒混匀;
40.(7)700g,4℃,离心10min,转移上清至一个新的2ml的ep管;
41.(8)3000g,4℃,离心15min,转移上清至一个新的2ml的ep管,并用500μl线粒体提取试剂c重悬沉淀;
42.(9)12000g,4℃,离心5min,弃去上清,沉淀即为线粒体,冰上放置;
43.(10)用pbs溶液重悬线粒体沉淀待用。
44.2、透射电镜观察线粒体结构完整性
45.(1)方法
46.将分离的线粒体沉淀使用戊二醛磷酸缓冲液固定,经脱水、浸透、包埋、染色,制成超薄的切片,在透射电子显微镜下观察线粒体的形态、结构、大小和数量,并拍照,获得多个视野图片。
47.(2)结果
48.如图1所示,提取的线粒体外膜连续,结构完整。
49.3、nanosight测量分离的线粒体粒径
50.(1)方法
51.将分离的线粒体沉淀重悬于200μl pbs中,使用nanosight仪器检测所提取的线粒体粒径。
52.(2)结果
53.如图2所示,nanosight检测分离的线粒体粒径。结果显示,所提取线粒体粒径集中在600nm和900nm附近。
54.4、mito
‑
tracker red标记鉴定所提取线粒体的活性
55.(1)方法
56.具有活性的线粒体经mito
‑
tracker red标记后可发红色荧光,活性较低或失去活性的线粒体则荧光较弱或无荧光。检测时,ep管中加入20μg/ml的线粒体500μl,再加入mito
‑
tracker red荧光染色工作液5μl(10μm)并混匀,在37℃培养箱内孵育20min。然后,3000g,4℃,离心15min。弃去上清,pbs润洗2次,12000g,4℃,离心15min。用500μl预冷的pbs重悬线粒体并转移至共聚焦皿中,在荧光显微镜下观察荧光强度即判断线粒体活性程度。
57.(2)结果
58.如图3所示,使用基于膜电位染料mito
‑
tracker red cmxros对所提取的线粒体进行标记,可以标记上的线粒体视为具有活性的线粒体。
59.实施例2线粒体对炎症微环境中hpdlscs成骨分化能力的影响
60.实验分组:
61.①
hpdlscs:常规培养,与其余各组同步换液。
62.②
hpdlscs+os(osteoinduction,成骨诱导):与其余各组同步更换成骨诱导液。
63.③
hpdlscs+p.g
‑
lps(牙龈卟啉单胞菌脂多糖):使用含终浓度1μg/ml p.g
‑
lps的α
‑
mem培养基刺激24h后,更换为新鲜的培养基。
64.④
hpdlscs+p.g
‑
lps+os:使用含终浓度1μg/ml p.g
‑
lps的α
‑
mem培养基刺激24h
后,同步更换成骨诱导液。
65.⑤
hpdlscs+p.g
‑
lps+mt(mitochondria,线粒体):使用含终浓度1μg/ml p.g
‑
lps的α
‑
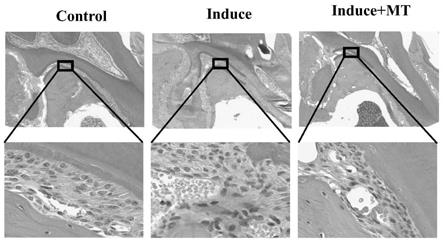
mem培养基刺激24h后,更换为含mt的新鲜的培养基处理24h,然后常规同步更换新鲜的培养基。
66.⑥
hpdlscs+p.g
‑
lps+mt+os:使用含终浓度1μg/ml p.g
‑
lps的α
‑
mem培养基刺激24h后,更换为含mt的新鲜的培养基处理24h,然后常规同步更换成骨诱导液。
67.1、茜素红染色观察矿化结节
68.(1)方法
69.取第4代hpdlscs以每孔2
×
104细胞密度接种于12孔板中,细胞贴壁后去除培养液,
③
、
④
、
⑤
、
⑥
组更换含1μg/ml p.g
‑
lps的α
‑
mem培养基,刺激24h后,
④
、
⑥
组更换为含20μg/ml mt培养基,其余组更换正常新鲜的培养基。待细胞生长覆盖率达80%后换成骨诱导液培养,每3d更换新鲜的成骨诱导液。14
‑
28d镜下观察到细胞呈复层生长,如出现圆形矿化结节,可弃去培养液。用pbs轻柔清洗后使用4%多聚甲醛固定30min,pbs洗3次,每次5min,然后加入1%茜素红染液,室温染色30min,去除茜素红染色液后,pbs洗3次,每次5min,显微镜下观察并拍照记录。弃净pbs液,每孔加入500μl 10%氯化十六烷基吡啶溶液,置于摇床上轻柔摇动30min,待茜素红充分溶解后取200μl加入96孔板中,每组3个复孔,酶标仪(波长562nm)检测各组的吸光度(od),作半定量分析。
70.(2)结果
71.结果如图4所示,a为hpdlscs成骨分化形成矿化结节的茜素红染色结果;b为茜素红染色半定量结果;结果显示,正常牙周膜干细胞经成骨诱导后,形成大量矿化结节,提示本实验中,牙周膜干细胞接受成骨诱导后成骨分化;单纯炎症处理后的细胞矿化结节形成量明显少于正常对照组,而炎症微环境中的牙周膜干细胞经过线粒体移植后,矿化结节比单纯炎症处理的细胞明显增多,这提示线粒体移植能够增强炎症状态下牙周膜干细胞成骨分化能力。
72.2、real
‑
time pcr检测成骨相关基因表达水平变化
73.(1)方法
74.提取细胞总rna:
75.取第4代处于对数生长期的hpdlscs常规消化处理,按每孔5
×
104细胞密度接种于6孔培养板内,细胞分组及处理如上,每组3个复孔。α
‑
mem完全养基培养3d,细胞密度达80%后,更换为成骨诱导液进行成骨诱导分化,每3d换液。成骨诱导7d,去除孔板内的培养基,每孔加入1ml trizol覆盖细胞,充分裂解细胞后,将样品转移至无酶ep管中,加入氯仿200μl,剧烈震荡15s后静置2min;4℃、12000rpm离心10min;离心后将最上层的透明水相层小心转移到新的ep管中,加入等体积的70%乙醇,上下颠倒混匀。将上步所得溶液全部加入到已装入收集管的吸附柱中。12000rpm离心20s,倒掉收集管中的废液,将吸附柱重新放回收集管中。向吸附柱加入700μl buffer rw1,12000rpm离心20s,倒掉废液,将吸附柱重新放回收集管中。向吸附柱加入500μl buffer rw2,12000rpm离心20s,倒掉废液,将吸附柱重新放回收集管中。12000rpm离心2min,倒掉收集管中的废液,将吸附柱置于室温数分钟,彻底晾干。将吸附柱置于一个新的rnase free离心管中,向吸附柱底部中央部位加入30
‑
50μldepc
‑
h2o。室温放置1min,1200rpm离心1min,收集rna溶液。用nanodrop2000微量紫外分光光度计检测
rna浓度和纯度,a260/a280在1.8
‑
2.0之间表明rna纯度满足实验要求。
76.cdna的合成:
77.按照反转录试剂盒说明书,采用随机引物法将rna逆转录为cdna。
78.首先配制rna模板溶液,混合液配置好后置于pcr仪中进行变性、退火反应。反应条件为65℃,5min,4℃备用。
[0079][0080]
配制反转录反应体系,合成cdna。反应条件为42℃,30
‑
60min,70℃,15min,4℃备用。
[0081][0082]
real
‑
time pcr反应:
[0083]
引物设计如下所示,所有引物均由invitrogen公司合成。
[0084][0085]
参照light cycler 480sybr green i master试剂盒说明书进行操作,反应体系如下:
[0086][0087]
以gapdh为内参基因,同时设立无cdna模板、无sybr green i master、ddh2o的阴性对照组。反应程序为:95℃变性10min后,按照95℃15s,58℃20s,72℃20s的程序进行40个循环,以gapdh为内参基因,计算目的基因的相对变化量,用2
‑
δδct
法计算和分析结果。
[0088]
(2)结果
[0089]
real
‑
time pcr检测细胞内成骨相关基因表达情况,结果如图5所示,表明外源线粒体可上调炎症损伤hpdlscs的成骨相关基因表达。
[0090]
实施例3线粒体对炎症损伤的hpdlscs免疫调节功能的影响
[0091]
(1)方法
[0092]
1)hpdlscs上清制备:取对数生长期的hpdlscs接种于10cm培养皿中。实验分组如下:control组、pg
‑
lps组、pg
‑
lps+mt组。接种细胞第2天,当细胞密度达到40%时,lps组和pg
‑
lps+mt组进行1μg/ml lps
‑
p.g刺激24h后更换新鲜培养基,pg
‑
lps+mt组中加入提取的线粒体(按照受体细胞数:供体细胞数=1:3的比例,即受体细胞数1.5
×
106,供体细胞数4.5
×
106hpdlscs)处理24h,处理结束后更换新鲜的完全培养基10ml。control组与pg
‑
lps组同步换液,24h后收集各组上清。收集的细胞上清以300g/min的速度离心10min,将离心后的细胞上清移至新的离心管中,以800g/min的速度再次离心10min,以去除死细胞和细胞碎屑。
[0093]
2)条件培养基(cm)制备:将细胞上清与新鲜完全培养基按1:1比例配制条件培养基。此时,制备的3组条件培养基命名为:control
‑
cm,pg
‑
lps
‑
cm,pg
‑
lps+mt
‑
cm。
[0094]
3)人原代巨噬细胞诱导:取新鲜人外周血20ml,分离获得单核细胞(pbmc),将分离的pbmc以每孔3
×
105个细胞接种于48孔培养板内,每组设3个复孔。使用含终浓度10ng/ml mcsf的1640培养基诱导细胞4d,然后更换含终浓度1ug/ml pg
‑
lps的培养基继续诱导细胞2d,按此方法诱导细胞后,约有50%至60%的细胞为m1型巨噬细胞,约10%至20%的细胞为m2型巨噬细胞。
[0095]
诱导后的巨噬细胞分组如下:
[0096]
①
control组:常规培养细胞
[0097]
②
control
‑
cm组:用control
‑
cm条件培养基培养细胞
[0098]
③
pg
‑
lps
‑
cm组:用pg
‑
lps
‑
cm条件培养基培养细胞
[0099]
④
pg
‑
lps+mt
‑
cm组:用pg
‑
lps+mt
‑
cm条件培养基培养细胞
[0100]
诱导后的巨噬细胞按照分组使用对应的条件培养基处理,于37℃,co2培养箱中培养24h后,收集细胞,用预冷的pbs润洗细胞。400g/min离心力下离心10min,pbs重悬细胞,加
入抗体(cd11c
‑
cy5.5,cd86
‑
pe,cd163
‑
apc),室温避光孵育30min。pbs清洗细胞两次,并在400g/min离心力下离心10min,然后将细胞重悬于300μl预冷pbs中。将细胞避光保存于冰上,用beckman流式细胞仪检测荧光强度,采用cytexpert软件分析数据。
[0101]
(2)结果
[0102]
流式结果如图6所示,a为流式细胞术结果的展示,b为流式细胞术结果的统计分析。结果显示,control
‑
cm可抑制人原代巨噬细胞向m1型极化(m1型比例由55.94%下降到24.92%),促进其向m2型极化(m2型比例由13.68%上升到49.66%)。lps刺激hpdlscs 24h后,其上清即pg
‑
lps
‑
cm的免疫调节功能被抑制。而lps刺激hpdlscs 24h后,再进行线粒体移植的hpdlscs分泌的细胞上清,即pg
‑
lps+mt
‑
cm可以显著抑制人原代巨噬细胞向m1型极化(m1型比例由40.08%下降到13.84%),促进其向m2型巨噬细胞分化(m2型比例由29.66%上升到48.74%)。外源性线粒体可通过调节炎症微环境中牙周膜干细胞的免疫调节功能,促进巨噬细胞向m2型分化,减轻微环境中炎症程度。
[0103]
实施例4线粒体对牙周炎的治疗效果
[0104]
实验分组:
[0105]
①
正常小鼠组
[0106]
②
牙周炎小鼠组
[0107]
③
牙周炎小鼠+线粒体组
[0108]
1.构建并评估牙周炎动物模型
[0109]
细菌凝胶造模:1
×
109个cfu的牙龈卟啉单胞菌与1ml的2%羧甲基纤维素钠凝胶混匀。
[0110]
①
组(正常小鼠组):在小鼠双侧上颌第一磨牙牙龈沟内,滴加20μl的2%羧甲基纤维素钠凝胶,并在小鼠上颌第一、二、三磨牙颊腭侧涂抹0.3ml的2%羧甲基纤维素钠凝胶。
[0111]
②③
组(牙周炎小鼠组):在小鼠双侧上颌第一磨牙牙龈沟内,滴加20μl的含牙龈卟啉单胞菌的2%羧甲基纤维素钠凝胶,并在小鼠上颌第一、二、三磨牙颊腭侧涂抹0.3ml的含牙龈卟啉单胞菌的2%羧甲基纤维素钠凝胶。
[0112]
造模第1周,每隔一天滴加和涂抹凝胶,之后为1次/1周,2周后通过micro
‑
ct评价牙周骨组织是否开始吸收及吸收程度,he染色评定牙周组织炎症水平。
[0113]
2.线粒体的植入
[0114]
待小鼠牙周组织处于炎症状态,
①②
组双侧上颌第一磨牙腭侧黏骨膜处局部注射20μl pbs,
③
组双侧上颌第一磨牙腭侧黏骨膜处局部注射20μl含线粒体(3
×
107个hpdlsc细胞所提取的线粒体)的pbs。粒体注射次数为2次/周,4周后取材检测。
[0115]
3.评价治疗效果
[0116]
(1)micro
‑
ct检测
[0117]
1)方法
[0118]
通过micro
‑
ct检测牙周骨组织的骨吸收程度。收集每组左侧上颌牙周
‑
颌骨联合标本,立即用4%多聚甲醛溶液固定24h后进行micro
‑
ct扫描。所得图像经三维重建后,测量各标本第一磨牙根分叉下50mm3体积的骨密度值,取各组均值作为结果;测量各标本患牙颊腭侧共六点(近中,中间,远中)釉牙骨质界至牙槽嵴顶的距离,取六点平均值作为每一个样本的结果。
[0119]
2)结果
[0120]
图7为各组小鼠上颌骨颊侧牙周骨组织的吸收程度,micro
‑
ct结果显示,与正常组小鼠相比,牙周炎组小鼠第一磨牙颊侧和舌侧牙槽骨均有明显吸收,釉牙骨质界与牙槽嵴顶距离增大。线粒体治疗组第一磨牙颊侧和舌侧牙槽骨吸收不明显,釉牙骨质界与牙槽嵴顶距离明显小于牙周炎组。
[0121]
(2)he染色
[0122]
(1)方法
[0123]
通过he染色检测炎症细胞浸润水平以及结缔组织附着丧失程度。收集每组右侧上颌牙周
‑
颌骨联合标本,立即用10%福尔马林溶液固定24h后,置于10%edta溶液中脱钙14天,然后进行脱水行石蜡包埋,制作近远中向5μm连续切片,取基本相同的2个位置做he染色。
[0124]
石蜡切片60℃烤片1h,趁热将玻片放入二甲苯中脱蜡,梯度浓度的乙醇水化;pbs洗涤。苏木素染液染10min,ddh2o洗2次,每次5min,伊红染色液染色1min,脱水至透明,用中性树胶封片。显微镜下观察,leica数字切片扫描仪扫描记录。
[0125]
(2)结果
[0126]
he切片结果如图8。结果显示,与正常小鼠组相比,牙周炎组小鼠第一磨牙根尖分叉区牙周膜间隙明显增宽,血管扩张,血管内可见较多血细胞,有明显的炎症细胞浸润,根尖区牙槽骨吸收,牙槽骨高度降低。线粒体治疗组小鼠第一磨牙根尖分叉区牙周膜间隙未明显增宽,血管未有明显改变,胶原纤维排列与正常相差无异,根尖区牙槽骨吸收不明显。说明线粒体可改善牙周炎症微环境,减轻组织炎症损伤,抑制牙槽骨吸收。
[0127]
综合上述体外实验和体内实验结果,表明线粒体移植可用于牙周炎治疗;通过线粒体移植以保护牙周膜干细胞成骨分化能力,促进牙周组织成骨,并且增强炎症微环境中hpdlscs的免疫调节功能,减轻牙周组织炎症,促进炎症牙周组织修复,解决了现存治疗手段对已经丧失的牙周组织无法有效恢复的困境,具有较大的应用前景。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1