一种帕莫酸托特罗定注射用混悬液制剂及其制备方法与流程
1.本发明属于医药制剂领域,具体涉及一种注射用混悬液制剂,特别涉及一种帕莫酸托特罗定注射用混悬液制剂及其制备方法。
背景技术:
2.托特罗定(tolterodine)是一种有效的、具有竞争性的毒蕈碱受体拮抗剂,广泛用于因膀胱过度兴奋引起的尿频。据报道经托特罗定治疗后排尿的平均频率降低,但是其口服后短时间即可被人体吸收,通常在1h左右到达作用部位并产生疗效,药物作用仅可维持5h。膀胱过度活动症是一个慢性的疾病,托特罗定消除半衰期短,仅为2~3h,因此需要长期不间断给药。
3.托特罗定本身熔点低、粘度高,分子中的两个苯环及大量烷烃链结构使其难溶于水,而在二甲亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、乙酸等溶剂中有较大溶解度。制剂中托特罗定一般以l(+)-酒石酸盐存在,其为白色结晶性粉末,酒石酸托特罗定在一定程度上提高了托特罗定在水中的溶解度,但仍存在味苦的较大缺陷。
4.cn101980999a公开了用于经皮药物递送系统的具有有效稳定性的托特罗定酸式盐,涉及托特罗定酸式盐,可改善托特罗定酒石酸盐的溶解度、吸湿性、稳定性等性能。
5.cn1164265c公开了一种含酒石酸托特罗定的缓释制剂及其制备方法,将酒石酸托特罗定和大量缓释材料组合在一起起到缓释作用,缺陷是缓释周期短,使用辅料种类和用量较多,改变不了需每日服药的特点,且仍未能解决托特罗定味苦的缺陷。
6.cn111925294a公开了一种托特罗定帕莫酸盐及其制备方法,具体涉及一种托特罗定帕莫酸盐和以托特罗定为原料制备托特罗定帕莫酸盐的制备方法,其中托特罗定帕莫酸盐中的托特罗定基团和帕莫酸基团的摩尔比为1.5:1。
7.缓释微球是一种创新型剂型,给药方式为肌肉或皮下,活性药物成分可随着载体材料在给药部位的降解缓慢释放出来,经吸收进入血液循环。cn105997887a公开了一种含有小分子添加剂的托特罗定缓释微球的制备方法,具体是将托特罗定和小分子脂肪酸/脂肪酸酯一起包裹在微球里,达到延缓托特罗定释放的效果;缺陷是小分子的加入使载药量变低,包封率达不到80%的药典指导要求。刘娜等研究报道了一种托特罗定微球的制备方法,制备过程中使用托特罗定碱基药物,采用乳化-溶剂挥发法制备缓释微球,并加入硬脂酸丁酯用来延缓释放,但其制备的微球包封率不高,仍未达到药典指导要求(托特罗定plga微球的制备及治疗膀胱过度活动症的研究[d].吉林大学,2018)。
[0008]
cn111728957a公开了一种托特罗定长效缓释微球及其制备方法,具体方法是将托特罗定帕莫酸盐和聚丙交酯-乙交酯一起加入到有机溶剂中溶解,乳化制备微球,挥发有机溶剂,洗涤冻干。不同规格的聚丙交酯-乙交酯材料,随着载药量的升高,微球的包封率逐渐降低,微球收率总体较低,且存在有机溶剂残留的缺陷;此外,虽然其释放周期长,但在给药后1~2周内因药物有效浓度达不到治疗浓度使药物不能及时起效。
[0009]
现有托特罗定口服制剂中存在作用时间短、清除率高的缺陷,目前已有口服缓释
剂型为每天给药1次,用药后血药浓度需2~6h才能出现最高峰,研发中的长效制剂例如微球制剂,给药后1~2周内药物不能达到有效治疗浓度。临床应用时要达到理想的血药浓度和治疗效果需要大剂量、反复用药,降低患者用药的顺应性和治愈的成功率。
[0010]
为解决托特罗定半衰期短、作用时间短,以及现有口服缓释制剂存在的血药浓度达峰时间长、研发中的长效制剂给药后1~2周内不能达到有效治疗浓度,发明人考虑将其做成帕莫酸盐,利用难溶性盐在肌注部位存留时间长,延缓药物释放速率,延长托特罗定药效的持续时间,减少血药浓度谷峰波动差异,恒定释放药物,但肌注的给药方式的注射容量一般较低(<5ml),因此长效注射剂需要在允许的注射容量范围内尽可能提高载药量。因此亟需提供一种新型托特罗定缓释制剂,用于解决上述问题,提高患者用药的顺应性,为临床提供更好的治疗方案。
技术实现要素:
[0011]
鉴于现有技术的缺陷,本发明的目的在于提供一种帕莫酸托特罗定注射用混悬液制剂,该制剂理化性质稳定,制备工艺简单,以实现肌肉或皮下注射后可恒定释药并延长托特罗定释药周期,减少血药浓度谷峰波动差异。
[0012]
本发明的技术方案为:一种帕莫酸托特罗定注射用混悬液制剂,所述制剂包含帕莫酸托特罗定、表面活性剂、稳定剂、等渗调节剂、缓冲盐和注射用水。
[0013]
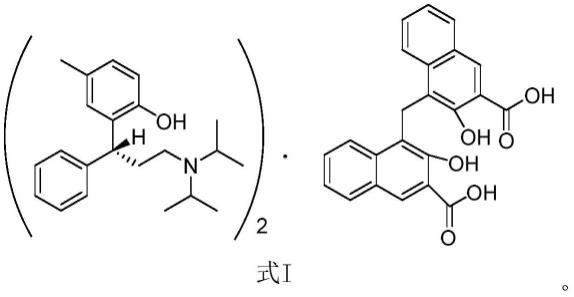
优选地,所述制剂中,帕莫酸托特罗定中托特罗定和帕莫酸的摩尔比为2:1,化学结构如式i所示:
[0014][0015]
优选地,所述制剂中,帕莫酸托特罗定浓度为50~600mg/ml。
[0016]
进一步优选地,所述制剂中,帕莫酸托特罗定浓度为100~300mg/ml。
[0017]
优选地,所述制剂中,表面活性剂选自聚山梨酯80、聚山梨酯20、泊洛沙姆188或十二烷基硫酸钠中的一种或几种。
[0018]
进一步优选地,所述制剂中,表面活性剂为聚山梨酯80或聚山梨酯20。
[0019]
优选地,所述制剂中,帕莫酸托特罗定与表面活性剂的重量比是1:0.01~0.2。
[0020]
进一步优选地,所述制剂中,帕莫酸托特罗定与表面活性剂的重量比是1:0.05~0.15。
[0021]
优选地,所述制剂中,稳定剂选自羧甲基纤维素钠、聚乙烯吡咯烷酮、羟丙基纤维素、羟丙甲基纤维素、聚乙二醇4000或聚乙二醇6000中的一种或几种。
[0022]
进一步优选地,所述制剂中,稳定剂选自羧甲基纤维素钠、聚乙烯吡咯烷酮、聚乙二醇4000或聚乙二醇6000中的一种或几种。
[0023]
优选地,所述制剂中,帕莫酸托特罗定与稳定剂的重量比是1:0.02~0.4。
[0024]
进一步优选地,所述制剂中,帕莫酸托特罗定与稳定剂的重量比是1:0.1~0.35。
[0025]
优选地,所述制剂中,等渗调节剂选自甘露醇、氯化钠、蔗糖或葡萄糖中的一种或几种。
[0026]
进一步优选地,所述制剂中,等渗调节剂为甘露醇或氯化钠。
[0027]
优选地,所述制剂中,帕莫酸托特罗定与等渗调节剂的重量比是1:0.01~0.2。
[0028]
进一步优选地,所述制剂中,帕莫酸托特罗定与等渗调节剂的重量比是1:0.05~0.15。
[0029]
优选地,所述制剂中,缓冲盐选自磷酸二氢钠、磷酸氢二钠、磷酸氢二钾、磷酸二氢钾或枸橼酸钠中的一种或几种。
[0030]
进一步优选地,所述制剂中,缓冲盐为磷酸二氢钠或磷酸氢二钠。
[0031]
优选地,所述制剂中,帕莫酸托特罗定与缓冲盐的重量比是1:0.001~0.1。
[0032]
进一步优选地,所述制剂中,帕莫酸托特罗定与缓冲盐的重量比是1:0.005~0.08。
[0033]
优选地,所述制剂的ph为6.8~7.4。
[0034]
本发明还提供了一种制备帕莫酸托特罗定注射用混悬液制剂的方法,其制备方法包含以下步骤:
[0035]
步骤a:制备包含表面活性剂、稳定剂、等渗调节剂和缓冲盐的水溶液,调节ph值至6.8~7.4,将该水溶液无菌过滤;
[0036]
步骤b:将帕莫酸托特罗定无菌地加入上述水溶液中,在密封容器中,高剪切3000~10000rpm条件下分散5~20min;
[0037]
步骤c:将步骤b制备的粗混悬液,用含有研磨珠的研磨机进行密闭无菌研磨2~4次,设置研磨转速,收集所得混悬液总重的50~75%的混悬液,即为大颗粒混悬液,置于密闭缓冲罐中;
[0038]
步骤d:将步骤c中剩余混悬液继续研磨2~4次,得小颗粒混悬液,将所其转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得帕莫酸托特罗定注射用混悬液制剂。
[0039]
优选地,所述制备方法中,研磨珠的粒径为0.3mm、0.5mm或0.8mm。
[0040]
优选地,所述制备方法中,研磨转速为6~10m/s。
[0041]
优选地,所述制剂中,混悬液由两种颗粒组成,小颗粒的平均粒径(d50)为0.2~2μm,大颗粒的平均粒径为2~20μm;进一步优选地,小颗粒的平均粒径为0.5~1μm,大颗粒的平均粒径为5~18μm。
[0042]
优选地,所述制剂中,混悬液由两种颗粒组成,小颗粒与大颗粒重量比例为1:1~10;进一步优选地,所述制剂中,小颗粒与大颗粒的重量比例为1:1~5。
[0043]
本发明的优势在于:
[0044]
(1)本发明制备的帕莫酸托特罗定注射用混悬液制剂,可实现100%载药量,以托特罗定和帕莫酸的摩尔比2:1的帕莫酸托特罗定为活性成分,给药后制剂中的小颗粒优先释放实现快速起效,大颗粒缓慢释放实现长效,该混悬注射剂显著改善长效注射剂给药后1~2周释药延迟(即不能达到有效治疗浓度)的问题,且可实现长效,提高了患者用药的顺应性;
[0045]
(2)本发明所得制剂的制备方法操作简单,制备过程中不使用有机溶剂,无残留溶剂,可实现连续化操作,重现性高,更适合工业化大生产。
附图说明
[0046]
图1:实施例3中所得制剂的粒度分布图;
[0047]
图2:实施例3和对比实施例1~2所得制剂的的体内药动学曲线。
具体实施方式
[0048]
下面列举具体实施方式对本发明予以进一步说明,但不以任何方式限制本发明的范围,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的范围之内。
[0049]
实施例1
[0050]
化合物帕莫酸托特罗定的制备:将托特罗定(32.55g,0.1mol)溶于260ml乙醇中,将充分研细的帕莫酸粉末(20.19g,0.052mol)分三批加入上述溶液中,控温75~80℃回流反应2~3h,降温0~5℃继续搅拌析晶1~2h,过滤,所得滤饼经45~60℃真空干燥2~4h后得淡黄色晶体粉末,即为目标产品帕莫酸托特罗定盐,收率95.62%,纯度99.31%,熔点为161.1~163.6℃。
[0051]
实施例1仅提供一种本发明制剂所用原料的合成方法,本发明实施例2~10中所用帕莫酸托特罗定原料可通过实施例1中的方法制备而得,也可以通过其他合成方法制备而得,本发明不限定制剂所用原料的合成方法,只要是能得到托特罗定与帕莫酸的摩尔比为2:1的帕莫酸托特罗定的合成方法均可,所得帕莫酸托特罗定(托特罗定与帕莫酸的摩尔比为2:1)都适用作为本发明的制剂原料。
[0052]
实施例2
[0053]
1)处方
[0054][0055]
2)制备工艺
[0056]
步骤a:称取处方量的聚山梨酯80、聚乙二醇4000、氯化钠、磷酸二氢钠溶解于800ml注射用水中,使用0.1mol/l氢氧化钠或盐酸水溶液调节ph值至6.8,将该水溶液无菌过滤;
[0057]
步骤b:将处方量的帕莫酸托特罗定无菌地加入上述水溶液中,在密封容器中,高
剪切3000rpm条件下分散5min,加剩余部分注射用水补全至处方总量,制成粗混悬液;
[0058]
步骤c:研磨步骤b制备的粗混悬液,使用含有研磨珠直径为0.3mm的研磨机进行密闭无菌通道式研磨2次,设置研磨转速6m/s,搅拌均匀状态下,收集所得混悬液总重的50%的混悬液,即为大颗粒混悬液,将其置于密闭缓冲罐中;
[0059]
步骤d:将步骤c中剩余混悬液继续研磨4次,得小颗粒混悬液,转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得。
[0060]
实施例3
[0061]
1)处方
[0062][0063]
2)制备工艺
[0064]
步骤a:称取处方量的聚山梨酯20、聚乙二醇6000、甘露醇、磷酸氢二钠溶解于900ml注射用水中,使用0.1mol/l氢氧化钠或盐酸水溶液调节ph值至7.0,将该水溶液无菌过滤;
[0065]
步骤b:将处方量的帕莫酸托特罗定无菌地加入上述水溶液中,在密封容器中,高剪切8000rpm条件下分散10min,加剩余部分注射用水补全至处方总量,制成粗混悬液;
[0066]
步骤c:研磨步骤b制备的粗混悬液,使用含有研磨珠直径为0.5mm的研磨机进行密闭无菌通道式研磨2次,设置研磨转速8m/s,搅拌均匀状态下,收集所得混悬液总重的60%的混悬液,即为大颗粒混悬液,将其置于密闭缓冲罐中;
[0067]
步骤d:将步骤c中剩余混悬液继续研磨5次,得小颗粒混悬液,转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得。
[0068]
实施例4
[0069]
1)处方
[0070]
[0071][0072]
2)制备工艺
[0073]
步骤a:称取处方量的聚山梨酯20、羧甲基纤维素钠、聚乙烯吡咯烷酮、氯化钠、磷酸氢二钠溶解于850ml注射用水中,使用0.1mol/l氢氧化钠或盐酸水溶液调节ph值至7.4,将该水溶液无菌过滤;
[0074]
步骤b:将处方量的帕莫酸托特罗定无菌地加入上述水溶液中,在密封容器中,高剪切10000rpm条件下分散20min,加剩余部分注射用水补全至处方总量,制成粗混悬液;
[0075]
步骤c:研磨步骤b制备的粗混悬液,使用含有研磨珠直径为1.0mm的研磨机进行密闭无菌通道式研磨2次,设置研磨转速10m/s,搅拌均匀状态下,收集所得混悬液总重的75%的混悬液,即为大颗粒混悬液,将其置于密闭缓冲罐中;
[0076]
步骤d:将步骤c中剩余混悬液继续研磨6次,得小颗粒混悬液,转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得。
[0077]
实施例5
[0078]
1)处方
[0079][0080]
2)制备工艺
[0081]
步骤a:称取处方量的泊洛沙姆188、羟丙基纤维素、蔗糖、磷酸氢二钾、磷酸二氢钾溶解于900ml注射用水中,使用0.1mol/l氢氧化钠或盐酸水溶液调节ph值至7.0,将该水溶液无菌过滤;
[0082]
步骤b:将处方量的帕莫酸托特罗定无菌地加入上述水溶液中,在密封容器中,高剪切8000rpm条件下分散20min,加剩余部分注射用水补全至处方总量,制成粗混悬液;
[0083]
步骤c:研磨步骤b制备的粗混悬液,使用含有研磨珠直径为0.5mm的研磨机进行密闭无菌通道式研磨2次,设置研磨转速10m/s,搅拌均匀状态下,收集所得混悬液总重的70%的混悬液,即为大颗粒混悬液,将其置于密闭缓冲罐中;
[0084]
步骤d:将步骤c中剩余混悬液继续研磨2次,得小颗粒混悬液,转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得。
[0085]
实施例6
[0086]
1)处方
[0087][0088]
2)制备工艺
[0089]
步骤a:称取处方量的十二烷基硫酸钠、羟丙甲基纤维素、葡糖糖溶解于800ml注射用水中,使用0.1mol/l氢氧化钠或盐酸水溶液调节ph值至7.0,将该水溶液无菌过滤;
[0090]
步骤b:将处方量的帕莫酸托特罗定无菌地加入上述水溶液中,在密封容器中,高剪切5000rpm条件下分散15min,加剩余部分注射用水补全至处方总量,制成粗混悬液;
[0091]
步骤c:研磨步骤b制备的粗混悬液,使用含有研磨珠直径为0.8mm的研磨机进行密闭无菌通道式研磨4次,设置研磨转速8m/s,搅拌均匀状态下,收集所得混悬液总重的65%的混悬液,即为大颗粒混悬液,将其置于密闭缓冲罐中;
[0092]
步骤d:将步骤c中剩余混悬液继续研磨6次,得小颗粒混悬液,转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得。
[0093]
实施例7
[0094]
1)处方
[0095][0096]
2)制备工艺
[0097]
步骤a:称取处方量的聚氧乙烯蓖麻油、焦亚硫酸钠、氯化钠、碳酸氢钠溶解于800ml注射用水中,使用0.1mol/l氢氧化钠或盐酸水溶液调节ph值至6.8,将该水溶液无菌过滤;
[0098]
步骤b:将处方量的帕莫酸托特罗定无菌地加入上述水溶液中,在密封容器中,高剪切3000rpm条件下分散5min,加剩余部分注射用水补全至处方总量,制成粗混悬液;
[0099]
步骤c:研磨步骤b制备的粗混悬液,使用含有研磨珠直径为0.3mm的研磨机进行密闭无菌通道式研磨2次,设置研磨转速6m/s,搅拌均匀状态下,收集所得混悬液总重的50%的混悬液,即为大颗粒混悬液,将其置于密闭缓冲罐中;
[0100]
步骤d:将步骤c中剩余混悬液继续研磨4次,得小颗粒混悬液,转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得。
[0101]
实施例8
[0102]
1)处方
[0103][0104]
2)制备工艺
[0105]
步骤a:称取处方量的聚山梨酯20、聚乙二醇6000、甘露醇、磷酸氢二钠溶解于900ml注射用水中,使用0.1mol/l氢氧化钠或盐酸水溶液调节ph值至7.0,将该水溶液无菌过滤;
[0106]
步骤b:将处方量的帕莫酸托特罗定无菌地加入上述水溶液中,在密封容器中,高剪切8000rpm条件下分散10min,加剩余部分注射用水补全至处方总量,制成粗混悬液;
[0107]
步骤c:研磨步骤b制备的粗混悬液,使用含有研磨珠直径为0.5mm的研磨机进行密闭无菌通道式研磨2次,设置研磨转速8m/s,搅拌均匀状态下,收集所得混悬液总重的60%的混悬液,即为大颗粒混悬液,将其置于密闭缓冲罐中;
[0108]
步骤d:将步骤c中剩余混悬液继续研磨5次,得小颗粒混悬液,转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得。
[0109]
实施例9
[0110]
1)处方
[0111][0112]
2)制备工艺
[0113]
步骤a:称取处方量的聚山梨酯80、聚乙二醇4000、氯化钠、磷酸二氢钠溶解于800ml注射用水中,使用0.1mol/l氢氧化钠或盐酸水溶液调节ph值至6.8,将该水溶液无菌过滤;
[0114]
步骤b:将处方量的帕莫酸托特罗定无菌地加入上述水溶液中,在密封容器中,高剪切3000rpm条件下分散5min,加剩余部分注射用水补全至处方总量,制成粗混悬液;
[0115]
步骤c:研磨步骤b制备的粗混悬液,使用含有研磨珠直径为0.3mm的研磨机进行密闭无菌通道式研磨2次,设置研磨转速6m/s,搅拌均匀状态下,收集所得混悬液总重的40%的混悬液,即为大颗粒混悬液,将其置于密闭缓冲罐中;
[0116]
步骤d:将步骤c中剩余混悬液继续研磨4次,得小颗粒混悬液,转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得。
[0117]
实施例10
[0118]
1)处方
[0119][0120]
2)制备工艺
[0121]
步骤a:称取处方量的聚山梨酯20、羧甲基纤维素钠、聚乙烯吡咯烷酮、氯化钠、磷酸氢二钠溶解于850ml注射用水中,使用0.1mol/l氢氧化钠或盐酸水溶液调节ph值至7.4,将该水溶液无菌过滤;
[0122]
步骤b:将处方量的帕莫酸托特罗定无菌地加入上述水溶液中,在密封容器中,高剪切10000rpm条件下分散20min,加剩余部分注射用水补全至处方总量,制成粗混悬液;
[0123]
步骤c:研磨步骤b制备的粗混悬液,使用含有研磨珠直径为0.8mm的研磨机进行密闭无菌通道式研磨5次,设置研磨转速10m/s,搅拌均匀状态下,收集所得混悬液总重的75%的混悬液,即为大颗粒混悬液,将其置于密闭缓冲罐中;
[0124]
步骤d:将步骤c中剩余混悬液继续研磨7次,得小颗粒混悬液,转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得。
[0125]
对比实施例1
[0126]
将2.38g酒石酸托特罗定溶于250ml水中,2.16g帕莫酸二钠溶于200ml水中,两者充分混合,室温下搅拌3h后过滤。滤饼用冷水洗涤3次,60℃减压干燥,得到3.52g左右的淡黄色固体粉末,得到托特罗定与帕莫酸摩尔比为1.5:1的托特罗定帕莫酸盐,收率为80.28%,纯度82.08%。
[0127]
精密称取托特罗定帕莫酸盐(托特罗定与帕莫酸的摩尔比为1.5:1)1.25g,聚丙交酯-乙交酯(plga)1.25g(la:ga=50:50)加入2ml二氯甲烷,涡旋超声使其溶解完全,作为油相;配制0.5%聚乙烯醇(pva)17-88水溶液作为水相,0~10℃冷藏备用,油相水相体积比例控制在1:50~100;采用乳化-溶剂挥发法制备微球,将油相加入到水相中,高速剪切1min;将剪切好的微球在室温下固化,低速磁力搅拌4h,减压促进有机溶剂挥发,离心、滤网筛分收集微球,用水洗涤微球,于冷冻干燥机中真空干燥即得。
[0128]
对比实施例2
[0129]
使用对比实施例1所得托特罗定帕莫酸盐(托特罗定与帕莫酸的摩尔比为1.5:1)为活性成分制备帕莫酸托特罗定注射用混悬液制剂:
[0130]
1)处方
[0131][0132]
2)制备工艺
[0133]
步骤a:称取处方量的聚山梨酯80、聚乙二醇4000、氯化钠、磷酸二氢钠溶解于800ml注射用水中,使用0.1mol/l氢氧化钠或盐酸水溶液调节ph值至6.8,将该水溶液无菌过滤;
[0134]
步骤b:将处方量的帕莫酸托特罗定(托特罗定与帕莫酸的摩尔比为1.5:1)无菌地加入上述水溶液中,在密封容器中,高剪切3000rpm条件下分散5min,加剩余部分注射用水补全至处方总量,制成粗混悬液;
[0135]
步骤c:研磨步骤b制备的粗混悬液,使用含有研磨珠直径为0.3mm的研磨机进行密闭无菌通道式研磨2次,设置研磨转速6m/s,搅拌均匀状态下,收集所得混悬液总重的50%的混悬液,即为大颗粒混悬液,将其置于密闭缓冲罐中;
[0136]
步骤d:将步骤c中剩余混悬液继续研磨4次,得小颗粒混悬液,转移至步骤c中的密闭缓冲罐中,搅拌、混合均匀即得。
[0137]
验证实施例
[0138]
1、粒度分布的测定
[0139]
测定方法:利用激光衍射粒度分析仪(型号:mastersizer 3000,英国马尔文仪器公司),通过湿法模块使用水作为分散介质以体积法测定,结果得到的粒径用基于中间粒径的平均粒径(d50)来表示,如表1所示。
[0140]
表1粒度分布的检测结果
[0141][0142]
2、体外加速释放度研究
[0143]
取实施例1~10中帕莫酸托特罗定注射用混悬液制剂,采用usp4法(流通池,sotax公司)开展体外释放度研究。该试验介质中添加表面活性剂,为加速体外释放度试验,目的为缩短研发时间。以含0.3%十二烷基硫酸钠的ph7.4磷酸缓冲液为介质,闭环模式,水浴温度为37
±
0.5℃,流速6ml/min,样品池直径22.6mm,于5、10、20、30、60、120、180、240、360和480min取样,用0.45μm滤膜过滤,取续滤液采用hplc法以甲醇-0.02mol/l甲酸铵溶液(用甲
酸调ph至3.0)(60:40)为流动相,检测波长为283nm,流速为1ml/min,柱温37℃的方法,按外标法计算释放度含量。
[0144]
表2累积释放度的检测结果
[0145][0146][0147]
3、体内药动学研究
[0148]
取实施例3和对比实施例1~2所得制剂进行sd大鼠体内的药动学研究。将18只雌性sd大鼠平均分为3组,即a、b和c组(n=6)。a组肌肉注射实施例3中帕莫酸托特罗定混悬液,b组肌肉注射对比实施例1中所得托特罗定缓释微球制剂,c组肌肉注射对比实施例2中帕莫酸托特罗定混悬液。实验前后及整个实验过程,照常给大鼠供应食物和水。每只大鼠给药剂量为50mg/kg,通过大鼠后肢外侧肌肉注射给药,分别于给药后0d、1d、3d、5d、7d、14d、21d和28d从大鼠眼眶后静脉丛取0.5ml血液装于肝素化的2mlep管中,以6000rpm离心10min,取上层血浆至另一干净ep管中,于-80℃冰箱冻存备用。而后制备血浆样品,并进行检测,按照标曲计算各个血浆样品的浓度。实施例3和对比实施例1~2的体内药动学曲线如附图2、表3所示。
[0149]
表3 a、b、c组药动学参数结果(n=6)
[0150]
药动学参数a组b组c组t
1/2
(h)336
±
72610
±
132480
±
108t
max
(h)120
±
24420
±
120336
±
86c
max
(ng/ml)5.636
±
0.9634.568
±
0.8515.261
±
0.819auc
0-336
(ng/ml*h)1012
±
98709
±
661395
±
128auc
0-∞
(ng/ml*h)1563
±
1051496
±
1011601
±
139
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1