负载相变材料微粒的纤维创面修复支架及其制备方法和应用
1.本发明属于生物材料领域,具体涉及负载相变材料微粒的纤维创面修复支架材料及其制备方法和应用。
背景技术:
2.由于机械损伤和烧伤或糖尿病和恶性肿瘤等引起的全层皮肤创伤发病率日益增高,皮肤创面的修复已成为创伤修复领域研究的重大医学问题。临床治疗的“金标准”是进行自体皮肤移植;然而,皮肤供体部位的缺乏、继发性损伤和感染风险等限制了其应用。因此,亟待开发人造创面修复支架材料,以解决自体移植物的不足等问题。
3.目前临床上可用的支架材料主要起到隔离或抗菌作用,但其生物活性低且鲜有活性因子的负载,导致创面愈合速度较慢。开发能够模拟细胞外基质组成与结构并提供修复阶段所需微环境的支架材料并明确其作用机制,对于人工干预创面修复至关重要。
4.近年来,针对多功能生物活性的创面修复支架材料的开发,研究人员进行了大量的创新性研究,其中较为理想的策略之一是:构筑具有特定拓扑结构的多功能生物活性支架,结合光、电或超声等治疗手段,从支架材料中时空可控释放所需的药物或生长因子;在防止伤口感染的同时,招募内源修复细胞或免疫细胞,促进血管化生成,调控细胞微环境以介导细胞迁移与增殖,加速组织重建;支架材料可被降解并被新生组织取代,或在愈合后从皮肤表面无痛分离。
5.目前的以静电纺丝为基础构筑的支架材料研究主要集中于将抗菌药物、生长因子等以共混或者后处理的形式与静电纺丝纳米纤维膜,得到的支架大多只是一个简单的复合支架,无法调整生物活性因子和抗菌药物等功能性物质定时按需释放。目前研究的重点越来越偏向于“时空可控效应”(hu w,et al.,high flexible and broad antibacterial nanodressing induces complete skin repair with angiogenic and follicle regeneration[j],advanced healthcare materials,2020:e2000035;jiang y,et al.,a mussel-inspired extracellular matrix-mimicking composite scaffold for diabetic wound healing[j],acs applied bio materials,2020,3(7):4052-4061;chen q,et al.,electrospun chitosan/pva/bioglass nanofibrous membrane with spatially designed structure for accelerating chronic wound healing[j],materials science&engineering c-materials for biological applications,2019,105:110083),即渴望在一定的时间内通过调控外界环境改变材料内部的相应情况,从而使所需的营养物质可控释放,这也是研究的难点之一。
技术实现要素:
[0006]
鉴于以上研究背景及进展,本发明提供了一种负载相变材料微粒的纤维创面修复支架,通过调控纺丝纤维拓扑结构及梯度结构,同时结合光热疗法,实现抗菌物质的前期释放、生长因子的时空可控释放等功能,可解决目前研究中存在的难点,从而高效地结合各项
促修复的诱导信号,调控介导皮肤创面愈合过程中修复细胞向伤口处的迁移与增殖,有效地加快创面修复并提高愈合效果,为皮肤创面修复材料的设计提供一种新途径新方法,为利用光热疗法加速皮肤创面愈合提供新的思路,为进一步发展可临床转化使用的创面修复材料奠定基础。
[0007]
本发明的目的之一在于提供一种负载相变材料微粒的纤维创面修复支架,包括内层结构、中间层和外层结构,所述内层结构为包含有抗菌药物的聚合物纤维层,内层结构的表面上沉积有生物活性物质;所述中间层为相变材料微粒负载层,所述相变材料微粒为核壳结构,其壳层为相变材料,核层为生长因子;所述外层结构为包含有抗菌药物的聚合物纤维层。
[0008]
具体地,所述的抗菌药物选自青霉素类、头孢霉素类、四环素类、氯霉素类、大环内酯类、林可霉素、氟喹诺酮类、硝基咪唑类、多肽类抗菌药中的至少一种;
[0009]
所述聚合物纤维层中的聚合物选自脂肪族聚酯或者脂肪族聚酯与天然高分子材料的共混物;所述的脂肪族聚酯选自可降解脂肪族聚酯,优选选自聚乳酸、聚己内酯、聚乳酸-羟基乙酸共聚物、聚乳酸-羟基乙酸-己内酯共聚物中的至少一种;所述的天然高分子材料选自胶原、明胶、壳聚糖、淀粉、纤维素、弹性蛋白中的至少一种;以脂肪族聚酯为100重量份来计,天然高分子材料的用量为0~100重量份,优选为5~100重量份;
[0010]
所述的生物活性物质模拟细胞外基质的组成,优选选自蛋白质类,更优选选自胶原、层粘连蛋白、纤连蛋白、胶原蛋白中的至少一种;
[0011]
所述的相变材料选自碳原子数为10~40的脂肪烃或脂肪酸中的至少一种,优选选自石蜡、正十六烷、正十八烷、二十烷、二十六烷、三十五烷、十四烷酸、十二烷酸、十八烷酸、十五烷酸、二十烷酸中的至少一种;
[0012]
所述的生长因子有促修复作用,优选选自血管内皮生长因子、血小板衍生生长因子、表皮细胞生长因子、成纤维细胞生长因子、肝细胞生长因子中的至少一种;
[0013]
所述生物活性物质粒子在内层结构表面上的沉积密度从四周向中心呈梯度分布,优选四周沉积浓度小于中心沉积浓度;生物活性物质离子的梯度分布,可以更好的引导细胞迁移及分化,将适当的细胞聚集到损伤部位以加速愈合,从而更有效的促进组织修复。
[0014]
所述内层结构和/或外层结构为均相结构的含抗菌药物的聚合物纤维,或者为核壳结构的含抗菌药物的聚合物纤维,当内层结构和/或外层结构为核壳结构的含抗菌药物的聚合物纤维时,其核层和壳层均为含有抗菌药物的聚合物,且核层材料中的抗菌药物和聚合物中的至少一种不同于壳层材料中的抗菌药物和聚合物;
[0015]
所述的内层结构的聚合物纤维层为放射状取向的纤维层或者单轴取向的纤维层。
[0016]
本发明的目的之二在于提供一种上述纤维创面修复支架的制备方法,包括将包含有抗菌药物的聚合物溶液静电纺丝形成内层结构,将相变材料和生长因子通过同轴静电喷雾在内层结构之上形成相变材料微粒负载层,再将含有抗菌药物的聚合物溶液静电纺丝在负载层之上形成外层结构,之后在内层结构表面上静电沉积生物活性物质粒子,即得所述负载相变材料微粒的纤维创面修复支架。优选地,所述的制备方法具体包括以下步骤:
[0017]
步骤(1)、将抗菌药物溶液a、抗菌药物溶液b分别和聚合物溶液c混合,得到溶液d和溶液e;
[0018]
步骤(2)、将步骤(1)得到的溶液d,进行静电纺丝后,得到包含有抗菌药物的聚合
物纤维层的内层结构;
[0019]
步骤(3)、将相变材料溶液f和生长因子溶液g,采用同轴静电喷雾到步骤(2)得到的内层结构上,得到相变材料微粒负载层;
[0020]
步骤(4)、将步骤(1)得到的溶液e静电纺丝沉积到步骤(3)得到的相变材料微粒负载层上,得到多层次纤维支架材料;
[0021]
步骤(5)、将生物活性物质溶液h静电喷雾到步骤(4)得到的多层次纤维支架材料的内层结构上,即得到所述的负载相变材料微粒的纤维创面修复支架。
[0022]
上述制备方法中,所述步骤(1)中:
[0023]
所述的抗菌药物溶液a、抗菌药物溶液b中的溶剂独立地选自水、乙醇、丙酮、甲苯、六氟异丙醇、三氟乙醇、三氯甲烷、甲醇、二氯甲烷、n,n
’‑
二甲基甲酰胺中的至少一种;
[0024]
所述的抗菌药物溶液a和抗菌药物溶液b中的抗菌药物相同或不同,独立地选自青霉素类、头孢霉素类、四环素类、氯霉素类、大环内酯类、林可霉素、氟喹诺酮类、硝基咪唑类、多肽类抗菌药中的至少一种;
[0025]
所述的抗菌药物溶液a和抗菌药物溶液b均为抗菌药物的饱和溶液;
[0026]
所述聚合物溶液c中的溶剂选自六氟异丙醇、三氟乙醇、三氯甲烷、甲醇、二氯甲烷、n,n
’‑
二甲基甲酰胺中的至少一种;
[0027]
所述聚合物溶液c中的聚合物选自脂肪族聚酯或者脂肪族聚酯与天然高分子材料的共混物,其中,以脂肪族聚酯为100重量份来计,天然高分子材料的用量为0~100重量份,优选为5~100重量份;
[0028]
所述聚合物溶液c的质量浓度为5~25%,优选为6~20%;
[0029]
所述的溶液d中,抗菌药物溶液a和聚合物溶液c的体积比为1:2~1:9,优选为1:4~1:9;
[0030]
所述的溶液e中,抗菌药物溶液b和聚合物溶液c的体积比为1:2~1:9,优选为1:4~1:9。
[0031]
上述制备方法中,所述步骤(3)中:
[0032]
所述的相变材料溶液e的溶剂选自醇类溶剂,优选选自乙醇、甲醇、三氟乙醇、六氟异丙醇中的至少一种;
[0033]
所述的相变材料选自碳原子数为10~40的脂肪烃或脂肪酸中的至少一种,优选选自石蜡、正十六烷、正十八烷、二十烷、二十六烷、三十五烷、十四烷酸、十二烷酸、十八烷酸、十五烷酸、二十烷酸中的至少一种;
[0034]
所述的相变材料溶液f的浓度为1~50%,优选为5~30%;
[0035]
所述的生长因子溶液g的溶剂选自乙醇、聚乙烯醇、聚丙烯酰胺、聚丙烯酸中的至少一种;
[0036]
所述的生长因子选自血管内皮生长因子、血小板衍生生长因子、表皮生长因子、成纤维细胞生长因子、肝细胞生长因子中的至少一种;
[0037]
所述的生长因子溶液g的浓度为0.1μg/ml~5mg/ml,优选为1μg/ml~1mg/ml。
[0038]
上述制备方法中,所述步骤(5)中:
[0039]
所述的生物活性物质溶液h中的溶剂选自盐酸、醋酸、乙酸乙酯、丙三醇、三氟乙醇、六氟异丙醇中的至少一种;
[0040]
所述的生物活性物质选自蛋白质类,优选选自胶原、层粘连蛋白、纤连蛋白、胶原蛋白中的至少一种;
[0041]
所述生物活性物质溶液的浓度为1~50mg/ml,优选为10~30mg/ml。
[0042]
上述制备方法中:
[0043]
所述步骤(2)或步骤(4)的静电纺丝沉积中,纺丝液流动速率为0.1~3ml/h,电压10~20kv,接收距离为10~20cm,纺丝10~300min;
[0044]
所述的静电纺丝的接收器为辊筒、u型凹槽中的至少一种时,得到单轴取向的载药纤维;所述的静电纺丝的接收器为中心含一金属针头的圆环时,得到放射状取向的载药纤维;
[0045]
所述步骤(3)中的同轴静电喷雾操作步骤包括:将相变材料溶液f注入壳层注射器,将生长因子溶液g注入核层注射器,步骤(2)得到的内层结构作为接收器,壳层电喷溶液流动速率为0.1~1ml/h,核层电喷溶液流动速率为0.3~3ml/h,电压10~20kv,接收距离为10~20cm,喷雾1~30min;
[0046]
所述步骤(5)中的静电喷雾采用掩模版模式进行梯度浓度的喷雾,粒子密度由外周向中心径向梯度增加的方式沉积生物活性物质粒子;电喷溶液流动速率为0.1~3ml/h,电压10~20kv,接收距离为10~20cm,喷雾10~60min;
[0047]
所述步骤(5)中静电喷雾得到的支架材料还需要脱除溶剂,可以采用常用的脱除溶剂方法脱除,也可以静置挥发,如:在通风橱中室温放置2-7天,溶剂脱出后包装消毒。
[0048]
本发明的目的之三在于提供上述负载相变材料微粒的纤维创面修复支架或者根据上述制备方法制备的负载相变微粒的纤维创面修复支架作为皮肤创面修复材料的应用。
[0049]
在构筑支架类型的选择上,由于其类细胞外基质结构的特性,静电纺丝纤维备受关注。多种材料均可通过静电纺丝技术制备形成纤维支架用于创面修复,例如天然材料如胶原、明胶、壳聚糖等及合成材料如聚己内酯、聚乳酸、聚氨酯等。单一结构的纺丝纤维支架往往无法修复全层皮肤的创伤,因此通过调控纺丝纤维的表面拓扑结构和功能性,加入促修复生长因子或药物并实现可控释放,是提高修复效果的关键及目前的研究热点。本发明通过在调控纤维拓扑结构方面,有序取向纤维可以通过表面接触诱导效应调控细胞的铺展和迁移,并且能够增强细胞浸润和对伤口渗液进行引流,纤维支架表面构筑特定的粗糙结构或图案化结构也可提高修复效果。为赋予支架材料生物活性,在静电纺丝材料中可引入抗菌药物和促修复生长因子,同时实现抗感染和促修复的效果。多种不同种类的抗菌药物或粒子加入纤维支架后,能够起到有效地抑制细菌和抗感染的作用。
[0050]
针对治疗手段上,由于近红外光特异性好、非侵入、且对正常组织的副作用小的优势,结合近红外光热疗法用于皮肤创面修复成为了近年来发展的一种有效手段。本发明通过结合热敏材料的可控释放系统与光热疗法,在光热触发后热敏材料改变构象或其他理化性质,这一特性为药物按需释放提供了可能。例如,一类相变材料在温度控制下可实现固液相转变,由于其流动性的变化,可以控制其中负载物的释放;其中脂肪酸作为一种生物相容性好、生物可降解性能良好、及价格低廉的相变材料,在药物递送领域备受关注,且创面修复后,热响应的表面可被用于实现材料与创面的分离,实现无痛揭除支架材料。因此,将光热疗法结合相变材料的触发式可控药物释放体系引入功能性纺丝纤维支架,为解决触发式地时空可控释放提供了一条途径。
[0051]
与现有技术相比,本发明具有以下有益效果:
[0052]
1.本发明提供的纤维创面修复支架中以可降解脂肪族聚酯与可降解天然高分子及相变材料为主要原料,并含有抗菌药物、活性物质粒子和生长因子,结合光热作用,有效整合拓扑结构、梯度结构、及药物和生物活性因子等多项诱导信号,其内层朝向创伤一侧为放射状取向或单轴取向纤维;
[0053]
2.本发明的支架材料中加入不同种类抗菌药物,以实现多重抗菌效果;含有沉积密度梯度增加的生物活性物质粒子,以促进细胞招募与迁移;含有促修复生长因子的相变材料微粒,以通过生长因子光热触发式可控递送调控不同细胞的行为;
[0054]
3.本发明提供的支架材料具有优异的生物相容性和降解性能,可介导细胞的迁移增殖分化及旁分泌效应,能加快创面修复速度并提高伤口愈合效果。
[0055]
本发明提出了一种操作简便的相变材料包裹生长因子的的制备方法。通过结合热敏材料的可控释放系统与光热疗法,在光热触发后热敏材料改变构象或其他理化性质,这一特性为药物按需释放提供了可能。例如,脂肪酸族作为一种生物相容性好、生物可降解性能良好、及价格低廉的相变材料,其可在温度控制下可实现固液相转变,由于其流动性的变化,可以控制其中负载物的释放,进而达到将光热疗法结合相变材料的触发式可控药物释放体系引入功能性纺丝纤维支架,为解决触发式地时空可控释放提供了一条途径。本发明制备的是一种复合支架,通过加入不同种类抗菌药物,以实现多重抗菌效果;在静电喷雾过程中可制备含有沉积密度梯度增加的生物活性物质粒子,以促进细胞招募与迁移;还含有促修复生长因子的相变材料微粒,以通过生长因子光热触发式可控递送调控不同细胞的行为,能加快创面修复速度并提高伤口愈合效果。
附图说明
[0056]
图1是实施例1~4中在该纤维创伤修复支架材料的放射状取向纤维内层负载生物活性物质粒子的示意图,本发明采用圆形光栅作为掩模版的策略,通过静电喷雾技术在放射状有序取向纤维表面沉积密度梯度的活性物质粒子,沉积密度由外周向中心逐渐增大。
[0057]
图2是实施例1制得的纤维创伤修复支架材料的内层放射状取向纤维的sem照片,由图片可以看出,支架内层的纤维呈明显的放射状取向结构。
[0058]
图3是实施例1制得的纤维创伤修复支架材料的内层放射状取向纤维表面沉积生物活性物质粒子的sem照片,纤维表面的突起为沉积的生物活性物质离子,图3a~3d依次为生物活性物质粒子从中心到四周的沉积情况。由图3a到图3d,沉积的生物活性物质粒子密度依次降低,说明生物活性物质粒子在内层结构表面上的沉积密度从四周向中心呈梯度分布。
[0059]
图4是实施例1制得的装有fitc标记的牛血清白蛋白微粒的相变微粒的sem图像。
[0060]
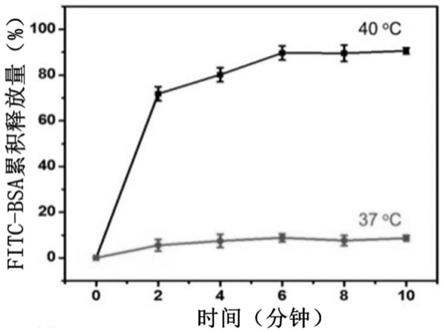
图5是实施例1制得的纤维创伤修复支架材料相变微粒,分别在37和40℃下连续红外激光照射加热后,从颗粒中累积释放的有效载荷fitc标记的牛血清白蛋白量,从图中可以看出在40℃下的释放量要远比37℃下多,并且释放量接近于100%,这说明制得的纤维创伤修复支架材料相变微粒在40℃下熔融的更好,这为之后生长因子的释放试验提供了温度条件。
[0061]
图6是l929细胞在含有不同甲硝唑浓度的pcl纳米纤维膜上通过cck-8测定在
450nm处的细胞活性,图6a是细胞在含有浓度为0%,1%,5%,10%,20%,30%,40%甲硝唑的pcl纳米纤维膜上粘附4h时的od值柱状图,图6b是细胞在含有浓度为0%,1%,5%,10%,20%,30%,40%甲硝唑的聚己内酯纳米纤维膜上粘增殖1、3、5、7天时的od值柱状图,每组柱状图从左到右依次为tcp、p0、p1、p5、p10、p20、p30、p40。
[0062]
图7-1是通过alexa fluor 555鬼笔环肽(左侧)对肌动蛋白的细胞骨架进行染色,和dapi(右侧)对细胞核进行染色,显示nih3t3细胞在取向纤维、胶原蛋白粒子均匀分布的取向纤维、胶原蛋白粒子梯度密度沉积的取向纤维三种不同纤维支架上的迁移效果的荧光显微照片。
[0063]
图7-2是nih3t3细胞在取向纤维、胶原蛋白粒子均匀分布的取向纤维、胶原蛋白粒子梯度密度沉积的取向纤维三种不同纤维支架上的迁移情况。由图a纤维上没有被细胞覆盖的空白处余留百分比可以看出,胶原蛋白粒子有助于细胞的迁移,并且当胶原蛋白成梯度分布时,更有助于细胞的迁移。由图b中nih3t3细胞在三种不同纤维支架上的迁移距离可以看出,胶原蛋白粒子有助于细胞的迁移,并且当胶原蛋白成梯度分布时,更有助于细胞的迁移。
具体实施方式
[0064]
下面结合具体实施例对本发明进行具体的描述,有必要在此指出的是以下实施例只用于对本发明的进一步说明,不能理解为对本发明保护范围的限制,本领域技术人员根据本发明内容对本发明做出的一些非本质的改进和调整仍属本发明的保护范围。
[0065]
实施例中所采用的测试仪器及测试条件如下:
[0066]
静电纺丝设备:型号:teadfs-103,北京新锐百纳科技有限公司;
[0067]
静电喷雾设备:型号:nano 01型,日本mecc株式会社。
[0068]
实施例中所采用的原料及来源如下:
[0069]
实施例中所用可降解脂肪族聚酯与天然高分子材料原料均采购于sigma试剂公司,有机溶剂均采购于aladdin公司,生长因子及染色试剂均购于thermo fisher scientific公司。
[0070]
l929细胞:小鼠成纤维细胞,积水潭医院;
[0071]
nih3t3细胞:小鼠成纤维细胞,积水潭医院。
[0072]
实施例1
[0073]
配制溶液:
[0074]
取甲硝唑加入到n,n-二甲基甲酰胺中,充分搅拌超声使其溶解以得到其饱和溶液a;
[0075]
取醋酸洗必泰加入到三氟乙醇中,充分搅拌超声使其溶解以得到其饱和溶液b;
[0076]
取聚己内酯溶于二氯甲烷中,室温磁力搅拌12h,得到质量浓度为6%的溶液c1;
[0077]
取聚乳酸溶于三氟乙醇中,室温磁力搅拌12h,得到质量浓度为6%的溶液c2;
[0078]
将十二烷酸和十八烷酸以质量比8:2溶解于体积比为2:8的乙醇和二氯甲烷的混合液中,超声10分钟,得到质量浓度为20%的溶液f;
[0079]
取重组人血小板衍生生长因子-bb加入到无菌水中,充分搅拌溶解得到100μg/ml的溶液g;
[0080]
将胶原蛋白和纤连蛋白以质量比1:1溶解于体积百分比浓度为50%的乙酸水溶液中,室温磁力搅拌12h后充分混合,得到18mg/ml的溶液h。
[0081]
制备纤维创面修复支架:
[0082]
步骤(1)、溶液a与溶液c1以体积比1:9混合,室温磁力搅拌12h,得到溶液d;溶液b与溶液c2以体积比1:9混合,室温磁力搅拌12h,得到溶液e;
[0083]
步骤(2)、用溶液d进行静电纺丝,用中心含一金属针头的圆环作为接收器,纺丝液流动速率为1.2ml/h,电压15kv,接收距离为15cm,纺丝300min,得到放射状取向的载药纤维内层;
[0084]
步骤(3)、更换纺丝液为溶液f和溶液g,更换单轴纺丝针头为同轴针头,溶液f注入壳层注射器,溶液g注入核层注射器;步骤(2)中得到的放射状有序取向纤维作为接收器,进行同轴静电喷雾,壳层电喷溶液流动速率为0.5ml/h,核层电喷溶液流动速率为1.2ml/h,电压为20kv,接收距离为10cm,喷雾30min,得到相变微粒负载的纤维膜;
[0085]
步骤(4)、更换纺丝液为溶液e,更换同轴针头为单轴纺丝针头,在步骤(3)中得到的相变微粒负载的纤维上进行静电纺丝沉积,纺丝液流动速率为1.2ml/h,电压15kv,接收距离为15cm,纺丝300min,得到多层次纤维支架材料;
[0086]
步骤(5)、更换电喷溶液为溶液h,在步骤(4)中得到的多层次纤维支架材料的内层放射状取向的载药纤维上进行静电喷雾,采用掩模版策略,沉积由外周向中心粒子密度径向梯度增加的生物活性物质粒子,电喷溶液流动速率为1.2ml/h,电压为20kv,接收距离为10cm,喷雾60min,得到内层含梯度粒子的多层次纤维支架材料;静电纺丝结束后,将纺丝膜在通风橱中室温放置3天,使残余溶剂充分挥发,即得负载相变材料微粒的纤维创面修复支架。
[0087]
实施例2
[0088]
配制溶液:
[0089]
取甲硝唑加入到三氟乙醇中,充分搅拌超声使其溶解以得到其饱和溶液a;
[0090]
取盐酸四环素加入到六氟异丙醇中,充分搅拌超声使其溶解以得到其饱和溶液b;
[0091]
取聚己内酯颗粒和明胶粉末质量比为60:40,分别溶于三氟乙醇中,室温磁力搅拌12h,得到均一的聚己内酯溶液和明胶溶液,将两溶液混合后揽拌6h后得到质量浓度为6%的溶液c1;
[0092]
取聚己内酯溶于三氟乙醇中,室温磁力搅拌12h,得到质量浓度为6%的溶液c2;
[0093]
将十二烷酸和十八烷酸以质量比8:2溶解于体积比为8:2的乙醇和二氯甲烷的混合液中,超声10分钟,得到质量浓度为20%的溶液f;
[0094]
取质量比1:1的血管内皮生长因子和表皮细胞生长因子混合加入到无菌水中,充分搅拌溶解得到生长因子浓度为200μg/ml的溶液g;
[0095]
取胶原蛋白溶解于六氟异丙醇中,室温磁力搅拌12h后充分混合,得到20mg/ml的溶液h。
[0096]
制备纤维创面修复支架:
[0097]
步骤(1)、溶液a与溶液c1以体积比2:8混合,室温磁力搅拌12h,得到溶液d;溶液b与溶液c2以体积比2:8混合,室温磁力搅拌12h,得到溶液e;
[0098]
步骤(2)、用溶液d进行静电纺丝,用中心含一金属针头的圆环作为接收器,纺丝液
流动速率为1.2ml/h,电压15kv,接收距离为15cm,纺丝300min,得到放射状取向的载药纤维内层;
[0099]
步骤(3)、更换纺丝液为溶液f和溶液g,更换单轴纺丝针头为同轴针头,溶液f注入壳层注射器,溶液g注入核层注射器;步骤(2)中得到的放射状有序取向纤维作为接收器,进行同轴静电喷雾,壳层电喷溶液流动速率为0.5ml/h,核层电喷溶液流动速率为1.2ml/h,电压15kv,接收距离为15cm,喷雾30min,得到相变微粒负载的纤维膜;
[0100]
步骤(4)、更换纺丝液为溶液e,更换同轴针头为单轴纺丝针头,在步骤(3)中得到的相变微粒负载的纤维上进行静电纺丝沉积,纺丝液流动速率为1.2ml/h,电压15kv,接收距离为15cm,纺丝300min,得到多层次纤维支架材料;
[0101]
步骤(5)、更换电喷溶液为溶液h,在步骤(4)中得到的多层次纤维支架材料的内层放射状取向的载药纤维上进行静电喷雾,采用掩模版策略,沉积由外周向中心粒子密度径向梯度增加的生物活性物质粒子,电喷溶液流动速率为1.2ml/h,电压为20kv,接收距离为10cm,喷雾60min,得到内层含梯度粒子的多层次纤维支架材料;静电纺丝结束后,将纺丝膜在通风橱中室温放置3天,使残余溶剂充分挥发,即得负载相变材料微粒的纤维创面修复支架。
[0102]
实施例3
[0103]
配制溶液:
[0104]
取甲硝唑加入到n,n-二甲基甲酰胺中,充分搅拌超声使其溶解以得到其饱和溶液a;
[0105]
取醋酸洗必泰加入到三氟乙醇中,充分搅拌超声使其溶解以得到其饱和溶液b;
[0106]
取聚己内酯溶于二氯甲烷中,室温磁力搅拌12h,得到质量浓度为6%的溶液c1;
[0107]
取聚乳酸溶于三氟乙醇中,室温磁力搅拌12h,得到质量浓度为6%的溶液c2;
[0108]
将十二烷酸和十八烷酸以质量比8:2溶解于体积比为2:8乙醇和二氯甲烷的混合液中,超声10分钟,得到质量浓度为20%的溶液f;
[0109]
取重组人血小板衍生生长因子bb加入到无菌水中,充分搅拌溶解得到150μg/ml溶液g;
[0110]
将胶原蛋白和纤连蛋白以质量比6:4溶解于体积百分比浓度为50%的乙酸水溶液中,室温磁力搅拌12h后充分混合,得到30mg/ml的溶液h。
[0111]
制备纤维创面修复支架:
[0112]
步骤(1)、溶液a与溶液c1以体积比1:9混合,室温磁力搅拌12h,得到溶液d;溶液b与溶液c2以体积比1:9混合,室温磁力搅拌12h,得到溶液e;
[0113]
步骤(2)、用溶液d进行静电纺丝,用高速转动的辊筒作为接收器,纺丝液流动速率为1.2ml/h,电压15kv,接收距离为15cm,纺丝300min,得到单轴取向的载药纤维内层;
[0114]
步骤(3)、更换纺丝液为溶液f和溶液g,更换单轴纺丝针头为同轴针头,溶液f注入壳层注射器,溶液g注入核层注射器;步骤(2)中得到的单轴取向纤维作为接收器,进行同轴静电喷雾,壳层电喷溶液流动速率为0.5ml/h,核层电喷溶液流动速率为1.2ml/h,电压15kv,接收距离为15cm,喷雾30min,得到相变微粒负载的纤维膜;
[0115]
步骤(4)、更换纺丝液为溶液e,更换同轴针头为单轴纺丝针头,在步骤(3)中得到的相变微粒负载的纤维上进行静电纺丝沉积,纺丝液流动速率为1.2ml/h,电压15kv,接收
距离为15cm,纺丝300min,得到多层次纤维支架材料;
[0116]
步骤(5)、更换电喷溶液为溶液h,在步骤(4)中得到的多层次纤维支架材料的内层放射状取向的载药纤维上进行静电喷雾,采用掩模版策略,沉积由两侧向中间粒子密度梯度增加的生物活性物质粒子,电喷溶液流动速率为1.2ml/h,电压为20kv,接收距离为10cm,喷雾60min,得到内层含梯度粒子的多层次纤维支架材料;静电纺丝结束后,将纺丝膜在通风橱中室温放置3天,使残余溶剂充分挥发,即得负载相变材料微粒的纤维创面修复支架。
[0117]
实施例4
[0118]
配制溶液:
[0119]
取甲硝唑加入到三氟乙醇中,充分搅拌超声使其溶解以得到其饱和溶液a;
[0120]
取醋酸洗必泰加入到三氟乙醇中,充分搅拌超声使其溶解以得到其饱和溶液b;
[0121]
取聚己内醋颗粒和明胶粉末质量比为60:40,分别溶于三氟乙醇中,室温磁力搅拌12h,得到均一的聚己内醋溶液和明胶溶液,将两溶液混合后揽拌6h后得到均匀的浓度为6%的溶液c1;
[0122]
取聚己内酯溶于三氟乙醇中,室温磁力搅拌12h,得到质量浓度为6%的溶液c2;
[0123]
将十二烷酸和十八烷酸以质量比8:2溶解于体积比为2:8的乙醇和二氯甲烷的混合液中,超声10分钟,得到质量浓度为20%的溶液f;
[0124]
将血管内皮生长因子和表皮细胞生长因子以质量比6:4混合加入到无菌水中,充分搅拌溶解得到浓度为250μg/ml的溶液g;
[0125]
取胶原蛋白溶解于六氟异丙醇中,室温磁力搅拌12h后充分混合,得到10mg/ml溶液h。
[0126]
制备纤维创面修复支架:
[0127]
步骤(1)、溶液a与溶液c以体积比2:8混合,室温磁力搅拌12h,得到溶液d;溶液b与溶液d以体积比2:8混合,室温磁力搅拌12h,得到溶液e;
[0128]
步骤(2)、用溶液d进行静电纺丝,用u型槽作为接收器,纺丝液流动速率为1.2ml/h,电压15kv,接收距离为15cm,纺丝300min,得到单轴取向的载药纤维内层;
[0129]
步骤(3)、更换纺丝液为溶液f和溶液g,更换单轴纺丝针头为同轴针头,溶液f注入壳层注射器,溶液g注入核层注射器;步骤(2)中得到的单轴取向纤维作为接收器,进行同轴静电喷雾,壳层电喷溶液流动速率为0.5ml/h,核层电喷溶液流动速率为1.2ml/h,电压15kv,接收距离为15cm,喷雾30min,得到相变微粒负载的纤维膜;
[0130]
步骤(4)、更换纺丝液为溶液e,更换同轴针头为单轴纺丝针头,在步骤(3)中得到的相变微粒负载的纤维上进行静电纺丝沉积,纺丝液流动速率为1.2ml/h,电压15kv,接收距离为15cm,纺丝300min,得到多层次纤维支架材料;
[0131]
步骤(5)、更换电喷溶液为溶液h,在步骤(4)中得到的多层次纤维支架材料的内层放射状取向的载药纤维上进行静电喷雾,采用掩模版策略,沉积由一侧单向粒子密度梯度增加的生物活性物质粒子,电喷溶液流动速率为1.2ml/h,电压为20kv,接收距离为10cm,喷雾60min,得到内层含梯度粒子的多层次纤维支架材料;静电纺丝结束后,将纺丝膜在通风橱中室温放置3天,使残余溶剂充分挥发,即得负载相变材料微粒的纤维创面修复支架。
[0132]
实施例5实施例1制得的纤维创面修复支架材料测试
[0133]
近红外激光照射纤维创伤修复支架材料
[0134]
近红外激光照射支架,测定支架中活性物质的释放情况。
[0135]
将制得的纤维创伤修复支架材料分别放置于六孔板中,在该孔中加入2ml的pbs缓冲液,利用近红外相机分别在37℃和40℃下连续红外激光照射加热制得的纤维创伤修复支架材料,每次照射时在温度升至相应温度后,持续照射2分钟,然后关闭激光使支架冷却至室温后再次进行照射,循环五次以保证释放完全,每次照射结束后,收集浸泡支架的pbs缓冲液并保存于-20℃冰箱中,在孔板中加入新鲜的pbs缓冲液后,进行下一次近红外光照,每组实验保证有3个平行样。用试剂盒计算从颗粒中累积释放的有效载荷fitc标记的牛血清白蛋白量。从图5中可以看出在40℃下的释放量要远比37℃下多,并且释放量接近于100%,这说明制得的纤维创伤修复支架材料相变微粒在40℃下熔融的更好,这为之后生长因子的释放试验提供了温度条件。
[0136]
细胞增殖测试
[0137]
cck-8法进行细胞增殖测试,验证细胞在材料上的增殖活性。
[0138]
将经过消毒灭菌等处理的材料剪裁成直径为1.5cm的材料铺于24孔板底部,使用经过高压灭菌、紫外消毒的直径为1.5cm的圆环固定材料使其以内层朝上嵌于底部,在孔板中加入pbs缓冲液浸泡20分钟,使用摇床震荡,洗去材料表面残留物,震荡结束后倒掉pbs,再加入新鲜的pbs缓冲液反复冲洗两次,改用l929细胞培养液冲洗一次备用。取生长至铺满培养瓶底部的l929进行种板。按照上述的传代步骤进行至细胞离心后,用10ml的细胞培养液吹打离心后的细胞后,以100μl/well将细胞悬液转移至孔板中,种于材料表面,然后每个孔补加900μl的细胞培养液,将种板后的24孔板放入细胞培养箱中。种板后的第一天记为0d,从0d开始计时,在支架的细胞增殖实验中,在1d、3d、5d、7d需要对含有浓度为0%、1%、5%、10%、20%、30%、40%甲硝唑的聚己内酯纳米纤维膜上面增殖的细胞进行od值测试。所有材料在1d、3d、5d、7d时,对不参与测试的孔进行换液,每孔吸除原有培养液后补加1ml细胞培养液;对参与测试的孔进行cck-8测试,每孔吸除原有培养液后,配制由细胞培养液和其体积10%的cck-8试剂混合得到的cck-8溶液,以500μl/well加入其中。将孔板放入细胞培养箱中4小时后测试其在450nm波长下的吸光度(od)值。od值反应细胞增殖情况,与细胞数量成正比。图6a中od值在0.4-1之间,说明细胞保持良好的存活状态,b中od值随天数增加有所增长,说明细胞在材料上增殖,细胞在纤维上能够粘附生长,细胞生长状态良好,细胞形态鲜明,证明了材料的优异的生物相容性。
[0139]
染色实验
[0140]
对细胞骨架和细胞核进行荧光染色,观察支架上的细胞形貌。
[0141]
将经过消毒灭菌等后处理的直径为2.5cm的支架放入6孔板底部,在孔板中加入pbs缓冲液浸泡20分钟,使用摇床震荡,洗去材料表面残留物,震荡结束后倒掉pbs,再加入新鲜的pbs缓冲液反复冲洗两次,改用l929细胞培养液冲洗一次后,将pdms圆柱体放置于支架中心处。l929按照细胞传代步骤进行至离心后,用10ml的细胞培养液充分吹打离心后的细胞至l929在培养液中均匀分散,以500μl/well沿pdms外侧圆周种板,每孔补加1.5ml的细胞培养液,放入细胞培养箱中培育4小时后取出,除seeding zone组外,弃去pdms继续培养,按照cck-8实验中的计时和近红外光照方法进行后续操作,在7d时结束细胞迁移实验,进行细胞染色。将支架用pbs缓冲液轻轻冲洗3遍,加入3%的戊二醛溶液用来固定材料,然后用pbs缓冲液轻轻冲洗3遍;加入0.1%的triton x-100用来进行细胞膜打孔,然后用pbs缓冲
液轻轻晃动冲洗3遍;加入1%的牛血清白蛋白(bsa)封闭1小时后吸出,用pbs缓冲液轻轻晃动冲洗3遍,加入500μl的鬼笔环肽染剂(alexafluor 568phalloidin)对细胞骨架进行染色,用锡纸包裹孔板放入4℃冰箱过夜,待12小时以上吸出,用pbs缓冲液轻轻晃动冲洗3遍,加入1ml的dapi染剂(alexa fluor402 dapi)染色10分钟后吸出,加入1ml的pbs缓冲液后低温保存,通过激光扫描共聚焦显微镜观察细胞的迁移,通过image j软件测量细胞迁移的最远距离、平均距离和细胞覆盖面积并进行定量分析。图7中,中间虚线包围的面积是没有被细胞覆盖的空白处,通过对比三组的空白处的大小,发现无粒子的空白最大,胶原蛋白粒子均匀分布的次之,而胶原蛋白粒子梯度密度沉积的最小,这说明胶原蛋白粒子梯度密度沉积的更有助于细胞的迁移。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1