噻二唑并嘧啶酰胺类化合物在制备治疗PDE2障碍疾病药物中的应用
噻二唑并嘧啶酰胺类化合物在制备治疗pde2障碍疾病药物中的应用
技术领域
1.本发明涉及医药技术领域,具体涉及噻二唑并嘧啶酰胺类化合物在制备治疗pde2障碍疾病药物中的应用。
背景技术:
2.环环磷酸腺苷(camp)和环磷酸鸟苷(cgmp)是神经递质相关的重要的细胞内第二信使,广泛参与到多种生理功能的实现,例如:细胞周期调控、细胞分化、增殖、炎症过程、平滑肌收缩放松、视觉信号转导、学习记忆和代谢功能等,还涉及到类固醇合成、胰岛素分泌、糖原合成和脂肪生成等。细胞内camp和cgmp的水平由相应的环化酶和磷酸二酯酶(pdes)控制,将其浓度维持在对信号相应的最佳范围内。腺苷酸环化酶(ac)可以活化三磷酸腺苷(atp)为camp,鸟苷酸环化酶(gc)活化三磷酸鸟苷(gtp)为cgmp。pdes通过水解camp和cgmp为无活性的5
’‑
amp和5
’‑
gmp,从而降低camp和cgmp在细胞内的浓度,维持camp和cgmp在细胞内保持动态平衡,发挥正常的生理功能。
3.pdes家族在体内广泛分布,已发现的pdes家族包含11种亚型,其中pde4、pde7、pde8是camp特异性水解酶;pde5、pde6、pde9是cgmp特异性水解酶,pde1、pde2、pde3、pde10、pde11能同时水解camp和cgmp。体内高浓度的pdes将导致视觉退化、充血性心衰、忧郁、哮喘、勃起障碍和炎症等。
4.磷酸二酯酶pde2是pdes家族一员,目前只有1个亚型pde2a被确定,pde2具有同源二聚体的结构,是camp和cgmp双重水解酶。pde2主要分布于中枢神经系统中,在大脑皮质、杏仁核和海马等区域具有高表达。研究表明,pde2是治疗抑郁、记忆和认知功能障碍、神经退行性疾病及心血管疾病的潜在治疗靶点,pde2抑制剂可以抑制pde2蛋白活性,使得camp和cgmp浓度升高,进而改善轻度认知损伤及与年龄相关的记忆力障碍疾病,也能够抑制血栓形成,可以用来治疗痴呆、血液病和癌症等。目前,已知的pde2抑制剂主要包括ehna(erythro
‑9‑
(2
‑
hydroxy
‑3‑
nonyl)adeninehydrochloride)、bay60
‑
7750等,部分化合物进入了临床试验研究。因此,开发具有新颖化学结构、高活性的pde2抑制剂具有重要意义,可以为pde2相关疾病的后续药物开发提供帮助。
技术实现要素:
5.为了治疗pde2障碍疾病的技术问题,而提供噻二唑并嘧啶酰胺类化合物在制备治疗pde2障碍疾病药物中的应用。本发明噻二唑并嘧啶酰胺类结构的化合物作为pde2抑制剂能够有效抑制pde2酶活性,有望作为活性成分用于制备治疗pde2障碍疾病的药物,具有药物应用前景。
6.为了达到以上目的,本发明通过以下技术方案实现:
7.噻二唑并嘧啶酰胺类化合物在制备治疗pde2障碍疾病药物中的应用,所述噻二唑并嘧啶酰胺类化合物作为pde2活性抑制剂通过抑制pde2活性以治疗pde2障碍疾病,所述噻
二唑并嘧啶酰胺类化合物是具有如下结构的式i化合物或者其药学上可接受的盐,
[0008][0009]
进一步地,所述pde2障碍疾病为中枢神经系统障碍疾病。
[0010]
再进一步地,所述中枢神经系统障碍疾病包括精神障碍和病症,焦虑障碍,运动病症,物质相关障碍,心境障碍,神经退行性障碍;还包括注意力和/或认知缺陷症状的障碍或病症,疼痛,孤独症障碍。
[0011]
进一步地,所述药物的成分包括所述噻二唑并嘧啶酰胺类化合物或者其药学上可接受的盐,以及药学上可接受的载体。所述的载体包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等。
[0012]
进一步地,所述药物的剂型为片剂、胶囊剂、颗粒剂、丸剂中的任意一种。但不限于此,也可以是其他剂型例如注射液、口服液等。上述各种剂型的药物均可以按照药学领域的常规方法制备。不同剂型的药物均是通过抑制pde2活性来治疗pde2障碍疾病,通过注射、喷射、滴鼻、滴眼、渗透、吸收、物理或化学介导的方法导入机体如肌肉、皮内、皮下、静脉、粘膜组织,或是被其他物质混合或包裹后导入机体。
[0013]
有益技术效果:
[0014]
本发明采用计算虚拟筛选与生物活性实验测定的方法从chemdiv数据库中寻找相关潜在能够治疗pde2障碍的药物分子结构,通过对药物分子的有效性进行先期计算评估,发现式i的噻二唑并嘧啶酰胺类化合物(n
‑
(4
‑
甲氧苄基)
‑2‑
(3
‑
甲基哌啶
‑1‑
基)
‑7‑
羰基
‑
7h
‑
[1,3,4]噻二唑并[3,2
‑
a]嘧啶
‑5‑
甲酰胺)(下文中出现的该化合物以编号f149
‑
0686表示)具有潜在的pde2抑制活性;采用生物学实验方法检测并验证活性,采用camp kit和pde
‑
glo
tm phosphodiesterase assay测得其酶学水平ic
50
值分别为ic
50
值为12.44、10.64μm,具有较好的pde2酶活性抑制的效果。实验证实f149
‑
0686该化合物对pde2具有较好的抑制pde2活性的作用。虽然关于pde2抑制剂f149
‑
0686的研究还未成熟到进入临床阶段,但这些研究对于最终研制出治疗pde2障碍疾病药物至关重要,具有重要的应用前景。
附图说明
[0015]
图1为采用camp kit测得f149
‑
0686在pde2蛋白水平上的ic
50
值图。
[0016]
图2为采用pde
‑
glo
tm phosphodiesterase assay测得f149
‑
0686在pde2蛋白水平
上的ic
50
值图。
具体实施方式
[0017]
下面将结合本发明的实施例和附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。以下对至少一个示例性实施例的描述实际上仅仅是说明性的,决不作为对本发明及其应用或使用的任何限制。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0018]
除非另外具体说明,否则在这些实施例中阐述的数值不限制本发明的范围。对于相关领域普通技术人员已知的技术、方法可能不作详细讨论,但在适当情况下,所述技术、方法应当被视为说明书的一部分。在这里示出和讨论的所有示例中,任何具体值应被解释为仅仅是示例性的,而不是作为限制。因此,示例性实施例的其它示例可以具有不同的值。
[0019]
实施例1
[0020]
1.实验方法
[0021]
1.1基于受体的虚拟筛选
[0022]
采用分子模拟软件包中的蛋白准备模块protein preparation wizard对pde2的晶体结构(pdb:4c1i、4htx)进行预处理,包括修正键级,添加氢原子及部分电荷。接着采用中的配体准备模块ligprep对chemdiv化合物库(https://www.chemdiv.com/)进行化合物的预处理,包括去重、去除盐离子和无机物,在ph=7.4条件下产生化合物的可能离子化状态和互变异构体,以及产生环构象等。采用中的glide对接方法,分别选择4c1i、4htx晶体结构中配体分子ehna、bay60
‑
7550为质心的正方体区域,定义为pde2的活性位点,将2个晶体结构中的配体分子重新用ligprep软件进行预处理,接着采用glide软件的sp(standard precision)打分方法重新对接到pde2活性位点,发现glide可以较好的重现晶体结构中配体的结合构象,从而证实了glide对接方法的有效性。
[0023]
采用上述的glide sp方法将ligprep预处理后的chemdiv化合物,分别对接到4c1i、4htx晶体结构的pde2活性位点,分别保留打分靠前的2000个化合物,总共得到4000个化合物。
[0024]
采用discovery studio分子模拟软件包中的find similar molecules by fingerprints模块获得4000个化合物中编号相同的1587个化合物。
[0025]
采用中的canvas模块中reos方法对上述化合物进行成药性分析,除去可能具有毒性、反应活性或其他不理想组分的化合物,得到1443个化合物。
[0026]
为了充分考虑筛选化合物的结构多样性,采用discovery studio中的find diverse molecules模块进行基于分子指纹的聚类分析,经过人工挑选最终获得了46个化合物,委托chemdiv公司在国内代理商上海陶素公司购买了化合物实体,并且进行了pde2酶活性测定。
[0027]
1.2pde2体外酶活性初筛实验步骤
[0028]
(1)pde2蛋白的表达纯化
[0029]
pet15b
‑
pde2a(580
‑
941)野生型及截短体质粒由美国北卡大学柯衡明教授实验室赠予。经测序鉴定后,转化于大肠杆菌bl21+(codon plus)中诱导表达(用0.1mm iptg诱导后,在15℃持续培养20小时),用ni柱进行纯化,获得his标签的pde2蛋白。
[0030]
(2)pde2体外酶活性检测步骤
[0031]
①
使用pde
‑
glo
tm phosphodiesterase assay测定化合物对pde2的抑制效果:
[0032]
s1:加入4μl pde2蛋白和2μl候选化合物(每个化合物测定7个浓度,3组平行实验)孵育30分钟;
[0033]
s2:再加入4μl bio
‑
camp与上一步剩余的pde2蛋白作用1小时;
[0034]
s3:在避光环境下加入15μl donor bead和acceptor的混合液反应1小时;
[0035]
s4:用多功能酶标仪读取微孔板信号值。
[0036]
每组实验都设有阳性最大值对照与阴性最小值对照,以不加蛋白只加bio
‑
camp底物为阳性对照,此时底物最多,信号值最大,也可称为全抑制对照;加入蛋白和bio
‑
camp底物为阴性对照,蛋白全部参与水解作用,过量的底物产生信号,此时信号值最小,也可称为全水解对照。以上每个实验做3组平行实验,每个步骤需要离心(转速1000r/min,离心1分钟)。
[0037]
②
使用pde
‑
glo
tm phosphodiesterase assay测定化合物对pde2的抑制效果:
[0038]
s1:每个孔加入1μl待筛化合物(每个化合物测定7个浓度,3组平行实验),1.5μl pde2,室温孵育30分钟;
[0039]
s2:继续加入2.5μl 2μm camp,室温孵育20分钟;
[0040]
s3:每孔加入2.5μl pde
‑
glo
tm termination buffer,2.5μl pde
‑
glo
tm detection solution,室温孵育20分钟;
[0041]
s4:最后加入10μl含有底物的缓冲液,室温孵育10分钟;
[0042]
s5:用多功能酶标仪读取微孔板信号值。
[0043]
每组实验设置阴性和阳性对照,阴性对照:加入camp和无pde蛋白。没有加入pde蛋白,则camp含量最高,pka活性也最高,磷酸化底物消耗的atp最多,因此发光信号最弱,这一组读板值最小。阳性对照:加入camp和pde蛋白。pde水解大部分camp,pka的活性有所下降,磷酸化底物消耗的atp减少,剩余的atp增加,发光信号最强,这一组读板值最大。
[0044]
2.实验结果
[0045]
测定了人工挑选最终获得了46个化合物在蛋白水平上针对磷酸二酯酶pde2的活性抑制作用,其中具有式i结构的噻二唑并嘧啶酰胺类化合物(以编号f149
‑
0686表示)具有较好的pde2酶活性抑制作用,
[0046][0047]
采用camp kit测得f149
‑
0686在pde2蛋白水平上的ic
50
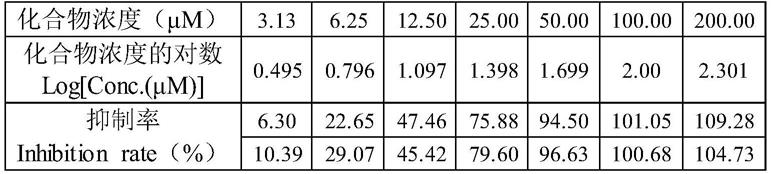
值图,如图1所示,图1中数据如表1所示。
[0048]
表1图1中数据
[0049][0050]
由图1和表1可知,经camp kit检测,当f149
‑
0686化合物终浓度为200μm时,具有较好的pde2酶体外抑制效果,达到了100%以上,经过计算f149
‑
0686化合物对pde2酶学水平的ic
50
值为12.44μm。
[0051]
采用pde
‑
glotmphosphodiesterase assay测得f149
‑
0686在pde2蛋白水平上的ic
50
值图,如图2所示,图2中数据见表2。
[0052]
表2图2中数据
[0053][0054]
由图2和表2可知,经pde
‑
glo
tm phosphodiesterase assay检测,当f149
‑
0686化合物终浓度为26.67μm时,f149
‑
0686化合物在体外蛋白酶学水平上具有较好的pde2酶体外抑制效果,达到了99.5%以上,经计算,其ic
50
值为10.64μm。
[0055]
对比例1
[0056]
类似结构的含有氮杂环的化合物(这些化合物为46个化合物中的一部分)及其pde2酶体外抑制率见表3。
[0057]
表3含有氮杂环的化合物及其pde2酶体外抑制率
[0058]
[0059][0060]
ic
50
值可以用来衡量化药物诱导细胞凋亡的能力,即诱导能力越强,该数值越低。由表3可知,虽然化合物结构上可能存在相似基团,但是通过对基团的改变,发现其对pde2酶的抑制效果具有不可预测性。
[0061]
综上,本发明f149
‑
0686化合物为有效的pde2酶活性抑制剂,在体外可有效抑制pde2酶活性。本发明f149
‑
0686化合物作为pde2活性抑制剂,具有潜在的治疗pde2障碍疾病的作用,可望作为活性成分用于制备治疗pde2障碍疾病的药物,尤其可望用于制备治疗中枢神经系统障碍疾病的药物,具有药用前景。
[0062]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1