DCLK1抑制剂和TKI在制备肺腺癌药物中的应用
dclk1抑制剂和tki在制备肺腺癌药物中的应用
技术领域
1.本发明属于生物医药领域,涉及dclk1抑制剂和tki在制备肺腺癌药物中的应用。
背景技术:
2.肺腺癌是非小细胞肺癌最主要的病理类型,且在亚裔人群中近一半患者存在egfr基因突变,目前针对这部分病人国内外指南一致推荐应用表皮生长因子受体酪氨酸激酶抑制剂(egfr-tki)作为一线治疗方案。但egfr-tki耐药后的治疗选择仍是亟待解决的临床问题。目前,对于egfr-tki耐药后临床上主要选择抗血管药物、免疫检查点抑制剂或直接应用化疗。但由于获益人群不明确,临床客观缓解率有限,最终难以达到长期有效控制肿瘤的目的。由此可见,积极探讨逆转egfr-tki耐药的方法,有助于突破肺腺癌后线治疗瓶颈,改善预后。
技术实现要素:
3.本发明的目的是提供dclk1抑制剂和tki在制备肺腺癌药物中的应用。
4.本发明提供了dclk1抑制剂和tki在制备肺腺癌药物中的应用。
5.本发明还提供了一种肺腺癌药物,其活性成分为dclk1抑制剂和tki。
6.本发明提供了dclk1抑制剂和tki在制备用于抑制肺腺癌细胞的药物中的应用。
7.本发明还提供了一种抑制肺腺癌细胞的药物,其活性成分为dclk1抑制剂和tki。
8.本发明还提供了dclk1抑制剂在制备药物中的应用;所述药物的功能为逆转tki耐药。
9.本发明还提供了一种逆转tki耐药的药物,其活性成分为dclk1抑制剂。
10.所述逆转tki耐药为逆转肺腺癌患者的tki耐药。
11.所述逆转tki耐药为逆转肺腺癌细胞的tki耐药。
12.具体的,所述dclk1抑制剂为dclk1-in-1。
13.具体的,所述tki为表皮生长因子受体酪氨酸激酶抑制剂(egfr-tki)。
14.具体的,所述tki为吉非替尼或奥西替尼。
15.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1-2:2-16。
16.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1-2:2-8。
17.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1-2:2-4。
18.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1-2:4-8。
19.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1-2:8-16。
20.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1:2-16。
21.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1:2-8。
22.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1:2-4。
23.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1:4-8。
24.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1:8-16。
25.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为2:2-16。
26.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为2:2-8。
27.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为2:2-4。
28.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为2:4-8。
29.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为2:8-16。
30.以上任一所述应用或药物中,吉非替尼和dclk1-in-1的摩尔配比可为1:2或1:4或1:8或1:16或2:2或2:4或2:8或2:16。
31.以上任一所述应用或药物中,奥西替尼和dclk1-in-1的摩尔配比可为0.15-0.2:2-8。
32.以上任一所述应用或药物中,奥西替尼和dclk1-in-1的摩尔配比可为0.15-0.2:2-4。
33.以上任一所述应用或药物中,奥西替尼和dclk1-in-1的摩尔配比可为0.15-0.2:4-8。
34.以上任一所述应用或药物中,奥西替尼和dclk1-in-1的摩尔配比可为0.15:2-8。
35.以上任一所述应用或药物中,奥西替尼和dclk1-in-1的摩尔配比可为0.15:2-4。
36.以上任一所述应用或药物中,奥西替尼和dclk1-in-1的摩尔配比可为0.15:4-8。
37.以上任一所述应用或药物中,奥西替尼和dclk1-in-1的摩尔配比可为0.2:2-8。
38.以上任一所述应用或药物中,奥西替尼和dclk1-in-1的摩尔配比可为0.2:2-4。
39.以上任一所述应用或药物中,奥西替尼和dclk1-in-1的摩尔配比可为0.2:4-8。
40.以上任一所述应用或药物中,奥西替尼和dclk1-in-1的摩尔配比可为0.15:2或0.15:4或0.15:8或0.2:2或0.2:4或0.5:8。
41.本发明的发明人发现,tki耐药肿瘤细胞中dclk1基因的表达量显著高于tki敏感肿瘤细胞。进一步,本发明的发明人发现:在tki敏感肿瘤细胞中过表达dclk1基因,显著降低细胞对tki的敏感性,抑制tki耐药肿瘤细胞中的dclk1基因表达,可使耐药肿瘤细胞重获对于tki的敏感性。进一步,本发明的发明人通过联合用药试验确认,dclk1-in-1与tki具有显著的协同作用,联合用药明显抑制耐药细胞的增殖,并显著增加耐药细胞的凋亡。本发明发现,dclk1特异性小分子抑制剂的应用有望逆转egfr-tki耐药,突破临床上肺腺癌后线治疗瓶颈。本发明具有临床转化价值,对于肺腺癌治疗具有重大意义。
附图说明
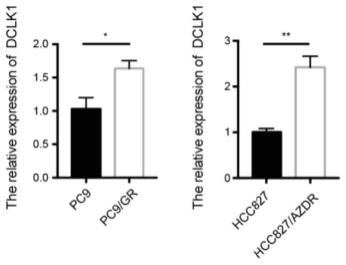
42.图1为实施例1中dclk1基因的相对表达量结果。
43.图2为实施例1中的western blot结果。
44.图3为实施例2的步骤一中qpcr检测和western blot检测的结果。
45.图4为实施例2的步骤二中qpcr检测和western blot检测的结果。
46.图5为实施例2的步骤三中cck8试验检测细胞存活率的结果(第一组试验)。
47.图6为实施例2的步骤三中cck8试验检测细胞存活率的结果(第二组试验)。
48.图7为实施例2的步骤四中平板克隆试验检测细胞存活率的结果(第一组试验)。
49.图8为实施例2的步骤四中平板克隆试验检测细胞存活率的结果(第二组试验)。
50.图9为实施例3的步骤二和步骤三中western blot检测的结果。
51.图10为实施例3的步骤四中平板克隆试验检测细胞存活率的结果。
52.图11为实施例3的步骤五中流式细胞术检测的结果(第一组试验)。
53.图12为实施例3的步骤五中流式细胞术检测的结果(第二组试验)。
54.图13为实施例3的步骤六中western blot检测的结果。
55.图14为实施例4的步骤一中细胞存活率的结果。
56.图15为实施例4的步骤二中细胞存活率的结果。
57.图16为实施例4的步骤三中平板克隆检测细胞杀伤的结果。
58.图17为实施例4的步骤四中流式细胞术检测细胞凋亡的结果
59.图18为实施例4的步骤五中western blot检测凋亡通路的激活情况的结果。
具体实施方式
60.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
61.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
62.如无特殊说明,以下实施例中的定量试验,均设置三次重复实验,结果取平均值。pc9细胞:上海富衡生物,货号fh0083。pc9/gr细胞:上海富衡生物,货号fh1002。hcc827细胞:美国atcc细胞库,货号crl-2868
tm
。hcc827/azdr细胞记载于如下文献:igfbp7 overexpression promotes acquired resistance to azd9291 in non-small cell lung cancer。pc9细胞为具有egfr19外显子突变的人肺腺癌细胞。hcc827细胞为具有egfr19外显子突变的人肺腺癌细胞。质粒pspax2(addgene公司,货号12260。质粒pmd2.g:addgene公司,货号12259。载体plvx-ires-zsgreen1:clontech公司,产品目录号:632187。lenticrisprv2质粒:addgene,货号52961。
63.ic50值,即50%的肿瘤细胞发生凋亡时,tki的药物浓度。
64.dclk1-in-1:mce公司,货号为hy-135985,cas号为2222635-15-4。
65.dclk1-in-1结构式如下:
[0066][0067]
吉非替尼(gefitinib):selleck公司,货号为s1025,cas号为184475-35-2。
[0068]
吉非替尼结构式如下:
[0069][0070]
奥西替尼(osimertinib):selleck公司,货号为s7297,cas号为1421373-65-0。
[0071]
奥西替尼结构式如下:
[0072][0073]
实施例1、不同细胞中dclk1基因的表达水平差异
[0074]
供试细胞:pc9细胞、pc9/gr细胞、hcc827细胞、hcc827/azdr细胞。
[0075]
一、ic50值检测
[0076]
将供试细胞接种于96孔板内(每孔5000个细胞),采用高糖dmem培养基培养24小时,然后吸弃上清;然后,加入含吉非替尼的高糖dmem培养基,培养24小时;然后,采用cck8试剂盒检测细胞存活率。吉非替尼在体系中的浓度分别设置为:0μm、1μm、2μm、8μm、32μm、128μm、512μm、2048μm或8192μm。供试细胞为pc9细胞或pc9/gr细胞。pc9/gr细胞对吉非替尼的ic50值为2452μm。pc9细胞对吉非替尼的ic50值为835.6μm。
[0077]
将供试细胞接种于96孔板内(每孔5000个细胞),采用rpmi-1640培养基培养24小时,然后吸弃上清;然后,加入含奥西替尼的rpmi-1640培养基,培养24小时;然后,采用cck8试剂盒检测细胞存活率。吉非替尼在体系中的浓度分别设置为:0μm、0.5μm、1μm、1.5μm、2μm、2.5μm、3μm、3.5μm、4μm或4.5μm。供试细胞为hcc827细胞或hcc827/azdr细胞。hcc827/azdr细胞对奥西替尼的ic50值为2.168μm。hcc827细胞对奥西替尼的ic50值为1.657μm。
[0078]
二、qpcr检测
[0079]
取供试细胞,提取总rna并反转录得到cdna。以cdna为模板,通过qpcr检测dclk1基因的相对表达量。内参基因为gapdh基因。
[0080]
用于检测dclk1基因的引物如下:
[0081]
f:5
’‑
ggagtggtgaaacgcctgtac-3’;r:5
’‑
ggttccattaactgagctgg-3’。
[0082]
用于检测内参基因的引物如下:
[0083]
f:5
’‑
ggagcgagatccctccaaaat-3’;r:5
’‑
ggctgttgtcatacttctcatgg-3’。
[0084]
dclk1基因的相对表达量见图1。
[0085]
三、western blot检测
[0086]
取供试细胞,提取总蛋白,通过western blot检测dclk1蛋白水平。
[0087]
western blot采用的一抗为dclk1抗体(abcam公司,货号ab31704)。
[0088]
western blot结果见图2。
[0089]
实施例1的结果表明:与tki敏感细胞相比,tki耐药细胞中的dclk1基因表达水平显著升高。
[0090]
实施例2、过表达dclk1基因显著降低肺腺癌细胞对tki的敏感性
[0091]
一、重组细胞pc9 dclk1
oe
的制备和鉴定
[0092]
1、制备pc9 dclk1
oe
[0093]
(1)将序列表的序列1所示的双链dna分子插入载体plvx-ires-zsgreen1的ecori和xbai酶切位点之间,得到重组质粒。重组质粒已进行测序验证。
[0094]
(2)借助neofect转染试剂将步骤(1)获得的重组质粒、质粒pspax2和质粒pmd2.g共同导入293t细胞,继续培养72小时。
[0095]
(3)完成步骤(2)后,3000g离心15min,收集上清液。
[0096]
(4)取步骤(3)得到的上清液,加入polybrene并使其在体系中的浓度为8ng/ml,然后感染pc9细胞,72小时后在荧光显微镜下观察感染效率,并通过流式分选zsgreen荧光蛋白阳性细胞,即为在pc9细胞中过表达dclk1基因的重组细胞,用pc9 dclk1
oe
表示。
[0097]
2、制备pc9 ctrl
[0098]
用载体plvx-ires-zsgreen1代替重组质粒,依次按照步骤1的(2)、(3)和(4)进行操作,得到转空载体的重组细胞,用pc9 ctrl表示。
[0099]
3、qpcr检测和western blot检测
[0100]
供试细胞:pc9 ctrl或pc9 dclk1
oe
。
[0101]
取供试细胞,分别进行qpcr检测和western blot检测。方法同实施例1的步骤二和步骤三。
[0102]
结果见图3。结果表明,pc9 dclk1
oe
中成功过表达dclk1基因。
[0103]
二、重组细胞hcc827 dclk1
oe
的制备和鉴定
[0104]
1、制备重组细胞hcc827 dclk1
oe
[0105]
(1)将序列表的序列1所示的双链dna分子插入载体plvx-ires-zsgreen1的ecori和xbai酶切位点之间,得到重组质粒。重组质粒已进行测序验证。
[0106]
(2)借助neofect转染试剂将步骤(1)获得的重组质粒、质粒pspax2和质粒pmd2.g共同导入293t细胞,继续培养72小时。
[0107]
(3)完成步骤(2)后,3000g离心15min,收集上清液。
[0108]
(4)取步骤(3)得到的上清液,加入polybrene并使其在体系中的浓度为8ng/ml,然后感染hcc827细胞,72小时后在荧光显微镜下观察感染效率,并通过流式分选zsgreen荧光蛋白阳性细胞,即为在hcc827细胞中过表达dclk1基因的重组细胞,用hcc827 dclk1
oe
表示。
[0109]
2、制备hcc827 ctrl
[0110]
用载体plvx-ires-zsgreen1代替重组质粒,依次按照步骤1的(2)、(3)和(4)进行操作,得到转空载体的重组细胞,用hcc827 ctrl表示。
[0111]
3、qpcr检测和western blot检测
[0112]
供试细胞:hcc827 ctrl或hcc827 dclk1
oe
。
[0113]
取供试细胞,分别进行qpcr检测和western blot检测。方法同实施例1的步骤二和步骤三。
[0114]
结果见图4。结果表明,hcc827 dclk1
oe
中成功过表达dclk1基因。
[0115]
三、cck8试验检测细胞存活率
[0116]
(一)第一组试验
[0117]
供试细胞:pc9 ctrl或pc9 dclk1
oe
。
[0118]
1、将供试细胞接种于96孔板内(5000个细胞/孔),采用dmem高糖培养基,培养24h(60%汇合度)。
[0119]
2、完成步骤1后,吸弃上清,加入含吉非替尼的dmem高糖培养基,培养24小时。吉非替尼在体系中的工作浓度分别设置为1、2、8、32、64或128μm。设置不加入吉非替尼的对照,即0浓度对照。
[0120]
3、完成步骤2后,采用cck8试剂盒(上海翊圣公司,产品目录号:40203es60)检测细胞存活率。
[0121]
结果见图5。
[0122]
(二)第二组试验
[0123]
供试细胞:hcc827 ctrl或hcc827 dclk1
oe
。
[0124]
1、将供试细胞接种于96孔板内(5000个细胞/孔),采用rpmi-1640培养基培养24h(60%汇合度)。
[0125]
2、完成步骤1后,吸弃上清,加入含奥西替尼的rpmi-1640培养基,培养24小时。奥西替尼在体系中的工作浓度分别设置为0.05、0.1、0.15、0.2、0.5、1、2或3μm。设置不加入奥西替尼的对照,即0浓度对照。
[0126]
3、完成步骤2后,采用cck8试剂盒检测细胞存活率。
[0127]
结果见图6。
[0128]
四、平板克隆试验检测细胞存活率
[0129]
(一)第一组试验
[0130]
供试细胞:pc9 ctrl或pc9 dclk1
oe
。
[0131]
1、将供试细胞接种于24孔板内(200个细胞/孔),采用含吉非替尼的dmem高糖培养基培养。吉非替尼在体系中的工作浓度分别设置为:4μm或8μm。设置不加入吉非替尼的对照组。培养时间分别设置为:24h、48h、72h、96h或120h。
[0132]
2、完成步骤1后,拍照并统计细胞存活率。
[0133]
细胞存活率(%)=试验组每孔活细胞数量/对照组每孔活细胞数量。
[0134]
结果见图7。
[0135]
(二)第二组试验
[0136]
供试细胞:hcc827 ctrl或hcc827 dclk1
oe
。
[0137]
1、将供试细胞接种于24孔板内(200个细胞/孔),采用含奥西替尼rpmi-1640培养基培养。奥西替尼在体系中的工作浓度分别设置为:0.5μm或1μm。设置不加入奥西替尼的对照组。培养时间分别设置为:24h、48h、72h、96h或120h。
[0138]
2、完成步骤1后,拍照并统计细胞存活率。
[0139]
细胞存活率(%)=试验组每孔活细胞数量/对照组每孔活细胞数量。
[0140]
结果见图8。
[0141]
实施例2的结果表明:过表达dclk1基因显著降低肿瘤细胞对tki的药物敏感性。
[0142]
实施例3、抑制dclk1基因表达显著提高肺腺癌细胞对tki的敏感性
[0143]
一、构建重组质粒
[0144]
1、取lenticrisprv2质粒,用限制性内切酶bsmbi进行酶切,回收11kb左右的大片段。
[0145]
2、将oligo1-dclk1和oligo2-dclk1退火,得到具有粘末端的双链分子。
[0146]
oligo1-dclk1:5
’‑
caccggagtagagagctgactacca-3’;
[0147]
oligo2-dclk1:5
’‑
aaactggtagtcagctctctactcc-3’。
[0148]
3、将步骤1获得的大片段和步骤2得到的双链分子连接,得到重组质粒。
[0149]
二、pc9/grdclk1-/-和pc9/gr ctrl的制备
[0150]
1、制备pc9/grdclk1-/-[0151]
(1)借助neofect转染试剂,将步骤一获得的重组质粒、质粒pspax2和质粒pmd2.g共同导入293t细胞,继续培养72小时。
[0152]
(2)完成步骤(1)后,3000g离心15min,收集上清液。
[0153]
(3)取步骤(2)得到的上清液,加入polybrene并使其在体系中的浓度为8ng/ml,然后感染pc9/gr细胞,培养48-72小时。
[0154]
(4)完成步骤(3)后,采用含4μg/ml嘌呤霉素的dmem高糖培养基培养7天,然后从存活细胞中分选单细胞克隆。
[0155]
(5)取步骤(4)得到的细胞,进行western blot检测。方法同实施例1的步骤三。获得dclk1基因被抑制表达的pc9/gr细胞,用pc9/grdclk1-/-表示。
[0156]
western blot检测的结果见图9。
[0157]
2、制备pc9/gr ctrl
[0158]
(1)借助neofect转染试剂将lenticrisprv2质粒、质粒pspax2和质粒pmd2.g共同导入293t细胞,继续培养72小时。
[0159]
(2)完成步骤(1)后,3000g离心15min,收集上清液。
[0160]
(3)取步骤(2)得到的上清液,加入polybrene并使其在体系中的浓度为8ng/ml,然后感染pc9/gr细胞,培养48-72小时。
[0161]
(4)完成步骤(3)后,采用含4μg/ml嘌呤霉素的dmem高糖培养基培养7天,然后从存活细胞中分选单细胞克隆,即为pc9/gr ctrl。
[0162]
western blot检测的结果见图9。
[0163]
三、hcc827/azdrdclk1-/-和hcc8279/azdr ctrl的制备
[0164]
1、制备hcc827/azdrdclk1-/-[0165]
用hcc827/azdr细胞代替pc9/gr细胞,用rpmi-1640培养基代替dmem高糖培养基,其他同步骤二的1,获得dclk1基因被抑制表达的hcc827/azdr细胞,用hcc827/azdr dclk1-/-表示。
[0166]
western blot检测的结果见图9。
[0167]
2、制备hcc827/azdr ctrl
[0168]
用hcc827/azdr细胞代替pc9/gr细胞,用rpmi-1640培养基代替dmem高糖培养基,其他同步骤二的2,得到hcc827/azdr ctrl。
[0169]
western blot检测的结果见图9。
[0170]
四、cck8试验检测细胞存活率
[0171]
(一)第一组试验
[0172]
供试细胞:pc9/gr ctrl或pc9/grdclk1-/-。
[0173]
1、将供试细胞接种于96孔板内(5000个细胞/孔),采用dmem高糖培养基培养24h
(60%汇合度)。
[0174]
2、完成步骤1后,吸弃上清,加入含吉非替尼的dmem高糖培养基,培养24小时。吉非替尼在体系中的工作浓度分别设置为:1、2、4、8、32、64、128或512μm。设置不加入吉非替尼的对照,即0浓度对照。
[0175]
3、完成步骤2后,采用cck8试剂盒检测细胞存活率。
[0176]
结果见图10。
[0177]
(二)第二组试验
[0178]
供试细胞:hcc827/azdr ctrl或hcc827/azdrdclk1-/-。
[0179]
1、将供试细胞接种于96孔板内(5000个细胞/孔),采用rpmi-1640培养基培养24h(60%汇合度)。
[0180]
2、完成步骤1后,吸弃上清,加入含奥西替尼的rpmi-1640培养基,培养24小时。奥西替尼在体系中的工作浓度分别设置为:0.05、0.1、0.15、0.2、0.5、1、2或3μm。设置不加入奥西替尼的对照,即0浓度对照。
[0181]
3、完成步骤2后,采用cck8试剂盒检测细胞存活率。
[0182]
结果见图10。
[0183]
步骤四的结果表明:抑制dclk1基因表达可增加耐药肿瘤细胞对于tki的药物敏感性。
[0184]
五、流式细胞术检测
[0185]
(一)第一组试验
[0186]
第一组:将pc9/gr ctrl接种于6孔板内(5
×
105个细胞/孔),采用含dmso的dmem高糖培养基培养3天。dmso在体系中的浓度为0.07μl/ml。
[0187]
第二组:将pc9/gr ctrl接种于6孔板内(5
×
105个细胞/孔),采用含8μm吉非替尼的dmem高糖培养基培养3天。
[0188]
第三组:将pc9/gr dclk1-/-接种于6孔板内(5
×
105个细胞/孔),采用含dmso的dmem高糖培养基培养3天。dmso在体系中的浓度为0.07μl/ml。
[0189]
第四组:将pc9/gr dclk1-/-接种于6孔板内(5
×
105个细胞/孔),采用含8μm吉非替尼的dmem高糖培养基培养3天。
[0190]
完成分组处理后,收取孔内细胞,利用pe/annexinv凋亡试剂盒(凯基公司,产品目录号:kga1014)进行染色,并进行流式上机,分析早期与晚期凋亡细胞比例。
[0191]
结果见图11。
[0192]
(二)第二组试验
[0193]
第一组:将hcc827/azdr ctrl接种于6孔板内(5
×
105个细胞/孔),采用含dmso的rpmi-1640培养基培养3天。dmso在体系中的浓度为0.05μl/ml。
[0194]
第二组:将hcc827/azdr ctrl接种于6孔板内(5
×
105个细胞/孔),采用含0.5μm奥西替尼的rpmi-1640培养基培养3天。
[0195]
第三组:将hcc827/azdr dclk1-/-接种于6孔板内(5
×
105个细胞/孔),采用含dmso的rpmi-1640培养基培养3天。dmso在体系中的浓度为0.05μl/ml。
[0196]
第四组:将hcc827/azdr dclk1-/-接种于6孔板内(5
×
105个细胞/孔),采用含0.5μm奥西替尼的rpmi-1640培养基培养3天。
[0197]
完成分组处理后,收取孔内细胞,利用pe/annexinv凋亡试剂盒进行染色,并进行流式上机,分析早期与晚期凋亡细胞比例。
[0198]
结果见图12。
[0199]
步骤五的结果表明:dclk1基因被抑制表达的耐药肿瘤细胞经tki处理后,细胞发生凋亡的数目明显增加。
[0200]
六、western blot检测
[0201]
(一)第一组试验
[0202]
第一组:将pc9/gr ctrl接种于60mm培养皿(1
×
106个细胞/皿),采用含dmso的dmem高糖培养基培养3天。dmso在体系中的浓度为0.07μl/ml。
[0203]
第二组:将pc9/gr ctrl接种于60mm培养皿(1
×
106个细胞/皿),采用含8μm吉非替尼的dmem高糖培养基培养3天。
[0204]
第三组:将pc9/gr dclk1-/-接种于60mm培养皿(1
×
106个细胞/皿),采用含dmso的dmem高糖培养基培养3天。dmso在体系中的浓度为0.07μl/ml。
[0205]
第四组:将pc9/gr dclk1-/-接种于60mm培养皿(1
×
106个细胞/皿),采用含8μm吉非替尼的dmem高糖培养基培养3天。
[0206]
完成分组处理后,收集细胞(包括漂浮细胞与贴壁细胞),提取总蛋白,通过western blot检测凋亡通路的激活情况。
[0207]
结果见图13。
[0208]
(二)第二组试验
[0209]
第一组:将hcc827/azdr ctrl接种于60mm培养皿(1
×
106个细胞/皿),采用含dmso的rpmi-1640培养基培养3天。dmso在体系中的浓度为0.05μl/ml。
[0210]
第二组:将hcc827/azdr ctrl接种于60mm培养皿(1
×
106个细胞/皿),采用含0.5μm奥西替尼的rpmi-1640培养基培养3天。
[0211]
第三组:将hcc827/azdr dclk1-/-接种于60mm培养皿(1
×
106个细胞/皿),采用含dmso的rpmi-1640培养基培养3天。dmso在体系中的浓度为0.05μl/ml。
[0212]
第四组:将hcc827/azdr dclk1-/-接种于60mm培养皿(1
×
106个细胞/皿),采用含0.5μm奥西替尼的rpmi-1640培养基培养3天。
[0213]
完成分组处理后,收集细胞(包括漂浮细胞与贴壁细胞),提取总蛋白,通过western blot检测凋亡通路的激活情况。
[0214]
结果见图13。
[0215]
步骤六的结果表明:结果表明:dclk1基因被抑制表达的耐药肿瘤细胞经tki处理后,凋亡通路明显激活。
[0216]
实施例4、dclk1抑制剂和tki的协同作用
[0217]
一、dclk1-in-1与吉非替尼具有明确的协同作用
[0218]
1、将pc9/gr细胞接种于96孔板内(5000个细胞/孔),采用dmem高糖培养基培养24小时。
[0219]
2、完成步骤1后,吸弃上清,加入含吉非替尼的dmem高糖培养基,培养24小时。设置不同的吉非替尼浓度。
[0220]
3、完成步骤2后,采用cck8试剂盒检测细胞存活率。吉非替尼对pc9/gr细胞的ic50
值为2452μm。
[0221]
4、完成步骤1后,吸弃上清,加入含dclk1-in-1的dmem高糖培养基,培养24小时。设置不同的dclk1-in-1浓度。
[0222]
5、完成步骤4后,采用cck8试剂盒检测细胞存活率。dclk1-in-1对pc9/gr细胞的ic50值为45.36μm。
[0223]
6、完成步骤1后,吸弃上清,加入含吉非替尼和dclk1-in-1的dmem高糖培养基,培养24小时。吉非替尼的浓度设置为1μm或2μm。dclk1-in-1的浓度设置为2μm、4μm、8μm或16μm。
[0224]
7、完成步骤6后,采用cck8试剂盒检测细胞存活率。
[0225]
8、根据步骤7的结果,采用compusyn software软件测定药物联合指数(combinationindex)—ci值。
[0226]
细胞存活率结果见图14。
[0227]
ci值结果见表1。
[0228]
表1
[0229]
组别吉非替尼(μm)dclk1-in-1(μm)faci1120.350900.086162140.437360.080383180.436190.1458041160.555740.127805220.396340.084226240.451340.088117280.470910.1294982160.592430.10646
[0230]
步骤一的结果表明:单独应用耐药浓度范围内吉非替尼pc9/gr细胞不发生凋亡;联合应用低剂量dclk1-in-1后,细胞的存活率明显降低,ci值小于1,显示两种药物具有明确的协同作用。结果表明:dclk1-in-1与吉非替尼具有明确的协同作用。
[0231]
二、dclk1-in-1与奥西替尼具有明确的协同作用
[0232]
1、将hcc827/azdr细胞接种于96孔板内(5000个细胞/孔),采用rpmi-1640培养基培养24小时。
[0233]
2、完成步骤1后,吸弃上清,加入含奥西替尼的rpmi-1640培养基,培养24小时。设置不同的奥西替尼浓度。
[0234]
3、完成步骤2后,采用cck8试剂盒检测细胞存活率。奥西替尼对hcc827/azdr细胞的ic50值为2.168μm。
[0235]
4、完成步骤1后,吸弃上清,加入含dclk1-in-1的rpmi-1640培养基,培养24小时。设置不同的dclk1-in-1浓度。
[0236]
5、完成步骤4后,采用cck8试剂盒检测细胞存活率。dclk1-in-1对hcc827/azdr细胞的ic50值为20.98μm。
[0237]
6、完成步骤1后,吸弃上清,加入含奥西替尼和dclk1-in-1的rpmi-1640培养基,培养24小时。奥西替尼的浓度设置为0.15μm或0.2μm。dclk1-in-1的浓度设置为2μm、4μm或8μ
m。
[0238]
7、完成步骤6后,采用cck8试剂盒检测细胞存活率。
[0239]
8、根据步骤7的结果,采用compusyn software软件测定药物联合指数(combinationindex)—ci值。
[0240]
细胞存活率结果见图15。
[0241]
ci值结果见表2。
[0242]
表2
[0243]
组别奥西替尼(μm)dclk1-in-1(μm)faci10.1520.339540.4713620.1540.40180.7229730.1580.514070.9835240.220.375070.4216650.240.422500.6813960.280.603270.75180
[0244]
步骤二的结果表明:单独应用耐药浓度范围内奥西替尼hcc827/azdr细胞不发生凋亡;联合应用低剂量dclk1-in-1后,ci值小于1,显示两种药物具有明确的协同作用。结果表明:dclk1-in-1与奥西替尼具有明确的协同作用。
[0245]
三、dclk1-in-1与tki联合应用对耐药细胞的杀伤作用明显增强
[0246]
(一)第一组试验
[0247]
1、将pc9/gr细胞接种于12孔板内(200个细胞/孔),采用dmem高糖培养基培养24小时。
[0248]
2、完成步骤1后,吸弃上清,分组处理:
[0249]
comb组:加入含1μm吉非替尼和2μm dclk1-in-1的dmem高糖培养基,培养4天;
[0250]
吉非替尼组:加入含1μm吉非替尼的dmem高糖培养基,培养4天;
[0251]
dclk1-in-1组:加入含2μm dclk1-in-1的dmem高糖培养基,培养4天;
[0252]
dmso组:加入含dmso的dmem高糖培养基(dmso浓度为0.01μl/ml),培养4天。
[0253]
3、完成步骤1后,吸弃上清,分组处理:
[0254]
comb组:加入含1μm吉非替尼和4μm dclk1-in-1的dmem高糖培养基,培养4天;
[0255]
吉非替尼组:加入含1μm吉非替尼的dmem高糖培养基,培养4天;
[0256]
dclk1-in-1组:加入含4μm dclk1-in-1的dmem高糖培养基,培养4天;
[0257]
dmso组:加入含dmso的dmem高糖培养基(dmso浓度为0.01μl/ml),培养4天。
[0258]
4、完成步骤2或完成步骤3后,拍照。
[0259]
结果见图16。
[0260]
(二)第二组试验
[0261]
1、将hcc827/azdr细胞接种于12孔板内(200个细胞/孔),采用rpmi-1640培养基培养24小时。
[0262]
2、完成步骤1后,吸弃上清,分组处理:
[0263]
comb组:加入含0.15μm奥西替尼和2μm dclk1-in-1的rpmi-1640培养基,培养4天;
[0264]
奥西替尼组:加入含0.15μm奥西替尼的rpmi-1640培养基,培养4天;
[0265]
dclk1-in-1组:加入含2μm dclk1-in-1的rpmi-1640培养基,培养4天;
[0266]
dmso组:加入含dmso的rpmi-1640培养基(dmso浓度为0.015μl/ml),培养4天。
[0267]
3、完成步骤1后,吸弃上清,分组处理:
[0268]
comb组:加入含0.15μm奥西替尼和4μm dclk1-in-1的rpmi-1640培养基,培养4天;
[0269]
奥西替尼组:加入含0.15μm奥西替尼的rpmi-1640培养基,培养4天;
[0270]
dclk1-in-1组:加入含4μm dclk1-in-1的rpmi-1640培养基,培养4天;
[0271]
dmso组:加入含dmso的rpmi-1640培养基(dmso浓度为0.015μl/ml),培养4天。
[0272]
4、完成步骤2或完成步骤3后,拍照。
[0273]
结果见图16。
[0274]
步骤三的结果表明:dclk1-in-1与tki联合应用对耐药肿瘤细胞的杀伤作用明显增强。
[0275]
四、dclk1-in-1与tki联合用药明显增加细胞凋亡数目
[0276]
(一)第一组试验
[0277]
第一组:将pc9/gr细胞接种于6孔板内(5
×
105个细胞/孔),采用dmem高糖培养基培养24小时;然后吸弃上清,加入含dmso的dmem高糖培养基,培养3天。dmso在体系中的浓度为0.01μl/ml。
[0278]
第二组:将pc9/gr细胞接种于6孔板内(5
×
105个细胞/孔),采用dmem高糖培养基培养24小时;然后吸弃上清,加入含1μm吉非替尼的dmem高糖培养基,培养3天。
[0279]
第三组:将pc9/gr细胞接种于6孔板内(5
×
105个细胞/孔),采用dmem高糖培养基培养24小时;然后吸弃上清,加入含4μmdclk1-in-1的dmem高糖培养基,培养3天。
[0280]
第四组:将pc9/gr细胞接种于6孔板内(5
×
105个细胞/孔),采用dmem高糖培养基培养24小时;然后吸弃上清,加入含1μm吉非替尼和4μmdclk1-in-1的dmem高糖培养基,培养3天。
[0281]
完成分组处理后,收取细胞(包括悬浮细胞以及贴壁细胞),利用pe/annexinv凋亡试剂盒进行染色,检测细胞凋亡情况。
[0282]
结果见图17。
[0283]
(二)第二组试验
[0284]
第一组:将hcc827/azdr细胞接种于6孔板内(5
×
105个细胞/孔),采用rpmi-1640培养基培养24小时;然后吸弃上清,加入含dmso的rpmi-1640培养基,培养3天。dmso在体系中的浓度为0.015μl/ml。
[0285]
第二组:将hcc827/azdr细胞接种于6孔板内(5
×
105个细胞/孔),采用rpmi-1640培养基培养24小时;然后吸弃上清,加入含0.15μm奥西替尼的rpmi-1640培养基,培养3天。
[0286]
第三组:将hcc827/azdr细胞接种于6孔板内(5
×
105个细胞/孔),采用rpmi-1640培养基培养24小时;然后吸弃上清,加入含4μmdclk1-in-1的rpmi-1640培养基,培养3天。
[0287]
第四组:将hcc827/azdr细胞接种于6孔板内(5
×
105个细胞/孔),采用rpmi-1640培养基培养24小时;然后吸弃上清,加入含0.15μm奥西替尼和4μmdclk1-in-1的rpmi-1640培养基,培养3天。
[0288]
完成分组处理后,收取悬浮细胞以及贴壁细胞,利用pe/annexinv凋亡试剂盒进行染色,检测细胞凋亡情况。
[0289]
结果见图17。
[0290]
结果表明:dclk1-in-1与tki联合用药明显增加细胞凋亡数目。
[0291]
五、dclk1-in-1与tki联合用药显著激活凋亡通路
[0292]
(一)第一组试验
[0293]
第一组:将pc9/gr细胞接种于60mm培养皿(1
×
106个细胞/皿),采用dmem高糖培养基培养至汇合度为70%;然后吸弃上清,加入含dmso的dmem高糖培养基,培养3天。dmso在体系中的浓度为0.01μl/ml。
[0294]
第二组:将pc9/gr细胞接种于60mm培养皿(1
×
106个细胞/皿),采用dmem高糖培养基培养至汇合度为70%;然后吸弃上清,加入含1μm吉非替尼的dmem高糖培养基,培养3天。
[0295]
第三组:将pc9/gr细胞接种于60mm培养皿(1
×
106个细胞/皿),采用dmem高糖培养基培养至汇合度为70%;然后吸弃上清,加入含4μmdclk1-in-1的dmem高糖培养基,培养3天。
[0296]
第四组:将pc9/gr细胞接种于60mm培养皿(1
×
106个细胞/皿),采用dmem高糖培养基培养至汇合度为70%;然后吸弃上清,加入含1μm吉非替尼和4μmdclk1-in-1的dmem高糖培养基,培养3天。
[0297]
完成分组处理后,收集细胞,提取总蛋白,通过western blot检测凋亡通路的激活情况。作为检测对象的凋亡蛋白:cleaved-caspase3、cleaved-caspase9、cleaved-parp。
[0298]
结果见图18。
[0299]
(二)第二组试验
[0300]
第一组:将hcc827/azdr细胞接种于60mm培养皿(1
×
106个细胞/皿),采用rpmi-1640培养基培养至汇合度为70%;然后吸弃上清,加入含dmso的rpmi-1640培养基,培养3天。dmso在体系中的浓度为0.015μl/ml。
[0301]
第二组:将hcc827/azdr细胞接种于60mm培养皿(1
×
106个细胞/皿),采用rpmi-1640培养基培养至汇合度为70%;然后吸弃上清,加入含0.15μm奥西替尼的rpmi-1640培养基,培养3天。
[0302]
第三组:将hcc827/azdr细胞接种于60mm培养皿(1
×
106个细胞/皿),采用rpmi-1640培养基培养至汇合度为70%;然后吸弃上清,加入含4μmdclk1-in-1的rpmi-1640培养基,培养3天。
[0303]
第四组:将hcc827/azdr细胞接种于60mm培养皿(1
×
106个细胞/皿),采用rpmi-1640培养基培养至汇合度为70%;然后吸弃上清,加入含0.15μm奥西替尼和4μmdclk1-in-1的rpmi-1640培养基,培养3天。
[0304]
完成分组处理后,收集细胞,提取总蛋白,通过western blot检测凋亡通路的激活情况。作为检测对象的凋亡蛋白:cleaved-caspase3、cleaved-caspase9、cleaved-parp。
[0305]
结果见图18。
[0306]
步骤五的结果表明:dclk1-in-1与tki联合用药显著激活tki耐药肿瘤细胞的凋亡通路。
[0307]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。
总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1