一种创伤弧菌灭活疫苗及其制备方法和用途
1.本发明涉及动物医学技术领域,具体涉及一种创伤弧菌灭活疫苗及其制备方法和用途。
背景技术:
2.创伤弧菌作为人和海洋生物共患病的弧菌,它主要有三种类型:生物i型,它易导致摄入性病例和伤口感染;生物ii型,是造成海洋养殖动物患病的致病类型;以及能够感染人类的生物ⅲ型(吴后波和潘金培,2001;bisharat et al.,1999;kelly and mccormick,1981;tison et al.,1982)。创伤弧菌的致病性是多种致病因子共同作用的结果,主要包括溶血素、martx毒素、铁载体、荚膜多糖、脂多糖以及金属蛋白酶等(王青柏,2018;li and wang,2020)。感染创伤弧菌后,易造成鳗鲡(fouz and amaro,2003)、石斑鱼(abdullah et al.,2017)、鲟鱼(si et al.,2010)、罗非鱼(chen et al.,2010)和金鲳鱼(li et al.,2006)等经济动物大批量死亡。针对弧菌引起的疾病大多数采取抗生素进行治疗,有研究发现从病害动物分离出的弧菌对多种抗生素检测出耐药基因和耐药性(kashulin et al.,2017;letchumanan et al.,2015)。随着水产疫苗研发工作的不断开展,疫苗在水产养殖病害中的应用越来越广泛。传统灭活疫苗使用福尔马林作为灭活剂,但灭活时完整抗原成分会遭到破坏,存在免疫效果不理想、免疫持续时间短的缺点(sun et al.,2020)。弧菌的细胞外和表面蛋白质易于被感染宿主识别,具有作为的疫苗潜力并能提供免疫保护作用(wang et al.,2017)。同时,在水产疫苗方面关于创伤弧菌疫苗的研究相对较少,开发能够保留相对完整抗原结构的灭活疫苗,成为水产灭活疫苗的开发重点。
3.在申请号为201610357120.6、名称为“一种抗菌肽tc38及其应用”的中国专利申请中公开了抗菌肽tc38具有杀伤创伤弧菌的作用,但是根据已公开的文献记载,美国红鱼、鲤鱼等硬骨鱼的组织因子途径抑制剂(tfpi)的c端衍生肽与创伤弧菌孵育后,透射电镜观察到细胞结构破裂、细胞内容物流出(he et al.,2018;su et al.,2020),细胞结构破裂表明难以将tfpi用于制备灭活疫苗。此外,当前的创伤弧菌疫苗主要是创伤弧菌和其他致病菌的联合疫苗(huang et al.,2012;shoemaker et al.,2011)和重组疫苗(kohei et al.,2018)等类型,相关研究相对较少,因此,研发针对水产动物弧菌病原的高效免疫学防控方法,已成为目前水产养殖业健康发展的迫切需求。
技术实现要素:
4.本发明要解决的技术问题是提供一种基于来源于半滑舌鳎tfpi
‑
2的c末端衍生肽tc38制备的创作菌创新灭活疫苗。基于研究发现在以tc38处理创伤弧菌后,随着时间的推移,创伤弧菌细胞内容物逐渐降解,细胞膜却依旧保持完整性,本发明制备了关于创伤弧菌的tc38灭活疫苗,并在大菱鲆体内检测了tc38灭活疫苗诱发的相对免疫保护率和免疫机制,为创伤弧菌灭活疫苗的研究提供新的途径。
5.本发明提供了一种创伤弧菌灭活疫苗的制备方法,包括:
6.1)将tc38抗菌肽加入到创伤弧菌菌液中,进行灭活处理,得到灭活的创伤弧菌孵育液;
7.2)将所述灭活的创伤弧菌孵育液离心,收集菌体沉淀,得灭活菌体;
8.3)将所述灭活菌体以无菌pbs清洗数次后,分散于无菌pbs中,即得灭活疫苗。
9.在根据本发明的一个实施方案中,制备方法还包括:
10.4)对灭活菌体进行无菌检验;
11.优选地,所述无菌检验是通过包括下述步骤的方法实现的:将所述灭活菌体以无菌pbs稀释后,取适量涂布于固体培养基,28℃培养24~48h,以确认创伤弧菌是否灭活完全。
12.在根据本发明的一个实施方案中,所述创伤弧菌菌液是通过包括下述步骤的方法制备得到的:
13.将于
‑
80℃保存的创伤弧菌以液体lb培养基复苏至对数生长中期,然后经离心、清洗后重悬于无菌pbs中,即得;优选地,重悬后得到的创伤弧菌菌液浓度为2
×
108cfu/ml。
14.在根据本发明的一个实施方案中,所述tc38抗菌肽为氨基酸序列与seq id no:1的同源性不低于85%的多肽。
15.本发明还提供了根据上述制备方法制备得到的创伤弧菌灭活疫苗。
16.本发明进一步提供了一种用于预防或治疗海洋养殖动物创伤弧菌感染的药物,其包含上述的创伤弧菌灭活疫苗。优选地,有效量为0.182mg/条。
17.本发明还提供了上述的创伤弧菌灭活疫苗在制备用于预防或治疗海洋养殖动物创伤弧菌感染的药物中的应用。
18.在根据本发明的一个实施方案中,所述海洋养殖动物选自鳗鲡、石斑鱼、鲟鱼、罗非鱼、金鲳鱼或大菱鲆中的一种或多种。
19.本发明的上述技术方案的有益效果如下:
20.本发明以tc38抗菌肽灭活创伤弧菌得到了一种新型灭活疫苗,该疫苗在大菱鲆中诱发的相对免疫保护率显著高于福尔马林灭活疫苗组,可诱导鱼体产生更高的非特异和特异性免疫应答水平,在水产动物创伤弧菌病害防治中具有良好的应用前景。
附图说明
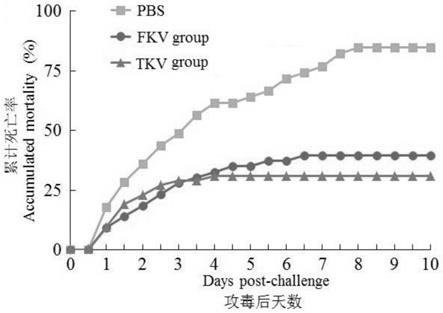
21.图1为攻毒后大菱鲆的累积死亡率统计示意图;
22.图2为疫苗免疫后鱼苗巨噬细胞呼吸爆发(a)和杀菌活性(b)的变化情况统计图;
23.图3为疫苗免疫后鱼苗血清的杀菌活性测定结果图;
24.图4为接种疫苗后大菱鲆血清中免疫相关酶活性测定结果图;
25.图5为疫苗接种后血清抗体水平和头肾中igm表达水平检测结果图;
26.图6为血清抗体诱导的创伤弧菌细菌凝集检测结果图谱;其中,疫苗免疫第21天时tkv组(a)、fkv组(b)、pbs组(c)血清与fitc标记的创伤弧菌产生的凝集现象;
27.图7为展示tkv对大菱鲆头肾组织免疫相关基因表达的影响的检测结果示意图谱。
具体实施方式
28.为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具
体实施例进行详细描述。
29.实验材料、试剂和设备
30.1、菌种和多肽:
31.创伤弧菌菌株从病鱼中分离鉴定并保存在
‑
80℃冰箱中。tc38(seq id no:1rncmevcvkgekkhtgqgmirrlrrnknnsifvvrkrv),来源于半滑舌鳎tfpi
‑
2蛋白的c末端。由chinapeptides公司(中国,上海)化学合成。抗菌肽通过高效液相色谱纯化至纯度>98%。这些冻干肽储存在
‑
80℃的超低温冰箱中,使用时在pbs(ph=7.4)中溶解。
32.2、养殖动物:
33.健康的大菱鲆(平均25
±
1.65g)购自青岛市崂山区昊睿源水产苗种养殖有限公司。
34.实验进行之前需要随机取样检测无病原菌后才能继续使用。在暂养期间,养殖水温保持在17℃,每天中午喂养一次商业饲料,换水一次。
35.3、实验仪器:
36.德国凯杰tissuelyserii组织细胞破碎仪、德国beckman高速离心机、杭州奥盛nano
‑
300微量分光光度计、德国hettich超速冷冻离心机、美国labnet微孔离心机、上海旻泉恒温制冷摇床、北京赛多利斯电子天平、北京国华hh
‑
3a数显恒温水浴锅、美国md多功能酶标仪、北京六一dycp
‑
31bn电泳仪、日本tomysx
‑
500高压灭菌锅、瑞士罗氏lightcycler96实时荧光定量pcr仪、青岛海尔
‑
80℃冰箱和德国蔡司axio observe 7全自动活细胞倒置显微镜。
37.如无特殊说明,下述实验数值以平均值
±
se形式表示,所有统计分析均使用spss 20.0软件进行。使用单因素方差分析(anova)中的duncan和lsd方差分析实验数值的显著性差异(*代表0.01<p<0.05;**代表p<0.01)。
38.实施例1灭活疫苗的制备
39.(1)将
‑
80℃取出的创伤弧菌使用液体lb培养基复苏至对数生长中期,然后将细菌离心、清洗,并重悬于无菌pbs中;
40.(2)使用20mg tc38抗菌肽,在28℃灭活创伤弧菌6h;同时,以福尔马林溶液(甲醛终浓度为3
‰
)作为对照组;
41.(3)将两种方式灭活的创伤弧菌孵育液分别于5000rpm中离心2min,菌体沉淀各使用无菌pbs清洗3次;
42.(4)灭活菌体以无菌的pbs调整至2
×
108cfu/ml浓度后,取50μl两组灭活疫苗涂布lb固体培养基中28℃培养24~48h,进行无菌检验;
43.(5)若有菌长出,则继续添加tc38抗菌肽(对照组则继续添加福尔马林溶液)继续孵育然后清洗,直至无菌检验合格,制备好的灭活疫苗暂时存放在4℃备用。
44.实施例2鱼体免疫方法
45.(1)随机将330条大菱鲆分成tc38灭活组(tc38
‑
killed vibrio vulnificus,tkv)、甲醛灭活组(formalin
‑
killed vibrio vulnificus,fkv)和pbs组,三组鱼苗在养殖桶中暂养一周以上来适应环境;
46.(2)养殖期间,每组随机抽取10条鱼苗对其肝脏、脾脏和肾脏进行取样,将组织研磨成匀浆液后进行平板涂布,检测大菱鲆是否感染创伤弧菌;
47.(3)向健康的大菱鲆腹腔注射100μl 2
×
108cfu/ml的tkv或fkv疫苗,注射100μl无菌pbs为对照组;
48.(4)免疫后每天观察鱼苗情况并投喂商业饲料,在免疫后第1d、7d、14d、21d和28d时对三组大菱鲆的肝脏、脾脏、肾脏和血清进行取样,保存在
‑
80℃以备后续实验使用。
49.实施例3相对免疫保护率的测定
50.1、测定方法
51.(1)创伤弧菌从
‑
80℃取出并复苏至对数生长中期,重悬至5
×
107cfu/ml;
52.(2)三组健康鱼苗状态稳定后,疫苗免疫一个月后的每条鱼腹腔注射100μl重悬菌液进行攻毒;
53.(3)从攻毒日起每12h记录三组鱼苗的死亡数量,分析各组的累计死亡率(cumulative mortality rate,csr)和疫苗的相对免疫保护率(relative immune protectionrate,rps);
54.rps={1
‑
(灭活组鱼苗死亡率%/pbs组鱼苗死亡率%)}
×
100%。
55.2、实验结果:
56.为检测tc38灭活疫苗的保护效果,在接种疫苗4周后用创伤弧菌进行攻毒,并监测其死亡情况。结果显示,tkv组、fkv组和pbs组鱼苗累积死亡率分别为30.77%、39.53%和84.62%(图1),对应的rps分别为63.64%和53.29%。与fkv组相比,tkv组诱导的rps显著提高,tkv组疫苗接种后可以产生较高的存活率,表明tc38灭活疫苗对大菱鲆具有良好的保护作用。对攻毒后的鱼苗进行病原分离,在死亡鱼的肝、脾、肾中检测到的唯一一种菌株是创伤弧菌,说明鱼的死亡是由于创伤弧菌感染所致。
57.实施例4鱼体巨噬细胞呼吸爆发水平和杀菌活性
58.1、鱼体巨噬细胞呼吸爆发水平检测
59.(1)每组免疫第1d、7d、14d、21d和28d时取5条大菱鲆的新鲜脾、肾组织进行巨噬细胞的提取,按照fish tumor tissue macrophage isolation kit试剂盒的流程进行细胞的提取;
60.(2)将每组的脾肾组织放在200目不锈钢筛网上研磨,一边研磨一边加入匀浆冲洗液;
61.(3)将研磨液室温放置2
‑
3h后,2500rpm离心15min后弃上清,用1640/双抗细胞培养液重悬至1
×
107个/ml;
62.(4)在96孔细胞培养板中加入上述细胞悬液100μl,在培养箱中23℃过夜培养,用无菌pbs清洗去除未贴壁细胞。
63.(5)加入100μl 1mg/ml的氯化硝基四氮唑蓝(nbt),25℃孵育2h;
64.(6)去除培养液然后加入100%甲醇并静止10min后弃上清,然后加入70%甲醇溶液清洗2次后去除液体,室温下自然风干96孔板;
65.(7)每孔加入120μl 2m的koh溶液,再加入140μl的dmso溶解蓝色结晶物,轻微震荡孔板,使其更好溶解结晶物;
66.(8)以koh/dmso为空白对照,在630nm波长下用酶标仪测定吸光度。
67.2、巨噬细胞杀菌指数测定
68.(1)按3.1.4方法提取好的巨噬细胞铺板于96孔细胞培养板后,培养3h后去除培养
液用150μl无菌pbs清洗2次;
69.(2)将创伤弧菌培养至对数生长中期,离心清洗并用无菌pbs重悬至1
×
106cfu/ml,每孔中加入100μl重悬菌液,28℃孵育5h;
70.(3)再向每孔中加入50μl 0.2%tween20溶液裂解细胞,每组取50μl涂布lb固体培养基中,28℃培养12h,进行菌落计数。
71.3、血清杀菌活性测定
72.(1)对免疫第1d、7d、14d、21d和28d的大菱鲆静脉血常温静止2h后,4℃过夜,然后3500rpm/min离心15min,取上清即为实验所需血清;
73.(2)创伤弧菌培养至对数生长中期并用无菌pbs清洗重悬至1
×
107cfu/ml;
74.(3)在96孔聚丙烯微孔板中每孔加入各组免疫后第1d、7d、14d、21d和28d的血清50μl,血清56℃失活30min或不做处理,再加入10μl的重悬菌液,28℃孵育2h;
75.(4)取上述孵育液稀释300倍后,取50μl稀释液涂布于固体lb培养基中,28℃培养12
‑
24h,进行菌落计数。
76.细菌存活率(%)=灭活组菌落数/pbs组菌落数
×
100%
77.4、实验结果:
78.在疫苗接种后第1d、7d、14d、21d和28d分别从注射tc38灭活疫苗,福尔马林灭活疫苗和pbs的鱼中收集头肾巨噬细胞,用于检查tc38灭活疫苗对巨噬细胞活性的影响。随后的呼吸爆发活性检测结果表明,与fkv组和pbs组的鱼相比,tkv组的鱼在接种后7d、14d和21d表现出明显的呼吸爆发(p<0.05)(图2中a)。杀菌活性分析的结果表明,tkv组的鱼在接种后第14d时创伤弧菌存活率显著低于fkv组和pbs组的鱼(p<0.05)(图2中b)。
79.在接种后第1d、7d、14d、21d和28d收集血清样品检测tkv组的血清对创伤弧菌杀菌活性的影响。图3显示,在接种后第7d、14d和28d,tkv组血清中的细菌存活率明显低于fkv组和pbs组(p<0.05),在第7d,tkv组创伤弧菌的存活率是fkv组血清中的0.494倍。实验表明在这些时间点,tkv组的血清杀菌活性显著高于fkv组(p<0.05)。当与创伤弧菌一起孵育之前加热血清,tkv组和fkv组的血清中创伤弧菌的存活率与对照鱼的血清类似。由此可以确定,本发明提供的tc38新型灭活疫苗可以更好的活化巨噬细胞进而激活相应的免疫应答反应,同时注射tc38新型灭活疫苗后能够更好地促进akp、acp、t
‑
sod和溶菌酶的分泌,进而参与到机体的非特异性免疫反应中从而达到抵御病原体的作用。
80.另外,由于tc38抗菌肽制备的疫苗能够维持创伤弧菌良好的内外膜结构,与甲醛灭活疫苗相比它保存了相对完整的细菌表面抗原结构,因此,在接种后第7d、14d、21d和28d,tkv组抗体响应速度很快,并且针对创伤弧菌的血清抗体水平均远远高于fkv组。
81.实施例5血清中免疫相关活性酶水平测定
82.(1)碱性磷酸酶(alkaline phosphatase,akp)活性:
83.血清中akp活性使用南京建成试剂盒(a059
‑
2)测定。在96孔酶标板中加入5μl待测血清、酚标准品(0.1mg/ml)、蒸馏水,每孔加入50μl缓冲液、50μl基质液混匀后37℃水浴15min,然后加入150μl显色液。轻轻混匀,在520nm处测量吸光值,每组重复五次。
84.(2)酸性磷酸酶(acid phosphatase,acp)活性:
85.按照南京建成试剂盒(a060
‑
2)说明书测定,在96孔板中加入4μl待测血清、酚标准品(0.1mg/ml)、蒸馏水,每孔加入40μl缓冲液、40μl基质液混匀后37℃水浴30min,然后加入
80μl碱液和80μl显色液。轻轻混匀,静止10min后在520nm处测量吸光值。
86.(3)总超氧化性歧化酶(total superoxide dismutase,t
‑
sod)活性:
87.由于黄嘌呤及其氧化酶反应可产生超氧阴离子自由基,它可氧化成亚硝酸盐在显色剂下呈紫红色。因此,按照南京建成试剂盒(a001
‑
1)说明书中指示的各试剂的剂量及顺序在550nm进行测定。
88.(4)溶菌酶(lysozyme)活性:
89.溶菌酶使用南京建成试剂盒(a050
‑1‑
1)测定。实验前将试剂水浴至37℃,在48孔酶标板中加入0.1ml待测血清、标准品(2.5μg/ml),然后吸取1ml的应用菌液(micrococcus lysodeikticus)迅速冲入孔中并混匀,分别在20s、2min20s时在530nm测定吸光值。
90.以上实验所用血清均稀释两倍后进行测定,并按照试剂盒说明书上指示的公式进行四种酶活力的计算。
91.结果表明,接种后14天的tkv组血清中akp、acp、溶菌酶和t
‑
sod活性达到峰值,明显高于fkv组和pbs组图(p<0.01),分别是fkv组的1.25、1.22、1.43和1.23倍(图4)。在fkv组中,akp和acp的活性在接种后14d最高(图4中的a和b),但溶菌酶和t
‑
sod的活性在接种后21d达到峰值(图4中的c和d)。这些结果表明,与fkv组相比,tc38灭活的疫苗不仅可以诱导血清中更高的酶活性,而且还可以诱导溶菌酶和t
‑
sod达到峰值的时间提前。
92.实施例6血清抗体效价的测定
93.1、测定方法
94.(1)创伤弧菌培养至对数生长中期后,用无菌pbs清洗重悬至5
×
107cfu/ml;
95.(2)将免疫第7d、14d、21d和28d的免疫组及对照组血清使用pbs按2
n
进行梯度稀释;
96.(3)取30μl稀释好的血清与10μl重悬菌液在96孔板中混合均匀,在37℃孵育3h后,吸取10μl孵育液滴加在载玻片上,在正置显微镜下观察,血清的最后一次稀释产生可见沉淀作为凝集抗体滴度。
97.2、实验结果:
98.用免疫凝集实验分别对免疫组和对照组的血清抗体水平进行检测,结果表明,在接种后第7d、14d、21d和28d,在tkv组和fkv组的血清中均检测到了抗体,tkv组的血清抗体水平均显著高于fkv组(p<0.05),分别是fkv组的9.97、4.44、8.88和8.80倍(图5中的a)。随后对大菱鲆头肾igm表达水平的分析表明,在接种疫苗后的第7d和21d,tkv组鱼头肾中的相对igm表达水平均显著高于fkv组(p<0.01),分别是fkv组的3.71和2.11倍(图5中的b)。
99.实施例7血清凝集实验
100.1、方法和步骤
101.(1)将创伤弧菌培养至od
600
=0.8,将菌液离心、清洗并重悬于2ml无菌pbs中,蘸取少量异硫氰酸荧光素(fitc)于重悬菌液中,28℃避光50rpm孵育5h;
102.(2)将孵育液离心清洗3次后,使用无菌pbs将菌沉淀重悬至1
×
108cfu/ml,取各组免疫第21d的10μl血清与10μl菌液28℃孵育3h;
103.(3)取8μl孵育液固定在玻璃玻片上,用荧光显微镜观察凝集情况,若镜头下细菌数量过多可稀释一定倍数进行观察。
104.2、实验结果:
105.疫苗免疫21d后在tkv组(图6中的a)和fkv组(图6中的b)中均可使创伤弧菌产生凝集反应。tkv组的细菌凝集水平明显高于fkv组,在对照组中,没有创伤弧菌的细菌凝集(图6中c)。这些结果表明,血清抗体是由创伤弧菌表面的抗原诱导的,tkv组的血清抗体的结合活性高于fkv组的血清抗体的结合活性(图6)。
106.对大菱鲆头肾中igm表达水平的分析表明,接种疫苗后第7d和21d时,tkv组鱼体头肾中的相对igm水平比fkv组显著上调,与血清抗体水平基本对应。此外,利用fitc标记的创伤弧菌与免疫第21d的血清孵育进一步验证鱼体产生的抗体水平及特性,结果tkv组可以明显观察到凝集成团的创伤弧菌,凝集效果要高于fkv组,表明对应的血清抗体是由创伤弧菌细胞的表面抗原诱导产生。这些结果表明,tc38新型灭活疫苗不仅可提高非特异性免疫应答水平,也可增强特异性免疫应答如血清抗体水平。
107.实施例8免疫基因表达分析
108.(1)取出
‑
80℃保存的肝、脾、肾组织冰上放置,使用组织研磨液研磨匀浆后在rnaprep pure cell/becteria kit试剂盒指示下提取组织的总rna,放置
‑
80℃保存;
109.(2)反转录使用fastking rt kit试剂盒,取各组8μl的总rna与2μl 5
×
gdna buffer 42℃孵育3min;
110.(3)按2μl的10
×
fast rt buffer、1μl的rt enzyme mix、2μl的fq
‑
rt primer mix并用rnase
‑
free ddh2o补足到10μl,配成mix;
111.(4)将(2)与(3)混合均匀后,42℃15min,95℃3min,4℃5min条件下孵育,将所得到的cdna放在
‑
80℃保存;
112.(5)使用sybr green premix pro taq hs qpcr kit试剂盒用于扩增c3、igm、il
‑
1β、mhc iα、mhc iiα、mx、nkef、tcrα、tlr3、tnf
‑
α、il
‑
8r、ifn
‑
γ和cd40,内参基因使用β
‑
actin。反应引物列于表1,反应体系如表2所示,使用罗氏lightcycler 96 system仪器进行扩增,程序为95℃持续30s,随后是40个循环,95℃持续5s,60℃持续30s。
113.表1用于定量实时聚合酶链反应的引物
114.[0115][0116]
表2荧光定量pcr反应体系
[0117][0118]
通过qrt
‑
pcr检测tkv免疫对大菱鲆头肾免疫相关基因表达的影响,结果如图7所示,在免疫后21d,大菱鲆肾脏中tkv组的c3、il
‑
1β、mhc iiα、mx、nkef、tcrα、tlr3、tnf
‑
α和
il
‑
8r的表达量明显高于fkv组(p<0.01),分别是fkv组的2.76、19.29、2.42、12.91、6.11、2.9、3.88、4.30、和2.33倍;mhc iα和ifn
‑
γ的表达三组无明显差别(p>0.05)。上述结果表明,tkv相对于fkv可更有效地诱导细胞因子的产生,这可能与tc38处理创伤弧菌后能够保留相对完整的抗原成分,从而能增强对机体的免疫刺激效应有关。
[0119]
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1