溶瘤病毒和免疫相关药物在协同抑制实体瘤中的应用的制作方法
1.本发明涉及生物医药技术领域,具体地涉及溶瘤病毒联合免疫相关药物协同抑制实体瘤中的应用及其相关药物。
背景技术:
2.重组人5型腺病毒(h101,安柯瑞,)是上海三维生物技术有限公司2006年上市的重组人5型腺病毒溶瘤病毒药物,目前安柯瑞已经生产12万支产品,主要用于头颈癌的治疗。在临床研究中发现,安柯瑞在进行瘤内注射并在肿瘤组织局部加热的条件下会产生对远端肿瘤的治疗效果。这是由安柯瑞在溶瘤过程中将肿瘤细胞表面或细胞内部的肿瘤特异性抗原呈递给免疫细胞,引发机体的抗肿瘤免疫反应所产生的。
3.同样可以使机体产生抗肿瘤免疫反应的包括免疫刺激因子、免疫检查点抑制剂和肿瘤特异性抗原等。其中人粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,gm-csf)作为一种免疫刺激因子能够活化抗原提呈细胞(antigen presenting cells,apcs),主要为树突状细胞(dc)和巨噬细胞,apc通过处理和递呈肿瘤抗原而激活t细胞,达到杀伤肿瘤的作用;免疫检查点抑制剂作为治疗各种癌症的重要治疗手段,已经在临床应用中已经取得了成效;肿瘤特异性抗原能够诱导免疫应答,可以有多种呈递方式,包括腺病毒、腺相关病毒、dna或rna疫苗等。
4.目前由于实体瘤的深部和内部缺乏淋巴细胞浸润,抗肿瘤的浸润性淋巴细胞可能受到各种免疫抑制机制的限制,其免疫治疗的效果受到影响。
5.因此,本领域迫切需要研发一种新的治疗实体瘤的方法。
技术实现要素:
6.本发明的目的就是提供了一种有效治疗肿瘤的治疗方法和药物,具体地本发明提供了重组人5型腺病毒与免疫相关药物在协同治疗肿瘤中的用途。
7.本发明的第一方面,提供了一种活性成分组合的用途,其特征在于,所述活性成分组合包括第一活性成分溶瘤病毒和第二活性成分免疫相关药物,并且所述组合用于制备协同治疗实体瘤的药物组合物或药盒。
8.在另一优选例中,所述的溶瘤病毒为重组人5型腺病毒。
9.在另一优选例中,所述的溶瘤病毒为商品名为安柯瑞的重组人5型腺病毒注射液。
10.在另一优选例中,在所述的溶瘤病毒的基因组中,删除了人5型腺病毒的e1b-55kda和e3区基因片段。
11.在另一优选例中,所述的免疫相关药物选自下组:免疫刺激因子、免疫检查点抑制剂、肿瘤特异性抗原或其组合。
12.在另一优选例中,所述的免疫刺激因子为粒细胞-巨噬细胞集落刺激因子(gm-csf)。
13.在另一优选例中,所述的免疫检测点抑制剂选自下组:特异性结合ctla4的抗
ctla4抗体或其抗原结合片段,特异性结合pd1的抗pd1抗体或其抗原结合片段,特异性结合pd-l1的抗pd-l1抗体或其抗原结合片段,或其组合。
14.在另一优选例中,所述的肿瘤特异性抗原选自下组:sage1、ny-eso-1、gp33、gp100、tx103、mucin-1、wt-1、mart-1、mage a1、mage a3、mage a4、mage b2、prame、survivin、mart-1、col6a3、tyrosinase、t antigen、slc45a2、vcx/y、hpv、甲胎蛋白、癌胚抗原、ca 125、her2、多巴色素互变异构酶、bage蛋白、gage蛋白、存活蛋白、酪氨酸酶、ssx2、细胞周期蛋白-a1、kif20a、muc5ac、meloe、lengsin、激肽释放酶4、igf2b3、磷脂酰肌醇蛋白聚糖或其组合。
15.在另一优选例中,所述的溶瘤病毒根据肿瘤体积以0.5
×
10
12
vp至2.5
×
10
12
vp的剂量施用。
16.在另一优选例中,所述的实体瘤选自下组:鼻咽癌、软骨肉瘤、结肠癌、dukes's d或非小细胞肺癌、乳腺癌、前列腺癌、卵巢癌、恶性肝癌、食管癌、小细胞肺癌、肺癌、结直肠癌、胃癌、宫颈癌、黑色素瘤或其组合。
17.在另一优选例中,所述实体瘤还存在转移的远端肿瘤。
18.在另一优选例中,所述实体瘤为结直肠癌。
19.本发明的第二方面,提供了一种活性成分组合,所述组合由溶瘤病毒和免疫相关药物构成。
20.在另一优选例中,所述溶瘤病毒是指重组人5型腺病毒或具有相同功能的衍生物,较优地,为重组人5型腺病毒。
21.在另一优选例中,所述的溶瘤病毒为商品名为安柯瑞的重组人5型腺病毒注射液。
22.在另一优选例中,在所述的溶瘤病毒的基因组中,删除了人5型腺病毒的e1b-55kda和e3区基因片段。
23.在另一优选例中,所述的免疫相关药物选自下组:免疫刺激因子、免疫检查点抑制剂、肿瘤特异性抗原或其组合。
24.在另一优选例中,所述的免疫刺激因子为粒细胞-巨噬细胞集落刺激因子(gm-csf)。
25.在另一优选例中,所述的免疫检测点抑制剂选自下组:特异性结合ctla4的抗ctla4抗体或其抗原结合片段,特异性结合pd1的抗pd1抗体或其抗原结合片段,特异性结合pd-l1的抗pd-l1抗体或其抗原结合片段,或其组合。
26.在另一优选例中,所述的肿瘤特异性抗原选自下组:sage1、ny-eso-1、gp33、gp100、tx103、mucin-1、wt-1、mart-1、mage a1、mage a3、mage a4、mage b2、prame、survivin、mart-1、col6a3、tyrosinase、t antigen、slc45a2、vcx/y、hpv、甲胎蛋白、癌胚抗原、ca 125、her2、多巴色素互变异构酶、bage蛋白、gage蛋白、存活蛋白、酪氨酸酶、ssx2、细胞周期蛋白-a1、kif20a、muc5ac、meloe、lengsin、激肽释放酶4、igf2b3、或磷脂酰肌醇蛋白聚糖或其组合。
27.在另一优选例中,所述的肿瘤特异性抗原为载有所述抗原基因的腺病毒、腺相关病毒、dna或rna疫苗。
28.本发明的第三方面,提供了一种药物组合物,所述的药物组合物包括(a)溶瘤病毒、(b)免疫相关药物和(c)药学上可接受的载体。
29.在另一优选例中,所述溶瘤病毒是指重组人5型腺病毒或具有相同功能的衍生物,较优地,为重组人5型腺病毒。
30.在另一优选例中,所述的溶瘤病毒为商品名为安柯瑞的重组人5型腺病毒注射液。
31.在另一优选例中,在所述的溶瘤病毒的基因组中,删除了人5型腺病毒的e1b-55kda和e3区基因片段。
32.在另一优选例中,所述的免疫相关药物选自下组:免疫刺激因子、免疫检查点抑制剂、肿瘤特异性抗原或其组合。
33.在另一优选例中,所述的药物组合物包括重组人5型腺病毒、免疫检查点抑制剂和免疫刺激因子。
34.在另一优选例中,所述的药物组合物包括重组人5型腺病毒和肿瘤特异性抗原。
35.本发明的第四方面,提供了一种药盒,所述药盒包括:
36.(a)第一制剂,所述第一制剂含有溶瘤病毒以及药学上可接受的载体;
37.(b)第二制剂,所述第二制剂含有免疫相关药物以及药学上可接受的载体;
38.(c)说明书,所述说明书描述了将溶瘤病毒和免疫相关药物联用以治疗实体瘤的方法。
39.在另一优选例中,所述的第一制剂和第二制剂是各自独立的。
40.在另一优选例中,所述的第一制剂和第二制剂为冻干制剂或液态制剂。
41.在另一优选例中,所述的第一制剂和第二制剂是注射剂。
42.在另一优选例中,所述的第一制剂在施用第二制剂之前、之中或之后被施用。
43.在另一优选例中,所述第一制剂的施用方式为瘤内注射,第二制剂的施用方式为静脉、腹腔或瘤内注射。
44.在另一优选例中,所述的溶瘤病毒为商品名为安柯瑞的重组人5型腺病毒注射液。
45.在另一优选例中,在所述的溶瘤病毒的基因组中,删除了人5型腺病毒的e1b-55kda和e3区基因片段。
46.在另一优选例中,所述的免疫相关药物选自下组:免疫刺激因子、免疫检查点抑制剂、肿瘤特异性抗原或其组合。
47.本发明的第五方面,提供了一种治疗实体瘤的方法,包括步骤:对有需要的对象施用如权利要求6所述活性成分组合和/或如权利要求7所述的药物组合物,从而治疗实体瘤。
48.在另一优选例中,所述有需要的对象为人类或非人类哺乳动物。
49.在另一优选例中,所述的非人类哺乳动物包括猴、猩猩、牛、猪、狗、羊、兔或鼠。
50.在另一优选例中,所述有需要的对象为小鼠。
51.在另一优选例中,所述有需要的对象患有肿瘤。
52.在另一优选例中,所述实体瘤选自下组:鼻咽癌、软骨肉瘤、结肠癌、dukes's d或非小细胞肺癌、乳腺癌、前列腺癌、卵巢癌、恶性肝癌、食管癌、小细胞肺癌、肺癌、结直肠癌、胃癌、宫颈癌、黑色素瘤或其组合。
53.在另一优选例中,所述方法包括:a)对有需要的对象施用溶瘤病毒;和b)对所述有需要的对象施用一种或多种免疫相关药物。
54.在另一优选例中,所述方法包括:对所述对象同时施用溶瘤病毒和免疫相关药物。
55.在另一优选例中,所述方法包括:在施用溶瘤病毒之后的1-6天,对所述对象施用
免疫相关药物。
56.在另一优选例中,所述溶瘤病毒为重组人5型腺病毒。
57.在另一优选例中,所述的免疫相关药物为抗pd-1单抗。
58.在另一优选例中,所述的免疫相关药物包括抗pd-1单抗和粒细胞-巨噬细胞集落刺激因子(gm-csf)。
59.在另一优选例中,所述的免疫相关药物为载有sage1的腺病毒。
60.在另一优选例中,所述重组人5型腺病毒的施用方式为瘤内注射。
61.在另一优选例中,所述免疫相关药物的施用方式可以为静脉、腹腔或瘤内注射。
62.在另一优选例中,所述方法还包括向需要的对象施用治疗肿瘤的支持性治疗药物。
63.在另一优选例中,所述的支持性治疗药物包括:抗生素、止痛药物、营养药物或其组合。
64.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
65.图1.安柯瑞与anti-mpd-1和/或mgm-csf联合治疗治疗开始后小鼠结直肠癌mc38的生长曲线。其中数据以均数
±
标准误表示,d20天后的肿瘤生长曲线因小鼠肿瘤体积达到终点后安乐死而出现波动,未予显示。
66.图2.安柯瑞与anti-mpd-1和/或mgm-csf联合治疗治疗开始后实验动物生存曲线。
具体实施方式
67.本发明人经过广泛而深入的研究,首次意外地发现,当特定的重组人5型腺病毒与特定的免疫相关药物联用时,在治疗实体瘤方面具有协同的治疗效果。实验表明,联合运用重组人5型腺病毒与免疫相关药物能够有效抑制实体瘤的生长,其效果远优于二者的加合作用,并且可以显著降低使用传统治疗方案的副作用。在此基础上,完成了本发明。
68.术语说明
69.如本文所用,术语“第一活性成分”指重组人5型腺病毒,或溶瘤病毒。应理解,该术语包括与重组人5型腺病毒具有相同功能的衍生物。
70.如本文所用,术语“第二活性成分”指免疫相关药物,包括免疫刺激因子、免疫检查点抑制剂或肿瘤特异性抗原。
71.如本文所用,术语“本发明的活性成分组合”、“本发明的物质组合”、“本发明的药物成分组合”可互换使用,指上述第一活性成分和第二活性成分的组合。
72.如本文所用,术语“本发明的药物组合物”指包括或含有第一活性成分(或含所述第一活性成分的第一制剂)和第二活性成分(或含所述第二活性成分的第二制剂)的组合物,其中,所述的第一制剂和第二制剂可以是相同或不同的制剂。此外,第一制剂和第二制剂可以是同一制剂,或各自独立的制剂。
73.免疫检测点抑制剂
74.在本发明的一个优选例中,本发明所述的免疫相关药物包括免疫检测点抑制剂,所述免疫检测点抑制剂选自下组:特异性结合ctla4的抗ctla4抗体或其抗原结合片段,特异性结合pd-1的抗pd-1抗体或其抗原结合片段,特异性结合pd-l1的抗pd-l1抗体或其抗原结合片段,或其组合。ctla4,pd-1以及pd-l1通过抑制t细胞激活从而抑制机体免疫应答,使肿瘤细胞发生免疫逃逸。通过使用上述的免疫检测点抑制剂,解除对机体免疫系统的抑制,激活t细胞,对肿瘤细胞进行杀伤。
75.在本发明的优选实施例中,所述免疫检测点抑制剂为抗pd-1单克隆抗体。
76.pd-1和pd-l1
77.pd-1为程序性死亡受体1,也称为cd279(分化簇279),是一种重要的免疫抑制分子。pd-1通过向下调节免疫系统对人体细胞的反应,以及通过抑制t细胞炎症活动来调节免疫系统并促进自身耐受。pd-1是免疫检查点,通过两种机制防止自身免疫。首先,它促进淋巴结中抗原特异性t细胞的凋亡(程序性细胞死亡)。其次,它减少了调节性t细胞(抗炎,抑制性t细胞)的细胞凋亡。pd-1与其配体pd-l1结合启动t细胞的程序性死亡,使肿瘤细胞获得免疫逃逸。
78.在本发明中,给受试小鼠注射抗pd-1单克隆抗体后,其通过与小鼠免疫细胞表面的pd-1结合,阻断了pd-l1与pd-1的结合,使得原本处在抑制状态的免疫系统被再次激活,进而攻击体内肿瘤细胞。
79.免疫刺激因子
80.在本发明的一个优选例中,本发明所述的免疫相关药物包括免疫刺激因子。在本发明的实施例中,所述免疫刺激因子是指粒细胞-巨噬细胞集落刺激因子(gm-csf)。
81.在一个优选例中,实验表明,采用小鼠粒细胞-巨噬细胞集落刺激因子(mgm-csf)并联合溶瘤病毒和抗pd-1单克隆抗体使用时,对小鼠实体瘤具有协同的更为显著的抑制作用。
82.肿瘤特异性抗原
83.在本发明的一个优选例中,本发明所述的免疫相关药物包括肿瘤特异性抗原。术语“肿瘤特异性抗原”是指仅表达于某种肿瘤细胞表面而不存在于正常细胞上的新抗原,故又称独特肿瘤抗原。其大多是癌基因或抑癌基因的突变产物,通过mhc-i分子递呈于肿瘤细胞表面,能够被cd8+t细胞特异性识别和结合。
84.本发明所用的肿瘤特异性抗原是指通过体外重组技术制备的载有所述抗原基因的腺病毒、腺相关病毒、dna或rna疫苗,诱导免疫应答,实现对肿瘤细胞的杀伤。
85.在本发明的一个优选例中,所用肿瘤特异性抗原为sage1腺病毒(ad-sage1),所述sage1腺病毒为通过体外重组技术制备的载有所述sage1抗原基因的腺病毒。在本发明的实施例中,实验表明,当采用sage1腺病毒(ad-sage1)并联合溶瘤病毒使用时,对小鼠肿瘤也具有系统的更为显著的抑制作用。
86.药物组合物以及给药方式
87.本发明还提供一种可用于协同治疗实体瘤的组合物,它可用于抑制肿瘤生长和/或转移。
88.本发明的药物组合物包括:有效量的重组人5型腺病毒,和有效量的免疫相关药物,以及药学上可接受的载体。
89.通常,可将本发明的重组人5型腺病毒,或免疫相关药物配制于无毒的、惰性的和药学上可接受的载体介质中,其中ph通常约为5-8,较佳地,ph约为6-8。
90.如本文所用,“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
91.术语指这样一些药剂载体:它们本身并不是必要的活性成分,且施用后没有过分的毒性。合适的载体是本领域普通技术人员所熟知的。在组合物中药学上可接受的载体可含有液体,如水、盐水、缓冲液。另外,这些载体中还可能存在辅助性的物质,如填充剂、润滑剂、助流剂、润湿剂或乳化剂、ph缓冲物质等。所述的载体中还可以含有细胞转染试剂。
92.如本文所用,术语“有效量”或“有效剂量”是指可对人和/或动物和/或细胞产生功能或活性的且可被人和/或动物所接受的量。
93.如本文所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、聚山梨酯、乙醇及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物可以被制成针剂形式,例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。活性成分的给药量是治疗有效量。本发明的药物制剂还可制成缓释制剂。
94.此外,本发明的活性成分组合还可与其他治疗剂(如抗肿瘤剂或化疗剂)一起使用。
95.使用药物组合物时,是将安全有效量的活性成分组合(包括第一活性成分(或其制剂)和/或第二活性成分(或其制剂))施用于哺乳动物。
96.应理解,本发明所述活性成分组合中第一活性成分(或其制剂)和/或第二活性成分(或其制剂)的有效量,可随给药的模式和肿瘤的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:药代动力学参数例如生物利用率、代谢、半衰期等;肿瘤的严重程度、患者的体重、患者的免疫状况、给药的途径等。
97.典型地,对于第一活性成分,其治疗有效量通常至少为0.5
×
10
12
vp至2.5
×
10
12
vp,当然,具体剂量还应考虑肿瘤体积、病人健康状况等因素,这些都是熟练医师技能范围之内的。
98.对于第二活性成分,一个典型的例子如免疫检查点抑制剂,其安全有效量通常至少约1mg/kg体重,而且在大多数情况下不超过约20mg/kg体重,较佳地该剂量是约2mg/kg体重至10mg/kg体重。当然,具体剂量还应考虑所用药物的种类、剂型、给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
99.对于第二活性成分,另一个典型的例子如免疫刺激因子,其安全有效量通常至少约2~10μg/kg体重,较佳地该剂量是约3μg/kg体重至5μg/kg体重。当然,具体剂量还应考虑所用药物的种类、剂型、给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
100.对于第二活性成分,另一个典型的例子如肿瘤特异性抗原,其具体剂量应考虑所用肿瘤体积、病人健康状况等因素,这些都是熟练医师技能范围之内的。
101.本发明所述的药物组合物的给药方式没有特别限制,代表性的例子包括(但并不限于):瘤内注射、腹腔注射、静脉注射。
102.药盒
103.本发明提供一种药盒,所述药盒包括:
104.组分(1):含有重组人5型腺病毒的制剂;
105.组分(2):含免疫相关药物的制剂;
106.组分(3):说明书。
107.所述的含有重组人5型腺病毒的制剂包括(但并不限于):冻干剂、液体制剂或注射液。
108.所述的免疫相关药物的制剂包括(但并不限于):冻干剂、液体制剂、或注射液。
109.典型地,药盒中装有一个或多个(如至少两个)含有重组人5型腺病毒的单元剂型和一个或多个(如至少两个)含有免疫相关药物的单元剂型;较佳地各为4-10个。
110.如本文所用,术语“单元剂型”是指为了施用方便,将组合物制备成单次施用所需的剂型,包括但不限于各种固体剂(如片剂)、液体剂、胶囊剂、缓释剂。
111.在本发明中,重组人5型腺病毒的单元剂型通常为液体剂。
112.本发明提供的说明书中可以有如下描述:所述药盒的使用方法是同时使用含有重组人5型腺病毒的单元剂型和含有免疫相关药物的单元剂型。
113.本发明提供的药盒通过下述步骤制备得到:将含有重组人5型腺病毒的制剂和含有免疫相关药物的制剂,以及说明书一起放置,形成药盒。
114.所述的含有重组人5型腺病毒的制剂优选含有重组人5型腺病毒的单元剂型,所述含有免疫相关药物的制剂优选含有免疫相关药物的单元剂型。
115.所述步骤优选将至少一个含有重组人5型腺病毒的单元剂型和至少一个含有免疫相关药物的单元剂型,以及说明书一起放置,形成药盒。
116.本发明的主要优点在于:
117.(1)本发明首次发现,重组人5型腺病毒联合免疫相关药物可以更好地抑制实体瘤的生长,基于此提出了溶瘤病毒联合免疫相关药物用于治疗实体瘤的药物组合。
118.(2)本发明所提出的药物组合,在显著抑制肿瘤生长的情况下,不引发其他药物不良反应和毒副作用。
119.(3)本发明提出的溶瘤病毒联合免疫相关药物的药物组合治疗,为实体瘤的治疗提供了新思路。
120.(4)通过重组人5型腺病毒对肿瘤组织内部的溶瘤作用,可以增加淋巴细胞浸润,联合给予免疫刺激因子、免疫检查点抑制剂/和或肿瘤特异性抗原,可以成为一种新的治疗实体瘤的方法。
121.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。除非特别说明,否则本发明实施例中所用材料和试剂均为市售产品。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重
量份数。
122.实验材料
123.重组人5型腺病毒注射液,商品名为安柯瑞,可购自上海三维生物技术有限公司,规格为1.87
×
10
12
vp/ml;
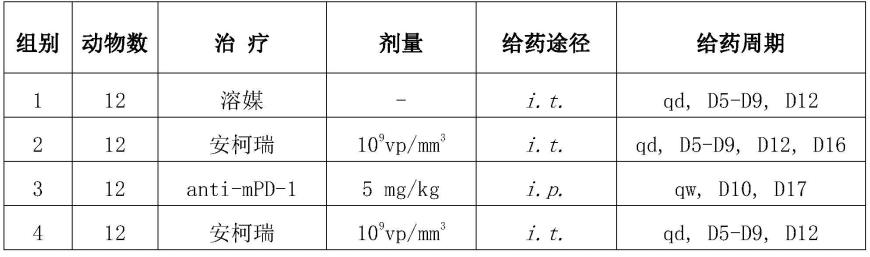
124.anti-mpd-1(invivomab anti-mouse pd-1)由bioxcell提供,规格为6.78mg/ml;
125.mgm-csf(recombinant mouse gm-csf,重组小鼠粒-巨噬细胞集落刺激因子)由novoprotein提供,规格为50μg/支。
126.磷酸盐缓冲液、胎牛血清、dmem培养基均购自gibco公司;
127.胰蛋白酶-edta消化液(0.25%)和青霉素-链霉素混合液(100
×
)购自solarbio公司;
128.小鼠结直肠癌mc38肿瘤细胞购自普如汀生物技术(北京)有限公司(biovector ntcc inc.)。
129.实验动物信息如下:
130.种属品系:mus musculus,c57bl/6j
131.周龄:8周
132.性别:雄性
133.体重:20-23g
134.数量:75只
135.实验动物提供商:南京大学-南京生物医药研究院
136.生产许可证号:scxk(苏)2015-0001
137.质量合格证号:201802616
138.实验动物饲养在spf级恒温恒湿的层流清洁房间内,使用独立通风笼具ivc,每5只鼠一笼。温度/湿度控制在(23
±
3)℃/40-70%范围内。
139.动物体内药效试验方法
140.(1)细胞培养
141.用含有灭活的10%胎牛血清,100u/ml的青霉素和100μg/ml的链霉素以及2mm谷氨酰胺的dmem培养基在37℃、5%co2的培养箱中培养小鼠结直肠癌mc38肿瘤细胞,每隔3天左右待细胞长满后分瓶传代,将处于对数生长期的肿瘤细胞用于体内肿瘤的接种。
142.(2)肿瘤细胞接种与分组
143.pbs重悬的mc38肿瘤细胞,浓度为3
×
107个/ml,接种于实验动物的右侧胁肋部皮下,100μl/只,在接种后5天(记为d5)平均肿瘤体积达到77mm3左右时分组给药。
144.(3)小鼠实验检测指标
145.a.肿瘤体积:每周使用游标卡尺对肿瘤体积进行3次的测量,测量肿瘤的长径和短径,其体积计算公式为:体积=0.5
×
长径
×
短径2。
146.b.动物给药后的反应:在进行肿瘤体积测量的同时,称量小鼠体重。记录小鼠体重的变化与给药时间的关系。同时观察小鼠的存活情况和健康状况如给药期间动物活动、进食等一般状态。
147.c.生存期:记录单只小鼠在肿瘤接种后肿瘤体积超过3000mm3时的天数,定义为其生存期。
148.d.肿瘤称重、拍照:在实验结束时,剥离肿瘤后称重并拍照。
149.统计学分析
150.应用one-way anova检验以及log rank检验对肿瘤体积和生存期进行组间统计学分析,p《0.05认为有显著性差异。
151.实施例1
152.安柯瑞与anti-mpd-1和/或mgm-csf联合治疗mc38皮下荷瘤小鼠
153.(1)采用上文所述方法建立mc38皮下荷瘤小鼠模型,用空白对照(溶媒对照、安柯瑞、anti-mpd-1(invivomab anti-mouse pd-1)、安柯瑞+anti-mpd-1、mgm-csf+安柯瑞+anti-mpd-1分别给药,按照表1所示给药方案对小鼠给药。
154.表1安柯瑞与anti-mpd-1和/或mgm-csf联合给药方案
[0155][0156][0157]
注:anti-mpd-1的给药容积为10μl/g体重,mgm-csf给药容积为100μl/鼠,安柯瑞的给药容积为109vp/mm3,按照根据治疗前肿瘤体积范围进行调整(见表2):
[0158]
表2安柯瑞给药容积调整范围
[0159][0160]
(2)试验结果
[0161]
计算各治疗组与溶媒对照组的t/c(%)(如表3所示)。在溶媒对照组结束实验时(d20),溶媒对照组、安柯瑞组、anti-mpd-1组、安柯瑞+anti-mpd-1组、mgm-csf+安柯瑞+anti-mpd-1组的肿瘤体积分别为4870mm3、2537mm3、3942mm3、1848mm3、1756mm3,各药物治疗组肿瘤体积与溶媒对照组相比,均有极显著性差异(均p《0.001),相应的肿瘤生长抑制率分别为48%、19%、62%、64%;安柯瑞+anti-mpd-1组和mgm-csf+安柯瑞+anti-mpd-1组平均生存期均与安柯瑞组比较或与anti-mpd-1组比较,有显著性差异(均p《0.05)。
[0162]
各组小鼠的生存期数据如表4所示,生存期曲线如图2所示。溶媒对照组、安柯瑞组、anti-mpd-1组、安柯瑞+anti-mpd-1组、mgm-csf+安柯瑞+anti-mpd-1组的平均生存期分别为18、21.5、20、25、25天,各药物治疗组中位生存期与溶媒对照组相比,均有极显著性差异(均p《0.01),安柯瑞+anti-mpd-1组和mgm-csf+安柯瑞+anti-mpd-1组的平均生存期与安柯瑞组比较或与anti-mpd-1组比较,均有显著性差异(均p《0.05)。
[0163]
表3受试物对小鼠结直肠癌mc38的抑瘤作用(肿瘤体积)
[0164][0165][0166]
注:*溶媒对照组在d20结束实验,其余组继续观察,治疗后肿瘤体积数据取d20时测量结果进行比较。
[0167]
a.均数
±
标准误;
[0168]
b.与安柯瑞组比较或与anti-mpd-1组比较,p《0.05。
[0169]
表4受试物对小鼠结直肠癌mc38的抑瘤作用(生存期)
[0170]
组别治疗动物数(只)平均生存期(天)pb1溶媒1218
‑‑
2安柯瑞1221.5
‑‑
3anti-mpd-11220
‑‑
4安柯瑞+anti-mpd-11025<0.055mgm-csf+安柯瑞+anti-mpd-11025<0.05
[0171]
注:单只小鼠肿瘤体积超过3000mm3时达到生存期终点;
[0172]
b.与安柯瑞组比较或与anti-mpd-1组比较,p《0.05。
[0173]
结果表明:
[0174]
(i)安柯瑞单用及其与anti-mpd-1、mgm-csf+anti-mpd-1联合对小鼠结直肠癌mc38皮下瘤模型均显示出抗肿瘤作用;
[0175]
(ii)安柯瑞+anti-mpd-1、mgm-csf+安柯瑞+anti-mpd-1的联合给药可以有效地抑制mc38肿瘤生长,并显著优于anti-mpd-1或安柯瑞单用。
[0176]
(iii)mgm-csf+安柯瑞+anti-mpd-1的联合给药对肿瘤生长的抑制作用也优于安柯瑞+anti-mpd-1联合给药。
[0177]
(iv)安柯瑞+anti-mpd-1、mgm-csf+安柯瑞+anti-mpd-1的联合给药与anti-mpd-1或安柯瑞单用相比,可显著延长小鼠的生存期。
[0178]
实施例2
[0179]
安柯瑞与载有sage1的腺病毒(ad-sage1)联合给药
[0180]
(1)采用上文所述方法建立mc38皮下荷瘤小鼠模型,按照表5所示给药方案对小鼠给药。
[0181]
表5安柯瑞与载有sage1的腺病毒(ad-sage1)联合给药方案
[0182][0183]
(2)试验结果
[0184]
计算各治疗组与溶媒对照组的t/c(%)(如表6所示)。结果表明,安柯瑞与ad-sage1联用对小鼠结直肠癌的肿瘤生长抑制率比单独使用安柯瑞或ad-sage1提高了约20%,具体显著的协同效果,并且不会产生额外的毒副作用。说明安柯瑞与肿瘤特异性抗原联合用药可以增强安柯瑞的肿瘤治疗效果。
[0185]
表6受试物对小鼠结直肠癌mc38的抑瘤作用(肿瘤体积)
[0186][0187]
注:*溶媒对照组在d20结束实验,其余组继续观察,治疗后肿瘤体积数据取d20时测量结果进行比较。
[0188]
a.均数
±
标准误;b.与安柯瑞组或与ad-sage1组比较,p《0.05。
[0189]
综上所述,动物实验结果表明,重组人5型腺病毒与免疫刺激因子、免疫检查点抑制剂、肿瘤特异性抗原联合施用,均对肿瘤生长发挥了显著优于单用重组人5型腺病毒或免疫刺激因子、免疫检查点抑制剂、肿瘤特异性抗原的抑制效果。
[0190]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1