靶向CYP1B1酶的NIR/PET双模态探针前体及其制备和用途
靶向cyp1b1酶的nir/pet双模态探针前体及其制备和用途
技术领域
1.本发明涉及分子探针技术领域,具体地,涉及靶向cyp1b1酶的nir/pet双模态探针前体及其制备和用途。
背景技术:
2.分子成像是肿瘤诊断的常用方法之一,其指通过分子影像学手段,无创性的显示细胞水平的某个特定分子并实时监测其变化,从影像学方面对一些生物学行为进行观测从而定性或定量研究,可有效提高早期诊断成功的可能性。分子影像学利用分子探针与生物标记物特异性结合,借用分子探针的成像获得信号,通过监测信号变化而对所靶向的生物标记物进行监测。故在技术层面不仅要求分子探针与靶向部位有强亲和力,同时要求其具有细胞膜的穿透性与无毒性。
3.常用的分子影像学手段包括光学成像、磁共振成像(magnetic resonance imaging,mri)、计算机断层扫描成像(computed tomography,ct)、正电子发射断层扫描成像(positron emission tomography,pet)、单光子发射计算机断层扫描成像(single photon emission computed tomography,spect)、超声(ultrasound,us)等,各种成像技术在对于癌症的诊断、分期和治疗上都有一定的缺陷,但也拥有其独特的优势。
4.近红外荧光(near infrared,nir)染料是一类聚甲菁染料的杂环化合物,吸收及发射光谱均处于近红外(700
‑
1000nm)波段。其优点包括良好的组织渗透性和无毒及无放射性等,符合分子探针的安全性要求。nir成像是一种光学成像技术,其优点是自体荧光干扰低,能够在术中进行实时在体显示肿瘤的位置指导手术的进行,研究证明,这种方法能极大的提高恶性肿瘤的检出率,改善预后。
5.pet成像可准确定量且灵敏度高,出于大多数pet同位素合成困难,价格昂贵,或半衰期极短的考虑,正常情况下它们使用较少,所以半衰期为110分钟的
18
f成为了pet成像的优选,并且
18
f还存在着化学形式多样的优势。正电子发射断层扫描成像技术在早期诊断中占据优势,但仍然存在定位模糊、图像采集时间长等问题。
6.由此可见,单一成像模式存在独有的优势,也会产生局限性,为了弥补单一分子影像学手段存在的不足,医学工作者提出了双模态或者多模态分子探针的概念。这是指在构建分子探针时组合多种成像模式,糅合成像方式之间的优点,将局限性减弱,便于在检测时获得更为精确全面的信息。
7.细胞色素p450(cyp450)酶广泛存在于人体组织中,是可自身氧化的亚铁血红素蛋白家族,属于单氧酶一类,其参与许多内源性底物(如固醇激素类)和外源性物底物(如药物和环境化合物等)的代谢,是肝脏代谢的关键酶,对内环境稳态的维持有着非常重要的作用(c.j.omiecinski,r.p.remmel and v.p.hosagrahara concise review of the cytochrome p450s and their roles in toxicology[j].toxicol sci,1999,2:151
‑
6)。其成员之一cyp1b1作为一种重要的胞内氧化酶,能够催化17
‑
β雌激素羟基化、代谢激活多种前致癌物,如多环芳烃、杂环胺、芳香胺和硝基多环烃等,还能催化产生毒性更高的代谢
中间产物,同时可引起肿瘤细胞对部分抗肿瘤药物产生耐药性,是目前抗肿瘤药物研究中的新靶点(rochat,b.;morsman,j.m.;murray,g.i.;figg,w.d.;mcleod,h.l.human cyp1b1 and anticancer agent metabolism:mechanism for tumor
‑
specific drug inactivation?”j.pharmacol.exp.ther.,2001,296,537
‑
541.)。大量研究表明,cyp1b1酶在包括乳腺癌、肺癌、肾癌和卵巢癌等肿瘤细胞中高表达,而在正常组织中表达水平远低于相应的肿瘤组织。此外,有文献报道芳烃受体(ahr)与其配体结合可诱导cyp1b1的表达,因此作为ahr的配体,稠环芳烃类的前致癌物,如2,3,7,8
‑
四氯二苯并
‑
p
‑
二恶英(tcdd)等可诱导cyp1b1的表达(d.w.nebert and t.p.dalton the role of cytochrome p450 enzymes in endogenous signalling pathways and environmental carcinogenesis[j].nat rev cancer,2006,12:947
‑
60)。由此可见cy1b1同时具备在肿瘤组织中特异性表达和在早期癌变细胞中诱导表达这两个特征,故可见其具有作为肿瘤标记物的用于肿瘤诊断的潜力。鉴于目前用于肿瘤诊断的分子探针特异性不高的问题以及各种单一模态小分子探针的局限性,探索靶向cyp1b1的双模态分子探针在肿瘤早期发现和诊断中的应用价值,有望提高治愈率,降低死亡率,具有重要意义。
技术实现要素:
[0008]
针对现有技术中的缺陷,本发明的目的是提供一种靶向cyp1b1酶的新型nir/pet双模态小分子探针前体及其制备方法和应用。通过对胞内cyp1b1酶的表达水平进行nir及pet显像,为肿瘤的早期诊断及治疗提供新方法,解决目前肿瘤治疗中诊断困难和诊断特异性不高以及近红外单模态分子探针穿透深度有限的问题。nir/pet双模态的分子探针可结合两种模态的优势,未用核素标记时的双模态探针无放射性具有近红外荧光可用于荧光介导的手术,用放射性核素标记后可应用于临床的pet成像,同一个探针可保证手术时(nir成像)切除的肿瘤区域和检查(pet成像)时显示的完全一致。
[0009]
在我们的前期工作中,通过一定的合理修饰,获得了一种选择性好的、仅与cyp1b1酶结合的α
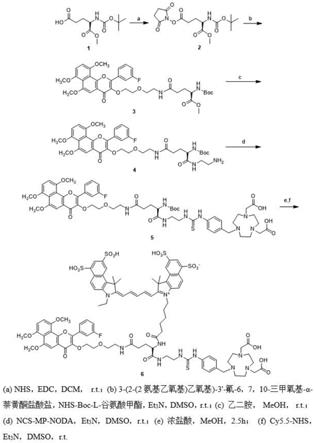
‑
萘黄酮衍生物,通过在3位引入羟基,合成了该化合物的衍生物α
‑
萘黄酮醇,并于3位羟基上引入羟基烷基醇侧链,与氨基酸成酯制备其水溶性的盐酸盐,得到稳定性高、水溶性好、活性强的cyp1b1酶抑制剂(j.cui,q.meng,x.zhang,et al.design and synthesis of new alpha
‑
naphthoflavones as cytochrome p450(cyp)1b1 inhibitors to overcome docetaxel
‑
resistance associated with cyp1b1 overexpression[j].j med chem,2015,8:3534
‑
47)。
[0010]
本发明的nir/pet双模态分子探针设计中同样在cyp1b1酶抑制剂的3位通过连接链引入信号基团。由于双模态探针需要同时引入荧光和用于pet核素标记的基团,我们借助具有三个可用于化学修饰的官能团的谷氨酸作为聚乙二醇(peg)连接链延伸,分别连接cyp1b1酶抑制剂,螯合剂和近红外荧光基团,使探针具有靶向性的同时可适用于两种模态的成像。
[0011]
基于以上研究,我们提出以α
‑
萘黄酮为配体,以谷氨酸链为连接链,通过合理的合成路线设计,依次连接配体,可用于核素
18
f标记的螯合基团及近红外荧光染料,合成获得了靶向cyp1b1酶的双模态的分子探针前体,并通过体内外评价实验探究该类探针前体对cyp1b1酶的特异性结合和在体成像能力,探索以cyp1b1为靶点的的分子影像探针在肿瘤诊
断中的应用价值,为获得具有临床转化意义的肿瘤早期诊断试剂奠定基础。
[0012]
本发明的目的是通过以下方案实现的:
[0013]
本发明的第一方面提供一种靶向cyp1b1酶的nir/pet双模态探针前体,所述双模态探针前体包括亲和配体、信号基团和用于连接亲和配体和信号基团的连接链;所述亲和配体为α
‑
萘黄酮衍生物,信号基团为近红外荧光分子及能被
18
f标记的螯合基团noda;所述连接链为具备多个化学反应活性位点的谷氨酸链。因为本发明中需要连接链具有三个可供修饰的官能团,分别连接靶向基团部分,荧光基团部分和螯合剂部分,现有技术中采用peg连接链只有两端可供修饰,无法实现带有靶向基团的双模态探针的设计。
[0014]
优选的,所述双模态探针前体的结构式如式6所示:
[0015][0016]
本发明的第二方面提供一种上述所述的靶向cyp1b1酶的nir/pet双模态探针前体的制备方法,包括如下步骤:
[0017]
步骤a、boc
‑
l
‑
谷氨酸
‑
α
‑
甲酯的γ
‑
羧基被nhs所活化得到化合物2
[0018][0019]
步骤b、将化合物2与3
‑
(2
‑
(2氨基乙氧基)乙氧基)
‑
3'
‑
氟
‑
6,7,10
‑
三甲氧基
‑
α
‑
萘黄酮盐酸盐中的氨基发生缩合反应得到化合物3
[0020][0021]
步骤c、将化合物3与过量的乙二胺发生氨解反应形成酰胺得到化合物4
[0022][0023]
步骤d、将化合物4与原料ncs
‑
mp
‑
noda中的硫氰键发生亲核加成反应引入螯合剂
noda得到化合物5
[0024]
步骤e、将化合物5在强酸条件下脱去boc,使裸露的氨基成功与nhs活化的cy5.5发生偶联反应从而获得所述nir/pet双模态探针前体化合物6。
[0025]
优选的,步骤a的反应在碳酰二亚胺类缩合剂的催化下进行。
[0026]
优选的,步骤b的反应在三乙胺的催化下进行。
[0027]
优选的,步骤c的反应在室温下,以甲醇作溶剂进行反应。
[0028]
优选的,步骤d的反应在三乙胺的催化下进行。
[0029]
优选的,步骤e中,化合物5在甲醇溶剂中,以浓盐酸作为强酸,脱去boc保护基。
[0030]
优选的,步骤e中,偶联反应是以dmso作为溶剂,三乙胺作为碱,在室温下进行。
[0031]
本发明的第三方面提供一种上述所述的靶向cyp1b1酶的nir/pet双模态探针前体在制备肿瘤诊断试剂中的用途。
[0032]
本发明的原理是:通过利用具备多个活性位点的氨基酸链—boc
‑
l
‑
谷氨酸
‑
α
‑
甲酯作为双模态探针中的配体与信号基团的连接链,制备nir/pet双模态探针前体,克服单一模态探针的局限性,提供更准确全面的信息,提高肿瘤显像的准确性。cyp1b1酶具有在肿瘤组织中特异性高表达和在早期癌变细胞中被诱导表达的两大特征,显示出作为肿瘤标志物用于肿瘤早期诊断的潜力及应用价值。在前期研究中,我们已经分别获得靶向cyp1b1的nir近红外探针(近红外荧光分子为cy5.5)与能被可发射正电子的核素
18
f标记的螯合剂,在双模态探针前体的构建过程中为尽量减少近红外荧光基团cy5.5受到环境淬灭的影响,我们在信号基团的连接顺序上选择先引入螯合基团noda,再引入cy5.5。boc
‑
l
‑
谷氨酸
‑
α
‑
甲酯首先与nhs反应活化γ
‑
羧基,之后再与化合物3
‑
(2
‑
(2氨基乙氧基)乙氧基)
‑
3'
‑
氟
‑
6,7,10
‑
三甲氧基
‑
α
‑
萘黄酮盐酸盐上的氨基发生偶联反应,从而将谷氨酸链与配体基团相连,之后采用乙二胺与连接链上的甲酯发生氨解反应引入另一个裸露氨基,便于进一步与noda偶联,最后将连接链谷氨酸氨基上的boc保护基脱除,暴露出nh2之后nhs活化的cy5.5反应,从而获得靶向cyp1b1的nir/pet双模态探针。
[0033]
所述信号基团是用于nir成像的分子cy5.5及在
18
f标记后可用于pet成像的螯合基团noda。近红外荧光成像能够很好的弥补pet在空间分辨率上的不足,而pet能够在无创的情况下定量分辨深部组织的结构,同时也能对肿瘤分期进行监测,其具有良好的互补性,在肿瘤的前期诊断与手术定位中有巨大的利用潜力。
[0034]
与现有技术相比,本发明具有如下的有益效果:
[0035]
1)本发明所述的双模态分子探针前体的设计有效地弥补了单一模态探针成像的局限性,提高肿瘤显像的准确性。
[0036]
2)本发明提供的nir/pet双模态分子探针前体可选择性靶向cyp1b1酶。近红外荧光成像技术已应用于临床肿瘤外科手术,具有检测深度大且无损检测的优点,目前部分靶向于肿瘤特异性标记物的近红外分子探针已进行临床前研究。本发明提供的nir/pet双模态分子探针前体可通过与cyp1b1酶结合特异性地在肿瘤细胞中富集,实现在体实时的肿瘤
成像,同时,在临床中可先通过标记
18
f用pet非侵入性的对肿瘤部位进行定位,再通过nir在术中实时观测以进行荧光介导的手术切除或者活检等。
[0037]
3)本发明所选用的靶点cyp1b1酶为肿瘤的特异性标记物,作为一个在癌细胞病变早期就出现且仅在肿瘤细胞中特异性表达的标记物,前期未见报道以其为活体成像的生物靶标进行双模态分子探针前体的研究,本发明所述的以肿瘤的特异性标记物cyp1b1酶为靶点的nir/pet双模态分子探针前体将有效促进肿瘤活体成像的应用,在肿瘤早期诊断及术中成像定位方面将具有良好应用前景及临床转化价值。
附图说明
[0038]
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
[0039]
图1为本发明制得结构式nir/pet双模态分子探针前体的制备路线图;
[0040]
图2a为本发明的nir/pet双模态分子探针前体在结肠癌细胞hct
‑
15中的共聚焦显微成像结果;细胞用dapi染核,cy5.5表示cy5.5荧光通道,merge为两种通道信号重合的图像;
[0041]
图2b为本发明的nir/pet双模态分子探针前体在人乳腺癌细胞lcc6中的共聚焦显微成像结果;细胞用dapi染核,cy5.5表示cy5.5荧光通道,merge为两种通道信号重合的图像;
[0042]
图3a为结肠癌细胞hct
‑
15荷瘤小鼠在仅注射nir/pet双模态分子探针前体(imaging)和共同注射nir/pet双模态分子探针前体及阻断剂anf后(blocking)不同时间点的近红外荧光活体成像结果;
[0043]
图3b为结肠癌细胞hct
‑
15荷瘤小鼠在仅注射nir/pet双模态分子探针前体(imaging)和共同注射nir/pet双模态分子探针前体及阻断剂anf后(blocking)不同时间点的肿瘤部位荧光强度的量化结果;
[0044]
图4a为结肠癌细胞hct
‑
15移植瘤小鼠在仅注射nir/pet双模态分子探针前体(imaging)和共同注射nir/pet双模态分子探针前体及阻断剂anf后(blocking)主要离体组织中nir/pet双模态分子探针前体的生物分布情况;
[0045]
图4b为结肠癌细胞hct
‑
15移植瘤小鼠在仅注射nir/pet双模态分子探针前体(imaging)和共同注射nir/pet双模态分子探针前体及阻断剂anf后(blocking)主要离体组织中nir/pet双模态分子探针前体的生物分布的量化结果。
具体实施方式
[0046]
下面结合具体实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变化和改进。这些都属于本发明的保护范围。
[0047]
本发明涉及近红外荧光成像(nir)、正电子发射断层扫描成像(pet)和分子影像探针领域,涉及一种靶向cyp1b1酶的nir/pet双模态探针前体及其制备和用途,具体来说是一种由近红外荧光染料cy5.5及能被
18
f标记的螯合基团noda与能和细胞色素p4501b1酶特异
性结合的配体组成的诊断试剂复合物,通过结合细胞色素p4501b1酶在肿瘤细胞中特异性富集,利用nir成像能够实时监测肿瘤部位分子水平的变化及pet成像提供可以更准确的定量信息的优点,可提高肿瘤显像的准确性,更有效地对肿瘤进行早期诊断。同时在临床使用时可以先通过pet非侵入性的对肿瘤部位进行定位,再通过nir在术中实时观测以进行荧光介导的手术切除或者活检。
[0048]
实施例1
[0049]
本实施例涉及一种具有结构式6的nir/pet双模态探针的制备方法,合成路线如图1所示,包括以下步骤:
[0050]
步骤一:将boc
‑
l
‑
谷氨酸甲酯(1g,3.8mmol)和n
‑
羟基琥珀酰亚胺(nhs)(440mg,3.8mmol)溶于7ml四氢呋喃(thf)中,随后加入溶于5ml二氯甲烷(dcm)中的1
‑
乙基
‑3‑
(3
‑
二甲基氨基丙基)
‑
碳二亚胺(edc)(594mg,3.8mmol)。将反应物混合搅拌过夜并通过薄层色谱(tlc)监测。反应完成后,减压蒸发溶剂,将残余物溶于20ml dcm中。之后,将溶液用水、饱和nahco3和盐水洗涤。用硫酸镁干燥有机相后,减压浓缩可获得白色固体产物化合物2,收率:95%。1h nmr(400mhz,cdcl 3
):5.18(br,1h),4.36(s,1h),3.74(s,3h),2.81(s,4h),2.62
‑
2.74(m,2h),2.27(s,1h),2.00
‑
2.07(m,1h),1.42(s,9h)。
[0051]
步骤二:将3
‑
(2
‑
(2
‑
氨基乙氧基)乙氧基)
‑
3'
‑
氟
‑
6,7,10
‑
三甲氧基
‑
萘黄酮盐酸盐(21mg,0.04mmol)和化合物2(16mg,0.04mmol)溶于600μl二甲基亚砜(dmso)中。向上述溶液中加入20μl三乙胺。将反应物混合避光搅拌过夜,并通过分析型hplc监测。反应结束后,将产物用20ml dcm稀释,分别用10ml水,10ml 0.1m盐酸和10ml盐水洗涤。用mgso4干燥有机相后,减压蒸发得到黄色固体产物化合物3。收率:97%。1h nmr(400mhz,cdcl3):8.29
‑
8.33(m,2h),7.48
‑
7.52(m,2h),7.21
‑
7.24(m,1h),7.16
‑
7.18(m,1h),7.09
‑
7.11(m,1h),4.35(m,2h),4.25(m,1h),4.10(s,3h),4.08(s,3h),3.95(s,3h),3.81(m,2h),3.68(s,3h),3.60(m,2h),3.48(m,2h),2.29
‑
2.31(m,2h),1.98
‑
2.01(m,2h),1.38(s,9h)。
[0052]
步骤三:将化合物3(6.0mg,0.008mmol)溶于300μl甲醇中,然后滴加600μl乙二胺。将反应物混合避光搅拌过夜并通过分析型hplc监测。反应完成后,将产物用20ml dcm稀释,分别用10ml水和10ml盐水洗涤。用mgso4干燥有机相后,减压蒸发得到得到粗产物,之后用半制备hplc分离纯化,冻干后得到深黄色固体化合物4。收率:80%。1h nmr(400mhz,dmso
‑
d6):8.30
‑
8.32(m,1h),8.23
‑
8.26(m,1h),7.99
‑
8.02(m,1h),7.84
‑
7.87(m,1h),7.63
‑
7.70(br,4h),7.39
‑
7.43(m,1h),7.27
‑
7.28(m,3h),4.35
‑
4.38(m,2h),4.03(s,3h),3.92(s,3h),3.82(s,3h),3.67
‑
3.69(m,2h),3.35
‑
3.38(m,2h),3.24
‑
3.29(m,2h),3.14
‑
3.18(m,2h),2.81
‑
2.84(m,2h),2.05
‑
2.08(m,2h),1.84
‑
1.88(m,1h),1.69(m,1h),1.34(s,9h)。
[0053]
步骤四:将化合物4(7.7mg,0.01mmol)和2,2'
‑
(7
‑
(4
‑
异硫氰酸酯苄基)
‑
1,4,7
‑
三唑烷
‑
1,4
‑
二基)二乙酸(ncs
‑
mp
‑
noda)(4.0mg,0.01mmol)溶于1.2ml dmso中,然后滴加300μl三乙胺。将反应物混合避光搅拌过夜,并通过分析型hplc监测。反应结束后,将溶液用半制备hplc分离纯化并冻干,得到浅黄色固体化合物5。收率:40%。1h nmr(600mhz,cd3od):8.12
‑
8.13(m,1h),8.01
‑
8.03(m,1h),7.42
‑
7.44(m,2h),7.40
‑
7.41(m,1h),7.32
‑
7.35(m,2h),7.14
‑
7.16(m,1h),6.99
‑
7.00(m,1h),6.94
‑
6.95(m,1h),6.87
‑
6.89(m,1h),4.21
‑
4.22(m,2h),4.18
‑
4.19(m,2h),3.85
‑
3.88(m,1h),3.81(s,3h),3.77(s,3h),3.71(s,3h),3.67(m,2h),3.41
‑
3.44(m,4h),3.31
‑
3.36(m,4h),3.25
‑
3.28(m,4h),3.11(m,2h),3.06(m,2h),
2.97(m,2h),2.69
‑
2.73(m,4h),2.57(m,2h),2.17
‑
2.19(m,2h),1.90
‑
1.94(m,1h),1.74
‑
1.78(m,1h),1.30(s,9h)。esi
‑
hrms:c
56
h
72
fn8o
15
s
+
calcd 1147.4822;found 1147.4850[m+h]
+
。
[0054]
步骤五:将化合物5(7.1mg,0.006mmol)溶于0.5ml meoh中,加入50μlmeoh/hcl(3:1)。将反应物混合搅拌并加热2.5小时,直到分析型hplc反应物的峰消失。之后加入20μl三乙胺以中和酸,减压蒸发溶剂,得到黄色固体,无需进一步纯化即可直接用于下一步。随后,将cy5.5
‑
nhs(7.0mg,0.006mmol)和30μl三乙胺加入600μl无水dmso的脱保护产物溶液中。将反应混合物在室温下避光搅拌过夜。反应结束后,将溶液用半制备hplc分离纯化。收集含有化合物6的组分,冻干后得到深蓝色固体化合物6。收率:59%。esi
‑
hrms:c
92
h
103
fn
10
o
26
s
52
‑
;calcd 971.2816;found 971.2791[m
‑
2h]2‑
。
[0055]
实施例2
[0056]
实施例1中得到的化合物5对cyp1a1,cyp1a2,cyp1b1酶的抑制活性测定。
[0057]
本实验用7
‑
乙氧基
‑
3h
‑
吩噁嗪3
‑
酮脱乙氧基(erod)实验测定其对cyp1a1,cyp1a2,cyp1b1酶的抑制活性和选择性(yamaori et al,biochem.pharmacol.2010,79:1691
‑
1698.)。反应体系(200μl)包含cyp1a1(10fmol),cyp1a2(60fmol)或cyp1b1(20fmol),不同浓度的待测化合物,nadph再生系统(1.3mm nadpna2,3.3mm葡萄糖
‑6‑
磷酸,0.5u/ml葡萄糖
‑6‑
磷酸
‑
脱氢酶),3.3mm氯化镁溶液和150nm的7
‑
乙氧基
‑
3h
‑
吩噁嗪
‑3‑
酮。每个实验组或者对照组设4个复孔作为平行实验。反应缓冲液为含1%bsa溶液的50mm tris
‑
hcl(ph 7.4)缓冲液。反应体系于37℃预热5min后,加入nadph再生系统启动反应,含cyp1a1酶的反应体系于37℃孵育15min,含cyp1a2酶体系温孵50min,含cyp1b1酶体系温孵35min。待反应结束后加入100微升预冷乙腈终止反应,10min内采用多功能酶标仪检测荧光值,激发波长和发射波长分别为545nm和590nm。然后运用统计软件prism计算ic
50
数值,最终的ic
50
测定结果采用三次重复实验的平均值,以α
‑
萘黄酮(anf)为阳性对照。实验结果如表1所示:
[0058]
表1、化合物5对cyp1a1,cyp1a2,cyp1b1酶的抑制活性和选择性
[0059][0060]
由表1的结果可知,用连接链boc
‑
l
‑
谷氨酸α
‑
甲酯和螯合剂noda修饰确实一定程度上影响了配体对cyp1b1的抑制活性,与阳性对照anf相比效力降低了100倍。然而,其ic
50
值仍然保持在纳摩尔级范围内,这表明化合物5与酶结合的亲和力仍然相对较高。同时,在引入氨基酸连接链和noda后(ic
50
比率:cyp1a1/1b1=20,cyp1a2/1b1=23),对其他两种cyp1酶成员的抑制选择性显著增强,这种结合选择性对于保证靶向cyp1b1的分子探针的成像准确性是必要的。由于来自nir荧光团的荧光信号的干扰,在化合物5与cy5.5缀合后未能测量酶抑制活性。然而,在随后的基于细胞的饱和曲线绘制中确定了nir/pet双模态探针6的结合亲和力。总之,尽管引入氨基酸连接链和螯合剂noda后的化合物对cyp1b1的抑制活性有所下降,但考虑到纳摩尔级别的ic
50
值,我们认为该化合物保持对cyp1b1的结合能力。更重要的是,化学修饰后对cyp1a1或cyp1a2的抑制选择性提高,这可以增强nir/pet双模态
探针的成像特异性。
[0061]
实施例3
[0062]
本实施例进行了nir/pet双模态分子探针前体(化合物6)对cyp1b1酶高表达的结肠癌细胞hct
‑
15的共聚焦显微成像研究。
[0063]
将cyp1b1酶高表达的hct
‑
15结肠癌细胞以合适密度种于8孔nunc
tm
lab
‑
tek
tm
腔室载玻片系统中,在细胞培养箱37℃,5%co2中培养24h之后吸取多余的培养基,分别加入2*1μm、2*0.5μm的nir/pet双模态分子探针前体,另外设置阻断对照组(阻断组加入2*1μm探针和20μm的α
‑
萘黄酮衍生物溶液),每组2个复孔。37℃,5%co2中孵育1小时后,吸除含有探针的培养基并用pbs缓冲液洗三遍。之后按说明书拆除载玻片上的腔室,加上含有染核染料dapi的封片油,并盖上盖玻片封片。随后用共聚焦显微镜分别对两种浓度的荧光探针共孵育过的细胞进行成像。成像结果如图2a所示,双模态探针前体浓度为1μm时,细胞内荧光显色较强。双模态探针浓度为0.5μm时,细胞内有较弱的荧光显色。阻断组几乎无近红外荧光显色,从而在细胞水平上定性说明了nir/pet双模态分子探针前体通过与cypib1酶特异性结合在hct
‑
15细胞内富集。
[0064]
实施例4
[0065]
本实施例进行了nir/pet双模态分子探针前体(化合物6)对cyp1b1酶高表达的人乳腺癌细胞lcc6的共聚焦显微成像研究。
[0066]
将cyp1b1酶高表达的lcc6结肠癌细胞以合适密度种于8孔nunc
tm
lab
‑
tek
tm
腔室载玻片系统中,在细胞培养箱37℃,5%co2中培养24h之后吸取多余的培养基,分别加入2*1μm、2*0.5μm的nir/pet双模态分子探针前体,另外设置阻断对照组(阻断组加入2*1μm探针和20μm的α
‑
萘黄酮衍生物溶液),每组2个复孔。37℃,5%co2中孵育1小时后,吸除含有荧光探针的培养基并用pbs缓冲液洗三遍。之后按说明书拆除载玻片上的腔室,加上含有染核染料dapi的封片油,并盖上盖玻片封片。随后用共聚焦显微镜分别对两种浓度的荧光探针共孵育过的细胞进行成像。成像结果如图2b所示,双模态探针浓度为1μm时,细胞内荧光显色较强。双模态探针浓度为0.5μm时,细胞内有较弱的荧光显色。阻断组几乎无近红外荧光显色,从而在细胞水平上定性说明了nir/pet双模态分子探针前体通过与cypib1酶特异性结合在lcc6细胞内富集。
[0067]
实施例5
[0068]
本实施例在细胞水平测定了nir/pet双模态探针前体与cyp1b1酶的平衡解离常数k
d
。
[0069]
将实施例4中已测定为cyp1b1酶高表达的结肠癌细胞hct
‑
15以合适的密度种于六孔板中,在37℃,5%co2中培养24h后之后吸除培养基,按照0.05μm、0.1μm、0.2μm、0.5μm、1μm、1.5μm以及2μm的双模态探针前体浓度,每孔分别加入2ml nir/pet双模态探针前体。另外设置空白对照组(不加双模态探针前体)与阻断对照组(阻断组分别采用成像组试剂浓度20倍浓度的α
‑
萘黄酮衍生物,细胞内剩余的荧光强度为非特异性结合的荧光探针,在每组数据中扣除)。在37℃,5%co2中孵育1h后吸除含有分子探针的培养基并用pbs缓冲液洗两遍。细胞用胰酶消化并悬浮于1ml培养基中,转移至离心管中进行离心(1000r/min,5min),离心完毕后弃去上清液,用0℃的pbs缓冲液重悬再进行离心,如此重复两遍最终悬浮于0℃的pbs溶液中并转移至流式管,将样品至于冰浴上待测。用流式细胞仪测定cy5.5的吸收波长
段下,不同浓度探针孵育后的细胞荧光强度,并分别扣除各浓度下通过非特异性结合被细胞摄取的探针荧光强度(阻断组数据)。利用统计软件prism绘制分子探针前体与cyp1b1酶高表达的hct
‑
15细胞结合的饱和曲线并计算平衡解离常数k
d
,计算nir/pet双模态探针k
d
值为479.8nm,在纳摩尔级别,由此可见分子探针在细胞水平上保持了对cyp1b1酶的高亲合性,符合在体成像分子探针的要求。
[0070]
实施例6
[0071]
本实施例为nir/pet双模态探针的荷瘤(结肠癌细胞hct
‑
15)小鼠活体成像能力评价与生物分布的测定实验。
[0072]
将5
×
106个hct
‑
15细胞接种于裸鼠右前臂,约接种后两周,待肿瘤直径达到0.5cm
‑
1cm后,给荷瘤小鼠注射nir/pet双模态探针前体并在不同的时间段进行近红外荧光活体成像。将仅注射nir/pet双模态探针前体的小鼠(12nmol/只,每组5只)作为成像组,并设置同时注射nir/pet双模态探针(12nmol/只,每组5只)和cyp1b1抑制剂α
‑
萘黄酮(20mg/kg)的小鼠作为阻断组,在注射后2小时,6小时,24小时用ivis2000小动物活体成像设备分别对两组小鼠进行近红外成像。实验结果如图3a所示,在注射后2小时荧光探针就显示出了在肿瘤部位的富集,在3个时间点,成像组肿瘤部位的荧光强度均高于阻断组,肿瘤部位始终清晰可见,注射探针后24小时两组差异最为显著(p<0.001),由此在体内实验中证实了nir/pet双模态探针前体可通过与cyp1b1酶特异性结合在肿瘤组织中富集(如图3b所示)。为了获得nir/pet双模态探针前体在小鼠体内的生物分布数据,在24h的成像实验结束后,我们将两组小鼠颈椎脱臼处死,分离收集各主要脏器组织(心脏,肺,肝脏,肾脏,脾脏,消化系统,肌肉)及肿瘤组织进行体外近红外成像。结果如附图4a、4b所示,探针主要富集在肿瘤部位,成像组肿瘤组织的荧光强度显著高于阻断组,在心脏、脾脏以及肌肉组织中几乎不存在探针分布,在肾脏组织中存在一定的分布,附图4为肿瘤组织的荧光强度定量,在探针注射的24小时后,肿瘤组织的探针分布依然最多。数据显示,在正常组织中也存在一定量的探针分布,例如在肺、肝、肠、肾中就存在较多的荧光。并且在肺脏与肝脏中,阻断组的荧光强度要大于成像组荧光强度。说明此时在正常组织中的分布属于非特异性的,与cyp1b1表达无关。该实验证实了在cyp1b1酶过表达的hct
‑
15移植瘤中,nir/pet双模态探针可通过与cyp1b1特异性结合在肿瘤组织中富集。
[0073]
综上所述,本专利设计并合成了通过与cyp1b1酶特异性结合在肿瘤组织中富集的nir/pet双模态探针前体化合物6,进行了对cyp1b1酶的亲合力测定并研究了其体内外肿瘤成像能力。研究结果证明所设计的nir/pet双模态探针前体化合物6在细胞水平和小动物活体成像中都能通过与cyp1b1酶特异性结合在肿瘤细胞中富集,为获得具有临床转化价值的双模态分子探针奠定了基础。
[0074]
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变化或修改,这并不影响本发明的实质内容。在不冲突的情况下,本技术的实施例和实施例中的特征可以任意相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1