ASB17在制备治疗NLRP3炎症小体相关炎症性疾病药物中的用途的制作方法
asb17在制备治疗nlrp3炎症小体相关炎症性疾病药物中的用途
技术领域
1.本发明属于生物技术领域,尤其涉及一种asb17在制备治疗nlrp3炎症小体相关炎症性疾病药物中的用途。
背景技术:
2.目前,炎症小体(inflammasome)是先天性免疫系统的重要组成部分,其中nlrp3((nlr family pyrin domain containing 3)炎症小体是研究最广泛和最深入的炎症小体。nlrp3炎症小体是一个大的蛋白复合物,这个复合物主要由细胞质感应蛋白nlrp3,接头蛋白asc和效应蛋白caspase
‑
1三种蛋白构成。nlrp3炎症小体不仅可以识别病原体相关的分子模式(pamps),还可以识别危险信号相关的分子模式(damps)。它的刺激物非常广泛,包括病毒、细菌、真菌、atp、nigericin、尿酸单钠(monosodium urate)、石棉(asbestos)、二氧化硅晶体(silica crystals)、铝盐晶体(aluminum salt crystals)、纤维状淀粉样蛋白
‑
β肽(fibrillar amyloid
‑
β peptide)等。刺激物激活nlrp3炎症小体之后,nlrp3,asc和caspase
‑
1组成复合物激活caspase
‑
1,激活的caspase
‑
1能够介导下游炎症因子il
‑
1β前台蛋白(pro
‑
il
‑
1β)的成熟和分泌,促炎因子il
‑
1β释放到胞外参与机体炎症及损伤等过程,同时激活的caspase
‑
1也可以通过剪切效应蛋白gsdmd引起细胞焦亡。nlrp3炎症小体在宿主抵抗病原体感染中起着重要作用,但是nlrp3炎症小体的过度激活或调节失控和很多炎症性疾病紧密相关,例如痛风、2型糖尿病、动脉粥样硬化、帕金森病、阿尔茨海默病、多种自身免疫性疾病等。探究宿主抑制nlrp3炎症小体激活对于丰富nlrp3炎症小体的调控机理和防治nlrp3炎症小体相关疾病都起着重要作用。
3.目前发现宿主蛋白可以通过对nlrp3的修饰影响其功能,从而抑制nlrp3炎症小体的激活。在多巴胺通过多巴胺d1受体抑制nlrp3炎症小体的激活过程中,e3泛素连接酶march7起着重要作用,march7能够促进nlrp3的降解,从而抑制nlrp3炎症小体。e3泛素连接酶trim31能够促进nlrp3的k48泛素化和降解,从而抑制nlrp3炎症小体的激活。e3泛素连接酶arih2促进nlrp3的k48和k63泛素化,从而抑制nlrp3炎症小体的激活。
4.asb17是asb(ankyrin repeat and suppressor of cytokine signaling(socs)box containing protein)家族成员之一。目前,asb家族共有18个成员,从asb1到asb18。asb家族成员都含有蛋白锚定重复结构域(ankyrin repeat domain)和细胞信号抑制因子盒子结构域(socs box domain)。含有socs box结构域的蛋白通常能参与底物的泛素化降解,因此asb家族成员被称为e3泛素连接酶。目前asb家族的功能研究较少,只有部分成员的功能有文献报道,例如,asb2能促进filamin a和filamin b的降解以及asb8能促进tbk1/ikki的泛素化和降解。在asb家族成员中,asb17的功能目前没有文献报道。
5.nlrp3炎症小体激活主要发生在巨噬细胞(macrophages)和树突状细胞(dendritic cells,dcs)等免疫细胞中。本发明的前期研究结果发现:在dcs中e3泛素连接酶asb17能够促进nlrp3泛素化和降解,抑制nlrp3炎症小体的激活。dcs是独特的免疫细胞,
能够连接先天性免疫(innate immune)和获得性免疫(adaptive immune)。它是目前最有效的抗原呈递细胞,同时调节t细胞免疫和免疫耐受(immune tolerance)。目前研究抑制nlrp3炎症小体激活的机制主要在巨噬细胞中,在dcs中抑制nlrp3炎症小体激活研究较少,这促使本发明寻求更加深入的探讨。
6.2009年,ghiringhelli等人发现在dcs中nlrp3炎症小体激活能够诱导依赖il
‑
1β的适应性免疫抗肿瘤,这表明nlrp3炎症小体能够将先天性免疫和获得性免疫联系起来去抗肿瘤细胞。2019年,zhang等人发现neat1的敲低能够通过抑制nlrp3炎症小体激活,从而诱导dcs成为耐受性树突状细胞(tolerogenic dendritic cells,tol
‑
dcs)。免疫耐受可以通过先天性免疫和获得性免疫限制免疫系统的激活和组织损伤,防止免疫系统对自身产生反应,避免自身免疫性疾病的发展。tol
‑
dcs是免疫耐受的重要组成部分,它能够激活调节性t细胞(regulatory t cells,tregs),抑制效应t细胞(effector t cells,teffs),产生il
‑
10和tgfβ等抗炎细胞因子。目前,tol
‑
dcs的细胞免疫治疗在很多实验动物模型中已成功试验,同时大量临床研究表明,tol
‑
dcs的细胞免疫治疗是安全的,在免疫相关疾病中有很好的免疫耐受性。因此,探究诱导tol
‑
dcs的分子机制,能够为免疫相关疾病的治疗提供重要靶点。
7.通过上述分析,现有技术存在的问题及缺陷为:asb17能够通过降解nlrp3从而抑制nlrp3炎症小体激活;但是asb17的调控方式,以及如何把asb17蛋白运输到细胞内抑制nlrp3炎症小体激活。
8.解决以上问题及缺陷的难度为:第一个问题,asb17的调控方式如何,我们推测asb17可能受宿主的细胞因子调控,但是需要进一步筛选和验证;第二个问题,如何把asb17蛋白运输到细胞内抑制nlrp3炎症小体激活,这个确实是一个难点,最近出现了改造过的病毒做为载体,但是安全性还需要进一步研究。
9.解决以上问题及缺陷的意义为:如果能够知道调控asb17表达的细胞因子,那么该细胞因子可以做为抑制炎症反应和导致免疫耐受的重要靶点;同时如果把asb17克隆在安全的改造过的病毒载体上,那么就解决了asb17蛋白的运输问题,对于asb17能够成为药物靶标起着重要作用。
技术实现要素:
10.针对现有技术存在的问题,本发明提供了一种asb17在制备治疗nlrp3炎症小体相关炎症性疾病药物中的用途。通过研究结果,本发明推测:asb17和nlrp3相互作用,能够促进nlrp3泛素化和降解,从而抑制nlrp3炎症小体激活,从而抑制nlrp3炎症小体相关炎症性疾病。
11.本发明是这样实现的,
12.本发明提供一种asb17在制备治疗nlrp3炎症小体相关炎症性疾病药物中的用途。
13.asb17的human asb17 sequence.txt序列为:
14.atgagtaaatctactaaattatgtggtaagacttcttgtccaagaagcaatatattctgcaatctccttgacaaaattgttaaaagaccctccctacagtttttgggtcagtggggatatcactgttacgaaccaaggatttacagatcactggcaaaaattctgaggtatgtggacttggatggttttgacgcactactcacagattacattgcatttgtggaaaaatcaggataccgttttgaagtaagttttaacctcgacttcactgaaatatgtgtgaatacaattctgta
ctgggtttttgccagaaaaggtaatcctgactttgtggaattgcttctcaagaagacaaaagactatgttcaagacagaagttgtaacctggcactgatatggagaactttcacaccagtatactgtccaagcccattaagtggcatcacacctctcttttatgtagctcagacaagacagtctaatatcttcaaaatactactgcaatatggaatcttagaaagagaaaaaaaccctatcaacattgtcttaacaatagtactctacccttcgagagtaagagtaatggttgatcgtgaattggctgacatccatgaagatgccaaaacatgtttggtactatgttccagagtgctttctgtcatttcagtcaaggaaataaagacacagctgagtttaggaagacatccaattatttcaaattggtttgattacattccttcaacaagatacaaagatccatgtgaactattacatctttgcagactaaccatcaggaatcaactattaaccaacaatatgctcccagatggaatattttcacttctaattcctgctcgtctacaaaactatctgaatttagaaatctaa。
15.asb17的mouse asb17 sequence.txt序列为:
16.atgaataactcttctaaattatgccggaagacgtcttttccaagaagcaatatattctgtaaccttgttgacaagatagttaagcggccctctctgcagtttctgggccaatggggataccactgctatgaacccaggatttacagaaccctggcaaaaatcctgaggtatgttgacttggacggctttgacatactcctcacggactatattgcttttgtggaaaagtcaggacaccgttttgaactcaactttaaccttgagtttactgaaatatgcgtgaataccattctgtactgggttttcgccaggaaaggtaatcctgacttcgtggaactgcttctcaagaagacgaaggactatgtccaagacagaagctgcagcctggcgctgatatggagaaccttcacacctgtgtactgccccagccccctgagtggcatcacacctctactctacgtggctcagacaagacagtcaaatatcttaaaaattctcctgcagtatggaatcctagaaagagaaaaaaaccctatcaacattgttctgacaatactactttacccttcgagagtgagaataatggttgaccacgagttgattgacattcaagaagatgccaagacatgtttaatgctatgttccagagtgctttctacgatctcagtcagggagatagagacacagctgagcttaggacgacgcccaattattcaaaattggttggactacatcccgccaacaagatacaaggatccatgtgaactcgtccacctttgcagaataaccatcaggacccaactgctggccaacaatatgctcccaaatggaatattttcccttctaattcctactcgtttacaaaacttcctgaatttagaaagctag。
17.本发明另一目的在于提供一种验证asb17制备治疗nlrp3炎症小体相关炎症性疾病药物的方法包括以下步骤:
18.步骤一,蛋白质免疫印迹、酵母双杂交、免疫共沉淀以及免疫荧光;
19.步骤二,重建nlrp3炎症小体激活;
20.步骤三,蛋白质降解及泛素化实验;
21.步骤四,小鼠原代细胞(bmdcs和bmdms)分离;
22.步骤五,lps诱导小鼠败血症及alum诱导小鼠腹腔炎。
23.所述蛋白质免疫印迹、酵母双杂交、免疫共沉淀以及免疫荧光,包括:
24.(1)蛋白质免疫印迹
25.跑胶和转膜完成后,取出nc膜,用含有5%脱脂牛奶的pbst,即pbs+tween缓冲液封闭45min;pbst洗三次,每次5min;一抗用pbst缓冲液稀释后,加到膜上,4℃孵育过夜;回收一抗,pbst洗3次,每次5min;加入用含有2%脱脂牛奶的pbst配制的二抗,室温孵育45min;pbst洗3次,每次10min;显色和曝光;
26.(2)酵母双杂交
27.1)首先将nlrp3的结构域pyd克隆到pgbkt7载体上,通过测序确定克隆成功。
28.2)将载体pgbkt7
‑
pyd转化到y2hgold酵母菌中,通过western blot实验确定pyd能够在酵母菌中表达。
29.3)检测pyd蛋白的表达是否能够引起菌内报告基因的自激活以及是否对酵母菌本
身有毒性。
30.4)将含有pgbkt7
‑
pyd的y2hgold酵母菌扩大培养,与含有人cdna(构建在pgadt7载体上)文库的y187酵母菌进行交配。
31.5)将交配的酵母菌涂布在60
‑
70个含有ddo/x/a的150cm平板上进行筛选,涂布完之后,放在30℃培养箱中培养。
32.6)48h之后,将平板上的蓝斑圈出来,做好菌落编号,然后将蓝斑菌落接种到含有qdo/x/a的平板上进行更加严格的筛选,涂布完之后,放在30℃培养箱中继续培养。48h之后将平板上的蓝斑圈出来,接种到含有qdo/a的酵母培养基中进行培养。
33.7)三天之后,按照试剂盒上说明书来提取酵母中的质粒。
34.8)将得到的质粒转化大肠杆菌感受态中,然后涂布到含有ampr抗性的lb固体培养基中,在37℃培养箱中培养12
‑
16h。
35.9)拿出lb固体培养基,挑菌,接种到含有ampr抗性的lb液体培养基中,在37℃摇床中培养12
‑
16h。
36.10)提取相应细菌的质粒,送去测序。
37.11)将测序结果在ncbi网站上进行blast,确定未知cdna的基因名称。cdna的序列不在对应基因的编码区,或者cdna序列移码导致不编码对应基因的蛋白或者部分区域,这些cdna结果都需要排除。
38.12)将得到的阳性cdna与诱饵基因pyd分别转化到酵母菌中进行回复实验,两种酵母菌进行交配,然后再涂布到含有ddo/a/x和qdo/a/x的平板上,看酵母是否能在这些平板上生长。如果能够生长同时变蓝,进一步说明筛选得到的cdna的可靠性,否则反之。
39.(3)免疫共沉淀
40.用1.5ml ep管收集待处理的细胞样品,用预冷的pbs洗2次,加入0.5ml~1ml ripa裂解液和cocktail蛋白酶抑制剂;混匀后,将ep管放在冰上裂解20min;其中,所述ripa裂解液的配方为0.05m tris,0.001m edta,0.15m nacl,1%np
‑
40,5%glycerol;ph 7.4;
41.通过超声仪超声破碎ep管中的细胞样品,离心,4℃,12000rpm,15min;离心之后,取上清液体100μl作为对照,加入25μl 5x sds loading buffer,沸水浴10min,样品保存;把1.5ml ep管中剩余的上清液体900μl全部转移到另一个新的ep管中做后续实验;
42.取出protein a/g珠子,用ripa裂解液把protein a/g珠子洗三次,将处理之后protein a/g珠子加入到含有上述ep管中,放在4℃翻转摇床上预孵育2h;离心,4℃,2000rpm,1min,吸取上清,不要吸到protein a/g珠子,转移到新的1.5ml ep管中;
43.加入相对应的1μg ip抗体,将ep管放在4℃翻转摇床上孵育过夜;第二天,取出新的protein a/g珠子,用ripa裂解液洗三次,将处理好的protein a/g珠子加入到上述1.5ml ep管中,在4℃翻转摇床上孵育2h;离心,4℃,2000rpm,1min;
44.去掉上清液体,用ripa洗脱液洗4~6次;将ep管放在离心机上离心,4℃,2000rpm,1min,吸干ep管中残留的液体,不要吸到protein a/g珠子;在ep管中加入50μl 2x sds loading buffer,沸水浴10min,离心后,样品放在
‑
20℃冰箱保存;其中,所述ripa洗脱液的配方为0.05m tris,0.001m edta,0.3m nacl,1%np
‑
40,5%glycerol;ph 7.4;
45.(4)免疫荧光
46.弃掉confocal皿培养基,用预冷的pbs洗两次;加入预冷的甲醇和丙酮混合液,甲
醇:丙酮为1:1,4℃,静置20min;用pbs洗三次,每次5min;用含有3%胎牛血清白蛋白bsa的pbs封闭细胞1h;用pbs洗三次,每次5min;一抗用含有3%胎牛血清白蛋白bsa的1x pbs稀释,加入皿中,4℃冰箱孵育过夜;用pbs洗三次,每次10min;荧光二抗用含有10%胎牛血清白蛋白bsa的1x pbs缓冲液稀释,室温避光孵育45min;用pbs洗三次,每次10min;加入用甲醇配置的dapi染液染核,37℃避光孵育5min;用pbs洗三次,每次10min;用激光共聚焦扫描显微镜进行分析和处理。
47.进一步,步骤二中,所述重建nlrp3炎症小体激活,包括:
48.1)在hek293t细胞中,按照质量比10:3:3:10转染pcdna3.1
‑
nlrp3、pcdna3.1
‑
asc、pcdna3.1
‑
caspase
‑
1和pcdna3.1
‑
il
‑
1β四种质粒,转染18h之后,换新鲜培养基,6h后收集培养基和细胞;
49.2)通过elisa试剂盒检测培养基中成熟的il
‑
1β或western blot检测培养基中成熟的il
‑
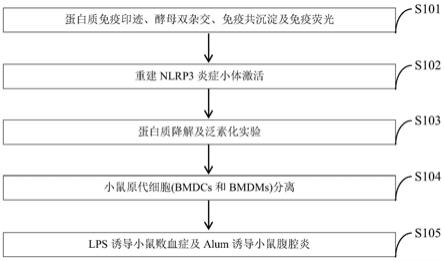
1β和caspase
‑
1,确定nlrp3炎症小体激活;通过在hek293t细胞中重建nlrp3炎症小体激活验证asb17等蛋白对nlrp3炎症小体激活的影响;
50.进一步,步骤三中,所述蛋白质降解和泛素化实验,包括:
51.(1)蛋白质降解实验
52.在hek293t细胞中,转染相对应质粒,收集待处理细胞,用预冷的pbs洗1~2次,吸干残留液体,加入100μl含有1%sds的细胞裂解液,吹打混匀,4℃放置20min;然后4℃,12000rpm离心10min;取80μl管中上清液体,加入加入20μl 5x sds loading buffer,沸水浴10min,样品保存在
‑
20℃冰箱,第二天跑胶,转膜和显色。
53.(2)泛素化实验
54.收集待处理细胞,用预冷的pbs洗1~2次,吸干残留液体,加入100μl含有1%sds的ripa裂解液,吹打混匀,沸水浴5min;加入900μl ripa裂解液,使管中的sds的浓度稀释到0.1%,放置冰上裂解20min,4℃,12000rpm离心10min;管中上清液体100μl作为实验input对照,另外900ul加入相对应的抗体1μg,4℃翻转摇床孵育过夜;第二天上午加入已经洗好的protein a/g,4℃翻转摇床孵育2h,离心,用ripa洗脱液把protein a/g洗5次,最后一次把管内残留的液体吸干;加入50μl 2x sds loading buffer,沸水浴10min,离心后,样品保存在
‑
20℃冰箱。
55.进一步,步骤四中,所述小鼠原代细胞分离(bmdcs和bmdms),包括:
56.(1)分离小鼠骨髓来源树突状细胞bmdcs
57.准备6~8周龄的野生小鼠和asb17敲除小鼠,取出所有股骨和胫骨;将骨移至超净台内,在70%酒精的中浸泡2~5min,用无菌的pbs洗2次;用注射器抽取pbs,反复冲洗出骨髓至培养皿中,直至骨完全变白;悬液用200目尼龙网;过滤,离心,用含20ng/ml gm
‑
csf的rpmi 1640培养基重悬,铺至100mm细菌培养皿;第3天时,向培养皿中再加入10ml含20ng/ml gm
‑
csf的rpmi 1640培养基;第6天和第8天分别半量换液,即收集旧培养液,离心后用含20ng/ml重组小鼠gm
‑
csf的完全培养液重悬细胞沉淀,再将细胞悬液放回原皿;第10天时可收集细胞,即为bmdcs;
58.(2)分离小鼠骨髓来源巨噬细胞bmdms
59.准备6~8周龄的野生小鼠和asb17敲除小鼠,取出所有股骨和胫骨;将骨移至超净台内,在70%酒精的中浸泡2~5min,用无菌的pbs洗2次;用注射器抽取pbs,反复冲洗出骨
髓至培养皿中,直至骨完全变白;悬液用200目尼龙网;过滤,再离心,用红细胞裂解液去掉红细胞;向培养皿中加入含10~20%l929细胞培养基的rpmi 1640培养基;第3天和第5天分别换液,即换为10~20%l929细胞培养基的rpmi 1640培养基,第6天即为bmdms。
60.进一步,步骤五中,所述lps诱导小鼠败血症和alum诱导小鼠腹腔炎,包括:
61.(1)lps诱导小鼠败血症:
62.准备两组小鼠,每组asb17+/+和asb17
‑
/
‑
小鼠各10~16只,鼠龄为7周,性别保持一致,给这两组小鼠分别腹腔注射30mg/kg的lps,每12小时观察小鼠的生存情况和体重并记录数据,当存活小鼠的生存情况和体重稳定时停止记录,用graphpad prism软件制作出生存曲线图和体重变化图;
63.(2)alum诱导小鼠腹腔炎:
64.准备两组小鼠,每组包括asb17+/+和asb17
‑
/
‑
小鼠各3~6只,鼠龄为7周,性别保持一致,给两组小鼠分别腹腔注射组注射1ml含有imject alum 700μg的生理盐水,8小时后,取小鼠的腹腔液测定腹腔液中il
‑
1β和tnf
‑
ɑ
的含量;同样的小鼠,12小时后,取小鼠的腹腔液测定腹腔液中il
‑
1β和tnf
‑
ɑ
的含量,腹腔液中的细胞用流式细胞仪测定各种细胞的数量;
65.本发明提供一种用于检测asb17制备治疗nlrp3炎症小体相关炎症性疾病药物药效的试剂盒,所述试剂盒包含所述asb17制备治疗nlrp3炎症小体相关炎症性疾病药物药效的方法的试剂。
66.结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明提供的asb17在治疗nlrp3炎症小体相关炎症性疾病中的应用中,本发明研究工作发现:(1)asb17可以和nlrp3相互;(2)在细胞水平发现asb17能够促进nlrp3泛素化和降解,同时抑制nlrp3炎症小体激活;(3)在动物水平发现asb17能够抑制lps诱导的败血症和alum诱导的腹腔炎。在实验结果和国内外研究进展的基础上,探究树突状细胞中asb17抑制nlrp3炎症小体激活的具体机制和作用,这为宿主抑制nlrp3炎症小体激活提供实验依据,为nlrp3炎症小体在获得性免疫中的调控作用提供理论基础,以及为防治nlrp3炎症小体相关疾病提供新的思路。
67.(1)本发明的研究意义:
68.nlrp3炎症小体是目前研究最为深入的炎症小体,它的刺激物种类特别多,包括流感病毒,寨卡病毒,脑心肌炎病毒,腺病毒,李斯特菌,金黄色葡萄球菌,白色念珠菌,酿酒酵母,atp,nigericin,尿酸单钠,石棉,二氧化硅晶体,铝盐晶体,纤维状淀粉样蛋白
‑
β肽,等等。而nlrp3炎症小体的调节失控和很多炎症性疾病紧密相关,例如痛风、2型糖尿病、自身免疫性疾病、动脉粥样硬化、等等。如何抑制nlrp3炎症小体的激活成为全世界科研人员关注的科学问题和临床难题,本发明揭示树突状细胞中asb17抑制nlrp3炎症小体的具体机制和作用,为宿主抑制nlrp3炎症小体激活提供实验依据,为丰富nlrp3炎症小体的调控机理提供理论基础,以及为防治nlrp3炎症小体相关疾病提供新的思路。
69.(2)本发明的研究目标明确
70.本发明的研究目标非常明确,紧紧围绕asb17抑制nlrp3炎症小体激活的具体机制和作用展开两个方面的研究。
71.本发明的创新之处在于:
72.(1)宿主蛋白asb17抑制nlrp3炎症小体激活的新机制
73.本发明是宿主蛋白抑制炎症小体及相关疾病的分子机制研究,利用酵母双杂交进行大规模的初步筛选以及免疫共沉淀实验发现asb17能够分别与nlrp3相互作用。在细胞水平上,阐明在树突状细胞中asb17抑制nlrp3炎症小体激活的具体机制;在动物水平上,探究asb17抑制nlrp3炎症小体及相关疾病的作用。这为揭示宿主蛋白抑制nlrp3炎症小体激活的提供新机制。
74.(2)本发明提供抗炎新蛋白。本发明阐明asb17抑制nlrp3炎症小体激活的机制,为nlrp3炎症小体及相关疾病提供抗炎新蛋白。
附图说明
75.为了更清楚地说明本发明实施例的技术方案,下面将对本发明实施例中所需要使用的附图做简单的介绍,显而易见地,下面所描述的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下还可以根据这些附图获得其他的附图。
76.图1是本发明实施例提供的asb17能够和nlrp3相互作用示意图。
77.图1(a
‑
b)是本发明实施例提供的在hek293t细胞中验证pyd(nlrp3的第一个结构域)和目标蛋白(由酵母双杂交筛选得到)pa2g4,asb17,n4bp2l2,sgip1和fam35a的相互作用。
78.图1(c)是本发明实施例提供的在hek293t细胞中,以igg作为对照,进一步验证pyd与asb17和n4bp2l2的相互作用。
79.图1(d
‑
e)是本发明实施例提供的通过酵母双杂交回复实验验证pyd和asb17
‑
c(asb17的c端)的相互作用。
80.图1(f
‑
g)是本发明实施例提供的在hek293t细胞中通过western blotting和免疫荧光验证asb17和nlrp3的相互作用以及共定位情况。
81.图1(h
‑
i)是本发明实施例提供的在hek293t细胞中验证asb17分别与nlrp3,asc,caspase
‑
1和il
‑
1β的相互作用。
82.图1(j
‑
k)是本发明实施例提供的在hek293t细胞中验证nlrp3分别与asb17以及asb17截短的相互作用。
83.图2是本发明实施例提供的asb17能够抑制nlrp3炎症小体激活示意图。
84.图2(a
‑
b)是本发明实施例提供的在hek293t细胞中转染nlrp3,asc,pro
‑
casapase
‑
1和pro
‑
il
‑
1β四种质粒,通过elisa实验验证重建nlrp3炎症小体激活模型。
85.图2(c
‑
d)是本发明实施例提供的在重建nlrp3炎症小体激活模型中,通过elisa实验验证目标蛋白对nlrp3炎症小体激活的作用。
86.图2(e
‑
f)是本发明实施例提供的在重建nlrp3炎症小体激活模型中,通过elisa和western blotting实验验证asb17和相应对照对nlrp3炎症小体激活的作用。
87.图2(g)是本发明实施例提供的在重建nlrp3炎症小体激活模型中,通过elisa实验验证目标蛋白asb17在加刺激物nigericin(10μm,2h)和不加刺激物对nlrp3炎症小体激活的作用。
88.图2(h)是本发明实施例提供的通过rt
‑
pcr和western blotting实验验证过表达
asb17的thp
‑
1稳转细胞系是否构建成功。
89.图2(i)是本发明实施例提供的在过表达asb17的thp
‑
1稳转细胞系和其对照细胞系中,通过elisa实验验证asb17在atp(5mm,30min),nigericin(10μm,1h)和alum(400μg/ml,6h)的刺激下对nlrp3炎症小体激活的作用。
90.图2(j)是本发明实施例提供的在过表达asb17的thp
‑
1稳转细胞系中,通过免疫沉淀验证在atp(5mm,30min)和nigericin(10μm,1h)的刺激下asb17和nlrp3相互作用的动态变化。
91.图3是本发明实施例提供的asb17能够促进nlrp3泛素化并导致其降解示意图。
92.图3(a
‑
b)是本发明实施例提供的在hek293t细胞中验证asb17是否能够分别降解nlrp3,asc,pro
‑
casapase
‑
1和pro
‑
il
‑
1β四种蛋白。
93.图3(c)是本发明实施例提供的在hek293t细胞中验证不同浓度梯度的asb17能够促进nlrp3蛋白的降解。
94.图3(d)是本发明实施例提供的在hek293t细胞中验证asb17在加刺激物atp(5mm,1h)和nigericin(10μm,2h)和不加刺激物的情况下对nlrp3蛋白的降解。
95.图3(e)是本发明实施例提供的在hek293t细胞中,通过western blottting实验验证mg132(蛋白酶体抑制剂)能够抑制asb17对nlrp3的降解。
96.图3(f)是本发明实施例提供的nlrp3泛素化位点点突变的示意图。
97.图3(g)是本发明实施例提供的在hek293t细胞中,通过western blotting确定asb17对nlrp3突变蛋白的影响。
98.图3(h)是本发明实施例提供的在hek293t细胞中,通过elisa测定il
‑
1β含量确定asb17对nlrp3
‑
k689r突变的影响。
99.图3(i)是本发明实施例提供的在hek293t细胞中,通过泛素化实验确定asb17对nlrp3突变蛋白的影响。
100.图3(j)是本发明实施例提供的在hek293t细胞中,通过泛素化实验确定asb17促进nlrp3泛素化的类型(k48o,k63o,k48r和k63r)。
101.图4是本发明实施例提供的在树突状细胞中asb17抑制il
‑
1β分泌示意图。
102.图4(a)图中数据为造血干细胞和祖细胞(hematopoietic stem和progenitor cells,hspcs)中asb17,nlrp3,asc,caspase
‑
1和il
‑
1β的mrna水平(https://www.ebi.ac.uk/gxa/home)。基因在tpm中的表达水平代表不同的颜色。高(红色):1000<tpm;中(橙色):10<tpm<1000;低(黄色):0<tpm<10;低于临界值(绿色):tpm=0。
103.图4(b
‑
d)是本发明实施例提供的分离asb17
+/+
和asb17
‑
/
‑
小鼠中的bmdms,在lps(1μg/ml,6h)刺激下,通过rt
‑
pcr检测刺激前后nlrp3,il
‑
1β和asb17的mrna水平。
104.图4(e
‑
g)是本发明实施例提供的分离asb17
+/+
和asb17
‑
/
‑
小鼠中的bmdcs,在lps(1μg/ml,6h)刺激下,通过rt
‑
pcr检测刺激前后nlrp3,il
‑
1β和asb17的mrna水平。
105.图4(h
‑
i)是本发明实施例提供的分离asb17
+/+
和asb17
‑
/
‑
小鼠中的bmdms,在lps(1μg/ml,6h)以及atp(5mm,30min)或nigericin(10μm,1h)刺激下,通过elisa实验测定细胞培养基中炎症因子il
‑
1β和tnf
‑
ɑ
的含量。
106.图4(j
‑
k)是本发明实施例提供的分离asb17
+/+
和asb17
‑
/
‑
小鼠中bmdcs,在lps(1μg/ml,6h)以及atp(5mm,30min)或nigericin(10μm,1h)刺激下,通过elisa实验测定细胞培
养基中炎症因子il
‑
1β和tnf
‑
ɑ
的含量。
107.图5是本发明实施例提供的在dcs中asb17特异性抑制nlrp3炎症小体激活示意图。
108.图5(a
‑
d)是本发明实施例提供的从asb17
+/+
和asb17
‑
/
‑
小鼠小鼠骨髓中分离bmdcs,通过形态,rt
‑
pcr,凝胶电泳和流式鉴定分离的bmdcs。
109.图5(e
‑
f)是本发明实施例提供的分离asb17
+/+
和asb17
‑
/
‑
小鼠中bmdcs,在lps(1μg/ml,6h)以及atp(5mm,30min)或nigericin(10μm,1h)刺激下,通过elisa实验测定细胞培养基中炎症因子il
‑
1β和tnf
‑
ɑ
的含量。
110.图5(g
‑
h)是本发明实施例提供的分离asb17
+/+
和asb17
‑
/
‑
小鼠中bmdcs,在lps(1μg/ml,6h)以及mdp(100ug/ml,12h)或alum(400μg/ml,6h)刺激下,通过elisa实验测定细胞培养基中炎症因子il
‑
1β和tnf
‑
ɑ
的含量。
111.图5(i)是本发明实施例提供的分离asb17
+/+
和asb17
‑
/
‑
小鼠中bmdcs,在lps(1μg/ml,6h)以及atp(5mm,30min)或nigericin(10μm,1h)刺激下,通过western blotting实验测定细胞培养基和细胞裂解液中各种蛋白的含量。
112.图5(j)是本发明实施例提供的分离asb17
+/+
和asb17
‑
/
‑
小鼠中bmdcs,在lps(1μg/ml,6h)以及mdp(100ug/ml,12h)或alum(400μg/ml,6h)刺激下,通过western blotting实验测定细胞培养基和细胞裂解液中各种蛋白的含量。
113.图5(k)是本发明实施例提供的分离asb17
+/+
和asb17
‑
/
‑
小鼠中bmdcs,分别加入慢病毒plenti
‑
nc以及plenti
‑
flag
‑
asb17,36小时后,加入lps(1μg/ml,6h)以及atp(5mm,30min)或nigericin(10μm,1h)刺激下,通过elisa实验测定细胞培养基中炎症因子il
‑
1β含量。
114.图5(l
‑
m)是本发明实施例提供的从asb17
+/+
和asb17
‑
/
‑
小鼠骨髓中分离bmdcs,在lps(1μg/ml,6h)以及atp(5mm,30min)刺激下,通过asc斑点实验验证asb17对nlrp3炎症小体激活的影响。
115.图6是本发明实施例提供的asb17在lps诱导败血症和alum诱导腹腔炎中的作用示意图。
116.图6(a)是本发明实施例提供的通过mut
‑
f/wt
‑
r和wt
‑
f/mut
‑
r两对引物验证小鼠的基因型。
117.图6(b)是本发明实施例提供的通过rt
‑
pcr检测asb17
+/+
和asb17
‑
/
‑
小鼠的不同器官中asb17的mrna含量。
118.图6(c
‑
d)是本发明实施例提供的在asb17
+/+
和asb17
‑
/
‑
小鼠中腹腔注射lps(30mg/kg,6h),取小鼠血液,通过elisa实验测定血液中炎症因子il
‑
1β和tnf
‑
ɑ
的含量;pbs组,n=3;lps组,n=6。
119.图6(e
‑
f)是本发明实施例提供的准备asb17
+/+
和asb17
‑
/
‑
(各10
‑
16只),通过腹腔注射pbs和含lps(30mg/kg)的pbs,统计小鼠的生存情况和体重。
120.图6(g
‑
h)是本发明实施例提供的准备asb17
+/+
和asb17
‑
/
‑
小鼠,通过腹腔注射pbs和含alum(700μg)的pbs,8小时后,取小鼠腹腔液,通过elisa实验检测小鼠腹腔液中的炎症因子(il
‑
1β和tnf
‑
α);pbs组,n=3;alum组,n=6。
121.图6(i
‑
m)是本发明实施例提供的准备asb17
+/+
和asb17
‑
/
‑
小鼠,通过腹腔注射pbs和含alum(700μg)的pbs,12小时后,取小鼠腹腔液,通过流式实验检测小鼠腹腔液中的腹腔
渗出细胞,中性粒细胞(ly6g+f4/80
‑
),单核
‑
巨噬细胞(f4/80+)的数量;同时取asb17
+/+
和asb17
‑
/
‑
小鼠的脾组织做h&e染色,黑色箭头为中性粒细胞浸润;pbs组,n=3;alum组,n=6。
122.图7是本发明实施例提供的验证asb17制备治疗nlrp3炎症小体相关炎症性疾病药物药效的方法流程图。
具体实施方式
123.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
124.针对现有技术存在的问题,本发明提供了一种asb17在治疗nlrp3炎症小体相关炎症性疾病中的应用,下面结合附图对本发明作详细的描述。
125.如图8所示,本发明实施例提供的验证asb17制备治疗nlrp3炎症小体相关炎症性疾病药物药效的方法包括以下步骤:
126.s101,蛋白质免疫印迹、酵母双杂交、免疫共沉淀以及免疫荧光;
127.s102,重建nlrp3炎症小体激活;
128.s103,蛋白质降解及泛素化实验;
129.s104,小鼠原代细胞(bmdcs)分离及细胞刺激实验;
130.s105,lps诱导小鼠败血症及alum诱导小鼠腹腔炎。
131.下面结合具体实施例对本发明的技术方案作进一步描述。
132.1、本发明研究工作发现:(1)asb17可以和nlrp3相互作用;(2)在细胞水平发现asb17能够促进nlrp3泛素化和降解,同时抑制nlrp3炎症小体激活;(3)在动物水平发现asb17能够抑制lps诱导的败血症和alum诱导的腹腔炎。在实验结果和国内外研究进展的基础上,探究树突状细胞中asb17抑制nlrp3炎症小体激活的具体机制和作用,这为宿主抑制nlrp3炎症小体激活提供实验依据,为nlrp3炎症小体在获得性免疫中的调控作用提供理论基础,以及为防治nlrp3炎症小体相关疾病提供新的思路。
133.(1)本发明的研究意义重要
134.nlrp3炎症小体是目前研究最为深入的炎症小体,它的刺激物种类特别多,包括流感病毒,寨卡病毒,脑心肌炎病毒,腺病毒,李斯特菌,金黄色葡萄球菌,白色念珠菌,酿酒酵母,atp,nigericin,尿酸单钠,石棉,二氧化硅晶体,铝盐晶体,纤维状淀粉样蛋白
‑
β肽,等等。而nlrp3炎症小体的调节失控和很多炎症性疾病紧密相关,例如痛风、2型糖尿病、自身免疫性疾病、动脉粥样硬化、等等。如何抑制nlrp3炎症小体的激活成为全世界科研人员关注的科学问题和临床难题,本发明揭示树突状细胞中asb17抑制nlrp3炎症小体的具体机制和作用,为宿主抑制nlrp3炎症小体激活提供实验依据,为丰富nlrp3炎症小体的调控机理提供理论基础,以及为防治nlrp3炎症小体相关疾病提供新的思路。
135.(2)本发明的研究目标明确
136.本发明的研究目标非常明确,紧紧围绕asb17抑制nlrp3炎症小体激活的具体机制和作用展开两个方面的研究。
137.本发明的创新之处在于:
138.(1)asb17抑制nlrp3炎症小体激活的新机制
139.本发明是宿主蛋白抑制炎症小体及相关疾病的分子机制研究,利用酵母双杂交进行大规模的初步筛选以及免疫共沉淀实验发现asb17能够分别与nlrp3相互作用。在细胞水平上,阐明在树突状细胞中asb17抑制nlrp3炎症小体激活的具体机制;在动物水平上,探究asb17抑制nlrp3炎症小体及相关疾病的作用。这为揭示宿主蛋白抑制nlrp3炎症小体激活的提供新机制。
140.(2)提供抗炎新蛋白。
141.本发明阐明asb17抑制nlrp3炎症小体激活的机制,为nlrp3炎症小体及相关疾病提供抗炎新蛋白。
142.2、技术内容
143.2.1明确asb17抑制nlrp3炎症小体激活的具体机制
144.(1)asb17和nlrp3相互作用,并能够促进nlrp3降解
145.通过免疫共沉淀,酵母双杂交和免疫荧光,确定asb17和nlrp3相互作用;通过蛋白质降解实验,确定asb17能够促进nlrp3的降解。
146.(2)asb17抑制nlrp3炎症小体激活是通过降解nlrp3蛋白
147.通过蛋白质降解实验发现asb17仅对nlrp3炎症小体组分(nlrp3,asc和caspase
‑
1)以及il
‑
1β四种蛋白中的nlrp3蛋白有降解;asb17促进nlrp3泛素化和降解的位点为nlrp3
‑
k689。
148.2.2在树突状细胞中asb17抑制nlrp3炎症小体激活功能的影响
149.通过分离小鼠原代细胞(bmdms和bmdcs),通过细胞刺激实验发现树突状细胞中asb17能够抑制il
‑
1β的分泌以及nlrp3炎症小体激活。
150.2.3动物水平明确asb17对nlrp3炎症小体相关疾病的作用
151.本发明发现asb17抑制lps诱导的败血症模型以及alum诱导腹腔炎模型,这两个模型都是nlrp3炎症小体相关疾病模型。本发明推测asb17是体内的一个通过抑制nlrp3炎症小体激活的抑制炎症蛋白
152.3、实验方法
153.(1)细胞总rna提取和荧光定量pcr
154.1).根据细胞的量加入0.5ml或1ml的trizol溶液,振荡器上振荡10s,然后放入
‑
80冰箱里保存。
155.2).拿出样品出来解冻,根据trizol溶液的量(每0.5ml trizol溶液加入0.1ml氯仿)加入氯仿,盖上盖子,剧烈振荡10s,然后放置2~3min。
156.3).把ep管放入
‑
4℃冷冻离心机中,12000rpm,离心15min。
157.4).离心之后,最上面溶液转移到新的ep管中,加入等体积的异丙醇,然后将ep管轻轻混匀,室温放置5min。
158.5).4℃冷冻离心机中,12000rpm,离心15min,看到在底部有白色沉淀。
159.6).用75%的乙醇洗涤白色沉淀两次。
160.7).离心之后,去掉上清,干燥5min。
161.8).在ep管中加入18μl depc水,55℃水浴10min。
162.9).取出新的pcr管,加入17μl rna样品和1μl oligo dt,把混匀的pcr管放入pcr仪中,70℃,5min,然后立即把pcr管放置在冰上。
163.10).在pcr管中,配置反转录pcr(rt
‑
pcr)反应体系。把配置好的反应体系放在pcr仪上,程序根据反转录酶的说明书来进行设定。
164.11).用以上获得cdna为模板,配置实时荧光定量pcr(real
‑
time pcr,qpcr)反应体系。以单个体系20μl为例:1μl cdna、1μl引物(primer f/primerr)、8μl ddh2o和10μl 2x mix buffer。
165.12).将配置好的pcr反应体系加入96孔pcr板中,然后放到实时荧光定量pcr仪(roche 480)上进行分析。
166.(2)细胞的培养和转染
167.细胞的培养
168.hek293t细胞培养于含有10%胎牛血清fbs和双抗(100μg/ml链霉素和100u/ml氨苄青霉素)的dulbecco modified eagle medium(dmem)培养基中。thp
‑
1细胞培养于含有10%胎牛血清fbs(gibco)和双抗的roswell park memorial institute(rpmi)1640培养基中,tpa诱导分化的thp
‑
1巨噬细胞的过程是:加入tpa(40~100ng/ml)诱导分化thp
‑
1细胞过夜,第二天上午细胞贴壁之后,给细胞换成rpmi 1640培养基,48小时之后(中间再换一次rpmi 1640培养基),细胞即可用来做刺激实验。小鼠成纤维细胞系l929培养于含有10%胎牛血清fbs和双抗的dmem培养基中。
169.细胞的转染
170.1).当hek293t细胞的密度达到70%~80%时,即可进行转染。
171.2).准备好质粒和转染试剂(pei),用opti
‑
mem培养液分别稀释质粒和转染试剂。按照1:3的比例加入转染试剂,即转染1μg质粒需要加入3
‑
4μl pei。
172.3).将稀释好的质粒加入到稀释好的转染试剂中,混匀,静置20min。
173.4).将混合液体加入培养板中,轻轻摇晃培养板,混匀。
174.(3)小鼠原代细胞分离
175.分离小鼠骨髓来源树突状细胞(bmdcs)
176.1).准备野生小鼠和asb17敲除小鼠(6~8周龄),取出所有股骨和胫骨。
177.2).将骨移至超净台内,在70%酒精的中浸泡2~5min,用无菌的pbs洗2次。
178.3).用注射器抽取pbs,反复冲洗出骨髓至培养皿中,直至骨完全变白;悬液用200目尼龙网。过滤,再离心,用含20ng/ml gm
‑
csf的rpmi 1640培养基重悬,铺至100mm细菌培养皿。
179.4).第3天时,向培养皿中再加入10ml含20ng/ml gm
‑
csf的rpmi 1640培养基;第6天和第8天分别半量换液,即收集旧培养液,离心后用含20ng/ml重组小鼠gm
‑
csf的完全培养液重悬细胞沉淀,然后再将细胞悬液放回原皿;第10天时可收集细胞,即为bmdcs。
180.分离小鼠骨髓来源巨噬细胞(bmdms)
181.1).准备野生小鼠和asb17敲除小鼠(6~8周龄),取出所有股骨和胫骨。
182.2).将骨移至超净台内,在70%酒精的中浸泡2~5min,用无菌的pbs洗2次。
183.3).用注射器抽取pbs,反复冲洗出骨髓至培养皿中,直至骨完全变白;悬液用200目尼龙网。过滤,再离心,用红细胞裂解液去掉红细胞。
184.4).向培养皿中加入含10~20%l929细胞培养基的rpmi 1640培养基。
185.5).第3天和第5天分别换液(10~20%l929细胞培养基的rpmi 1640培养基),第6
天即为bmdms。
186.(4)蛋白质免疫印迹
187.1).细胞样品的制备:收集细胞,用遇冷的pbs缓冲液洗2次;加入一定体积的细胞裂解液,同时加入cocktail蛋白酶抑制剂,重悬细胞,放在冰上;用超声破碎仪处理细胞,管中液体由浑浊变为澄清即可;离心,4℃,12000rpm15分钟;转移上清到新的1.5ml ep管中,加入5x sds loading buffer,沸水浴10min。
188.2).免疫印迹:跑胶和转膜完成后,取出nc膜,用含有5%脱脂牛奶的pbst(pbs+tween)缓冲液封闭45min;pbst洗三次,每次5min;一抗用pbst缓冲液稀释,然后加到膜上,4℃孵育过夜;回收一抗,pbst洗3次,每次5min;加入二抗(用含有2%脱脂牛奶的pbst配制),室温孵育45min;pbst洗3次,每次10min;显色和曝光。
189.(5)免疫共沉淀
190.1).收集待处理的细胞样品,用预冷的pbs洗2次,加入0.5ml~1ml ripa裂解液(配方为0.05m tris,0.001m edta,0.15m nacl,1%np
‑
40,5%glycerol;ph 7.4)和cocktail蛋白酶抑制剂。混匀之后,将ep管放在冰上裂解20min。
191.2).通过超声仪超声破碎ep管中的细胞样品,离心,4℃,12000rpm,15min。
192.3).离心之后,取上清液体100μl作为对照,加入25μl 5x sds loading buffer,沸水浴10min,样品保存。把1.5ml ep管中剩余的上清液体900μl全部转移到新的ep管中做后续实验。
193.4).取出protein a/g珠子,用ripa裂解液把protein a/g珠子洗三次,将处理之后protein a/g珠子加入到含有上述ep管中,放在4℃翻转摇床上预孵育2h。
194.5).离心,4℃,2000rpm,1min,吸取上清,转移到新的1.5ml ep管中。
195.6).加入相对应的1μg ip抗体,将ep管放在4℃翻转摇床上孵育过夜。
196.7).第二天,取出新的protein a/g珠子,用ripa裂解液洗三次,将处理好的protein a/g珠子加入到上述1.5ml ep管中,在4℃翻转摇床上孵育2h。
197.8).离心,4℃,2000rpm,1min。去掉上清液体,然后用ripa洗脱液(配方为0.05m tris,0.001m edta,0.3m nacl,1%np
‑
40,5%glycerol;ph 7.4)洗4~6次。
198.9).将ep管放在离心机上离心,4℃,2000rpm,1min,吸干ep管中残留的液体(注意不要吸到protein a/g珠子)。
199.10).在ep管中加入50μl 2x sds loading buffer,沸水浴10min,离心之后,样品放在
‑
20℃冰箱保存。
200.(6)免疫荧光
201.弃掉confocal皿培养基,用预冷的pbs洗两次;加入预冷的甲醇和丙酮混合液(甲醇:丙酮为1:1),4℃,静置20min;用pbs洗三次,每次5min;用含有3%胎牛血清白蛋白(bsa)的pbs封闭细胞1h;用pbs洗三次,每次5min;一抗用含有3%胎牛血清白蛋白(bsa)的1x pbs稀释,然后加入皿中,4℃冰箱孵育过夜;用pbs洗三次,每次10min;荧光二抗用含有10%胎牛血清白蛋白(bsa)的1x pbs缓冲液稀释,室温避光孵育45min;用pbs洗三次,每次10min;加入用甲醇配置的dapi染液染核,37℃避光孵育5min;用pbs洗三次,每次10min;用激光共聚焦扫描显微镜进行分析和处理。
202.(7)重建nlrp3炎症小体激活
203.在hek293t细胞中,按照质量比(10:3:3:10)转染pcdna3.1
‑
nlrp3、pcdna3.1
‑
asc、pcdna3.1
‑
caspase
‑
1和pcdna3.1
‑
il
‑
1β四种质粒,转染18h之后,换新鲜培养基,6h之后收集培养基和细胞。通过elisa试剂盒检测培养基中成熟的il
‑
1β或者western blot检测培养基中成熟的il
‑
1β和caspase
‑
1,确定nlrp3炎症小体激活。通过在hek293t细胞中重建nlrp3炎症小体激活可以验证asb17等蛋白对nlrp3炎症小体激活的影响。
204.(8)细胞培养液中蛋白的提取
205.首先,收集细胞培养液样品,在2ml ep管中,依次加入1ml样品,0.5ml甲醇和0.125ml氯仿(按照体积比8:4:1加入),在振荡器混匀后离心,2ml ep管中分为三层,中间白色层为蛋白,去掉最上层的液体(尽量吸取干净),再在2ml ep管中加入0.5ml甲醇,轻轻混匀后离心;然后,2ml ep管中分为两层,下面为蛋白层,吸掉上面液体(尽量吸取干净),把开盖2ml ep管的放入水浴锅中,50℃水浴5min;最后,拿出2ml ep管,加入2x loading buffer煮样,通过western blot分析细胞培养液中成熟il
‑
1β和caspase
‑
1的相对含量。
206.(9)泛素化实验
207.首先,收集待处理细胞,用预冷的pbs洗1~2次,吸干残留液体,加入100μl含有1%sds的ripa裂解液,吹打混匀,沸水浴5min;然后,加入900μl ripa裂解液,使管中的sds的浓度稀释到0.1%,放置冰上裂解20min,4℃,12000rpm离心10min;管中上清液体100μl作为实验input对照,另外900ul加入相对应的抗体1μg,4℃翻转摇床孵育过夜;第二天上午加入已经洗好的protein a/g,4℃翻转摇床孵育2h,离心,用ripa洗脱液把protein a/g洗5次,最后一次,把管内残留的液体吸干;最后加入50μl 2x sds loading buffer,沸水浴10min,离心之后,样品保存在
‑
20℃冰箱。
208.(10)lps诱导小鼠败血症
209.准备两组小鼠,每组asb17
+/+
和asb17
‑
/
‑
小鼠各10~16只,鼠龄为7周,性别保持一致,给这两组小鼠分别腹腔注射lps(30mg/kg),每12小时观察小鼠的生存情况和体重并记录数据,当存活小鼠的生存情况和体重稳定时停止记录,用graphpad prism软件制作出生存曲线图和体重变化图。
210.(11)alum诱导小鼠腹腔炎
211.准备两组小鼠,每组包括asb17
+/+
和asb17
‑
/
‑
小鼠各3~6只,鼠龄为7周,性别保持一致,给这两组小鼠分别腹腔注射组注射1ml含有imject alum(700μg)的生理盐水,8小时之后,取小鼠的腹腔液测定腹腔液中il
‑
1β和tnf
‑
ɑ
的含量;同样处理上述小鼠,12小时之后,取小鼠的腹腔液测定腹腔液中il
‑
1β和tnf
‑
ɑ
的含量,腹腔液中的细胞用流式细胞仪测定各种细胞的数量。
212.4、实验结果与讨论
213.nlrp3炎症小体的激活是宿主面对外源病原体或者危险信号产生的免疫应答,nlrp3炎症小体的激活会产生大量的促炎因子il
‑
1β,同时可以导致细胞焦亡。宿主内负调控nlrp3炎症小体的激活的机制是防止炎症小体的过度激活,这是宿主保护自身的重要机制。为了研究宿主自身负调控nlrp3炎症小体的分子机制,用nlrp3的pyd结构域为诱饵蛋白继续筛选目的蛋白。通过酵母双杂交初步筛选以及测序排除非编码区和移码,最终筛选到了pa2g4、asb17、n4bp2l2、sgip1和fam35a。通过在hek293t细胞中的co
‑
ip实验和重建nlrp3炎症小体实验发现asb17能够和nlrp3有相互作用,同时它能够抑制nlrp3炎症小体的激活,
这引起了本发明的极大的兴趣。锚蛋白重复序列和含有socs盒的蛋白17(ankyrin repeat和socs box containing protein 17,asb17)是asb家族中的一个成员。asb17目前的功能还不是很清楚,基本没有文献报道,只知道它能够在小鼠的睾丸器官中大量表达。本文发现了asb17新的功能,首先通过酵母双杂交发现asb17的c端能够和nlrp3的pyd结构域有相互作用,随后通过co
‑
ip实验发现过表达的asb17和nlrp3可以在293t中相互作用,同时它又能在hek293t细胞中抑制nlrp3炎症小体的激活以及在动物水平asb17能够抑制lps诱导的败血症和alum诱导的腹腔炎,判断它可能是宿主体内一个重要的抑制nlrp3炎症小体激活的蛋白,对于保护宿主自身nlrp3炎症小体的过度激活起着重要。因此本发明深入探讨了asb17在抑制nlrp3炎症小体激活中的功能。
214.4.1 asb17能够和nlrp3相互作用
215.为了探究nlrp3炎症小体激活调控的宿主蛋白,本发明使用酵母双杂交筛选法筛选了与nlrp3
‑
pyd相互作用的细胞蛋白,包括pa2g4、asb17、n4bp2l2、sgip1和fam35a。通过免疫共沉淀(co
‑
ip)验证nlrp3
‑
pyd分别与pa2g4、asb17、n4bp2l2、sgip1和fam35a。结果表明pyd与asb17和sgip1相互作用(图1a~b)。为了进一步验证pyd和asb17相互作用,以igg作为对照,结果发现pyd能够和asb17相互作用(图1c)。利用酵母双杂交回复实验发现pyd与酵母双杂交筛选的蛋白asb17
‑
c(asb17的c端)有相互作用(图1d~e)。hek293t细胞中共转染asb17和nlrp3质粒,co
‑
ip结果表明asb17与nlrp3相互作用(图1f)。免疫荧光结果表明单独的asb17和nlrp3在细胞质中共定位(图1g)。为了探究asb17与nlrp3炎症小体所有组分蛋白相互作用,在hek293t细胞中共转染asb17与nlrp3、asc、caspase
‑
1或il
‑
1β质粒,co
‑
ip结果发现asb17能特异性的和nlrp3相互作用,但不能与asc、caspase
‑
1或il
‑
1β相互作用(图1h~i)。作为asb家族蛋白的成员,asb17包含n端锚蛋白重复(ank)域和c端细胞因子信号抑制器(socs)框域。为了确定与nlrp3相互作用的区域,本发明构建了一系列带有flag标签的asb17截断突变体(图1j)。co
‑
ip结果表明nlrp3主要和asb17的c端部分(178aa
‑
295aa)相互作用。总之,本发明实验结果表明asb17能够和nlrp3相互作用。
216.4.2 asb17能够抑制nlrp3炎症小体激活
217.nlrp3炎症小体重建体系常用来验证蛋白对nlrp3炎症小体激活的影响。本发明在hek293t细胞中重建nlrp3炎症小体激活,在细胞中转染nlrp3、asc和pro
‑
caspase
‑
1(pro
‑
casp
‑
1)和pro
‑
il
‑
1β四种质粒。通过elisa和western blotting实验确定hek293t中nlrp3炎症小体重建成功,在细胞培养液中检测到成熟的il
‑
1β和caspase
‑
1(图2a~b)。利用nlrp3炎症小体重建体系,确定预选蛋白pa2g4、asb17、n4bp2l2、sgip1和fam35a对nlrp3炎症小体激活的作用。实验结果显示pa2g4和asb17抑制nlrp3炎症小体激活,n4bp2l2、sgip1和fam35a对nlrp3炎症小体激活没有显著影响(图2c~d)。为了进一步验证asb17对nlrp3炎症小体激活的作用,转染asb17和lrrc6(作为阴性对照)以及nlrp3炎症小体组分到hek293t细胞中,elisa实验结果表明asb17能够显著抑制il
‑
1β分泌,lrrc6对il
‑
1β分泌影响不大(图2e);western blotting实验结果表明asb17能够显著抑制培养基中成熟的il
‑
1β(p17)和caspase
‑
1(p20),而lrrc6对它们没有显著影响(图2f)。同时本发明也发现:在细胞裂解物中,asb17能够促进nlrp3蛋白的降解,而对asc、caspase
‑
1和il
‑
1β蛋白相对不受asb17的影响没有作用(图2f)。因此,这些结果表明在hek293t细胞中过表达asb17能够特异性抑制nlrp3炎症小体激活。在巨噬细胞中进一步探索了asb17在抑制内源性nlrp3炎症小体激活
的作用。本发明构建了稳定表达asb17蛋白质的thp
‑
1细胞系(图2h)。本发明还注意到内源性asb17 mrna在thp
‑
1细胞中几乎不表达(图2h)。在atp、nigericin和alum刺激thp
‑
1分化的巨噬细胞,本发明发现过表达asb17能够显著抑制内源性nlrp3炎症小体激活(图2i)。总之,本发明的实验结果表明过表达asb17能够显着抑制nlrp3炎症小体激活。
218.4.3 asb17能够促进nlrp3泛素化并导致其降解
219.进一步探究asb17抑制nlrp3炎症小体激活的机制,本发明把重点放在asb17对nlrp3炎症小体组分蛋白的作用上。通过western blotting实验发现asb17能够促进nlrp3蛋白的降解,但对asc、caspase
‑
1或il
‑
1β蛋白水平没有影响(图3a~b)。同时本发明发现在hek293t细胞中,asb17以剂量依赖性方式促进nlrp3蛋白水平的降解(图3c)。由于asb17是asb家族蛋白的一员,有部分成员通过泛素
‑
蛋白酶体途径促进其底物降解,从而参与先天免疫反应的调节。本发明探究asb17是否通过促进nlrp3的泛素化和降解来抑制nlrp3炎性体的激活,实验结果表明asb17能够促进nlrp3蛋白的降解,蛋白酶体抑制剂(mg
‑
132)能够抑制asb17介导nlrp3蛋白的降解(图3d),同时asb17能够促进nlrp3的降解(图3e)。通过使用ubpred软件预测nlrp3中潜在的泛素化位点,本发明发现一个lys(lys689)是高置信度,六个lys(lys93、lys192、lys194、lys324、lys430和lys696)是中等置信度。为了研究由asb17介导的nlrp3泛素化的特定位点,构建了七个nlrp3突变质粒,其中k残基被r残基取代(图3f)。asb17促进了野生型nlrp3和六个突变体nlrp3的降解,但未能促进nlrp3
‑
k689r的降解(图3g)。为进一步证实asb17对nlrp3炎症小体激活是通过对nlrp3蛋白降解的作用。本发明重建nlrp3炎性小体和重建nlrp3
‑
k689r炎症小体,elisa实验结果表明:asb17抑制nlrp3炎症小体激活,但未能抑制nlrp3
‑
k689r炎症小体的激活(图3h)。泛素化实验表明asb17没有显着增加nlrp3
‑
k689r的泛素化(图3i)。这些结果表明k689是由asb17介导的nlrp3泛素化的特异性位点(图3g,i)。为了研究asb17介导的nlrp3多泛素化的形式,在转染分析中使用了分别在48位和63位保留单个赖氨酸残基的泛素突变载体k48o和k63o以及仅在48位和63位不保留单个赖氨酸残基的泛素突变载体k48r和k63r。实验结果表明asb17介导了nlrp3的k48泛素化(图3j)。总之,本发明实验结果表明asb17促进nlrp3蛋白泛素化和降解,从而抑制nlrp3炎症小体的激活。
220.4.4在树突状细胞中asb17抑制il
‑
1β分泌
221.lps诱导败血症和alum诱导腹腔炎都是nlrp3炎症小体激活相关模型,asb17是否抑制nlrp3炎症小体激活,从而抑制炎症反应,需要本发明进一步探讨。根据网站提供的信息(https://www.ebi.ac.uk/gxa/home)分析asb17在造血干细胞和祖细胞(hspcs)中的mrna表达情况。结果表明,asb17的mrna水平在巨噬细胞中未检测到,在树突细胞中较低(图4a)。nlrp3炎症小体的激活主要发生在巨噬细胞和树突细胞中,本发明检测nlrp3,il
‑
1β和asb17在lps刺激前后,它们mrna表达水平变化情况。在asb17
+/+
和asb17
‑
/
‑
小鼠分离的骨髓来源的巨噬细胞(bmdms)中,本发明发现在lps刺激之后,nlrp3和il
‑
1βmrna水平明显升高,但是asb17
+/+
和asb17
‑
/
‑
bmdms没有明显差异(图4b
‑
c),而asb17 mrna水平无论是lps刺激前后,还是在asb17
+/+
和asb17
‑
/
‑
bmdms中,表达水平都非常低(图4d)。在asb17
+/+
和asb17
‑
/
‑
小鼠分离的骨髓来源的树突状细胞(bmdcs)中,本发明发现在lps刺激之后,nlrp3和il
‑
1βmrna水平明显升高,但是asb17
+/+
和asb17
‑
/
‑
bmdms没有明显差异(图4e
‑
f),而asb17 mrna水平在asb17
+/+
bmdms中,lps能够促进asb17的表达。asb17mrna水平在asb17
‑
/
‑
bmdms中几乎检
测不到表达(图4g)。本发明探究了asb17在bmdms和bmdcs中对nlrp3炎症小体激活的作用,实验结果表明asb17
+/+
和asb17
‑
/
‑
bmdms在lps+atp和lps+nig的处理下,炎症因子il
‑
1β和tnf
‑
α没有明显差异(图4h
‑
i);asb17
+/+
和asb17
‑
/
‑
bmdcs在lps+atp和lps+nig的处理下,炎症因子il
‑
1β明显升高,而tnf
‑
α没有明显差异(图4j
‑
k)。总之,本发明的实验结果表明,在小鼠树突状细胞中asb17敲除能够增强炎症因子il
‑
1β的分泌。
222.4.5在dcs中asb17特异性抑制nlrp3炎症小体激活
223.为了进一步探讨asb17在小鼠bmdcs中的作用,本发明从asb17
+/+
和asb17
‑
/
‑
小鼠中骨髓中分离bmdcs。从细胞的形态,rt
‑
pcr鉴定以及流式实验确定本发明分离的bmdcs是成功的(图5a~d)。从asb17
+/+
和asb17
‑
/
‑
小鼠中分离的bmdcs,在lps+atp,lps+nigericin和lps+alum的处理下,在asb17
‑
/
‑
bmdcs分泌的炎症因子il
‑
1β显著高于在asb17
+/+
bmdcs(图5e,g),在lps+mdp处理下,在asb17
‑
/
‑
bmdcs分泌的炎症因子il
‑
1β没有显著高于在asb17
+/+
bmdcs(图5g),在lps+atp,lps+nigericin,lps+alum和lps+mdp刺激下,asb17
‑
/
‑
bmdcs和asb17
+/+
bmdcs中分泌的tnf
‑
α没有显著性差异(图5f,h)。通过western blotting实验表明:在lps+atp和lps+nigericin刺激下,asb17
‑
/
‑
bmdcs培养基中成熟的caspase
‑
1和il
‑
1β显著高于asb17
+/+
bmdcs(图5i);在lps+alum刺激下,asb17
‑
/
‑
bmdcs培养基中成熟的il
‑
1β显著高于asb17
+/+
bmdcs(图5j);在lps+mdp(mdp为nlrp1炎症小体刺激物)刺激下,asb17
‑
/
‑
bmdcs培养基中成熟的il
‑
1β没有显著高于asb17
+/+
bmdcs(图5j)。从asb17
+/+
和asb17
‑
/
‑
小鼠中分离的bmdcs,然后感染慢病毒,最后加入刺激物(lps,lps+atp和lps+nigericin),通过elisa实验表明asb17敲除能够促进nlrp3炎症小体激活,asb17蛋白的回复能够抑制nlrp3炎症小体激活(图5k)。在nlrp3炎症小体激活期间,asc斑点被寡聚化为nlrp3炎症小体复合物的一部分,以形成每个细胞的单个大核周焦点。本发明研究了asb17敲除对asc斑点形成的影响。在lps+atp存在的情况下,asc斑点的数量增加(图5l~m)。总之,这些实验结果表明:在树突状细胞中asb17能够特异性抑制nlrp3炎症小体激活。
224.4.6 asb17在lps诱导败血症和alum诱导腹腔炎中的作用
225.asb17敲除小鼠购买北京白奥赛图生物技术有限公司,通过mut
‑
f/wt
‑
r和wt
‑
f/mut
‑
r两对引物验证小鼠的基因型(asb17
+/+
,asb17
‑
/
‑
和asb17
+/
‑
)(图6a)。本发明也检测了asb17
+/+
和asb17
‑
/
‑
小鼠各器官中asb17的mrna表达,,发现它在睾丸的表达量最高,在脾脏和肝脏有表达,在其它的器官中几乎不表达(图6b)。在lps诱导小鼠的败血症模型中本发明探索asb17在小鼠生理水平上的作用,腹腔注射lps 6小时后,本发明检测小鼠血液中的炎症因子il
‑
1β和tnf
‑
α的含量,发现在lps刺激情况下,相比较asb17
+/+
小鼠,asb17
‑
/
‑
小鼠血液中的il
‑
1β更高,而tnf
‑
α没有变化(图6c
‑
d)。为了进一步检测asb17在lps诱导小鼠的败血症模型中作用,腹腔注射lps,每12小时观察小鼠体重和生存情况。本发明发现asb17
+/+
小鼠的体重在48小时内逐渐减少,然后从48小时到96小时小鼠体重逐渐增加,而asb17
‑
/
‑
小鼠的体重在72小时内逐渐减少,从72小时到96小时小鼠体重逐渐增加(图6e),同时发现腹腔注射lps后,asb17
‑
/
‑
小鼠在lps注射后24小时开始死亡,只有大约30%的asb17
‑
/
‑
小鼠存活到96小时,而asb17
+/+
小鼠在lps注射后36小时开始死亡和大约80%的asb17
+/+
小鼠存活到96小时(图6f)。这些结果表明,在lps诱导的败血症模型中,asb17敲除促进炎症因子il
‑
1β分泌以及小鼠死亡,这说明asb17可能是一种重要的抗炎蛋白。为了进一步验证asb17在小鼠生理上的功能,本发明使用alum诱导腹腔炎模型。结果显示,注射alum之后,asb17
‑
/
‑
小鼠
腹腔液中炎症因子il
‑
1β含量明显高于asb17
+/+
小鼠(图6g),而asb17
+/+
小鼠和asb17
‑
/
‑
小鼠腹腔液中炎症因子tnf
‑
α没有明显差异(图6h)。此外,通过流式细胞仪分析腹腔液中的炎症细胞募集,包括腹膜渗出细胞(pec)、中性粒细胞(ly6g+f4/80
‑
)和单核细胞
‑
巨噬细胞(f4/80
+
)(图6i)。与asb17
+/+
小鼠相比,asb17
‑
/
‑
小鼠腹腔液中腹腔渗出细胞、中性粒细胞和单核细胞
‑
巨噬细胞的总数明显增加(图6j
‑
l),同时本发明把asb17
+/+
小鼠和asb17
‑
/
‑
小鼠的脾做h&e染色,发现asb17
‑
/
‑
小鼠脾中的中性粒细胞浸润比asb17
+/+
小鼠中明显增加(图6m)。这些结果表明asb17在alum诱导腹膜炎模型中起着抑制炎症作用。综上所述,asb17可能在小鼠生理水平上起着抗炎作用。
226.在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上;术语“上”、“下”、“左”、“右”、“内”、“外”、“前端”、“后端”、“头部”、“尾部”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语“第一”、“第二”、“第三”等仅用于描述目的,而不能理解为指示或暗示相对重要性。
227.以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,都应涵盖在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1