一种谷胱甘肽敏感的纳米载药系统及其制备方法和应用
1.本发明属于抗肿瘤药物递送技术领域,具体地,涉及一种谷胱甘肽敏感的纳米载药系统及其制备方法和应用。
背景技术:
2.免疫疗法在临床治疗各种实体肿瘤如黑色素瘤、肾细胞癌(rcc)和非小细胞肺癌(nsclc)中显示出很强的抗肿瘤活性。肿瘤免疫治疗通过主动或被动方式诱导机体产生肿瘤特异性免疫反应,抑制肿瘤增长,防止肿瘤复发或转移。迄今报道的有效肿瘤免疫治疗策略主要包括免疫检查点阻断(icb),过继t细胞疗法(act),肿瘤特异性疫苗,小分子免疫调节药物的应用。
3.在众多的治疗策略中,吲哚胺-2,3-双加氧酶(ido)的抑制受到广泛关注,因其在介导肿瘤免疫逃逸中起到关键性作用。吲哚胺-2,3-双加氧酶催化色氨酸(trp)降解为犬尿氨酸(kyn),而犬尿氨酸会抑制细胞毒性t淋巴细胞(ctl)的功能,激活调节性t细胞(treg)。吲哚胺-2,3-双加氧酶强大的免疫调节功能归因于色氨酸“饥饿”和犬尿氨酸水平的积累。相比于传统的常规治疗手段,吲哚胺-2,3-双加氧酶抑制发展为一种很有前景的肿瘤免疫治疗方法,但这种免疫治疗效果是有限的,这是由于在肿瘤免疫逃逸中,效应t淋巴细胞例如辅助性t细胞(cd4
+
)和细胞毒性淋巴细胞(ctls)在肿瘤部位具有较低的浸润。因此,为了增强临床治疗效果,吲哚胺-2,3-双加氧酶(ido)抑制需要协同其他能促进抗肿瘤t淋巴细胞肿瘤浸润的治疗手段,联合治疗已成为提高抗肿瘤疗效的有效途径,如联合化疗、光动力治疗或放疗等[seeber a,klinglmair g,fritz j,et al.high ido-1expression in tumor endothelial cells is associated with response to immunotherapy in metastatic renal cell carcinoma.cancer sci.2018,109,1583-1591.]、[xing l,gong j h,wang y,et al.hypoxia alleviation-triggered enhanced photodynamic therapy in combination with ido inhibitor for preferable cancer therapy.biomaterials 2019,206,170-182.]、[liu m,li z,yao w,et al.ido inhibitor synergized with radiotherapy to delay tumor growth by reversing t cell exhaustion.mol.med.rep.2020,21,445-453.]。
[0004]
一氧化氮(no)作为一种多功能信号分子在肿瘤的形成和进展中发挥着重要作用。一氧化氮不仅可以通过线粒体和dna损伤诱导各种肿瘤的凋亡,还可以调节肿瘤免疫微环境。但一氧化氮与吲哚胺-2,3-双加氧酶抑制协同用于肿瘤免疫治疗尚未有研究。
技术实现要素:
[0005]
本发明针对现有技术中存在的不足,旨在提供一种谷胱甘肽敏感的纳米载药系统及其制备方法和应用。本发明采用对谷胱甘肽敏感的纳米金属有机框架化合物cu-btc作为纳米载体介导一氧化氮和小分子吲哚胺-2,3-双加氧酶抑制剂协同免疫治疗肿瘤,靶向小分子药物至肿瘤区域,增强肿瘤免疫治疗效果。
[0006]
本发明的首要目的是提供一种谷胱甘肽敏感的纳米载药系统。
[0007]
本发明的另一目的是提供所述纳米载药系统的制备方法。
[0008]
本发明的再一目的是提供所述纳米载药系统在制备抗肿瘤药物中的应用。
[0009]
本发明的上述目的是通过以下技术方案实现的:
[0010]
本发明首先提供一种谷胱甘肽敏感的纳米载药系统,所述载药系统以金属有机框架化合物cu-btc为载体,包封吲哚胺2,3-双加氧酶抑制剂和一氧化氮供体。
[0011]
本发明该纳米载药系统,采用谷胱甘肽(gsh)敏感的金属有机框架化合物(mof)包封免疫抑制酶吲哚胺2,3-双加氧酶(ido)抑制剂和一氧化氮(no)供体,该纳米载药系统具有较高的t-1弛豫度,可用于体内磁共振成像(mri)可视化的药物递送。当纳米载药系统到达肿瘤细胞,细胞内高浓度的谷胱甘肽(0.5~10mm)与mof金属有机框架发生级联反应,cu-btc中的二价铜离子可以与谷胱甘肽发生氧化还原反应转化为一价铜离子,减弱了cu-btc内部的配位作用,造成金属有机框架纳米载体cu-btc的解体,迅速释放出在孔洞中的小分子吲哚胺-2,3-双加氧酶抑制剂和一氧化氮供体,随后一氧化氮供体与一价铜离子反应生成大量no气体。释放的小分子吲哚胺-2,3-双加氧酶抑制剂可以抑制吲哚胺-2,3-双加氧酶的活性,缓解抗肿瘤t淋巴细胞的免疫抑制,而原位产生的no能进一步重塑肿瘤免疫抑制的微环境。吲哚胺-2,3-双加氧酶(ido)抑制剂和一氧化氮(no)气体协同调节了免疫抑制肿瘤微环境,显著增加细胞毒性t淋巴细胞浸润,减少调节性t细胞(treg)数量,从而实现高效的免疫治疗。
[0012]
众所周知,小分子药物往往缺乏肿瘤特异性,这限制了其治疗应用,而且在生物体内容易引起副作用,这使得小分子药物的体内高效输送成为当今研究的热点。另一方面,联合治疗通常需要不同的小分子药物在时空可控的方式下有效的共传递。也即在联合治疗中,不仅药物的肿瘤靶向递送非常重要,而且不同药物在肿瘤特定部位作用位点释放也很关键。本发明提供的纳米载药系统可以在肿瘤特定位点积聚,同时,通过在纳米载体中引入精心设计的刺激响应结构,编程包裹的不同药物的释放,可以精确地针对不同的作用位点。本发明的纳米载药系统可有效介导一氧化氮和小分子吲哚胺-2,3-双加氧酶抑制剂发挥免疫联合治疗效果,增强抗肿瘤免疫活性,同时最大限度地减少免疫调节药物的脱靶免疫毒性。
[0013]
优选地,所述吲哚胺2,3-双加氧酶抑制剂包括但不限于bms-986205、incb24360、nlg919、1-甲基-d-色氨酸中的任一种。
[0014]
在本发明优选的实施例中,所述吲哚胺2,3-双加氧酶抑制剂为bms-986205。
[0015]
优选地,所述一氧化氮供体包括但不限于s-亚硝基硫醇、有机亚硝酸盐、n-偶氮烯二醇类化合物、硝基苯中的任一种。
[0016]
在本发明优选的实施例中,所述一氧化氮供体为s-亚硝基硫醇。
[0017]
本发明所述金属有机框架化合物cu-btc,作为一种优选地可实施方式,所述cu-btc采用如下方法制备而成:
[0018]
将4.7g三水硝酸铜溶于200ml甲醇中;将2.58g间苯三甲酸溶于200ml甲醇中;再将间苯三甲酸的甲醇溶液以100~150μl/min的速度,滴加到三水硝酸铜甲醇溶液中,在室温条件下搅拌2~8h;10000rpm离心5min收集蓝色沉淀,然后用n,n-二甲基甲酰胺溶液洗涤若干次;最后,在真空烘箱中110~150℃干燥8~12h,得到cu-btc粉末。
[0019]
作为一种优选地可实施方式,本发明上述纳米载药系统的制备方法包括如下步骤:
[0020]
s1.将吲哚胺-2,3-双加氧酶抑制剂、一氧化氮供体、金属有机框架化合物cu-btc溶于二甲基亚砜中,第一次混匀,后加入聚醚f127,第二次混匀;
[0021]
s2.将步骤s1制备的溶液以100~150μl/min的速度,滴加到去离子水中,静置2~8h,真空蒸发、透析、冷冻干燥,得到所述纳米载药系统。
[0022]
优选地,步骤s1所述吲哚胺-2,3-双加氧酶抑制剂、一氧化氮供体、金属有机框架化合物cu-btc、二甲基亚砜、聚醚f127的用量比为3~6mg:3~6mg:10~30mg:1~3ml:60~120mg。
[0023]
优选地,步骤s1所述第一次混匀室温搅拌0.5~2h;所述第二次混匀为室温搅拌2~4h。
[0024]
优选地,步骤s2所述透析为在截留分子量mwco=3500da的纤维素透析袋中透析48~96h去除有机溶剂和游离药物。优选透析72h。
[0025]
优选地,步骤s2所述冷冻干燥的温度为-50℃~-10℃,时间为4~8h。
[0026]
本发明上述方法在cu-btc包封吲哚胺2,3-双加氧酶抑制剂bms-986205和一氧化氮供体s-亚硝基硫醇的bms-snap@cu-btc纳米材料表面修饰了f127(polyethylene-polypropylene glycol)以提高纳米载药系统bms-snap-mof的水分散性和生物相容性。
[0027]
将该纳米载药系统bms-snap-mof用于治疗小鼠三阴性乳腺癌(tnbc),小鼠肿瘤明显消退,表现优异的肿瘤免疫治疗效果。
[0028]
因此,上述纳米载药系统或由上述方法制备得到的纳米载药系统bms-snap-mof在制备抗肿瘤药物中的应用也应在本发明的保护范围内。
[0029]
采用本发明纳米载药系统bms-snap-mof可对各种实体肿瘤如恶性黑色素瘤、肺癌、宫颈癌、乳腺癌和膀胱癌起到免疫治疗效果。在本发明优选的实施例中,所述肿瘤为三阴性乳腺癌(tnbc)。
[0030]
本发明的有益效果:
[0031]
本发明提供一种谷胱甘肽敏感的纳米载药系统bms-snap-mof,采用金属有机框架化合物cu-btc作为纳米载体介导一氧化氮和小分子吲哚胺-2,3-双加氧酶抑制剂免疫联合治疗肿瘤,吲哚胺-2,3-双加氧酶抑制剂和一氧化氮协同调节了免疫抑制肿瘤微环境,显著增加效应t细胞和减少调节性t细胞,从而实现高效的肿瘤免疫治疗效果,克服了现有技术中单独使用吲哚胺-2,3-双加氧酶抑制剂进行免疫治疗的效果有限的问题。
[0032]
且本发明的纳米载药系统bms-snap-mof制备方法简单,适于大量推广,为实体肿瘤的免疫疗法提供一种新型、高效的药物方案。
附图说明
[0033]
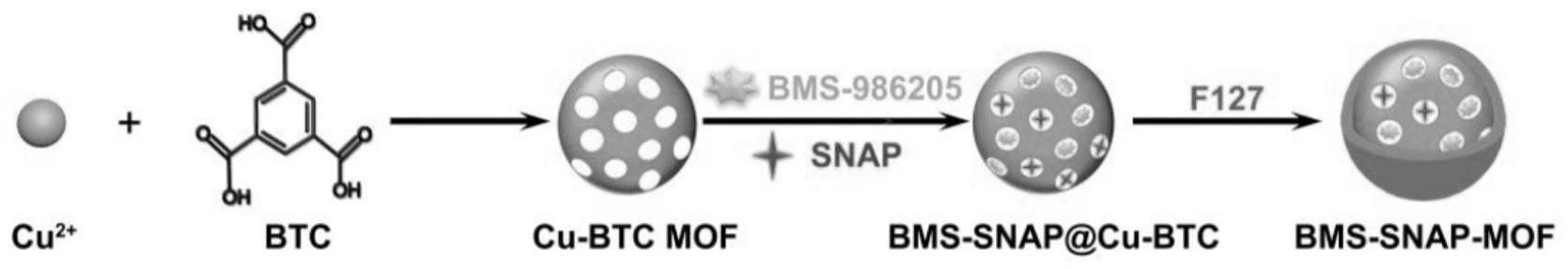
图1为纳米载药系统bms-snap-mof制备流程;
[0034]
图2为金属有机框架cu-btc xrd x-射线衍射图谱;
[0035]
图3为金属有机框架cu-btc xps x-射线光电子能谱学;
[0036]
图4为金属有机框架cu-btc n2吸附脱吸附;
[0037]
图5为金属有机框架cu-btc孔道大小分布曲线;
[0038]
图6为金属有机纳米载体bms-snap-mof tem透射电镜图;
[0039]
图7为细胞内一氧化氮生成的荧光成像;
[0040]
图8为细胞内一氧化氮含量的流式定量分析;
[0041]
图9为小鼠肿瘤部位的核磁共振成像;
[0042]
图10为免疫细胞毒性t淋巴细胞(ctl)流式检测。
具体实施方式
[0043]
下面结合说明书附图和具体实施方式对本发明作进一步的说明,但实施例并不对本发明做任何形式的限定。除非另有说明,本发明实施例采用的原料试剂为常规购买的原料试剂。
[0044]
激光共聚焦荧光显微镜(德国蔡司lsm 510);
[0045]
流式细胞分析仪购自美国becton dickinson(facscanto ii);
[0046]
细胞计数器购自美国默克(scepter 2.0);
[0047]
小鼠乳腺癌细胞(4t1)购自中科院上海细胞库。
[0048]
实施例1
[0049]
图1为bms-snap-mof的制备流程图。
[0050]
一、cu-btc的制备与表征
[0051]
1、制备
[0052]
将4.7g三水硝酸铜溶于200ml甲醇中;将2.58g间苯三甲酸溶于200ml甲醇中;再将间苯三甲酸的甲醇溶液以130μl/min滴加到三水硝酸铜甲醇溶液中,在室温条件下搅拌4h;10000rpm离心5min收集蓝色沉淀,然后用n,n-二甲基甲酰胺溶液洗涤若干次;最后,在真空烘箱中120℃干燥12h,得到cu-btc粉末(cu-btc mof)。
[0053]
2、表征
[0054]
(1)cu-btc的x射线衍射(xrd)结果如图2所示,6.8
°
(200)、9.5
°
(220)和11.6
°
(222)处衍射峰与文献报道的cu-btc的xrd结果相一致,表明成功制备了cu-btc,由图中可以看出制备的样品具有较高的纯度。
[0055]
(2)x射线光电子能谱(xps)分析表明cu-btc由cu、o和c组成(图3)。
[0056]
(3)n2脱/吸附测试及孔道分析结果分别如图4和图5所示,cu-btc粉体的比表面积为1161.75m
2 g-1
,平均孔径为2.02nm,该结果表明制备的cu-btc具备介孔结构且具有潜在的载药性能。
[0057]
二、bms-snap-mof的制备与表征
[0058]
1、制备
[0059]
首先将5mg吲哚胺-2,3-双加氧酶抑制剂bms-986205、5mg一氧化氮供体s-亚硝基硫醇(snap)和20mg cu-btc mof材料溶于二甲基亚砜(dmso,2ml)中,室温超声搅拌0.5h得到bms-snap@cu-btc。然后在溶液中加入100mg的聚醚f127,室温搅拌2h。以130μl/min的速度,滴加到去离子水中,静置2h,真空蒸发有机溶剂。在纤维素袋(mwco=3500da)中透析72h,去除有机溶剂和游离药物后,在-30℃冷冻干燥6h,得到bms-snap-mof。
[0060]
2、表征
[0061]
bms-snap-mof的透射电镜(tem)结果如图6所示,制备的bms-snap-mof具有球形的
形貌,并且表现出良好的分散性,其平均尺寸为75nm。
[0062]
三、bms-mof和snap-mof的制备方法同bms-snap-mof的制备。
[0063]
实施例2体外一氧化氮检测
[0064]
1、实验方法
[0065]
(1)bms-snap-mof溶液(1mg/ml)的配制:将实施例1制备的1mg bms-snap-mof分散在1ml ph 7.4的去离子水中,然后用0.22μm的无菌过滤器过滤除菌。
[0066]
(2)细胞培养
[0067]
小鼠乳腺癌细胞(4t1),在含有10%胎牛血清、1%青霉素/链霉素的rpmi-1640培养液中,在37℃、5%co2的湿润环境中培养。实验前用细胞计数器测定细胞密度。
[0068]
(3)细胞处理
[0069]
将培养后的小鼠乳腺癌细胞(4t1)与bms-snap-mof(1mg/ml)、谷胱甘肽(5μm)在细胞培养箱中共孵育8h。然后,移除细胞培养液,加入1ml稀释好的3-氨基,4-氨基甲基-2',7'-二荧光素,二乙酸酯基(daf-fm da)5μm,以能充分盖住细胞,37℃细胞培养箱内孵育20分钟。用磷酸盐缓冲盐溶液(pbs,ph7.4)洗涤细胞三次,以充分去除未进入细胞内的daf-fm da。用激光共聚焦荧光显微镜和流式细胞分析仪检测细胞荧光分布情况。
[0070]
其中3-氨基,4-氨基甲基-2',7'-二荧光素,二乙酸酯基(daf-fm da)是用于一氧化氮定量检测的荧光探针,daf-fm da可以穿过细胞膜,进入细胞后可以被细胞内的酯酶催化形成不能穿过细胞膜的daf-fm。daf-fm本身仅有很弱的荧光,但在和一氧化氮反应后可以产生强烈荧光,激发波长为495nm,发射波长为515nm。dapi即4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole),是一种能够与dna强力结合的荧光染料,常用于荧光显微镜成像。
[0071]
2、实验结果
[0072]
细胞内一氧化氮检测的荧光成像结果如图7所示,图8为细胞内一氧化氮含量的流式定量分析结果,从图7,8可见,用不同纳米药物处理小鼠4t1乳腺癌细胞8h后,只有bms-snap-mof和谷胱甘肽共处理的4t1细胞,才表现出明显的荧光信号,说明细胞内有生成一氧化氮气体。此外,bms-snap-mof在1640培养基中加入谷胱甘肽gsh后被分解并产生一氧化氮气体,证实其在细胞中是成功的no供体。证实了bms-snap-mof中的二价铜离子可以与肿瘤微环境高浓度的gsh发生氧化还原反应转化为一价铜离子,造成金属有机框架解体,释放出在孔洞中的bms-986205和一氧化氮供体s-亚硝基硫醇snap。随后,snap与一价铜离子反应生成no气体。
[0073]
实施例3动物模型体内mr成像
[0074]
1、实验方法
[0075]
balb/c小鼠(4~6周,20g)购自广东省医学实验动物中心,将4t1细胞(1.0
×
106细胞)用100μl磷酸盐缓冲盐溶液悬浮,皮下注射小鼠侧翼,建立动物肿瘤模型(三阴性乳腺癌)。当肿瘤达到约100mm3时,使用动物进行实验。
[0076]
将实施例1制备的bms-snap-mof(10mg/kg)注入荷瘤小鼠尾静脉,分别于注射前及注射后4h、8h、12h、24h对小鼠肿瘤部位进行磁共振成像(mri)研究。
[0077]
cu
2+
在磁共振成像(mri)中是一种t1造影剂,因此含cu
2+
的bms-snap-mof可以作为一种有效的t1造影剂在磁共振成像中使用。采用3.0t mri临床扫描仪评估bms-snap-mof的
t1加权磁共振成像。磁共振成像可评估bms-snap-mof纳米颗粒在4t1荷瘤小鼠体内的半定量生物分布分析。
[0078]
2、实验结果
[0079]
图9为静脉尾注射bms-snap-mof前后4t1荷瘤小鼠的t1加权核磁共振成像图,从图9可以看到,小鼠肿瘤部位在注射bms-snap-mof后,mri信号强度持续增强,在注射后8h达到最强,并在24h仍保持较高的mri信号水平。实验结果表明静脉尾注射bms-snap-mof后,纳米药物可以有效的在肿瘤部位积聚。并且,出色的核磁共振成像精准明确了肿瘤区域,为后续协同ido/no免疫治疗提供了有效的指导。
[0080]
实施例4体内细胞毒性t淋巴细胞(ctl)检测
[0081]
1、实验方法
[0082]
balb/c小鼠(4~6周,20g)购自广东省医学实验动物中心,将4t1细胞(1.0
×
106细胞)用100μl磷酸盐缓冲盐溶液悬浮,皮下注射小鼠侧翼,建立动物肿瘤模型(三阴性乳腺癌)。当肿瘤达到约100mm3时,使用动物进行实验。
[0083]
将4t1荷瘤小鼠随机分为4组,每组5只。四组小鼠分别尾静脉注射pbs,实施例1制备的bms-mof(10mg/kg)、snap-mof(10mg/kg)和bms-snap-mof(10mg/kg),每两天一次。第14天将肿瘤组织取出并切成小块,然后用组织研磨器研磨,2-8℃,300-400g的条件下离心细胞悬液4-5min,弃上清,用磷酸盐缓冲盐溶液洗两次,制成磷酸盐缓冲盐的单细胞悬液。然后,用荧光标记的表面抗体(cd3、cd4和cd8)在4℃避光条件下染色30分钟。染色结束后,用流式细胞染色缓冲液洗3次,1500rpm离心5min。最后,用0.5ml facs缓冲液重悬细胞,采用流式细胞仪检测染色细胞,评估不同处理组肿瘤免疫反应。
[0084]
2、实验结果
[0085]
图10为免疫细胞毒性t淋巴细胞(ctl)流式检测结果,从图10可看到,与磷酸盐缓冲盐溶液处理组(8.1%)相比,bms-mof或snap-mof单独处理组仅部分增加了细胞毒性t淋巴细胞在肿瘤部位的数量,分别是21.1%和15.7%。而bms-snap-mof处理的肿瘤组织中cd8
+
t细胞(cd3
+
cd4-cd8
+
)数量相比对照组增加较为明显,为31.4%。由结果可以看出,与其他三组相比,bms-snap-mof处理组显著增强了cd8
+
t细胞在肿瘤部位的浸润。
[0086]
综上实验表明本发明的bms-snap-mof纳米载药系统中,吲哚胺-2,3-双加氧酶(ido)抑制剂和一氧化氮(no)气体协同调节了肿瘤免疫抑制微环境,显著增加细胞毒性t淋巴细胞含量和减少调节性t细胞数量,从而实现一种高效的协同免疫治疗。在动物实验中,该纳米诊疗系统在治疗小鼠三阴性乳腺癌(tnbc),表现出对肿瘤免疫治疗的优异效果。
[0087]
显然,本发明的上述实施例仅仅是为清楚地说明本发明所作的举例,而并非是对本发明的实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1