一种经皮肤致敏的食物过敏动物模型的建立方法
1.本发明属于医疗评价、检测技术领域,具体涉及一种经皮肤致敏的食物过敏动物模型的建立方法。
背景技术:
2.食物过敏是指由机体免疫系统对某些食物蛋白质的超常反应,发病时可累及周身多个系统,如皮肤、呼吸道、胃肠道和中枢神经系统,严重时可导致过敏性休克甚至危及生命。近些年来,世界范围内食物过敏的发病率呈逐年上升趋势,食物过敏已经成为全球关注的公共卫生问题,被称为继哮喘之后的“第二波”过敏流行病。大量研究发现,早期皮肤暴露是诱发食物过敏的重要风险因素,据此提出的“双重致敏原暴露假说”,认为经口致敏可以促进免疫耐受的形成,但是经皮肤致敏则会干扰口服耐受。受损的皮肤屏障导致的变应原早期暴露和持续性炎症可能诱发和加剧食物过敏。
3.准确的食物致敏原评价方法有助于过敏相关免疫机理的研究,也是研发预防和治疗食物过敏手段的必要途径。评价食物致敏原致敏性的方法有体外免疫学方法、模拟胃肠消化模型、细胞模型和动物模型。体内评价是研究食物潜在致敏性最直接、准确的方法。致敏原的体内评价手段多采用龋齿类动物过敏模型。作为生物医学领域最常使用的实验动物,小鼠常被用于构建食物过敏的动物模型,其中近交系的balb/c小鼠和c57bl/6小鼠是常见的实验用动物。
4.目前利用小鼠构建食物过敏的模型多采用灌胃致敏和腹腔注射致敏两种致敏途径。其中灌胃致敏构建的食物过敏模型存在建模周期长、成本高和易产生口服耐受性的缺陷。而腹腔注射并非人体摄入食物致敏原的天然途径,因而不能反应食物进入机体的真实情况。近些年,经皮肤致敏造成的食物过敏的发生率呈逐年上升的趋势。传统的灌胃和腹腔注射致敏构建的模型已经不能很好的模拟当前临床上的致敏发生的过程。
5.公开号为cn113209082a的专利申请公开了一种食物过敏的小鼠造模方法,具体建立方法是:致敏期每周灌胃鸡蛋清5mg+10μg霍乱毒素,致敏诱导时间:第7、14、21和28天,第35天用20mg鸡蛋清液激发并在激发后30min观察各组小鼠致敏症状。同时设置空白对照组每次每只小鼠灌胃300μl pbs。该方法的致敏动物模型为灌胃致敏方面,不能够很好的模拟当前临床上的一些致敏发生的过程。
6.所以经皮肤致敏并优良的致敏动物模型的构建是发现过敏机制并研究过敏的又一重要途径和方向。
技术实现要素:
7.为了解决上述问题,本发明提出一种小鼠经皮肤致敏的食物过敏模型的建立及其免疫评价,该模型具有致敏显著,相关过敏指标显著的特点。
8.为了实现上述目的,本发明的实施例在一方面构建了经皮肤致敏的食物过敏模型,并选用了两种不同品种的小鼠,另一方面分析了食物过敏相关指标并对该经皮肤致敏
的食物过敏模型进行了评价。
9.根据本发明实施例的一种小鼠经皮肤致敏的食物过敏模型的建立方法,其构建模型所需试剂为mc903(钙泊三醇水合物)和ova(鸡蛋卵清蛋白)。其构建的小鼠经皮肤致敏的食物过敏模型具有较高过敏症状评分、较高水平的血清ova-特异性ige和较高占比的脾脏th2亚群。这些结果表明本发明的小鼠经皮肤致敏的食物过敏模型构建成功,并能很好的评价小鼠的食物过敏状态及程度。
10.本发明提供了一种经皮肤致敏的食物过敏动物模型的建立方法,包括致敏原致敏阶段和致敏原激发阶段,致敏原致敏阶段使用含有ova的mc903乙醇溶液涂抹实验动物皮肤,致敏原激发阶段使用溶解在缓冲液中的ova进行灌胃激发。
11.优选的,其中ova的浓度为5mg/ml,mc903的浓度为2nmol。
12.优选的,所用实验动物为小鼠,小鼠为balb/c或c57bl/6。
13.具体的,致敏原致敏阶段涂抹含有ova的mc903乙醇溶液时,每天涂抹,共2周。
14.具体的,致敏原致敏阶段涂抹含有ova的mc903乙醇溶液时,涂抹双耳进行致敏。
15.优选的,致敏原致敏阶段涂抹含有ova的mc903乙醇溶液时,每只小鼠的每次涂抹量为20μl。
16.具体的,致敏原激发阶段灌胃时,每只小鼠灌胃激发使用的ova浓度为250mg/ml,灌胃量为200μl。
17.具体的,灌胃激发时,分别在致敏原致敏阶段结束后的第一天和第五天灌胃一次。
18.本发明的有益效果:本发明提供了一种经皮肤致敏的食物过敏动物模型的建立方法,具有操作简便、造模周期短、费用低、重现性好等优点。构建的过敏模型具有较高过敏症状评分、较高水平的血清ova-特异性ige和较高占比的脾脏th2亚群。本发明的小鼠经皮肤致敏的食物过敏模型构建成功,并能很好的评价小鼠的致敏状态及程度。
附图说明
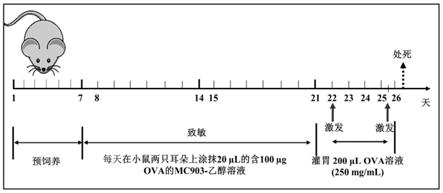
19.图1为小鼠经皮肤致敏的食物过敏模型构建方案图。
20.图2为小鼠过敏临床症状打分图,其中“+”代表“含有”,
“‑”
代表“不含有”。
21.图3为小鼠血清中ova-特异性ige水平图,其中“+”代表“含有”,
“‑”
代表“不含有”。
22.图4为小鼠脾脏组织中淋巴细胞th2淋巴细胞亚群占比结果图,其中“+”代表“含有”,
“‑”
代表“不含有”。
具体实施方式
23.在以下实施例中,本发明比较了小鼠灌胃致敏构建的食物过敏模型和经皮肤致敏构建的食物过敏模型的建模周期和建模成本。便于比较,本实施例中选用的小鼠为balb/c小鼠。其结果如图1所示,灌胃致敏的食物过敏模型所需构建周期为33天,建模所需的费用约为730元/只小鼠。经皮肤致敏的食物过敏模型所需构建周期为25天,建模所需费用约为216.5元/只。相比较传统的灌胃致敏的食物过敏模型,经皮肤致敏的食物过敏模型具有操作简便、造模周期短、费用低、重现性好等优点。
24.在以下实施例和对照例中,对最后一次激发的小鼠,进行过敏临床症状评分。具体方法如下:
25.过敏症状评分系统如下表所示:
26.表1过敏临床症状打分体系
[0027][0028]
在以下实施例和对照例中,最后一次激发小鼠24小时后,小鼠经摘眼球取血后,测定血清中ova-特异性ige。具体方法如下:
[0029]
小鼠血清ova特异性ige测定:
[0030]
(1)按照100μl/孔将100μg/ml的ova溶液(溶在pbs中,ph=7.4)添加到elisa 96孔板上,密封,4℃孵育包被过夜;
[0031]
(2)第二天,取出包被好的96孔板,弃去包被液,每孔加入300μl的洗涤液(pbs+0.05%吐温20)孵育1min,弃去液体,滤纸上拍干,再加入300μl的洗涤液进行洗板,重复洗板3次,避免产生气泡。
[0032]
(3)每孔加入200μl封闭液(5%bsa的pbs溶液,ph=7.4),37℃孵育1h;之后加入300μl的洗涤液洗板3次
[0033]
(4)每孔加入100μl稀释后的小鼠血清样品,37℃孵育2h;之后同样加入300μl的洗涤液洗板5次。
[0034]
(5)每孔加入100μl hrp标记的二抗(goat anti-mouse ige-hrp),37℃孵育1h;之后加入300μl的洗涤液洗板5次。
[0035]
(6)每孔加入100μl tmb,37℃避光孵育20min后加入50μl终止液(2m h2so4),在450nm波长测定各孔的od值。
[0036]
在以下实施例和对照例中,最后一次激发小鼠24小时后,小鼠引颈处死并解剖取脾脏组织,测定脾脏组织中th2淋巴细胞亚群占比。具体方法如下:
[0037]
单细胞悬液制备。
[0038]
(1)取脏器:将处死后的小鼠浸泡于75%酒精中5min,转移至超净台,解剖并取脾脏、肠系膜淋巴结和派氏结。
[0039]
(2)研磨并制备单细胞悬液:将200目筛置于无菌培养皿上,用无菌镊子将脾脏置于200目筛上,先加入2-3ml无菌pbs缓冲液,轻轻研磨,再加入7-8ml pbs缓冲液,充分研磨并冲洗200目筛,将脾细胞悬液转移至15ml离心管中(转移时不要将结缔组织混入细胞悬液中)。4℃,1000rpm离心5min,弃上清取沉淀。
[0040]
(3)红细胞裂解:向每个15ml离心管加入约3ml红细胞裂解液,轻轻吹打,室温下静置约5min。
[0041]
(4)离心和洗涤:4℃,1000rpm离心5min。向细胞沉淀中加入5ml pbs缓冲液,轻轻吹打。离心,弃上清取沉淀,重复该操作2次。
[0042]
(5)计数:向细胞沉淀中加入约1ml rpmi-1640培养基(1%青链霉素和10%胎牛血清),吹打重悬,计数后调整细胞数目至10
6-107细胞/ml。
[0043]
流式细胞术分析。
[0044]
(1)取1ml脾脏单细胞悬液至1.5ml ep管中,4℃,500rpm离心5min,弃上清。加入表面抗体(fitc结合的抗鼠-cd4单克隆抗体),4℃避光孵育30min。此外,每个抗体准备1个单染管;每个组别准备空白管,不加任何抗体。
[0045]
(2)加入1ml staining buffer洗涤,4℃,500rpm离心5min,弃上清。
[0046]
(3)加入250μl 1
×
fix/perm buffer,混匀,4℃避光孵育30min。
[0047]
(4)加入1
×
perm/wash buffer洗涤,4℃,500rpm离心5min,弃上清。重复此操作1次。
[0048]
(5)向ep管中加入100μl 1
×
perm/wash buffer和胞内抗体(pe结合的抗鼠-il4单克隆抗体),混匀,4℃避光孵育60min.。
[0049]
(6)洗涤2次,向细胞沉淀中加入500μl stain buffer,混匀,上流式细胞仪进行分析。
[0050]
实施例1
[0051]
小鼠过敏模型构建方案如图1所示。
[0052]
balb/c小鼠购自浙江省医学科学院(浙江省杭州市西湖区天目山路182号),并由浙江省医学科学院进行饲养和相关实验操作。小鼠预饲养1周后,体重达18
±
1g的小鼠用于后续实验。小鼠分组后,每天用含有ova(100μg)的mc903(2nmol)乙醇溶液涂抹双耳进行致敏,涂抹量为20μl,致敏阶段为2周。致敏结束后,分别在结束后的第一天上午和第五天中午,用含有ova(50mg)的pbs溶液对小鼠进行灌胃激发,将灌胃的ova溶解在pbs(ph=7.4)中,浓度为250g/l,每只小鼠灌胃量为200μl。每次激发后的30min内记录小鼠的表现症状,用于过敏症状打分。最后一次激发24小时后,对小鼠进行取血,分离血清,用于血清中ova-特异性ige的检测。取完血后,引颈处死小鼠,收集脾脏组织,用流式细胞仪分析小鼠脾脏单
细胞悬液中th2淋巴细胞亚群占比。通过分析临床症状得分、血清ova-特异性ige和脾脏组织中th2淋巴细胞亚群占比的结果,用于评价经皮肤致敏动物模型的优劣。
[0053]
对本实施例得到的结果进行分析,处理组小鼠为含有ova(100μg)的mc903(2nmol)乙醇溶液涂抹双耳进行致敏的小鼠;空白组为仅涂抹ova(100μg,涂抹量为20μl)乙醇溶液的小鼠。结果如图2-4所示:
[0054]
(1)过敏临床症状评分如图2所示:处理组小鼠激发后30分钟内过敏临床症状评分为8.20
±
0.20,显著高于空白组小鼠的过敏临床症状评分(0.80
±
0.23);
[0055]
(2)血清中ova特异性ige水平如图3所示:处理组小鼠血清中ova-特异性ige水平(od
450
=0.82
±
0.07)显著高于空白组小鼠血清中ova-特异性ige水平(od
450
=0.13
±
0.04);
[0056]
(3)脾脏组织th2淋巴细胞亚群占比如图4所示:处理组小鼠脾脏中th2淋巴细胞亚群占比(22.04
±
0.41%)显著高于空白组小鼠脾脏中th2淋巴细胞亚群占比(15.54
±
1.41%)。
[0057]
综合以上结果表明balb/c小鼠经皮肤致敏,灌胃激发后,过敏相关的指标(过敏临床症状评分、血清中ova特异性ige水平和脾脏组织th2淋巴细胞亚群占比)均显著提高,所以经皮肤致敏balb/c小鼠模型建立成功。
[0058]
实施例2
[0059]
c57bl/6小鼠购自浙江省医学科学院(浙江省杭州市西湖区天目山路182号),并由浙江省医学科学院进行饲养和相关实验操作。小鼠预饲养1周后,体重达18
±
1g的小鼠用于后续实验。小鼠分组后,每天用含有ova(100μg)的mc903(2nmol)乙醇溶液涂抹双耳进行致敏,涂抹量为20μl,致敏阶段为2周。致敏结束后,分别在结束后的第一天上午和第五天中午,用含有ova(50mg)的pbs溶液对小鼠进行灌胃激发,将灌胃的ova溶解在pbs(ph=7.4)中,浓度为250mg/ml,每只小鼠灌胃量为200μl。每次激发后的30min内记录小鼠的表现症状,用于过敏症状打分。最后一次激发24小时后,对小鼠进行取血,分离血清,用于血清中ova-特异性ige的检测。取完血后,引颈处死小鼠,收集脾脏组织,用流式细胞仪分析小鼠脾脏单细胞悬液中th2淋巴细胞亚群占比。通过分析临床症状得分、血清ova-特异性ige和脾脏组织中th2淋巴细胞亚群占比的结果,用于评价经皮肤致敏动物模型的优劣。
[0060]
对本实施例得到的结果进行分析,处理组小鼠为含有ova(100μg)的mc903(2nmol)乙醇溶液涂抹双耳进行致敏的小鼠;空白组为仅涂抹ova(100μg,涂抹量为20μl)乙醇溶液的小鼠。结果如图2-4所示:
[0061]
(1)过敏临床症状评分如图2所示:处理组小鼠激发后30分钟内过敏临床症状评分为7.67
±
0.22,显著高于空白组小鼠的过敏临床症状评分(1.20
±
0.08);
[0062]
(2)血清中ova特异性ige水平如图3所示:处理组小鼠血清中ova-特异性ige水平(od
450
=2.01
±
0.03)显著高于空白组小鼠血清中ova-特异性ige水平(od
450
=0.14
±
0.05);
[0063]
(3)脾脏组织th2淋巴细胞亚群占比如图4所示:处理组小鼠脾脏中th2淋巴细胞亚群占比(21.47
±
0.54%)显著高于空白组小鼠脾脏中th2淋巴细胞亚群占比(15.88
±
0.24%)。
[0064]
综合以上结果表明c57bl/6小鼠经皮肤致敏,灌胃激发后,过敏相关的指标(过敏
临床症状评分、血清中ova特异性ige水平和脾脏组织th2淋巴细胞亚群占比)均显著提高,所以经皮肤致敏c57bl/6小鼠模型建立成功。
[0065]
对比例1
[0066]
balb/c小鼠购自浙江省杭州师范大学(浙江省杭州市钱塘区下沙高教园区学林街16号),并由杭州师范大学进行饲养和相关实验操作。小鼠预饲养1周后,体重达18
±
1g的小鼠用于后续实验。小鼠分组后,每周的周一、二、四、五给小鼠灌胃,分别灌胃浓度为50mg/ml的ova溶液,灌胃量为100μl及浓度为0.1mg/ml霍乱毒素佐剂,灌胃量为100μl,进行致敏。致敏阶段为3周。致敏结束后,分别在结束后的第一天上午和第五天中午,用含有ova(50mg)的pbs溶液对小鼠进行灌胃激发,其中,将灌胃的ova溶解在pbs(ph=7.4)中,浓度为250mg/ml,每只小鼠灌胃量为200μl。空白组小鼠致敏阶段灌胃等量pbs及霍乱毒素(cholera toxin,ct),激发阶段与致敏组相同。每次激发后的30min内记录小鼠的表现症状,用于过敏症状打分。最后一次激发24小时后,对小鼠进行取血,分离血清,用于血清中ova-特异性ige的检测。取完血后,引颈处死小鼠,收集脾脏组织,用流式细胞仪分析小鼠脾脏单细胞悬液中th2淋巴细胞亚群占比。通过分析临床症状得分、血清ova-特异性ige和脾脏组织中th2淋巴细胞亚群占比的结果,用于评价经皮肤致敏动物模型的优劣。
[0067]
对本对照例得到的结果进行分析,处理组小鼠为致敏阶段灌胃ova溶液及霍乱毒素佐剂致敏的小鼠;空白组为致敏阶段灌胃等量pbs及ct的小鼠。结果如图2-4所示:
[0068]
(1)过敏临床症状评分如图2所示:处理组小鼠激发后30分钟内过敏临床症状评分为0.25
±
0.46,与空白组小鼠的过敏临床症状评分(0)无显著差异;
[0069]
(2)血清中ova特异性ige水平如图3所示:处理组小鼠血清中ova-特异性ige水平(od
450
=0.11
±
0.01)显著高于空白组小鼠血清中ova-特异性ige水平(od
450
=0.07
±
0.01)。但对照例中的处理组小鼠血清中ova-特异性ige水平(od
450
=0.11
±
0.01)显著显著低于实施例1中处理组小鼠血清中ova-特异性ige水平(od
450
=0.82
±
0.07)。
[0070]
(3)脾脏组织th2淋巴细胞亚群占比如图4所示:处理组小鼠脾脏中th2淋巴细胞亚群占比(35.59
±
2.19)显著高于空白组小鼠脾脏中th2淋巴细胞亚群占比(29.14
±
2.83)。在脾脏组织th2淋巴细胞亚群占比的情况下,对照例和实施例1都可以表征小鼠的食物过敏。
[0071]
综合以上结果表明balb/c小鼠经灌胃致敏和激发后,过敏相关的指标(血清中ova特异性ige水平和脾脏组织th2淋巴细胞亚群占比)均显著提高。但血清中ova特异性ige水平的响应值显著低于经皮肤致敏、灌胃激发小鼠血清中ova特异性ige水平的响应值。
[0072]
综上所述,本发明的方法可以构建两种不同近交系品种小鼠(balb/c和c57bl/6)的致敏动物模型。相比较以前的经灌胃致敏和激发的食物过敏动物模型,本发明的实施例所构建的经皮肤致敏小鼠模型具有过敏相关指标显著、造模周期短、费用低、重现性好等优点。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1