药物球囊及其制备方法与流程
1.本发明涉及医疗器械技术领域,具体的说是一种药物球囊及其制备方法。
背景技术:
2.药物球囊常用于治疗心血管疾病,可抑制扩张的血管平滑肌细胞的增殖,预防血管扩张后再狭窄,药物球囊在介入治疗中应用具有明显的疗效。
3.在球囊的表面涂覆药物涂层,通过导管将药物球囊输送至病变位置,球囊在血管内膨胀,球囊膨胀时间短,必须要保证药物涂层在球囊充气期转移至血管壁以及能够有效的将药物释放,提高对不溶于水的治疗剂的吸收;同时要保证药物球囊输送过程中药物涂层的完整性。
4.经检索,cn2009101341746公开了一种采用治疗剂液体制剂的局部和/或区域递送,可扩张性部件外表面附着有治疗剂液体制剂,液体制剂包含药学有效剂量的雷帕霉素、残余浓度为约1.57%重量的乙醇、量为约6.55%重量的维生素e tpgs和量为约90.51%重量的水,液体制剂包含4mg/ml至15mg/ml的雷帕霉素终溶液。
5.此种方式存在的不足之处为:一是使用了重量为90.51%的水,涂完药物的球囊需要进行加热干燥,加热时间长,球囊长时间在高温下会老化,影响球囊质量;二是球囊本体无牢固度持久的亲水性物质,在药物球囊输送过程中,伴随着tpgs和药物的损失,球囊的润滑性迅速下降,很可能无法将球囊输送至病变部位。
6.经检索,cn2014104566634公开了一种适用于涂在植入或介入医疗器械表面的药物涂层组合物,包括亲水性高聚物、治疗血管内壁再增生的药物、氯化钙和溶剂体系,亲水性高聚物选自聚乙烯吡咯酮(pvp),含有耦合碘的聚乙烯吡咯酮,聚乙烯醇(pva),聚氧化乙烯(peo)或聚乙二醇(peg):治疗血管内壁再增生的药物选自紫杉醇或其衍生物、雷帕霉素或其衍生物、抗血凝药。
7.此种结构存在的不足之处为:一是仅使用pvp或peg等单一组分,虽然在一定程度上可提高球囊润滑性,但随着球囊在血管内移送,pvp逐渐损失,使得球囊的润滑性有所减弱;二是pvp分子量较大,在进入病变血管位置后,较大的分子量不利于药物的生物利用率。
技术实现要素:
8.本发明的目的是解决上述现有技术的不足,提供一种适用于颅内血管狭窄患者使用、球囊润滑性好、药物输送损失率低、生物利用率高的药物球囊。
9.本发明解决其技术问题所采用的技术方案是:一种药物球囊,包括球囊本体,所述球囊本体的外表面上涂覆有药物涂层,其特征在于:所述药物涂层包括第一组分和第二组分,所述第一组分包括聚乙烯吡咯烷酮(pvp)、聚乙二醇(peg)、光引发剂和第一溶剂,所述第二组分包括细胞增殖抑制药物、药物载体和第二溶剂,所述药物载体为两亲性高分子化合物的一种或多种,药物球囊根据其临床应用,决定了球囊本体要能在迂曲血管中移送至病变部位,且药物涂层需尽快被组织吸收,提高
生物利用率,但提高生物利用率同时意味着药物在往体内输送的过程中会有大量的药物损失,有的输送后所剩无几,有的输送过程中形成较大碎片,有血栓风险;第一组分的设置,在紫外光的作用下,光引发剂将自身的羟基枝节到球囊本体的尼龙或者聚醚聚酰胺材料上,使原本无亲水性的球囊本体表面有一定亲水性,从而与peg的亲水基团形成结合力,peg分子在球囊本体表面形成类似网状结构,将亲水性更强的pvp锁在peg网状结构中,在水环境下,pvp亲水基团与水分子结合,最终在球囊本体表面形成了水凝膜形态,使球囊具备了润滑性,同时pvp在输送过程中损失小,确保了球囊本体在输送过程中一直能保持较高的润滑性直至病变部位,此优势在颅内血管中体现的尤为明显,颅内血管相比冠脉和外周血管,颅内血管脆弱、迂曲、细长,如球囊不够润滑,很可能导致球囊无法输送到位,甚至导致血管夹层、穿孔、血管破裂,危及患者生命,第一组分的设置能够保证球囊本体在颅内可顺畅到达病变部位;第二组分的设置,两亲性高分子化合物本身具备亲水性,亲水性的头部结构peg,可以在纳米载体表面形成亲水性外壳,亲水性外壳起着稳定纳米颗粒结构的作用,从而减少体内调理素和血浆蛋白对纳米载体的吸附作用,减少药物在体内输送过程中的损失;两亲性高分子化合物也具备亲脂性,在进入人体后,慢慢熔化形成黏性溶液,球囊本体打开后,通过其亲脂性,加上本身的粘性,带着药物,牢牢固定在靶血管中,药物充分利用,减少了血栓发生风险,也提高了药物的生物利用率;第一组分与第二组分的配合,两亲性高分子化合物的亲水性基团与pvp分子和peg的亲水基团结合,疏水基团与疏水性药物结合,使得在复杂迂曲的颅内血管中,既提升了球囊的润滑性,保证了球囊的到位能力,也提高了药物的牢固度,极大减少了药物的递送损失率。
10.本发明所述药物载体可选用维生素e聚乙二醇琥珀酸酯(tpgs)、聚乙烯吡咯烷酮(pvp)、聚乙二醇-磷脂缀合物或聚氧化乙烯-磷脂缀合物等两亲性高分子化合物。
11.本发明所述细胞增殖抑制药物为雷帕霉素、雷帕霉素及其衍生物、紫杉醇及其衍生物的一种或多种。
12.本发明所述第二溶剂为无水乙醇、异丙醇、甲醇、四氢呋喃、丙酮的一种或多种,第二溶剂不加水,无需加热,自然晾干即可,且药物干燥速度快。
13.本发明所述聚乙烯吡咯烷酮(pvp)、聚乙二醇(peg)、光引发剂三者的重量比为(2~6):(2~6):(0.5~1),此比例配方下,pvp与peg的配合,使pvp在球囊移送过程中不会损失,球囊的润滑性好,能够满足颅内迂曲血管狭窄的治疗。
14.本发明所述细胞增殖抑制药物与药物载体的重量比为(0.5~1):(1~6),此比例配方下,tpgs有明显的药物增溶效果,大大提高细胞增殖抑制药物的水溶解度,提高生物利用率。
15.一种药物球囊的制备方法,所述方法包括:步骤s1:制备药物涂层,将聚乙烯吡咯烷酮(pvp)、聚乙二醇(peg)、光引发剂按照(2~6):(2~6):(0.5~1)的比例放入第一溶剂中,制备第一组份溶液;将细胞增殖抑制药物、药物载体按照(0.5~1):(1~6)的比例放入第二溶剂中制备第二组分溶液;步骤s2:对球囊本体充气,使球囊本体膨胀,打开球囊本体,对球囊本体的表面先涂覆第一组分,涂覆方式可采用气压喷涂、超声喷涂或者浸涂等方式,打开紫外线照射灯,
第一组分在紫外线照射下固化;步骤s3:涂覆第二组分,涂覆方式可采用气压喷涂、超声喷涂或者浸涂等方式,第二组分涂覆结束后,将带有药物涂层的球囊本体放置到真空干燥箱中固化;步骤s4:对球囊本体抽真空;步骤s5:球囊本体套入套管中;步骤s6:对涂覆有药物涂层的球囊本体、套管整体进行灭菌处理。
16.本发明所述球囊本体涂覆药物前,先通过高压电流对高纯氧的氧分子进行离子场处理,并轰击球囊本体表面,使球囊疏水性材料嵌段聚醚-聚酰胺共聚物的高分子链上接枝o离子,使其具备一定亲水特性,以便于提高药物涂层在球囊本体表面的牢固度,减少输送过程的损失。
17.本发明所述第一组分、第二组分涂覆采用超声喷涂机进行喷涂,将球囊本体放置在超声喷涂机左右两侧,旋转球囊本体进行喷涂,在超声喷涂机的中部放置药物收集槽,小粒径药物喷涂到球囊本体上,大粒径药物进入到药物收集槽中,将球囊本体放置到超声喷涂机左右两侧,超声喷涂机工作时为扩张状态喷涂,左右两侧喷涂的药物粒径小,中部喷涂的药物粒径大,此种设置方式,以使喷涂到球囊本体上的药物粒径小,进一步使药物进入人体后吸收效果好。
18.本发明所述球囊本体在喷涂药物前需对球囊本体进行三翼或五翼的折叠,再进行加热固化,球囊本体在灭菌处理时,球囊本体在虹吸作用下,球囊本体表面融化后的部分两亲性高分子化合物带着细胞增殖抑制药物向着球囊本体折叠的缝隙内流动,使得细胞增殖抑制药物进入球囊本体折叠夹缝,减少了输送损失。
19.本发明的有益效果为:药物球囊根据其临床应用,决定了球囊本体要能在迂曲血管中移送至病变部位,且药物涂层需尽快被组织吸收,提高生物利用率,但提高生物利用率同时意味着药物在往体内输送的过程中会有大量的药物损失,有的输送后所剩无几,有的输送过程中形成较大碎片,有血栓风险;第一组分的设置,在紫外光的作用下,光引发剂将自身的羟基枝节到球囊本体的尼龙或者聚醚聚酰胺材料上,使原本无亲水性的球囊本体表面有一定亲水性,从而与peg的亲水基团形成结合力,peg分子在球囊本体表面形成类似网状结构,将亲水性更强的pvp锁在peg网状结构中,在水环境下,pvp亲水基团与水分子结合,最终在球囊本体表面形成了水凝膜形态,使球囊具备了润滑性,同时pvp在输送过程中损失小,确保了球囊本体在输送过程中一直能保持较高的润滑性直至病变部位,此优势在颅内血管中体现的尤为明显,颅内血管相比冠脉和外周血管,颅内血管脆弱、迂曲、细长,如球囊不够润滑,很可能导致球囊无法输送到位,甚至导致血管夹层、穿孔、血管破裂,危及患者生命,第一组分的设置能够保证球囊本体在颅内可顺畅到达病变部位;第二组分的设置,两亲性高分子化合物本身具备亲水性,亲水性的头部结构peg,可以在纳米载体表面形成亲水性外壳,亲水性外壳起着稳定纳米颗粒结构的作用,从而减少体内调理素和血浆蛋白对纳米载体的吸附作用,减少药物在体内输送过程中的损失;两亲性高分子化合物也具备亲脂性,在进入人体后,慢慢熔化形成黏性溶液,球囊本体打开后,通过其亲脂性,加上本身的粘性,带着药物,牢牢固定在靶血管中,药物充分利用,减少了血栓发生风险,也提高了药物的生物利用率;
第一组分与第二组分的配合,两亲性高分子化合物的亲水性基团与pvp分子和peg的亲水基团结合,疏水基团与疏水性药物结合,使得在复杂迂曲的颅内血管中,既提升了球囊的润滑性,保证了球囊的到位能力,也提高了药物的牢固度,极大减少了药物的递送损失率。
附图说明
20.图1是对比文件1球囊润滑性测试图谱。
21.图2是对比文件1药物体外性能测试。
22.图3是对比文件2球囊润滑性测试图谱。
23.图4是对比文件2药物体外性能测试。
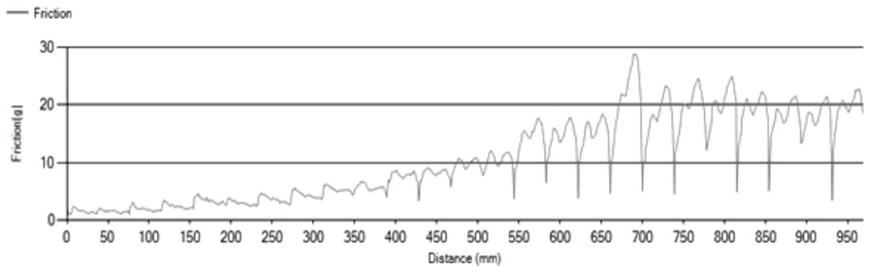
24.图5是本发明球囊润滑性测试图谱。
25.图6是本发明药物体外性能测试。
26.图7是本发明28天内组织中药物吸收情况示意图。
具体实施方式
27.下面结合附图和实施例对本发明进行说明。
28.一种药物球囊,包括球囊本体,所述球囊本体的外表面上涂覆有药物涂层,所述药物涂层包括第一组分和第二组分,所述第一组分包括聚乙烯吡咯烷酮(pvp)、聚乙二醇(peg)、光引发剂和第一溶剂,所述第二组分包括细胞增殖抑制药物、药物载体和第二溶剂,所述药物载体为两亲性高分子化合物的一种或多种。
29.药物球囊根据其临床应用,决定了球囊本体要能在迂曲血管中移送至病变部位,且药物涂层需尽快被组织吸收,提高生物利用率,但提高生物利用率同时意味着药物在往体内输送的过程中会有大量的药物损失,有的输送后所剩无几,有的输送过程中形成较大碎片,有血栓风险;第一组分的设置,在紫外光的作用下,光引发剂将自身的羟基枝节到球囊本体的尼龙或者聚醚聚酰胺材料上,使原本无亲水性的球囊本体表面有一定亲水性,从而与peg的亲水基团形成结合力,peg分子在球囊本体表面形成类似网状结构,将亲水性更强的pvp锁在peg网状结构中,在水环境下,pvp亲水基团与水分子结合,最终在球囊本体表面形成了水凝膜形态,使球囊具备了润滑性,同时pvp在输送过程中损失小,确保了球囊本体在输送过程中一直能保持较高的润滑性直至病变部位,此优势在颅内血管中体现的尤为明显,颅内血管相比冠脉和外周血管,颅内血管脆弱、迂曲,细长,如球囊不够润滑,很可能导致球囊无法输送到位,甚至导致血管夹层、穿孔、血管破裂,危及患者生命;第二组分的设置,两亲性高分子化合物本身具备亲水性,亲水性的头部结构peg,可以在纳米载体表面形成亲水性外壳,亲水性外壳起着稳定纳米颗粒结构的作用,从而减少体内调理素和血浆蛋白对纳米载体的吸附作用,减少药物在体内输送过程中的损失;两亲性高分子化合物也具备亲脂性,球囊本体打开后,通过其亲脂性,加上本身的粘性,带着药物,牢牢固定在靶血管中,药物充分利用,减少了血栓发生风险,也提高了药物的生物利用率。
30.所述药物载体可选用维生素e聚乙二醇琥珀酸酯(tpgs)、聚乙烯吡咯烷酮(pvp)、
聚乙二醇-磷脂缀合物或聚氧化乙烯-磷脂缀合物等两亲性高分子化合物。
31.药物载体使用维生素e聚乙二醇琥珀酸酯(tpgs)时,维生素e聚乙二醇琥珀酸酯(tpgs)可选用tpgs800、tpgs1000、tpgs1200、tpgs1400、tpgs1600、tpgs1800或tpgs2000;药物载体使用聚乙烯吡咯烷酮(pvp)时,聚乙烯吡咯烷酮(pvp)可选用k15、k30、k60或k90。
32.所述细胞增殖抑制药物为雷帕霉素、雷帕霉素及其衍生物、紫杉醇及其衍生物的一种或多种。
33.所述第二溶剂为无水乙醇、异丙醇、甲醇、四氢呋喃、丙酮的一种或多种,第二溶剂不加水,无需加热,自然晾干即可,且药物干燥速度快。
34.此实施例中细胞增殖抑制药物优选使用雷帕霉素,药物载体优选使用tpgs1000,第二溶剂优选使用无水乙醇,tpgs有强大的疏水性药物增溶作用,可使雷帕霉素或紫杉醇等疏水性药物在水中的溶解度提高1000-10000倍,极大的提高了生物利用率。tpgs1000较tpgs其他分子量,有促进细胞内吞和抑制外排的作用,也极大的提高了生物利用率。
35.tpgs的熔点为35-40摄氏度,在进入人体后,tpgs慢慢熔化形成黏性溶液。
36.所述细胞增殖抑制药物与药物载体的重量比为(0.5~1):(1~6),此比例配方下,tpgs有明显的药物增溶效果,大大提高细胞增殖抑制药物的水溶解度,提高生物利用率。
37.所述聚乙烯吡咯烷酮(pvp)、聚乙二醇(peg)、光引发剂三者的重量比为(2~6):(2~6):(0.5~1),此比例配方下,pvp与peg的配合,使pvp在球囊移送过程中不会损失,球囊的润滑性好,能够满足颅内迂曲血管狭窄的治疗。
38.所述光引发剂为二苯甲酮或irgacure2959,以确保能充分利用紫外线光,确保紫外线光的照射强度。
39.所述聚乙烯吡咯烷酮(pvp)可选用分子量不同的pvp k30、pvp k60或pvp k90,此实施例中优选使用pvpk60。
40.所述聚乙二醇(peg)可选用分子量不同的peg200、peg400、peg600或peg1000,优选使用peg1000。
41.所述第一溶剂采用酒精。
42.此实施例中第一组分的配置方法为:取1l酒精,三口烧瓶中加入0.3l酒精,开启搅拌,搅拌状态下,用电子天平依次称量定量的10.6g聚乙二醇(peg)、2g光引发剂和13.3g聚乙烯吡咯烷酮(pvp)于锡纸盘中,并依次加入到0.3l酒精中,剩余0.7l酒精清洗锡纸盘确保药物完全利用,对第一组份进行搅拌直至药物彻底溶解,整个搅拌过程在避光环境中进行,最后将第一组份药液转移至棕色试剂瓶中密封避光保存。
43.此实施例中第二组分的配置方法为:用移液管精密量取100ml的无水乙醇于棕色试剂瓶中,用电子天平称量4g的tpgs,并转移至棕色试剂瓶中,开启搅拌,待tpgs溶解,用电子天平称量2g的雷帕霉素,在tpgs溶液搅拌状态下,将雷帕霉素缓慢加入到tpgs溶液中,继续搅拌,直至药物完全溶解,将棕色试剂瓶密封,避光保存。此比例配方下,tpgs有明显的药物增溶效果,将雷帕霉素的水溶解度提高至少1000倍,提高生物利用率。
44.一种药物球囊的制备方法,所述方法包括:步骤s1:制备药物涂层,将聚乙烯吡咯烷酮(pvp)、聚乙二醇(peg)、光引发剂按照(2~6):(2~6):(0.5~1)的比例放入第一溶剂中,制备第一组份溶液;将细胞增殖抑制药物、药物载体按照(0.5~1):(1~6)的比例放入第二溶剂中制备第二组分溶液;
步骤s2:对球囊本体进行三翼或五翼的折叠,再放在45~60摄氏度环境中加热固化5~10min;步骤s3:在0.2大气压~9大气压的低压力下使球囊本体膨胀,打开球囊本体,对球囊本体的表面先涂覆第一组分,涂覆方式可采用气压喷涂、超声喷涂或者浸涂等方式,打开紫外线照射灯,第一组分在紫外线照射下固化,此实施例中紫外线照射的强度为100μw/cm
²
,照射30s~60s,以确保紫外线的照射强度能满足要求;步骤s4:涂覆第二组分,涂覆方式可采用气压喷涂、超声喷涂或者浸涂等方式,第二组分涂覆结束后,将带有药物涂层的球囊本体放置到真空干燥箱中固化;步骤s5:对球囊本体抽真空,依靠球囊本体折叠过的记忆性,使球囊本体自动回到三翼或五翼折叠状态;步骤s6:球囊本体套入套管中;步骤s7:对涂覆有药物涂层的球囊本体、套管整体进行灭菌处理。
45.所述球囊本体涂覆药物前,先通过高压电流对高纯氧的氧分子进行离子场处理,并轰击球囊本体表面,使球囊疏水性材料嵌段聚醚-聚酰胺共聚物的高分子链上接枝o离子,使其具备一定亲水特性,以便于提高药物涂层在球囊本体表面的牢固度,减少输送过程的损失。
46.所述第一组分、第二组分涂覆采用超声喷涂机进行喷涂,将球囊本体放置在超声喷涂机左右两侧,旋转球囊本体进行喷涂,在超声喷涂机的中部放置药物收集槽,小粒径药物喷涂到球囊本体上,大粒径药物进入到药物收集槽中,将球囊本体放置到超声喷涂机左右两侧,超声喷涂机工作时为扩张状态喷涂,左右两侧喷涂的药物粒径小,中部喷涂的药物粒径大,此种设置方式,以使喷涂到球囊本体上的药物粒径小,进一步使药物进入人体后吸收效果好。球囊本体药物喷涂完成后,将药物收集槽中的药物溶液进行回收再利用,极大的节约了药物配置成本。
47.此实施例中将球囊本体放置在超声喷涂机工作室,旋转球囊本体,超声喷头高频振动将药液形成微小颗粒,在气流作用下,将微小颗粒送到球囊本体表面,第一组分和第二组分的涂覆方式一致,先进行第一组分的涂覆,再进行第二组分涂覆,第一组分保证球囊本体在进入颅内迂曲血管时,能够保证足够的润滑性,确保产品能够顺利达到病变位置。第二组分实现病变处粥样硬化血管的血管平滑肌细胞增殖一致作用,减少了再狭窄的发病几率。
48.涂覆药物后,球囊本体泄压形成三翼或五翼折叠状态,并套在保护鞘管中进行环氧乙烷灭菌,球囊本体灭菌处理时,温度超过tpgs1000的熔点,使得灭菌过程中药物处于熔化流动状态,在球囊折叠翼与翼之间的狭小空间下,形成毛细效应,球囊本体在虹吸作用下,球囊本体表面融化后的部分tpgs带着细胞增殖抑制药物向着球囊本体折叠的缝隙内流动,使得细胞增殖抑制药物进入球囊本体折叠夹缝被保护起来,极大的减少了输送损失。
49.此实施例中将本发明与对比文件做了对比,如附图所示,图1中示出了cn2009101341746的球囊润滑性效果,横坐标为距离,纵坐标为摩擦力大小,随着距离增加,摩擦力逐渐变大,球囊的润滑性效果变差。
50.图2中示出了cn2009101341746药物体外性能测试,药物递送过程损失率达到60%,药物释放率40%,球囊本体剩余药物0%。
51.图3中示出了cn2014104566634的球囊润滑性效果,横坐标为距离,纵坐标为摩擦力大小,随着距离增加,摩擦力逐渐变大,球囊的润滑性效果变差。
52.图4中示出了cn2014104566634药物体外性能测试,药物递送过程损失率达到50%,药物释放率30%,球囊本体上还有剩余药物20%。
53.图5中示出了本发明球囊润滑性效果,横坐标为距离,纵坐标为摩擦力大小,随着距离增加,摩擦力并未变大,确保在递送过程中一直保持高润滑性,有利于球囊本体能顺畅到达血管病变部位。
54.图6示出了本发明药物体外性能测试,药物递送过程损失率仅40%,药物释放率60%,球囊本体上剩余药物0%。药物递送过程中的损失率远低于对比文件1和对比文件2的损失率,同样,药物释放率远高于对比文件1和对比文件2的释放率,且球囊本体上无药物残留,药物能够充分利用。
55.图7示出了本发明28天内组织中药物吸收情况(动物实验数据),图中可看出,药物粘在血管壁上,并逐渐被血管组织吸收,处于14天的时候,血管组织中依然保持有有效的抑制细胞增殖药物,细胞治疗周期合适,生物利用率高。
56.纯亲水性的药物进入血管组织中吸收速度快,细胞治疗周期短,抑制细胞增殖效果差,纯亲脂性的药物进入血管组织中吸收的时间长,但因时间太长,很大一部分药物被血流冲刷走,生物利用率低。
57.从数据中可明显看出,本发明第一组分和第二组分的配合,使得球囊润滑性好、药物输送损失率低、生物利用率高。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1