一种含有SVHRSP蝎毒肽的药物组合物及其制备方法与流程
一种含有svhrsp蝎毒肽的药物组合物及其制备方法
技术领域
1.本发明涉及药物制备技术领域,具体涉及一种含有svhrsp蝎毒肽的药物组合物及其制备方法。
背景技术:
2.中药东亚钳蝎(buthusmartensi ikarsch,bmk),bmk亦称之为马氏钳蝎,现代医学研究证明,其功用在于蝎尾毒囊腺排放的蝎毒(scorpion venom,sv)sv具有多种治疗作用,但严重的神经毒作用使其开发和应用受到极大的限制,我国已从bmk蝎毒中分离纯化出具有抗肿瘤、抗痛、抗癫痫、抗栓、抗炎、抗风湿、抗菌等功能的蝎毒素。
3.中国发明专利申请cn1324621a公开了一种既可消除bmk神经毒性而又保持其治疗活性的有效蝎毒,证实了bmk的药用部位蝎尾节毒囊腺排放的毒液-蝎毒对难治性癫病的有效性及经工艺处理后的安全性。
4.中国发明专利申请cn104341495a公开了从bmk的sv中去除不耐热和耐热的有毒成分,获取一种更安全的蝎毒耐热肽提取液。该多肽在用于防治难治性癫病、帕金森病、阿尔兹海默病时具有共同的作用靶点,而且又具有各自的特殊药效。
5.中国发明专利申请cn106220713a公开了从bmk的sv中检出svhrsp蝎毒肽的氨基酸序列,该多肽保持了蝎毒耐热肽的药效活性和安全性,具有防治难治性癫病、帕金森病和阿尔兹海默病的作用,还具有促进神经胶质细胞逆分化为神经干细胞的生物活性特征。该公开记载svhrsp蝎毒肽肽序具有15个氨基酸,其多肽序列为lys-val-leu-asn-gly-pro-glu-glu-glu-ala-ala-ala-pro-ala-glu。svhrsp蝎毒肽原料为白色或类白色的疏松块状物,易潮解,在水中易溶,在高温、偏碱性环境中易降解,从而导致主药含量低,杂质增高。现有技术还未见有关含有svhrsp蝎毒肽药物组合物的报道,因此,开发一种稳定可长期贮存的含有svhrsp蝎毒肽的药物组合物尤为重要。
技术实现要素:
6.为了解决svhrsp蝎毒肽在高温、偏碱性环境中易降解的问题,使其稳定可长期贮存,本发明提供了一种含有svhrsp蝎毒肽的药物组合物,其包含治疗有效量的svhrsp蝎毒肽或其药学上可接受的盐以及药学上可接受的载体,所述药学上可接受的载体包括ph调节剂、渗透压调节剂、防腐剂中的任意一种或两种以上。
7.在本发明的优选实施方案中,所述svhrsp蝎毒肽药学上可接受的盐为醋酸盐或三氟乙酸盐。
8.所述svhrsp蝎毒肽或其药学上可接受的盐在药物组合物中的浓度为7.5mg/ml-22.5mg/ml。
9.在本发明的优选实施方案中,所述ph调节剂选自碳酸氢钠、氢氧化钠或枸橼酸钠,调节ph值为3.5-4.5。
10.更为优选地,所述调节ph值为3.8-4.2。通过ph筛选研究表明,生产过程中控制ph
在3.8-4.2时药物组合物更加稳定。
11.在本发明的优选实施方案中,所述渗透压调节剂选自甘露醇、葡萄糖、氯化钠、果糖、氯化镁、山梨醇、乳糖或蔗糖。
12.更为优选地,所述渗透压调节剂选自甘露醇或葡萄糖。采用甘露醇或葡萄糖作为渗透压调节剂制备得到的药物组合物在一定期限内的有关物质低于采用氯化钠作为渗透压调节剂制备得到的药物组合物。
13.在本发明的优选实施方案中,所述甘露醇在药物组合物中的浓度为30mg/ml~50mg/ml,所述葡萄糖在药物组合物中的浓度为30mg/ml~50mg/ml。
14.在本发明的优选实施方案中,所述防腐剂选自间甲酚、苯酚、三氯叔丁醇或苯甲醇。
15.更为优选地,所述防腐剂在药物组合物中的浓度为2mg/ml~4mg/ml。
16.此外,本发明的组合物优选制备成注射制剂组合物。
17.本发明另一方面还提供了一种制备本发明所述的药物组合物的方法,包括如下步骤:
18.(1)称取处方量渗透压调节剂、防腐剂,加入注射用水,搅拌均匀,制得a溶液;
19.(2)向a溶液中加入处方量svhrsp蝎毒肽或其药学上可接受的盐,溶解后,用ph调节剂将ph值调节到预定值后,继续加注射用水至配制总体积,制得b溶液;
20.(3)采用除菌过滤法对b溶液进行过滤,分装,即得所述注射制剂组合物。
21.在本发明的优选实施方案中,所述除菌过滤法采用0.22μm除菌过滤器进行过滤。采用除菌过滤工艺制得的药物组合物有关物质明显低于高温灭菌工艺。
22.采用本发明所述的制备方法制备得到的药物组合优选为注射制剂组合物。注射制剂可以分装于任何容器中,例如安瓿瓶、小药瓶、卡式瓶等。
23.本发明的药物组合物可以用于防治难治性癫病、帕金森病和阿尔兹海默病。
24.本发明通过分别对ph调节剂、渗透压调节剂、防腐剂的种类和浓度进行了大量的筛选试验,获得了本发明的含有svhrsp蝎毒肽的药物组合物,同时还提供了其制备方法。深入研究发现,在各辅料一定配比条件下,结合生产工艺参数的控制,可以达到提高产品稳定性的效果,稳定性试验表明,本发明所制备的药物组合物储存两年内,有关物质、svhrsp蝎毒肽含量均无明显变化,质量稳定。动物安全性试验表明,本发明所制备的药物组合物安全性好,符合国家对药品安全性的评价,可供临床注射使用。
具体实施方式
25.下面通过实施例对本发明作进一步的详细说明,旨在用于说明本发明而非限定本发明。应当指出,对于本领域技术人员而言,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也同样落入本发明的保护范围之内。
26.实施例1含有svhrsp蝎毒肽的药物组合物的ph的研究
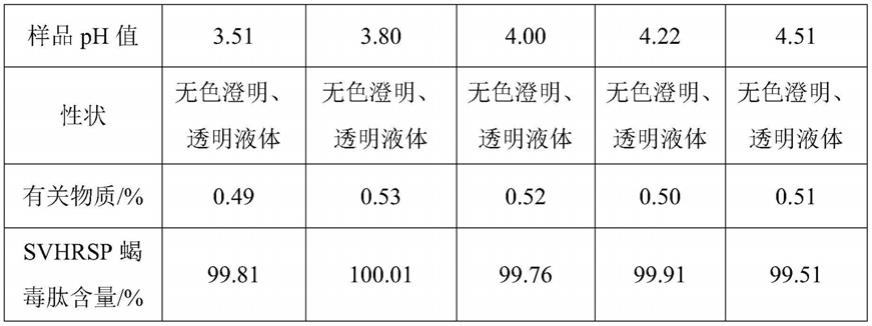
27.1、制剂处方及制备工艺
28.称取37g甘露醇、3g间甲酚,加入800ml注射用水中,搅拌混合均匀,加入15g svhrsp蝎毒肽,待主药全部溶解后,补加注射用水至配制1l。将药液分成5等份,每份3组平行实验,采用氢氧化钠溶液分别调ph至3.5、3.8、4.0、4.2、4.5,分别采用0.22μm除菌过滤器
进行过滤,将这些溶液转移到具有旋盖的15ml玻璃小瓶中。
29.2、试验方法
30.(1)高温试验
31.供试品置密封洁净容器中,在40℃条件下放置10天,第10天取样,检测有关指标。
32.(2)光照射试验
33.供试品置光照箱内,于照度4500lx土500lx条件下放置10天,第10天取样检测。
34.3、试验结果和结论
35.试验开始时、高温试验10天后以及光照射试验10天后,含有不同ph的svhrsp蝎毒肽药物组合物的稳定性数据分别列于表1-3中。
36.表1 0天检测结果
[0037][0038]
表2高温10天的检测结果
[0039][0040]
表3光照10天的检测结果
[0041]
[0042][0043]
从表1-3可知,不同ph的svhrsp蝎毒肽组合物于高温40℃放置10天后,有关物质有所增加,而在光照(4500
±
500lx)放置10天后,有关物质几乎无变化,且高温条件下,ph 3.8-4.2范围内有关物质较低,更有利于组合物的稳定性。
[0044]
实施例2含有svhrsp蝎毒肽的药物组合物的渗透压调节剂的研究1、制剂处方及制备工艺
[0045]
实施例2.1
[0046]
svhrsp蝎毒肽15g氯化钠9g间甲酚3g氢氧化钠调节ph至4.0加注射用水至1l
[0047]
称取处方量氯化钠、间甲酚,加入800ml注射用水中,搅拌混合均匀,加入处方量svhrsp蝎毒肽,待主药全部溶解后,用氢氧化钠调节ph为4.0,补加注射用水至1l,采用0.22μm除菌过滤器进行过滤,将其转移到具有旋盖的15ml玻璃小瓶中。
[0048]
实施例2.2
[0049]
svhrsp蝎毒肽15g葡萄糖45g间甲酚3g氢氧化钠调节ph至4.0加注射用水至1l
[0050]
称取处方量葡萄糖、间甲酚,加入800ml注射用水中,搅拌混合均匀,加入处方量svhrsp蝎毒肽,待主药全部溶解后,用氢氧化钠调节ph为4.0,补加注射用水至1l,采用0.22μm除菌过滤器进行过滤,将其转移到具有旋盖的15ml玻璃小瓶中。
[0051]
实施例2.3
[0052]
svhrsp蝎毒肽15g甘露醇37g间甲酚3g氢氧化钠调节ph至4.0加注射用水至1l
[0053]
称取处方量甘露醇、间甲酚,加入800ml注射用水中,搅拌混合均匀,加入处方量svhrsp蝎毒肽,待主药全部溶解后,用氢氧化钠调节ph为4.0,补加注射用水至1l,采用0.22μm除菌过滤器进行过滤,将其转移到具有旋盖的15ml玻璃小瓶中。
[0054]
2、试验结果和结论
[0055]
参照实施例1中高温和光照试验,将实施例2.1-2.3药物组合物进行试验,试验开始时、高温试验10天后以及光照射试验10天后,采用不同渗透压调节剂的svhrsp蝎毒肽药物组合物的稳定性数据分别列于表4-6中。
[0056]
表4 0天检测结果
[0057][0058]
表5高温10天的检测结果
[0059][0060]
表6光照10天的检测结果
[0061][0062]
从表4-6可知,分别采用不同渗透压调节剂试制的蝎毒肽注射液于高温40℃、光照(4500
±
500lx)放置10天后,有关物质均有所增加,且从0天至10天的有关物质增幅来看,高
温比光照对组合物的影响更剧烈。实施例2.3有关物质涨幅较低,svhrsp蝎毒肽含量与0d相比基本无明显变化。
[0063]
实施例3含有svhrsp蝎毒肽的药物组合物的灭菌工艺研究
[0064]
svhrsp蝎毒肽15g甘露醇37g间甲酚3g氢氧化钠调节ph至4.0加注射用水至1l
[0065]
称取处方量甘露醇、间甲酚,加入800ml注射用水中,搅拌混合均匀,加入处方量svhrsp蝎毒肽,待主药全部溶解后,用氢氧化钠调节ph为4.0,补加注射用水至1l。将该药液分成两等份,每份做3组平行实验,其中一份采用0.22μm滤膜除菌过滤、灌装、压塞轧盖。另外一份灌装压塞轧盖后,置于灭菌锅中采用121℃灭菌15min,考察药物组合物中svhrsp蝎毒肽的含量,结果为每份3组平行实验的平均值,详见表7。
[0066]
表7灭菌工艺对比结果
[0067] 高温灭菌除菌过滤性状无色澄明、透明液体无色澄明、透明液体有关物质/%17.690.52svhrsp蝎毒肽含量/%80.2199.76
[0068]
从表7中可以看出,svhrsp蝎毒肽注射液的灭菌工艺不能采用常规的注射剂高温灭菌,121℃灭菌15min会导致注射液中svhrsp蝎毒肽的含量大幅度下降,采用除菌过滤法方式可以有效的保持注射液中svhrsp蝎毒肽的含量,且可大幅降低有关物质含量。
[0069]
实施例4含有svhrsp蝎毒肽的药物组合物的长期稳定性研究
[0070]
1、制剂处方和制备工艺
[0071]
实施例4.1
[0072]
svhrsp蝎毒肽7.5g甘露醇30g间甲酚2g氢氧化钠调节ph至3.8加注射用水至1l
[0073]
称取处方量甘露醇、间甲酚,加入800ml注射用水中,搅拌混合均匀,加入处方量svhrsp蝎毒肽,待主药全部溶解后,用氢氧化钠调节ph值为3.8,补加注射用水至1l,采用0.22μm除菌过滤器进行过滤,以3ml/支分装在卡式瓶中。
[0074]
实施例4.2
[0075]
svhrsp蝎毒肽醋酸盐15g葡萄糖40g苯酚3g碳酸氢钠调节ph至4.0加注射用水至1l
[0076]
称取处方量葡萄糖、苯酚,加入800ml注射用水中,搅拌混合均匀,加入处方量svhrsp蝎毒肽醋酸盐,待主药全部溶解后,用碳酸氢钠调节ph值为4.0,补加注射用水至1l,采用0.22μm除菌过滤器进行过滤,以3ml/支分装在卡式瓶中。
[0077]
实施例4.3
[0078]
svhrsp蝎毒肽三氟乙酸盐22.5g甘露醇40g三氯叔丁醇4g枸橼酸钠调节ph至4.2加注射用水至1l
[0079]
称取处方量甘露醇、三氯叔丁醇,加入800ml注射用水中,搅拌混合均匀,加入处方量svhrsp蝎毒肽三氟乙酸盐,待主药全部溶解后,用枸橼酸钠调节ph值为4.2,补加注射用水至1l,采用0.22μm除菌过滤器进行过滤,以3ml/支分装在卡式瓶中。
[0080]
实施例4.4
[0081]
svhrsp蝎毒肽22.5g甘露醇50g苯甲醇3g氢氧化钠调节ph至4.0加注射用水至1l
[0082]
称取处方量甘露醇、苯甲醇,加入800ml注射用水中,搅拌混合均匀,加入处方量svhrsp蝎毒肽,待主药全部溶解后,用氢氧化钠调节ph值为4.0,补加注射用水至1l,采用0.22μm除菌过滤器进行过滤,以3ml/支分装在卡式瓶中。
[0083]
2、长期稳定性试验
[0084]
将实施例4.1-4.4在5
±
3℃、rh60%
±
10%条件进行试验,在0月、6月、12月、24月取样检测,结果见表8。
[0085]
表8实施例4.1-4.4长期稳定性研究
[0086][0087]
从表8可以看出,本发明实施例4.1-4.4制备的svhrsp蝎毒肽的药物组合物储存24个月内,有关物质、svhrsp蝎毒肽含量均无明显变化,质量稳定。
[0088]
实施例5本发明实施例4.1-4.4制备的svhrsp蝎毒肽注射液动物安全性试验
[0089]
1、血管刺激性实验
[0090]
取体重为1.5-1.8kg的新西兰大白兔25只,随机分为5组,每组5只,包括空白对照组、实验组1-4。采用兔耳缘静脉缓慢注射,注射量为250μg/kg体重/次。其中空白对照组采用氯化钠注射液,实验组1-4组分别采用实施例4.1-4.4制备的svhrsp蝎毒肽注射液。
[0091]
每天两次,连续给药7天,于最后一次给药24小时后剪短兔耳,置于10%甲醛溶液中固定标本,然后送病理进行组织学检查,在兔耳缘静脉的不同部位的5处取材,即从注射初始部位开始向心端每隔1cm作一切片。
[0092]
经兔耳缘静脉病理学检查,空白对照组和实验组1-4的耳缘静脉管壁完整,内皮细胞结构清楚,无明显病变,无炎细胞浸润。
[0093]
2、过敏实验
[0094]
dunkin-hartley种白化豚鼠,体重200-250g,临床健康,符合实验动物质量要求。豚鼠随机分为5组,每组10只,雌雄各半。观察豚鼠静脉注射氯化钠空白对照组、实验组1-4组的过敏反应,其中空白对照组采用氯化钠注射液,实验组1-4组分别采用实施例4.1-4.4
制备的svhrsp蝎毒肽注射液。
[0095]
具体方法是:按照空白对照组、实验组1-4组分别间日给予腹腔注射svhrsp蝎毒肽注射液100μg/kg致敏,连续三次,然后第14天及21天分别攻击给药,400μg/kg,立即观察1小时。
[0096]
结果显示,空白对照组和实验组1-4组未出现明显异常现象。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1