海参长链碱及其衍生物在制备抑制PI3K制品中的应用的制作方法
海参长链碱及其衍生物在制备抑制pi3k制品中的应用
技术领域:
1.本发明涉及一种海参来源长链碱类化合物及其衍生物的新用途,具体涉及海参长链碱及其衍生物在制备抑制pi3k制品中的应用。
背景技术:
2.癌症、心血管疾病、高血压是目前死亡率最高的几种疾病,针对上述几种疾病的药物开发与研制是一直以来的重要课题。磷脂酰肌醇3-激酶(pi3k),是一个涉及细胞功能的酶家族,如细胞生长、增殖、分化、运动、存活和细胞内运输等。pi3k主要包括pi3kα、pi3kβ、pi3kγ和pi3kδ四种形态。其主要功能包括:1)激活pi3k/akt通路控制下游的凋亡抑制蛋白来抑制细胞凋亡,从而诱导了肿瘤细胞的耐药性;2)控制pi3k/akt通路下游蛋白(gsk3,mtor,mdm2等)促进细胞增殖;3)磷酸化并激活鸟嘌呤交换因子(gefs),如vav,tiaml,sos,p-rexl,活化的gefs进一步激活控制细胞游走的关键蛋白rho-gtpases;4)控制细胞dna的转录和表达,细胞营养物质的摄取,从而影响细胞的生长与分裂。药理研究表明,pi3kγ缺失老鼠对各种炎症和血栓病表现出强烈的抗性,抑制pi3ks酶活性有助于改善心血管的收缩性和治疗高血压病。此外,pi3k对于很多类型的癌症发生起关键作用,pi3k的抑制可以破坏调节性t细胞介导的对肿瘤的免疫耐受,增加免疫反应,从而导致在动物模型里肿瘤的消退,尤其是那些对于免疫反应不充足的肿瘤,例如乳癌,肺癌(包括小细胞肺癌,非小细胞肺癌,支气管肺泡癌),前列腺癌,胆小管癌,骨癌,膀胱癌,头颈癌,肾癌,肝癌,胃肠组织癌,食道癌,卵巢癌,胰腺癌,皮肤癌,睾丸癌,甲状腺癌,子宫癌,宫颈癌和阴道癌,白血病,多发性骨髓瘤和淋巴瘤等。除上述疾病外,还有证据表明pi3k在炎症和自身免疫性疾病中也扮演重要的角色。于是,对pi3k的抑制可以用于治疗炎症和自身免疫性疾病,包括但不限于皮肤炎症,类风湿性关节炎,过敏性鼻炎,哮喘,克氏病,慢性阻塞性肺疾病(copd),系统性红斑狼疮,牛皮癣,多发性硬化症,活化的pi3k综合症,和sjogren综合症等。因此pi3k成为一个重要的疾病治疗靶标,pi3k抑制剂成为多种疾病治疗的潜在药物。
3.长链碱是一种2-氨基-4-烷基-1,3-二醇类有机物,具有双亲性,其烷基链长度、支链化程度及双键个数与位置对其生物活性具有重要影响。目前发现的海参来源的长链碱具有不饱和度高的特点,其结构独特、种类众多,异于陆地哺乳动物来源的脑苷脂,如d17:1,t17:0等。但其是否能够作为pi3k抑制剂还未见报道。
技术实现要素:
4.本发明要解决的技术问题是目前仍没有关于海参长链碱及其衍生物在作为pi3k抑制剂的研究。
5.为解决上述问题,本发明证实了海参长链碱及其衍生物在作为pi3k抑制剂方面具有显著作用。
6.为达到上述目的,本发明具体通过以下技术方案实现:海参长链碱及其衍生物在制备抑制pi3k制品中的应用。
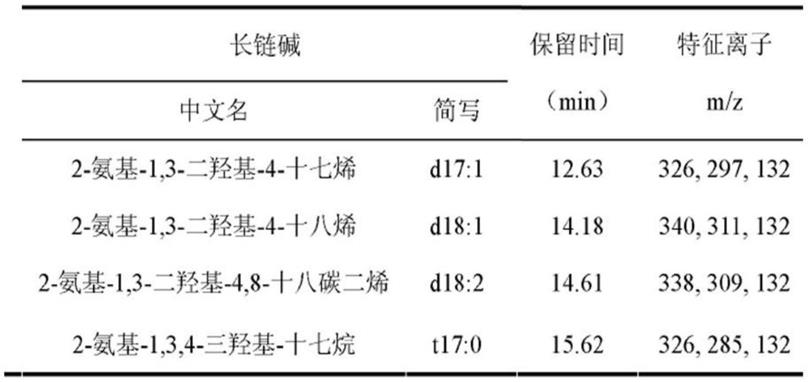
7.进一步的,所述海参长链碱包括d17:1、d18:1、d18:2、t17:0其化学式见附图1。其中,所述海参长链碱及其衍生物的gc-ms检测方法如下:hp-5ms毛细管柱(0.32mm
×
30m,0.25μm);进样口温度240℃,柱温从180℃开始,以4℃/min程序升温至250℃,持续10min;载气为高纯氦气;流速1.0ml/min,传输线温度280℃;进样体积10μl。其中,海参长链碱的gc-ms谱图如图2所示,谱图显示该海参长链碱的结构信息如下:
[0008][0009]
进一步的,所述海参长链碱衍生物包括海参长链碱的前体神经酰胺d17:1-c22:0h、d17:1-c23:0h、d17:1-c24:1h;d18:1-c22:0h、d18:1-c23:0h、d18:1-c24:1h;d18:2-c22:0、d18:2-c18:1、d18:2-c20:1、d18:2-c24:1;t17:0-c22:0h、t17:0-c23:1h、t17:0-c24:1h;以及葡萄糖脑苷脂d17:1-c22:0h、d17:1-c23:0h、d17:1-c24:1h;d18:1-c22:0h、d18:1-c23:0h、d18:1-c24:1h;d18:2-c22:0、d18:2-c18:1、d18:2-c20:1、d18:2-c24:1;t17:0-c22:0h、t17:0-c23:1h、t17:0-c24:1h。
[0010]
体外抑制实验表明,长链碱(lcb)对pi3k活性具有显著抑制作用,且对pi3k相关的癌细胞活性具有显著的抑制作用。体内实验表明,长链碱显著抑制了pi3k参与的癌症恶病质的发展。分子对接分析表明lcb与pi3k具有好的结合能力,且在833lys、841asp及869cys等多个氨基酸位点产生氢键且相互作用较强,同时与部分活性位点氨基酸进行疏水性结合,据报道,该位点是pi3k的活性抑制位点。
[0011]
进一步的,所述制品为药品或特医食品,保健品以及生物制剂,优选为药品或特医食品。
[0012]
进一步的,所述的制品包含有药理有效浓度的海参长链碱及其衍生物。
[0013]
进一步的,所述海参长链碱及其衍生物的制备方法包括以下步骤:
[0014]
(1)将干海参粉碎,用氯仿/甲醇(2∶1,v/v)浸提12h,过滤,浸提3次;将浸提液合并后旋转蒸发至干,得脂质粗提物;将脂质粗提物采用正相硅胶柱层析法分离,三氯甲烷和甲醇(95∶5
→
90∶10,v/v)梯度洗脱,分步收集洗脱液,减压浓缩,采用tlc法初步检测收集物成分,合并rf值相同的组分,减压浓缩至干,分别得到海参长链碱衍生物,即神经酰胺和葡萄糖脑苷脂;
[0015]
(2)将脂质粗提物经4mol/lkoh37℃皂化1h,1mol/l盐酸80℃酸解反应16h,用乙醚萃取长链碱粗提物,并采用正向硅胶柱层析法纯化得到海参长链碱。
[0016]
本发明的有益效果在于:
[0017]
(1)通过实验证明了海参长链碱显著抑制了磷脂酰肌醇4,5-二磷酸3-激酶催化亚单位γ亚型(pik3cg)的活性,首次验证了海参长链碱作为pi3k抑制剂的作用,为以pi3k为靶点的相关疾病的治疗提供了新的途径。
[0018]
(2)本发明还验证了海参长链碱对多种癌细胞的抑制作用,为治疗以pi3k为靶点的相关疾病提供了技术参考。
[0019]
(3)本发明还分析了海参长链碱与pi3k的结合能力及结合位点,为治疗以pi3k为靶点的相关疾病提供了理论基础。
[0020]
(4)为海参长链碱在治疗以pi3k为靶点的相关疾病中的应用给出了合理的指导,具有广阔的市场前景。
附图说明
[0021]
图1为本发明海参长链碱的化学结构图;
[0022]
图2为本发明海参长链碱的gc-ms谱图;
[0023]
图3为实施例3的数据图;
[0024]
图4为实施例4的数据图。
具体实施方式:
[0025]
为使本发明实施例的目的、技术方案和优点更加清楚,下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0026]
实施例1:本发明化合物对pi3k体外抑制试验
[0027]
本发明化合物的pi3k抑制活性通过测定长链碱1(lcb1,d17:1)抑制pik3cg的能力来测定。
[0028]
化合物于包含50mmhepesph7.5,3mmmgcl2,1mmegta,100mmnacl,0.03%chaps,2mmdtt,最终激酶浓度是pi3k17nm,最终pip2浓度为50m,最终atp浓度为25m的反应液中并在37℃孵育45分钟。然后,加入adp-glo试剂终止反应。温育30分钟后,加入激酶检测试剂,混匀,室温静置30分钟,测定荧光值。采用s型剂量响应方程(prismgraphpadsoftware,lajolla,ca,usa),计算ic50值。在使用pik3cg的试验中,长链碱1(lcb1,d17:1)的ic50值是0.0067mm,表明浓度为0.0067mm的lcb1对pik3cg具有50%的抑制率,对pik3cg具有优异的抑制效果。
[0029]
实施例2:本发明化合物对肿瘤增殖的体外抑制试验
[0030]
本发明化合物的pi3k抑制活性通过测定长链碱1(lcb1,d17:1)抑制鼠肉瘤细胞s180、人肝癌细胞hepg2、人结肠癌细胞caco-2、人胃癌细胞hgc-27、人高转移肺癌细胞95d的生长能力来测定。
[0031]
化合物加入对数生长期的不同肿瘤细胞中,于37℃、5%co2条件下分别培养24h、48h和72h。弃去培养基,加入mtt液(pbs液配制,终浓度为0.5mg/ml)。继续培养4h,加入酸化异丙醇,吹打至蓝色结晶物完全溶解,用酶标仪测570nm处吸光值,以[(样品组吸光值)/(空白对照组吸光值)]*100%表示该样品浓度作用下细胞的存活率。采用s型剂量响应方程
(prismgraphpadsoftware,lajolla,ca,usa),计算gc50值。在采用s180、hepg2、caco-2、hgc-27、95d细胞的试验中,式(1)化合物的gi50值分别是0.0103mm、0.0102mm、0.0026mm、0.005mm、0.0061mm,表明在以上浓度下lcb1对不同类型的癌细胞具有优异的抑制效果。
[0032]
实施例3:本发明化合物对肿瘤增殖的体内抑制试验
[0033]
本发明化合物的pi3k抑制活性通过测定长链碱1(lcb1,d17:1)抑制鼠肉瘤细胞s180的体内生长能力来测定。小鼠根据体重分为四组:正常组、模型组、口服lcb组及注射lcb组。除正常组外,小鼠腹腔注射s180细胞2*106/只。24小时后,口服lcb组口服16.7mg/kg体重的(1)化合物,注射lcb组腹腔注射5mg/kg体重的(1)化合物,并观察小鼠腹围,14天后停止给药观察小鼠的存活时间。结果表明,口服和腹腔注射(1)化合物lcb均显著抑制小鼠因s180生长造成腹水增多导致的腹围增大,其中腹腔注射(1)化合物lcb以更低的剂量达到了更佳的效果(图3a)。另外两种给药方式均显著延长荷瘤小鼠的生存时间(图3b和c)。
[0034]
实施例4:本发明化合物与pi3k对接位点的分析试验
[0035]
利用moe分子对接分析表明lcb1与pik3cg(pdb:6xrm)的结合能为-7.8601kj/mol,且在833lys、841asp及869cys氨基酸位点产生3个氢键,且相互作用较强,同时与部分活性位点氨基酸进行疏水性结合。对接过程中相关氨基酸有964asp、880glu、867tyr、838leu、845leu、965phe、963ile、879ile、882val、953met、881ile、831ile、812trp、961phe、885ala(图4a)。lcb2与pik3cg(pdb:6xrm)的结合能为-8.7345kj/mol,且在867tyr、833lys及841asp氨基酸位点产生3个氢键,且相互作用较强,同时与部分活性位点氨基酸进行疏水性结合。对接过程中相关氨基酸有869cys、880glu、842met、845leu、965phe、838leu、963ile、831ile、961phe、953met、885ala、881ile、812trp、882val、879ile、804met(图4b)。lcb3与pik3cg(pdb:6xrm)的结合能为-7.1385kj/mol,且在869cys氨基酸位点产生1个氢键,且相互作用较强,同时与部分活性位点氨基酸进行疏水性结合。对接过程中相关氨基酸有963ile、883lys、806ser、880glu、841asp、951asn、867tyr、838leu、845leu、965phe、810pro、831ile、804met、953met、879ile、961phe、882val(图4c)。lcb4与pik3cg(pdb:6xrm)的结合能为-7.5506kj/mol,且在964asp、833lys和869cys氨基酸位点产生3个氢键,且相互作用较强,同时与部分活性位点氨基酸进行疏水性结合。对接过程中相关氨基酸有963ile、962his、880glu、841asp、867tyr、845leu、965phe、953met、804met、812trp、885ala、882val、831ile、961phe、881ile、879ile(图4d)。以上数据表明,lcb与pi3k具有好的结合能力,且在833lys、841asp及869cys等多个氨基酸位点产生氢键且相互作用较强,同时与部分活性位点氨基酸进行疏水性结合,据报道,该位点是pi3k的活性抑制位点。
[0036]
以上所述,仅是本发明的较佳实施例,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可以利用上述技术内容加以变更或改型为等同变化的等效实施例。但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1