异欧前胡素在制备神经炎症抑制剂中的用途
1.本发明属于药物研究技术领域,具体公开了异欧前胡素在制备神经炎症抑制剂中的用途。
背景技术:
2.免疫系统在炎症调节中至关重要,它是人体对于外界一切刺激和入侵的一道防线,同时具有抵御病原体,修复受损组织的功能,但慢性诱导可能会导致机体受损。神经炎症,即中枢神经系统中发生的炎症,被认为是很多疾病的病理特征,例如帕金森症、阿尔兹海默症、肌萎缩性脊髓侧索硬化症等。许多证据表明,神经炎症在神经元退化过程中起着关键性的作用,神经退行性疾病的病理特征更是验证了这一观点。
3.大多数神经退行性疾病都有一个共同特征,那就是中枢神经系统中多巴胺能神经元坏死,蛋白的病理性堆积。例如帕金森症中,其发病的本质是大脑皮层黑质致密部多巴胺能神经元坏死和存活神经元胞浆中α-突触核蛋白的异常聚集(路易小体)。免疫球蛋白(igg)定位于路易小体上,它会与α-突触核蛋白结合形成免疫复合物,继而与小胶质细胞表面fcy受体
‑ⅰ
相互作用,从而介导小胶质细胞激活,产生神经炎症。小胶质细胞激活在神经炎症和随后的神经元变性中起着至关重要的作用,被作为一种脑内神经炎症反应发生的标志。
4.小胶质细胞,源于胚胎卵黄膜中的骨髓祖细胞,约占总神经胶质细胞的12%。在正常情况下,小胶质细胞处于静息状态,细胞形态为较小的胞体和高度分枝的突起,在中枢神经系统中起到警惕和监视的作用,维持大脑稳态;当中枢神经系统受损时,小胶质细胞被激活,产生m1样小胶质细胞介导的初始炎症反应。这种激活在早期有助于机体吞噬病原体,清除细胞碎片,但在后期小胶质细胞被不受控制的激活或过度激活时,会引起慢性神经炎症的发生,一系列促炎因子的释放,氧化应激反映的发生,进一步加剧神经元的坏死和丢失,诱发神经退行性疾病。
5.目前,临床上缺乏预防和治疗神经炎症的药物,此外,临床上也缺乏治疗一系列神经退行性疾病的特效药。神经炎症在神经退行性疾病的进程中起到了至关重要的作用,一方面它保护了大脑不受外界刺激的侵扰,另一方面,慢性持续的神经炎症也会引起神经元死亡,进一步恶化病程的发展,因此开发针对神经炎症控制的药物将成为神经退行性疾病的预防和治疗的重要研究方向。
6.中药拥有悠久的历史和丰富的临床经验,以其显著的生物学活性和较小的毒副作用历久弥新,但中药种类千千万万,且每种中药的化学成分又种类不一,因此探究中药化学成分对于神经炎症控制的药效可能会成为防治神经退行性疾病的新方向。
7.异欧前胡素,羌活中的一种呋喃香豆素类化合物,2020版《中国药典》中规定异欧前胡素为其质量控制指标,分子式为c
16h14
o4,结构式如式ⅰ所示。羌活目前临床主要用于风寒感冒,头痛项强,风湿痹痛,肩背酸痛。异欧前胡素为羌活主要有效成分,已有其抗炎(骨关节炎)、镇痛、抗病毒和抗癌活性的报道,但关于神经炎症并无相关报道。
8.
技术实现要素:
9.鉴于以上技术问题,本发明提供了以下技术方案:
10.本发明一方面提供了异欧前胡素在制备神经炎症抑制剂中的用途。
11.优选地,所述异欧前胡素用于制备小胶质细胞bv2释放的炎症因子tnf-α、il-6的mrna表达抑制剂。
12.优选地,所述异欧前胡素用于制备小胶质细胞bv2释放的炎症因子tnf-α、il-6的蛋白表达抑制剂。
13.优选地,所述异欧前胡素用于制备小胶质细胞bv2中no的释放抑制剂。
14.优选地,所述异欧前胡素用于制备炎症酶inos和cox-2的表达抑制剂。
15.本发明还提供一种用于抑制神经炎症的药物,其包括上述任一项所述异欧前胡素,以及药学上可接受的辅料或载体。
16.本发明另一方面提供一种用于治疗退行性疾病的药物,其包括上述任一项所述异欧前胡素,以及药学上可接受的辅料或载体。
17.优选地,所述退行性疾病为帕金森症、阿尔兹海默症或肌萎缩性脊髓侧索硬化症。
18.对比现有技术,本发明的有益效果为:
19.本发明提供了异欧前胡素在制备神经炎症抑制剂中的用途。细胞实验证实:异欧前胡素能够抑制lps诱导的小胶质细胞bv2激活释放的炎症因子tnf-α、il-6的mrna及蛋白表达水平,同时能够干扰小胶质细胞bv2激活所产生的氧化应激反应。
附图说明
20.图1是异欧前胡素对小胶质细胞bv2的细胞活力的影响;
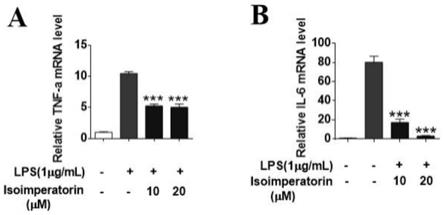
21.图2是异欧前胡素抑制lps诱导的小胶质细胞bv2激活所产生的的炎症因子tnf-α、il-6的mrna水平的表达;a、tnf-αmrna水平,b、il-6mrna水平;与lps组相比,
***
p《0.001;
22.图3是异欧前胡素抑制lps诱导的小胶质细胞bv2激活所产生的的炎症因子tnf-α、il-6的蛋白水平的表达;a、tnf-α,b、il-6;与lps组相比,
**
p《0.01,
***
p《0.001;
23.图4是异欧前胡素抑制lps诱导的小胶质细胞bv2激活所产生的的氧化应激反应中no的释放;与lps组相比,
***
p《0.001;
24.图5是inos和cox-2炎症酶的蛋白表达水平。
具体实施方式
25.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
26.实施例1
27.异欧前胡素对小胶质细胞bv2的细胞活力的影响
28.为了研究异欧前胡素对于神经炎症是否有抑制作用,首先对异欧前胡素是否影响bv2细胞的生物活性进行检测。具体方法如下:
29.将bv2细胞铺于96孔板中,待其密度生长至70%-80%时,分别加入不同浓度的异欧前胡素0μm、0.1μm、1μm、10μm、20μm、40μm、80μm继续培养,48h后采用mtt的方法检测异欧前胡素对于bv2细胞生长活力的影响。所有数据均采用平均值
±
标准差的方法进行分析,每次分析至少重复三次。结果如图1所示。
30.检测结果显示,0-80μm的异欧前胡素对bv2细胞生长活力未出现明显影响,可进行后续试验。
31.实施例2
32.异欧前胡素对lps诱导的小胶质细胞bv2激活所释放的的炎症因子tnf-α、il-6的mrna表达水平的影响
33.神经炎症发生时往往伴随着炎症因子的释放和氧化应激反应的发生,因此我们通过这两种途径检验异欧前胡素对于lps引起的bv2细胞炎症反应的抑制作用。
34.对bv2细胞进行不同浓度的异欧前胡素(10μm、20μm)预处理30min,然后加入1μg/ml lps处理24h,提取dna通过qpcr方法检测肿瘤坏死因子tnf-α和il-6在mrna水平的表达量。所有数据均采用平均值
±
标准差的方法进行分析,每次分析至少重复三次。结果如图2所示。
35.结果显示,与空白组比较,加入lps后,炎症因子tnf-α和il-6表达量显著升高;加入异欧前胡素后,炎症因子表达量明显下降,说明异欧前胡素可有效抑制lps诱导的bv2细胞炎症因子的释放。
36.实施例3
37.异欧前胡素对lps诱导的小胶质细胞bv2激活所释放的的炎症因子tnf-α、il-6的蛋白表达水平的影响
38.对bv2细胞进行不同浓度的异欧前胡素(10μm、20μm)预处理30min,然后加入1μg/ml lps处理24h,取上清液采用elisa的方法检测肿瘤坏死因子tnf-α和il-6的蛋白表达量。所有数据均采用平均值
±
标准差的方法进行分析,每次分析至少重复三次。结果如图3所示。
39.图3结果显示,与空白组相比较,lps刺激组的tnf-α和il-6的蛋白表达量显著升高;加入异欧前胡素后,加药组的tnf-α和il-6的蛋白表达量明显降低。
40.实施例4
41.异欧前胡素对lps诱导的小胶质细胞bv2激活所产生的氧化应激反应的影响
42.小胶质细胞表达烟酰胺腺嘌呤二核苷酸磷酸氧化酶,在其被lps刺激后,会在胞外
分泌超氧化物,这些超氧化物被超氧化物歧化酶分解为过氧化氢,过氧化氢会刺激小胶质细胞表达一氧化氮合酶inos从而产生一氧化氮no。
43.本发明对bv2细胞进行不同浓度的异欧前胡素(10μm、20μm)预处理30min,然后加入1μg/ml lps处理24h,取上清液通过试剂盒检测no的表达量。所有数据均采用平均值
±
标准差的方法进行分析,每次分析至少重复三次。结果如图4所示。
44.通过试剂盒检测no的表达量(图4),发现lps刺激后,no表达量显著增加,加入异欧前胡素干预后,no表达量明显下降,说明异欧前胡素可以抑制lps诱导的bv2细胞no的释放。
45.同时,通过western blot检测炎症酶inos和cox-2的表达量(图5),发现结果与no表达量所表明的趋势一致,表明异欧前胡素可能是通过调节炎症酶inos和cox-2的表达来调控no,从而抑制其过量释放。
46.以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是本发明的原理,在不脱离本发明精神和范围的前提下本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明的范围内。本发明要求的保护范围由所附的权利要求书及其等同物界定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1