一种基因递送载体及其抗肿瘤应用
1.本发明涉及药物领域,具体地,本发明涉及一种基因递送载体及其抗肿瘤应用。
背景技术:
2.肿瘤严重威胁生命健康,对抗肿瘤药物及其递送载体的研究成为当今的研究热点。肿瘤细胞是一种自身稳态性高的细胞,例如,为了平衡氧化应激以维持细胞内氧化还原稳态,肿瘤细胞也会产生强大的抗氧化系统,包括过氧化氢酶、超氧化物歧化酶和谷胱甘肽,从而使得肿瘤细胞内的氧化-还原处于一个动态平衡中,从而维持肿瘤的生长。
3.基因疗法是一种治疗肿瘤的生物治疗方法,具有治疗效率高的优势。基因疗法是通过将治疗性遗传物质(如dna、rna)和相关调控元件递送至靶细胞来治疗肿瘤等相关疾病。然而,尽管目前已有大量基于基因治疗的临床试验,但基因治疗的有效和安全应用仍面临巨大挑战。非病毒基因载体,尤其是阳离子聚合物,由于其非免疫遗传学、易于合成的结构和高负载能力,被认为是现代基因治疗的基石。然而,传统的阳离子聚合物基因传递系统难以被肿瘤细胞摄取和吸收,到达肿瘤细胞内难以解离,从而抑制dna的有效释放,最终导致基因转染效率低下,从而无法有效抑制肿瘤,还有,现有基因载药纳米颗粒容易在溶酶体中聚集,溶酶体中的多种酶将纳米颗粒及其负载的基因药物降解,从而降低基因药物的抗肿瘤效果。
4.因此,本领域迫切需要开发一种提高基因药物治疗效果的基因递送载体,从而提高抗肿瘤效果。
技术实现要素:
5.本发明的目的在于提供一种提高基因药物治疗效果的递送载体。
6.本发明的第一方面提供了一种递送载体,所述的递送载体包括脂质膜和b-pdeaea,所述的脂质膜包裹所述b-pdeaea;
7.所述的脂质膜包括ir780碘化物;
8.所述的b-pdeaea结构如下:
9.10.优选地,所述的递送载体为药物递送载体。
11.优选地,所述的药物包括抗肿瘤药物。
12.优选地,所述的药物包括基因。
13.优选地,所述的递送载体为基因递送载体。
14.优选地,所述的基因选自下组:dna、rna,或其组合。
15.优选地,所述的基因包括trail(为肿瘤坏死因子相关凋亡诱导配体)基因。
16.优选地,所述的trail基因的genbank为nm_003810.3。
17.优选地,所述的递送载体为纳米载体。
18.优选地,所述的纳米载体为核-壳结构,所述的核为b-pdeaea,所述的脂质膜为壳。
19.优选地,所述的b-pdeaea的分子量为10000-30000da,较佳地15000-23000da,更佳地16000-20000da,更佳地17000-19000da,更佳地17500-18500da,最佳地18000da。
20.优选地,所述的b-pdeaea的分散系数为1.2-2.0,较佳地1.4-2.0,更佳地1.5-1.9,更佳地1.6-1.8,最佳地1.7。
21.优选地,所述ir780碘化物负载在所述脂质膜上。
22.优选地,所述脂质膜包载所述ir780碘化物。
23.优选地,所述的脂质膜还包括脂质材料。
24.优选地,所述的脂质材料选自下组:胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)](dspe-mpeg)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc)、1,2-二硬脂基-sn-甘油-3-磷酸乙醇胺-聚乙二醇(dspe-peg)、大豆磷脂、磷脂酰胆碱(pc,卵磷脂)磷脂酰乙醇胺(pe,脑磷脂)、磷脂酰丝氨酸(ps)、磷脂酰肌醇(pi)、磷脂酰甘油(pg)、二鲸蜡磷酸酯(dcp)、二肉豆寇酰磷脂酰胆碱(dmpc)、二硬脂酰磷脂酰胆碱(dspc)、二月桂酰磷脂酰胆碱(dlpc)和二油酰磷脂酰胆碱(dopc),或其组合。
[0025]
优选地,所述的1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)](dspe-mpeg)包括1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)
[0026]
优选地,所述的脂质材料选自下组:胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000),或其组合。
[0027]
优选地,所述的脂质材料包括胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)和1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)。
[0028]
优选地,所述的脂质膜包括胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)和ir780碘化物。
[0029]
优选地,所述的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)为2.5-4重量份,较佳地3.0-3.4重量份,更佳地3.16重量份。
[0030]
优选地,所述的1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)为1.5-2.5重量份,较佳地1.9-2.3重量份,更佳地2.1重量份。
[0031]
优选地,所述的胆固醇为0.4-0.7重量份,较佳地0.5-0.6重量份,更佳地0.54重量份。
[0032]
优选地,所述的ir780碘化物为0.3-0.7重量份,较佳地0.4-0.6重量份,更佳地0.5重量份。
[0033]
优选地,所述的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)与所述1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)的重量比为0.8-3:1,较佳地1.0-2:1,更佳地1.3-1.7:1,更佳地1.5:1。
[0034]
优选地,所述的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)与所述胆固醇的重量比为4-8-3:1,较佳地5.5-6.3:1,更佳地5.6-6.0:1,更佳地5.9:1。
[0035]
优选地,所述的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)与所述ir780碘化物的重量比为4-8-3:1,较佳地5.8-6.8:1,更佳地6.2-6.5:1,更佳地6.3:1。
[0036]
优选地,所述的脂质膜通过以下方法制备:
[0037]
将胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)和ir780碘化物溶于有机溶剂中,旋转蒸发除去有机溶剂,得到脂质膜。
[0038]
优选地,所述的脂质膜通过以下方法制备:
[0039]
将胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)和ir780碘化物溶于有机溶剂中,将混合液倒入圆底烧瓶中旋转蒸发除去有机溶剂,得到脂质膜。
[0040]
优选地,所述的有机溶剂选自下组:乙醇、二氯甲烷、丙酮、三氯甲烷,或其组合。
[0041]
优选地,所述的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)与所述b-pdeaea的重量比为1.5-4:1,较佳地1.5-3:1,更佳地2-2.5:1,更佳地2.3:1。
[0042]
优选地,所述的b-pdeaea为0.5-3重量份,较佳地0.8-2重量份,更佳地1.0-1.6重量份,更佳地1.2-1.6重量份,更佳地1.3-1.5重量份,最佳地1.4重量份。
[0043]
优选地,所述b-pdeaea与所述ir780碘化物的重量比为2.5-3.5:1,较佳地2.8-3.2:1,更佳地2.6-3.0:1,更佳地2.8:1。
[0044]
优选地,所述的b-pdeaea以干燥或溶液的形式存在。
[0045]
优选地,所述的递送载体包括脂质膜和b-pdeaea溶液,所述的脂质膜包裹所述b-pdeaea溶液。
[0046]
优选地,所述的递送载体通过以下方法制备:
[0047]
将b-pdeaea溶液与所述脂质膜混合,搅拌后,得到递送载体。
[0048]
优选地,所述的递送载体通过以下方法制备:
[0049]
将b-pdeaea溶液与所述脂质膜混合,搅拌后,冷冻干燥得到递送载体。
[0050]
优选地,所述的溶液的介质为hepes缓冲液。
[0051]
优选地,所述hepes缓冲液的ph为7.2-7.6,较佳地7.4。
[0052]
优选地,所述hepes缓冲液的浓度为8-12mm,较佳地10mm。
[0053]
优选地,所述b-pdeaea溶液中,所述b-pdeaea的浓度为100-800μg/ml,较佳地100-600μg/ml,更佳地100-100μg/ml,更佳地200-300μg/ml,更佳地250-290μg/ml。
[0054]
本发明第二方面,提供一种如本发明第一方面所述的递送载体的用途,用于制备
负载药物的药物复合物,所述的递送载体用于:(i)促进药物复合物跨肿瘤血管内皮细胞渗透;(ii)促进药物复合物在肿瘤细胞部位的富集和/或渗透;(iii)促进药物复合物被肿瘤细胞吸收和摄取;(iv)改善药物复合物被肿瘤细胞溶酶体的吞噬和/或降解;(v)增强药物复合物对肿瘤治疗;和/或(vi)提高药物复合物的血液清除半衰期。
[0055]
优选地,所述的改善包括避免、降低、克服和/或抑制。
[0056]
优选地,所述的(v)增强药物复合物对肿瘤靶向治疗包括在对肿瘤进行超声刺激下,增强药物复合物在对肿瘤治疗。
[0057]
优选地,在对肿瘤进行超声刺激下,药物复合物在肿瘤细胞内解离释放药物。
[0058]
优选地,所述的治疗包括靶向治疗。
[0059]
优选地,所述的递送载体用于:改善药物复合物被溶酶体的吞噬和/或降解,增强药物复合物在在肿瘤细胞内稳定性。
[0060]
优选地,所述的药物包括抗肿瘤药物。
[0061]
优选地,所述的药物包括负电荷药物。
[0062]
优选地,所述的药物包括容易被溶酶体酶降解的药物。
[0063]
优选地,所述的药物包括基因。
[0064]
优选地,所述的基因选自下组:dna、rna,或其组合。
[0065]
优选地,所述的基因包括trail(为肿瘤坏死因子相关凋亡诱导配体)基因。
[0066]
优选地,所述的药物负载在所述b-pdeaea上。
[0067]
优选地,所述的药物结合在所述b-pdeaea上。
[0068]
优选地,所述的药物通过静电作用结合在所述b-pdeaea上。
[0069]
优选地,所述b-pdeaea中的n原子和基因中p原子的摩尔数之比为10-40:1,较佳地10-30:1,更佳地15-25:1,更佳地18-22:1,更佳地20:1。
[0070]
优选地,所述的肿瘤包括低渗透性肿瘤。
[0071]
优选地,所述的肿瘤包括实体瘤。
[0072]
优选地,所述的肿瘤包括低渗透性实体肿瘤。
[0073]
优选地,所述的肿瘤包括胰腺癌。
[0074]
优选地,所述的胰腺癌为胰腺腺癌。
[0075]
优选地,所述的胰腺癌为原位胰腺癌。
[0076]
优选地,所述的胰腺癌为原位胰腺腺癌。
[0077]
优选地,所述的胰腺癌为胰腺导管腺癌。
[0078]
优选地,所述的胰腺癌为人胰腺导管腺癌。
[0079]
优选地,所述的胰腺癌的癌细胞为bxpc-3细胞。
[0080]
优选地,所述的药物复合物为注射制剂。
[0081]
优选地,所述的注射剂为静脉注射制剂或动脉注射制剂。
[0082]
优选地,静脉注射剂为头静脉注射制剂、手背静脉注射制剂或足背静脉注射制剂。
[0083]
优选地,所述的药物复合物为纳米载体。
[0084]
本发明第三方面,提供一种药物复合物,所述的药物复合物包括如本发明第一方面所述的递送载体;和药物。
[0085]
优选地,所述的药物复合物为纳米载体。
[0086]
优选地,所述的药物包括抗肿瘤药物。
[0087]
优选地,所述的药物包括负电荷药物。
[0088]
优选地,所述的药物包括容易被溶酶体酶降解的药物。
[0089]
优选地,所述的药物包括基因。
[0090]
优选地,所述的基因选自下组:dna、rna,或其组合。
[0091]
优选地,所述的基因包括trail(为肿瘤坏死因子相关凋亡诱导配体)基因。
[0092]
优选地,所述的药物负载在所述b-pdeaea上。
[0093]
优选地,所述的药物结合在所述b-pdeaea上。
[0094]
优选地,所述的药物通过静电作用结合在所述b-pdeaea上。
[0095]
优选地,所述b-pdeaea中的n原子和基因中p原子的摩尔数之比为10-40:1,较佳地10-30:1,更佳地15-25:1,更佳地18-22:1,更佳地20:1。
[0096]
优选地,所述的药物复合物为注射制剂。
[0097]
优选地,所述的注射剂为静脉注射制剂或动脉注射制剂。
[0098]
优选地,静脉注射剂为头静脉注射制剂、手背静脉注射制剂或足背静脉注射制剂。
[0099]
优选地,所述的药物复合物为纳米载体。
[0100]
本发明第四方面,提供一种本发明第三方面所述的药物复合物的制备方法,所述的方法包括步骤:
[0101]
(1)制备脂质膜,所述的脂质膜通过以下方法制备:
[0102]
将胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)和ir780碘化物溶于有机溶剂中,旋转蒸发除去有机溶剂,得到脂质膜;
[0103]
(2)制备负载药物的b-pdeaea溶液,所述的负载药物的b-pdeaea溶液通过以下方法制备:
[0104]
将药物溶液与b-pdeaea溶液混合,得到负载药物的b-pdeaea溶液;
[0105]
(3)将负载药物的b-pdeaea溶液与所述脂质膜混合,搅拌后,得到药物复合物。
[0106]
优选地,所述的混合包括涡旋混合。
[0107]
优选地,所述的溶液的介质为hepes缓冲液。
[0108]
优选地,所述hepes缓冲液的ph为7.2-7.6,较佳地7.4。
[0109]
优选地,所述hepes缓冲液的浓度为8-12mm,较佳地10mm。
[0110]
优选地,所述的药物溶液中药物的浓度为35-45μg/ml,较佳地38-42μg/ml。
[0111]
优选地,所述的b-pdeaea溶液中b-pdeaea的浓度为540-560μg/ml,较佳地548-558μg/ml。+
[0112]
优选地,所述的药物溶液与所述b-pdeaea溶液的体积比为1:0.5-1.5,较佳地1:0.8-1.2,更佳地1:1。
[0113]
优选地,所述的步骤(3)中,将负载药物的b-pdeaea溶液与所述脂质膜混合,搅拌后,冷冻干燥,得到药物复合物。
[0114]
本发明第五方面,提供一种本发明第三方面所述的药物复合物的用途,用于制备组合物,所述的组合物用于预防和/或治疗肿瘤。
[0115]
优选地,所述的组合物为药物组合物。
[0116]
优选地,所述的药物组合物还包括药学上可接受的载体。
[0117]
优选地,所述的组合物为固体制剂、液体制剂或半固体制剂。
[0118]
优选地,所述的组合物为注射制剂、口服制剂或外用制剂。
[0119]
优选地,所述的注射制剂为注射制剂。
[0120]
优选地,所述的注射剂为静脉注射制剂或动脉注射制剂。
[0121]
优选地,静脉注射剂为头静脉注射制剂、手背静脉注射制剂或足背静脉注射制剂。
[0122]
优选地,所述的肿瘤包括低渗透性肿瘤。
[0123]
优选地,所述的肿瘤包括实体瘤。
[0124]
优选地,所述的肿瘤包括低渗透性实体肿瘤。
[0125]
优选地,所述的肿瘤包括胰腺癌。
[0126]
优选地,所述的胰腺癌为胰腺腺癌。
[0127]
优选地,所述的胰腺癌为原位胰腺癌。
[0128]
优选地,所述的胰腺癌为原位胰腺腺癌。
[0129]
优选地,所述的胰腺癌为胰腺导管腺癌。
[0130]
优选地,所述的胰腺癌为人胰腺导管腺癌。
[0131]
优选地,所述的胰腺癌的癌细胞为bxpc-3细胞。
[0132]
优选地,所述的治疗包括抑制、减轻、缓解、逆转或根除。
[0133]
本发明第六方面,提供一种组合物,所述的组合物包括如本发明第一方面所述的递送载体、和/或如本发明第三方面所述的药物复合物。
[0134]
优选地,所述的组合物为药物组合物。
[0135]
优选地,所述的药物组合物还包括药学上可接受的载体。
[0136]
优选地,所述的组合物为固体制剂、液体制剂或半固体制剂。
[0137]
优选地,所述的组合物为注射制剂、口服制剂或外用制剂。
[0138]
优选地,所述的注射制剂为注射制剂。
[0139]
优选地,所述的注射剂为静脉注射制剂或动脉注射制剂。
[0140]
优选地,静脉注射剂为头静脉注射制剂、手背静脉注射制剂或足背静脉注射制剂。
[0141]
本发明第七方面,提供一种用于治疗肿瘤的系统或装置,所述的系统包括如本发明第三方面所述的药物复合物、和/或如本发明第六方面所述的组合物;和超声装置。
[0142]
优选地,所述的系统或装置还包括或标签,所述的说明书或标签记载:
[0143]
在给所需的肿瘤对象施用如本发明第三方面所述的药物复合物、和/或如本发明第六方面所述的组合物预防和/或治疗肿瘤过程中,用超声装置对肿瘤部位进行超声刺激。
[0144]
优选地,所述的超声装置包括超声仪。
[0145]
优选地,所述的对象包括人或非人哺乳动物。
[0146]
优选地,所述的非人哺乳动物包括牛、马、羊、狗、猫或鼠。
[0147]
优选地,所述的肿瘤包括低渗透性肿瘤。
[0148]
优选地,所述的肿瘤包括实体瘤。
[0149]
优选地,所述的肿瘤包括低渗透性实体肿瘤。
[0150]
优选地,所述的肿瘤包括胰腺癌。
[0151]
优选地,所述的胰腺癌为胰腺腺癌。
[0152]
优选地,所述的胰腺癌为原位胰腺癌。
[0153]
优选地,所述的胰腺癌为原位胰腺腺癌。
[0154]
优选地,所述的胰腺癌为胰腺导管腺癌。
[0155]
优选地,所述的胰腺癌为人胰腺导管腺癌。
[0156]
优选地,所述的胰腺癌的癌细胞为bxpc-3细胞。
[0157]
优选地,所述的施用为注射施用、口服施用或外用施用。
[0158]
优选地,所述注射施用为静脉施用或动脉施用。
[0159]
优选地,所述注射施用为头静脉注射施用、手背静脉注射施用或足背静脉注射施用。
[0160]
本发明第八方面,提供一种如本发明第七方面所述的系统或装置的用途,用于制备治疗设备,所述的治疗设备用于治疗肿瘤。
[0161]
优选地,所述的治疗设备还包括或标签,所述的说明书或标签记载:
[0162]
在给所需的肿瘤对象施用如本发明第三方面所述的药物复合物、和/或如本发明第六方面所述的组合物预防和/或治疗肿瘤过程中,用超声装置对肿瘤部位进行超声刺激。
[0163]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
[0164]
图1为不同颗粒的表征分析。图1a为lip、il、btl、btil的纳米颗粒的粒子分布图和透射电镜图;图1b为lip、il、btl、btil纳米颗粒在溶液中的整体外观;图1c为lip、il、btl、btil纳米颗粒的粒径;图1d为lip、il、btl、btil纳米颗粒和ir780的紫外-可见分光光度计测定的吸收光谱图。
[0165]
图2为b-pdeaea与基因的不同n/p比的转染结果,pei-dna中n/p比为7。
[0166]
图3为流式细胞术测定不同孵育时间点bxpc-3细胞对btil的吸收和摄取结果。
[0167]
图4为为clsm观察cy5.5标记的btil在细胞内分布的特性,蓝色为细胞核,绿色为溶酶体,红色为cy5.5标记的btil。
[0168]
图5为clsm观察有或没有超声刺激下btil在bxpc-3细胞内解离,其中,us(-)表示无超声刺激,us(+)表示有超声刺激,
cy5
dna为btil负载的cy5标记的trail基因,
cy3
dna为btil负载的cy3标记的trail基因。
[0169]
图6为btil的血液清除率曲线。
[0170]
图7为btil的体内荧光成像和生物分布,其中,图7a为btil在注射后的不同时间,荷瘤小鼠肿瘤部位的荧光成像;图7b为btil在注射后的12h,荷瘤小鼠肿瘤、心、肝、脾、肺和肾的荧光成像;图7c为btil在注射后的不同时间,荷瘤小鼠肿瘤部位的荧光强度变化;图7d为为btil在注射后的12h,荷瘤小鼠肿瘤、心、肝、脾、肺和肾的荧光强度;m
±
sd,n=3。
[0171]
图8为不同处理组的荷瘤小鼠在不同时间点的原位胰腺癌的荧光成像,其中(1)为control组,(2)为us组,(3)为btl组,(4)为btil组,(5)为btil+us组。
[0172]
图9为不同处理组的荷瘤小鼠在不同时间点的原位胰腺癌的荧光相对强度比,其中,荧光相对强度比=(给药处理后不同时间点的肿瘤荧光强度)/(给药处理前(即0天)的
肿瘤荧光强度)。
[0173]
图10为不同处理组的bxpc3-luci荷瘤小鼠在不同时间点的体重变化。
[0174]
图11为不同处理组bxpc3-luci荷瘤小鼠在治疗的第15天后处死,解剖的肿瘤的h&e、ki-67和tunel染色;h&e染色中的比例尺为75μm,ki-67和tunel染色中的比例尺为50μm。
[0175]
图12为不同处理组的bxpc3-luci荷瘤小鼠在治疗的第15天后处死,解剖的心、肝、脾、肺和肾的h&e染色,h&e染色中的比例尺为75μm。
[0176]
图13为不同浓度的btil溶血分析,以pbs为阴性对照,去离子水为阳性对照。
[0177]
图14为荷瘤小鼠尾静脉注射btil后的血液生化分析,血尿素氮(bun),肌酐(urea),丙氨酸转移酶(alt),天冬氨酸转移酶(ast),碱性磷酸酶(alp),红细胞计数(rbc),白细胞计数(wbc),血小板计数(plt),红细胞平均容量(mcv),红细胞分布宽度(rdw),血细胞比容(hct)。
具体实施方式
[0178]
本发明开发了一种递送载体,所述的递送载体包括脂质膜和b-pdeaea,所述的脂质膜包裹所述b-pdeaea。本发明所述的递送载体能够用于负载药物(如基因),负载药物(如基因)的递送载体能够有效的在肿瘤部位聚集且有效的被肿瘤细胞吸收和摄取,进入肿瘤细胞,从而增强药物(如基因)递送到肿瘤内,发挥肿瘤靶向治疗效果,负载药物(如基因)的递送载体进入肿瘤细胞内能够有效地避免溶酶体的吞噬和避免溶酶体降解能力,从而增强药物(如基因)在肿瘤细胞内稳定性,在超声辐射刺激肿瘤细胞下,本发明负载药物(如基因)的递送载体在肿瘤细胞内能够有效地解离释放药物(如基因),从而增强抗药物(如基因)的抗肿瘤效果。此外,本发明所述的负载药物(如基因)的递送载体具有优异的长时间血液清除半衰期,有利于负载药物(如基因)的递送载体在肿瘤部位的聚集和有利于超声刺激诱导的抗肿瘤效果,且递送载体具有优异的生物安全性。因此,本发明所述的负载药物(如基因)的递送载体能够用于增强药物(如基因)的抗肿瘤效果。
[0179]
术语
[0180]
如本文所用,术语“包括”、“包含”与“含有”可互换使用,不仅包括开放式定义,还包括半封闭式、和封闭式定义。换言之,所述术语包括了“由
……
构成”、“基本上由
……
构成”。
[0181]
如本文所用,术语“bxpc-3细胞”是指人原位胰腺导管腺癌细胞。
[0182]
如本文所用,术语“bxpc-3-luci”是指人原位胰腺导管腺癌细胞-荧光素酶标记。
[0183]
如本文所用,术语“trail”为tumor necrosis factor-related apoptosis-inducing ligand(肿瘤坏死因子相关凋亡诱导配体)。
[0184]
如本文所用,术语“cck-8”是指cell counting kit-8。
[0185]
如本文所用,b-pdeaea的分散系数是指mw/mn(mw和mn分别为重均、数均分子量)。
[0186]
如本文所用,“btl”是指b-pdeaea/trail。
[0187]
如本文所用,“btil”是指b-pdeaea/trail@ir780脂质体。
[0188]
如本文所用,“il”是指负载ir780脂质体。
[0189]
如本文所用,“lip”是指脂质体。
[0190]
如本文所用,ir780碘化物的结构式如下:
[0191][0192]
ir780碘化物(cas号:207399-07-3)。
[0193]
如本文所用,术语“重量份”可以是任何一个固定的以毫克、克数或千克表示重量(如1mg、1g或1kg等等)。例如,一个由1重量份组分a和9重量份组分b构成的组合中,可以是1克组分a+9克组分b,也可以是10克组分a+90克组分b等构成的组合。在所述的组合中,某一组分的百分比含量=(该组分的重量份数/所有组分的重量份数之和)
×
100%,因此,由1重量份组分a和9重量份组分b构成的组合物中,组分a的含量为10%,组分b的含量为90%。
[0194]
在本发明中,术语“预防”表示预防疾病和/或它的附随症状的发作或者保护对象免于获得疾病的方法。
[0195]
本发明所述的“治疗”包括抑制、减轻、缓解、逆转或根除疾病的进展,并不需要100%抑制、消灭和逆转。在一些实施方案中,与不存在本发明所述的b-pdeaea/trail@ir780脂质体(btil)时观察到的水平相比,本发明所述b-pdeaea/trail@ir780脂质体(btil)将相关疾病(如肿瘤)及其并发症减轻、抑制和/或逆转了例如至少约10%、至少约30%、至少约50%、或至少约80%、或至少约90%、或至少约95%,或约100%。
[0196]
在本发明中,术语“肿瘤”、“癌”和“癌症”可互换使用。
[0197]
在本发明中,n/p比是b-pdeaea中的氮n原子和基因(如trail基因)中磷p原子的摩尔数之比。
[0198]
trail
[0199]
trail为tumor necrosis factor-related apoptosis-inducing ligand(肿瘤坏死因子相关凋亡诱导配体)的简称,是肿瘤坏死因子tnf超家族的成员之一,trail能够通过凋亡通路诱导肿瘤细胞凋亡。
[0200]
本发明所述的trail基因优选人trail基因(genbank:nm_003810.3)。
[0201]
肿瘤
[0202]
在本发明的一个优选例中,所述肿瘤包括低渗透性肿瘤。
[0203]
在本发明的一个优选例中,所述的肿瘤包括实体瘤。
[0204]
优选地,所述的肿瘤包括低渗透性实体肿瘤。
[0205]
在本发明的一个优选例中,所述的肿瘤包括人源肿瘤。
[0206]
在本发明的一个优选例中,所述的肿瘤包括胰腺癌。
[0207]
优选地,所述的胰腺癌为胰腺腺癌。
[0208]
优选地,所述的胰腺癌为原位胰腺癌。
[0209]
优选地,所述的胰腺癌为原位胰腺腺癌。
[0210]
优选地,所述的胰腺癌为胰腺导管腺癌。
[0211]
优选地,所述的胰腺癌为人胰腺导管腺癌。
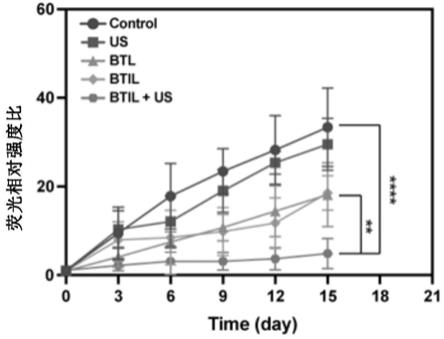
[0212]
优选地,所述的胰腺癌的癌细胞为bxpc-3细胞。
[0213]
递送载体
[0214]
本发明提供一种递送载体,所述的递送载体包括脂质膜和b-pdeaea,所述的脂质膜包裹所述b-pdeaea;
[0215]
所述的脂质膜包括ir780碘化物;
[0216]
所述的b-pdeaea结构如下:
[0217][0218]
本发明所述的递送载体可以为药物递送载体。
[0219]
在本发明一个优选例中,所述的药物包括抗肿瘤药物。
[0220]
在本发明一个优选例中,所述的药物包括基因。例如,所述的基因选自下组:dna、rna,或其组合。代表性地,所述的基因包括trail(为肿瘤坏死因子相关凋亡诱导配体)基因。优选地,所述的trail基因的genbank为nm_003810.3。
[0221]
优选地,所述的递送载体为基因递送载体。
[0222]
在本发明一个优选例中,所述的递送载体为纳米载体。
[0223]
优选地,所述的纳米载体为核-壳结构,所述的核为b-pdeaea,所述的脂质膜为壳。
[0224]
在本发明一个优选例中,所述的b-pdeaea的分子量为10000-30000da,较佳地15000-23000da,更佳地16000-20000da,更佳地17000-19000da,更佳地17500-18500da,最佳地18000da。
[0225]
在本发明一个优选例中,所述的b-pdeaea的分散系数为1.2-2.0,较佳地1.4-2.0,更佳地1.5-1.9,更佳地1.6-1.8,最佳地1.7。
[0226]
在本发明一个优选例中,所述ir780碘化物负载在所述脂质膜上。
[0227]
在本发明一个优选例中,所述脂质膜包载所述ir780碘化物。
[0228]
在本发明一个优选例中,所述的脂质膜还包括脂质材料。
[0229]
优选地,所述的脂质材料选自下组:胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)](dspe-mpeg)、1,2-二棕榈酰基-sn-甘油-3-磷酸胆碱(dppc)、1,2-二硬脂基-sn-甘油-3-磷酸乙醇胺-聚乙二醇(dspe-peg)、大豆磷脂、磷脂酰胆碱(pc,卵磷脂)磷脂酰乙醇胺(pe,脑磷脂)、磷脂酰丝氨酸(ps)、磷脂酰肌醇(pi)、磷脂酰甘油(pg)、二鲸蜡磷酸酯(dcp)、二肉豆寇酰磷脂酰胆碱(dmpc)、二硬脂酰磷脂酰胆碱(dspc)、二月桂酰磷脂酰胆碱(dlpc)和二油酰磷脂酰胆碱(dopc),或其组合。
[0230]
优选地,所述的1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二
醇)](dspe-mpeg)包括1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)
[0231]
优选地,所述的脂质材料选自下组:胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000),或其组合。
[0232]
优选地,所述的脂质材料包括胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)和1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)。
[0233]
在本发明一个优选例中,所述的脂质膜包括胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)和ir780碘化物。
[0234]
在本发明一个优选例中,所述的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)为2.5-4重量份,较佳地3.0-3.4重量份,更佳地3.16重量份。
[0235]
在本发明一个优选例中,所述的1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)为1.5-2.5重量份,较佳地1.9-2.3重量份,更佳地2.1重量份。
[0236]
在本发明一个优选例中,所述的胆固醇为0.4-0.7重量份,较佳地0.5-0.6重量份,更佳地0.54重量份。
[0237]
在本发明一个优选例中,所述的ir780碘化物为0.3-0.7重量份,较佳地0.4-0.6重量份,更佳地0.5重量份。
[0238]
在本发明一个优选例中,所述的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)与所述1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)的重量比为0.8-3:1,较佳地1.0-2:1,更佳地1.3-1.7:1,更佳地1.5:1。
[0239]
在本发明一个优选例中,所述的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)与所述胆固醇的重量比为4-8-3:1,较佳地5.5-6.3:1,更佳地5.6-6.0:1,更佳地5.9:1。
[0240]
在本发明一个优选例中,所述的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)与所述ir780碘化物的重量比为4-8-3:1,较佳地5.8-6.8:1,更佳地6.2-6.5:1,更佳地6.3:1。
[0241]
在本发明一个优选例中,所述的脂质膜通过以下方法制备:
[0242]
将胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)和ir780碘化物溶于有机溶剂中,旋转蒸发除去有机溶剂,得到脂质膜。
[0243]
优选地,所述的脂质膜通过以下方法制备:
[0244]
将胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)和ir780碘化物溶于有机溶剂中,将混合液倒入圆底烧瓶中旋转蒸发除去有机溶剂,得到脂质膜。
[0245]
优选地,所述的有机溶剂选自下组:乙醇、二氯甲烷、丙酮、三氯甲烷,或其组合。
[0246]
在本发明一个优选例中,所述的1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)与所述b-pdeaea的重量比为1.5-4:1,较佳地1.5-3:1,更佳地2-2.5:1,更佳地2.3:1。
[0247]
在本发明一个优选例中,所述的b-pdeaea为0.5-3重量份,较佳地0.8-2重量份,更
佳地1.0-1.6重量份,更佳地1.2-1.6重量份,更佳地1.3-1.5重量份,最佳地1.4重量份。
[0248]
在本发明一个优选例中,所述b-pdeaea与所述ir780碘化物的重量比为2.5-3.5:1,较佳地2.8-3.2:1,更佳地2.6-3.0:1,更佳地2.8:1。
[0249]
优选地,所述的b-pdeaea以干燥或溶液的形式存在。
[0250]
在本发明一个优选例中,所述的递送载体包括脂质膜和b-pdeaea溶液,所述的脂质膜包裹所述b-pdeaea溶液。
[0251]
在本发明一个优选例中,所述的递送载体通过以下方法制备:
[0252]
将b-pdeaea溶液与所述脂质膜混合,搅拌后,得到递送载体。
[0253]
在本发明一个优选例中,所述的递送载体通过以下方法制备:
[0254]
将b-pdeaea溶液与所述脂质膜混合,搅拌后,冷冻干燥得到递送载体。
[0255]
优选地,所述的溶液的介质为hepes缓冲液。
[0256]
优选地,所述hepes缓冲液的ph为7.2-7.6,较佳地7.4。
[0257]
优选地,所述hepes缓冲液的浓度为8-12mm,较佳地10mm。
[0258]
优选地,所述b-pdeaea溶液中,所述b-pdeaea的浓度为100-800μg/ml,较佳地100-600μg/ml,更佳地100-100μg/ml,更佳地200-300μg/ml,更佳地250-290μg/ml。
[0259]
本发明还提供一种本发明所述的递送载体的用途,用于制备负载药物的药物复合物,所述的递送载体用于:(i)促进药物复合物跨肿瘤血管内皮细胞渗透;(ii)促进药物复合物在肿瘤细胞部位的富集和/或渗透;(iii)促进药物复合物被肿瘤细胞吸收和摄取;(iv)改善药物复合物被肿瘤细胞溶酶体的吞噬和/或降解;(v)增强药物复合物对肿瘤治疗;和/或(vi)提高药物复合物的血液清除半衰期。
[0260]
优选地,所述的改善包括避免、降低、克服和/或抑制。
[0261]
优选地,所述的(v)增强药物复合物对肿瘤靶向治疗包括在对肿瘤进行超声刺激下,增强药物复合物在对肿瘤治疗。
[0262]
优选地,在对肿瘤进行超声刺激下,药物复合物在肿瘤细胞内解离释放药物。
[0263]
优选地,所述的治疗包括靶向治疗。
[0264]
优选地,所述的递送载体用于:改善药物复合物被溶酶体的吞噬和/或降解,增强药物复合物在在肿瘤细胞内稳定性。
[0265]
药物复合物、制备方法及其用途
[0266]
本发明还提供一种药物复合物,本发明所述的药物复合物包括如本发明所述的递送载体;和药物。
[0267]
优选地,所述的药物复合物为纳米载体。
[0268]
优选地,所述的药物包括抗肿瘤药物。
[0269]
优选地,所述的药物包括负电荷药物。
[0270]
优选地,所述的药物包括容易被溶酶体酶降解的药物。
[0271]
优选地,所述的药物包括基因。
[0272]
优选地,所述的基因选自下组:dna、rna,或其组合。
[0273]
优选地,所述的基因包括trail(为肿瘤坏死因子相关凋亡诱导配体)基因。
[0274]
优选地,所述的药物负载在所述b-pdeaea上。
[0275]
优选地,所述的药物结合在所述b-pdeaea上。
[0276]
优选地,所述的药物通过静电作用结合在所述b-pdeaea上。
[0277]
优选地,所述b-pdeaea中的n原子和基因中p原子的摩尔数之比为10-40:1,较佳地10-30:1,更佳地15-25:1,更佳地18-22:1,更佳地20:1。
[0278]
优选地,所述的药物复合物为注射制剂。
[0279]
优选地,所述的注射剂为静脉注射制剂或动脉注射制剂。
[0280]
优选地,静脉注射剂为头静脉注射制剂、手背静脉注射制剂或足背静脉注射制剂。
[0281]
优选地,所述的药物复合物为纳米载体。
[0282]
本发明还提供一种如本发明所述的药物复合物的制备方法,所述的方法包括步骤:
[0283]
(1)制备脂质膜,所述的脂质膜通过以下方法制备:
[0284]
将胆固醇、1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(dope)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](dspe-mpeg2000)和ir780碘化物溶于有机溶剂中,旋转蒸发除去有机溶剂,得到脂质膜;
[0285]
(2)制备负载药物的b-pdeaea溶液,所述的负载药物的b-pdeaea溶液通过以下方法制备:
[0286]
将药物溶液与b-pdeaea溶液混合,得到负载药物的b-pdeaea溶液;
[0287]
(3)将负载药物的b-pdeaea溶液与所述脂质膜混合,搅拌后,得到药物复合物。
[0288]
优选地,所述的混合包括涡旋混合。
[0289]
优选地,所述的溶液的介质为hepes缓冲液。
[0290]
优选地,所述hepes缓冲液的ph为7.2-7.6,较佳地7.4。
[0291]
优选地,所述hepes缓冲液的浓度为8-12mm,较佳地10mm。
[0292]
优选地,所述的药物溶液中药物的浓度为35-45μg/ml,较佳地38-42μg/ml。
[0293]
优选地,所述的b-pdeaea溶液中b-pdeaea的浓度为540-560μg/ml,较佳地548-558μg/ml。
[0294]
优选地,所述的药物溶液与所述b-pdeaea溶液的体积比为1:0.5-1.5,较佳地1:0.8-1.2,更佳地1:1。
[0295]
优选地,所述的步骤(3)中,将负载药物的b-pdeaea溶液与所述脂质膜混合,搅拌后,冷冻干燥,得到药物复合物。
[0296]
本发明还提供一种本发明所述药物复合物的用途,用于制备组合物,所述的组合物用于预防和/或治疗肿瘤。
[0297]
优选地,所述的治疗包括抑制、减轻、缓解、逆转或根除。
[0298]
组合物
[0299]
本发明还提供一种组合物,本发明所述的组合物可以包括本发明所述的递送载体、和/或本发明所述的药物复合物。
[0300]
优选地,所述的组合物为药物组合物。本发明所述的药物组合物还可以包括药学上可接受的载体。
[0301]
如本文所用“药学上可接受的载体”是指一种或多种相容性固体、半固体、液体或凝胶填料,它们适合于人体或动物使用,而且必须有足够的纯度和足够低的毒性。“相容性”是指药物组合物中的各组分和药物的活性成分以及它们之间相互掺和,而不明显降低药
效。
[0302]
应理解,在本发明中,所述的药学上可接受的载体没有特别的限制,可选用本领域常用材料,或用常规方法制得,或从市场购买得到。药学可接受的载体部分例子有纤维素及其衍生物(如甲基纤维素、乙基纤维素、羟丙甲基纤维素、羧甲基纤维素钠等)、明胶、滑石粉、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油、等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如吐温)、润湿剂(如十二烷基硫酸钠)、缓冲剂、螯合剂、增稠剂、ph调节剂、透皮促进剂、着色剂、调味剂、稳定剂、抗氧化剂、防腐剂、抑菌剂、无热原水等。
[0303]
在本发明中,组合物的剂型包括但不限于口服制剂、注射制剂、外用制剂。代表性地,组合物的剂型包括但不限于片剂、注射剂、输液剂、膏剂、凝胶剂、溶液剂、微球、膜剂。
[0304]
优选地,所述的注射制剂为注射制剂。
[0305]
优选地,所述的注射剂为静脉注射制剂或动脉注射制剂。
[0306]
优选地,静脉注射剂为头静脉注射制剂、手背静脉注射制剂或足背静脉注射制剂。
[0307]
药物制剂应与给药方式相匹配,优选的给药方式为口服给药、注射给药(如瘤内注射),使用时,是将治疗有效量的药物施用于所需对象(如人或非人哺乳动物)。如本文所用,术语“治疗有效量”,是指对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。本领域的普通技术人员应该理解,所述的“治疗有效量”可随着药物组合物的形式、给药途径、所用药物的辅料、疾病的严重程度以及与其他药物联合用药等情况的不同而有所不同。
[0308]
活性成分的安全有效日使用剂量通常至少约0.1mg,而且在大多数情况下不超过约2500mg。较佳地,该剂量是1mg-500mg;当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是在熟练医师技能范围之内的。
[0309]
系统或装置及其用途
[0310]
本发明还提供一种用于治疗肿瘤的系统或装置,所述的系统包括如本发明所述的药物复合物、和/或如本发明所述的组合物;和超声装置。
[0311]
优选地,所述的系统或装置还包括或标签,所述的说明书或标签记载:
[0312]
在给所需的肿瘤对象施用如本发明所述的药物复合物、和/或如本发明所述的组合物预防和/或治疗肿瘤过程中,用超声装置对肿瘤部位进行超声刺激。
[0313]
优选地,在给所需的肿瘤对象施用如本发明所述的药物复合物、和/或如本发明所述的组合物前、后或同时,用超声装置对肿瘤部位进行超声刺激。
[0314]
优选地,所述的超声装置包括超声仪。
[0315]
优选地,所述的对象包括人或非人哺乳动物。
[0316]
优选地,所述的非人哺乳动物包括牛、马、羊、狗、猫或鼠。
[0317]
优选地,所述的施用为注射施用、口服施用或外用施用。
[0318]
优选地,所述注射施用为静脉施用或动脉施用。
[0319]
优选地,所述注射施用为头静脉注射施用、手背静脉注射施用或足背静脉注射施用。
[0320]
本发明还提供一种本发明所述的系统或装置的用途,用于制备治疗设备,所述的治疗设备用于治疗肿瘤。
[0321]
优选地,所述的治疗设备还包括或标签,所述的说明书或标签记载:
[0322]
在给所需的肿瘤对象施用如本发明所述的药物复合物、和/或如本发明所述的组合物预防和/或治疗肿瘤过程中,用超声装置对肿瘤部位进行超声刺激。
[0323]
本发明的主要优异技术效果包括:
[0324]
1.本发明开发了一种用于负载药物(如基因)的递送载体,所述的负载药物(如基因)的递送载体能够有效的在肿瘤部位的聚集且有效的被肿瘤细胞吸收和摄取,进入肿瘤细胞,从而增强负载的药物(如基因)递送到肿瘤内,发挥肿瘤靶向治疗效果。
[0325]
2.本发明所述的用于负载药物(如基因)的递送载体进入肿瘤细胞内能够有效地避免溶酶体的吞噬和避免溶酶体降解能力,从而增强药物(如基因)在肿瘤细胞内稳定性,进而增强抗肿瘤效果。
[0326]
3.在超声辐射刺激肿瘤细胞下,本发明负载药物(如基因)的递送载体在肿瘤细胞内能够有效地解离释放负载的药物(如抗肿瘤基因),从而增强负载的药物(如抗肿瘤基因)的抗肿瘤效果。超声辐射刺激由于其非侵入性和高组织穿透深度而广泛应用于医学治疗和诊断,超声介导的负载药物(如基因)的递送载体疗法能够克服肿瘤组织深度限制并有效增强对原位肿瘤的治疗效果。
[0327]
4.本发明所述的负载药物(如基因)的递送载体具有优异的长时间血液清除半衰期,有利于负载药物(如基因)的递送载体在肿瘤部位的聚集,且有利于超声刺激诱导的抗肿瘤效果。
[0328]
5.本发明所述的负载药物(如基因)的递送载体具有优异的生物安全性。
[0329]
下面结合具体实施例,进一步阐述本发明。应理解,以下具体实施例以本技术方案为前提,给出了详细的实施方式和具体操作过程,但本发明的保护范围并不限于本实施例。
[0330]
实施例1
[0331]
1.材料
[0332]
丙烯酸2-(n,n-二乙氨基)乙酯的英文2-(n,n-diethylamino)ethyl acrylate,简写deaea,购自sigma-aldrich,丙烯酸2-(n,n-二乙氨基)乙酯(deaea)的结构式如下:
[0333][0334]
丙烯酸2-(n,n-二乙氨基)乙酯(deaea)。
[0335]
支化聚乙烯亚胺(branched polyethylenimine,pei 25kda)购自sigma-aldrich,pei的结构式如下:
[0336][0337]
偶氮二异丁腈(azodiisobutyronitrile)简写aibn,购自aladdin。
[0338]
4-(溴甲基)苯基硼酸(4-(bromomethyl)phenylboronic acid)购自soochiral chemical science&technology co.,ltd。
[0339]
1,2-二油酰基-sn-甘油-3-磷酸乙醇胺(1,2-dioleoyl-sn-glycero-3-phosphoethanola mine)简写dope,cas号:4004-05-1,购自avanti polar lipids company(alabast er,al)。
[0340]
胆固醇琥珀酸单酯(cholesteryl hemisuccinate)简写chems,cas号:1510-21-0,购自东京化学工业有限公司。
[0341]
1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000](1,2-distearoyl-sn-glycero-3-phosphoethanolamine n-[methoxy(polyethylene glycol)-2000]简写dspe-mpeg2000购自laysan bio.inc。
[0342]
2',7'-二氯荧光素二乙酸酯(2
′
,7
′‑
dichlorofluorescin diacetateand)购自sigma-aldrich
[0343]
ir780碘化物(ir780iodide)购自sigma-aldrich,其结构式如下:
[0344][0345]
ir780碘化物(cas号:207399-07-3)
[0346]
trail为肿瘤坏死因子相关凋亡诱导配体基因,来源为人源,购买于invivo gen公司,具体信息为:human trail isoform 1(puno1-htraila);genbank:nm_003810.3with silent variation in codon phe275;orf size:846bp;subclone:ncoi-nhei。
[0347]
使用qiagen plasmid maxi kit提取trail的dna。
[0348]
bxpc-3细胞购自中国科学院上海细胞研究所。
[0349]
cy5的英文为cyanine 5。
[0350]
cy5.5的英文为cyanine 5.5。
[0351]
cy3的英文为cyanine 3。
[0352]
2.b-pdeaea的合成
[0353]
将deaea(5g,29mmol)和aibn(0.048g,0.029mmol)加入到25ml烧瓶中,在20℃室温下用氮气脱氧,然后在65℃聚合24小时,将反应液溶解在ch2cl2中并在冷的正己烷中沉淀和真空干燥得到pdeaea(4.2g,产率84%),分子量约为10000da(分散系数1.6),核磁图谱为:1h-nmr(bruker advance drx-400,cdcl
3,
δin ppm):3.9-4.1(2h,cooch2),2.6-2.8(2h,cooch2ch2n),δ=2.5-2.6(4h,n(ch2ch3)2),2.2-2.4(1h,ch2ch),1.7-2.1(2h,ch2ch),0.8-1.1(6h,n(ch2ch3)2)。
[0354]
然后取pdeaea(0.3g,1.8mmol叔胺)和4-(溴甲基)苯基硼酸(0.56g,2.6mmol)在20ml dmf中20℃室温下反应24h,使用透析袋(截留分子量:3500da)将所得反应液在去离子水中透析过夜除去杂质,并冷冻干燥获得b-pdeaea(0.5g,产率为92%),分子量约为18000da(分散系数1.7),核磁图谱为:1h-nmr(400mhz,d2o,δ):7.2-8.0(4h,arh),4.0-4.6(4h,arch2n,cooch2),3.0-3.6(6h,n(ch2ch3)2ch2ch2ooc),2.3-2.6(1h,ch2ch),0.8-1.6(8h,
n(ch2ch3)2,ch2ch)。
[0355]
b-pdeaea的结构如下:
[0356][0357]
3.b-pdeaea/trail(btl)的制备
[0358]
trail基因用hepes缓冲液(10mm,ph=7.4)稀释至2.5ml,得到trail基因浓度为40μg/ml的溶液,然后溶液与2.5ml b-pdeaea的hepes缓冲液(10mm,ph=7.4)(b-pdeaea的浓度为552.7μg/ml,即n/p=20)混合,将混合液加入到15ml离心管中并涡旋5min,得到b-pdeaea/trail(btl)溶液,冷冻干燥备用。
[0359]
在b-pdeaea/trail中,trail基因结合在b-pdeaea上
[0360]
4.b-pdeaea/trail@ir780脂质体(btil)的制备
[0361]
4.1 b-pdeaea/trail(btl)的制备
[0362]
trail基因用hepes缓冲液(10mm,ph=7.4)稀释至2.5ml,得到trail基因浓度为40μg/ml的溶液,然后溶液与2.5ml b-pdeaea的hepes缓冲液(10mm,ph=7.4)(b-pdeaea的浓度为552.7μg/ml,即n/p=20)混合,将混合液加入到15ml离心管中并涡旋5min,得到b-pdeaea/trail(btl)溶液。
[0363]
在b-pdeaea/trail中,trail基因结合在b-pdeaea上。
[0364]
4.2负载ir780脂质薄膜的制备
[0365]
将3.16mg dope、2.1mg dspe-mpeg2000、0.54mg胆固醇和0.5mg ir780碘化物混合并溶解在1ml chcl3中,将溶液倒入50ml圆底烧瓶中旋转蒸发形成脂质膜,得到负载ir780的脂质薄膜。
[0366]
4.3 b-pdeaea/trail@ir780脂质体(btil)的制备
[0367]
将5ml步骤“4.1”制备的b-pdeaea/trail溶液加入到步骤“4.2”制备的负载ir780脂质薄膜的圆底烧瓶中,在20℃室温下磁力搅拌12h,得到b-pdeaea/trail@ir780脂质体(btil)溶液,冷冻干燥备用。
[0368]
5、cy5.5标记的b-pdeaea/trail@ir780脂质体的制备
[0369]
cy5.5标记的btil的制备方法同“4.3b-pdeaea/trail@ir780脂质体(btil)的制备”,不同点在于:用cy5.5标记的dspe-mpeg2000替换dspe-mpeg2000。
[0370]
6、cy5标记的b-pdeaea/trail@ir780脂质体的制备
[0371]
cy5标记的btil的制备方法同“4.3b-pdeaea/trail@ir780脂质体(btil)的制备”,不同点在于:用cy5标记的trail基因替换trail。
[0372]
7、cy3标记的b-pdeaea/trail@ir780脂质体的制备
[0373]
cy3标记的btil的制备方法同“4.3b-pdeaea/trail@ir780脂质体(btil)的制备”,不同点在于:用cy3标记的trail基因替换trail。
[0374]
8.负载ir780脂质体(il)的制备
[0375]
将3.16mg dope、2.1mg dspe-mpeg2000、0.54mg胆固醇和0.5mg ir780碘化物混合并溶解在1ml chcl3中,将溶液倒入50ml圆底烧瓶中旋转蒸发形成脂质膜,得到负载ir780脂质薄膜。
[0376]
将5ml hepes缓冲液(10mm,ph=7.4)加入到负载ir780脂质薄膜的圆底烧瓶中,在20℃室温下磁力搅拌12h,得到负载ir780脂质体(il)溶液,备用。
[0377]
9.脂质体(lip)的制备
[0378]
将3.16mg dope、2.1mg dspe-mpeg2000和0.54mg胆固醇混合并溶解在1ml chcl3中,将溶液倒入50ml圆底烧瓶中旋转蒸发形成脂质膜,得到脂质薄膜;
[0379]
将5ml hepes缓冲液(10mm,ph=7.4)加入到脂质薄膜的圆底烧瓶中,在20℃室温下磁力搅拌12h,得到脂质体(lip)溶液,备用。
[0380]
10.颗粒的表征
[0381]
b-pdeaea/trail@ir780脂质体(btil)、b-pdeaea/trail(btl)、脂质体(lip)、和负载ir780脂质体(il)溶解在hepes缓冲溶液(10mm,ph=7.4)中。使用zetasizer nano-zs纳米粒度电位仪(malvern instruments,uk)在25℃下测量纳米颗粒的大小和zeta电位。数据表示为平均值
±
sd(n=3)。使用透射电子显微镜(tem)(jem-1200ex)测定醋酸双氧铀染色的纳米颗粒的形态。紫外可见分光光度计(spectramaxm5,美国)用于测定btil、btl、lip、和il的吸收光谱。
[0382]
不同颗粒的表征分析如图1所示。zetasizer nano-zs纳米粒度电位仪和透射电镜测定观察的不同颗粒的粒径如图1a所示,lip(liposome)、il、btl、btil的纳米颗粒的粒径分布都较为均一(pdi分散系数均小于0.15),粒径分别为50.6
±
17.7nm、50.8
±
17.1nm、73.7
±
23.5nm、75.2
±
20.6nm。由图1b所示,纳米颗粒荷载ir780后,溶液的外观形态由无色逐渐变为淡绿色。从图1a、图1b和图1c的粒径变化和tem测定的形态可以看出,负载ir780脂质膜壳将b-pdeaea/trail核包裹。btil、btl、liposomelip)、il和ir780的紫外-可见(uv-vis)吸收光谱如图1d所示。从图1d中可以看出,ir780负载在脂质体上。
[0383]
11.基因转染
[0384]
bxpc-3细胞均培养在rpmi 1640中,并添加10%热灭活胎牛血清、青霉素(100u/ml)和链霉素(100μg/ml),在37℃和5%co2下培养。
[0385]
荷载荧光素酶基因的btl和不同n/p的btl:
[0386]
按照“3.b-pdeaea/trail(btl)的制备”,将btl中的trail基因替换成荧光素酶(luciferase)的dna(luci),b-pdeaea的浓度为248.7μg/ml、359.2μg/ml、552.7μg/ml、829.0μg/ml或1381.7μg/ml(n/p=9、13、20、30、或50),用于转染bxpc-3细胞。
[0387]
对于荧光素酶基因转染,bxpc-3细胞在48孔板(5x104个细胞/孔)中培养并孵育过夜。细胞在新鲜培养基(0%或10%fbs)中以相当于每孔1μg luci的剂量加入荷载荧光素酶
基因的pei-dna和不同n/p的btl处理4小时。然后将培养基替换为10%fbs培养基。随后在孵育48小时后根据操作手册(promega)中描述的标准方案确定荧光素酶基因表达,从而测定基因的转染情况。
[0388]
基因转染结果如图2所示,从图2中可以看出,在10%血清和无血清条件下,与pei/dna复合物和其他n/p的btl相比,btl在n/p比为20时具有最高的转染效率。
[0389]
12.细胞吸收和摄取
[0390]
bxpc-3细胞(3x105个/孔)接种在96孔板中并培养24小时。然后,将1ml含有btil(trail的含量为20μg/ml)的培养基添加到96孔板中,将细胞分别孵育0h、2h、4h、6h、12h、24h。然后,通过流式细胞术分析1x104细胞的ir780荧光强度,以检测不同时间点btil的细胞摄取。
[0391]
流式细胞术测定不同孵育时间点bxpc-3细胞对btil的摄取结果如图3所示。从图3中可以看出,随着孵育时间延长,bxpc-3细胞对btil的摄取量不断增加,表明bxpc-3细胞对btil具有优异的吸收和摄取能力。
[0392]
13.细胞内递送研究
[0393]
如“12.细胞吸收和摄取”步骤,将bxpc-3细胞与cy5.5标记的btil孵育12h后,细胞用lysotracker green(invitrogen,thermo fisher scientific)以200nm的浓度培养20min以标记溶酶体,用5μg/ml dapi染色细胞核5min,细胞用4%pfa固定溶液固定,用pbs洗涤三次,然后通过激光扫描共聚焦显微镜(clsm)成像。
[0394]
clsm测定bxpc-3细胞对btil的可视化吸收如图4所示,从图4中可以看出,btil能够有效递送到bxpc-3细胞内,且btil和溶酶体之间为低荧光信号重叠,表明btil具有避免溶酶体的吞噬和避免溶酶体降解能力,从而避免溶酶体对btil和trail基因的降解,从而提高trail的治疗效果。
[0395]
14.细胞内btil的解离研究
[0396]
bxpc-3细胞置于玻璃底培养皿上,密度为在1ml培养基含5x104个细胞中,孵育24h。培养基更换为1ml新鲜无血清培养基,该新鲜培养基含有cy5标记的btil和cy3标记的btil。孵育4h后,将培养基更换为含10%fbs的细胞培养基,细胞再孵育24h。然后,在用4%pfa固定溶液固定之前,用或不用超声(1mhz,0.2w/cm2,1min)进一步刺激细胞。细胞核用dapi染色5min,并通过激光扫描共聚焦显微镜(clsm)获取图像,dapi的激发波长为405nm。
[0397]
clsm测定有或没有超声刺激下btil在bxpc-3细胞内解离如图5所示,从图5中可以看出,在没有超声刺激的情况下,由于红色和绿色荧光重叠,观察到黄点,表明在没有超声刺激作用下,btil没有解聚释放trail基因。然而,在超声刺激的情况下,在bxpc-3细胞核内外都观察到了大量的红色和绿色荧光,表明在有超声刺激作用下,btil解聚释放trail,即超声刺激诱导btil的trail的有效解离和释放,进入细胞核,发挥治疗作用。
[0398]
15.体外抗肿瘤效应试验
[0399]
使用cck-8方法测定体外抗肿瘤作用:
[0400]
将bxpc-3细胞(5x103个)接种到96孔板中并培养过夜。然后,将btil或btl加入到培养基(其中trail给药剂量均为20μg/ml)中,且选用不加药物作为对照组(control)。孵育4h后,将培养基更换为100μl含有10%fbs的新鲜培养基。孵育24h后,用或不用超声刺激(1mhz,0.2w/cm2,1min)处理细胞,孵育24h后,将培养基更换为100μl含有10μl cck-8溶液
的新鲜培养基,孵育2h后,使用紫外-可见分光光度计在450nm处检测吸光度。
[0401]
cck-8测定bxpc-3细胞经不同处理后的存活率如表1所示:
[0402]
表1 cck-8测定bxpc-3细胞经不同处理后的存活率(数据为m
±
sd)
[0403]
不同处理组细胞存活率(%)control(无药物+无超声刺激处理)100
±
4.48control+us(无药物+超声刺激处理)100
±
16.29btl(btl+无超声刺激处理)52.93
±
11.0
***
btl+us(btl+超声刺激处理)51.30
±
4.37
****
btil(btil+无超声刺激处理)47.71
±
2.72
****
btil+us(btil+超声刺激处理)20.01
±
0.98
****
[0404]
备注:***p《0.001和****p《0.0001
[0405]
从表1可以看出,btil+us组对bxpc-3细胞的细胞存活率最低,且超声刺激(us)能够显著增强btil对肿瘤的杀伤效果。
[0406]
16.btil的体内荧光(fl)成像和生物分布。
[0407]
使用caliper ivis lumina ii(caliper life sciences)进行体内荧光(fl)成像。荷bxpc-3瘤裸鼠通过尾静脉静脉注射btil(含有20μg trail基因)。分别在注射后不同时间获取ir780荧光图像,根据ir780荧光强度测定btil的药代动力学,肿瘤部位的荧光强度由ivis spectrum软件计算。在给药后12h,收集肿瘤和主要器官(心、肝、脾、肺、肾脏)用于离体荧光成像,测定平均荧光强度。
[0408]
根据ir780荧光强度测定btil的血液循环半衰期约为4.1h(图6所示),表明btil具有优异的血液长循环,较长的血液循环半衰期能够显著延长btil在血液中的循环时间,增强btil渗透进行肿瘤部位,发挥抗肿瘤作用。
[0409]
btil的体内生物分布如图7所示,从图7a和图7c的体内实时成像和肿瘤部位荧光强度可以看出,btil在注射后1、2、4、6、8和12h内,肿瘤部位的荧光强度不断增强,表明btil能够长时间的在肿瘤部位聚集,发挥抗肿瘤效果,从图7b和图7d可以看出,与其他主要器官(心、肝、脾、肺和肾)相比,btil在肿瘤部位的荧光强度最强,表现出增强的肿瘤富集效应,从而发挥有效的肿瘤靶向治疗效果。
[0410]
因此,btil具有良好的药代动力学特征和有效的肿瘤积累,从而具有优异的肿瘤靶向治疗效果。
[0411]
17.原位胰腺癌荷瘤小鼠的抗肿瘤治疗
[0412]
通过将2x106个bxpc-3-luci细胞注射到小鼠的胰腺中,在小鼠中构建原位胰腺癌模型。使用caliper ivis lumina ii通过生物发光成像监测肿瘤生长。接种10天后,将小鼠随机分为control组、us组、btl组、btil组和btil+us组,每组6只,分组后,control组和us组小鼠尾静脉注射100μl pbs溶液,btl组小鼠尾静脉注射100μl btl溶液(trail基因给药剂量为3mg/kg),btil组和btil+us组小鼠尾静脉注射100μl btil溶液(trail基因给药剂量为3mg/kg),各组小鼠给药12小时后,us组和btil+us组小鼠的肿瘤应用超声刺激(3mhz,1.5w/cm2,10min),每3天给药一次,共计给药五次,并在给药12h后进行超声辐射一次。在注射给药后的第3、6、9、12和15天,注射200μl d-荧光素(150μg/ml)pbs溶液后,通过生物发光测定体内荧光素酶表达,观察治疗小鼠的肿瘤进展。在治疗期间记录小鼠体重。在治疗的第15天
处死小鼠,解剖小鼠主要器官和肿瘤组织并进行h&e、ki-67和tunel染色。
[0413]
超声刺激由于其非侵入性和高组织穿透深度而广泛应用于医学治疗和诊断。
[0414]
不同处理组的荷瘤小鼠在不同时间点的原位胰腺癌的荧光成像如图8所示,不同处理组的荷瘤小鼠在不同时间点的的原位胰腺癌荧光相对强度比如图9所示。
[0415]
从图8和图9中可以看出,与control(对照)和us相比,btl和btil组表现出较佳的抑制肿瘤生长效果,且与其它治疗相比,btil+us组在整个治疗期间表现出最强的抗肿瘤效果,且超声刺激(us)能够显著增强btil对肿瘤的杀伤效果。超声介导的trail递送疗法能够克服肿瘤组织深度限制并有效增强对原位胰腺癌的治疗效果。
[0416]
不同处理组的bxpc3-luci荷瘤小鼠在不同时间点的体重变化如图10所示,从图从图10中可以看出,对照组和其他治疗组之间的体重没有观察到明显差异,表明btl和btil具有优异的生物安全性。
[0417]
不同处理组bxpc3-luci荷瘤小鼠在治疗的第15天后处死,解剖的肿瘤的h&e、ki-67和tunel染色如图11所示,从图11中可以看出,tunel免疫荧光肿瘤切片显示control和us组均未见明显肿瘤凋亡,与btl和btil治疗组相比,btil+us组中大多数肿瘤细胞凋亡,且肿瘤凋亡细胞量最多,从而表明超声刺激(us)能够显著增强btil在肿瘤部位的聚集并增强对肿瘤的杀伤效果。
[0418]
不同处理组的bxpc3-luci荷瘤小鼠在治疗的第15天后处死,解剖的心、肝、脾、肺和肾的h&e图12所示,从图12中可以看出,解剖的心、肝、脾、肺和肾基本没有损伤,表明btl、il+us和btil具有优异的生物安全性。
[0419]
18.btil的溶血测定
[0420]
进行红细胞溶血分析以确认血液相容性。具体地,将0.4ml稀释的血细胞悬液与0.5ml含有不同浓度btil(15.625、31.25、62.5、125、250和500μg/ml,以trail基因量计)的pbs溶液孵育1h。pbs(ph7.4)和去离子水分别作为阴性(-)和阳性(+)对照。收集上清液以研究溶血情况。
[0421]
btil的溶血测定结果如图13所示,从图13可以看出,红细胞在500μg/ml的btil仍未发生溶血,因此,btil表现出良好的生物相容性
[0422]
19.体内毒性试验
[0423]
荷bxpc-3瘤小鼠分为两组(n=3)。小鼠静脉注射100μl btil(6mg/kg)溶液,以pbs注射组为对照。治疗14天后,取各组小鼠血样进行血液生化指标分析。
[0424]
血细胞检测和血液生化分析结果如图14所示,从图14中够可以看出,与pbs相比,注射btil后小鼠的血细胞检测和血液生化分析结果未显示血液指标有任何明显变化,表明btil的没有毒副作用。
[0425]
统计分析
[0426]
所有实验至少重复3次。数据表示为平均值
±
标准偏差,并通过使用学生t检验和单向方差分析进行分析。在所有测试中,graphpad prism 8(graphpad software inc.,)用于统计分析,统计显着性设为p《0.05。
[0427]
以上所述是本发明针对一种案例设计的实施方案,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下还可以作出若干改进,这些改进也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1