苦参酮在制备防治帕金森病药物中的应用
1.本发明涉及医药领域,具体涉及苦参酮在制备防治帕金森病药物中的应用。
背景技术:
2.帕金森病(parkinson’s disease,pd)是一种的神经变性疾病,常见于60岁以上的中老年人群。临床上以行动迟缓、静止性震颤等运动症状为特征;伴随嗅觉减退、睡眠障碍、认知损害等非运动症状。相关研究表明,黑质多巴胺(dopamine,da)能神经元的变性死亡和纹状体da含量显著减少是帕金森病较为突出的病理改变。除此以外,遗传因素、环境因素、炎症、氧化应激等均会导致帕金森病的发生。pd患病率在60岁以上的人群中高达1%,pd患者逐渐丧失工作和生活能力,给家庭和社会带来沉重的负担。
3.因此,寻找pd新的致病机制和治疗靶点,对pd防治药物的开发具有重要意义。苦参酮(kurarinone)是一种具有薰衣草烯基的二氢黄酮类化合物,是中药苦参的特征性成分,具有抗菌、抗肿瘤等作用。目前,关于苦参酮在治疗pd方面的用途尚未见报道。
技术实现要素:
4.本发明的目的是克服现有技术的不足,提供苦参酮在制备防治帕金森病药物中的应用。
5.本发明的第二个目的是提供包含苦参酮的药物制剂在制备防治帕金森病药物中的应用。
6.本发明的技术方案概述如下:
7.苦参酮在制备防治帕金森病药物中的应用。
8.包含苦参酮的药物制剂在制备防治帕金森病药物中的应用。
9.本发明的优点:
10.本发明研究发现苦参酮(kurarinone)可以抑制可溶性环氧化物水解酶(seh)活性,增加脑内多巴胺(da)及其代谢物3,4-二羟基苯乙酸(dopac)和高香草酸(hva)含量,减轻运动障碍,在治疗帕金森病中具有重要应用价值,可以用于开发治疗pd药物。本发明通过研究苦参酮(kurarinone)是否在帕金森病理进程中保护黑质和纹状体酪氨酸羟化酶(th)神经细胞的减少,发现了抑制可溶性环氧化物水解酶(seh)在苦参酮(kurarinone)治疗帕金森病中发挥重要作用,从而可以作为治疗帕金森病的治疗药物和靶点。
11.实验证明:采用1-甲基-4-苯基-1,2,3,6-四氢吡啶盐酸盐(mptp)造模后,pd小鼠的运动能力降低,脑内多巴胺(da)及其代谢物3,4-二羟基苯乙酸(dopac)和高香草酸(hva)水平降低,酪氨酸羟化酶(th)水平降低。给予苦参酮(kurarinone)抑制可溶性环氧化物水解酶(seh)活性,提高脑内多巴胺(da)及其代谢物3,4-二羟基苯乙酸(dopac)和高香草酸(hva)含量,进而改善mptp诱导的pd。
附图说明
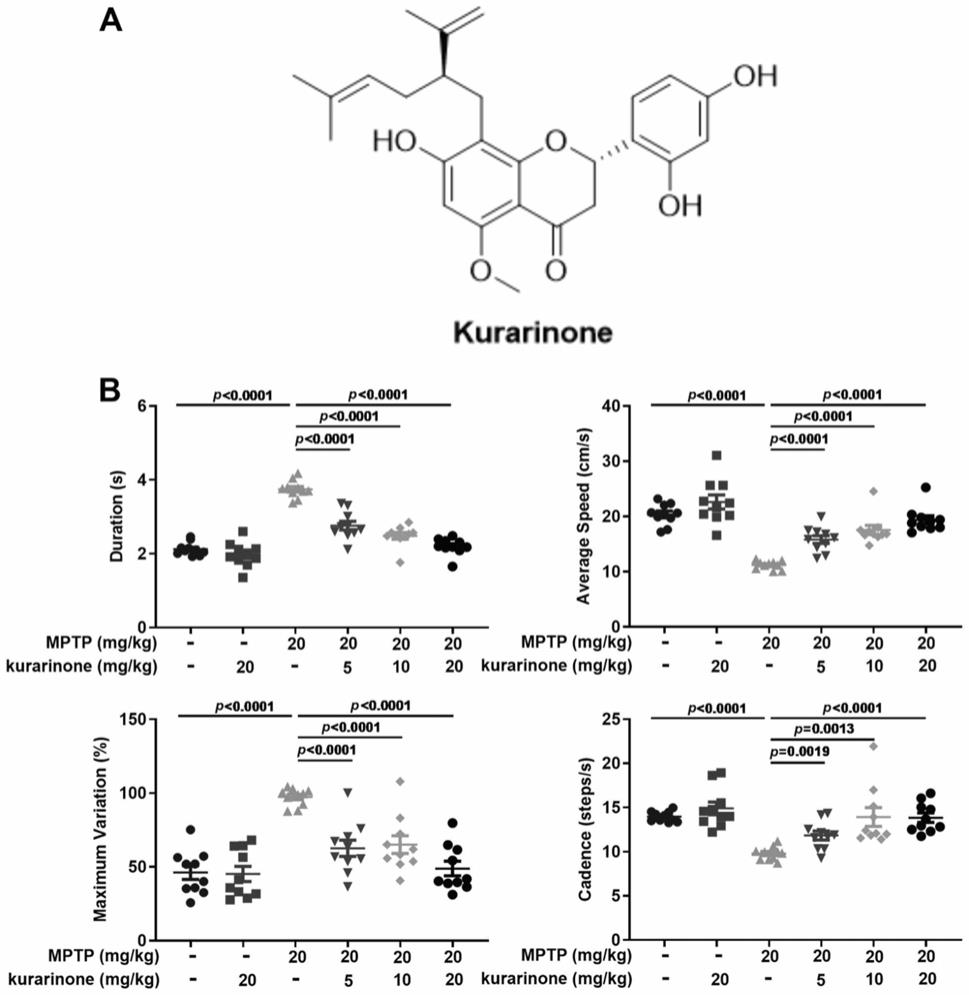
12.图1苦参酮(kurarinone)改善mptp诱导pd小鼠的行为,其中:
13.(a)苦参酮(kurarinone)的结构。
14.(b)苦参酮(kurarinone)对mptp诱导pd小鼠的行为学的影响(通过时间,duration;最大变异量,maximum variation;平均速度,average speed;每秒行走的步数,cadence),n=10。
15.图2苦参酮(kurarinone)对mptp诱导pd小鼠的th表达水平和神经递质水平的影响,其中:
16.(a)苦参酮(kurarinone)对黑质区(sn)和纹状体(str)中酪氨酸羟化酶(th)神经元的影响。
17.(b)苦参酮(kurarinone)对黑质区(sn)酪氨酸羟化酶(th)蛋白表达水平的影响。
18.(c)酪氨酸羟化酶(th)蛋白量化结果,n=6。
19.(d)苦参酮(kurarinone)对神经递质多巴胺(da)及其代谢物3,4-二羟基苯乙酸(dopac)和高香草酸(hva)的影响,n=6。
20.正常对照组,control;空白给药组,kurarinone(20mg/kg);模型组,mptp;低剂量组,mptp+kurarinone(5mg/kg);中剂量组,mptp+kurarinone(10mg/kg);高剂量组,mptp+kurarinone(20mg/kg)。
21.图3苦参酮(kurarinone)对mptp诱导pd小鼠的小胶质细胞激活和神经炎症的影响,其中:
22.(a)苦参酮(kurarinone)对小胶质细胞激活的影响。
23.(b)苦参酮(kurarinone)对神经炎症相关蛋白cox-2、tnf-a、il-6、p-p65和p65的影响。
24.(c)cox-2、tnf-α、il-6和p-p65/p65蛋白量化结果,n=6。
25.正常对照组,control;空白给药组,kurarinone(20mg/kg);模型组,mptp;低剂量组,mptp+kurarinone(5mg/kg);中剂量组,mptp+kurarinone(10mg/kg);高剂量组,mptp+kurarinone(20mg/kg)。
26.图4苦参酮(kurarinone)对pd小鼠脑内eets及其代谢物dhets和gsk3β信号通路的影响,其中:
27.(a)苦参酮(kurarinone)对eets(8,9-环氧二十碳三烯酸,8,9-eet;11,12-环氧二十碳三烯酸,11,12-eet;14,15-环氧二十碳三烯酸,14,15-eet)及其代谢物dhets(8,9-二羟基二十碳三烯酸,8,9-dhet;11,12-二羟基二十碳三烯酸,11,12-dhet;14,15-二羟基二十碳三烯酸,14,15-dhet)的影响,n=6。
28.(b)苦参酮(kurarinone)对gsk3β信号通路的影响。
29.(c)p-gsk3β/gsk3β的蛋白量化结果,n=6。
30.图5苦参酮(kurarinone)对seh活力的影响及其两者亲和力测试结果,其中:
31.(a)苦参酮(kurarinone)对seh的抑制作用(残余率,ctrl%);
32.(b)苦参酮(kurarinone)与seh的亲和力测试结果(图中所用浓度,从上到下依次降低;时间,time;响应值,response)。
具体实施方式
33.下面将结合具体实施例对本发明的技术方案进行描述,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
34.实施例中未注明具体实验步骤或条件者,按照本领域内的文章所描述的常规实验的操作或条件进行即可。所用试剂或仪器未注明生产厂商者,均为市售可获得的常规试剂产品。
35.实施例1
36.苦参酮(kurarinone)通过抑制可溶性环氧化物水解酶(seh)阻断mptp导致的帕金森病理进程的实验
37.(1)实验材料
38.清洁级雄性c57bl/6小鼠(23-25g,8周龄),市售。室温22-24℃,相对湿度50%-60%,通风良好,人工昼夜(12h/12h),自由摄食摄水。
39.本实验中使用的苦参酮(kurarinone)由发明人从中药苦参中分离得到,经nmr技术鉴定为苦参酮(kurarinone)。1-甲基-4-苯基-1,2,3,6-四氢吡啶盐酸盐(简称:mptp)也可以采用市售的苦参酮。
40.(2)实验方法
41.1)mptp帕金森病小鼠模型的制备
42.将雄性c57bl/6小鼠随机分为:正常对照组、空白给药组(苦参酮,20mg/kg/天,溶于10%羟丙基-β-环糊精水溶液)、mptp模型组(20mg/kg/天,溶于生理盐水),低剂量治疗组(苦参酮,5mg/kg/天,溶于10%羟丙基-β-环糊精水溶液;mptp,20mg/kg/天,溶于生理盐水),中剂量治疗组(苦参酮,10mg/kg/天,溶于10%羟丙基-β-环糊精水溶液;mptp,20mg/kg/天,溶于生理盐水),高剂量治疗组(苦参酮,20mg/kg/天,溶于10%羟丙基-β-环糊精水溶液;mptp,20mg/kg/天,溶于生理盐水),每组10只。
43.正常对照组连续19天灌胃给予相应体积的10%羟丙基-β-环糊精水溶液,于第8天开始连续5天腹腔注射给予相应体积的生理盐水。
44.空白给药组连续19天灌胃给予苦参酮(20mg/kg/天,溶于10%羟丙基-β-环糊精水溶液),于第8天开始连续5天腹腔注射给予相应体积的生理盐水。
45.mptp模型组连续19天灌胃给予相应体积的10%羟丙基-β-环糊精水溶液,于第8天开始连续5天腹腔注射给予mptp(20mg/kg/天,溶于生理盐水)。
46.低剂量治疗组连续19天灌胃给予苦参酮(5mg/kg/天,溶于10%羟丙基-β-环糊精水溶液),于第8天开始连续5天腹腔注射给予mptp(20mg/kg/天,溶于生理盐水)。
47.中剂量治疗组连续19天灌胃给予苦参酮(10mg/kg/天,溶于10%羟丙基-β-环糊精水溶液),于第8天开始连续5天腹腔注射给予mptp(20mg/kg/天,溶于生理盐水)。
48.高剂量治疗组连续19天灌胃给予苦参酮(20mg/kg/天,溶于10%羟丙基-β-环糊精水溶液),于第8天开始连续5天腹腔注射给予mptp(20mg/kg/天,溶于生理盐水)。
49.实验结束后处死小鼠,取血清及脑组织待测。
50.3)行为学监测
51.catwalk步态分析实验:本实验用来评价小鼠的自然运动行为及运动协调性。采用
小动物步态分析仪(catwalk xt,noldus,荷兰)检测,实验前训练三天。检测时使小鼠自由穿过检测通道,利用内光源脚印折射技术对摄像头拍摄视频中的足印进行高效的计算机处理,在自然行走情况下评估小鼠运动情况。
52.4)脑组织酪氨酸羟化酶(th)和小胶质细胞激活检测
53.动物灌注固定取材:行为学测定后将动物麻醉固定,迅速开胸暴露心脏,将连有37℃生理盐水的输液器针头插入左心室,剪开右心耳,快速灌注生理盐水,至小鼠肝脏发白流出液基本为无色为止。将生理盐水更换为4℃的4%多聚甲醛慢速灌流。灌流完毕后,取脑,置于4%多聚甲醛中固定,过夜。然后将脑转至30%蔗糖溶液中脱水,至脑块沉入瓶底后进行冰冻切片。
54.冰冻切片:修整中脑组织块,进行冠状连续冰冻切片,片厚20μm。
55.免疫组织化学染色:选取结构完整的切片,37℃烘箱内放置过夜烘干,pbs洗涤3次,0.3%triton x-100孵育90min以充分暴露抗原,室温30min,37℃30min,再室温30min;3%h2o2避光作用10min以阻断内源性过氧化物酶;室温羊血清封闭1.5h;弃去羊血清后,加入th抗体(1:200),4℃过夜;将切片从冰箱内取出后室温放置30min;pbs洗涤3次,加入二抗(羊抗兔),室温40min;pbs洗涤3次,dab染色;蒸馏水冲洗dab染色液终止反应;梯度酒精脱水;中性树胶封片,显微镜下观察拍照。
56.免疫荧光染色:选取结构完整的切片,用10%羊血清溶液(0.3%triton-100/pbs)于37℃封闭1.5h;弃去羊血清后,iba-1(1:100)或th(1:200)4℃孵育过夜。将切片从冰箱内取出后室温放置30min;pbs洗涤3次,荧光二抗37℃避光孵育1.5h。pbs洗涤3次后,中性树胶封片,显微镜下观察拍照
57.5)免疫印迹
58.每组各称取20mg脑组织样本,用添加蛋白酶抑制剂的全细胞裂解液4℃裂解30min。离心后(12000g,4
°
,10min),采用bca试剂盒测定上清的蛋白浓度。等量的蛋白采用10%的sds-page胶电泳分离,并转移到pvdf膜上,用0.5%bsa室温封闭2h,cox-2(1:1000)、p65(1:1000)、p-p65(1:1000)、p-gsk3β(1:1000)、th(1:1000)、gsk3β(1:1000)、il-6(1:1000)或tnf-α(1:1000)抗体于4℃,孵育过夜。经pbs洗涤3次后,室温孵育二抗孵育2h,用ecl发光液显影。
59.5)lc-ms/ms分析
60.纹状体称重后,冰水浴匀浆,于4℃ 20000g离心20min。收集上清,采用ab sciex 5500 lc-ms/ms系统,进行da、dopac、hva、8,9-eet、11,12-eet、14,15-eet、8,9-dhet、11,12-dhet和14,15-dhet含量检测。
61.6)体外苦参酮对seh的抑制作用
62.称取适量苦参酮,溶解在dsmo中配制成20mm溶液。不同浓度的苦参酮与seh蛋白(溶于bistris-hcl缓冲液,25mm,ph=7.4)预孵育3min,加入探针底物(10μm),于37℃恒温孵育20min。反应终止后,于465nm检测荧光信号。
63.7)统计学分析
64.利用graphpad prism 8(graphpad software inc.,san diego,ca,usa)对数据进行分析。数据显示为均值
±
平均值标准误差,统计分析采用单因素方差分析,p《0.05为统计学差异有显著性
65.(3)实验结果
66.图1为苦参酮(kurarinone)对mptp诱导pd小鼠的行为的影响。从行为学测试结果可以看出,与mptp组小鼠相比,苦参酮(kurarinone,5,10,20mg/kg)剂量依赖性降低了小鼠通过检测通道的时间和最大变异量,同时提高了小鼠的平均速度和每秒行走的步数。提示苦参酮(kurarinone)可以改善小鼠的pd样行为。
67.图2为苦参酮(kurarinone)对mptp诱导pd小鼠的th表达水平和神经递质水平的影响。免疫荧光和免疫组化实验结果表明,苦参酮(kurarinone,5,10,20mg/kg)能够剂量依赖性改善mptp诱导的黑质和纹状体th阳性神经元的缺失,同时可以提高mptp诱导的pd小鼠黑质区th的表达水平。进一步实验结果表明,与mptp组小鼠相比,苦参酮(kurarinone,5,10,20mg/kg)能够剂量依赖性提高da的代谢物dopac和hva的含量。对于da而言,苦参酮(kurarinone,10和20mg/kg)才能有效提高da的含量。上述结果说明苦参酮(kurarinone)能够改善mptp导致的神经毒性。
68.图3为苦参酮(kurarinone)对mptp诱导pd小鼠的小胶质细胞激活和神经炎症的影响。免疫荧光实验结果表明,与mptp组小鼠相比,苦参酮(kurarinone,5,10,20mg/kg)能够剂量依赖性抑制小胶质细胞的激活。western blot实验结果表明,苦参酮(kurarinone,5,10,20mg/kg)能够剂量依赖性降低mptp诱导的cox-2、tnf-α和il-6表达水平的升高,同时可以降低mptp诱导的p65磷酸化水平的升高。上述结果表明,苦参酮(kurarinone)可以缓解mptp诱导的神经炎症。
69.图4为苦参酮(kurarinone)对pd小鼠脑内eets及其代谢物dhets和gsk3β信号通路的影响。lc-ms/ms实验结果表明,mptp会导致小鼠脑内8,9-eet、11,12-eet和14,15-eet含量的降低和8,9-dhet、11,12-dhet和14,15-dhet含量的升高。与mptp组小鼠相比,除8,9-eet外,苦参酮低剂量组(kurarinone,5mg/kg)对11,12-eet、14,15-eet、8,9-dhet、11,12-dhet和14,15-dhet没有显著影响,而苦参酮中和高剂量组(kurarinone,10和20mg/kg)能够显著提高mptp小鼠脑内8,9-eet、11,12-eet和14,15-eet含量,同时有效降低mptp小鼠脑内8,9-dhet、11,12-dhet和14,15-dhet的含量。可溶性环氧化物水解酶(seh)作为一种α/β水解酶,可以水解有重要生物学活性的环氧二十碳三烯酸(epoxyeicosatrienoic acid,eets),生成具有较弱活性的二羟基-二十碳三烯酸(dhets),eets和dhets的比值能够体现seh的活性水平。通过分析eets和dhets比例,发现苦参酮(kurarinone,5,10,20mg/kg)能够剂量依赖性降低mptp诱导的seh活性的升高。
70.seh的抑制会导致活性代谢eets的水平升高,进而抑制gsk3β信号通路。为此,进一步考察苦参酮(kurarinone)对gsk3β信号通路的影响。实验结果表明,与mptp组小鼠相比,苦参酮(kurarinone,5,10,20mg/kg)能够剂量依赖性下调gsk3β的磷酸化水平。上述结果表明,苦参酮(kurarinone)能够抑制seh缓解mptp诱导的帕金森病。
71.图5为苦参酮(kurarinone)对seh活力的影响及其两者亲和力测试结果。体外实验结果表明,苦参酮(kurarinone)能够剂量依赖性抑制seh活力,其ic
50
为1.44μm,其亲和力kd为1.45μm。上述结果说明苦参酮(kurarinone)能够抑制seh活力,进而改善mptp所致的帕金森症。
72.显然,上述实施例仅仅是为了清楚的说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化
或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
73.将苦参酮与药学上可接受的载体按常规技术手段制成常用的制剂,如片剂、胶囊剂、颗粒剂等,制成包含苦参酮的药物制剂在制备防治帕金森病药物中的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1