一种药物组合物的制作方法
1.本公开属于医药领域,具体涉及一种包含阿托品或其药学上可接受的盐的药物组合物。
背景技术:
2.阿托品是非选择性毒蕈碱受体拮抗剂,作为一种强长效的散瞳剂和睫状肌麻痹剂,在近视进展控制方面的临床试验已被广泛开展。此外,阿托品作为目前唯一经循证医学证实的有效减缓近视进展的药物,其用于控制近视的进展也有很多年的历史。
3.目前国内外用于控制青少年近视进展的药物不多,且副作用大。国内上市销售的阿托品眼用制剂的规格为1%,由于阿托品的浓度较大,存在瞳孔散大、视物模糊和停药反弹等不良反应,会对患者的生活学习造成一定程度的影响,限制了其临床应用。而低浓度阿托品眼用制剂预防和治疗青少年近视已取得阶段性进展且使瞳孔扩张效应减少了很多,从而大大降低了高浓度阿托品造成的瞳孔扩大,近物视物不清、畏光、结膜炎和皮炎等副作用。然而,低浓度阿托品眼用制剂更适宜青少年长期滴眼以控制近视进展,且停药后反弹效应明显降低。已经有发明人就相关技术申请了专利保护,例如cn109675038a公开了一种包含低浓度硫酸阿托品、柠檬酸盐缓冲盐、氯化钠和羧甲基纤维素的滴眼液。cn110934816a公开了一种含有低浓度硫酸阿托品、羟丙基甲基纤维素、依地酸二钠、硼酸的滴眼液。cn110621298a公开了一种包含低浓度硫酸阿托品、无水磷酸二氢钠、无水磷酸氢二钠、乙二胺四乙酸二钠二水合物、氯化钠、羟丙基甲基纤维素的滴眼液。cn109310687a公开了一种包含硫酸阿托品、羟乙基纤维素、磷酸二氢钠和浓甘油的滴眼液。cn110974970a公开了含有m-胆碱受体激动剂或阻断剂、羟丙甲纤维素及其类似功效物、透明质酸钠及其类似功效物的复方滴眼液。但是,低浓度阿托品在溶剂中具有较低的稳定性,通常来说,增稠剂、渗透压调节剂、缓冲剂、酸碱调节剂等辅料的选择对低浓度阿托品的稳定性具有较大的影响,进而影响阿托品的安全性和临床疗效。另外,辅料的选择也会影响药物的成药性以及制备工艺等,进而影响药品的工业化生产。
技术实现要素:
4.本公开提供了一种药物组合物,其包括阿托品或其药学上可接受的盐、聚乙烯醇和枸橼酸盐,该组合物在稳定性方面具有优异的特性。
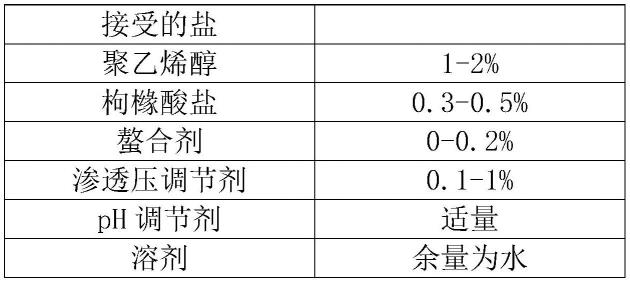
5.在某些实施方式中,阿托品药学上可接受的盐包含硫酸盐、盐酸盐、乙酸盐、乳酸盐、酒石酸盐、苹果酸盐或琥珀酸盐,优选硫酸盐。
6.在某些实施方式中,阿托品或其药学上可接受的盐的含量选自0.001-0.5%w/v,可以选自0.002-0.8%w/v、0.003-0.6%w/v、0.004-0.4%w/v、0.005-0.2%w/v、0.006-0.1%w/v、0.007-0.09%w/v、0.008-0.08%w/v,具体可以选自0.001%w/v、0.002%w/v、0.003%w/v、0.004%w/v、0.005%w/v、0.006%w/v、0.007%w/v、0.008%w/v、0.009%w/v、0.01%w/v、0.011%w/v、0.012%w/v、0.013%w/v、0.014%w/v、0.015%w/v、0.016%w/v、
0.017%w/v、0.018%w/v、0.019%w/v、0.02%w/v、0.021%w/v、0.022%w/v、0.023%w/v、0.024%w/v、0.025%w/v、0.025%w/v、0.026%w/v、0.027%w/v、0.028%w/v、0.029%w/v、0.03%w/v、0.031%w/v、0.032%w/v、0.033%w/v、0.034%w/v、0.035%w/v、0.036%w/v、0.037%w/v、0.038%w/v、0.039%w/v、0.04%w/v、0.041%w/v、0.042%w/v、0.043%w/v、0.044%w/v、0.045%w/v、0.046%w/v、0.047%w/v、0.048%w/v、0.049%w/v、0.05%w/v,优选0.004-0.4%w/v,更优选0.008-0.08%w/v,最优选0.01%w/v或0.05%w/v。
7.在某些实施方式中,聚乙烯醇的含量选自0.5-3%w/v,可以选自0.5-2.5%w/v、0.5-2%w/v、1-2%w/v,具体可以选自0.5%w/v、0.6%w/v、0.7%w/v、0.8%w/v、0.9%w/v、1.0%w/v、1.1%w/v、1.2%w/v、1.3%w/v、1.4%w/v、1.5%w/v、1.6%w/v、1.7%w/v、1.8%w/v、1.9%w/v、2.0%w/v、2.1%w/v、2.2%w/v、2.3%w/v、2.4%w/v、2.5%w/v、2.6%w/v、2.7%w/v、2.8%w/v、2.9%w/v、3%w/v,优选1-2%w/v,更优选1-1.5%w/v,最优选1.4%w/v。
8.在某些实施方式中,药物组合物中枸橼酸盐选自枸橼酸钠、枸橼酸钾、枸橼酸钙,优选枸橼酸钠。
9.在某些实施方式中,枸橼酸钠的含量选自0.05-1.5%w/v,可以选自0.05-1%w/v、0.05-0.5%w/v,具体可以选自0.05%w/v、0.1%w/v、0.15%w/v、0.2%w/v、0.25%w/v、0.3%w/v、0.35%w/v、0.4%w/v、0.45%w/v、0.5%w/v、0.55%w/v、0.6%w/v、0.65%w/v、0.7%w/v、0.75%w/v、0.8%w/v、0.85%w/v、0.9%w/v、1%w/v、1.1%w/v、1.2%w/v、1.3%w/v、1.4%w/v、1.5%w/v,优选0.3-1%w/v,更优选0.3-0.5%w/v,最优选0.45%w/v。
10.在某些实施方式中,药物组合物还包含螯合剂。所述螯合剂选自依地酸二钠、依地酸钙钠、乙二胺四乙酸、乙二胺四乙酸二钠盐、乙二胺四乙酸二钙盐、乙二胺四乙酸钾盐、乙二胺四乙酸钙钠盐中的一种或多种,优选依地酸二钠、依地酸钙钠中的一种或多种,最优选依地酸二钠。
11.在某些实施方式中,药物组合物中螯合物的含量不大于0.5%w/v,具体选择不大于0.5%w/v、0.4%w/v、0.3%w/v、0.2%w/v、0.1%w/v、0.09%w/v、0.08%w/v、0.07%w/v、0.06%w/v、0.05%w/v、0.04%w/v、0.03%w/v、0.02%w/v或0.01%w/v,优选不大于0.1%w/v,最优选不大于0.05%w/v。
12.在某些实施方式中,药物组合物还包含渗透压调节剂。所述渗透压调节剂选自氯化钠、氯化钾和葡萄糖中的一种或几种,优选氯化钠。
13.在某些实施方式中,药物组合物中渗透压调节剂含量选自0.1-2%w/v,可以选自0.1-1%w/v、0.5-1%w/v,具体可以选自0.1%w/v、0.2%w/v、0.3%w/v、0.4%w/v、0.5%w/v、0.6%w/v、0.7%w/v、0.8%w/v、0.9%w/v、1%w/v、1.1%w/v、1.2%w/v、1.3%w/v、1.4%w/v、1.5%w/v、1.6%w/v、1.7%w/v、1.8%w/v、1.9%w/v、2%w/v,优选0.5-1.5%w/v,更优选0.5-1%w/v,最优选0.7%w/v。
14.在某些实施方式中,药物组合物中还包含ph调节剂,所述组合物的ph可以为3-7,优选4-7,更优选5-6。
15.在某些实施方式中,药物组合物中不包含防腐剂。
16.在某些实施方式中,药物组合物,其包含以各成分质量(g)与药物组合物总体积(100ml)计的:
[0017][0018][0019]
所述阿托品或其药学上可接受的盐选自硫酸盐、盐酸盐、乙酸盐、乳酸盐、酒石酸盐、苹果酸盐或琥珀酸盐,优选硫酸盐;所述枸橼酸盐选自枸橼酸钠、枸橼酸钾、枸橼酸钙中的一种或多种,优选枸橼酸钠;螯合剂选自依地酸二钠、依地酸钙钠、乙二胺四乙酸、乙二胺四乙酸二钠盐、乙二胺四乙酸二钙盐、乙二胺四乙酸钾盐、乙二胺四乙酸钙钠盐中的一种或多种,优选依地酸二钠、依地酸钙钠中的一种或多种,最优选依地酸二钠;所述渗透压调节剂选自氯化钠、氯化钾和葡萄糖中的一种或几种,优选氯化钠;所述ph调节剂选自盐酸和/或氢氧化钠。
[0020]
在某些实施方式中,药物组合物,其包含以各成分质量(g)与药物组合物总体积(100ml)计的:
[0021][0022]
所述阿托品或其药学上可接受的盐选自硫酸盐、盐酸盐、乙酸盐、乳酸盐、酒石酸盐、苹果酸盐或琥珀酸盐,优选硫酸盐;所述枸橼酸盐选自枸橼酸钠、枸橼酸钾、枸橼酸钙中的一种或多种,优选枸橼酸钠;螯合剂选自依地酸二钠、依地酸钙钠、乙二胺四乙酸、乙二胺四乙酸二钠盐、乙二胺四乙酸二钙盐、乙二胺四乙酸钾盐、乙二胺四乙酸钙钠盐中的一种或多种,优选依地酸二钠、依地酸钙钠中的一种或多种,最优选依地酸二钠;所述渗透压调节剂选自氯化钠、氯化钾和葡萄糖中的一种或几种,优选氯化钠;所述ph调节剂选自盐酸和/或氢氧化钠。
[0023]
在某些实施方式中,药物组合物,其包含以各成分质量(g)与药物组合物总体积(100ml)计的:
[0024][0025]
所述阿托品或其药学上可接受的盐选自硫酸盐、盐酸盐、乙酸盐、乳酸盐、酒石酸盐、苹果酸盐或琥珀酸盐,优选硫酸盐;所述枸橼酸盐选自枸橼酸钠、枸橼酸钾、枸橼酸钙中的一种或多种,优选枸橼酸钠;螯合剂选自依地酸二钠、依地酸钙钠、乙二胺四乙酸、乙二胺四乙酸二钠盐、乙二胺四乙酸二钙盐、乙二胺四乙酸钾盐、乙二胺四乙酸钙钠盐中的一种或多种,优选依地酸二钠、依地酸钙钠中的一种或多种,最优选依地酸二钠;所述渗透压调节剂选自氯化钠、氯化钾和葡萄糖中的一种或几种,优选氯化钠;所述ph调节剂选自盐酸和/或氢氧化钠。
[0026]
在某些实施方式中,药物组合物被配制成澄清的溶液、悬浮液或乳液,优选澄清的溶液。
[0027]
如本公开所理解的,澄清溶液是指其中所有溶质在室温条件下,即在15-25℃之间完全可溶解或完全溶解的液体溶液。澄清溶液不包含任何颗粒或固相组分,例如不包含未溶解的活性物质。特别是,澄清溶液在15-25℃之间是热力学稳定的,意味着在平衡状态下,所有溶解的组分(如阿托品或其药学上可接受的盐)都保持溶解状态,并且没有发生溶液的相分离、沉淀或物理形式的变化。
[0028]
在某些实施方式中,所述药物组合物为眼用制剂。在某些实施方式中,眼用制剂为滴眼剂、洗眼剂或眼内注射溶液。在某些实施方式中,所述眼用制剂为滴眼剂。
[0029]
在某些实施方式中,本公开所述的药物组合物于25℃的条件下放置1个月,基于初始浓度,其中阿托品或其药学上可接受的盐的含量保持至少85%,优选至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。储存后所述组合物中所述药物的百分比是基于所述组合物中初始存在(即储存条件前)的药物的量。
[0030]
在某些实施方式中,本公开所述的药物组合物于25℃的条件下放置2个月,基于初始浓度,其中阿托品或其药学上可接受的盐的含量保持至少85%,优选至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。储存后所述组合物中所述药物的百分比是基于所述组合物中初始存在(即储存条件前)的药物的量。
[0031]
在某些实施方式中,本公开所述的药物组合物于40℃的条件下放置1个月,基于初始浓度,其中阿托品或其药学上可接受的盐的含量保持至少85%,优选至少86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%。储存后所述组合物中所述药物的百分比是基于所述组合物中初始存在(即储存条件前)的药物的量。
[0032]
本公开所述的药物组合物于光照条件下放置12天,基于初始浓度,其中阿托品或其药学上可接受的盐的含量保持至少85%,优选至少86%、87%、88%、89%、90%、91%、
92%、93%、94%、95%、96%、97%、98%或99%。储存后所述组合物中所述药物的百分比是基于所述组合物中初始存在(即储存条件前)的药物的量。
[0033]
在某些实施方式中,本公开所述的药物组合物于25℃的条件下放置1个月,其中药物组合物中有关物质的含量少于或等于2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%或0.2%。
[0034]
在某些实施方式中,本公开所述的药物组合物于25℃的条件下放置2个月,其中药物组合物中有关物质的含量少于或等于2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%或0.2%。
[0035]
在某些实施方式中,本公开所述的药物组合物于40℃的条件下放置1个月,其中药物组合物中有关物质的含量少于或等于2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%或0.2%。
[0036]
在某些实施方式中,本公开所述的药物组合物于光照条件下放置12天,其中药物组合物中有关物质的含量少于或等于2%、1.9%、1.8%、1.7%、1.6%、1.5%、1.4%、1.3%、1.2%、1.1%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%或0.2%。
[0037]
在某些实施方式中,本公开所述的药物组合物在制备用于预防和/或缓解近视的药物中的用途。一般而言,儿童或青少年(年龄≤18岁),由于眼睛和视觉系统尚未完全发育成熟,或者由于学习压力较大,或者接触电子游戏或视频较频繁,更易患上近视。在某些实施方式中,所述的患者为儿童或青少年。
[0038]
在某些实施方式中,本公开提供了一种制备药物组合物的方法,所述方法包括:将阿托品或其药学上可接受的盐与聚乙烯醇和枸橼酸盐混合的步骤,所述枸橼酸盐选自枸橼酸钠、枸橼酸钾、枸橼酸钙中的一种或多种,优选枸橼酸钠。
[0039]
另外,本公开提供了包含上述药物组合物和容纳所述药物组合物的容器的药物试剂盒。优选地,包含组合物的容器具有分配装置如适于将所述药物组合物局部施用到患者眼睛的滴液装置。
[0040]
本发明所述“含量”单位w/v表示g/100ml。
[0041]
以下实施方式用来说明本公开,但这些实施例不应理解为限制本公开的范围。
具体实施方式
[0042]
有关物质按照高效液相色谱法(中国药典通则0512)测定。
[0043]
色谱条件:用氰基硅烷键合硅胶为填充剂(hypersil bds cn 150mm
×
4.6mm,5μm或效能相当的色谱柱);以醋酸钠缓冲液(醋酸钠6.8g,加水溶解并稀释至1000ml,加入3.5ml三乙胺和6.6ml冰醋酸,用冰醋酸调节ph值为4.5)-甲醇(85:15)为流动相。检测波长为225nm;柱温为40℃;流速为每分钟0.6ml;进样体积40μl。
[0044]
含量测定照高效液相色谱法(中国药典通则0512)测定。
[0045]
色谱条件:用氰基硅烷键合硅胶为填充剂(hypersil bds cn 150mm
×
4.6mm,5μm或效能相当的色谱柱);以醋酸钠缓冲液(醋酸钠6.8g,加水溶解并稀释至1000ml,加入3.5ml三乙胺和6.6ml冰醋酸,用冰醋酸调节ph值为4.5)-甲醇(85:15)为流动相。检测波长为225nm;柱温为40℃;流速为每分钟0.6ml;进样体积20μl。
[0046]
实施例1:
[0047]
将硫酸阿托品、聚乙烯醇、羟丙甲纤维素、羧甲基纤维素、枸橼酸钠、硼酸、一水磷酸二氢钠、无水磷酸氢二钠、无水磷酸二氢钠、二水磷酸二氢钠、氯化钠、依地酸二钠以及ph调节剂盐酸/氢氧化钠按表1-5中的比例混合、定容、灌装得到液体制剂a-f。
[0048]
表1:制剂a
[0049][0050]
表2:制剂b
[0051][0052]
表3:制剂c
[0053][0054]
表4:制剂d
[0055][0056]
表5:制剂e
[0057][0058]
表6:制剂f
[0059][0060][0061]
测试例1:将实施例1制备得到的制剂a-f于25℃/40%rh放置1个月考察稳定性,结果如下表7所示。
[0062]
表7
[0063][0064]
实验结果显示,制剂a在25℃/40%rh条件下放置1个月后纯度变化较小,且总杂含量较低,明显优于处方b-f。
[0065]
实施例2:
[0066]
辅料相容性实验筛选时发现,将聚乙烯醇与硼酸、聚乙烯醇与磷酸二氢钠混合时出现肉眼可见沉淀,因此不适合同时作为制剂辅料使用。
[0067]
实施例3:
[0068]
将硫酸阿托品、聚乙烯醇、枸橼酸钠、氯化钠、依地酸二钠以及ph调节剂盐酸/氢氧化钠按表8中的比例混合、定容、灌装得到液体制剂a、g和h。
[0069]
表8
[0070][0071][0072]
上述实验结果表明枸橼酸钠含量的提高有助于减少总杂生成,提高了低含量阿托品制剂的稳定性。
[0073]
实施例4:
[0074]
将硫酸阿托品、聚乙烯醇、枸橼酸钠、氯化钠、依地酸二钠以及ph调节剂盐酸/氢氧化钠按表9中的比例混合、定容、灌装得到液体制剂i。
[0075]
表9
[0076][0077]
测试例2:将实施例1制备得到的制剂a和实施例4制备得到的制剂i分别于25℃、40℃和光照条件下放置考察稳定性,结果如下表10和表11所示。
[0078]
表10:制剂a稳定性考察
[0079][0080][0081]
表11:制剂i稳定性考察
[0082][0083]
结果显示,制备得到的制剂a和i在25℃、40℃和光照条件下均具有良好的稳定性。参考标准usp43版滴眼液标准限度中关于杂质的规定,杂质a≤7.0%、杂质b≤1.0%、杂质c≤1.0%、其他单个杂质≤1.0%、杂质总量≤7.0%。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1