KGF-2制备治疗皮肤功能障碍药物中的应用
kgf-2制备治疗皮肤功能障碍药物中的应用
技术领域
1.本发明涉及医药技术领域,更具体的说是涉及kgf-2制备治疗皮肤功能障碍药物中的应用。
背景技术:
2.增生性瘢痕(hypertrophic scar,hs)是一种皮肤过度纤维化性病症,是烧伤、皮肤创伤或手术等创伤的常见并发症。增生性瘢痕的实质是成纤维细胞的过度增殖和持续激活,进而合成大量的细胞外基质(extracellular matrix,ecm),导致胶原纤维的大量沉积进而影响皮肤正常生理功能。
3.虽然皮肤移植、压力疗法、类固醇、激光和硅酮敷料等干预措施取得了一定抑制瘢痕的作用,但是,到目前为止,手术切除仍是增生性瘢痕治疗的唯一有效方法。因此,急需开发瘢痕防治的药物,减少或避免损伤造成的瘢痕及由此引起的皮肤功能障碍。
4.因此,如何提供一种治疗皮肤纤维化和瘢痕的药物是本领域技术人员亟需解决的问题。
技术实现要素:
5.有鉴于此,本发明提供了kgf-2制备治疗皮肤功能障碍药物中的应用。角质细胞生长因子-2(keratinocyte growth factor-2,kgf-2)是一个对损伤愈合具有重要调控作用的生长因子。本发明通过临床样本,动物模型和细胞模型,探索kgf-2在体内外瘢痕形成中的作用,并探讨kgf-2下调瘢痕形成的分子机制,为kgf-2在增生性疤痕治疗中的应用提供依据。
6.为了实现上述目的,本发明采用如下技术方案:
7.一种kgf-2制备治疗皮肤功能障碍药物中的应用。
8.优选的:皮肤功能障碍为皮肤纤维化和增生性瘢痕。
9.优选的:药物下调stap2的表达,减少stat3的磷酸化水平,从而影响下游纤维化相关蛋白的表达。
10.优选的:蛋白包括colⅰ,colⅲ和α-sma。
11.优选的:kgf-2下调小鼠皮肤组织中胶原的表达量。
12.优选的:kgf-2抑制机械应力诱导的小鼠疤痕形成。
13.优选的:kgf-2减少原代成纤维细胞细胞外基质的表达。
14.本发明还提供了一种抑制疤痕的药物,其特征在于,包括kgf-2,且kgf-2的用量为250~500μg/kg。
15.进一步的,本发明具体利用he、masson染色观察临床瘢痕组织增生性区域的结构,并通过wb检测细胞外基质,α-sma,胶原ⅰ和胶原iii的表达,同时通过rt-pcr检测α-sma、胶原ⅰ和胶原iii蛋白的mrna水平,从而对临床瘢痕组织在组织病理学和分子学角度进行全面分析,确定疤痕组织的病理特征。与此同时,通过wb和rt-qpcr检测疤痕组织中常见生长因
子的表达变化。建立机械应力诱导的瘢痕小鼠模型和提取的原代成纤维细胞,通过he、masson染色,wb,rt-pcr,免疫组化和免疫荧光等方法分别在体内外验证kgf-2对ecm表达和瘢痕形成的影响。进一步利用蛋白质组学方法分析并找到kgf-2调控的关键蛋白,并对其抑制或过表达,研究该蛋白对下游stat3的磷酸化以及疤痕相关蛋白的表达影响,探讨其在kgf-2调控瘢痕中所起到的作用。最后通过mapk通路抑制剂,研究kgf-2所依赖的调控通路。
16.有益效果在于:临床瘢痕皮肤组织胶原纤维致密,存在高表达的胶原蛋白,细胞外基质合成相关蛋白高度表达。除此之外,kgf-2的mrna和蛋白水平在瘢痕组织中下调,p-stat3蛋白水平在瘢痕组织中上调。动物实验结果显示kgf-2能够减少机械应力诱导的瘢痕形成,减少增生性疤痕的区域。并且kgf-2能够下调动物皮肤组织中的细胞外基质和磷酸化stat3的表达。对提取的原代细胞进行研究,结果显示kgf-2不仅能够减少原代增生性瘢痕成纤维细胞胶原i,胶原iii,α-sma的表达,还能使磷酸化stat3的表达下调。通过对动物组织进行蛋白质组学分析,结果指出stap2是影响kgf-2调控瘢痕形成的关键蛋白。stap2和磷酸化stat3在机械应力诱导的瘢痕小鼠模型的皮肤组织和提取的原代成纤维细胞中表达上调正好验证此结果。进一步验证实验显示抑制stap2表达,能够减少原代成纤维细胞胶原i,胶原iii,α-sma和p-stat3表达。过表达stap2会导致p-stat3表达的增加以及ecm的累积。通过抑制p38通路,显示kgf-2无法调控胶原i,胶原iii,α-sma的表达,进而说明kgf-2通过p38调控stap2的表达,进一步调节p-stat3的水平,从而影响下游纤维化相关蛋白的表达,减少了瘢痕的形成。
17.经由上述的技术方案可知,与现有技术相比,本发明公开提供了kgf-2制备治疗皮肤功能障碍药物中的应用,相较于现有技术本发明显示瘢痕组织以胶原纤维致密,细胞外基质分泌旺盛,并且存在kgf-2的低表达为特征。kgf-2能够显著抑制机械应力诱导的小鼠疤痕形成,减少原代成纤维细胞细胞外基质的表达。而stap2在瘢痕形成的过程中存在关键作用。kgf-2通过p38调控stap2的表达,进一步调节p-stat3的水平,从而影响下游纤维化相关蛋白的表达,减少了瘢痕的形成。因此,stap2有希望成为瘢痕防治的新靶点,kgf-2有希望成为预防瘢痕形成的有效药物。
附图说明
18.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
19.图1附图为本发明提供的临床皮肤样本中p-stat3表达的免疫荧光分析图,其中,红色:波形蛋白,绿色:p-stat3。
20.图2附图为本发明提供的临床皮肤样本中stat3表达的免疫荧光分析图,其中,红色:波形蛋白,绿色:stat3。
21.图3附图为本发明提供的p-stat3在if中的统计学分析图。
22.图4附图为本发明提供的stat3的if统计学分析图。
23.图5附图为本发明提供的机械应力诱导疤痕形成的小鼠模型的过程图。
24.图6附图为本发明提供的给药终期取材前小鼠皮肤疤痕的表观现象图。
25.图7附图为本发明提供的he和masson染色图。
26.图8附图为本发明提供的小鼠皮肤增生性疤痕区域的统计学分析图。
27.图9附图为本发明提供的p-stat3在western免疫印迹中的统计学分析图。
28.图10附图为本发明提供的ⅰ型胶原在western免疫印迹中的统计学分析图。
29.图11附图为本发明提供的ⅲ型胶原在western免疫印迹中的统计学分析图。
30.图12附图为本发明提供的α-sma在western免疫印迹中的统计学分析图。
31.图13附图为本发明提供的α-sma和波形蛋白在小鼠皮肤中表达的免疫荧光分析图,其中,红色:波形蛋白,绿色:α-sma。
32.图14附图为本发明提供的p-stat3和波形蛋白在小鼠皮肤中表达的免疫荧光分析图,其中,红色:波形蛋白,绿色:p-stat3。
33.图15附图为本发明提供的人原代增生性疤痕成纤维细胞的免疫荧光鉴定图。
34.图16附图为本发明提供的α-sma在western免疫印迹分析中的统计学分析图。
35.图17附图为本发明提供的p-stat3在western免疫印迹分析中的统计学分析图。
36.图18附图为本发明提供的ⅰ型胶原在western免疫印迹分析中的统计学分析图。
37.图19附图为本发明提供的ⅲ型胶原在western免疫印迹分析中的统计学分析图。
38.图20附图为本发明提供的差异蛋白的细胞成分类聚分析图。
39.图21附图为本发明提供的细胞外基质相关细胞成分的类聚分析图。
40.图22附图为本发明提供的stat3与stap2的免疫共沉淀图。
41.图23附图为本发明提供的临床皮肤样本中stat2和p-stat3表达的免疫荧光分析图,其中,红色:stap2,绿色:p-stat3。
42.图24附图为本发明提供的stap2在临床皮肤样本if中的统计学分析图。
43.图25附图为本发明提供的p-stat3在临床皮肤样本if中的统计学分析图。
44.图26附图为本发明提供的小鼠皮肤组织和原代成纤维细胞中stap2在westernblot中的实验结果图。
45.图27附图为本发明提供的stap2在临床样本western免疫印迹分析中的统计学分析图。
46.图28附图为本发明提供的stap2在小鼠皮肤组织western免疫印迹分析中的统计学分析图。
47.图29附图为本发明提供的)stap2在原代成纤维细胞western免疫印迹分析中的统计学分析图。
48.图30附图为本发明提供的kgf-2在过表达stap2细胞系中western免疫印迹分析图。
49.图31附图为本发明提供的stap2在western免疫印迹分析中的统计学分析图。
50.图32附图为本发明提供的α-sma mrna水平的统计学分析图。
51.图33附图为本发明提供的ⅰ型胶原mrna水平的统计学分析图。
52.图34附图为本发明提供的ⅲ型胶原mrna水平的统计学分析图。
53.图35附图为本发明提供的过表达stap2细胞系中stat2和p-stat3的免疫荧光分析图,其中红色:stap2,绿色:p-stat3。
具体实施方式
54.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
55.本发明实施例公开了kgf-2制备治疗皮肤功能障碍药物中的应用。
56.实施例中的必要仪器、设备、实验材料均为市售途径获得,例如:ccc-hsf-1购自上海拜力生物科技有限公司、dmem高糖液体培养基、dmem-f12液体培养基购自gibco公司;青-链霉素溶液(双抗)购自hyclone公司;kgf-2冻干粉、fgf-21冻干粉购自浙江生物技术制药工程重点实验室;mtt购自sigma公司;抗荧光淬灭pvp封片液、ripa裂解液(强)、蛋白酶抑制剂(pmsf)、westernblot超敏化学发光底物购自碧云天生物技术公司;dmso购自amresco公司;sirna购自吉玛生物科技有限公司;lipo3000购自sigma公司;总rna提取试剂盒、逆转录试剂盒购自北京索莱宝科技有限公司;过表达慢病毒购自和元生物科技有限公司;qpcr sybr green mastermix购自上海翊圣生物科技有限公司;stat3 rabbit polyclonal antibody购自proteintech公司;stap-2goat polyclonal antibody购自abcam公司;p-stat3 rabbit polyclonal antibody购自sab(signalway antibody)公司;α-sma rabbitpolyclonal antibody、vimentin mouse monoclonal antibody、colⅰrabbit polyclonal antibody、colⅲrabbit polyclonal antibodymmp-9 rabbit polyclonal antibody购自proteintech公司;kgf-2rabbit polyclonal antibody、p-erk1/2polyclonal antibody、erk1/2polyclonal antibody、fgf2 rabbit polyclonal antibody、p38 rabbit polyclonal antibody、p-p38 rabbit polyclonal antibody购自sab(signalway antibody)公司;fgf1 rabbit polyclonal antibody购自santa cruz公司;akt mouse monoclonal antibody、p-akt mouse monoclonal antibody、gapdh抗体、羊抗兔igg-hrp、驴抗羊igg-hrp购自proteintech公司;驴抗兔igg h&l(alexa488)、驴抗鼠igg h&l(alexa555)、驴抗羊igg h&l(alexa647)购自abcam公司;ppic蛋白磷酸酶抑制剂、pic蛋白酶抑制剂购自北京全式金生物技术有限公司等。
57.电泳缓冲液
58.称取18.90g甘氨酸,3.02g tris-base及1g sds粉末溶解于双蒸水中并定容至1000ml,配置成1
×
的电泳缓冲液,室温静置储存备用。
59.电转缓冲液:称取14.42g甘氨酸,3.02g tris-base粉末溶解于双蒸水中并定容至800ml,最后加入200ml甲醇溶液,将ph调至8.2-8.3,配置成1
×
的电转缓冲液,室温静置储存备用。
60.tbs溶液:称取40gnacl,1g kcl及15g tris-base粉末溶解于双蒸水中并定容至500ml,加浓hcl调节ph至7.5,配置成10
×
的tbs缓冲液,室温静置储存备用。
61.tbst溶液:量取50ml 10
×
的tbs缓冲液,加入0.1%tween-20,用双蒸水定容到500ml,常温储存备用。
62.封闭液(5%脱脂奶粉):称取1.5g脱脂奶粉溶解于30ml 1
×
的tbst缓冲溶液中,现配现用。
63.10%ap溶液:称取0.1g ap溶解于1ml双蒸水中,4℃冰箱储存备用,需两周内使用。
64.10%sds溶液:称取1g sds粉末溶解于10ml双蒸水中,室温摇床混匀后静置备用。
65.kgf-2:kgf-2粉末于4℃冰箱保存,使用时用细胞培养基溶解分装于1.5ml ep管中,kgf-2稀释液储存于-20℃冰箱中,待下次使用前常温解冻。
66.细胞培养基
67.(1)deme细胞完全培养基:dmem高糖培养基+10%胎牛血清+1x青霉素-链霉素抗生素浓缩液。
68.(2)deme细胞饥饿培养基:dmem高糖培养基+0.5%胎牛血清+1x青霉素-链霉素抗生素浓缩液。
69.(3)deme细胞饥饿肝素培养基:dmem高糖培养基+0.5%胎牛血清+1x青霉素-链霉素抗生素浓缩液+100μg/ml肝素钠。
70.统计学分析:使用graphpad prism6.0软件进行数据处理和统计分析。组间比较经正态检验和方差齐性检验后,采用单因素方差分析(one-way anova)。p《0.05表示差异有统计学意义。所有实验均重复3次或3次以上。
71.样本
72.人疤痕皮肤成纤维细胞和人正常皮肤成纤维细胞是从满足增生性疤痕的6个患者的疤痕皮肤活组织和其正常皮肤活组织样品中分离得到的。人类研究由温州医科大学药学院伦理委员会批准。所有患者和对照者都签署了当地机构审查委员会批准的同意书。
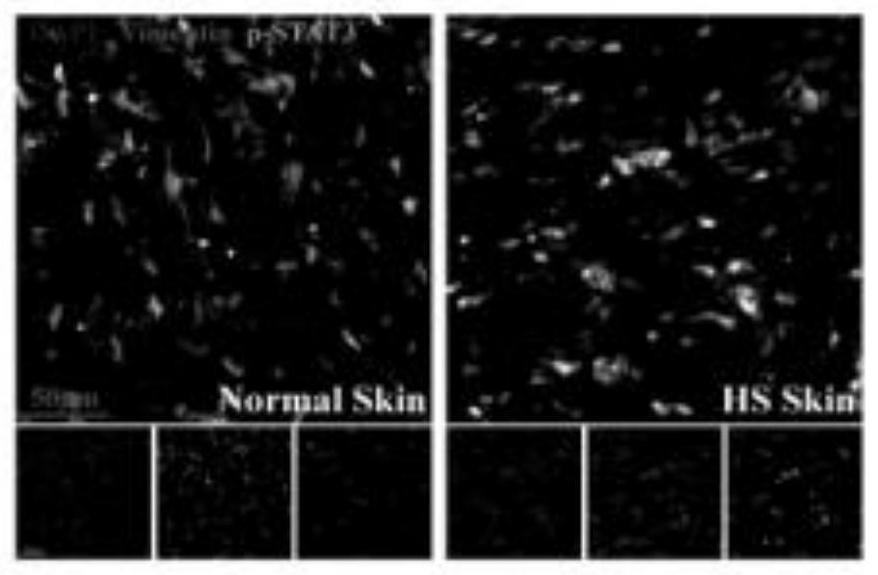
73.实施例中涉及的组织包埋:石蜡包埋预处理过程、石冰冻包埋预处理过程;he和masson染色实验;免疫印迹法;蛋白变性;sds-page电泳;ihc和if染色实验、细胞培养、细胞复苏、细胞传代、细胞冻存、细胞计数均为常规实验方式,在此不再赘述。
74.实时定量pcr
75.用总rna提取试剂盒(索莱宝)提取的总细胞rna,并使用iscript cdna试剂盒(bio rad)进行逆转录。如前所述(ray等,2010),在含有5μliqsybr green supermix(bio rad)和200nm引物的10μl反应中扩增cdna产物。为了标准化模板输入,测量每个样品的gapdh转录物水平。数据表示为归一化为gapdh后的倍数变化。
76.用于rt-pcr的引物如下:
77.col1a1,有义引物(sp):5'-gagggccaagacgaagacatc-3'和反义引物(as):5'-cagatcacgtcatcgcacaac-3';
78.col1a2,sp:5'-ctccatggtgagtttggtctc-3'和as:5'-cttccaataggaccagtaggac-3';
79.col3a1,sp:5'-ggagctggctacttctcgc-3'和as:5'-gggaacatcctccttcaacag-3';
80.α-sma,sp:5'-gtgttgcccctgaagagcat-3'和as:5'-gctgggacattgaaagtctca-3';
81.kgf-2,sp:5'-cagtagaaatcggagttgttgcc-3'和as:5'-tgagccatagagtttccccttc-3';
82.afgf,sp:5'-ttcacagccctgaccgagaa-3'和as:5'-cgttgctacagtagaggagtttg-3';
83.bfgf,sp:5'-agaagagcgaccctcacatca-3'和as:5'-cggttagcacacactcctttg-3';
84.stap-2,sp:5'-gaccttggagtgtcgggaaat-3'和as:5'-gaagcagggtcaagtcggt-3';
85.gapdh,sp:5'-ggagcgagatccctccaaaat-3'和as:
86.5'-ggctgttgtcatacttctcatgg-3'。
87.实施例1
88.通过he和masson染色发现增生性瘢痕组织胶原纤维致密,胶原间的间隙很小。
89.westernblot和rt-pcr实验结果表明,α-sma,胶原蛋白i和胶原蛋白iii在增生性瘢痕组织中高表达,而促进胶原蛋白降解的mmp-9蛋白表达下调。另外,通过检查增生性瘢痕组织中afgf,bfgf和kgf-2的表达,增生性瘢痕病人组织kgf-2的mrna和蛋白表达显著下调,而afgf和bfgf表达均没有明显变化。
90.成纤维细胞与p-stat3免疫荧光共定位试验,揭示增生性瘢痕成纤维细胞中存在p-stat3的高表达(参见图1、2、3、4)。
91.结论:瘢痕组织存在细胞外基质的过度沉积和stat3磷酸化表达上调。生长因子检测揭示,kgf-2的缺乏可能与瘢痕的形成有关。
92.备注:与正常皮肤组相比,***p≤0.001,**p≤0.01,*p≤0.05,n=6。
93.实施例2
94.机械应力诱导的瘢痕模型的构建
95.4~6周龄b57cl/6小鼠24只,清洁级(购买于北京维通利华实验动物有限责任公司)。分笼饲养于温州医科大学中试基地二期动物实验中心。饲养的环境为室温23
±
2℃左右,相对湿度60
±
5%左右,12h交替日夜光照,固体颗粒鼠饲料喂养,自由饮水。实验动物购回饲养1周后进行瘢痕模型的构建。
96.小鼠用4%水合氯醛以腹腔注射的方式麻醉后,将背部中央的毛剃去,75%的酒精局部消毒后,制备疤痕模型。在小鼠背上产生一个1.5cm的全层皮肤剪切伤并缝合,待愈合后在伤口两端加载上张力装置,并且3天调节一下张力,给药时间为一个月。
97.每3天给一次药,治疗时间为一个月。
98.分组如下:
99.对照组:剪切伤,不装载张力装置,注射生理盐水,体积v=0.1ml;
100.模型组:剪切伤,装载张力装置,注射生理盐水,体积v=0.1ml;
101.低剂量治疗组:剪切伤,装载张力装置,注射25μg/ml kgf-2;
102.高剂量治疗组:剪切伤,装载张力装置,注射50μg/ml kgf-2。
103.通过制作机械应力诱导的小鼠增生性瘢痕模型,在剪切伤愈合后,加载上拉力装置并每三天调节拉力的同时,皮下注射kgf-2(图5)。
104.给药末期,观察缝合区疤痕印记,如图6所示,与未加载机械应力的切割损伤小鼠相比,模型组瘢痕明显,经kgf-2治疗后,瘢痕明显减轻,且有量效关系。
105.从he和masson染色中,我们可以观察到500μg/kg kgf-2给药组瘢痕面积显著减少,瘢痕面积仅为模型组的30%(图7、8)。
106.westernblot实验结果表明,kgf-2不仅显著减少α-sma,i型胶原和iii型胶原等的表达,还减少瘢痕组织中p-stat3的表达(图9~12)。但kgf-2未改变stat3在皮肤组织中的表达,只影响stat3的磷酸化水平。ⅰ型胶原的免疫组化染色也显示,kgf-2以剂量依赖方式下调给小鼠皮肤组织中胶原的表达量。在小鼠皮肤组织免疫荧光染色试验中也观察到α-sma和p-stat3被下调(图13~14)。
107.以上结果表明,kgf-2可在一定程度上抑制机械应力诱导的瘢痕的形成。
108.备注:与正常组相比,###p≤0.001,#p≤0.05;与模型组相比,***p≤0.001,**p≤
0.01,*p≤0.05,n=6。
109.实施例3
110.将细胞消化、离心后转移至超净台内,弃去上清液。加入3ml完全培养基,轻轻吹打重悬混匀。将准备好的细胞计数板,盖上盖玻片,吸取一定量的细胞混悬液,滴入缝隙,避免产生气泡。将细胞计数板放至于倒置显微镜,根据数上不数下、数左不数右的计数原则记录四大格中的细胞总数。公式:每毫升的细胞数=(四大格细胞数总和/4)
×
104个。
111.mtt:为了检测kgf-2对细胞的影响,将提取的原代细胞铺与96孔板,每孔5000个细胞,培养24h后换上饥饿培养基过夜,第二天通过三倍浓度梯度稀释的方法,将kgf-2作用于细胞,起始浓度为300μg/ml。作用24h之后每孔加入20ul的mtt,4h之后吸去培养液,每孔加入120ul的dmso,在振荡器上振荡5~10min,在酶标仪上490nm测定吸光值(abs490)。数据用graphpadprism 6.0统计分析及制作统计图。
112.为了进一步证实kgf-2对细胞外基质表达的调节,从临床组织中提取了原代疤痕成纤维细胞(hsf)并给予一定浓度的kgf-2进行刺激。
113.结果表明:
114.原代细胞免疫荧光鉴别试验表明,瘢痕成纤维细胞(hsf)具有高表达的α-sma(图15)。在接下来的免疫荧光和western blot试验,同样证实了临床样本和动物实验的结果:kgf-2以剂量依赖性方式下调瘢痕成纤维细胞(hsf)中α-sma,胶原ⅰ,胶原ⅲ和p-stat3的表达(图16~19)。
115.实施例4
116.kgf-2治疗的疤痕小鼠,于实验末期将正常组,模型组与kgf-2治疗组小鼠进行取材。取适量组织样品置于液氮充分研磨。加入4倍体积的裂解缓冲液,使用高强度超声波仪(scientz)处理3次。4℃,12000g离心10min,去除细胞碎片,收集上清液,并根据制造商的说明使用bca试剂盒(碧云天生物科技有限公司)测定蛋白质浓度。
117.蛋白溶液中加入二硫苏糖醇使其终浓度为5mm,56℃还原30min。之后加入碘代乙酰胺使其终浓度为11mm,室温避光孵育15min。最后将样品的尿素浓度稀释至低于2m。以1:50的质量比例(胰酶:蛋白)加入胰酶,37℃酶解过夜。再以1:100的质量比例(胰酶:蛋白)加入胰酶,继续酶解4h。胰酶酶解的肽段用stratax c18(phenomenex)除盐后真空冷冻干燥。标记试剂解冻后用乙腈溶解,与肽段混合后室温孵育2h,标记后的肽段混合后除盐,真空冷冻干燥。用tmt标记后用液相色谱-质谱联用检测,得出的数据通过生物信息学软件(interproscan,kegg mapper,wolfpsort,cello,perl module,blast)分析差异蛋白,并对差异蛋白进行类聚分析,形成kgf-2调节基因的转录组网络。
118.结果显示,对小鼠皮肤组织进行了蛋白质组学分析,给予kgf-2治疗前后,小鼠皮肤蛋白表达谱发生显著改变(图20)。
119.细胞成分的类聚分析表明,模型组纤维蛋白原复合物等细胞外基质相关蛋白高于对照组和给药组(图21)。通过比对给药组中逆转蛋白的表达情况,并通过生物信息学分析(perl module),围绕kgf-2调节基因的转录组网络,构建出以stap2作为纤维化和瘢痕形成中心的网络。进一步通过免疫共沉淀证明,stap2与stat3存在蛋白间的相互作用,即,kgf-2通过下调stap-2表达调控stat3磷酸化,从而抑制皮肤瘢痕的形成(图22)。
120.实施例5
121.sirna的转染
122.stap2 sirna(吉玛)在nf和hsf 40%汇合度,遵循制造商的说明,在无血清无双抗培养基中转染后5小时换液,过24h收集细胞并用于蛋白质或总rna提取。
123.stap2和p-stat3在纤维化皮肤中积聚
124.为了证实stap2是疤痕调控的重要靶点,对比分析正常皮肤(normal skin)、增生性瘢痕(hs skin)组织,疤痕小鼠皮肤组织和原代疤痕成纤维细胞中的stap2的表达情况。
125.免疫荧光数据显示,与对照组相比,hs患者皮肤中stap2蛋白和stat3的磷酸化水平显著增加(图23~25)。
126.瘢痕小鼠模型stap2蛋白水平是正常小鼠的6倍。kgf-2给药后,疤痕小鼠组织中stap2和p-stat3表达被下调并趋于正常。在原代疤痕成纤维细胞中,stap2蛋白水平为正常皮肤的1.6倍。值得注意的是,kgf-2以剂量依赖的方式下调stap2和p-stat3表达。
127.上述结果在westernblot实验也得到证实(图26~29)。以上结果证实了疤痕组织中存在高表达的stap2和stat3蛋白磷酸化。
128.备注:与正常组相比,###p≤0.001,##p≤0.01;与模型组相比,***p≤0.001,**p≤0.01,*p≤0.05,n=6。
129.利用rna干扰技术,构建了stap2敲低细胞模型。western-blot和q-rt-pcr结果表明,转染stap2干扰载体后,stap2表达显著下调。
130.与对照相比,stap2缺乏后,减少了stat3的磷酸化和ⅰ型胶原、ⅲ型胶原以及α-sma等细胞外基质的积累。上述的结果验证了stap2是纤维化和瘢痕形成的关键靶点。
131.备注:nc:negative control;kd:positive stap2-sirna;与对照组相比,***p≤0.001,**p≤0.01,*p≤0.05,n=6。
132.实施例6
133.过表达慢病毒的应用
134.过表达慢病毒由元和生物构建并鉴定。在nf 60%汇合度,遵循制造商的说明,在无血清无双抗培养基中转染后5小时换液,在倒置显微镜下确定转染效率。给药后过24h收集细胞并用于蛋白质或总rna提取。
135.kgf-2通过stap2和stat3的相互作用调控瘢痕形成(stap2诱导stat3磷酸化)
136.构建stap2过表达的ccc-hsf-1细胞系。蛋白质印迹分析显示,stap2过表达的细胞系中stap2表达量是原来的2倍(图30、31)。数据表明stap2过表达显着增加了p-stat3的表达水平,并且细胞外基质水平显着增加。
137.实时定量pcr分析表明,α-sma,ⅰ型胶原,ⅲ型胶原等ecm基因的mrna在过表达细胞系中被明显的上调(图32~34)。
138.免疫荧光结果显示,stap2过表达细胞系中,p-stat3的表达显著增加(图35)。
139.结果表明:stap2能够引起stat3磷酸化水平产生变化,进而影响ecm的沉积导致瘢痕的形成。实时qpcr分析还显示,stap2过表达的细胞具有较高的ⅰ型胶原和ⅲ型胶原表达以及α-sma水平。
140.western-blot结果显示在过度表达的细胞中,p-stat3趋于增加。过表达细胞中胶原蛋白水平升高,α-sma水平升高,纤维化蛋白(包括colⅰ,colⅲ和α-sma)也升高,而mmp9则下调。
141.为了确认kgf-2通过stap2参与瘢痕形成的调控,向stap2过表达的细胞中添加50μg/ml的kgf-2。
142.western-blot结果显示,在50μg/ml kgf-2处理后,stap2过表达细胞系的p-stat3蛋白水平降低,ecm相关因子(包括colⅰ,colⅲ和α-sma)的蛋白水平也被降低。
143.实时qpcr分析表明colⅰ,colⅲ和α-sma的mrna在kgf-2的作用下被下调。kgf-2能够一定程度上逆转stap2过表达导致的细胞外基质蛋白的累积。
144.实施例7
145.通路抑制剂的应用
146.为了了解kgf-2是否通过mapk通路对细胞产生影响,将提取的原代细胞铺与6孔板,每孔1x105个细胞,培养24小时后换上饥饿培养基过夜,第二天加入相应的通路抑制剂预处理一小时,再加入一定剂量的kgf-2作用于细胞,作用24h后进行总蛋白提取,通过western blot对蛋白进行定量分析。p38和erk1/2激酶共同抑制成纤维细胞对stap2的stat3信号转导
147.根据蛋白质组数据分析,丝裂原活化蛋白激酶(mitogen-activated protein kinase,mapk)信号通路参与kgf-2介导的细胞增殖及细胞迁移。
148.因此,研究mapk信号是否介导stap2的过表达,以响应stat3的磷酸化。在疤痕成纤维细胞的实验中添加了mapk途径的抑制剂。
149.结果表明,当p38途径被抑制时,kgf-2下调疤痕作用被抑制。而erk途径被抑制时,stap2表达下调。
150.此外,由于erk和p38途径的级联反应,在erk途径抑制剂存在下,kgf-2的调节作用得以增强。
151.表明,kgf-2可能通过p38途径调节stap2。
152.本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
153.对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1