一种光敏控释微针及其制备方法与流程
1.本发明属于经皮给药技术领域,具体涉及一种光敏控释微针及其制备方法。
背景技术:
2.缓释微针是一种作用皮内后,可实现药物持续、平缓递送的新型透皮给药制剂,适用于需长期给药,治疗窗窄药物的使用,具有减少给药次数,提高患者用药安全性和便利性等优点,极大地提高了患者的用药依从性,在新型微针给药制剂研究中占有重要地位。但现有技术中,缓释微针多采用微针吸收体液后溶胀释放药物的策略,如专利cn112472659、cn102202720等,此类缓释微针属于对药物缓释速率进行前置设定,对于不同的药物或不同的病症程度无法统一适用,即无法做到控释。hardy等人公开了一种光控缓释微针,由聚丙烯酸类交联聚合物物理包裹安息香与阿霉素的结合物,当受到光照时,安息香与阿霉素的结合物链断裂,释放药物阿霉素;该策略下,一方面药物的化学结构受到限制;另一方面,光敏基团需要在紫外光照下才能发生断裂释放药物,没有光照时,微针不能释放药物;再一方面,紫外光照射时无法精准控制而伤及被照肌肤,对人体伤害极大(hardy jg,larraneta e,donnelly r f,et al.hydrogel-forming microneedle arrays made from light-responsive materials for on-demand transdermal drug delivery[j].molecularpharmaceutics,2016,13(3).)。
技术实现要素:
[0003]
为解决上述技术问题,本发明提供一种光敏控释微针,该微针包括光敏基团交联的聚合物壳体,以及可装载药物和上转换纳米粉末的空腔。所述的上转换纳米粉末可将980nm近红外光转化为350~360nm的紫外光,聚合物壳体受刺激后交联密度下降,从而可根据光照时间后置调控缓释速率。980nm的近红外光对人体几乎不存在伤害且穿透性强,并且以聚合物壳体包裹上转换纳米粉末,可减少紫外线对体内其余组织的辐射,安全性强。
[0004]
本发明通过以下技术方案实现:
[0005]
一种光敏控释微针,所述微针包括壳体和空腔,所述壳体包括针体和基体。
[0006]
所述针体由聚(甲基乙烯基醚/马来酸)共聚物与丙烯酸酯类共聚物交联而成;所述丙烯酸酯类共聚物由丙烯酸酯类化合物与单体a共聚而成,所述单体a具有以下分子结构:
[0007][0008]
进一步的,所述丙烯酸酯类化合物选自甲基丙烯酸甲酯、甲基丙烯酸乙酯、丙烯酸乙酯、丙烯酸甲酯中的一种或组合。
[0009]
进一步的,所述聚(甲基乙烯基醚/马来酸)共聚物为液态,其特性粘度(1%水溶
液)为2.5~10dl/g。
[0010]
本发明通过在微针成型过程中,聚(甲基乙烯基醚/马来酸)共聚物中的羧基与丙烯酸酯类共聚物中的羟基进行缩合酯化反应成键。当受到紫外光照射下,酯键断裂,从而解交联。
[0011]
本发明提供单体a的制备方法,具体如下:在丙酮中溶解4
’‑
羟基安息香和甲基丙烯酸2-溴乙酯,并计入碳酸钾,升温至60℃回流反应8h,经纯化后得到单体a,为白色固体粉末。
[0012]
本发明提供丙烯酸酯类共聚物的制备方法,具体如下:按投料比混合丙烯酸酯单体和单体a,并加入引发剂,加热至80~100℃反应。
[0013]
本发明提供所述微针制备方法,具体如下:
[0014]
(1)制备酰氯化聚(甲基乙烯基醚/马来酸)共聚物:在氯仿中,将聚(甲基乙烯基醚/马来酸)共聚物和二氯亚砜混合,加热至60℃,搅拌6h,旋蒸挥发溶剂,所得产物在80℃烘箱中干燥24h,得到酰氯化的聚(甲基乙烯基醚/马来酸)共聚物,放在干燥环境下备用。
[0015]
(2)配置浇注液:在聚乙二醇中,将酰氯化聚(甲基乙烯基醚/马来酸)共聚物和丙烯酸酯类共聚物混合,加热至60℃搅拌均匀,超声除去气泡。
[0016]
(3)将步骤(2)得到的浇注液注入pdms模具,超声后,刮平至模具上表面没有液体残留,放入80℃烘箱中固化交联24h。
[0017]
(4)利用激光造孔对针体的最大横截面进行造孔,孔径体积为针体体积的1/3~1/5。
[0018]
(5)将载有上转换纳米粉末和活性药物的液溶胶注入孔中,继续放入烘箱中进行干燥固化。
[0019]
(6)在步骤(5)的模具上再浇注一层成膜聚合物,刮平后加压放入烘箱中继续干燥成膜,脱模即得到控释药物的微针阵列。
[0020]
本发明采用的上转换纳米粉末为nayf4:bi,yb。
[0021]
所述上转换纳米粉末和活性药物分散在含有溶胶的溶液中,溶胶干燥后呈固态,可根据药物的性质独立地选择不同的溶胶。
[0022]
所述聚乙二醇优选为peg-200~400,作为增塑剂的同时作为溶剂,在针体固化过程中中可减少溶剂挥发产生气泡。
[0023]
聚合物壳体干燥时具有很高的强度,可刺穿角质层和表皮层,当吸收体液后发生溶胀变软,由此为空腔内药物的缓释提供通路,即不接受光照的情况下微针有一定的缓释;当接受照射后,微针的交联密度下降,进一步加快缓释,即可根据光照时间调节微针的缓释速率。
[0024]
本发明具有如下优点和有益效果:
[0025]
按照本发明的制备方法可制备出标准化产品,再根据光照调节药物的释放速率,使用方便。包含微针阵列的贴片在皮肤内吸收体液中的水后只溶胀不溶解,可以长期贴敷于皮肤表面吸收体液在针体中形成微孔道达到缓释和控释的给药效果,用药完毕后可以整体拿出,具有优异的机械性能、控释效果明显。
附图说明
[0026]
图1为控释药物的微针贴片的结构示意图。
[0027]
图2为微针的实物图。
[0028]
图3为上转换纳米粉末在980nm光激发下的发射光谱图。
[0029]
图4为样品的压力随位移的变化曲线。
[0030]
图5为样品在不同光照时间下在pbs溶液中溶胀率随时间的变化曲线。
[0031]
图6为样品在不同光照时间下,药物缓释率随时间的变化曲线。
具体实施方式
[0032]
下面结合具体实施例对本发明做进一步详细说明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0033]
微针阵列的结构示意图参阅附图1,微针贴片包括壳体和空腔,所述壳体包括针体和基体,所述空腔通过激光造孔的方式制得。
[0034]
所述针体长300~600μm,最大横截面积(即上表面)的直径为150~200μm。所述基体厚度为0.5~1mm。所述空腔的体积为针体体积的1/3~1/5。
[0035]
光敏控释微针的实物图参阅附图2。
[0036]
所述针体由聚(甲基乙烯基醚/马来酸)共聚物与丙烯酸酯类共聚物交联而成。
[0037]
所述空腔用于负载含有上转换纳米粉末和活性药物。
[0038]
1.丙烯酸酯类共聚物的制备方法
[0039]
所述丙烯酸酯类共聚物为单体a与丙烯酸酯类单体的共聚物,丙烯酸酯类单体可选自甲基丙烯酸甲酯、甲基丙烯酸乙酯、丙烯酸乙酯、丙烯酸甲酯中的一种或组合。
[0040]
(1)制备单体a:在丙酮中加入4
’‑
羟基安息香和甲基丙烯酸2-溴乙酯,并计入碳酸钾,升温至60℃回流反应8h,反应结束后过滤,旋干后硅胶柱层析,以dcm为洗脱剂,干燥后得到白色固体粉末。所述4
’‑
羟基安息香和甲基丙烯酸2-溴乙酯的投料摩尔比为1:1.2,碳酸钾的加入量为4
’‑
羟基安息香质量的2%,产率为65~78%。
[0041]
单体a的1h-nmr,δ(cdcl3):2.11(c=c-ch3,s,3),4.37~4.58(o-ch2-ch2-o,t,4),5.18(o-h,s,1)6.42~6.44(ar-ch-co,d,1),6.57(c=ch2,s,2),6.77~6.80(ar
1-h,d,2),7.26~6.29(ar
1-h,d,2),7.55~7.61(ar
2-h,t,2),7.65~7.67(ar
2-h,t,1),8.02~8.04(ar
2-h,d,2)。
[0042]
(2)制备丙烯酸酯类共聚物,称取丙烯酸酯单体和单体a,在甲苯中溶解,加入bpo,加热至90℃聚合3h,得到的反应液在120~150℃下减压旋蒸得到粗产物,重新用dcm溶解,加入等体积硫代硫酸钠水溶液洗涤,洗至淀粉碘化钾试纸不变蓝,再以去离子水清洗,有机相旋干得到丙烯酸酯类共聚物;所述丙烯酸酯单体与单体a的摩尔比为3~5:1,所述bpo的加入量为单体总质量的1%。
[0043]
2.含有上转换纳米粉末和活性药物的溶胶溶液的制备方法
[0044]
(1)上转换纳米粉末nayf4:yb,bi的制备:将镧系氧化物bi2o3、yb2o3、y2o3和naoh的混合并溶解在温度95℃、浓度50%的三氟乙酸中,将混合溶液置于三颈烧瓶中,在氩气吹扫下蒸发至干燥。然后将油酸和油胺加入到三颈烧瓶中,并加热至120℃,磁力搅拌30min去除
水和氧气。在氩气保护下,以12℃/min左右的速度将溶液加热至275℃,并在此温度下剧烈搅拌0.5h。将混合物冷却至室温,倒入丙酮中,在超声波清洗器中超声沉淀,然后通过11000rpm离心10min,并用乙醇多次洗涤沉淀,即得到nayf4:yb,bi纳米晶体。
[0045]
(2)含有上转换纳米粉末和活性药物的溶胶溶液的制备
[0046]
本发明微针可负载的活性药物可以为化学类药物、护肤类成分,不建议负载蛋白、多肽类药物,由于在紫外辐射下,容易变质失活。
[0047]
液溶胶具体为多糖与金属盐的混合溶液。
[0048]
进一步的,所述多糖可选自明胶、透明质酸、海藻酸、果胶、卡拉胶、软骨素(硫酸)、葡聚糖(硫酸)、聚赖氨酸(polylysine)、普鲁兰多糖中的至少一种来源于生物的可溶性物质;所述金属盐可选自氯化铁、氯化钙、氯化铜中的一种。
[0049]
具体将上转换纳米粉末、活性药物、多糖、金属盐在溶液中混合均匀得到含有上转换纳米粉末和活性药物的溶胶溶液。
[0050]
所述液溶胶的溶剂根据活性药物的溶解度进行选择,优选为乙醇(脂溶性药物)、水(水溶性药物)。
[0051]
所述上转换纳米粉末、多糖、金属盐、溶剂的质量混合比例为2~10:40~60:1~10:100。
[0052]
3.微针制备方法
[0053]
(1)制备酰氯化聚(甲基乙烯基醚/马来酸)共聚物:在氯仿中,将聚(甲基乙烯基醚/马来酸)共聚物和二氯亚砜混合,加热至60℃,搅拌6h,旋蒸挥发溶剂,所得产物在80℃烘箱中干燥24h,得到酰氯化的聚(甲基乙烯基醚/马来酸)共聚物,放在干燥环境下备用;所述聚(甲基乙烯基醚/马来酸)共聚物的特性粘度为2.5~10(1%水溶液);所述聚(甲基乙烯基醚/马来酸)共聚物与二氯亚砜的投料质量比例为10:5。
[0054]
(2)配置浇注液:在聚乙二醇中,将酰氯化聚(甲基乙烯基醚/马来酸)共聚物和丙烯酸酯类共聚物混合,加热至60℃搅拌均匀,超声除去气泡;所述聚乙二醇为peg-200~400;所述酰氯化聚(甲基乙烯基醚/马来酸)共聚物、丙烯酸酯类共聚物的混合质量比例为2:2~3。
[0055]
(3)将步骤(2)得到的浇注液注入pdms模具,离心后,刮平至模具上表面没有液体残留,放入80℃烘箱中固化交联24h。
[0056]
(4)利用激光造孔对针体的最大横截面进行造孔,孔径体积为针体体积的1/3~1/5。
[0057]
(5)将载有上转换纳米粉末和活性药物的液溶胶注入孔中,继续放入烘箱中进行干燥固化。
[0058]
(6)在步骤(5)的模具上再浇注一层成膜聚合物,刮平后加压放入烘箱中继续干燥成膜,脱模即得到控释药物的微针阵列。
[0059]
所述成膜聚合物可以为步骤(3)的浇注液,也可以独立地选自:聚氨酯及其衍生物、硅胶及其衍生物、聚丙烯酸及其衍生物。
[0060]
进一步,可在步骤(5)和步骤(6)之间,在pdms模具的上表面涂覆一层黏胶剂,使其可粘附在皮肤表面。
[0061]
实施例1丙烯酸酯共聚物的制备
[0062]
称取丙烯酸酯单体和单体a,在甲苯中溶解,加入bpo,加热至90℃聚合3h,得到的反应液在120~150℃下减压旋蒸得到粗产物,重新用dcm溶解,加入等体积硫代硫酸钠水溶液洗涤,洗至淀粉碘化钾试纸不变蓝,再以去离子水洗,有机相旋干得到丙烯酸酯类共聚物;所述丙烯酸酯单体与单体a的摩尔比为3~5:1,所述bpo的加入量为单体总质量的1%。
[0063]
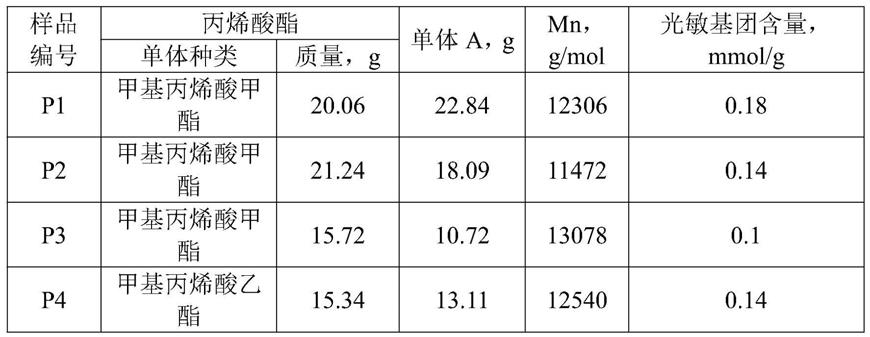
表1
[0064][0065]
mn用gpc测得,溶剂为四氢呋喃。
[0066]
光敏基团含量用1h-nmr测得,溶剂为cdcl3。
[0067]
实施例2上转换纳米粉末的制备
[0068]
上转换纳米粉末nay
0.978
f4:2%yb,0.2%bi的制备:将镧系氧化物0.002mmol bi2o3、0.02mmol yb2o3、0.978mmol y2o3和2mmol naoh的混合并溶解在温度95℃、浓度50%的三氟乙酸中,将混合溶液置于100ml三颈烧瓶中,在氩气吹扫下蒸发至干燥。然后将16ml油酸和8ml油胺加入到三颈烧瓶中,并加热至120℃,磁力搅拌30min去除水和氧气。在氩气保护下,以12℃/min左右的速度将溶液加热至275℃,并在此温度下剧烈搅拌0.5h。将混合物冷却至室温,倒入丙酮中,在超声波清洗器中超声沉淀,然后通过11000rpm离心10min,并用乙醇多次洗涤沉淀,即得到nay
0.978
f4:2%yb,0.2%bi纳米粉末。
[0069]
纳米粉末在980nm光激发下的发射光谱图参阅附图3。
[0070]
实施例3含有上转换纳米粉末和活性药物的液凝胶的制备
[0071]
本实施例以阿霉素为模型药物,制备液凝胶。
[0072]
具体制备方法:按投料比将多糖、上转换纳米粉末、阿霉素依次加入溶剂中,搅拌均匀后,超声使得上转化纳米粉末均匀分散于溶液中,然后边搅拌边缓慢滴加金属盐溶液(浓度为5g/l),得到负载纳米粉末和活性药物的液凝胶。
[0073]
表2
[0074]
[0075]
实施例4制备微针阵列
[0076]
配置浇注液,在聚乙二醇中,将酰氯化聚(甲基乙烯基醚/马来酸)共聚物(pvm/ma)和丙烯酸酯类共聚物混合,加热至60℃搅拌均匀,超声除去气泡;所述聚乙二醇为peg-200~400;所述酰氯化聚(甲基乙烯基醚/马来酸)共聚物、丙烯酸酯类共聚物的混合质量比例为2:2~3。
[0077]
浇注液各组分如下:
[0078]
表3
[0079][0080][0081]
上述浇注液均采用peg-200,加入peg-200对浇注液的粘度进行控制,粘度的测试均在30℃下进行。
[0082]
得到的浇注液注入pdms模具,然后在3000rpm下离心,刮平至模具上表面没有液体残留,放入80℃烘箱中固化交联24h。固化完毕后,静置冷却,再利用激光造孔对针体的最大横截面进行造孔,将载有上转换纳米粉末和活性药物的液溶胶(样品y2)利用针孔直径为80μm的细针注入孔中,注入量为0.5~0.8nl。
[0083]
再次离心后放入烘箱中进行干燥固化,固化温度为80~100℃,固化时间为24h。
[0084]
待冷却后,在模具表面再浇注一层浇注液,控制厚度为0.5~1mm,刮平后加压放入烘箱中继续干燥成膜,脱模即得到光敏控释微针阵列。
[0085]
本发明对基底的成膜聚合物不作出限定,可选择浇注液,也可以独立地选自:聚氨酯及其衍生物、硅胶及其衍生物、聚丙烯酸及其衍生物。
[0086]
试验一微针机械强度测试
[0087]
微针的机械强度用压力-拉力测试仪表征。具体做法是:将微针用双面胶贴在长方体铜台子上表面,置于压力-拉力测试仪水平载物台中央,测试范围为0.05n~60n,压缩速率为0.5mm/min,得到压力随位移的变化曲线。
[0088]
各样品在压缩位移为0.45mm的压力如表4所示,其中样品a1~a5的压力-位移曲线如图4所示。
[0089]
表4
[0090]
样品压力,n样品压力,na152a628
a264a737a348a847a453a955a542a1045
[0091]
从表4和图4结果可知,当样品中pvm/ma的相对含量越高、粘度越大,微针的机械强度越高;另外,在相同pvm/ma含量和粘度下,微针的机械强度随丙烯酸酯共聚物的光敏基团越多而越高;以上结果皆因微针的交联密度增加而导致的。
[0092]
试验二溶胀性能测试
[0093]
采用重量法对微针的溶胀性能进行测试。具体做法是:将微针贴片投入装有pbs(7.4)的缓冲溶液中,随即分别利用980nm光照射微针0min、5min、10min、20min、30min,在不同的时间取出微针贴片,用吸水纸吸掉表面多余的水分后称量,记录微针贴片的溶胀度随时间的变化。
[0094]
样品a4在不同光照时间溶胀率随时间的变化关系参阅附图5。
[0095]
从图中可知,随着光照时间的增加,微针的溶胀平衡时间减少,同时溶胀率也显著升高。当微针溶胀平衡后,微针里的液体才能与外部进行自由交换,因此在溶胀平衡前药物的释放速度较为缓慢。由此证明,通过调控光照时间,可以对微针的溶胀度和溶胀平衡时间进行调控。
[0096]
试验三体外缓释性能测试
[0097]
采用紫外分光光度法测溶液中阿霉素的吸光度对微针的缓释性能进行测试。具体做法是:绘制吸光度与浓度关系曲线;将微针贴片投入5ml装有pbs(7.4)的缓冲溶液中,随机分别利用980nm光照射微针0min、5min、10min、20min、30min,然后,在37℃条件下放置,每隔一定时间取出烧杯中溶液用紫外分光光度计测其在490nm出的吸光度,测试结束后及时将液体倒回烧杯,记录缓释率随时间的变化。
[0098]
样品a4在不同光照时间药物释放随时间的变化关系参阅附图6。
[0099]
从图中可知,在10h前药物的释放量较少,与上述试验二的结果相符,即微针溶胀平衡前药物释放效率较低,当达到溶胀平衡后,药物快速释放;另外,在100h左右,光照时间为10~30min的微针药物释放趋于稳定,释放率达95%。
[0100]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1