一种痰热清雾化吸入制剂及其应用的制作方法
1.本发明涉及医药制剂,具体涉及一种痰热清雾化吸入制剂及其应用。
背景技术:
2.近年来,随着人们对呼吸道疾病如哮喘、肺气肿、慢性阻塞性肺病和囊性纤维化等疾病的深入了解,已经认识到雾化吸入给药是治疗上述疾病较为简单有效的给药途径。与其他的给药途径相比,雾化吸入给药作用在肺部,具有吸收表面积大,吸收部位血流丰富以及避免肝脏首过效应的特点,而且肺部具有酶活性较低、上皮屏障较薄及通透性高等优点,此外,它还能降低药物在其他组织中的分布,可以大大降低不良反应。鉴于肺部给药的这些特点,雾化吸入给药研究发展迅速,肺部是雾化吸入给药的作用部位,但并非所有药液经雾化后,雾化粒子都能沉积肺部,进入肺部的粒子会发生惯性碰撞、沉降和扩散,粒子的粒径、形态和密度是决定粒子肺部沉积的重要因素。
3.痰热清注射液包括黄芩、熊胆粉、山羊角、金银花和连翘,用于清热、解毒、化痰,但由于中药注射剂直接注射入人体或静脉,因此其安全性日益受到关注,而临床上也有痰热清注射液引起一些毒副作用或过敏反应的报道,而将注射液制备成一些常规的口服制剂如口服液、片剂、胶囊等又存在生物利用度低,难以达到注射剂的治疗效果的缺陷。介于上述雾化吸入给药的优势,目前亟需一种痰热清雾化吸入剂型以改善痰热清注射液的效果。
技术实现要素:
4.为了克服现有技术中的缺陷,本发明提供了一种痰热清雾化吸入制剂及其应用。
5.为实现上述目的,本发明采用如下技术方案:
6.本发明的第一方面是提供一种痰热清雾化吸入制剂,将痰热清雾化吸入溶液置于雾化装置得到;该痰热清雾化吸入溶液包括活性成分、溶剂以及药学上可接受的载体,该活性成分包括黄芩、熊胆粉、山羊角、金银花和连翘的提取物;该雾化装置喷出药液的粒径为1~5μm。
7.进一步地,上述雾化装置为压缩空气式雾化器。
8.进一步地,上述雾化装置的空气动力学直径≤3.57μm。
9.进一步地,上述雾化装置为pari boy sx红芯雾化器。
10.进一步地,上述溶剂选用注射用水、生理盐水、等渗葡萄糖溶液中的至少一种。
11.进一步地,上述药学上可接受的载体包括稳定剂、等渗剂、ph调节剂中的一种或多种。
12.进一步地,上述稳定剂为丙二醇、乙醇、和甘油中一种或多种混合。
13.进一步地,上述活性成分由如下质量份数的原料的提取物制备而成:熊胆粉20~40份、山羊角20~200份、黄芩100~250份、金银花100~250份、连翘60~500份。
14.本发明的第二方面是提供上述痰热清雾化吸入制剂在祛痰止咳中的应用。
15.本发明的第三方面是提供上述痰热清雾化吸入制剂在治疗发热中的应用。
16.本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
17.本发明提供了一种痰热清雾化吸入制剂,筛选了体外沉积性能最佳的匹配的压缩空气式雾化器,药液经雾化器喷出后通过口鼻的粘膜吸收,具有吸收快、起效快的特点。此外,本发明验证了该痰热清雾化吸入制剂的给药方式可显著祛痰止咳,抑制发热,相对于现有的剂型具有显著的效果,且消除了注射液的毒副作用和过敏反应。
具体实施方式
18.本发明提供了一种痰热清雾化吸入制剂及其应用,确定了效果最佳的喷雾装置的性能参数并筛选了效果最佳的喷雾器,克服了现有注射液存在的弊端。
19.下面通过具体实施例对本发明进行详细和具体的介绍,以使更好的理解本发明,但是下述实施例并不限制本发明范围。
20.实施例中方法如无特殊说明的采用常规方法,使用的试剂如无特殊说明的使用常规市售试剂或按常规方法配制的试剂。
21.实施例1
22.本实施例提供一种痰热清雾化吸入制剂,其制备方法包括如下步骤:
23.步骤一,由上海凯宝药业有限公司提供的痰热清注射液用作痰热清雾化吸入溶液,其中活性成分包括如下重量份数的原料的提取物:熊胆粉40份、山羊角200份、黄芩250份、金银花250份、连翘500份;
24.步骤二,选用移液枪吸取痰热清雾化吸入溶液2ml,置入雾化装置中获得该痰热清雾化吸入制剂,该雾化装置喷出药液的粒径为1~5μm。
25.实施例2
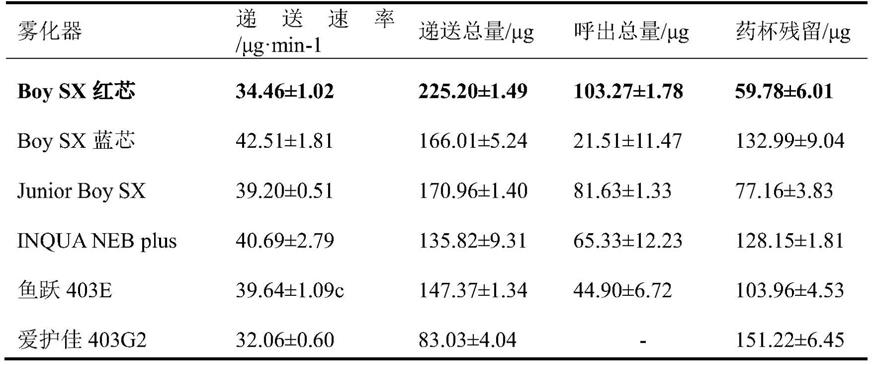
26.本实施例对比研究6种不同型号的空气压缩式雾化器,采用呼吸模拟器对递送性能进行考察,以新一代级联撞击器为测定装置,对体外粒径分布情况进行考察,以期优选出适合痰热清吸入溶液的性能最佳压缩空气式雾化器。
27.1.不同雾化器递送速率和递送总量的比较
28.选用移液枪吸取痰热清雾化吸入溶液2ml,置入雾化杯中,分别选用百瑞pari boy sx雾化器配备红、蓝两种性能不同的雾化杯内芯(德国百瑞有限公司)、百瑞inqua neb plus(德国百瑞有限公司)、百瑞pari junior boy sx(德国百瑞有限公司)、鱼跃403e雾化器(江苏鱼跃医疗设备股份有限公司)、爱护佳403g2雾化器(宁波吉丽医疗器械有限公司),雾化300s,用ngi检测微细粒子空气动力学特性,分别用50%乙醇洗涤收集杯,按照吸入制剂供雾化器用液体制剂项下有关规定(中国药典2020年版四部0111)测定,平行操作3次。结果见表1。
29.表1不同雾化器递送性能结果(n=3)
[0030][0031]
表1显示通过呼吸模拟器试验测定6种雾化器在成人模式下递送性能结果。pari boy sx蓝芯的雾化器递送速率最快,为42.51μg
·
min-1
,pari junior boy sx和鱼跃403e没有显著性差异,爱护佳403g2的递送速率最慢,为32.06μg
·
min-1
。从递送总量上可以看出,pari boy sx红芯的递送总量最高,达到252.20μg,其次为pari boy sx蓝芯和pari junior boy sx,二者没有显著性差异,最低的是爱护佳403g2,仅为83.03μg。从呼出总量看,六种雾化器呼出量差异显著。爱护佳403g2呼出量为0,原因是实验过程中发现该款雾化杯的上盖不能密封,在雾化过程中,大量雾化颗粒从雾化杯上口喷出,滤膜未收集到活性物质,该款药杯残留量最大,为151.22μg,pari boy sx蓝芯和inqua neb plus没有显著性差异,残留量为132.99μg和128.15μg,药杯中残留量最少的是pari boy sx红芯,仅为59.78μg。
[0032]
递送速率和递送总量是选择雾化器的重要指标之一,递送总量越高,雾化杯残留越低,雾化器越好,根据上述结果,我们选择百瑞pari boy sx红芯雾化器。
[0033]
2.不同雾化器微细粒子剂量的比较
[0034]
表2为通过ngi测定的六种雾化器空气动力学结果。mmad值最小的是pari boy sx红芯,为3.57μm,比其大一些的是pari junior boy sx,为4.13μm,pari boy sx蓝芯、inquaneb plus、鱼跃403e和爱护佳403g2四款雾化器的mmad值(空气动力学平均直径)没有显著性差异。fpf(%)值代指微细粒子有效沉积率,pari boy sx红芯最高,为69.69,其次是pari junior boy sx,达到59.98%,其余四款雾化器依次为52.33%、50.77%、49.53%、48.76%,没有显著性差异。gsd值是pari boy sx红芯最小,说明经其雾化后,粒径分布最窄。
[0035]
微细粒子剂量是选择雾化器的另一重要指标之一,mmad值(空气动力学直径越小),fpf(%)值(微细粒子有效沉积率)越高,雾化器越好,综合微细粒子剂量结果最佳的是百瑞pari boy sx红芯。
[0036]
表2不同雾化器微细粒子剂量(n=3)
[0037][0038]
综合各项检测结果,pari boy sx红芯雾化器对痰热清雾化吸入溶液体外沉积性能最佳。
[0039]
实施例3
[0040]
本实施例验证痰热清雾化吸入溶液的药理作用,具体的实验过程和结果如下:
[0041]
1.痰热清雾化吸入溶液止咳作用研究
[0042]
昆明小鼠,90只,体重16-18g,雌雄各半,适应性喂养3天后,采用人工计数并配合dsi公司研发的wbp系统自动检测计数。以1.1-1.3ml/min的速率雾化12-14%浓氨水刺激l2 s后记录小鼠的咳嗽潜伏期及3min内的咳嗽次数。取1min内咳嗽次数达3次以上的动物进行实验。选取合格小鼠80只,按照体重随机分为8组,模型组、阳性对照组(氢溴酸右美沙芬分散片)、阴性对照组(雾化生理盐水)、痰热清雾化给药高、中、低、极低4个剂量组、痰热清注射给药组,每组10只,雌雄各半;分别在给予氢溴酸右美沙芬分散片(18mg/kg)1h后、静脉给药组(剂量为3ml/kg)给药25-30min后、阴性对照组雾化生理盐水20min后和痰热清雾化给药4个剂量组分别雾化吸入痰热清雾化吸入溶液(高、中、低、极低剂量组分别雾化吸入给药20、10、5、2.5min)后立即利用wbp系统雾化12-14%氨水12s,诱导小鼠咳嗽完成造模,观察并记录小鼠咳嗽潜伏期以及3min内小鼠的咳嗽次数。
[0043]
结果显示,与模型组比较,阳性对照组给药后动物的咳嗽次数明显减少(p《0.001),能够在一定程度上减少咳嗽次数,p《0.001;与模型组比较,痰热清雾化给药高、中、低、极低4个剂量组均能够明显减少动物的咳嗽次数(p《0.001、p《0.01、p《0.001、p《0.01),4个剂量组均能够在一定程度上延长咳嗽潜伏期,但是无显著性差异;痰热清注射给药组能够在一定程度上减少咳嗽次数并延长咳嗽潜伏期,p《0.05、p《0.01。结果见表3。
[0044]
表3痰热清吸入溶液雾化给药对氨水引咳小鼠的影响
[0045][0046]
注:与模型组相比
*
p<0.05,
**
p<0.01,
***
p<0.001。
[0047]
2.痰热清雾化吸入溶液祛化痰作用研究
[0048]
icr小鼠,90只,体重16-18g,雌雄各半,动物适应性喂养3天,按照体重随机分为7组,每组10只,包括模型组、阳性对照组(盐酸氨溴索注射液)、痰热清雾化给药高、中、低、极低4个剂量组、痰热清注射给药组。模型组不做任何处理,阴性对照组雾化吸入生理盐水20min,阳性对照组尾静脉注射盐酸氨溴索注射液(6.5-7.0mg/kg),痰热清雾化给药4个剂量组和痰热清注射给药组给药剂量同上述实验,各组每天给药1次,连续给药3天。
[0049]
末次给药前1天禁食不禁水,末次给药后30min,每只小鼠腹腔注射2.5%酚红生理盐水溶液(250mg/kg),30min后脱颈处死小鼠,分离气管,将平头针头插入气管内约0.5cm,结扎固定后,用0.5ml5%碳酸氢钠溶液灌洗气管,静置30s,将灌洗液抽出注入试管内,重复3次,合并3次的灌洗液,静置30min后,2000r/min离心5min,吸取上清液用酶标仪测定555nm处的吸光度值,根据标准曲线方程折算出每只小鼠呼吸道酚红排出量,比较每组小鼠酚红排出量,即排痰量。
[0050]
实验结果显示,与模型组比较,阳性对照组给药后酚红排泌量均明显增加(p《0.01);与模型组相比,痰热清雾化给药高、中、低、极低4个剂量组以及注射给药组给药后酚红排泌量均明显增加(p《0.001、p《0.01、p《0.001、p《0.05、p《0.05),结果见表4
[0051]
表4痰热清雾化吸入溶液对小鼠气管酚红排泌量的影响
[0052][0053]
注:与模型组相比
*
p<0.05,
**
p<0.01,
***
p<0.001。
[0054]
3痰热清雾化吸入溶液对lps致大鼠发热模型治疗作用研究
[0055]
wistar大鼠100只,体重160-200g,雄性,适应性喂养后,所有动物用电子体温计测大鼠肛温(每次测定肛温前让动物排空粪便,电子体温计探头上用甘油润滑,轻轻插入大鼠肛门2cm,使适应环境和测温刺激,温度计稳定后读数),早晚一次,连续3天,选择肛温在36.5~37.5℃,且两次肛温波动在0.5℃以内的动物用于本实验。
[0056]
大鼠禁食不禁水16h后,测肛温2次,2次间隔30min,以两次平均值为动物基础体温。随机挑选10只动物为空白组(第1组),其余动物腹腔注射lps(10ml/kg)造模,空白组腹腔注射同体积生理盐水,腹腔注射后立即测肛温,之后每1小时测1次肛温,待温度升高(约4-6小时),温度升高0.6℃的记为合格,选取合格大鼠70只,随机分为7组,模型组(第2组)、阳性对照组(第3组)、痰热清雾化给药高(第4组)、中(第5组)、低(第6组)、极低(第7组)4个剂量组、痰热清注射给药组(第8组),每组10只。阳性对照组灌胃给药阿司匹林(200mg/kg),痰热清雾化给药4个剂量组和注射液给药剂量同上述实验分别雾化吸入痰热清雾化吸入溶液:高剂量雾化吸入20min给药,中剂量雾化吸入10min给药,低剂量雾化吸入5min给药,极低剂量组雾化给药2.5min,痰热清注射给药组尾静脉注射给药(剂量为2ml/kg),给药后立即开始监测肛温,连续4小时。各组数据用表示,组间t检验。
[0057]
实验结果显示,与空白组比较,腹腔注射lps后2小时后大鼠体温显升高,具有显著性差异(p《0.01),持续6小时;与模型组比较,阳性对照组给药后1h~4h,可使体温降低,具有显著性差异(p《0.001)。雾化给药后雾化高、中剂量组给药后1h动物体温升高值显著降低,药效均持续到药后4h,(p《0.05、p《0.01)雾化给药低剂量组药后3小时动物体温升高值显著降低,药效持续到药后4h,(p《0.05)。注射给药组药后2小时动物体温升高值显著降低,药效持续到药后3h(p《0.05)。结果见表5。
[0058]
表5痰热清雾化吸入溶液对lps引起的大鼠发热模型的解热作用(n=10,)
[0059][0060]
注:与正常对照组比较,
△
p《0.05,
△△
p《0.01;与模型对照组比较,
*
p《0.05,
**
p《0.01,
***
p《0.001。
[0061]
△
t为造模后不同时间大鼠肛温与基础体温的差值。
[0062]
以上对本发明的具体实施例进行了详细描述,但其只作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1