一种用于胃肠道恶性肿瘤靶点追踪的装置
1.本发明属于医疗技术领域,具体涉及一种用于胃肠道恶性肿瘤靶点追踪的装置。
背景技术:
2.恶性肿瘤即通常人们所述的癌症,其细胞分化和增殖异常,生长失去控制,具有浸润性和转移性等生物学特征,恶性肿瘤的发病因素通常是多因素、多步骤的,与吸烟、职业暴露、环境污染、遗传等多种因素相关。恶性肿瘤的临床表现可以为肿块、疼痛、溃疡、出血等,有局部症状,也有全身性症状,甚至还存在肿瘤转移的情况。
3.恶性肿瘤的检查包括基因检测、影像学检查、肿瘤标志物检测、病理组织检查等多种手段,各类检查结果综合评判后,给出诊断结果。
4.恶性肿瘤的治疗包括手术治疗(切除等)、化学治疗(利用化学药物杀死肿瘤细胞)、放射治疗(利用辐射线杀死肿瘤细胞)、靶向治疗(利用肿瘤特异性药物靶向结合并杀死肿瘤细胞)等多种治疗手段。
5.胃肠道肿瘤主要发生在胃、小肠或者大肠中,其可通过胃镜或者内镜来诊断疾病或者辅助治疗疾病,无论是上述恶性肿瘤的诊断还是治疗过程,精确或者较为精确的靶向追踪肿瘤位置均可提高诊断效率和治疗效率,减少对正常细胞的损伤。尤其是对于恶性肿瘤,靶向追踪其位置,对于了解其扩散转移位置、治疗扩散转移的病灶非常有帮助。
6.现有技术缺乏针对胃肠道肿瘤的靶点追踪装置。
技术实现要素:
7.为了解决上述技术问题,本发明提供了一种用于胃肠道恶性肿瘤靶点追踪的装置。
8.本发明的目的是提供一种用于胃肠道恶性肿瘤靶点追踪的装置,其为胶囊结构,所述胶囊结构包括胶囊壳和内容物,所述胶囊壳由以下重量份的原料组分制成:明胶50-70份、纯化水50-77份、稀酸(0.1-0.5mol/l的盐酸)0.5-1份、增塑剂(甘油)0.5-1份、壳聚糖1-3份;其中明胶与纯化水的重量份比例为1:1-1.1;
9.所述内容物的结构如下:包括母核,围绕所述母核外周分散设有多个支芽,多个支芽呈放射状或者星状分布,每个所述支芽的远离母核的端部设有载药球;
10.所述母核、支芽均由明胶、纯化水、增塑剂按照100:80-90:1-2的重量份比例混合并制成;
11.所述载药球由以下重量份的原料组分制成:明胶33-55份、纯化水30-50份、增塑剂0.8-1.2份、抗肿瘤药物30-40份;制备载药球的原料中,明胶和纯化水的重量份比例为1.1:1,且抗肿瘤药物的重量份小于等于明胶的重量份;
12.所述胶囊壳或者所述载药球上设有用于识别恶性肿瘤位置的追踪标记。
13.优选的,上述用于胃肠道恶性肿瘤靶点追踪的装置,所述载药球的制备方法如下:
14.按重量份比例称取明胶、纯化水、增塑剂和抗肿瘤药物;
15.将明胶、纯化水、增塑剂于真空度为-0.10~-0.05mpa、80-90℃条件下持续搅拌,得到明胶溶液,当明胶溶液无气泡后,降温至50-60℃;
16.加入抗肿瘤药物充分混合,置于载药球模具中干燥成型;或者,将抗肿瘤药物制成溶液,作为内容物原料,明胶溶液作为胶囊壳原料,利用胶囊机制成胶囊,干燥成型,得到载药球。
17.优选的,上述用于胃肠道恶性肿瘤靶点追踪的装置,所述载药球模具为球形或者椭球形,干燥条件为20-40℃干燥,载药球的水分含量低于5%。
18.优选的,上述用于胃肠道恶性肿瘤靶点追踪的装置,所述内容物的制备方法如下:
19.准备具有内容物的结构形状的内容物模具,将载药球放置在内容物模具中载药球的位置;
20.将明胶、纯化水、增塑剂(甘油)按照100:80-90:1-2的重量份比例混合,于真空度为-0.10~-0.05mpa、80-90℃条件下持续搅拌,当溶液无气泡后,降温至50-60℃,加入到内容物模具中,并使溶液将载药球包裹,20-40℃干燥,水分含量低于5%,得到内容物。
21.优选的,上述用于胃肠道恶性肿瘤靶点追踪的装置,所述用于胃肠道恶性肿瘤靶点追踪的装置的制备方法如下:
22.准备具有胶囊形状的胶囊壳模具,可以是椭球形或者球形或者半球形、半椭球形,将内容物放置在胶囊壳模具中;
23.按照胶囊壳的重量份配比称取各原料,将壳聚糖与稀酸混合均匀,得到壳聚糖物料,备用;
24.将明胶、纯化水、增塑剂混合,于真空度为-0.10~-0.05mpa、80-90℃条件下持续搅拌,当溶液无气泡后,降温至50-60℃,加入壳聚糖物料,继续搅拌使物料充分混合,得到胶囊壳溶液;
25.所述胶囊壳溶液或者载药球上设置用于识别恶性肿瘤位置的追踪标记;
26.将胶囊壳溶液加入到胶囊壳模具中,并使溶液将内容物包裹,20-40℃干燥,水分含量低于5%,得到用于胃肠道恶性肿瘤靶点追踪的装置。
27.优选的,上述用于胃肠道恶性肿瘤靶点追踪的装置,所述内容物的外表面先喷涂一层可食用液态保鲜膜,浸润内容物外表面,然后再放入胶囊壳模具中。
28.优选的,上述用于胃肠道恶性肿瘤靶点追踪的装置,所述载药球中还添加有3-5份的抗肿瘤药物的药效增强剂。
29.优选的,上述用于胃肠道恶性肿瘤靶点追踪的装置,所述胶囊壳和内容物的质量比例为1:1-1.5。
30.优选的,上述用于胃肠道恶性肿瘤靶点追踪的装置,还包括导丝和导管,所述导管用于插入胃肠插管内,所述导管的外壁分散设置有多个穿孔,每个所述穿孔处均设有一个所述胶囊结构,且所述穿孔的直径小于所述载药球的直径,所述导丝插入在导管内,且其头端管穿出所述穿孔并刺入胶囊结构内,其尾端延伸至导管外部。
31.优选的,上述用于胃肠道恶性肿瘤靶点追踪的装置,所述导管外壁设有可被影像识别的影像标记,比如不透x射线或者不透超声波的材料。
32.与现有技术相比,本发明具有以下有益效果:
33.1、本发明采用的壳聚糖溶于稀酸呈黏稠状,在稀酸中壳聚糖的β-1,4-糖苷键会慢
慢水解,生成低相对分子质量的壳聚糖,溶于酸性溶液形成带正电的阳离子基团,具有很强的吸附性,作为药物缓释材料,对人体细胞有很好的亲和性。人体服用胶囊后,胶囊壳在胃液中逐渐分解,胶囊壳中的壳聚糖释放出来,其与胃肠中细胞亲和,减少胶囊成分对人体细胞的刺激。
34.2、载药球的一个作用是负载抗肿瘤药物,便于靶向治疗,该抗肿瘤药物可以是抑制恶性肿瘤生长的靶向探针药物,该靶向探针药物具有荧光标记等可被检测到的追踪标记,通过检测药物的位置来识别追踪恶性肿瘤细胞的位置。该抗肿瘤药物还可以是不含探针的化疗药物,则需要配备可被追踪识别的纳米颗粒等,比如将“cn 104721843 b”专利制备的可被近红外荧光示踪的ph响应的疏水药物纳米胶囊20-40℃干燥至恒重,然后粉碎成200目以下的粉末,与化疗药充分混合,然后在用于制备载药球。
35.载药球的另一个作用是将其填充在胶囊壳内部,人体使用胶囊后,由于其中的壳聚糖对细胞的亲和力以及吸附能力,其可以靠近细胞,并且,胶囊壳在胃肠液中逐渐分解,载药球被释放出来,其上的抗肿瘤药物直接是贴近细胞作用的,药物不与口腔等非肿瘤部位接触,减少胃肠液、唾液等与抗肿瘤药物之间的非治病性作用,提高药物利用率。若载药球上设有用于识别恶性肿瘤位置的追踪标记,也可防止这些追踪标记在与人体其他部位接触而引起的不适感。
36.3、本发明将内容物设置为放射状或者星状,则每个载药球之间是分隔开的,则不同的载药球上可负载不同的抗肿瘤药物,随着不同载药球上明胶含量的不同,其缓释药物的时间是不同的,则可是不同抗肿瘤药物在不同时间内释放,并作用于肿瘤细胞,通过一次性给药完成不同时间、不同药物的释放,省去患者频繁记录吃药时间的麻烦。另外,由于放射状或者星状的形状具有多个支芽以及载药球,且内容物中支芽、母核、载药球中明胶与纯化水的重量份比值大于胶囊壳中相对应的明胶与纯化水的重量份比值,则内容物在胃肠道中的降解速度较慢,当胶囊壳分解掉以后,剩余的内容物所具有的支芽以及载药球可以快速附着在肿瘤组织处,以更好的发挥抗肿瘤药效,使得该种内容物结构特别适用于定向给药途径。
37.4、本发明提供的药效增强剂可以增强抗肿瘤药物对肿瘤细胞的抑制率。
附图说明
38.图1为实施例1-8的用于胃肠道恶性肿瘤靶点追踪的装置的结构示意图;
39.图2为实施例9的用于胃肠道恶性肿瘤靶点追踪的装置的结构示意图一;
40.图3为实施例9的用于胃肠道恶性肿瘤靶点追踪的装置的结构示意图二。
具体实施方式
41.为了使本领域技术人员更好地理解本发明的技术方案能予以实施,下面结合具体实施例和附图对本发明作进一步说明。
42.在本发明的描述中,如未特殊说明,所用试剂均为市售,所用方法均为本领域常规技术。
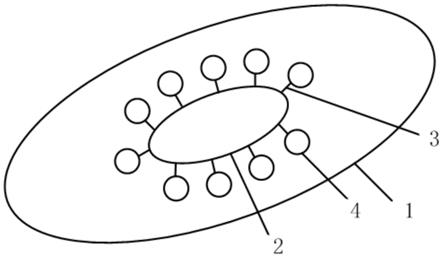
43.在本发明的描述中,需要理解的是,术语“中心”、“纵向”、“横向”、“长度”、“宽度”、“厚度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”、“顺时
针”、“逆时针”、“轴向”、“径向”、“周向”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。
44.术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征;在本发明的描述中,除非另有说明,“多个”的含义是两个或两个以上。
45.在本发明的描述中,除非另有明确的规定和限定,术语“安装”、“相连”、“连接”、“固定”等术语应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或成一体;可以是机械连接,也可以是电连接;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系,除非另有明确的限定。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
46.在本发明的描述中,除非另有明确的规定和限定,第一特征在第二特征“上”或“下”可以是第一特征和第二特征直接接触,或第一特征和第二特征通过中间媒介间接接触。而且,第一特征在第二特征“之上”、“上方”和“上面”可是第一特征在第二特征正上方或斜上方,或仅仅表示第一特征水平高度高于第二特征。第一特征在第二特征“之下”、“下方”和“下面”可以是第一特征在第二特征正下方或斜下方,或仅仅表示第一特征水平高度小于第二特征。
47.实施例1
48.一种用于胃肠道恶性肿瘤靶点追踪的装置,参见图1,其为胶囊结构,所述胶囊结构包括胶囊壳1和内容物,所述胶囊壳1由以下重量份的原料组分制成:明胶70份、纯化水77份、0.2mol/l的盐酸1份、甘油1份、壳聚糖3份;其中明胶与纯化水的重量份比例为1:1.1;
49.所述内容物的结构如下:包括母核2,围绕所述母核2外周分散设有多个支芽3,多个支芽3呈放射状分布,每个所述支芽3的远离母核2的端部设有载药球4;
50.所述母核2、支芽3均由明胶、纯化水、甘油按照100:80:1的重量份比例混合并制成;
51.所述载药球4由以下重量份的原料组分制成:明胶55份、纯化水50份、甘油0.8份、抗肿瘤药物40份;制备载药球4的原料中,明胶和纯化水的重量份比例为1.1:1;
52.所述胶囊壳1或者载药球4上设有用于识别恶性肿瘤位置的追踪标记。
53.实施例2
54.一种用于胃肠道恶性肿瘤靶点追踪的装置,其为胶囊结构,所述胶囊结构包括胶囊壳1和内容物,所述胶囊壳1由以下重量份的原料组分制成:明胶50份、纯化水50份、0.5mol/l的盐酸0.5份、甘油0.5份、壳聚糖1份;其中明胶与纯化水的重量份比例为1:1;
55.所述内容物的结构如下:包括母核2,围绕所述母核2外周分散设有多个支芽3,多个支芽3呈放射状分布,每个所述支芽3的远离母核2的端部设有载药球4;
56.所述母核2、支芽3均由明胶、纯化、甘油水按照100:80:2的重量份比例混合并制成;
57.所述载药球4由以下重量份的原料组分制成:明胶44份、纯化水40份、甘油1.2份、抗肿瘤药物35份;制备载药球4的原料中,明胶和纯化水的重量份比例为1.1:1;
58.所述胶囊壳1或者载药球4上设有用于识别恶性肿瘤位置的追踪标记。
59.实施例3
60.一种用于胃肠道恶性肿瘤靶点追踪的装置,其为胶囊结构,所述胶囊结构包括胶囊壳1和内容物,所述胶囊壳1由以下重量份的原料组分制成:明胶60份、纯化水66份、0.1mol/l的盐酸0.8份、甘油0.8份、壳聚糖2份;其中明胶与纯化水的重量份比例为1:1.1;
61.所述内容物的结构如下:包括母核2,围绕所述母核2外周分散设有多个支芽3,多个支芽3呈星状分布,每个所述支芽3的远离母核2的端部设有载药球4;
62.所述母核2、支芽3均由明胶、纯化水、甘油按照100:90:2的重量份比例混合并制成;
63.所述载药球4由以下重量份的原料组分制成:明胶33份、纯化水30份、甘油1.1份、抗肿瘤药物30份;制备载药球4的原料中,明胶和纯化水的重量份比例为1.1:1;
64.所述胶囊壳1或者载药球4上设有用于识别恶性肿瘤位置的追踪标记。
65.实施例4
66.一种实施例1所述的胃肠道恶性肿瘤靶点追踪的装置的制备方法,如下:
67.步骤一,制备载药球4
68.按实施例1载药球4的原料重量份比例称取明胶、纯化水、甘油和抗肿瘤药物;
69.将明胶以及纯化水、甘油于真空度为-0.05mpa、温度为90℃条件下持续搅拌,得到明胶溶液,当明胶溶液无气泡后,降温至60℃;
70.加入抗肿瘤药物充分混合,置于载药球模具中干燥成型,得到载药球4;
71.所述载药球模具为圆形,干燥条件为20℃或者40℃干燥,载药球4的水分含量低于5%;
72.步骤二,制备内容物
73.准备具有内容物结构形状的内容物模具,将载药球4放置在内容物模具中载药球4的位置;
74.按照实施例1的母核、支芽的原料重量份比例将所述明胶、纯化水、甘油混合,于真空度为-0.10mpa、温度为80℃条件下持续搅拌,当溶液无气泡后,降温至50℃,加入到内容物模具中,并使溶液将载药球4包裹,20℃干燥,水分含量低于5%,得到内容物;
75.步骤三,制备胶囊结构
76.准备具有胶囊壳1结构的胶囊壳模具,可以是椭球形或者球形或者半球形、半椭球形,将内容物放置在胶囊壳模具中;
77.按照实施例1的胶囊壳1的原料重量份配比称取各原料,将壳聚糖与稀酸混合均匀,得到壳聚糖物料,备用;
78.将明胶、纯化水、甘油混合,于真空度为-0.10mpa、温度为80℃条件下持续搅拌,当溶液无气泡后,降温至50℃,加入壳聚糖物料,继续搅拌使物料充分混合,得到胶囊壳溶液;
79.所述胶囊壳溶液或者载药球4上设置用于识别恶性肿瘤位置的追踪标记;
80.将胶囊壳溶液加入到胶囊壳模具中,并使溶液将内容物包裹,20℃干燥,水分含量低于5%,得到用于胃肠道恶性肿瘤靶点追踪的装置。
81.实施例5
82.一种实施例2所述的胃肠道恶性肿瘤靶点追踪的装置的制备方法,如下:
83.步骤一,制备载药球4
84.按实施例2的载药球4的原料重量份比例称取明胶、纯化水、甘油和抗肿瘤药物;
85.将明胶以及纯化水、甘油于真空度为-0.10mpa、温度为80℃条件下持续搅拌,得到明胶溶液,当明胶溶液无气泡后,降温至50℃;
86.加入抗肿瘤药物充分混合,置于载药球模具中干燥成型,得到载药球4;
87.所述载药球模具为椭球形,干燥条件为30℃干燥,载药球4的水分含量低于5%;
88.步骤二,制备内容物
89.准备具有内容物结构形状的内容物模具,将载药球4放置在内容物模具中载药球4的位置;
90.按照实施例2的母核、支芽的原料重量份比例将所述明胶、纯化水、甘油混合,于真空度为-0.05mpa、温度为90℃条件下持续搅拌,当溶液无气泡后,降温至60℃,加入到内容物模具中,并使溶液将载药球4包裹,40℃干燥,水分含量低于5%,得到内容物;
91.步骤三,制备胶囊结构
92.准备具有胶囊壳1结构的胶囊壳模具,可以是椭球形或者球形或者半球形、半椭球形,将内容物放置在胶囊壳模具中;
93.按照实施例2的胶囊壳1的原料重量份配比称取各原料,将壳聚糖与稀酸混合均匀,得到壳聚糖物料,备用;
94.将明胶、纯化水、甘油混合,于真空度为-0.05mpa、温度为90℃条件下持续搅拌,当溶液无气泡后,降温至60℃,加入壳聚糖物料,继续搅拌使物料充分混合,得到胶囊壳溶液;
95.所述胶囊壳溶液或者载药球4设置用于识别恶性肿瘤位置的追踪标记;
96.将胶囊壳溶液加入到胶囊壳模具中,并使溶液将内容物包裹,40℃干燥,水分含量低于5%,得到用于胃肠道恶性肿瘤靶点追踪的装置。
97.实施例6
98.一种实施例3所述的胃肠道恶性肿瘤靶点追踪的装置的制备方法,与实施例4所述方法基本相同,区别在于:各部件的重量份配方采用实施例3的配方。
99.实施例7
100.一种实施例1所述的胃肠道恶性肿瘤靶点追踪的装置的制备方法,与实施例4所述方法基本相同,区别在于:
101.所述载药球4由以下重量份的原料组分制成:明胶55份、纯化水50份、甘油0.8份、抗肿瘤药物40份、药效增强剂3份。
102.载药球4的制备方法如下:
103.按实施例7载药球4的原料重量份比例称取明胶、纯化水、甘油和抗肿瘤药物;
104.将明胶以及纯化水、甘油于真空度为-0.05mpa、温度为90℃条件下持续搅拌,得到明胶溶液,当明胶溶液无气泡后,降温至60℃;
105.加入抗肿瘤药物、药效增强剂充分混合,置于载药球模具中干燥成型,得到载药球4;
106.所述载药球模具为圆形,干燥条件为20℃或者40℃干燥,载药球4的水分含量低于5%。
107.实施例8
108.一种实施例1所述的胃肠道恶性肿瘤靶点追踪的装置的制备方法,与实施例7所述方法基本相同,区别在于:
109.所述载药球4由以下重量份的原料组分制成:明胶55份、纯化水50份、甘油0.8份、抗肿瘤药物40份、药效增强剂5份。
110.需要说明的是,上述实施例4-8所述方法制备的胶囊结构,可直接口服,具体用药剂量根据胶囊结构中抗肿瘤药物的有效含量以及患者对抗肿瘤药物的需求量进行计算。
111.需要说明的是,上述实施例4-8所述方法中,所述内容物的外表面先喷涂一层可食用液态保鲜膜,浸润内容物外表面,然后再放入胶囊壳模具中,比如cn104073000a所记载的液态保鲜膜,其既具有抗菌作用,防止抗肿瘤药物被细菌污染,也可与胶囊壳1形成一层分界面,由于胶囊壳1以及保鲜膜在体内均需要分解,则内容物分解开始的时间明显晚于胶囊壳1,使得内容物与体内环境直接接触时,其形状依然维持良好的放射状或者星状形态。
112.实施例9
113.一种用于胃肠道恶性肿瘤靶点追踪的装置,参见图2-3,在实施例1-3任一项的基础上新增导丝5和导管6,所述导管6用于插入胃肠插管7内,所述胃肠插管7选择现有技术的灌肠或者向胃中注入流食的插管7,所述导管6的外壁分散设置有多个穿孔,每个所述穿孔处均设有一个所述胶囊结构,且所述穿孔的直径小于所述载药球4的直径,所述导丝5插入在导管6内,且其头端管穿出所述穿孔并刺入胶囊结构内,其尾端延伸至导管6外部,便于手持操作。所述导丝5用于将胶囊结构固定或者释放。
114.本实施例的工作原理如下:向导管6中插入导丝5,并使导丝5头端管穿出所述穿孔并刺入胶囊结构内,其尾端延伸至导管6外部,然后将制备好的胶囊结构的用于胃肠道恶性肿瘤靶点追踪的装置穿刺在导丝5头端,注意,不要刺破载药球4,优选的,将胶囊结构贴着导管6外壁放置,获得给药导管,备用;对于需要靶向追踪和给药的恶性肿瘤位置,将胃肠插管7(为胃插管或者肠插管)将插入患处,并尽量靠近恶性肿瘤位置,胃肠插管7的插入方法参考现有技术,然后将给药导管的头端先插入胃肠插管7内,然后从给药导管的尾端控制,使给药导管逐渐进入胃肠插管7内,并且其具有载药球4的端部尽量靠近恶性肿瘤,参见图2,然后拔出任一导丝5,则载药球4在穿孔的阻挡下,其与相应的导丝5分离,完成一次给药操作,参见图3,通过追踪胶囊结构的位置可判断给药位置,随着所有导丝5的拔出,则所有载药球4的给药操作完成,取出胃肠插管7、导管6、导丝5。
115.需要说明的是,所述导管6外壁设有可被影像识别的影像标记,比如不透x射线或者不透超声波的材料,便于观察给药操作。
116.优选的,在不同载药球4内放置不同的抗肿瘤药物,抗肿瘤药物,根据前次给药位置调整后一次给药位置,尽量保证每种抗肿瘤药物都尽可能靶向治疗恶性肿瘤。
117.实验例1抑制胃癌细胞活性实验
118.本实验例选择的药效增强剂为维生素e和辣椒素,本实验选择的细胞株为胃癌三种细胞株mgc-803、bgc-823、sgc-7901。
119.采用mtt比色法检测各细胞株的活性,以不添加任何药物的作为空白对照,以添加药物的作为实验组。先将细胞株贴壁培养,约孵育48h左右,然后按照空白对照和实验组的药物浓度设置分别添加相应的药物,继续孵育48h后,洗涤细胞,更换新的培养基,然后mtt以及二甲基亚砜进行处理,最终测570nm吸光值,计算细胞活性。
120.胃癌细胞活性计算结果见表1,空白对照的抑制率视为0,结果显示,维生素e和辣椒素具有很好的抑制为癌细胞活性的作用,抑制率高达50%以上。
121.表1不同剂量药物对肿瘤细胞的细胞活性影响
[0122][0123][0124]
实施例2增强抗肿瘤药效实验
[0125]
本实验例选择的药效增强剂为维生素e和辣椒素,选择的抗肿瘤药物为甲磺酸阿帕替尼片(江苏恒瑞医药股份有限公司),本实验选择的细胞株为胃癌三种细胞株mgc-803、bgc-823、sgc-7901。表2的添加量中,甲磺酸阿帕替尼片用量以阿帕替尼量计。
[0126]
采用mtt比色法检测各细胞株的活性,以不添加任何药物的作为空白对照,以添加药物的作为实验组。先将细胞株贴壁培养,约孵育48h左右,然后按照空白对照和实验组的药物浓度设置分别添加相应的药物,继续孵育48h后,洗涤细胞,更换新的培养基,然后mtt以及二甲基亚砜进行处理,最终测570nm吸光值,计算细胞活性。
[0127]
胃癌细胞活性计算结果见表2,下表2中,空白对照的抑制率视为0,药物添加浓度与药物名称的先后顺序相对应,结果显示,维生素e与阿帕替尼联合,以及辣椒素与阿帕替尼联合,比单纯的阿帕替尼抑制癌细胞的效果。
[0128]
表2不同剂量药物对肿瘤细胞的细胞活性影响
[0129]
[0130][0131]
需要说明的是,本发明中未特别提及的部件连接关系均默认采用现有技术,由于其不涉及发明点,且为现有技术普遍应用,故不详述结构连接关系。
[0132]
需要说明的是,本发明中涉及数值范围时,应理解为每个数值范围的两个端点以及两个端点之间任何一个数值均可选用,由于采用的步骤方法与实施例相同,为了防止赘述,本发明描述了优选的实施例。尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例做出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
[0133]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1