抗体的位点特异性修饰方法与流程
抗体的位点特异性修饰方法
【技术领域】
1.本发明涉及核医学领域,特别是用于诊断或治疗癌症。
背景技术:
2.为了递送医学上感兴趣的离子(ions)或放射性核素(radionuclides),形成稳定络合物的合适螯合剂(chelating agents)至关重要。此外,螯合剂可以与单克隆抗体偶联(be conjugated to)以实现对癌细胞的靶向递送。对于癌症的靶向治疗所产生的构建体(constructs,所谓的生物偶联抗体、抗体有效载荷偶联物或抗体药物偶联物(adc))越来越令人感兴趣。然后,经修饰的抗体可以积聚在肿瘤细胞中,集中放射性核素的放射性效应。
3.adc已获得fda批准(adcetris、kadcyla、besponsa和mylotarg),所有这些adc的有效载荷都以非位点特异性方式(a non-site specific manner)化学连接至抗体。因此,所得产物在抗体和有效载荷之间的化学计量关系(有效载荷-抗体比或药物-抗体比,或dar)以及抗体上的结合位点方面均具有高度异质性。虽然在相同的药物产品中,但每种产生的物质可能具有不同的性质,可能导致广泛不同的体内药代动力学性质和活性。
4.研究表明,与非位点特异性adc相比,位点特异性药物连接可导致显著更高的肿瘤摄取和非靶向组织中降低的摄取。这些数据表明,与化学修饰的adc相比,化学计量明确的adc显示出更好的药代动力学和更好的治疗指标。
5.作为位点特异性技术(a site-specific technology),酶促偶联(enzymatic conjugation)已显示出极大的兴趣,因为这些偶联反应通常很快,并且可以在生理条件下进行。在可用的酶中,来自物种茂原链霉菌的转谷氨酸酶(mtg)作为包括抗体在内的功能部分的常规化学蛋白质偶联的有吸引力的替代品,已发现越来越受关注。mtg在生理条件下催化蛋白质或肽的“反应性”谷氨酰胺与蛋白质或肽中的“反应性”赖氨酸残基之间的转酰胺反应,而后者也可以是简单的低分子量伯胺,如5-氨基戊基基团。
6.jeger等人(angew.chem.int.ed.2010,49,9995-9997)和denner等人(bioconjugate chemistry 2014,25,569-578)报告说,mtg通常只靶向少数谷氨酰胺,因此使mtg成为位点特异性和化学计量蛋白质修饰的有吸引力的工具。谷氨酰胺295(q295)被确定为不同igg类型的重链上唯一的反应性谷氨酰胺,可被具有低分子量伯胺底物的mtg特异性靶向(jeger等人)。
7.denner等人已经证明,只有在用pngase f去除天冬酰胺残基297(n297)处的聚糖部分后,才能定量偶联至q295,而糖基化抗体不能有效偶联。
8.wo 2017/025179公开了一种蛋白质位点特异性生物结合方法,以产生包含至少一个含酰基谷氨酰胺的氨基供体序列的蛋白质,该序列经由γ-谷氨酰基-酰胺键共价连接至包含氨基供体的底物,其中至少一个含酰基谷氨酰胺的氨基酸供体序列至少包含氨基酸序列tyfqayg。因此,wo 2017/025179的方法需要预先对蛋白质进行繁琐的工程处理,以便将其连接至含酰基谷氨酰胺的氨基酸标签上。
9.因此,仍然需要提供一种简单而有效的方法,以限定的dar和位点特异性方式获得
与抗体与螯合剂的生物偶联。
技术实现要素:
10.本发明涉及一种以产生限定的螯合剂-抗体比(car)的方式将抗体与螯合剂位点特异性偶联的方法,所述方法稳健且易于实施。
11.该方法不涉及对每个感兴趣的抗体进行基因工程、培养和纯化,这在许多生物结合方案中很常见。相反,该方法允许使用任何抗体与螯合剂生物偶联。
12.根据一个目的,本发明涉及一种用于制备式(i)的位点特异性生物偶联抗体的方法:
13.ab-(连接物-螯合剂)nꢀꢀ(i)14.其中
15.ab是抗体,
16.连接物是具有cooh末端和n-末端的寡肽,
17.螯合剂是金属螯合剂,
18.n是螯合剂-抗体比(car),其中0《n≤2;
19.所述方法包括:
[0020]-所述抗体的酶促去糖基化;
[0021]-在转谷氨酰胺酶的存在下使获得的去糖基化抗体与式(a)化合物偶联:
[0022]
连接物-螯合剂(a)
[0023]
所述方法的特征在于:
[0024]
所述连接物在其n-末端与ab结合,并包含选自(*g-g-g)、(*k-g-g)和(*a-k-a)的序列,
[0025]
其中*表示与ab共价结合的连接物的n-末端。
[0026]
本文所用的ab是指抗体,尤其是单克隆抗体,如人重组单克隆抗体,特别是对癌抗原具有特异性,如cd38、her2、vegf、egfr等,以靶向癌细胞。它特别包括g型免疫球蛋白,如igg1、igg2、igg3和igg4。本发明意义上的合适抗体包括贝伐单抗、西妥昔单抗、曲妥珠单抗、达雷妥尤单抗、帕尼单抗、利妥昔单抗。
[0027]
本文所用的“位点特异性(site specific)”是指在抗体上发生式(a)化合物连接的位置。通常,该位置是igg的谷氨酰胺295(q295),其中微生物转谷氨酰胺酶(mtg)用于生物偶联。这对应于mtg特异性靶向的不同igg类型重链上的反应性谷氨酰胺。
[0028]“寡肽(oligopeptide)”是指通过肽(酰胺)键连接的少于15个氨基酸的短链。通常,寡肽链具有氨基末端基团(或n-末端)和羧基(cooh)末端基团或c-末端。因此,根据本发明,连接物在其n-末端与抗体(ab)共价结合,并经由其c-末端与螯合剂共价结合。
[0029]
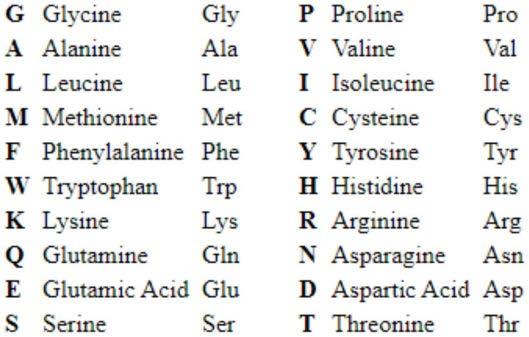
如本文所用,氨基酸可由其1-字母代码指定,如下所示:
[0030][0031]
glycine:甘氨酸
[0032]
alanine:丙氨酸
[0033]
leucine:亮氨酸
[0034]
methionine:蛋氨酸
[0035]
phenylalanine:苯丙氨酸
[0036]
tryptophan:色氨酸
[0037]
lysine:赖氨酸
[0038]
glutamine:谷氨酰胺
[0039]
glutamic acid:谷氨酸
[0040]
serine:丝氨酸
[0041]
proline:脯氨酸
[0042]
valine:缬氨酸
[0043]
isoleucine:异亮氨酸
[0044]
cysteine:半胱氨酸
[0045]
tyrosine:酪氨酸
[0046]
histidine:组氨酸
[0047]
arginine:精氨酸
[0048]
asparagine:天冬酰胺
[0049]
asparatic acid:天冬氨酸
[0050]
threonine:苏氨酸
[0051]
根据一个实施方式,连接物选自式:-*g-g-g-(x)p-、-*k-g-g-(x)p-、-*a-k-a-(x)p-的那些连接物,
[0052]
其中*表示与ab共价结合的连接物的n-末端。
[0053]
x是氨基酸,且p是使得0≤p≤10的整数。
[0054]
根据一个实施方式,所述连接物至少包含*g-g-g序列。通常,所述连接物可选自-g-g-g-或-g-g-g-g-。
[0055]
根据优选实施方式,所述连接物是g-g-g。
[0056]
car指的是螯合剂-抗体比。应当理解,如上所定义的式(i)化合物可以是具有各种car的化合物(i)的混合物。它通常作为平均值给出。因此,n表示所述混合物的平均car(数量)。
[0057]
可通过完整质量分析进行测量,如wong等人“precise characterization of intact monoclonal antibodies by the agilent 6545xt advancebio lc/q-tf,application note,agilent technologies,2017”所描述的。
[0058]
根据一个实施方式,本发明的方法允许实现包括0.5至2、尤其是1至2、通常约1.5+/-0.5的car。
[0059]
酶促去糖基化是指去除抗体的聚糖部分,通常在天冬酰胺残基297(n297)。
[0060]
根据一个实施方式,酶促去糖基化用n-糖苷酶进行。
[0061]
《n-糖苷酶》是指催化内部糖苷键断裂的酶。
[0062]
通常,n-糖苷酶是pngase f(来自脑膜脓毒性黄杆菌的蛋白质n-糖苷酶f)。
[0063]
pngase f可商购,可从例如roche或r&d systems购买。
[0064]
本发明意义上的术语“螯合剂”用于限定能够螯合金属(即)以与单个中心金属原子形成两个或更多个单独配位键的化合物。这种螯合剂通常是化合物,其结构允许它们的两个或更多个供体原子(或位点)同时连接至同一金属离子上,并通过螯合作用产生一个或多个环。
[0065]
根据一个实施方式,螯合剂选自可螯合放射性金属同位素的螯合剂。
[0066]
根据一个实施方式,螯合剂可以为式(ii):
[0067][0068]
其中在式(ii)中:
[0069]
r5、r6和r8各自独立地选自由h、(c
1-c6)烷基、(c
1-c6)烷基-c(=o)-or
25
和(c
1-c6)烷基-c(=o)-n(-r
25
)-r
26
组成的组;
[0070]
r9、r
10
、r
11
、r
12
、r
15
、r
16
、r
17
、r
18
、r
19
、r
20
、r
21
、r
22
、r
23
和r
24
各自独立地选自由h、(c
1-c6)烷基组成的组;
[0071]
r7独立地选自由h、(c
1-c6)烷基、(c
1-c6)烷基-c(=o)-n(-r
25
)-r
26
和l
1-组成的组;
[0072]r13
和r
14
各自独立地选自由h、(c
1-c6)烷基和l
1-组成的组;
[0073]r25
和r
26
各自独立地选自由h、(c
1-c6)烷基和(c
1-c6)烷基-c(=o)-oh组成的组;
[0074]
螯合剂通过l
1-与连接物结合;
[0075]
如果一个l
1-存在于r7、r
13
或r
14
,另一个r7、r
13
和r
14
分别为h、(c
1-c6)烷基或(c
1-c6)烷基-c(=o)-n(-r
25
)-r
26
,如上所述;
[0076]
l
1-独立地选自由(c
1-c6)烷基-c(=o)-nh-(c
1-c6)alkyl-c(=o)-nh-、(c
1-c6)烷
基-(c6h4)-nh-c(=s)-nh-、c(-co2h)-(c
1-c6)烷基-(c6h4)-nh-c(=s)-nh-、(c
1-c6)烷基-c(=o)-nh-、(c
1-c6)烷基-c(=o)-nh-(c
1-c6)烷基-nh-、(c
1-c6)烷基-(c6h4)-nh-和(c
1-c6)烷基-c(=o)-(o-ch
2-ch2)
1-20-c(=o)-nh-组成的组。
[0077]
特别是,在式(ii)中:
[0078]
r5、r6和r8表示(c
1-c6)烷基-c(=o)-n(-r
25
)-r
26
;
[0079]
r9、r
10
、r
11
、r
12
、r
13
、r
14
、r
15
、r
16
、r
17
、r
18
、r
19
、r
20
、r
21
、r
22
、r
23
、r
24
、r
25
和r
26
表示h;
[0080]
r7表示l1;
[0081]
并且l
1-表示(c
1-c6)烷基-c(=o)-nh-(c
1-c6)烷基-nh-或(c
1-c6)烷基-(c6h4)-nh-;
[0082]
根据替代的实施方式,螯合剂-衍生自以下螯合剂前体:
[0083]
[0084]
[0085]
[0086][0087]
isothiocyantobenzyl:异硫氰酸苄基
[0088]
aminobenzyl:氨基苄基
[0089]
如上所使用,螯合剂前体定义为当与连接物偶联时适合形成上述式(a)的化合物的化合物。
[0090]
通常,螯合剂前体是dota、dotam、dotam-ch
2-ch
2-nh2、ncs-tcmc或nh
2-tcmc,更优选nh
2-tcmc。
[0091]
本文中使用的金属通常指金属的放射性同位素,其可能在核医学中有用。此类放射性核素包括:
66
ga、
68
ga、
86
y、
90
y、
111
in、
212
pb、
212
bi、
213
bi、
89
zr、
177
lu、
225
ac,更优选
212
pb(铅-212)。
[0092]“转谷氨酰胺酶”是指可以催化谷氨酰胺残基侧链的γ-羧酰胺基团(-(c=o)nh2)和赖氨酸残基侧键的ε-氨基基团(-nh2)之间形成异肽键,并随后释放氨(nh3)的酶。
[0093]
根据一个实施方式,谷氨酰胺转胺酶是微生物谷氨酰胺转氨酶。通常,转谷氨酰胺酶可以是来自物种茂原链霉菌的转谷氨酸酶mtgase。
[0094]
这种转谷氨酰胺酶是商业上可获得的,例如zedira销售的mtgase酶。
[0095]
根据本发明,方法包括用n-糖苷酶f(pngase f)对抗体进行去糖基化的步骤。该酶通过在n-连接糖蛋白的最内层glcnac和天冬酰胺残基之间切割n-连接寡糖来发挥作用,如图1所示。
[0096]
根据一个实施方式,这导致天冬酰胺残基297(n297)处的聚糖部分被去除。
[0097]
去糖基化反应通常可在20℃至40℃、通常约23℃至37℃的温度和1至24小时、通常约15至24小时进行。所使用的n-糖苷酶的量可为100ng/mg至1mg/mg、通常约500ng/mg。
[0098]
一旦抗体去糖基化,可以在去糖基化步骤之后进行渗滤步骤(adiafiltration step)以去除过量的n-糖苷酶f酶。
[0099]
根据一个实施方式,因此本发明的方法包括在进行去糖基化步骤之后的渗滤步骤。
[0100]
然后,连接物-螯合剂(a)化合物与微生物谷氨酰胺转胺酶(mtgase)反应,该酶将通过连接物的自由n-末端将式(a)的化合物与抗体偶联。这可以通过将式(a)化合物与转谷氨酰胺酶孵育来实现。
[0101]
具体而言,微生物转谷氨酰胺酶通过催化谷氨酰胺的γ-羰基酰胺基团与氨基酸(如赖氨酸)的伯胺之间形成共价键来工作,尽管也使用了其他酰胺供体(denner 2014,mehta 2005)。2010年,jeger等人证明去糖基化igg1抗体重链(恒定结构域)中295位的保守谷氨酰胺是mtgases将发生反应的唯一位置,理论上螯合剂-抗体比为2(抗体每个重链上各
有一个)。酶促反应可在以下条件下进行:
[0102]
温度:20℃至40℃,通常23℃至37℃
[0103]
转谷氨酰胺酶(mtgase)的量:1u/ml至10u/ml,通常约6u/ml
[0104]
时间:1至24小时,通常16至24小时。
[0105]
因此,这确保了本发明的生物偶联是位点特异性的,因为偶联仅发生在抗体的该位置,并且所获得的生物偶联化合物或生物偶联化合物的混合物是均质的,只要在偶联的位点发生。
[0106]
这种生物偶联导致形成相应的生物偶联抗体ab-(连接物-螯合剂)n。
[0107]
可以获得具有各种car(即n)的化合物的混合物。因此,此处使用的car(n)是指平均值(以数量计)。
[0108]
所获得的产物可纯化,通常通过离心透析,和/或进一步交换到存储缓冲液如乙酸铵中。
[0109]
然后可通过标准程序对抗体进行表征,例如,确保中间酶被充分去除,评估抗体大小,和/或确定螯合剂-抗体比。
[0110]
连接物-螯合剂(a)化合物可通过在酯活化剂(例如hatu(1-[二(二甲氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]三氧化吡啶六氟磷酸盐,六氟磷酸盐偶氮苯并三氮唑四甲基脲)和碱(例如h
ü
nig's碱(n,n-二异丙基乙胺,dipea)或三乙胺)的存在下,在诸如二甲基乙酰胺(dmac或dma)的溶剂中使相应前体形式的连接物oh-linker-z(其中z可以是胺的保护基团,如羧基苄基(cbz))与螯合剂反应来制备。该反应可以在室温下进行。
[0111]
根据另一个目的,本发明还涉及式(i)的位点特异性生物偶联抗体:
[0112]
ab-(连接物-螯合剂)nꢀꢀ(i)[0113]
如上所定义,可通过本发明的方法获得。
[0114]
它还涉及式(i)化合物:
[0115]
式(i)的位点特异性生物偶联抗体:
[0116]
ab-(连接物-螯合剂)nꢀꢀ(i)[0117]
如上所定义用作核医学中的造影剂或药物。
[0118]
它通常可用于癌症的诊断和/或治疗。
[0119]
本发明的另一个目的也是一种药物组合物,其包含作为活性成分的根据本发明的式(i)化合物或其药学上可接受的盐或溶剂化物。这些药物组合物包含有效剂量的至少一种根据本发明的化合物,和至少一种药学上可接受的赋形剂(excipient)。
[0120]
所述赋形剂可在本领域技术人员已知的常用赋形剂中根据药物形式和所需的施用途径选择。通常,本发明的组合物适用于全身施用,如肠外施用,例如通过腹膜内、肌肉内或静脉内途径。
[0121]
根据惯例,适合每位患者的剂量由医生根据施用途径、患者体重和反应确定。通常,上述式(i)的活性成分、其盐或溶剂化物可作为单一剂型与常用药物赋形剂混合施用。
[0122]
本发明根据其另一个方面还涉及用于诊断和/或治疗癌症的方法,其包括向患者施用有效剂量的根据本发明的式(i)化合物,或具有其药学上可接受的盐。
[0123]
本发明通过代表性附图和实验结果进一步说明。
【附图说明】
[0124]
[图1]图1是本发明说明性方法的示意图,其中(1)表示全长抗体,其:
[0125]-在步骤1中去糖基化,
[0126]-在步骤2中:通过渗滤洗涤,
[0127]-在步骤3中:与(2):连接物-螯合剂和mtgase反应
[0128]-在步骤4中:通过渗滤洗涤,
[0129]-以得到相应的生物偶联抗体(3)。
【具体实施方式】
[0130]
实验结果
[0131]
定义
[0132]
pbs-磷酸盐缓冲盐水
[0133]
edta-乙二胺四乙酸
[0134]
mwco-截留分子量
[0135]
hatu:(1-[二(二甲氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]三氧化吡啶六氟磷酸盐,六氟磷酸盐偶氮苯并三氮唑四甲基脲)
[0136]
dipea:n,n-二异丙基乙胺
[0137]
dma:二甲基乙酰胺(ch3c(o)n(ch3)2)
[0138]
材料:
[0139]
nh
2-tcmc(化合物1)由macrocyclics提供并用作合成ggg-tcmc的主要原料。所有溶剂和试剂均从商业来源购买,并在收到时使用。
[0140]
合成ggg-tcmc:
[0141][0142]
purified on biotage:在biotage上纯化
[0143]
overall yield:总收率
[0144]
制备式的z-(gly)
3-oh(3.3g,10.2mmol)在dma(64ml)中的溶液,随后添加dipea(5.20ml,29.9mmol)和hatu(4.51g,11.9mmol)。
[0145]
制备nh
2-tcmc(1)(6.56g,10.1mmol)在含dipea(5.80ml,33.3mmol)的dma(80ml)
中的溶液并添加至制备好的肽溶液中。反应于室温搅拌17小时。hplc监测表明反应不完全。将溶解在含dipea(5.20ml,29.9mmol)和hatu(4.53g,11.9mmol)的dma(36ml)中的第二当量的z-(gly)
3-oh(3.35g,10.4mmol)添加到反应器中并搅拌额外的22小时。将反应溶液滴加到乙醚(1.50l)中以沉淀粗材料。向容器中加入额外的乙醚(1.0l),并搅拌20分钟。沉淀物通过真空过滤分离,并用乙醚(150ml)洗涤滤饼。用乙腈(120ml)、h2o(480ml)和tfa(6ml)制备储备溶液。使用乙腈中0.1%tfa和h2o流动相中0.1%tfa,通过反相色谱法纯化粗材料。2的纯化部分通过旋转蒸发浓缩,然后转移至parr摇瓶中。加入10%的碳-钯催化剂,混合物经历真空,然后加压至30psi氢。氢化批料于室温摇动,直到hplc监测表明反应完成。反应混合物使用0.2μm pvdf膜过滤器在真空下过滤,并冷冻干燥以获得固体形式的3。
[0146]
靶向cd38生物偶联的igg1单克隆抗体
[0147]
在生物偶联之前将该抗体渗滤到pbs中。通过添加6u/mg pngase f酶并在37℃搅拌过夜,将抗体去糖基化。通过50kda mwco过滤器的渗滤去除酶并将缓冲液交换至pbs+50mm edta。将抗体与80mol当量的化学连接物-螯合剂(ggg-tcmc)和6u/ml mtgase酶(zedira)在37℃轻轻搅拌下孵育过夜。缓冲液交换和酶的去除通过渗滤到ph 4.5的150mm醋酸铵中进行。
[0148]
确定最终抗体浓度为6.4mg/ml。通过完整质量分析确定car为0.8。
[0149]
[表1]
[0150]
每抗体螯合剂丰度0292,4831825,940261,925总计1180348car0.8
[0151]
car=((825,940)+(2*61.925))/(1180348)
[0152]
靶向tem-1生物偶联的igg1单克隆抗体
[0153]
在开始生物偶联之前将抗体渗滤到pbs中。通过添加6u/mg pngase f酶并在37℃搅拌过夜,将抗体去糖基化。通过50kda mwco过滤器的渗滤去除酶并将缓冲液交换至pbs+50mm edta。将抗体与80mol当量的化学连接物-螯合剂(ggg-tcmc)和6u/ml mtgase酶(zedira)在37℃轻轻搅拌下孵育过夜。缓冲液交换和酶的去除通过渗滤到ph 4.5的150mm醋酸铵中进行。
[0154]
确定最终抗体浓度为6.5mg/ml。通过完整质量分析确定car为1.2。
[0155]
[表2]
[0156]
[0157][0158]
igg1抗体生物偶联
[0159]
在开始生物偶联之前将igg1抗体渗滤到pbs中。
[0160]
通过添加6u/mg pngase f酶并在37℃搅拌过夜,将抗体去糖基化。通过50kda mwco过滤器的渗滤去除酶并将缓冲液交换至pbs+50mm edta。将抗体与80mol当量的化学连接物-螯合剂(ggg-tcmc)和6u/ml mtgase酶(购自zedira)在37℃轻轻搅拌下孵育过夜。缓冲液交换和酶的去除通过渗滤到ph 4.5的150mm醋酸铵中进行。
[0161]
确定最终抗体浓度为5.1mg/ml。通过完整质量分析确定car为1.1。
[0162]
[表3]
[0163]
每抗体螯合剂丰度0672,78614,854,31821,258,650总计6,785,754car1.1
[0164]
靶向cd20生物偶联的单克隆igg1抗体
[0165]
在开始生物偶联之前将该抗体渗滤到pbs中。通过添加6u/mg pngase f酶并在37℃搅拌过夜,将抗体去糖基化。通过50kda mwco过滤器的渗滤去除酶并将缓冲液交换至pbs+50mm edta。将抗体与80mol当量的化学连接物-螯合剂(ggg-tcmc)和6u/ml mtgase酶(zedira)在37℃轻轻搅拌下孵育过夜。缓冲液交换和酶的去除通过渗滤到ph 4.5的150mm醋酸铵中进行。
[0166]
确定最终抗体浓度为5.6mg/ml。通过完整质量分析确定car为1.0。
[0167]
[表4]
[0168]
每抗体螯合剂丰度0266,07612,257,4762233,893总计2,757,445car1.0
[0169]
靶向her2生物偶联的单克隆抗体
[0170]
在开始生物偶联之前将该抗体渗滤到pbs中。
[0171]
通过添加6u/mg pngase f(roche)酶并在37℃搅拌过夜,将抗体去糖基化。
[0172]
通过50kda mwco过滤器的渗滤去除酶并将缓冲液交换至pbs+50mm edta。
[0173]
将抗体与80mol当量的化学连接物-螯合剂(ggg-tcmc)和6u/ml mtgase酶(zedira)在37℃轻轻搅拌下孵育过夜。
[0174]
缓冲液交换和酶的去除通过渗滤到ph 4.5的150mm醋酸铵中进行。
[0175]
确定最终抗体浓度为2.5mg/ml。通过完整质量分析确定car为0.9。
[0176]
[表5]
[0177]
每抗体螯合剂丰度0200,3591731,247296,722总计1,028,328car0.9
[0178]
靶向egfr生物偶联的单克隆igg1抗体
[0179]
在开始生物偶联之前将igg1抗体渗滤到pbs中。通过添加6u/mg pngase f(roche)酶并在37℃搅拌过夜,将抗体去糖基化。通过50kda mwco过滤器的渗滤去除酶并将缓冲液交换至pbs+50mm edta。将抗体与80mol当量的化学连接物-螯合剂(ggg-tcmc)和6u/ml mtgase酶(zedira)在37℃轻轻搅拌下孵育过夜。缓冲液交换和酶的去除通过渗滤到ph 4.5的150mm醋酸铵中进行。
[0180]
确定最终抗体浓度为3.0mg/ml。通过完整质量分析确定car为1.1。
[0181]
靶向her2生物偶联的单克隆抗体
–
比较kgg和ggg连接物
[0182]
在开始生物偶联之前,将冻干抗体再悬浮并渗滤到pbs中。通过添加500ng/mg pngase f酶(r&d系统)并在37℃搅拌过夜,将抗体去糖基化。通过50kda mwco过滤器的渗滤去除酶。将抗体与80mol当量的化学连接物ggg-tcmc或kgg-tcmc和6u/ml mtgase酶(zedira)在37℃轻轻搅拌下孵育过夜。缓冲液交换和酶的去除通过渗滤到ph 4.5的150mm醋酸铵中进行。
[0183]
对于与ggg-连接物的生物偶联,确定最终抗体浓度为5.1mg/ml,对于与kgg-连接物的生物学偶联,确定最终的抗体浓度为7.2mg/ml。通过完整质量确定:kgg-tcmc抗体的car为0.8,ggg-tcmc-抗体的car为1.9。
[0184]
靶向her2抗体的单克隆igg1抗体-存在和不存在pngase去糖基化时aka-tcmc和ggg-tcmc的生物偶联
[0185]
该实验的目的在于发现,取决于所使用的连接物,是否需要pngase去糖基化将螯合剂与抗体偶联。选择aka-tcmc是因为它不需要pngase。在存在和不存在pngase去糖基化时将aka-tcmc与ggg-tcmc进行比较。
[0186]
程序
[0187]
在开始生物偶联之前,将冻干抗体再悬浮并渗滤到pbs中。
[0188]
通过添加500ng/mg pngase f酶(r&d系统)并在37℃搅拌过夜,将一半抗体去糖基化。另一半没有接受pngase f。
[0189]
酶通过50kda mwco过滤器通过渗滤去除,并渗滤到偶联缓冲液(pbs+50mm edta)中。
[0190]
将抗体(去糖基化和非去糖基化)与80mol当量的化学连接物-螯合剂(ggg-tcmc)
或(aka-tcmc)与6u/ml的mtgase酶(zedira)在37℃轻轻搅拌下孵育过夜。
[0191]
将偶联物无菌过滤,然后通过渗滤到ph 4.5的150mm醋酸铵中进行缓冲液交换和酶的去除。进行最终无菌过滤。
[0192]
结果
[0193]
[表7]
[0194][0195]
数据表明,aka-tcmc和ggg-tcmc与抗体偶联需要去糖基化,此外,aka-tcmc和ggg-tcmc二者都能够与抗体偶联。
[0196]
靶向her2抗体的单克隆igg1抗体-ggg-tcmc和gggg-tcmc的生物偶联
[0197]
程序
[0198]
在开始生物偶联之前,将冻干抗体再悬浮并渗滤到pbs中。
[0199]
通过添加500ng/mg pngase f酶(r&d系统)并在37℃搅拌过夜,将抗体去糖基化。
[0200]
酶通过50kda mwco过滤器通过渗滤去除,并渗滤到偶联缓冲液(pbs+50mm edta)中。
[0201]
将抗体与80mol当量的化学连接物-螯合剂(ggg-tcmc)或(aka-tcmc)与2u/ml的mtgase酶(zedira)在37℃轻轻搅拌下孵育过夜。
[0202]
将偶联物无菌过滤,然后通过渗滤到ph 4.5的150mm醋酸铵中进行缓冲液交换和酶的去除。进行最终无菌过滤。
[0203]
结果
[0204]
[表8]
[0205] 最终蛋白质浓度car值tcmc-ggg-抗体1.3mg/ml0.5tcmc-gggg-抗体0.9mg/ml0.8
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1