靶向OX40和FAP的双特异性抗原结合分子的制作方法
靶向ox40和fap的双特异性抗原结合分子
技术领域
1.本发明涉及新的双特异性抗原结合分子,其包含至少两个能够特异性结合至ox40的抗原结合结构域以及能够特异性结合至成纤维细胞活化蛋白(fap)的抗原结合结构域,以及fc结构域、特别是包含降低与fc受体结合和/或效应子功能的一个或多个氨基酸取代的fc结构域。本发明的其他方面为这些分子的产生方法及其使用方法。
背景技术:
2.尽管有若干种新剂为患者提供存活益处,但癌症仍为全世界范围内的主要死亡原因之一。尽管在治疗选择方面已取得进展,但患有晚期癌症的患者的预后仍然较差。许多癌症适应症的预后较差,并且由于肿瘤复发率高或发生远程转移,大多数晚期实体肿瘤的管理仍具有挑战性。患有晚期实体肿瘤的患者明显受益于检查点抑制剂(cpi)疗法。即使在治疗中断后,其仍可延长患者亚组的总体存活期,这有可能是经由产生记忆免疫反应而引起。尽管此疗法已改变许多癌症类型的治疗前景,但不幸的是,60%-80%的患有转移性疾病的患者不能自此类型的癌症免疫疗法中获得长期益处。因此,在医学上迫切需要不断地开发新的且最佳的疗法,其可加至现有的治疗中以延长癌症患者的存活期,而不会引起不可接受的毒性。
3.某些肿瘤中的免疫抑制微环境具有较高的共抑制信号,例如pd-l1,但缺乏ox40配体的充分表达。ox40(cd134;tnfrsf4)是肿瘤坏死因子(tnf)受体超家族的成员,其在与t细胞受体(tcr)接合后由t细胞瞬时表达。ox40接合双向地调节t细胞与ox40l
+
抗原呈现细胞(例如b细胞、树突细胞(dc)、单核球)的相互作用。在tcr接合的情况下,ox40主要向cd4
+
效应t细胞提供共刺激信号,并且也向cd8
+
效应t细胞提供共刺激信号,从而使得增殖、存活期和效应子功能(例如细胞因子分泌)增强。相反,ox40信号传导引起调控性t细胞的功能抑制和损失。ox40激动作用使tgf-效应抵消(例如阻碍foxp3诱导)并减少il-10分泌。在鼠类肿瘤模型中,激动剂抗ox40抗体与ox40接合可促进抗肿瘤t-细胞反应、肿瘤缩小和可再现的伴随远隔效应。ox40激动剂的单药疗法功效通常较低,但在与免疫原性治疗(化学疗法、放射及疫苗接种)、检查点抑制剂(pd-1、ctla-4)以及其他共刺激性激动剂(诸如4-1bb、icos或gitr)组合时实现较强的抗肿瘤功效。
4.成纤维细胞活化蛋白-α(fap)是一种丝氨酸蛋白酶,其在>90%的人上皮恶性病的癌症相关基质细胞的细胞表面上、在位于淋巴结的t细胞引导块中的网状成纤维细胞上高度表达,并且可在正常组织中的活化成纤维细胞上发现。fap在各种癌症适应症中的高流行率使得其可用作应在肿瘤环境内累积的药物的靶向部分。
5.在肿瘤微环境中特异性地恢复ox40共刺激的一种方式是双特异性抗体,其包含至少一个针对肿瘤基质中的成纤维细胞活化蛋白(fap)的抗原结合结构域以及至少一个针对ox40的抗原结合结构域。举例而言,此类双特异性抗体已描述于wo 2017/055398 a2和wo 2017/060144 a1中。通过细胞表面fap交联并表面固定此类双特异性分子将产生针对ox40阳性t细胞的高激动性基质,在此情况下,其支持nf b介导的效应子功能且可替代ox40配体
的连接。众多人肿瘤适应症有报道高fap表达,无论是在肿瘤细胞自身上,还是在免疫抑制性癌症相关成纤维细胞(caf)上。因此,需要改进的靶向fap的ox40双特异性抗体,其具有优异的药理学性质,诸如更佳的储放期限、较低的免疫原性,并且具有较少的非特异性相互作用,诸如过敏性反应或不受控的细胞因子释放。
技术实现要素:
6.本发明涉及具有改进性质的能够特异性结合至ox40和成纤维细胞活化蛋白(fap)的新的双特异性抗原结合分子,其中经由在肿瘤基质细胞上表达的fap且潜在地也经由在次级淋巴样组织中中间表达的fap进行交联来提供ox40共刺激。因此,本发明的抗原结合分子不仅能够有效地而且还能够非常有选择性地在所需位点触发ox40,同时克服了fcγr交联的需求,从而减少了副作用。这些新的双特异性抗原结合分子的特征在于包含与fc结构域的c末端融合的新的fap抗原结合结构域以及改进的药物动力学性质。
7.本发明的双特异性抗原结合分子将至少两个能够特异性结合至共刺激性tnf受体家族成员ox40的抗原结合结构域与靶向成纤维细胞活化蛋白(fap)的抗原结合结构域组合,该fap包含新的鼠类抗人fap克隆212及其人源化变体。这些双特异性抗原结合分子是ox40激动剂且是有利的,这是由于这些分子能够以高亲和力结合至fap,因此将优选地使靠近表达fap的肿瘤部位的共刺激性ox40受体活化。这些分子进一步经设计以具有有利的药物动力学特征,以使治疗方案优化,从而得到增强的安全性与功效平衡。
8.在一个方面,本发明提供一种双特异性抗原结合分子,其包含:
9.(a)至少两个能够特异性结合至ox40的抗原结合结构域;
10.(b)能够特异性结合至成纤维细胞活化蛋白(fap)的抗原结合结构域,其包含:重链可变区(vhfap),所述vhfap包含:
11.(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包含选自由seq id no:4、seq id no:11和seq id no:12组成的组的氨基酸序列,和(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含:(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13和seq id no:14组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,和(vi)cdr-l3,其包含seq id no:8的氨基酸序列;以及
12.(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
13.在一个方面,fc区包含降低抗体与fc受体的结合亲和力和/或效应子功能的一个或多个氨基酸取代。
14.在一个进一步的方面,提供一种双特异性抗原结合分子,其中能够特异性结合至fap的抗原结合结构域包含:重链可变区(vhfap),所述vhfap包含与seq id no:9的氨基酸序列至少约90%相同的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含与seq id no:10的氨基酸序列至少约90%相同的氨基酸序列。在一个方面,能够与fap特异性结合的抗原结合结构域包含:重链可变区(vhfap),其包含seq id no:9的氨基酸序列;以及轻链可变区(v
l
fap),其包含seq id no:10的氨基酸序列。
15.在另一个方面,能够与fap特异性结合的抗原结合结构域包含:重链可变区(vhfap),其包含选自由seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19和seq id no:20组成的组的氨基酸序列,和轻链可变区(v
l
fap),其包含选自由
seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25和seq id no:26组成的组的氨基酸序列。在一个方面,能够特异性结合至fap的抗原结合结构域包含(a)包含seq id no:15的氨基酸序列的重链可变区(vhfap)以及包含seq id no:21的氨基酸序列的轻链可变区(v
l
fap),(b)包含seq id no:16的氨基酸序列的重链可变区(vhfap)以及包含seq id no:21的氨基酸序列的轻链可变区(v
l
fap),(c)包含seq id no:16的氨基酸序列的重链可变区(vhfap)以及包含seq id no:22的氨基酸序列的轻链可变区(v
l
fap),或(d)包含seq id no:19的氨基酸序列的重链可变区(vhfap)以及包含seq id no:25的氨基酸序列的轻链可变区(v
l
fap)。特别地,能够与fap特异性结合的抗原结合结构域包含:(a)重链可变区(vhfap),其包含seq id no:15的氨基酸序列;以及轻链可变区(v
l
fap),其包含seq id no:21的氨基酸序列。
16.在一个方面,能够特异性结合至ox40的抗原结合结构域结合至包含seq id no:1的氨基酸序列的多肽或由其组成的多肽。
17.在进一步的方面,提供一种双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域(每一者)包含:
18.(a)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:27的氨基酸序列,(ii)cdr-h2,其包含seq id no:28的氨基酸序列,和(iii)cdr-h3,其包含seq id no:29的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:30的氨基酸序列,(v)cdr-l2,其包含seq id no:31的氨基酸序列,和(vi)cdr-l3,其包含seq id no:32的氨基酸序列;或者
19.(b)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:35的氨基酸序列,(ii)cdr-h2,其包含seq id no:36的氨基酸序列,和(iii)cdr-h3,其包含seq id no:37的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:38的氨基酸序列,(v)cdr-l2,其包含seq id no:39的氨基酸序列,和(vi)cdr-l3,其包含seq id no:40的氨基酸序列;或者
20.(c)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:43的氨基酸序列,(ii)cdr-h2,其包含seq id no:44的氨基酸序列,和(iii)cdr-h3,其包含seq id no:45的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:46的氨基酸序列,(v)cdr-l2,其包含seq id no:47的氨基酸序列,和(vi)cdr-l3,其包含seq id no:48的氨基酸序列;或者
21.(a)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:51的氨基酸序列,(ii)cdr-h2,其包含seq id no:52的氨基酸序列,和(iii)cdr-h3,其包含seq id no:53的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:54的氨基酸序列,(v)cdr-l2,其包含seq id no:55的氨基酸序列,和(vi)cdr-l3,其包含seq id no:56的氨基酸序列。
22.在一个方面,能够特异性结合至ox40的抗原结合结构域(每一者)包含:重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:27的氨基酸序列,(ii)cdr-h2,其包含seq id no:28的氨基酸序列,和(iii)cdr-h3,其包含seq id no:29的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:30的氨基酸序列,(v)cdr-l2,其包含seq id no:31的氨基酸序列,和(vi)cdr-l3,其包含seq id no:32的氨基酸序列。在
no:41的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:42的氨基酸序列。
30.在另一个方面,提供了如本文上文所定义的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:
31.(i)重链可变区(vhox40),其包含seq id no:59的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列,或者
32.(ii)重链可变区(vhox40),其包含seq id no:60的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列,或者
33.(iii)重链可变区(vhox40),其包含seq id no:61的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。
34.在一个方面,提供一种如本文上文所定义的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含seq id no:59的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。在一个方面,能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含seq id no:60的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。在进一步的方面,能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含seq id no:61的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。
35.在另一个方面,双特异性抗原结合分子为人源化或嵌合抗体,特别是人源化抗体。在进一步的方面,双特异性抗原结合分子包含igg fc区,特别是igg1 fc区或igg4 fc区。特别地,fc区包含降低抗体与fc受体的结合亲和力和/或效应子功能的一个或多个氨基酸取代。在一个特定方面,提供一种双特异性抗原结合分子,其中fc区属于人igg1亚类,其具有氨基酸突变l234a、l235a和p329g(根据kabat eu索引编号)。
36.在另一个方面,提供了如上文所定义的双特异性抗原结合分子,其中根据杵臼结构(knobs into holes)方法,fc区的第一亚基包含杵并且fc区的第二亚基包含臼。特别地,提供一种双特异性抗原结合分子,其中fc区的第一亚基包含氨基酸取代s354c和t366w(根据kabat eu索引编号),并且fc区的第二亚基包含氨基酸取代y349c、t366s和y407v(根据kabat eu索引编号)。在又一个方面,fc区是鼠类起源,并且fc区的第一亚基包含氨基酸取代k392d和k409d(根据kabat eu索引编号),并且fc区的第二亚基包含氨基酸取代e356k和d399k(根据kabat eu索引编号)。更特别地,提供一种双特异性抗原结合分子,其中fc区的第一亚基包含氨基酸取代s354c和t366w(根据kabat eu索引编号),并且fc区的第二亚基包含氨基酸取代y349c、t366s和y407v(根据kabat eu索引编号)。
37.在进一步的方面,提供一种双特异性抗原结合分子,其中所述双特异性抗原结合分子包含
38.(a)至少两个能够特异性结合至ox40的fab片段,它们各自连接至所述fc区的其中一个亚基的n末端;和
39.(b)一个能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
40.(c)所述由能够稳定缔合的第一亚基和第二亚基构成的fc区。
41.因此,提供一种双特异性抗原结合分子,其提供对ox40的二价结合以及对fap的单价结合(2+1形式)。特别地,所述双特异性抗原结合分子包含一个能够特异性结合至fap的
交叉fab片段,其中所述能够特异性结合至fap的交叉fab片段的vh-cκ链与fc区的其中一个亚基的c末端融合。在一个特定方面,能够特异性结合至fap的交叉fab片段的vh-cκ链与fc区中包含氨基酸取代s354c和t366w(根据kabat eu索引编号)的第一亚基的c末端融合,即与杵链融合。
42.在一个方面,提供一种双特异性抗原结合分子,其中所述双特异性抗原结合分子由以下项组成:
43.(aa)第一fab片段,其能够特异性结合至ox40;
44.(ab)第二fab片段,其能够特异性结合至ox40;
45.(b)能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
46.(c)由能够稳定缔合的第一亚基和第二亚基构成的fc区,其中所述第一fab片段(aa)在vh-ch1链的c末端与所述第一亚基的n末端融合且所述第二fab片段(ab)在vh-ch1链的c末端与所述第二亚基的n末端融合。
47.因此,提供一种双特异性抗原结合分子,其提供对ox40的二价结合以及对fap的单价结合(2+1形式)。
48.在另一个方面,提供一种双特异性抗原结合分子,其中所述双特异性抗原结合分子由以下项组成:
49.(aa)第一fab片段,其能够特异性结合至ox40;
50.(ab)第二fab片段,其能够特异性结合至ox40;
51.(ac)第三fab片段,其能够特异性结合至ox40;
52.(b)能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
53.(c)由能够稳定缔合的第一亚基和第二亚基构成的fc区,其中所述第二fab片段(ab)在vh-ch1链的c末端与所述第一fab片段(aa)的vh-ch1链的n末端融合,所述第一fab片段(aa)的vh-ch1链又在其c末端与所述第一亚基的n末端融合,并且所述第三fab片段(ac)在fab重链的c末端与所述第二亚基的n末端融合。
54.因此,提供一种双特异性抗原结合分子,其提供对ox40的三价结合以及对fap的单价结合(3+1形式)。
55.在一个方面,提供一种双特异性抗原结合分子,其中所述双特异性抗原结合分子由以下项组成:
56.(aa)第一fab片段,其能够特异性结合至ox40;
57.(ab)第二fab片段,其能够特异性结合至ox40;
58.(ac)第三fab片段,其能够特异性结合至ox40;
59.(b)能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
60.(c)由能够稳定缔合的第一亚基和第二亚基构成的fc区,其中所述第二fab片段(ab)在vh-ch1链的c末端与所述第一fab片段(aa)的vh-ch1链的n末端融合,所述第一fab片段(aa)的vh-ch1链又在其c末端与fc区中包含氨基酸取代y349c、t366s和y407v(根据kabat eu索引编号)的第二亚基的n末端融合,并且所述第三fab片段(ac)在fab重链的c末端与包
含氨基酸取代s354c和t366w(根据kabat eu索引编号)的第一亚基的n末端融合。特别地,能够特异性结合至fap的交叉fab片段的vh-cκ链与fc区中包含氨基酸取代s354c和t366w(根据kabat eu索引编号)的第一亚基的c末端融合。
61.在一个方面,提供一种双特异性抗原结合分子,其包含(a)两条重链,一条重链包含能够特异性结合至ox40的fab片段的两条任选地通过肽接头彼此连接的vh-ch1链以及fc区亚基,并且一条重链包含能够特异性结合至ox40的fab片段的一条vh-ch1链以及fc区亚基,(b)三条轻链,每条轻链包含能够特异性结合至ox40的fab片段的vl以及cκ结构域,以及(c)能够特异性结合至fap的包含vl-ch1轻链和vh-cκ链的交叉fab片段,其中所述vh-cκ链任选地通过肽接头连接至(a)中的所述两条重链中的一者的c末端。
62.在一个方面,提供一种双特异性抗原结合分子,其中所述双特异性抗原结合分子由以下项组成:
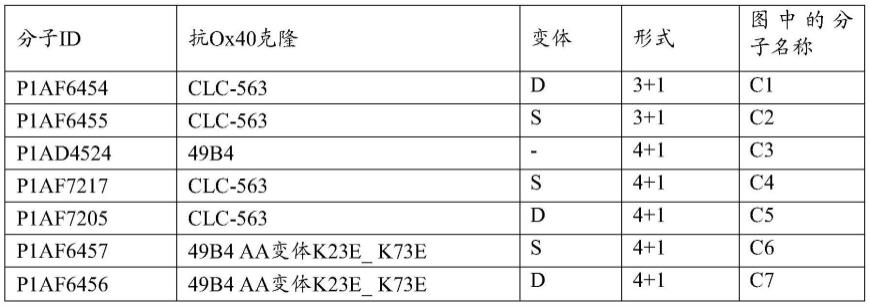
63.(aa)第一fab片段,其能够特异性结合至ox40;
64.(ab)第二fab片段,其能够特异性结合至ox40;
65.(ac)第三fab片段,其能够特异性结合至ox40;
66.(ad)第四fab片段,其能够特异性结合至ox40;
67.(b)能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
68.(c)由能够稳定缔合的第一亚基和第二亚基构成的fc区,其中所述第二fab片段(ab)在vh-ch1链的c末端与所述第一fab片段(aa)的vh-ch1链的n末端融合,所述第一fab片段(aa)的vh-ch1链又在其c末端与所述第一亚基的n末端融合,并且所述第四fab片段(ad)在vh-ch1链的c末端与所述第三fab片段(ac)的vh-ch1链的n末端融合,所述第三fab片段(ac)的vh-ch1链又在其c末端与所述第二亚基的n末端融合。
69.因此,提供一种双特异性抗原结合分子,其提供对ox40的四价结合以及对fap的单价结合(4+1形式)。在一个特定方面,能够特异性结合至fap的交叉fab片段的vh-cκ链与fc区中包含氨基酸取代s354c和t366w(根据kabat eu索引编号)的第一亚基的c末端融合。
70.在一个方面,提供一种双特异性抗原结合分子,其中所述两条重链各自包含能够特异性结合至ox40的fab片段的两条任选地通过肽接头彼此融合的vh-ch1链。因此,在一个方面,本发明提供一种双特异性抗原结合分子,其包含(a)两条重链,每条重链包含能够特异性结合至ox40的fab片段的两条任选地通过肽接头彼此连接的vh-ch1链以及fc区亚基,(b)四条轻链,每条轻链包含能够特异性结合至ox40的fab片段的vl以及cκ结构域,以及(c)能够特异性结合至fap的包含vl-ch1轻链和vh-cκ链的交叉fab片段,其中所述vh-cκ链任选地通过肽接头连接至(a)中的所述两条重链中的一者的c末端。
71.根据本发明的另一方面,提供一种如上文所述的编码双特异性抗原结合分子的分离的核酸。本发明进一步提供一种载体,特别是表达载体,其包含本发明的分离的核酸;并且提供一种宿主细胞,其包含本发明的分离的核酸或表达载体。在一些方面,宿主细胞是真核细胞,特别是哺乳动物细胞。在另一个方面,提供一种产生如上文所述的双特异性抗原结合分子的方法,其包括在适合于表达双特异性抗原结合分子的条件下培养如上所述的宿主细胞,并且分离所述双特异性抗原结合分子。本发明还涵盖与ox40和fap特异性结合的通过本发明的方法产生的双特异性抗原结合分子。
72.本发明进一步提供药物组合物,其包含如上文所述的双特异性抗原结合分子以及药用载体。在一个方面,药物组合物包含附加治疗剂。
73.本发明还涵盖如上文所述的双特异性抗原结合分子或抗体,或包含该双特异性抗原结合分子的药物组合物,其用作药物。
74.在一个方面,提供一种如上文所述的双特异性抗原结合分子或本发明的药物组合物,其用于
75.(i)诱导免疫刺激,
76.(ii)刺激肿瘤特异性t细胞应答,
77.(iii)引起肿瘤细胞凋亡,
78.(iv)治疗癌症,
79.(v)延缓癌症发展,
80.(vi)延长癌症患者的存活期,
81.(vii)治疗感染。
82.在具体方面,提供如上文所述的双特异性抗原结合分子或本发明的药物组合物,其用于治疗癌症。在另一个具体方面,本发明提供了如上文所述的双特异性抗原结合分子,其用于治疗癌症,其中所述双特异性抗原结合分子与化学治疗剂、放射和/或用于癌症免疫疗法的其他药剂联合施用。在一个方面,提供用于治疗癌症的双特异性激动性ox40抗原结合分子或药物组合物,其中所述双特异性激动性ox40抗原结合分子用于与t细胞活化性抗cd3双特异性抗体(例如抗cea/抗cd3双特异性抗体)联合施用。在一个进一步的方面,如本文所述的双特异性抗原结合分子用于治疗癌症,其中所述双特异性抗原结合分子用于与阻断pd-l1/pd-1相互作用的药剂(诸如pd-l1抗体,例如阿替利珠单抗(atezolizumab),或pd-1抗体,例如纳武利尤单抗(nivolumab)或帕博利珠单抗(pembrolizumab))联合施用。在另一个方面,提供如上文所述的双特异性抗原结合分子或本发明的药物组合物,其用于上调或延长细胞毒性t细胞活性。
83.在进一步的方面,本发明提供一种抑制个体中肿瘤细胞生长的方法,其包括向所述个体施用有效量的如上文所述的双特异性抗原结合分子或本发明的药物组合物,以抑制肿瘤细胞的生长。在另一个方面,本发明提供一种治疗或延迟个体的癌症的方法,其包括向所述个体施用有效量的如上文所述的双特异性抗原结合分子或本发明的药物组合物。
84.另外,提供如上文所述的双特异性抗原结合分子在制造用于治疗有需要的个体的疾病的药物中的用途,特别是在制造用于治疗癌症的药物中的用途,以及一种治疗个体的疾病的方法,其包括向所述个体施用治疗有效量的包含本发明的双特异性抗原结合分子的组合物,所述组合物呈药用形式。在具体方面,疾病为癌症。在上述方面中的任何方面,个体为哺乳动物,特别是人。
附图说明
85.图1a至图e显示与人ox40和fap特异性结合的双特异性抗原结合分子的示意图。图1a显示呈4+1形式的双特异性fap-ox40抗体的示意图,其由四个ox40结合fab片段与一个fap(1g1a)结合部分组合作为交叉fab片段组成,其中vh-cκ链融合在fc杵链的c末端(对于ox40为四价且对于fap为单价)。图1b显示呈3+1形式的双特异性fap-ox40抗体的示意图,其
由三个ox40结合fab片段与一个fap(1g1a)结合部分组合作为交叉fab片段组成,其中vh-cκ链融合在fc杵链的c末端(对于ox40为三价且对于fap为单价)。包含两个彼此融合的ox40结合fab片段的臂在fc杵链上。图1c显示呈3+1形式的双特异性fap-ox40抗体的示意图,其由三个ox40结合fab片段与一个fap(1g1a)结合部分组合作为交叉fab片段组成,其中vh-cκ链融合在fc杵链的c末端(对于ox40为三价且对于fap为单价)。包含两个彼此融合的ox40结合fab片段的臂在fc臼链上。图1d显示呈2+1形式的双特异性fap-ox40抗体的示意图,其由两个ox40结合fab片段与一个fap(1g1a)结合部分组合作为交叉fab片段组成,其中vh-cκ链融合在fc杵链的c末端(对于ox40为二价且对于fap为单价)。图1e显示呈4+1形式的双特异性fap-ox40抗体p1ad4524的示意图,其由四个ox40结合fab片段与一个fap(4b9)结合部分组合作为vh和vl结构域组成,其中所述vl结构域融合在fc杵链的c末端且该vh结构域融合在fc臼链的c末端(对于ox40为四价且对于fap为单价)。黑点象征杵臼结构突变。
86.图2a至图2f显示包含ox40克隆49b4的呈不同形式的双特异性抗原结合分子的细胞结合。fap抗原结合结构域h212是fap克隆212的人化形式,其在本文中称为fap(1g1a)。使人fap阴性肿瘤细胞(a549-nlr)(图2f)、fap阳性成纤维细胞(nih/3t3-hufap-克隆19)(图2e)、ox40阳性活化pbmc(活化cd4和cd8 t细胞,分别为图2a和2c)以及ox40阴性静息pbmc(静息cd4和cd8 t细胞,分别为图2b和2d)与测试抗体的指示连续稀释液一起温育,接着通过针对人fcγ的荧光标记2级抗体检测。对活细胞设门,并且自两个重复绘制二级抗体的平均荧光强度,基线由仅培养基样品校正。误差条指示sem。
87.图3a至3f显示包含ox40克隆8h9的呈不同形式的双特异性抗原结合分子的细胞结合,并且与包含ox40克隆49b4的呈4+1形式的双特异性抗原结合分子(p1ae6838)进行比较。使人fap阴性肿瘤细胞(a549-nlr)(图3f)、fap阳性成纤维细胞(nih/3t3-hufap-克隆19)(图3e)、ox40阳性活化pbmc(活化cd4和cd8 t细胞,分别为图3a和3c)以及ox40阴性静息pbmc(静息cd4和cd8 t细胞,分别为图3b和3d)与测试抗体的指示连续稀释液一起温育,接着通过针对人fcγ的荧光标记2级抗体检测。对活细胞设门,并且自两个重复绘制二级抗体的平均荧光强度,基线由仅培养基样品校正。误差条指示sem。克隆8h9以亚纳摩尔亲和力结合至ox40阳性细胞且强度与三价和二价抗体相当。
88.图4a至4f显示包含ox40克隆moxr0916的呈不同形式的双特异性抗原结合分子的细胞结合,并且与包含ox40克隆49b4的呈4+1形式的双特异性抗原结合分子(p1ae6838)进行比较。使人fap阴性肿瘤细胞(a549-nlr)(图4f)、fap阳性成纤维细胞(nih/3t3-hufap-克隆19)(图4e)、ox40阳性活化pbmc(活化cd4和cd8 t细胞,分别为图4a和4c)以及ox40阴性静息pbmc(静息cd4和cd8 t细胞,分别为图4b和4d)与测试抗体的指示连续稀释液一起温育,接着通过针对人fcγ的荧光标记2级抗体检测。对活细胞设门,并且自两个重复绘制二级抗体的平均荧光强度,基线由仅培养基样品校正。误差条指示sem。克隆moxr0916以纳摩尔亲和力结合至ox40阳性细胞,其强度与三价和二价抗体相当。
89.图5a至5f显示包含ox40克隆clc563的呈不同形式的双特异性抗原结合分子的细胞结合,并且与包含ox40克隆49b4的呈4+1形式的双特异性抗原结合分子(p1ae6838)进行比较。使人fap阴性肿瘤细胞(a549-nlr)(图5f)、fap阳性成纤维细胞(nih/3t3-hufap-克隆19)(图5e)、ox40阳性活化pbmc(活化cd4和cd8 t细胞,分别为图5a和5c)以及ox40阴性静息pbmc(静息cd4和cd8 t细胞,分别为图5b和5d)与测试抗体的指示连续稀释液一起温育,接
着通过针对人fcγ的荧光标记2级抗体检测。对活细胞设门,并且自两个重复绘制二级抗体的平均荧光强度,基线由仅培养基样品校正。误差条指示sem。克隆clc-563以纳摩尔亲和力结合至ox40阳性细胞,其强度与三价和二价抗体相当。
90.图6a至6f显示包含在vh结构域中具有氨基酸突变的ox40克隆49b4的不同变体的呈不同形式的双特异性抗原结合分子的细胞结合,并且与包含ox40克隆49b4的呈4+1形式的双特异性抗原结合分子(p1ae6838)进行比较。使人fap阴性肿瘤细胞(a549-nlr)(图6f)、fap阳性成纤维细胞(nih/3t3-hufap-克隆19)(图6e)、ox40阳性活化pbmc(活化cd4和cd8 t细胞,分别为图6a和6c)以及ox40阴性静息pbmc(静息cd4和cd8 t细胞,分别为图6b和6d)与测试抗体的指示连续稀释液一起温育,接着通过针对人fcγ的荧光标记2级抗体检测。对活细胞设门,并且自两个重复绘制二级抗体的平均荧光强度,基线由仅培养基样品校正。误差条指示sem。与包括克隆49b4的抗原结合分子相比,所有包含具有氨基酸突变的ox40(49b4)变体的抗原结合分子均显示与ox40阳性细胞的结合略有改进。
91.图7a至7c显示表达ox40的报道细胞系hela_hox40_nfκb_luc1中nf b介导的荧光素酶表达活性。将包含ox40克隆49b4的呈不同形式的双特异性抗原结合分子或其对照的浓度对在温育并添加荧光素酶检测溶液后测量的光释放单位(url)作图。所示为4+1、3+1或2+1形式的nf b诱导,这些形式与表达人fap的nih/3t3成纤维细胞交联(图7a)、与2:1比率的二级抗体交联(图7b)或没有进一步交联(图7c)。同种型对照抗体不诱导任何nf b活化。所有含ox40的构建体均诱导剂量依赖性nf b活化。由于在不存在交联的情况下已组装三聚体核心ox40受体信号传导单元,因此包含四个ox40 fab片段的四价形式诱导一定的nf b活化。呈三价或二价形式的相同克隆相应地显示较低的生物活性。ox40抗原结合结构域的价越高,nf b活化程度越强,并且所需浓度越低。所示为两个重复的平均值。误差条表示sem。
92.图8a至8c显示包含ox40克隆8h9的不同双特异性抗原结合分子在表达ox40的报道细胞系hela_hox40_nfκb_luc1中的nf b介导的荧光素酶表达活性。将呈不同形式的双特异性抗原结合分子或其对照的浓度对在温育并添加荧光素酶检测溶液后测量的光释放单位(url)作图。所示为3+1或2+1形式的nf b诱导,这些形式与表达人fap的nih/3t3成纤维细胞交联(图8a)、与2:1比率的二级抗体交联(图8b)或没有进一步交联(图8c)。同种型对照抗体不诱导任何nf b活化。所有含ox40的构建体均诱导剂量依赖性nf b活化。由于在不存在交联的情况下已组装三聚体核心ox40受体信号传导单元,因此包含四个ox40 fab片段的四价形式诱导一定的nf b活化且为最强效的。包含呈三价或二价形式的ox40克隆8h9的双特异性抗原结合分子相应地显示较低的生物活性。表达人fap的成纤维细胞经由fap结合部分或二级交联抗体经由ox40抗原结合分子的fc区所引起的额外交联进一步增加nf b活化。克隆ox40(8h9)已以2+1形式实现最高的nfkb活化诱导。三价并未增加进一步益处。所示为两个重复的平均值。误差条表示sem。
93.图9a至9c显示包含ox40克隆moxr0916的不同双特异性抗原结合分子在表达ox40的报道细胞系hela_hox40_nfκb_luc1中的nf b介导的荧光素酶表达活性。将呈不同形式的双特异性抗原结合分子或其对照的浓度对在温育并添加荧光素酶检测溶液后测量的光释放单位(url)作图。所示为3+1或2+1形式的nf b诱导,这些形式与表达人fap的nih/3t3成纤维细胞交联(图9a)、与2:1比率的二级抗体交联(图9b)或没有进一步交联(图9c)。同种型对照抗体不诱导任何nf b活化。所有含ox40的构建体均诱导剂量依赖性nf b活化。由于在不
存在交联的情况下已组装三聚体核心ox40受体信号传导单元,因此包含四个ox40 fab片段的四价形式诱导一定的nf b活化且为最强效的。包含呈三价或二价形式的ox40克隆moxr0916的双特异性抗原结合分子相应地显示较低的生物活性。表达人fap的成纤维细胞经由fap结合部分或二级交联抗体经由ox40抗原结合分子的fc区所引起的额外交联进一步增加nf b活化。克隆ox40(moxr0916)已以2+1形式实现最高的nfkb活化诱导,3+1形式并未获得进一步益处。所示为两个重复的平均值。误差条表示sem。
94.图10a至10c显示包含ox40克隆clc563的不同双特异性抗原结合分子在表达ox40的报道细胞系hela_hox40_nfκb_luc1中的nf b介导的荧光素酶表达活性。将呈不同形式的双特异性抗原结合分子或其对照的浓度对在温育并添加荧光素酶检测溶液后测量的光释放单位(url)作图。所示为3+1或2+1形式的nf b诱导,这些形式与表达人fap的nih/3t3成纤维细胞交联(图10a)、与2:1比率的二级抗体交联(图10b)或没有进一步交联(图10c)。同种型对照抗体不诱导任何nf b活化。所有含ox40的构建体均诱导剂量依赖性nf b活化。由于在不存在交联的情况下已组装三聚体核心ox40受体信号传导单元,因此包含四个ox40 fab片段的四价形式诱导一定的nf b活化且为最强效的。包含呈三价或二价形式的ox40克隆clc563的双特异性抗原结合分子显示较低的生物活性。表达人fap的成纤维细胞经由fap结合部分或二级交联抗体经由ox40抗原结合分子的fc区所引起的额外交联进一步增加nf b活化。克隆ox40(clc563)以3+1形式实现最高的nf b活化诱导,其较2+1形式略微更强效。所示为两个重复的平均值。误差条表示sem。
95.图11a至11c显示呈不同形式的在vh结构域中具有氨基酸突变的ox40克隆49b4的不同变体在表达ox40的报道细胞系hela_hox40_nfκb_luc1中的nf b介导的荧光素酶表达活性,并且与包含ox40克隆49b4的呈4+1形式的双特异性抗原结合分子(p1ae6838)进行比较。将呈不同形式的双特异性抗原结合分子或其对照的浓度对在温育并添加荧光素酶检测溶液后测量的光释放单位(url)作图。所示为nf b诱导,与表达人fap的nih/3t3成纤维细胞交联(图11a)、与2:1比率的二级抗体交联(图11b)或没有进一步交联(图11c)。同种型对照抗体不诱导任何nf b活化。所有氨基酸变体诱导剂量依赖性nk b活化的程度均与呈4+1形式的ox40(49b4)抗体类似。由于三聚体核心ox40受体信号传导单元的组装,因此以四价使用ox40抗原结合结构域诱导一定的nf b活化。表达人fap的成纤维细胞经由fap结合部分或二级交联抗体经由ox40抗原结合分子的fc区所引起的额外交联进一步增加nf b活化,其在较低浓度下已显而易见。所示为两个重复的平均值。误差条表示sem。
96.图12a和12b显示与不同的参照分子(p1ad3690,即包含四个ox40(49b4)fab片段的非靶向分子;p1ad4524,即包含四个ox40(49b4)fab片段和fap抗体4b9作为c末端vh/vl的分子;p1ad4353,即包含两个ox40(49b4)fab片段和fap抗体4b9的分子;和p1ad3691,即包含两个ox40(49b4)fab片段和两个fap(28h1)fab片段的分子)相比,双特异性抗原结合分子p1ae6838的原代t细胞生物活性。图12a显示cd4
+
t细胞的数目,并且图12b显示在终点时cd4
+
t细胞上的cd25活化标志物表达。观察到fap靶向的四价ox40抗原结合分子以剂量依赖性方式增加增殖以及cd25活化标志物表达。与四价相比,二价分子导致生物活性降低,这与49b4为亲合力驱动的ox40抗体的事实一致。非靶向ox40分子在最高测试浓度下显示最小活性,而同种型对照在基线校正后不显示活化。所示为三个重复的平均值。误差条表示sem。
97.图13a和13b显示与p1ad4524(一种包含四个ox40(49b4)fab片段和fap抗体4b9作
为c末端vh/vl的分子)相比,包含ox40(49b4)以及fap(1g1a)的呈4+1、3+1和2+1形式的双特异性抗原结合分子的原代t细胞生物活性。图13a显示cd4
+
t细胞的数目,并且图13b显示在终点时cd4
+
t细胞上的cd25活化标志物表达。观察到fap靶向的四价ox40抗原结合分子以剂量依赖性方式增加增殖以及cd25活化标志物表达。与四价相比,三价和在更大程度上二价ox40抗原结合分子导致生物活性降低,这与49b4为亲合力驱动抗体的事实一致。同种型对照在基线校正后不显示活化。所示为三个重复的平均值。误差条表示sem。
98.图14a和14b显示与p1ae6838(一种包含四个ox40(49b4)fab片段的分子)相比,包含克隆ox40(8h9)的呈3+1和2+1形式的双特异性抗原结合分子的原代t细胞生物活性。图14a显示cd4
+
t细胞的数目,并且图14b显示在终点时cd4
+
t细胞上的cd25活化标志物表达。观察到fap靶向的四价ox40抗原结合分子以剂量依赖性方式增加增殖以及cd25活化标志物表达。与四价克隆49b4相比,包含克隆8h9的三价和二价抗原结合分子导致最大反应略微降低,其中亚纳摩尔ec
50
相当。同种型对照在基线校正后不显示活化。所示为三个重复的平均值。误差条表示sem。
99.图15a和15b显示与p1ae6838(一种包含四个ox40(49b4)fab片段的分子)相比,包含克隆ox40(moxr0916)的呈3+1和2+1形式的双特异性抗原结合分子的原代t细胞生物活性。图15a显示cd4
+
t细胞的数目,并且图15b显示在终点时cd4
+
t细胞上的cd25活化标志物表达。观察到fap靶向的四价ox40抗原结合分子以剂量依赖性方式增加增殖以及cd25活化标志物表达。与包含克隆49b4的四价分子相比,包含克隆moxr0916的三价和二价抗原结合分子使得cd4
+
t细胞数目相似且使得最大cd25表达降低。在含有moxr0916的分子的最高测试浓度下,cd4
+
t细胞的下降是活化诱导细胞死亡指标。同种型对照在基线校正后不显示活化。所示为三个重复的平均值。误差条表示sem。
100.图16a和16b显示与p1ae6838(一种包含四个ox40(49b4)fab片段的分子)相比,包含克隆ox40(clc563)的呈3+1和2+1形式的双特异性抗原结合分子的原代t细胞生物活性。图16a显示cd4
+
t细胞的数目,并且图16b显示在终点时cd4
+
t细胞上的cd25活化标志物表达。观察到fap靶向的四价ox40抗原结合分子以剂量依赖性方式增加增殖以及cd25活化标志物表达。与包含克隆49b4的四价分子相比,包含克隆clc563的三价和二价抗原结合分子使得cd4
+
t细胞数目相似且使得最大cd25表达降低。同种型对照在基线校正后不显示活化。所示为三个重复的平均值。误差条表示sem。
101.图17a和17b显示呈不同形式的在vh结构域中具有氨基酸突变的ox40克隆49b4的不同变体的原代t细胞生物活性,并且与包含ox40克隆49b4的呈4+1形式的双特异性抗原结合分子(p1ae6838)进行比较。图17a显示cd8
+
t细胞的数目,并且图17b显示在终点时cd4
+
t细胞上的cd25活化标志物表达。观察到fap靶向的四价ox40抗原结合分子以剂量依赖性方式增加增殖以及cd25活化标志物表达。就cd8
+
t细胞增殖以及cd4
+
t细胞上的cd25上调而言,这三种四价氨基酸变体展示与亲代抗体相当的活性。同种型对照在基线校正后不显示活化。所示为三个重复的平均值。误差条表示sem。
102.图18中提供对所有抗原结合分子在终点处测量的cd4
+
t细胞上cd25活化标志物表达的曲线下面积(auc)的归一化概览。
103.图19显示如在三只不同的雌性hufcrn小鼠(f350、f351和f353)中测量的参照分子p1ad4524的血清浓度-时间曲线和平均值曲线。
104.图20a至20c显示如参照化合物p1ad4524中所包括的fap克隆4b9的fab区的等电位表面区域。黑色网格描绘带正电荷的区片,而白色网格描绘带负电荷的区片。图20a给予背面视图,图20b显示正面视图且图20c图示抗体的顶部。图20d至20f显示如本发明分子中所包括的fap克隆1g1a的fab区的等电位表面区域。黑色网格描绘带正电荷的区片,而白色网格描绘带负电荷的区片。图20d给予背面视图,图20e显示正面视图且图20f图示fab的顶部。
105.图21显示在三种不同的雌性hufcrn小鼠(f350、f351和f353)中测量的包含c末端交叉fab片段的双特异性抗原结合分子p1ae6836与包含c末端融合fc区的vh和vl结构域的参照分子p1ad4524相比的血清浓度-时间曲线和平均值曲线。
106.图22a至22c显示如参照化合物p1ad4524中所包括的ox40克隆49b9的fab区的等电位表面区域。黑色网格描绘带正电荷的区片,而白色网格描绘带负电荷的区片。图22a给予背面视图,图22b显示正面视图且图22c图示抗体的顶部。
107.图23a至23c显示ox40克隆8h9的fab区的等电位表面区域。黑色网格描绘带正电荷的区片,而白色网格描绘带负电荷的区片。图23a给予背面视图,图23b显示正面视图且图23c图示抗体的顶部。
108.图24a至24c显示ox40克隆clc563的fab区的等电位表面区域。黑色网格描绘带正电荷的区片,而白色网格描绘带负电荷的区片。图24a给予背面视图,图24b显示正面视图且图24c图示抗体的顶部。
109.图25a至25c显示ox40克隆moxr0916的fab区的等电位表面区域。黑色网格描绘带正电荷的区片,而白色网格描绘带负电荷的区片。图25a给予背面视图,图25b显示正面视图且图25c图示抗体的顶部。
110.图26是arc测定中所用的transwell系统的示意图。将马丁达比犬肾细胞(madin-darby canine kidney cell,mdck)接种于transwell系统的顶端区室中。mdck细胞已经用人fcrn转染。
111.图27a至27c显示如利用实例7.1中所述的测定所测量的一组人个体血浆样品中先前存在的抗药物抗体(ada)反应性。对于如wo 2017/060144a1中所述的其中vh和vl结构域以c末端连接至每条重链的双特异性抗原结合分子ox40(49b4)
×
fap(4b9)(4+1),观察到高信号具有高发生率(图27a)。对于融合至fc结构域的c末端的vh和vl结构域由fab片段替代的双特异性抗原结合分子,检测到较少的发生率。然而,如自图27b中的ox40(49b4)
×
fap(4b9)(4+1)以及图27c中的ox40(49b4)
×
fap(1g1a)(4+1)可见,似乎仍存在针对fab片段的先前存在的抗药物抗体。1g1a是fap克隆212的人源化变体(h212)。
112.图28比较在一组人个体血浆样品中,包含不同的抗ox40克隆(49b4、8h9、mox0916和clc-563)的呈2+1形式的双特异性抗原结合分子的先前存在的抗药物抗体(ada)反应性。
113.图29a显示对照分子、即非靶向四价ox40(49b4)抗原结合分子(p1ad3690)、fap(1g1a)抗体(p1ae1689)或种系对照抗体(dp47)不引起先前存在的抗药物抗体(ada)反应性,而如图29b中所示,包含融合在fc结构域的c末端的fab片段的双特异性抗原分子均引起先前存在的igg干扰。令人惊讶地,较小的2+1分子较呈3+1和4+1形式的分子诱导略高的发生率。
114.图30a至30c涉及双特异性抗原结合分子ox40(49b4)
×
fap(1g1a)(3+1)的先前存在的抗药物抗体(ada)反应性的测试。如图30a中可见,包含具有"游离"c末端epksc的ch1结
构域的分子诱导先前存在的ada反应性。通过在没有药物分子的情况下实施测定所测量的个别缓冲液背景信号示于图30b中,并且图30c显示减去背景信号的分子的先前存在的ada反应性。
115.图31a至31c:如图30c中所测定的双特异性抗原结合分子ox40(49b4)
×
fap(1g1a)(3+1)在一组人个体血浆样品中先前存在的抗药物抗体(ada)反应性也示于图31a中,并且将其与由包含epkscd末端的双特异性分子ox40(moxr0916)
×
fap(1g1a)(3+1)(图31b)或由包含epkscs末端的双特异性分子ox40(moxr0916)
×
fap(1g1a)(3+1)(图31c)诱导的先前存在的igg反应性进行比较。观察到epksd变体使得先前存在的ada反应性显著降低,而epkscs变体使得先前存在的ada反应性完全消除。
116.图32a至32c显示呈2+1形式的各自的分子集,并且对以下的先前结果予以证实:与具有游离c末端epksc的分子ox40(49b4)
×
fap(1g1a)(2+1)(p1ae6840,图32a)相比,具有epkscd末端的双特异性抗原结合分子ox40(moxr0916)
×
fap(1g1a)(2+1)(p1af4852,图32b)降低与血浆中先前存在抗体的反应性,而具有epkscs末端的双特异性抗原结合分子ox40(moxr0916)
×
fap(1g1a)(2+1)(p1af4858,图32c)消除与血浆中先前存在抗体的反应性。
117.图33a至33f证实三个其他实例观察到相同的效应。显示以下各项在一组人个体血浆样品中先前存在的ada反应性:具有epkscd末端的ox40(clc563)
×
fap(1g1a)(3+1)(p1af6454,图33a)、具有epkscs末端的ox40(clc563)
×
fap(1g1a)(3+1)(p1af6455,图33b)、具有epkscd末端的ox40(clc563)
×
fap(1g1a)(4+1)(p1af7205,图33c)、具有epkscs末端的ox40(clc563)
×
fap(1g1a)(4+1)(p1af7217,图33d)、具有epkscd末端的ox40(49b4_k23e_k73e)
×
fap(1g1a)(3+1)(p1af6456,图33e)以及具有epkscs末端的ox40(49b4_k23e_k73e)
×
fap(1g1a)(3+1)(p1af6457,图33f)。
118.图34a至34f显示包含ox40克隆ox40(49b4_k23e_k73e)或ox40(clc563)的呈3+1和4+1形式作为如所指示的d和s变体的双特异性抗原结合分子的细胞结合。使对活化cd4细胞(图34a、34c、34e)以及活化cd8 t细胞(图34c、34d、34f)设门的ox40阳性活化pbmc分别与测试抗体的指示连续稀释液一起温育,接着通过针对人fcγ的荧光标记2级抗体检测。对活细胞设门,并且自两个重复绘制二级抗体的平均荧光强度,基线由仅培养基样品校正。图34a显示作为d和s变体的ox40(clc563)3+1构建体与活化cd4细胞的结合,并且与活化cd8 t细胞的结合示于图34b中。图34c和图34d中显示作为d和s变体的ox40(clc563)4+1构建体分别在活化cd4细胞上以及在活化cd8细胞上的结合。作为d和s变体的ox40(49b4_k23e_k73e)4+1构建体与活化cd4细胞以及与活化cd8 t细胞的结合分别示于图34e和图34f中。作为对照分子,使用非靶向四价ox40(49b4)4+0构建体(p1ad3690)、四价ox40(49b4)-fap(4b9)4+1构建体(p1ad4524)以及同种型对照。
119.图35a至35f显示表达ox40的报道细胞系hela_hox40_nfκb_luc1中nfκb介导的荧光素酶表达活性。将包含ox40克隆ox40(49b4_k23e_k73e)或ox40(clc563)的呈3+1和4+1形式作为d和s变体的双特异性抗原结合分子的浓度对在温育并添加荧光素酶检测溶液后测量的光释放单位(url)作图。所示为nfκb诱导,与表达人fap的nih/3t3成纤维细胞交联(图35a为作为d和s变体的ox40(clc563)3+1构建体,图35c为作为d和s变体的ox40(clc563)4+1构建体且图35e为作为d和s变体的ox40(49b4_k23e_k73e)4+1构建体),或没有进一步交联
(图35b为作为d和s变体的ox40(clc563)3+1构建体,图35d为作为d和s变体的ox40(clc563)4+1构建体且图35f为作为d和s变体的ox40(49b4_k23e_k73e)4+1构建体)。同种型对照抗体不诱导任何nfκb活化。所有含ox40的构建体均诱导剂量依赖性nfκb活化。由于在不存在交联的情况下已组装三聚体核心ox40受体信号传导单元,因此包含四个ox40 fab片段的四价形式诱导一定的nfκb活化。s和d变体的性能相似。所示为两个重复的平均值。误差条表示sem。
120.图36a至36f显示包含ox40克隆ox40(49b4_k23e_k73e)或ox40(clc563)的呈3+1和4+1形式作为如所指示的d和s变体的双特异性抗原结合分子的原代t细胞生物活性。此处所评价的生物活性标志物为在终点时cd4
+
t细胞(图36a为ox40(clc563)3+1构建体,图36c为ox40(clc563)4+1构建体且图36e为ox40(49b4_k23e_k73e)4+1构建体)以及cd8
+
t细胞(图36b为ox40(clc563)3+1构建体,图36d为ox40(clc563)4+1构建体且图36f为ox40(49b4_k23e_k73e)4+1构建体)上的cd25活化标志物表达。观察到fap靶向的ox40抗原结合分子以剂量依赖性方式增加增殖以及cd25活化标志物表达。非靶向ox40分子仅在最高测试浓度下显示活性,而同种型对照在基线校正后不显示活化。在s与d变体之间未能检测到统计学上显著的差异。所示为两个重复的平均值。误差条表示sem。
121.图37a至37f显示,利用fap靶向的ox40激动剂进行共刺激增强由ceacam5 tcb介导的肿瘤细胞溶解诱导的pbmc的细胞因子分泌。使pbmc与mkn45 nlr靶细胞、fap
+
nih/3t3-hufap克隆19、cecam5tcb[2nm]以及包含ox40克隆ox40(49b4_k23e_k73e)或ox40(clc563)的呈3+1和4+1形式作为如所指示的d和s变体的双特异性抗原结合分子共培养48小时。此处所评价的生物活性标志物为测定上清液中gm-csf(图37a为ox40(clc563)3+1构建体,图37c为ox40(clc563)4+1构建体且图37e为ox40(49b4_k23e_k73e)4+1构建体)以及tnf-α(图37b为ox40(clc563)3+1构建体,图37d为ox40(clc563)4+1构建体且图37f为ox40(49b4_k23e_k73e)4+1构建体)相对于仅tcb处理样品的倍数增加。据观察,仅fap交联的ox40激动剂以剂量依赖性方式诱导细胞因子。非靶向ox40对照分子(p1ad3690)以及同种型对照在此处不显示活性。与d变体相比,s变体显示生物活性降低的趋势。所示为三个重复的平均值。
[0122]
图38a至38f也显示,利用fap靶向的ox40激动剂进行共刺激增强由ceacam5 tcb介导的肿瘤细胞溶解诱导的pbmc的细胞因子分泌。使pbmc与mkn45 nlr靶细胞、fap
+
nih/3t3-hufap克隆19、cecam5tcb[2nm]以及包含ox40克隆ox40(49b4_k23e_k73e)或ox40(clc563)的呈3+1和4+1形式作为如所指示的d和s变体的双特异性抗原结合分子共培养48小时。此处所评价的生物活性标志物为测定上清液中ifn(图38a为ox40(clc563)3+1构建体,图38c为ox40(clc563)4+1构建体且图38e为ox40(49b4_k23e_k73e)4+1构建体)以及il-2(图38b为ox40(clc563)3+1构建体,图38d为ox40(clc563)4+1构建体且图38f为ox40(49b4_k23e_k73e)4+1构建体)相对于仅tcb处理样品的倍数增加。据观察,仅fap交联的ox40激动剂以剂量依赖性方式诱导细胞因子。非靶向ox40对照分子(p1ad3690)以及同种型对照在此处不显示活性。与d变体相比,s变体显示生物活性降低的趋势。所示为三个重复的平均值。
[0123]
图39汇总数据,并且显示利用所有fap靶向的ox40激动剂进行共刺激均增强由ceacam5 tcb介导的肿瘤细胞溶解诱导的pbmc的细胞因子分泌。计算图37a至37f以及38a至38f中剂量反应曲线的auc,并且针对ox40(clc563)
×
fap(1g1a_epkscd)3+1抗原结合分子(p1af6454,也称为3+1clc563/h212-d)的auc作归一化。在盒须图中,每一符号表示一种细
胞因子。
[0124]
图40a至40c显示,利用fap靶向的ox40激动剂进行共刺激抑制tgfβ对treg细胞上foxp3的诱导。在利用针对cd28以及cd3的抗体活化t细胞期间,在tgfβ存在下培养含有原初cd4 t细胞的人pbmc制剂。经由包含ox40克隆ox40(clc563)或ox40(49b4_k23e_k73e)的呈3+1和4+1形式作为d和s变体的双特异性抗原结合分子的连续稀释列提供ox40激动作用。通过包覆至珠粒的fap抗原提供交联。ox40激动作用干扰treg诱导,这可通过foxp3表达减少看出。对活的cd4
+
cd25
+
treg单态细胞设门,并且报告αfoxp3抗体的mfi。通过不含ox40抗体的样品(由此仅存在tgbβ)的mfi校正每一浓度的foxp3 mfi。图40a显示ox40(clc563)3+1构建体的效应,图40b显示ox40(clc563)4+1构建体的效应且图40c显示ox40(49b4_k23e_k73e)4+1构建体的效应。每一fap靶向的ox40双特异性抗原结合分子的d和s变体将foxp3抑制至相似的范围。所示为三个重复的平均值,误差条表示sem。
[0125]
图41显示hu fcrn小鼠中ox40(clc563)
×
fap(1g1a_epkscd)3+1抗原结合分子(p1ae6454)以及ox40(49b4)
×
fap(4b9)4+1抗原结合分子(p1ad4524)的单剂量血浆浓度-时间曲线。
[0126]
图42a和42b显示在与fap
×
ox40双特异性抗原结合分子一起温育时,人全血样品中细胞因子il-6的释放。所示为相对于作为阴性比较物的的信号,每一供体以及不同浓度的中值信号。在图42a中,显示双特异性抗体c1、c2和c3(参见实例8.1.1)的中值信号,而双特异性抗体c4、c5、c6和c7的中值信号示于图42b中。
[0127]
图43a和43b显示在与fap
×
ox40双特异性抗原结合分子一起温育时,人全血样品中细胞因子il-8的释放。所示为相对于作为阴性比较物的的信号,每一供体以及不同浓度的中值信号。在图43a中,显示双特异性抗体c1、c2和c3(参见实例8.1.1)的中值信号,并且在图43b中,显示双特异性抗体c4、c5、c6和c7的中值信号。
[0128]
图44a和44b显示dc:cd4
+
t细胞测定的结果,该测定评价双特异性fap
×
ox40抗体p1af6454和p1af6455与作为阳性对照的钥孔帽贝血蓝蛋白(klh)以及贝伐珠单抗(bevacizumab)相比的序列相关免疫原性风险。图44a显示ifn刺激对刺激指数的图,并且图44b给出以反应者%计的反应率概览。
[0129]
图45a和45b涉及dc:cd4
+
t细胞测定的结果,该测定评价p1ad4524针对作为阳性对照的钥孔帽贝血蓝蛋白(klh)以及贝伐珠单抗以及阿达木单抗(adalimumab)图45a显示ifn刺激对刺激指数的图,并且图45b给出以反应者%计的反应率概览。
[0130]
图46、47和48显示在c57bl/6野生型小鼠以及对人igg1抗体免疫耐受的转基因c57bl/6-tg(higg1,k,l)小鼠中的4周免疫原性研究的结果。用p1af6455治疗的两个单独小鼠组的免疫反应示于图46中,用p1af6454治疗的两个单独小鼠组的那些免疫反应示于图47中,并且用p1ad4524治疗的两个单独小鼠组获得的免疫反应图示于图48中。
[0131]
图49显示在人源化小鼠中的mkn45异种移植物中,双特异性fap
×
ox40抗体(不同的ox40克隆相比较)与ceacam5 tcb组合的功效研究的研究设计。所示为设计和不同的治疗组。对包含抗体ox40(49b4_k23e_k73e,此处称为49b4 cpv)、ox40(clc563)、ox40(8h9)以及ox40(49b4)的双特异性fap
×
ox40抗体进行比较。
[0132]
图50a和50b显示fap
×
ox40双特异性抗体与ceacam5 tcb的组合在人源化小鼠中的mkn45异种移植物中的功效研究结果。所示为不同治疗组的个体小鼠的平均肿瘤体积(图50a)或肿瘤体积变化百分比(图50b),如在y轴上所绘制。
具体实施方式
[0133]
定义
[0134]
除非另有定义,否则本文使用的所有技术术语和科技术语都具有如在本发明所属领域中通常使用的相同含义。出于解释本说明书的目的,将应用以下定义,并且在适当时,以单数形式使用的术语也将包括复数,反之亦然。
[0135]
如本文所用,术语“抗原结合分子”在其最广义上是指特异性结合抗原决定簇的分子。抗原结合分子的示例是抗体、抗体片段和支架抗原结合蛋白。
[0136]
如本文所用,术语“能够特异性结合至靶细胞抗原的抗原结合结构域”或“能够特异性结合至靶细胞抗原的部分”是指特异性结合至抗原决定簇的多肽分子。在一个方面,抗原结合结构域能够通过其靶细胞抗原活化信号传导。在特定方面,抗原结合结构域能够将与其附接的实体(例如ox40激动型抗体)引导至靶位点,例如引导至携带抗原决定簇的特定类型的肿瘤细胞或肿瘤基质。能够特异性结合至靶细胞抗原的抗原结合结构域包括如本文进一步定义的抗体及其片段。另外,能够特异性结合至靶细胞抗原的抗原结合结构域包括如本文进一步定义的支架抗原结合蛋白,例如基于设计的重复序列蛋白或设计的重复序列结构域的结合结构域(参见例如wo 2002/020565)。特别地,能够与靶细胞抗原特异性结合的抗原结合结构域为能够与成纤维细胞活化蛋白(fap)特异性结合的抗原结合结构域。
[0137]
关于抗体或其片段,术语“能够特异性结合至靶细胞抗原的抗原结合结构域”是指分子的一部分,其包含与抗原的一部分或全部特异性结合并且与之互补的区域。可通过例如一种或多种抗体可变结构域(也称为抗体可变区)来提供能够特异性抗原结合的抗原结合结构域。特别地,能够特异性抗原结合的抗原结合结构域包括抗体轻链可变区(vl)和抗体重链可变区(vh)。在一个特定方面,“能够特异性结合至靶细胞抗原的抗原结合结构域”为fab片段或交叉fab片段。
[0138]
本文的术语“抗体”以最广义使用并且涵盖各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、单特异性和多特异性抗体(例如,双特异性抗体),以及抗体片段,只要它们表现出所需的抗原结合活性即可。
[0139]
如本文所用的术语“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即,除了可能的变异抗体(例如含有天然存在的突变或在单克隆抗体制剂的生产过程中产生,此类变体通常以少量存在)之外,包含所述群体的各个抗体是相同的和/或结合相同的表位。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂中的每种单克隆抗体针对抗原上的单一决定簇。
[0140]
如本文所用,术语“单特异性”抗体表示具有一个或多个结合位点的抗体,每个结合位点与相同抗原的相同表位结合。术语“双特异性”意指抗原结合分子能够特异性结合至至少两种独特的抗原决定簇。通常,双特异性抗原结合分子包含两个抗原结合位点,这两个抗原结合位点中的每个抗原结合位点对不同的抗原决定簇具有特异性。在某些实施例中,双特异性抗原结合分子能够同时结合两种抗原决定簇,特别是在两种独特细胞上表达的两
种抗原决定簇。如本文所述的双特异性抗原结合分子还可形成多特异性抗体的一部分。
[0141]
本技术中所用的术语“价态”表示在对一种独特抗原决定簇具有特异性的抗原结合分子中存在特定数量的对一种独特抗原决定簇具有特异性的结合位点。因此,术语“二价”、“三价”、“四价”和“六价”分别表示在抗原结合分子中存在对特定抗原决定簇具有特异性的两个结合位点、三个结合位点、四个结合位点点和六个结合位点。在本发明的特定方面,根据本发明的双特异性抗原结合分子对特定抗原决定簇可以是单价的,意味着它们对所述抗原决定簇仅具有一个结合位点,或者对特定抗原决定簇可以是二价或四价的,意味着它们对所述抗原决定簇分别具有两个结合位点或四个结合位点。
[0142]
术语“全长抗体”和“完整抗体”在本文中可互换使用,是指具有与天然抗体结构基本上相似的结构的抗体。“天然抗体”是指具有不同结构的天然存在的免疫球蛋白分子。举例而言,天然igg类抗体是约150,000道尔顿的异四聚体糖蛋白,其包含通过二硫键键合的两条轻链和两条重链。从n末端到c末端,每条重链具有可变区(vh)(也称为可变重链结构域或重链可变结构域),接着是三个恒定结构域(ch1、ch2和ch3)(也称为重链恒定区)。类似地,从n末端到c末端,每条轻链具有可变区(vl)(也称为可变轻链结构域或轻链可变结构域),接着是轻链恒定结构域(cl)(也称为轻链恒定区)。抗体的重链可以分配为五种类型中的一种,所述五种类型被称为α(iga)、δ(igd)、ε(ige)、γ(igg)或μ(igm),它们中的一些可以进一步分为亚型,例如γ1(igg1)、γ2(igg2)、γ3(igg3)、γ4(igg4)、α1(iga1)和α2(iga2)。抗体的轻链基于其恒定结构域的氨基酸序列,可以归属于两种类型中的一种,所述两种类型称为卡帕(κ)和兰姆达(λ)。
[0143]“抗体片段”是指完整抗体以外的分子,其包含完整抗体的一部分,所述部分结合完整抗体所结合的抗原。抗体片段的示例包括但不限于fv、fab、fab'、fab'-sh、f(ab')2;双体抗体、三体抗体、四体抗体、交叉fab片段;线性抗体;单链抗体分子(例如scfv);以及单结构域抗体。关于某些抗体片段的综述,参见hudson等人,nat med 9,129-134(2003)。关于scfv片段的综述,参见例如pl
ü
ckthun在the harmacology of monoclonal antibodies,vol.113,rosenburg and moore eds.,springer-verlag,new york,pp.269-315(1994)中所述;还可参见wo 93/16185;以及美国专利5,571,894和5,587,458。关于对包含补救受体结合表位残基并具有增加的体内半衰期的fab片段和f(ab')2片段的讨论,参见美国专利5,869,046。双体抗体是具有两个抗原结合位点的抗体片段,该双体抗体可以是二价的或双特异性的,参见例如ep 404,097;wo 1993/01161;hudson等人,nat med 9,129-134(2003);以及hollinger等人,proc natl acad sci usa 90,6444-6448(1993)。在hudson等人,nat med 9,129-134(2003)中也描述了三体抗体和四体抗体。单结构域抗体为包含抗体的全部或部分重链可变结构域或全部或部分轻链可变结构域的抗体片段。在某些实施例中,单结构域抗体是人单结构域抗体(domantis,inc.,waltham,ma;参见例如美国专利6,248,516b1)。抗体片段可以通过各种技术制备,包括但不限于完整抗体的蛋白水解消化以及由重组宿主细胞(例如大肠杆菌或噬菌体)产生,如本文所述。
[0144]
木瓜蛋白酶消化完整抗体产生两个称为“fab”片段的相同的抗原结合片段,每个“fab”片段含有重链可变结构域和轻链可变结构域以及轻链的恒定结构域和重链的第一恒定结构域(ch1)。因此,如本文所用,术语“fab片段”是指包含轻链片段以及重链的vh结构域和第一恒定结构域(ch1)的抗体片段,所述轻链片段包含vl结构域和轻链恒定结构域(cl)。
eng.des.sel.18,435-444(2005)、us20080139791、wo2005056764和us6818418b1。肽适体是组合的识别分子,该组合的识别分子由恒定的支架蛋白,通常是硫氧还蛋白(trxa)组成,所述恒定的支架蛋白含有在活性位点处插入的受约束的可变肽环。关于进一步细节,参见expert opin.biol.ther.5,783-797(2005)。微型体来源于含有3-4个半胱氨酸桥、长度为25-50个氨基酸的天然存在的微蛋白,所述微蛋白的示例包括kalatabi和芋螺毒素以及knottin。微蛋白具有环,其可以经工程化改造为包括多达25个氨基酸而不影响微蛋白的整体折叠。关于工程化改造的knottin结构域的进一步细节,参见wo2008098796。
[0150]
作为参考分子的“结合相同表位的抗原结合分子”是指这样的抗原结合分子,在竞争测定中所述抗原结合分子使参考分子与其抗原的结合被阻断50%或更多,并且相反地,在竞争测定中参考分子使抗原结合分子与其抗原的结合被阻断50%或更多。作为参考分子的“不结合相同表位的抗原结合分子”是指这样的抗原结合分子,在竞争测定中所述抗原结合分子未使参考分子与其抗原的结合阻断50%或更多,并且相反地,在竞争测定中参考分子未使抗原结合分子与其抗原的结合阻断50%或更多。
[0151]
术语“抗原结合结构域”或“抗原结合位点”是指抗原结合分子的一部分,其包含与抗原的一部分或全部特异性结合并互补的区域。在抗原较大的情况下,抗原结合分子可以仅与抗原的特定部分结合,该部分称为表位。抗原结合结构域可以由例如一个或多个可变结构域(也称为可变区)提供。优选地,抗原结合结构域包含抗体轻链可变区(vl)和抗体重链可变区(vh)。
[0152]
如本文所用,术语“抗原决定簇”与“抗原”和“表位”同义,并且是指多肽大分子上的位点(例如一段连续的氨基酸或由非连续氨基酸的不同区域组成的构象构型),抗原结合部分与所述位点结合,从而形成抗原结合部分-抗原复合物。有用的抗原决定簇可以在例如肿瘤细胞的表面上、病毒感染细胞的表面上、其他患病细胞的表面上、免疫细胞的表面上、血清中的游离物和/或细胞外基质(ecm)中找到。除非另有说明,否则本文中用作抗原的蛋白质可以是来自任何脊椎动物来源的任何天然形式的蛋白质,该脊椎动物来源包括哺乳动物诸如灵长类动物(例如人)和啮齿动物(例如小鼠和大鼠)。在一个特定实施例中,抗原是人蛋白质。当提及本文中的特定蛋白质时,该术语涵盖“全长”、未加工的蛋白质,以及由细胞内加工而产生的任何形式的蛋白质。该术语还涵盖天然存在的蛋白质变体,例如剪接变体或等位基因变体。
[0153]“特异性结合”是指结合对于抗原具有选择性,并且可以与不需要的或非特异性的相互作用区分开。抗原结合分子与特定抗原结合的能力可以通过酶联免疫吸附测定(elisa)或本领域技术人员熟悉的其他技术(例如表面等离子体共振(spr)技术(在biacore仪器上分析)(liljeblad等人,glyco j 17,323-329(2000))以及传统的结合测定(heeley,endocr res 28,217-229(2002))来测量。在一个实施例中,例如如通过spr所测得的,抗原结合分子与不相关蛋白的结合程度小于所述抗原结合分子与抗原的结合程度的约10%。在某些实施例中,与抗原结合的分子的解离常数(kd)为≤1μm、≤100nm、≤10nm、≤1nm、≤0.1nm、≤0.01nm或≤0.001nm(例如10-8
m或更低,例如10-8
m至10-13
m,例如10-9
m至10-13
m)。
[0154]“亲和力”或“结合亲和力”是指分子(例如抗体)的单个结合位点与其结合配偶体(例如抗原)之间的非共价相互作用的总和的强度。除非另有说明,否则如本文所用,“结合亲和力”是指内在结合亲和力,其反映了结合对的成员(例如抗体和抗原)之间的1:1相互作
用。分子x对其配偶体y的亲和力通常可以用解离常数(kd)表示,解离常数(kd)是解离速率常数与缔合速率常数(分别为koff和kon)的比率。因此,等效亲和力可以包括不同的速率常数,只要速率常数的比率保持相同即可。亲和力可以通过本领域已知的常规方法测量,包括本文所述的那些方法。测量亲和力的特定方法是表面等离子体共振(spr)。
[0155]“亲和力成熟的”抗体是指在一个或多个高变区(hvr)中具有一个或多个改变的抗体,与不具有此类改变的亲本抗体相比,此类改变导致了抗体对抗原的亲和力的改善。
[0156]
如本文所用,“靶细胞抗原”是指存在于靶细胞表面上的抗原决定簇,特别地肿瘤中的靶细胞(诸如癌细胞或肿瘤基质的细胞)。因此,靶细胞抗原是肿瘤相关抗原。特别地,肿瘤靶细胞抗原为成纤维细胞活化蛋白(fap)。
[0157]
术语“成纤维细胞活化蛋白(fap)”也称为脯氨酰内肽酶fap或seprase(ec 3.4.21),除非另有说明,否则该术语是指来自任何脊椎动物来源的任何天然fap,该脊椎动物来源包括哺乳动物诸如灵长类动物(例如人)、非人灵长类动物(例如食蟹猴)和啮齿动物(例如小鼠和大鼠)。该术语包括“全长”的未加工fap,以及通过细胞中加工产生的任何形式的fap。该术语还涵盖fap的天然存在变体,例如剪接变体或等位基因变体。在一个实施例中,本发明的抗原结合分子能够特异性结合至人、小鼠和/或食蟹猴fap。人fap的氨基酸序列示出于uniprot(www.uniprot.org)登录号q12884(149版,seq id no:2)或ncbi(www.ncbi.nlm.nih.gov/)refseq np_004451.2中。人fap的细胞外结构域(ecd)从26位的氨基酸延伸至760位的氨基酸。his标记的人fap ecd的氨基酸序列示出于seq id no:62中。小鼠fap的氨基酸序列示出于uniprot登录号p97321(126版,seq id no:63)或ncbi refseq np_032012.1中。小鼠fap的细胞外结构域(ecd)从26位的氨基酸延伸至761位的氨基酸。seq id no:64示出his标记的小鼠fap ecd的氨基酸。seq id no:65示出his标记的食蟹猴fap ecd的氨基酸。优选地,本发明的抗fap结合分子结合至fap的细胞外结构域。
[0158]
术语“可变区”或“可变结构域”是指参与抗原结合分子与抗原结合的抗体重链或轻链的结构域。天然抗体的重链和轻链的可变结构域(分别为vh和vl)通常具有相似的结构,其中每个结构域包含四个保守框架区(fr)和三个高变区(hvr)。参见例如,kindt等人,kuby immunology,第6版,w.h.freeman and co.,第91页(2007)。单个vh或vl结构域可足以赋予抗原结合特异性。
[0159]
如本文所用,术语“高变区”或“hvr”是指抗体可变结构域中在序列上高变并确定抗原结合特异性的各个区域,例如“互补决定区”(“cdr”)。通常,抗体包含六个cdr;三个在vh中(cdr-h1、cdr-h2、cdr-h3),并且三个在vl中的(cdr-l1、cdr-l2、cdr-l3)。本文中的示例性cdr包括:
[0160]
(a)存在于氨基酸残基26-32(l1)、50-52(l2)、91-96(l3)、26-32(h1)、53-55(h2)和96-101(h3)处的高可变环(chothia和lesk,j.mol.biol.196:901-917(1987));
[0161]
(b)存在于氨基酸残基24-34(l1)、50-56(l2)、89-97(l3)、31-35b(h1)、50-65(h2)和95-102(h3)处的cdr(kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md(1991));以及
[0162]
(c)存在于氨基酸残基27c-36(l1)、46-55(l2)、89-96(l3)、30-35b(h1)、47-58(h2)和93-101(h3)处的抗原接触(maccallum et al.j.mol.biol.262:732-745(1996))。
ch3结构域。人igg fc区的“ch2结构域”通常从大致231位的氨基酸残基延伸至大致340位的氨基酸残基。(根据kabat的eu编号系统)。在一个方面,ch2结构域具有apellggpsv flfppkpkdt lmisrtpevt cvwdvshedp evkfnwyvdg vevhnaktkp reeqestyrw svltvlhqdw lngkeykckv snkalpapie ktiskak(seq id no:153)的氨基酸序列。ch2结构域的独特之处在于它与另一个结构域的配对不紧密。相反,两个n连接的支链碳水化合物链介于完整天然fc区的两个ch2结构域之间。据推测,碳水化合物可能为结构域-结构域配对提供替代物,并有助于稳定ch2结构域。burton,mol.immunol.22(1985)161-206。在一个实施例中,碳水化合物链附接至ch2结构域。本文的ch2结构域可以是天然序列ch2结构域或变体ch2结构域。"ch3结构域"包含fc区中位于ch2结构域c末端的残基延伸段(即根据igg的kabat的eu编号系统,自约位置341处的氨基酸残基至约位置447处的氨基酸残基)。在一个方面,ch3结构域具有gqprepqvyt lppsrdeltk nqvsltclvk gfypsdiave wesngqpenn ykttppvlds dgsfflyskl tvdksrwqqg nvfscsvmhe alhnhytqks lslspg(seq id no:154)的氨基酸序列。本文的ch3区可以是天然序列ch3结构域或变体ch3结构域(例如在一条链中具有引入的“突起”(“杵”)而在另一条链中具有相应的引入的“空腔”(“臼”)的ch3结构域;参见以引用方式明确并入本文的美国专利号5,821,333)。此类变体ch3结构域可用于促进如本文所述的两条不相同的抗体重链的异二聚化。在一个实施例中,人igg重链fc区从cys226或从pro230延伸至重链的羧基末端。然而,fc区的c末端赖氨酸(lys447)可以存在或不存在。除非本文另外规定,否则fc区或恒定区中氨基酸残基的编号是根据eu编号系统,eu编号系统也称为eu索引,如在kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md,1991中所述。
[0171]
术语“野生型fc结构域”表示与自然界中发现的fc结构域的氨基酸序列相同的氨基酸序列。野生型人fc结构域包括天然人igg1 fc区(非a和a同种异型)、天然人igg2 fc区、天然人igg3 fc区和天然人igg4 fc区以及其天然存在的变体。野生型fc区表示在seq id no:155(igg1,白种人同种异型)、seq id no:156(igg1,非裔美国人同种异型)、seq id no:157(igg2)、seq id no:158(igg3)和seq id no:159(igg4)中。术语“变体(人)fc结构域”表示与“野生型”(人)fc结构域氨基酸序列的氨基酸序列区别在于至少一个“氨基酸突变”的氨基酸序列。在一个方面,与天然fc区相比,变体fc区具有至少一个氨基酸突变,诸如在天然fc区中从约1个至约10个氨基酸突变,并且在一个方面,从约1个至约5个氨基酸突变。在一个方面,(变体)fc区与野生型fc区具有至少约95%的同源性。
[0172]“杵臼结构(knob-into-hole)”技术描述于例如us 5,731,168;us7,695,936;ridgway等人,prot eng 9,617-621(1996)和carter,j immunol meth 248,7-15(2001)中。通常,该方法涉及在第一多肽的界面处引入突起(“杵”)并在第二多肽的界面中引入相应的空腔(“臼”),使得所述突起可以定位在所述空腔中,以便促进异二聚体的形成并阻碍同二聚体的形成。突起是通过用较大侧链(例如酪氨酸或色氨酸)替代来自第一多肽的界面的小氨基酸侧链而构建的。具有与突起相同或相似大小的补偿空腔是通过用较小的氨基酸侧链(例如丙氨酸或苏氨酸)替代大氨基酸侧链而在第二多肽的界面中创建的。突起和空腔可以通过改变编码多肽的核酸来制备,例如通过位点特异性诱变或通过肽合成。在具体实施例中,杵修饰包含fc结构域的两个亚基中的一个中的氨基酸取代t366w,而臼修饰包含fc结构
域的两个亚基中的另一个中的氨基酸取代t366s、l368a和y407v。在另一个具体实施例中,包含杵修饰的fc结构域的亚基另外包含氨基酸取代s354c,而包含臼修饰的fc结构域的亚基另外包含氨基酸取代y349c。引入这两个半胱氨酸残基导致在fc区的两个亚基之间形成二硫键,从而进一步稳定化二聚体(carter,j immunol methods 248,7-15(2001))。
[0173]“与免疫球蛋白的fc区等同的区域”旨在包括免疫球蛋白的fc区的天然存在的等位基因变体,以及具有产生取代、添加或缺失但基本上不降低免疫球蛋白介导效应子功能(诸如抗体依赖性细胞毒性)的能力的修改的变体。举例而言,可以使一个或多个氨基酸从免疫球蛋白的fc区的n末端或c末端缺失,而基本上不丧失生物学功能。可以根据本领域中已知的一般规则来选择此类变体,以便对活性具有最小的影响(参见例如bowie,j.u.等人,science 247:1306-10(1990))。
[0174]
术语“效应子功能”是指可归因于抗体的fc区、随着抗体同种型而变化的那些生物学活性。抗体效应子功能的实例包括:c1q结合和补体依赖性细胞毒性(cdc)、fc受体结合、抗体依赖性细胞介导的细胞毒性(adcc)、抗体依赖性细胞吞噬作用(adcp)、细胞因子分泌、免疫复合物介导的抗原呈递细胞的抗原摄取、下调细胞表面受体(例如b细胞受体),以及b细胞活化。
[0175]
fc受体结合依赖性效应子功能可通过抗体的fc区与fc受体(fcr)的相互作用来介导,fc受体是造血细胞上的特异性细胞表面受体。fc受体属于免疫球蛋白超家族,并且已被证明可通过吞噬免疫复合物来介导去除抗体包被的病原体,并且通过抗体依赖性细胞介导的细胞毒性(adcc)来裂解涂有相应抗体的红细胞以及其他各种细胞靶点(例如,肿瘤细胞)(参见例如van de winkel,j.g.和anderson,c.l.,j.leukoc.biol.49(1991)511-524)。fcr由其对免疫球蛋白同种型的特异性来定义:igg抗体的fc受体称为fcγr。fc受体结合描述于例如:ravetch,j.v.和kinet,j.p.,annu.修订版,immunol.9(1991)457-492;capel,p.j.等人,immunomethods 4(1994)25-34;de haas,m.等人,j.lab.clin.med.126(1995)330-341;以及gessner,j.e.等人,ann.hematol.76(1998)231-248。
[0176]
igg抗体(fcγr)fc区受体的交联触发多种效应子功能,包括吞噬作用、抗体依赖性细胞细胞毒性、炎症介质的释放以及免疫复合物清除和抗体产生的调节。已在人体中鉴定出三类fcγr,其中包括:
[0177]-fc ri(cd64)以高亲和力结合单体igg,并且在巨噬细胞、单核细胞、中性粒细胞和嗜酸性粒细胞上表达。fc区igg中在至少一个氨基酸残基e233-g236、p238、d265、n297、a327和p329(根据kabat的eu索引编号)的修饰,降低与fcγri的结合。在233-236位的igg2残基被igg1和igg4取代,使得与fcγri的结合力降低103倍,并且消除了人单核细胞对抗体敏化红细胞的应答(armour,k.l.等人,eur.j.immunol.29(1999)2613
–
2624)。
[0178]-fc rii(cd32)以中等至低亲和力结合复合igg,并得到广泛表达。该受体可分为两种亚型,即fc riia和fc riib。fc riia存在于许多参与杀伤的细胞(例如巨噬细胞、单核细胞、中性粒细胞)中,并且似乎能够活化杀伤过程。fcγriib似乎在抑制过程中起作用,并且存在于b细胞、巨噬细胞以及肥大细胞和嗜酸性粒细胞中。在b细胞上,它似乎起到抑制免疫球蛋白进一步产生以及同种型转换为例如ige类的作用。在巨噬细胞上,fcγriib用于抑制由fcγriia介导的吞噬作用。在嗜酸性粒细胞和肥大细胞上,b型可能通过ige与其单独受体的结合而有助于抑制这些细胞的活化。发现例如抗体(包含在至少一个氨基酸残基
id no:78)、ggsgngsg(seq id no:79)、ggngsgsg(seq id no:80)和ggngsg(seq id no:81)。特定目标肽接头为(g4s)(seq id no:67)、(g4s)2或ggggsggggs(seq id no:68)、(g4s)3(seq id no:72)和(g4s)4(seq id no:73)。
[0187]
如本技术中所用的术语“氨基酸”表示包括以下项的天然存在的羧基α-氨基酸的组:丙氨酸(三字母代码:ala,单字母代码:a)、精氨酸(arg,r)、天冬酰胺(asn,n)、天冬氨酸(asp,d)、半胱氨酸(cys,c)、谷氨酰胺(gln,q)、谷氨酸(glu,e)、甘氨酸(gly,g)、组氨酸(his,h)、异亮氨酸(ile,i)、亮氨酸(leu,l)、赖氨酸(lys,k)、蛋氨酸(met,m)、苯丙氨酸(phe,f)、脯氨酸(pro,p)、丝氨酸(ser,s)、苏氨酸(thr,t)、色氨酸(trp,w)、酪氨酸(tyr,y),以及缬氨酸(val,v)。
[0188]“融合”或“连接”意指组分(例如,抗体和fab片段的重链)直接地或经由一个或多个肽接头而通过肽键连接。
[0189]
相对于参考多肽(蛋白质)序列的“氨基酸序列同一性百分比(%)”被定义为在比对候选序列中的氨基酸残基与参考多肽序列中的氨基酸残基并引入缺口(如果需要的话)以实现最大的序列同一性百分比后,并且在不将任何保守取代考虑为所述序列同一性的一部分的情况下,与所述参考多肽序列中的氨基酸残基相同的所述候选序列中的氨基酸残基的百分比。用于确定氨基酸序列同一性百分比的比对可以以本领域技术范围内的各种方式实现,例如使用公众可获得的计算机软件,诸如blast、blast-2、align.sawi或megalign(dnastar)软件。本领域技术人员可确定用于比对序列的适当参数,包括在所比较的序列的全长上实现最大比对所需的任何算法。然而,为了本文的目的,使用序列比较计算机程序align-2来生成氨基酸序列同一性%的值。align-2序列比较计算机程序由基因泰克公司(genentech,inc.)编写,并且源代码已经与用户文档一起提交到u.s.copyright office,washington d.c.,20559,在那里以美国版权登记号txu510087注册。align-2程序可从基因泰克公司(genentech,inc.,south san francisco,california)公开获得,或者可以从所述源代码编译。align-2程序应经编译以在unix操作系统上使用,所述unix操作系统包括数字unix v4.0d。所有序列比较参数均由align-2程序设置并且不变。在采用align-2进行氨基酸序列比较的情况下,给定氨基酸序列a与给定氨基酸序列b的氨基酸序列同一性%(其可以另选地表达为给定氨基酸序列a具有或包含与给定氨基酸序列b的某一氨基酸序列同一性%)计算如下:
[0190]
100乘以分数x/y
[0191]
其中x是由序列比对程序align-2在该程序对a和b的比对中评分为相同匹配的氨基酸残基的数目,而其中y是b中氨基酸残基的总数。应当理解,在氨基酸序列a的长度不等于氨基酸序列b的长度的情况下,a与b的氨基酸序列同一性%将不等于b与a的氨基酸序列同一性%。除非另外特别指明,否则本文所使用的所有氨基酸序列同一性%的值是如前一段中所述使用align-2计算机程序获得的。
[0192]
在某些实施例中,考虑了本文提供的双特异性抗原结合分子的氨基酸序列变体。举例而言,可能需要改善含tnf配体三聚体的抗原结合分子的结合亲和力和/或其他生物学特性。含tnf配体三聚体的抗原结合分子的氨基酸序列变体可以通过向编码分子的核苷酸序列中引入适当的修饰或通过肽合成来制备。此类修饰包括例如抗体氨基酸序列内残基的缺失、和/或插入和/或取代。可以进行缺失、插入和取代的任何组合以实现最终构建体,前
提条件是最终构建体具有所需特征,例如抗原结合。用于取代诱变的感兴趣的位点包括hvr和框架(fr)。保守性取代在表b中表头“优选的取代”下提供,并在下文中参考氨基酸侧链类别(1)至(6)进一步描述。可以将氨基酸取代引入感兴趣的分子中,并对产物进行所需活性(例如保留/改善的抗原结合、降低的免疫原性,或改善的adcc或cdc)筛选。
[0193]
表a
[0194][0195][0196]
可根据共同的侧链特性将氨基酸分组:
[0197]
(1)疏水性;正亮氨酸、met、ala、val、leu、ile;
[0198]
(2)中性亲水性:cys、ser、thr、asn、gln;
[0199]
(3)酸性:asp、glu;
[0200]
(4)碱性:his、lys、arg;
[0201]
(5)影响链取向的残基:gly,pro;
[0202]
(6)芳族:trp、tyr、phe。
[0203]
非保守性取代将需要用这些类别中的一个的成员交换另一类别。
[0204]
术语“氨基酸序列变体”包括实质性变体,其中在亲本抗原结合分子(例如人源化或人抗体)的一个或多个高变区残基中存在氨基酸取代。通常,相对于亲本抗原结合分子,选为用于进一步研究的一个或多个所得变体将在某些生物学特性方面(例如,亲和力增加、免疫原性降低)有改变(例如,改善)和/或将基本上保留亲本抗原结合分子的某些生物学特性。示例性取代变体是亲和力成熟抗体,其可例如使用诸如本文所述的那些基于噬菌体展示的亲和力成熟技术方便地生成。简言之,将一个或多个hvr残基突变并且将变体抗原结合分子展示在噬菌体上并针对特定生物活性(例如结合亲和力)进行筛选。在某些实施例中,取代、插入或缺失可发生在一个或多个hvr内,只要此类改变基本上不降低抗原结合分子的抗原结合能力即可。举例而言,可在hvr中进行基本上不降低结合亲和力的保守性改变(举例而言,如本文提供的保守性取代)。可用于鉴别可被靶向诱变的抗体残基或区域的方法称作“丙氨酸扫描诱变”,如cunningham和wells(1989)science,244:1081-1085所述。在此方法中,鉴定残基或一组靶残基(例如,带电残基,诸如arg、asp、his、lys和glu)并用中性或带负电的氨基酸(例如,丙氨酸或多丙氨酸)替代以确定抗体与抗原的相互作用是否受到影响。可在对初始取代展示功能敏感性的氨基酸位置引入其他取代。另选地或另外地,利用抗原-抗原结合分子复合物的晶体结构鉴别抗体与抗原之间的接触点。可靶向或消除作为取代的候选的此类接触残基和相邻残基。可筛选变体以确定它们是否具备期望的特性。
[0205]
氨基酸序列插入包括长度范围为一个残基至含有一百个或更多个残基的多肽的氨基和/或羧基末端融合,以及一个或多个氨基酸残基的序列内插入。末端插入的示例包括具有n末端甲硫氨酰残基的本发明的双特异性抗原结合分子。分子的其他插入变体包括与增加双特异性抗原结合分子的血清半衰期的多肽的n末端或c末端的融合。
[0206]
在某些实施例中,改变本文提供的双特异性抗原结合分子以增加或降低抗体糖基化的程度。可通过改变氨基酸序列,使得产生或去除一个或多个糖基化位点,从而便利地获得分子的糖基化变体。当抗原结合分子包含fc区时,附接于其上的碳水化合物可以被改变。由哺乳动物细胞产生的天然抗体通常包含具有支链的双触角寡糖,所述双触角寡糖通常通过n-键结附接于fc区的ch2结构域的asn297。参见,例如,wright等人tibtech15:26-32(1997)。寡糖可包括各种碳水化合物,例如,甘露糖、n-乙酰基葡糖胺(glcnac)、半乳糖和唾液酸,以及附接于双触角寡糖结构的“茎”中的glcnac的岩藻糖。在一些实施例中,可以对含tnf家族配体三聚体的抗原结合分子中的寡糖进行修饰,以产生具有某些改善的特性的变体。在一个方面,提供了本发明的双特异性抗原结合分子或抗体的变体,其具有缺乏附接(直接或间接)于fc区的岩藻糖的碳水化合物结构。此类岩藻糖基化变体可具有改善的adcc功能,参见例如美国专利公开号us 2003/0157108(presta,l.)或us 2004/0093621(协和发酵工业株式会社(kyowa hakko kogyo co.,ltd))。在另一个方面,本发明的双特异性抗原结合分子或抗体提供有两分型寡糖的变体,例如其中附接于fc区的双触角寡糖是通过glcnac两分的。此类变体可具有降低的岩藻糖基化和/或改善的adcc功能,参见例如wo 2003/011878(jean-mairet等人);美国专利号6,602,684(umana等人);以及us 2005/0123546(umana等人)。还提供了在附接于fc区的寡糖中具有至少一个半乳糖残基的变体。此类抗体变体可具有改善的cdc功能并描述于例如wo 1997/30087(patel等人);wo 1998/
58964(raju,s.);以及wo 1999/22764(raju,s.)中。
[0207]
在某些方面,可期望产生本发明的双特异性抗原结合分子的半胱氨酸工程化改造的变体,例如“thiomab”,其中分子的一个或多个残基被半胱氨酸残基取代。在特定方面,取代的残基存在于分子的可接近位点。通过用半胱氨酸取代那些残基,反应性硫醇基由此定位于抗体的可接近位点,并且可用于将抗体与其他部分,诸如药物部分或接头-药物部分缀合,以产生免疫缀合物。在某些方面,可用半胱氨酸取代下列残基中的任何一个或多个:轻链的v205(kabat编号);重链的a118(eu编号);以及重链fc区的s400(eu编号)。可如例如美国专利号7,521,541中所述形成半胱氨酸工程化改造的抗原结合分子。
[0208]
术语“核酸”或“多核苷酸”包括包含核苷酸聚合物的任何化合物和/或物质。每个核苷酸由碱基构成,特别是嘌呤或嘧啶碱基(即胞嘧啶(c)、鸟嘌呤(g)、腺嘌呤(a)、胸腺嘧啶(t)或尿嘧啶(u))、糖(即脱氧核糖或核糖)和磷酸基团。通常,核酸分子通过碱基序列进行描述,由此所述碱基代表核酸分子的一级结构(线性结构)。碱基序列通常表示为从5'至3'。在本文中,术语核酸分子涵盖脱氧核糖核酸(dna)(包括例如互补dna(cdna)和基因组dna)、核糖核酸(rna)(特别是信使rna(mrna))、dna或rna的合成形式,以及包含这些分子中的两种或更多种的混合聚合物。核酸分子可以是线性的或环状的。此外,术语核酸分子包括有义链和反义链,以及单链和双链形式。此外,本文所描述的核酸分子可含有天然存在的或非天然存在的核苷酸。非天然存在的核苷酸的实例包括具有衍生化的糖或磷酸主链键或经化学修饰的残基的经修饰的核苷酸碱基。核酸分子还涵盖适合作为用于本发明的抗体的体外和/或体内(例如,在宿主或患者体内)直接表达的载体的dna和rna分子。此类dna(例如cdna)或rna(例如mrna)载体可以是未修饰的或经修饰的。举例而言,可以对mrna进行化学修饰以增强rna载体的稳定性和/或编码分子的表达,使得可以将mrna注射到受试者体内以在体内产生抗体(参见例如stadler等人,nature medicine 2017,在线发表于2017年6月12日,doi:10.1038/nm.4356或ep 2 101 823b1)。
[0209]“分离的”核酸是指已自其自然环境的组分中分离的核酸分子。分离的核酸包括这样的核酸分子,其包含在通常含有所述核酸分子的细胞中,但所述核酸分子存在于染色体外或与其天然染色体位置不同的染色体位置处。
[0210]“编码双特异性抗原结合分子或抗体的分离的核酸”是指编码双特异性抗原结合分子或抗体的重链和轻链(或其片段)的一种或多种核酸分子,包括在单个载体或单独的载体中的此类核酸分子,以及存在于宿主细胞中的一个或多个位置处的此类核酸分子。
[0211]
关于与本发明的参考核苷酸序列具有至少例如95%“一致”的核苷酸序列的核酸或多核苷酸,是指除了多核苷酸序列可包括参考核苷酸序列的每100个核苷酸至多五个点突变之外,多核苷酸的核苷酸序列与参考序列是一致的。换句话讲,为了获得具有与参考核苷酸序列至少95%一致的核苷酸序列的多核苷酸,参考序列中至多5%的核苷酸可缺失或被另外的核苷酸取代,或参考序列中总核苷酸的至多5%的数量的核苷酸可插入到参考序列中。参考序列的这些改变可发生在参考核苷酸序列的5’或3’末端位置或那些末端位置之间的任意位置,或单个地散布在参考序列的残基之中,或以一个或多个连续的组散布在参考序列内。作为一种实际情况,可以使用已知的计算机程序,诸如上文针对多肽所讨论的程序(例如align-2),常规确定任何特定多核苷酸序列是否与本发明的核苷酸序列至少80%、85%、90%、95%、96%、97%、98%或99%相同。
[0212]
术语“表达盒”是指通过重组或合成生成的多核苷酸,其具有允许特定核酸在靶细胞中转录的一系列特定核酸元件。重组表达盒可以掺入质粒、染色体、线粒体dna、质粒dna、病毒或核酸片段中。典型地,表达载体的重组表达盒部分除其他序列的外还包括待转录的核酸序列和启动子。在某些实施例中,本发明的表达盒包含编码本发明的双特异性抗原结合分子或其片段的多核苷酸序列。
[0213]
术语“载体”或“表达载体”与“表达构建体”是同义的并且是指用于将特定基因引入与其可操作地关联的靶细胞中并指导所述基因的表达的dna分子。该术语包括作为自我复制核酸结构的载体,以及整合入其已被引入的宿主细胞的基因组中的载体。本发明的表达载体包含表达盒。表达载体允许大量稳定mrna的转录。一旦表达载体处于靶细胞内部,即通过细胞转录和/或翻译机制产生由该基因编码的核糖核酸分子或蛋白。在一个实施例中,本发明的表达载体包含表达盒,所述表达盒包含编码本发明的双特异性抗原结合分子或其片段的多核苷酸序列。
[0214]
术语“宿主细胞”“宿主细胞系”和“宿主细胞培养物”可互换使用,并且是指外源核酸已被引入其中的细胞,包括此类细胞的子代。宿主细胞包括“转化体”和“转化细胞”,其包括原代转化细胞和来源于所述原代转化细胞的子代,不考虑传代次数。子代可能不与亲本细胞的核酸内容物完全一致,而是可能含有突变。本文包括如在原始转化细胞中筛选或选择的具有相同功能或生物活性的突变子代。宿主细胞是可以用于生成本发明的双特异性抗原结合分子的任何类型的细胞系统。宿主细胞包括培养的细胞,举几个例子,例如培养的哺乳动物细胞,诸如cho细胞、bhk细胞、ns0细胞、sp2/0细胞、yo骨髓瘤细胞、p3x63小鼠骨髓瘤细胞、per细胞、per.c6细胞或杂交瘤细胞、酵母细胞、昆虫细胞和植物细胞,以及包括在转基因动物、转基因植物或培养的植物或动物组织中的细胞。
[0215]
药剂的“有效量”是指在其所施用的细胞或组织中产生生理学变化所需的量。
[0216]
药剂(例如药物组合物)的“治疗有效量”是指在必需的剂量和时段上有效实现期望的治疗或预防结果的量。治疗有效量的药剂例如消除、减少、延迟、最小化或预防疾病的不良影响。
[0217]“个体”或“受试者”是哺乳动物。哺乳动物包括但不限于驯养的动物(例如牛、绵羊、猫、犬和马)、灵长类动物(例如人和非人灵长类动物,诸如猴)、兔以及啮齿类动物(例如小鼠和大鼠)。特别地,个体或受试者是人。
[0218]
术语“药物组合物”或“药物制剂”是指处于允许包含在其中的活性成分的生物活性有效的形式,并且不含对于将被施用药物组合物的受试者具有不可接受的毒性的另外组分的制剂。
[0219]“药用载体”是指药物组合物或配制物中除有效成分之外的成分,其对受试者是无毒的。药用载体包括但不限于缓冲剂、赋形剂、稳定剂,或防腐剂。
[0220]
术语“包装插页”用于指治疗产品的商业包装中通常包括的说明书,其含有涉及此类治疗产品的使用的有关适应症、用法、剂量、施用、联合疗法、禁忌症和/或警告的信息。
[0221]
如本文所用,“治疗(treatment)”(及其语法变型,诸如“治疗(treat)”或“治疗(treating)”)是指试图改变所治疗个体的自然进程的临床干预,并且可以是为了预防或在临床病理学的进程中进行。治疗的期望效果包括但不限于预防疾病的发生或复发、减轻症状、削弱疾病的任何直接或间接病理学后果、预防转移、降低疾病进展的速率、改善或减轻
疾病状态,以及缓解或改善预后。在一些实施例中,本发明的分子用于延迟疾病的发展或用于减缓疾病的进展。
[0222]
如本文所用的术语“癌症”是指增生性疾病,诸如淋巴瘤、淋巴细胞性白血病、肺癌、非小细胞肺(nscl)癌、支气管肺泡细胞肺癌、骨癌、胰腺癌、皮肤癌、头或颈癌、皮肤或眼内黑素瘤、子宫癌、卵巢癌、直肠癌、肛区癌、胃癌(stomach cancer)、胃癌(gastric cancer)、结肠癌、乳腺癌、子宫癌、输卵管癌、子宫内膜癌、子宫颈癌、阴道癌、外阴癌、霍奇金病、食管癌、小肠癌、内分泌系统癌、甲状腺癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、前列腺癌、膀胱癌、肾癌或输尿管癌、肾细胞癌、肾盂癌、间皮瘤、肝细胞癌、胆管癌、中枢神经系统(cns)肿瘤、脊椎轴肿瘤、脑干胶质瘤、多形性成胶质细胞瘤、星形细胞瘤、神经鞘瘤、室管膜瘤、成髓细胞瘤、脑膜瘤、鳞状细胞癌、垂体腺瘤和尤文氏肉瘤,包括以上癌症中的任一种的难治性型式,或一种或多种以上癌症的组合。
[0223]
如本文所用,术语“化学治疗剂”是指可用于治疗癌症的化合物。在一个方面,化学治疗剂为抗代谢物。在一个方面,抗代谢物选自由以下项组成的组:氨基蝶呤、甲氨蝶呤、培美曲塞、雷替曲塞、克拉屈滨、氯法拉滨、氟达拉滨、巯基嘌呤、喷司他丁、硫鸟嘌呤、卡培他滨、阿糖胞苷、氟尿嘧啶、氟尿苷和吉西他滨。在一个特定方面,抗代谢物为卡培他滨或吉西他滨。在另一个方面,抗代谢物为氟尿嘧啶。在一个方面,化学治疗剂是影响微管形成的药剂。在一个方面,影响微管形成的药剂选自由以下项组成的组:紫杉醇、多西他赛、长春新碱、长春碱、长春地辛、长春瑞滨、泰素帝、依托泊苷和替尼泊苷。在另一个方面,化学治疗剂为烷化剂诸如环磷酰胺。在一个方面,化学治疗剂为细胞毒性抗生素,诸如拓扑异构酶ii抑制剂。在一个方面,拓扑异构酶ii抑制剂为多柔比星。
[0224]
本发明的双特异性抗体
[0225]
本发明提供新颖双特异性抗原结合分子,其包含新的抗fap抗体(克隆212)。包含此新的抗fap抗体的双特异性抗原结合分子具有诸如以下等尤其有利的性质:可产生性、稳定性、结合亲和力、生物学活性、靶向效率、内化减少、优异药物动力学(pk)性质(诸如改进的清除率)、毒性降低、可给予患者的剂量范围扩大且由此功效可能增强。另外,取决于所包括的ox40抗体,已以有利的形式制备双特异性抗原结合分子。
[0226]
示例性双特异性抗原结合分子
[0227]
在一个方面,本发明提供双特异性抗原结合分子,其特征在于与ox40的靶向激动性结合。特别地,双特异性抗原结合分子是靶向fap的ox40激动剂。在另一个特定方面,本发明的双特异性抗原结合分子包含由能够稳定缔合的第一亚基和第二亚基构成的fc区,其包含降低效应子功能的突变。使用包含减少或消除效应子功能的突变的fc区将通过经由fc受体进行交联来防止非特异性激动作用,并防止ox40
+
细胞的adcc。如本文所述的双特异性抗原结合分子拥有相比于能够特异性结合至ox40的常规抗体的优势在于,它们选择性地诱导靶细胞(通常靠近肿瘤,即在肿瘤基质中)上的免疫应答。
[0228]
因此,所述双特异性抗原结合分子的特征在于与ox40的靶向fap的激动性结合。在fap表达细胞存在下,双特异性抗原结合分子能够诱导人ox40阳性nf b报道细胞中的nfκb活化。
[0229]
在一个方面,本发明提供一种双特异性抗原结合分子,其包含:
[0230]
(a)至少两个能够特异性结合至ox40的抗原结合结构域;
[0231]
(b)能够特异性结合至成纤维细胞活化蛋白(fap)的抗原结合结构域,其包含:重链可变区(vhfap),所述vhfap包含:
[0232]
(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包含选自由seq id no:4、seq id no:11和seq id no:12组成的组的氨基酸序列,和(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含:(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13和seq id no:14组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,和(vi)cdr-l3,其包含seq id no:8的氨基酸序列;以及
[0233]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0234]
在一个方面,能够特异性结合至成纤维细胞活化蛋白(fap)的抗原结合结构域包含:重链可变区(vhfap),所述vhfap包含
[0235]
(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包含选自由seq id no:4组成的组的氨基酸序列,以及(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含(iv)cdr-l1,其包含选自由seq id no:6组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,以及(vi)cdr-l3,其包含seq id no:8的氨基酸序列。
[0236]
在一个方面,fc区包含降低抗体与fc受体的结合亲和力和/或效应子功能的一个或多个氨基酸取代。
[0237]
在一个进一步的方面,提供一种双特异性抗原结合分子,其中能够特异性结合至fap的抗原结合结构域包含:重链可变区(vhfap),所述vhfap包含与seq id no:9的氨基酸序列至少约90%相同的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含与seq id no:10的氨基酸序列至少约90%相同的氨基酸序列。在一个方面,能够与fap特异性结合的抗原结合结构域包含:重链可变区(vhfap),其包含seq id no:9的氨基酸序列;以及轻链可变区(v
l
fap),其包含seq id no:10的氨基酸序列。
[0238]
在另一个方面,能够与fap特异性结合的抗原结合结构域包含重链可变区(vhfap),其包含选自由seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19和seq id no:20组成的组的氨基酸序列,和轻链可变区(v
l
fap),其包含选自由seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25和seq id no:26组成的组的氨基酸序列。在一个方面,能够特异性结合至fap的抗原结合结构域包含(a)包含seq id no:15的氨基酸序列的重链可变区(vhfap)以及包含seq id no:21的氨基酸序列的轻链可变区(v
l
fap),(b)包含seq id no:16的氨基酸序列的重链可变区(vhfap)以及包含seq id no:21的氨基酸序列的轻链可变区(v
l
fap),(c)包含seq id no:16的氨基酸序列的重链可变区(vhfap)以及包含seq id no:22的氨基酸序列的轻链可变区(v
l
fap),或(d)包含seq id no:19的氨基酸序列的重链可变区(vhfap)以及包含seq id no:25的氨基酸序列的轻链可变区(v
l
fap)。特别地,能够与fap特异性结合的抗原结合结构域包含:(a)重链可变区(vhfap),其包含seq id no:15的氨基酸序列;以及轻链可变区(v
l
fap),其包含seq id no:21的氨基酸序列。
[0239]
在一个方面,能够特异性结合至ox40的抗原结合结构域结合至包含seq id no:1的氨基酸序列的多肽或由其组成的多肽。
[0240]
在进一步的方面,提供一种双特异性抗原结合分子,其中能够特异性结合至ox40
的抗原结合结构域包含:
[0241]
(a)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:27的氨基酸序列,(ii)cdr-h2,其包含seq id no:28的氨基酸序列,和(iii)cdr-h3,其包含seq id no:29的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:30的氨基酸序列,(v)cdr-l2,其包含seq id no:31的氨基酸序列,和(vi)cdr-l3,其包含seq id no:32的氨基酸序列;或者
[0242]
(b)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:35的氨基酸序列,(ii)cdr-h2,其包含seq id no:36的氨基酸序列,和(iii)cdr-h3,其包含seq id no:37的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:38的氨基酸序列,(v)cdr-l2,其包含seq id no:39的氨基酸序列,和(vi)cdr-l3,其包含seq id no:40的氨基酸序列;或者
[0243]
(c)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:43的氨基酸序列,(ii)cdr-h2,其包含seq id no:44的氨基酸序列,和(iii)cdr-h3,其包含seq id no:45的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:46的氨基酸序列,(v)cdr-l2,其包含seq id no:47的氨基酸序列,和(vi)cdr-l3,其包含seq id no:48的氨基酸序列;或者
[0244]
(a)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:51的氨基酸序列,(ii)cdr-h2,其包含seq id no:52的氨基酸序列,和(iii)cdr-h3,其包含seq id no:53的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:54的氨基酸序列,(v)cdr-l2,其包含seq id no:55的氨基酸序列,和(vi)cdr-l3,其包含seq id no:56的氨基酸序列。
[0245]
在一个方面,能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:27的氨基酸序列,(ii)cdr-h2,其包含seq id no:28的氨基酸序列,和(iii)cdr-h3,其包含seq id no:29的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:30的氨基酸序列,(v)cdr-l2,其包含seq id no:31的氨基酸序列,和(vi)cdr-l3,其包含seq id no:32的氨基酸序列。在进一步的方面,能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:35的氨基酸序列,(ii)cdr-h2,其包含seq id no:36的氨基酸序列,和(iii)cdr-h3,其包含seq id no:37的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:38的氨基酸序列,(v)cdr-l2,其包含seq id no:39的氨基酸序列,和(vi)cdr-l3,其包含seq id no:40的氨基酸序列。在另一个方面,能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:43的氨基酸序列,(ii)cdr-h2,其包含seq id no:44的氨基酸序列,和(iii)cdr-h3,其包含seq id no:45的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:46的氨基酸序列,(v)cdr-l2,其包含seq id no:47的氨基酸序列,和(vi)cdr-l3,其包含seq id no:48的氨基酸序列。在再一个方面,能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:51的氨基酸序列,(ii)cdr-h2,其包含seq id no:52的氨基酸序列,和(iii)cdr-h3,其包含seq id no:53的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:54
的氨基酸序列,(v)cdr-l2,其包含seq id no:55的氨基酸序列,和(vi)cdr-l3,其包含seq id no:56的氨基酸序列。在一个特定方面,能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:35的氨基酸序列,(ii)cdr-h2,其包含seq id no:36的氨基酸序列,和(iii)cdr-h3,其包含seq id no:37的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:38的氨基酸序列,(v)cdr-l2,其包含seq id no:39的氨基酸序列,和(vi)cdr-l3,其包含seq id no:40的氨基酸序列。
[0246]
在一个方面,提供了如本文上文所定义的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:
[0247]
(i)重链可变区(vhox40),其包含seq id no:33的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列,或者
[0248]
(ii)重链可变区(vhox40),其包含seq id no:41的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:42的氨基酸序列,或者
[0249]
(iii)重链可变区(vhox40),其包含seq id no:49的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:50的氨基酸序列,或者
[0250]
(iv)重链可变区(vhox40),其包含seq id no:57的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:58的氨基酸序列。
[0251]
在一个方面,提供一种如本文上文所定义的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含seq id no:33的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。在另一个方面,提供一种如本文上文所定义的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含seq id no:41的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:42的氨基酸序列。在进一步的方面,提供一种如本文上文所定义的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含seq id no:49的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:50的氨基酸序列。在又进一步的方面,提供一种如本文上文所定义的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含seq id no:57的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:58的氨基酸序列。在一个特定方面,能够特异性结合至ox40的抗原结合结构域(每一者)包含:重链可变区(vhox40),其包含seq id no:41的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:42的氨基酸序列。
[0252]
在另一个方面,提供了如本文上文所定义的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:
[0253]
(i)重链可变区(vhox40),其包含seq id no:59的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列,或者
[0254]
(ii)重链可变区(vhox40),其包含seq id no:60的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列,或者
[0255]
(iii)重链可变区(vhox40),其包含seq id no:61的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。
[0256]
在一个方面,提供一种如本文上文所定义的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含seq id no:59的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。在一个方面,能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含seq id no:60的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。在进一步的方面,能够特异性结合至ox40的抗原结合结构域包含:重链可变区(vhox40),其包含seq id no:61的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。在一个特定方面,能够特异性结合至ox40的抗原结合结构域(每一者)包含:重链可变区(vhox40),其包含seq id no:60的氨基酸序列;以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。
[0257]
与ox40和fap结合的双特异性抗原结合分子
[0258]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0259]
(a)至少两个能够特异性结合至ox40的抗原结合结构域,其包含:重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:27的氨基酸序列,(ii)cdr-h2,其包含seq id no:28的氨基酸序列,和(iii)cdr-h3,其包含seq id no:29的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:30的氨基酸序列,(v)cdr-l2,其包含seq id no:31的氨基酸序列,和(vi)cdr-l3,其包含seq id no:32的氨基酸序列;
[0260]
(b)能够特异性结合至成纤维细胞活化蛋白(fap)的抗原结合结构域,其包含:重链可变区(vhfap),所述vhfap包含:
[0261]
(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包含选自由seq id no:4、seq id no:11和seq id no:12组成的组的氨基酸序列,和(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含:(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13和seq id no:14组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,和(vi)cdr-l3,其包含seq id no:8的氨基酸序列;以及
[0262]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0263]
在进一步的方面,提供一种双特异性抗原结合分子,其包含:
[0264]
(a)至少两个能够特异性结合至ox40的抗原结合结构域,其包含:重链可变区(vhox40),其包含选自由seq id no:33、seq id no:59、seq id no:60和seq id no:61组成的组的氨基酸序列;和轻链可变区(v
l
ox40),其包含选自由seq id no:34组成的组的氨基酸序列;
[0265]
(b)至少一个能够与fap特异性结合的抗原结合结构域,其包含:重链可变区(vhfap),其包含选自由seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19和seq id no:20组成的组的氨基酸序列,和轻链可变区(v
l
fap),其包含选自由seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25和seq id no:26组成的组的氨基酸序列;以及
[0266]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0267]
在特定方面,提供一种双特异性抗原结合分子,其包含:
[0268]
(a)至少两个能够特异性结合至ox40的抗原结合结构域,其包含:重链可变区(vhox40),其包含选自由seq id no:59、seq id no:60和seq id no:61组成的组的氨基酸
序列;和轻链可变区(v
l
ox40),其包含选自由seq id no:34组成的组的氨基酸序列;
[0269]
(b)至少一个能够特异性结合至fap的抗原结合结构域,其包含:重链可变区(vhfap),所述vhfap包含选自由seq id no:15组成的组的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含选自由seq id no:21组成的组的氨基酸序列;以及
[0270]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0271]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0272]
(a)至少两个能够特异性结合至ox40的抗原结合结构域,其包含:重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:35的氨基酸序列,(ii)cdr-h2,其包含seq id no:36的氨基酸序列,和(iii)cdr-h3,其包含seq id no:37的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:38的氨基酸序列,(v)cdr-l2,其包含seq id no:39的氨基酸序列,和(vi)cdr-l3,其包含seq id no:40的氨基酸序列,
[0273]
(b)能够特异性结合至成纤维细胞活化蛋白(fap)的抗原结合结构域,其包含:重链可变区(vhfap),所述vhfap包含:
[0274]
(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包含选自由seq id no:4、seq id no:11和seq id no:12组成的组的氨基酸序列,和(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含:(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13和seq id no:14组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,和(vi)cdr-l3,其包含seq id no:8的氨基酸序列;以及
[0275]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0276]
在进一步的方面,提供一种双特异性抗原结合分子,其包含:
[0277]
(a)至少两个能够特异性结合至ox40的抗原结合结构域,其包含:重链可变区(vhox40),其包含选自由seq id no:41组成的组的氨基酸序列;和轻链可变区(v
l
ox40),其包含选自由seq id no:42组成的组的氨基酸序列;
[0278]
(b)至少一个能够与fap特异性结合的抗原结合结构域,其包含:重链可变区(vhfap),其包含选自由seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19和seq id no:20组成的组的氨基酸序列,和轻链可变区(v
l
fap),其包含选自由seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25和seq id no:26组成的组的氨基酸序列;以及
[0279]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0280]
在特定方面,提供一种双特异性抗原结合分子,其包含:
[0281]
(a)至少两个能够特异性结合至ox40的抗原结合结构域,其包含:重链可变区(vhox40),其包含选自由seq id no:41组成的组的氨基酸序列;和轻链可变区(v
l
ox40),其包含选自由seq id no:42组成的组的氨基酸序列;
[0282]
(b)至少一个能够特异性结合至fap的抗原结合结构域,其包含:重链可变区(vhfap),所述vhfap包含选自由seq id no:15组成的组的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含选自由seq id no:21组成的组的氨基酸序列;以及
[0283]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0284]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0285]
(a)至少两个能够特异性结合至ox40的抗原结合结构域,其包含:重链可变区
no:4、seq id no:11和seq id no:12组成的组的氨基酸序列,和(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含:(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13和seq id no:14组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,和(vi)cdr-l3,其包含seq id no:8的氨基酸序列;以及
[0301]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0302]
在进一步的方面,提供一种双特异性抗原结合分子,其包含:
[0303]
(a)至少两个能够特异性结合至ox40的抗原结合结构域,其包含:重链可变区(vhox40),其包含选自由seq id no:57组成的组的氨基酸序列;和轻链可变区(v
l
ox40),其包含选自由seq id no:58组成的组的氨基酸序列;
[0304]
(b)至少一个能够与fap特异性结合的抗原结合结构域,其包含:重链可变区(vhfap),其包含选自由seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19和seq id no:20组成的组的氨基酸序列,和轻链可变区(v
l
fap),其包含选自由seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25和seq id no:26组成的组的氨基酸序列;以及
[0305]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0306]
在特定方面,提供一种双特异性抗原结合分子,其包含:
[0307]
(a)至少两个能够特异性结合至ox40的抗原结合结构域,其包含:重链可变区(vhox40),其包含选自由seq id no:57组成的组的氨基酸序列;和轻链可变区(v
l
ox40),其包含选自由seq id no:58组成的组的氨基酸序列;
[0308]
(b)至少一个能够特异性结合至fap的抗原结合结构域,其包含:重链可变区(vhfap),所述vhfap包含选自由seq id no:15组成的组的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含选自由seq id no:21组成的组的氨基酸序列;以及
[0309]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0310]
对于结合至ox40为二价且对于结合至fap为单价的双特异性抗原结合分子(2+1形式)
[0311]
在另一个方面,本发明提供一种双特异性抗原结合分子,其包含:
[0312]
(a)两个能够特异性结合至ox40的fab片段;
[0313]
(b)一个能够与fap特异性结合的交叉fab片段,其包含:重链可变区(vhfap),其包含:(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包含选自由seq id no:4、seq id no:11和seq id no:12组成的组的氨基酸序列,和(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),其包含:(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13和seq id no:14组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,和(vi)cdr-l3,其包含seq id no:8的氨基酸序列,以及
[0314]
(c)fc结构域,所述fc结构域包含能够稳定缔合的第一亚基和第二亚基。
[0315]
因此,提供一种双特异性抗原结合分子,其中所述双特异性抗原结合分子二价结合至ox40且单价结合至fap。
[0316]
在一个方面,提供一种双特异性抗原结合分子,其包含:
[0317]
(a)两条重链,每条重链包含能够特异性结合至ox40的fab片段的vh和ch1结构域以及fc区亚基,
[0318]
(c)两条轻链,每条轻链都包含能够特异性结合至ox40的fab片段的vl和cl结构域,以及
[0319]
(c)能够特异性结合至fap的交叉fab片段,其包含vl-ch1链和vh-cl链,其中所述vh-cl链连接至(a)中的所述两条重链中的一者的c末端。
[0320]
在一个方面,vh-cl(vh-cκ)链连接至fc杵重链的c末端。在一个方面,vh-cκ链连接至包含氨基酸取代s354c和t366w(根据kabat eu索引编号)的fc杵重链的c末端。
[0321]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0322]
(a)两条重链,每条重链包含能够特异性结合至ox40的fab片段的vh和ch1结构域以及fc区亚基,
[0323]
(c)两条轻链,每条轻链都包含能够特异性结合至ox40的fab片段的vl和cl结构域,以及
[0324]
(c)能够特异性结合至fap的交叉fab片段,其包含vl-ch1链和vh-cl链,其中所述vl-ch1链连接至(a)中的所述两条重链中的一者的c末端。
[0325]
在一个方面,vl-ch1链连接至fc杵重链的c末端。在一个方面,vl-ch1链连接至包含氨基酸取代s354c和t366w(根据kabat eu索引编号)的fc杵重链的c末端。
[0326]
在一个方面,本发明提供一种双特异性抗原结合分子,其包含:
[0327]
(a)两条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:91的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:90的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0328]
(b)两条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:91的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:90的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0329]
(c)两条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:91的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:90的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一个方面,本发明提供一种双特异性抗原结合分子,其包含(a)两条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:88的氨基酸序列;第一重链,其包含seq id no:91的氨基酸序列;以及第二重链,其包含seq id no:90的氨基酸序列,或(b)两条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:94的氨基酸序列;第一重链,其包含seq id no:91的氨基酸序列;以及第二重链,其包含seq id no:90的氨基酸序列,或(c)两条轻链,它们各自包含seq id no:87的氨
基酸序列;一条轻链,其包含seq id no:96的氨基酸序列;第一重链,其包含seq id no:91的氨基酸序列;以及第二重链,其包含seq id no:90的氨基酸序列。
[0330]
在另一个方面,本发明提供一种双特异性抗原结合分子,其包含:
[0331]
(a)两条轻链,它们各自包含与seq id no:93的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:97的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:98的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0332]
(b)两条轻链,它们各自包含与seq id no:93的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:97的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:98的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0333]
(c)两条轻链,它们各自包含与seq id no:93的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:97的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:98的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一个方面,本发明提供一种双特异性抗原结合分子,其包含(a)两条轻链,它们各自包含seq id no:93的氨基酸序列;一条轻链,其包含seq id no:88的氨基酸序列;第一重链,其包含seq id no:97的氨基酸序列;以及第二重链,其包含seq id no:98的氨基酸序列,或(b)两条轻链,它们各自包含seq id no:93的氨基酸序列;一条轻链,其包含seq id no:94的氨基酸序列;第一重链,其包含seq id no:97的氨基酸序列;以及第二重链,其包含seq id no:98的氨基酸序列,或(c)两条轻链,它们各自包含seq id no:93的氨基酸序列;一条轻链,其包含seq id no:96的氨基酸序列;第一重链,其包含seq id no:97的氨基酸序列;以及第二重链,其包含seq id no:98的氨基酸序列。
[0334]
在另一个方面,本发明提供一种双特异性抗原结合分子,其包含:
[0335]
(a)两条轻链,它们各自包含与seq id no:100的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:99的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:102的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0336]
(b)两条轻链,它们各自包含与seq id no:100的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:99的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及
no:104的氨基酸序列;一条轻链,其包含seq id no:96的氨基酸序列;第一重链,其包含seq id no:103的氨基酸序列;以及第二重链,其包含seq id no:106的氨基酸序列。
[0342]
对于结合至ox40为三价且对于结合至fap为单价的双特异性抗原结合分子(3+1形式)
[0343]
在另一个方面,提供一种双特异性抗原结合分子,其中所述双特异性抗原结合分子包含
[0344]
(aa)第一fab片段,其能够特异性结合至ox40;
[0345]
(ab)第二fab片段,其能够特异性结合至ox40;
[0346]
(ac)第三fab片段,其能够特异性结合至ox40;
[0347]
(b)能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
[0348]
(c)由能够稳定缔合的第一亚基和第二亚基构成的fc区,其中所述第二fab片段(ab)在vh-ch1链的c末端与所述第一fab片段(aa)的vh-ch1链的n末端融合,所述第一fab片段(aa)的vh-ch1链又在其c末端与所述第一亚基的n末端融合,并且所述第三fab片段(ac)在fab重链的c末端与所述第二亚基的n末端融合。
[0349]
在一个方面,双特异性抗原结合分子由以下项组成:
[0350]
(aa)第一fab片段,其能够特异性结合至ox40;
[0351]
(ab)第二fab片段,其能够特异性结合至ox40;
[0352]
(ac)第三fab片段,其能够特异性结合至ox40;
[0353]
(b)能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
[0354]
(c)由能够稳定缔合的第一亚基和第二亚基构成的fc区,其中所述第二fab片段(ab)在vh-ch1链的c末端与所述第一fab片段(aa)的vh-ch1链的n末端融合,所述第一fab片段(aa)的vh-ch1链又在其c末端与所述第一亚基的n末端融合,并且所述第三fab片段(ac)在fab重链的c末端与所述第二亚基的n末端融合。
[0355]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0356]
(a)重链,其包含能够特异性结合至ox40的第一fab片段的vh-ch1链,所述vh-ch1链在其n末端任选地经由肽接头而融合至能够特异性结合至ox40的第二fab片段的vh-ch1链,以及fc区亚基,
[0357]
(b)重链,其包含能够特异性结合至ox40的fab片段的vh-ch1结构域、fc区亚基以及能够与fap特异性结合的fab片段的vh-cl链,所述fap任选地经由肽接头与fc区亚基的c末端融合,
[0358]
(c)三条轻链,每条轻链都包含能够特异性结合至ox40的fab片段的vl和cl结构域,以及
[0359]
(d)轻链,其包含能够与fap特异性结合的fab片段的vl和ch1结构域。
[0360]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0361]
(a)一条重链,其包含能够特异性结合至ox40的第一fab片段的vh-ch1链(所述vh-ch1链在其n末端任选地经由肽接头与能够特异性结合至ox40的第二fab片段的vh-ch1链融合)、fc区亚基和能够特异性结合至fap的fab片段的vh-cl链(所述vh-cl链任选地经由肽接
头与所述fc区亚基的c末端融合),
[0362]
(b)一条重链,其包含能够特异性结合至ox40的fab片段的vh-ch1结构域以及fc区亚基,
[0363]
(c)三条轻链,每条轻链都包含能够特异性结合至ox40的fab片段的vl和cl结构域,以及
[0364]
(d)轻链,其包含能够与fap特异性结合的fab片段的vl和ch1结构域。
[0365]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0366]
(a)重链,其包含能够特异性结合至ox40的第一fab片段的vh-ch1链,所述vh-ch1链在其n末端任选地经由肽接头而融合至能够特异性结合至ox40的第二fab片段的vh-ch1链,以及fc区亚基,
[0367]
(b)重链,其包含能够特异性结合至ox40的fab片段的vh-ch1结构域、fc区亚基以及能够与fap特异性结合的fab片段的vl-ch1链,所述fap任选地经由肽接头与fc区亚基的c末端融合,
[0368]
(c)三条轻链,每条轻链都包含能够特异性结合至ox40的fab片段的vl和cl结构域,以及
[0369]
(d)轻链,其包含能够与fap特异性结合的fab片段的vh和cl结构域。
[0370]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0371]
(a)一条重链,其包含能够特异性结合至ox40的第一fab片段的vh-ch1链(所述vh-ch1链在其n末端任选地经由肽接头与能够特异性结合至ox40的第二fab片段的vh-ch1链融合)、fc区亚基和能够特异性结合至fap的fab片段的vl-ch1链(所述vl-ch1链任选地经由肽接头与所述fc区亚基的c末端融合),
[0372]
(b)一条重链,其包含能够特异性结合至ox40的fab片段的vh-ch1结构域以及fc区亚基,
[0373]
(c)三条轻链,每条轻链都包含能够特异性结合至ox40的fab片段的vl和cl结构域,以及
[0374]
(d)轻链,其包含能够与fap特异性结合的fab片段的vh和cl结构域。
[0375]
在一个特定方面,肽接头选自ggggs(seq id no:67)ggggsggggs(seq id no:68)、sggggsgggg(seq id no:69)、ggggsggggsgggg(seq id no:70)、gspgssssgs(seq id no:71)、(g4s)3(seq id no:72)、(g4s)4(seq id no:73)、gsgsgsgs(seq id no:74)、gsgsgngs(seq id no:75)、ggsgsgsg(seq id no:76)、ggsgsg(seq id no:77)、ggsg(seq id no:78)、ggsgngsg(seq id no:79)、ggngsgsg(seq id no:80)和ggngsg(seq id no:81)。特定目标肽接头为(g4s)(seq id no:67)、(g4s)2或ggggsggggs(seq id no:68)、(g4s)3(seq id no:72)和(g4s)4(seq id no:73)。
[0376]
在一个方面,提供一种双特异性抗原结合分子,其包含:
[0377]
(a)第一重链,其包含与seq id no:86的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:90的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相
同的氨基酸序列,或
[0378]
(b)第一重链,其包含与seq id no:86的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:90的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0379]
(c)第一重链,其包含与seq id no:86的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:90的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一个方面,提供一种双特异性抗原结合分子,其包含(a)第一重链,其包含seq id no:86的氨基酸序列;第二重链,其包含seq id no:90的氨基酸序列;三条轻链,它们各自包含seq id no:87的氨基酸序列;以及一条轻链,其包含seq id no:88的氨基酸序列,或(b)第一重链,其包含seq id no:86的氨基酸序列;第二重链,其包含seq id no:90的氨基酸序列;三条轻链,它们各自包含seq id no:87的氨基酸序列;以及一条轻链,其包含seq id no:94的氨基酸序列,或(c)第一重链,其包含seq id no:86的氨基酸序列;第二重链,其包含seq id no:90的氨基酸序列;三条轻链,它们各自包含seq id no:87的氨基酸序列;以及一条轻链,其包含seq id no:96的氨基酸序列。
[0380]
在一个方面,提供一种双特异性抗原结合分子,其包含:
[0381]
(a)第一重链,其包含与seq id no:97的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:95的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:93的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0382]
(b)第一重链,其包含与seq id no:97的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:95的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:93的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0383]
(c)第一重链,其包含与seq id no:97的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:95的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:93的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一个方面,提供一种双特异性抗原结合分子,其包含(a)第一重链,其包
含seq id no:97的氨基酸序列;第二重链,其包含seq id no:95的氨基酸序列;三条轻链,它们各自包含seq id no:93的氨基酸序列;以及一条轻链,其包含seq id no:88的氨基酸序列,或(b)第一重链,其包含seq id no:97的氨基酸序列;第二重链,其包含seq id no:95的氨基酸序列;三条轻链,它们各自包含seq id no:93的氨基酸序列;以及一条轻链,其包含seq id no:94的氨基酸序列,或(c)第一重链,其包含seq id no:97的氨基酸序列;第二重链,其包含seq id no:95的氨基酸序列;三条轻链,它们各自包含seq id no:93的氨基酸序列;以及一条轻链,其包含seq id no:96的氨基酸序列。
[0384]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0385]
(a)第一重链,其包含与seq id no:99的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:101的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:100的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0386]
(b)第一重链,其包含与seq id no:99的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:101的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:100的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0387]
(c)第一重链,其包含与seq id no:99的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:101的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:100的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一个方面,提供一种双特异性抗原结合分子,其包含(a)第一重链,其包含seq id no:99的氨基酸序列;第二重链,其包含seq id no:101的氨基酸序列;三条轻链,它们各自包含seq id no:100的氨基酸序列;以及一条轻链,其包含seq id no:88的氨基酸序列,或(b)第一重链,其包含seq id no:99的氨基酸序列;第二重链,其包含seq id no:101的氨基酸序列;三条轻链,它们各自包含seq id no:100的氨基酸序列;以及一条轻链,其包含seq id no:94的氨基酸序列,或(c)第一重链,其包含seq id no:99的氨基酸序列;第二重链,其包含seq id no:101的氨基酸序列;三条轻链,它们各自包含seq id no:100的氨基酸序列;以及一条轻链,其包含seq id no:96的氨基酸序列。
[0388]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0389]
(a)第一重链,其包含与seq id no:103的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:105的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:104的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%
或100%相同的氨基酸序列,或
[0390]
(b)第一重链,其包含与seq id no:103的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:105的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:104的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0391]
(c)第一重链,其包含与seq id no:103的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第二重链,其包含与seq id no:105的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;三条轻链,它们各自包含与seq id no:104的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一个方面,提供一种双特异性抗原结合分子,其包含(a)第一重链,其包含seq id no:103的氨基酸序列;第二重链,其包含seq id no:105的氨基酸序列;三条轻链,它们各自包含seq id no:104的氨基酸序列;以及一条轻链,其包含seq id no:88的氨基酸序列,或(b)第一重链,其包含seq id no:103的氨基酸序列;第二重链,其包含seq id no:105的氨基酸序列;三条轻链,它们各自包含seq id no:104的氨基酸序列;以及一条轻链,其包含seq id no:94的氨基酸序列,或(c)第一重链,其包含seq id no:103的氨基酸序列;第二重链,其包含seq id no:105的氨基酸序列;三条轻链,它们各自包含seq id no:104的氨基酸序列;以及一条轻链,其包含seq id no:96的氨基酸序列。
[0392]
对于结合至ox40为四价且对于结合至靶细胞抗原为单价的双特异性抗原结合分子(4+1形式)
[0393]
在另一个方面,本发明提供一种双特异性抗原结合分子,其包含:
[0394]
(a)四个能够特异性结合至ox40的抗原结合结构域,
[0395]
(b)一个能够与fap特异性结合的抗原结合结构域,其包含:(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包含选自由seq id no:4、seq id no:11和seq id no:12组成的组的氨基酸序列,和(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),其包含:(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13和seq id no:14组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,和(vi)cdr-l3,其包含seq id no:8的氨基酸序列,以及
[0396]
(c)fc结构域,所述fc结构域包含能够稳定缔合的第一亚基和第二亚基。
[0397]
因此,提供一种双特异性抗原结合分子,其中所述双特异性抗原结合分子四价结合至ox40且单价结合至fap。
[0398]
在一个方面,提供一种双特异性抗原结合分子,其中四个能够特异性结合至ox40的抗原结合结构域是fab片段,并且其中的每两者任选地经由肽接头彼此融合于重链处。在特定方面,抗原结合分子包含两条各自包含vhch1-肽接头-vhch1片段的重链。在特定方面,肽接头具有seq id no:68的氨基酸序列。
[0399]
在一个方面,双特异性抗原结合分子由以下项组成:
[0400]
(aa)第一fab片段,其能够特异性结合至ox40;
[0401]
(ab)第二fab片段,其能够特异性结合至ox40;
[0402]
(ac)第三fab片段,其能够特异性结合至ox40;
[0403]
(ad)第四fab片段,其能够特异性结合至ox40;
[0404]
(b)能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
[0405]
(c)由能够稳定缔合的第一亚基和第二亚基构成的fc区,其中所述第二fab片段(ab)在vh-ch1链的c末端与所述第一fab片段(aa)的vh-ch1链的n末端融合,所述第一fab片段(aa)的vh-ch1链又在其c末端与所述第一亚基的n末端融合,并且所述第四fab片段(ad)在vh-ch1链的c末端与所述第三fab片段(ac)的vh-ch1链的n末端融合,所述第三fab片段(ac)的vh-ch1链又在其c末端与所述第二亚基的n末端融合。
[0406]
在一个方面,提供一种抗原结合分子,其由以下项组成:
[0407]
(c)四条轻链,每条轻链都包含能够特异性结合至ox40的fab片段的vl和cl结构域,以及
[0408]
(b)两条重链,其中每条重链包含能够特异性结合至ox40的fab片段的vh-ch1结构域(所述结构域与能够特异性结合至ox40的第二fab片段的vh-ch1结构域的n末端融合)以及fc区亚基,以及
[0409]
(c)能够特异性结合至fap的交叉fab片段,其中vh-cl结构域经由肽接头连接至这些重链中的一者的c末端。
[0410]
在一个方面,提供一种双特异性抗原结合分子,其包含:
[0411]
(a)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:86的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:89的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,
[0412]
(b)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:86的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:89的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,
[0413]
(c)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:86的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:89的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一个方面,提供一种双特异性抗原结合分子,其包含(a)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:88的氨基酸序列;第一重链,其包含seq id no:86的氨基酸序列;以及第二重链,其包含seq id no:89的氨基酸
序列,(b)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:94的氨基酸序列;第一重链,其包含seq id no:86的氨基酸序列;以及第二重链,其包含seq id no:89的氨基酸序列,或(c)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:96的氨基酸序列;第一重链,其包含seq id no:86的氨基酸序列;以及第二重链,其包含seq id no:89的氨基酸序列。
[0414]
在另一个方面,提供一种双特异性抗原结合分子,其包含:
[0415]
(a)四条轻链,它们各自包含与seq id no:93的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:92的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:95的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,
[0416]
(b)四条轻链,它们各自包含与seq id no:93的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:92的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:95的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0417]
(c)四条轻链,它们各自包含与seq id no:93的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:92的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:95的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一个方面,提供一种双特异性抗原结合分子,其包含(a)四条轻链,它们各自包含seq id no:93的氨基酸序列;一条轻链,其包含seq id no:88的氨基酸序列;第一重链,其包含seq id no:92的氨基酸序列;以及第二重链,其包含seq id no:95的氨基酸序列,(b)四条轻链,它们各自包含seq id no:93的氨基酸序列;一条轻链,其包含seq id no:94的氨基酸序列;第一重链,其包含seq id no:92的氨基酸序列;以及第二重链,其包含seq id no:95的氨基酸序列,或(c)四条轻链,它们各自包含seq id no:93的氨基酸序列;一条轻链,其包含seq id no:96的氨基酸序列;第一重链,其包含seq id no:92的氨基酸序列;以及第二重链,其包含seq id no:95的氨基酸序列。
[0418]
在进一步的方面,提供一种双特异性抗原结合分子,其包含:
[0419]
(a)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:107的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:108的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,
[0420]
(b)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、
97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:107的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:108的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0421]
(c)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:107的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:108的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在进一步的方面,提供一种双特异性抗原结合分子,其包含(a)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:88的氨基酸序列;第一重链,其包含seq id no:107的氨基酸序列;以及第二重链,其包含seq id no:108的氨基酸序列,或(b)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:94的氨基酸序列;第一重链,其包含seq id no:107的氨基酸序列;以及第二重链,其包含seq id no:108的氨基酸序列,或(c)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:96的氨基酸序列;第一重链,其包含seq id no:107的氨基酸序列;以及第二重链,其包含seq id no:108的氨基酸序列。
[0422]
在进一步的方面,提供一种双特异性抗原结合分子,其包含:
[0423]
(a)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:109的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:110的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,或
[0424]
(b)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:109的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:110的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,
[0425]
(c)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:109的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:110的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在一个方面,提供一种双特异性抗原结合分子,其包含(a)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:88的氨基酸序列;第一重链,其包含seq id no:109的氨基酸序列;以及第二重链,其包含seq id no:110
的氨基酸序列,或(b)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:94的氨基酸序列;第一重链,其包含seq id no:109的氨基酸序列;以及第二重链,其包含seq id no:110的氨基酸序列,或(c)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:96的氨基酸序列;第一重链,其包含seq id no:109的氨基酸序列;以及第二重链,其包含seq id no:110的氨基酸序列。
[0426]
在进一步的方面,提供一种双特异性抗原结合分子,其包含:
[0427]
(a)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:88的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:111的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:112的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,
[0428]
(b)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:94的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:111的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:112的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列,
[0429]
(c)四条轻链,它们各自包含与seq id no:87的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;一条轻链,其包含与seq id no:96的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;第一重链,其包含与seq id no:111的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列;以及第二重链,其包含与seq id no:112的序列至少约90%、95%、96%、97%、98%、99%或100%相同的氨基酸序列。在进一步的方面,提供一种双特异性抗原结合分子,其包含(a)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:88的氨基酸序列;第一重链,其包含seq id no:111的氨基酸序列;以及第二重链,其包含seq id no:112的氨基酸序列,或(b)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:94的氨基酸序列;第一重链,其包含seq id no:111的氨基酸序列;以及第二重链,其包含seq id no:112的氨基酸序列,或(c)四条轻链,它们各自包含seq id no:87的氨基酸序列;一条轻链,其包含seq id no:96的氨基酸序列;第一重链,其包含seq id no:111的氨基酸序列;以及第二重链,其包含seq id no:112的氨基酸序列。
[0430]
减少fc受体结合和/或效应子功能的fc结构域修饰
[0431]
本发明的双特异性抗原结合分子进一步包含由能够稳定结合的第一亚基和第二亚基构成的fc结构域。
[0432]
在某些方面,一个或多个氨基酸修饰可引入本文提供的抗体的fc区中,从而生成fc区变体。fc区变体可包含人fc区序列(例如人igg1、igg2、igg3或igg4 fc区),其在一个或多个氨基酸位置上包含氨基酸修饰(例如取代)。
[0433]
fc结构域对本发明的双特异性抗体赋予有利的药代动力学特性,包括有助于靶组织中的良好积聚的长血清半衰期和有利的组织-血液分配比。然而,与此同时,可能导致本
发明的双特异性抗体不期望地靶向表达fc受体的细胞,而不是优选的抗原携带细胞。因此,在特定实施例中,与天然igg fc结构域,特别是igg1 fc结构域或igg4 fc结构域相比,本发明的双特异性抗体的fc结构域表现出降低的对fc受体的结合亲和力和/或降低的效应子功能。更特别地,fc结构域是igg1 fc结构域。
[0434]
在一个此类方面,与天然igg1 fc结构域(或包含天然igg1 fc结构域的双特异性抗原结合分子)相比,所述fc结构域(或包含所述fc结构域的本发明的双特异性抗原结合分子)表现出对fc受体的结合亲和力的小于50%、优选地少小20%、更优选地小于10%且最优选地小于5%;和/或与天然igg1 fc结构域(或包含天然igg1 fc结构域的本发明的双特异性抗原结合分子)相比,所述fc结构域(或包含所述fc结构域的本发明的双特异性抗原结合分子)表现出效应子功能的小于50%、优选地小于20%、更优选地小于10%且最优选地小于5%。在一个方面,fc结构域(或包含所述fc结构域的本发明的双特异性抗原结合分子)不显著结合fc受体和/或诱导效应子功能。在特定方面,fc受体是fcγ受体。在一个方面,fc受体是人fc受体。在一个方面,fc受体是活化性fc受体。在具体方面,fc受体是活化性人fcγ受体,更具体地是人fcγriiia、fcγri或fcγriia,最具体地是人fcγriiia。在一个方面,fc受体是抑制性fc受体。在具体方面,fc受体是抑制性人fcγ受体,更具体地是人fc riib。在一个方面,效应子功能是cdc、adcc、adcp和细胞因子分泌中的一个或多个。在特定方面,效应子功能是adcc。在一个方面,与天然igg1 fc结构域相比,fc结构域表现出基本上类似的对新生fc受体的结合亲和力。当fc结构域(或包含所述fc结构域的本发明的双特异性抗原结合分子)表现出天然igg1 fc结构域(或包含天然igg1 fc结构域的本发明的双特异性抗原结合分子)对fcrn的结合亲和力的大于约70%、具体地大于约80%、更具体地大于约90%时,实现了基本上类似的与fcrn的结合。
[0435]
在特定方面,fc结构域经过工程化改造,以与非工程化改造的fc结构域相比具有降低的对fc受体的结合亲和力和/或降低的效应子功能。在特定方面,本发明的双特异性抗原结合分子的fc结构域包含降低fc结构域对fc受体的结合亲和力和/或效应子功能的一个或多个氨基酸突变。典型地,相同的一个或多个氨基酸突变存在于fc结构域的两个亚基中的每一个中。在一个方面,氨基酸突变降低fc结构域对fc受体的结合亲和力。在另一个方面,氨基酸突变将fc结构域对fc受体的结合亲和力降低至少2倍、至少5倍或至少10倍。在一个方面,与包含非工程化改造的fc结构域的本发明的双特异性抗体相比,包含工程化改造的fc结构域的本发明的双特异性抗原结合分子表现出对fc受体的结合亲和力的少于20%、具体地少于10%、更具体地少于5%。在特定方面,fc受体是fcγ受体。在其他方面,fc受体是人fc受体。在一个方面,fc受体是抑制性fc受体。在具体方面,fc受体是抑制性人fcγ受体,更具体地是人fc riib。在一些方面,fc受体是活化性fc受体。在具体方面,fc受体是活化性人fcγ受体,更具体地是人fcγriiia、fcγri或fcγriia,最具体地是人fcγriiia。优选地,与这些受体中的每一者的结合降低。在一些方面,对互补组分的结合亲和力,对c1q的特异性结合亲和力也降低。在一个方面,对新生fc受体(fcrn)的结合亲和力不降低。当fc结构域(或包含所述fc结构域的本发明的双特异性抗原结合分子)表现出fc结构域的非工程化改造形式(或包含fc结构域的所述非工程化改造形式的本发明的双特异性抗原结合分子)对fcrn的结合亲和力的大于约70%时,实现了基本上类似的与fcrn的结合,即实现了fc结构域对所述受体的结合亲和力的保留。fc结构域或包含所述fc结构域的本发明的双特异
740;us 5,648,260;us 5,624,821;以及wo 94/29351。
[0440]
与fc受体的结合可以例如通过elisa或通过表面等离子体共振(spr)使用标准仪器(诸如biacore仪器(ge healthcare))容易地确定,并且fc受体诸如可以通过重组表达获得。本文描述了合适的此类结合测定。另选地,可以使用已知表达特定fc受体的细胞系(诸如表达fcγiiia受体的人nk细胞)来评价fc结构域或包含fc结构域的细胞活化双特异性抗原结合分子对fc受体的结合亲和力。fc结构域的效应子功能,或本发明的包含fc结构域的双特异性抗原结合分子,可以通过本领域已知的方法来测量。本文描述了用于测量adcc的合适的测定法。用于评定感兴趣的分子的adcc活性的体外测定的其他示例描述于美国专利号5,500,362;hellstrom等人,proc natl acad sci usa 83,7059-7063(1986)和hellstrom等人,proc natl acad sci usa 82,1499-1502(1985);美国专利号5,821,337;bruggemann等人,j exp med 166,1351-1361(1987)。另选地,可以使用非放射性测定方法(参见举例而言,用于流式细胞术的acti
tm
非放射性细胞毒性测定(celltechnology,inc.mountain view,ca);以及cytotox 非放射性细胞毒性测定(promega,madison,wi))。用于此类测定的有用效应物细胞包括外周血单核细胞(pbmc)和自然杀伤(nk)细胞。另选地或另外地,可例如在诸如在clynes等人,proc natl acad sci usa 95,652-656(1998)中公开的动物模型中体内评定感兴趣的分子的adcc活性。
[0441]
以下章节描述包含减少fc受体结合和/或效应子功能的fc结构域修饰的本发明的双特异性抗原结合分子的优选方面。在一个方面,本发明涉及双特异性抗原结合分子,(a)至少两个能够特异性结合至ox40的抗原结合结构域,(b)能够与fap特异性结合的抗原结合结构域,以及(c)由能够稳定缔合的第一亚基和第二亚基构成的fc结构域,其中fc结构域包含一个或多个氨基酸取代,所述氨基酸取代降低抗体与fc受体的结合亲和力,特别是对fc受体的结合亲和力。在另一个方面,本发明涉及双特异性抗原结合分子,其包含:(a)至少两个能够特异性结合至ox40的抗原结合结构域,(b)能够与fap特异性结合的抗原结合结构域,以及(c)由能够稳定缔合的第一亚基和第二亚基构成的fc结构域,其中fc结构域包含一个或多个氨基酸取代,所述氨基酸取代降低效应子功能。在特定方面,fc结构域属于人igg1亚类,其具有氨基酸突变l234a、l235a和p329g(根据kabat eu索引编号)。
[0442]
促进异源二聚化的fc结构域修饰
[0443]
本发明的双特异性抗原结合分子包含与fc结构域的两个亚基中的一个或另一个融合的不同抗原结合位点,因此所述fc结构域的两个亚基可包含在两个不相同的多肽链中。这些多肽的重组共表达和随后的二聚化导致了两种多肽的几种可能的组合。为了在重组产生中提高本发明的双特异性抗原结合分子的产率和纯度,因此在本发明的双特异性抗原结合分子的fc结构域中引入促进所需多肽的缔合的修饰将是有利的。
[0444]
因此,在特定方面,本发明涉及双特异性抗原结合分子,其包含:(a)至少两个能够特异性结合至ox40的抗原结合结构域,(b)能够与fap特异性结合的抗原结合结构域,以及(c)由能够稳定缔合的第一亚基和第二亚基构成的fc结构域,其中fc结构域包含促进fc结构域的第一亚基和第二亚基的缔合的修饰。人igg fc结构域的两个亚基之间最广泛的蛋白质间相互作用位点在fc结构域的ch3结构域中。因此,在一个方面,所述修饰在fc结构域的ch3结构域中。
[0445]
在具体方面,所述修饰是所谓的“杵臼结构”修饰,所述修饰包括fc结构域的两个
亚基中的一个中的“杵”修饰和fc结构域的两个亚基中的另一个中的“臼”修饰。因此,本发明涉及双特异性抗原结合分子,其包含:(a)至少两个能够特异性结合至ox40的抗原结合结构域,(b)能够与fap特异性结合的抗原结合结构域,以及(c)由能够稳定缔合的第一亚基和第二亚基构成的fc结构域,其中根据杵臼结构方法,fc结构域的第一亚基包含杵并且fc结构域的第二亚基包含臼。在特定方面,fc结构域的第一亚基包含氨基酸取代s354c和t366w(eu编号)而fc结构域的第二亚基包含氨基酸取代y349c、t366s和y407v(根据kabat eu索引编号)。
[0446]
杵臼结构技术描述于例如us 5,731,168;us 7,695,936;ridgway等人,prot eng 9,617-621(1996)和carter,j immunol meth 248,7-15(2001)中。通常,该方法涉及在第一多肽的界面处引入突起(“杵”)并在第二多肽的界面中引入相应的空腔(“臼”),使得所述突起可以定位在所述空腔中,以便促进异二聚体的形成并阻碍同二聚体的形成。突起是通过用较大侧链(例如酪氨酸或色氨酸)替代来自第一多肽的界面的小氨基酸侧链而构建的。具有与突起相同或相似大小的补偿空腔是通过用较小的氨基酸侧链(例如丙氨酸或苏氨酸)替代大氨基酸侧链而在第二多肽的界面中创建的。
[0447]
因此,在一个方面,在本发明的双特异性抗原结合分子的fc结构域的第一亚基的ch3结构域中,某一氨基酸残基被具有较大侧链体积的氨基酸残基替代,从而在第一亚基的ch3结构域内产生突起,所述突起可定位于第二亚基的ch3结构域内的空腔中;而在fc结构域的第二亚基的ch3结构域中,某一氨基酸残基被具有较小侧链体积的氨基酸残基替代,从而在第二亚基的ch3结构域内产生空腔,第一亚基的ch3结构域内的所述突起可定位在所述空腔内。突起和空腔可以通过改变编码多肽的核酸来制备,例如通过位点特异性诱变或通过肽合成。在具体方面,在fc结构域的第一亚基的ch3结构域中,366位处的苏氨酸残基被色氨酸残基(t366w)替代,而在fc结构域的第二亚基的ch3结构域中,407位处的酪氨酸残基被缬氨酸残基(y407v)替代。在一个方面,另外在fc结构域的第二亚基中,366位处的苏氨酸残基被丝氨酸残基(t366s)替代,并且368位处的亮氨酸残基被丙氨酸残基(l368a)替代。
[0448]
在又进一步的方面,另外在fc结构域的第一亚基中,354位处的丝氨酸残基被半胱氨酸残基(s354c)替代,并且另外在fc结构域的第二亚基中,349位的酪氨酸残基被半胱氨酸残基(y349c)替代。引入这两个半胱氨酸残基导致在fc结构域的两个亚基之间形成二硫桥,从而进一步稳定该二聚体(carter(2001),j immunol methods 248,7-15)。在特定方面,fc结构域的第一亚基包含氨基酸取代s354c和t366w(eu编号)而fc结构域的第二亚基包含氨基酸取代y349c、t366s和y407v(根据kabat eu索引编号)。
[0449]
在一个替代方面,促进fc结构域的第一亚基和第二亚基缔合的修饰包括介导静电转向效应的修饰,例如如在pct公开wo 2009/089004中所述。通常,该方法涉及用带电荷的氨基酸残基替代两个fc结构域亚基的界面处的一个或多个氨基酸残基,使得同源二聚体形成变得在静电上不利,但异源二聚化在静电上有利。
[0450]
如本文报道的双特异性抗体的重链的c末端可以是以氨基酸残基pgk结束的完整c末端。重链的c末端可以是缩短的c末端,在所述缩短的c末端中已经去除了一个或两个c末端氨基酸残基。在一个优选的方面,重链的c末端是以pg结束的缩短的c末端。在本文报道的所有方面中的一个方面,如本文所指定的包含含有c末端ch3结构域的重链的双特异性抗体,包含c末端甘氨酸-赖氨酸二肽(g446和k447,根据kabat eu索引编号)。在本文报道的所
有方面的一个方面,如本文所指定的包含含有c末端ch3结构域的重链的双特异性抗体,包含c末端甘氨酸残基(g446,根据kabat eu索引编号)。
[0451]
fab结构域中的修饰
[0452]
在一个方面,本发明涉及双特异性抗原结合分子,其包含(a)至少两个能够特异性结合至ox40的fab片段,(b)能够与fab特异性结合的fab片段,以及(c)由能够稳定缔合的第一亚基和第二亚基构成的fc结构域,其中在fab片段之一中,可变结构域vh和vl或恒定结构域ch1和cl被交换。根据crossmab技术制备双特异性抗体。
[0453]
wo2009/080252和schaefer,w.等人(pnas,108(2011)11187-1191)详细描述了在一个结合臂中具有结构域置换/交换的多特异性抗体(crossmab vh-vl或crossmab ch-cl)。它们明显减少了由抗第一抗原的轻链与抗第二抗原的错误重链的错配导致的副产物(与没有此类结构域交换的方法相比)。
[0454]
在一个方面,本发明涉及双特异性抗原结合分子,其包含(a)至少两个能够特异性结合至ox40的fab片段,(b)能够与fab特异性结合的fab片段,以及(c)由能够稳定缔合的第一亚基和第二亚基构成的fc结构域,其中在fab片段之一中,恒定结构域cl和ch1被彼此替代,使得ch1结构域是轻链的一部分,并且cl结构域是重链的一部分。更特别地,在能够与靶细胞抗原特异性结合的第二fab片段中,恒定结构域cl和ch1被彼此替代,使得ch1结构域是轻链的一部分,并且cl结构域是重链的一部分。
[0455]
在特定方面,本发明涉及双特异性抗原结合分子,其包含(a)至少两个能够特异性结合至ox40的fab片段,(b)能够特异性结合至fap的fab片段,其中在能够特异性结合至fap的fab片段中,恒定结构域cl和ch1彼此替代,使得ch1结构域为轻链的一部分且cl(cκ)结构域为重链的一部分。
[0456]
因此,在一个方面,本发明包含双特异性抗原结合分子,其包含(a)抗体的两条轻链和两条重链,其包含两个能够特异性结合至ox40的fab片段以及fc区,以及(b)能够特异性结合至fap的交叉fab片段,其与fc区的其中一个亚基的c末端融合。
[0457]
在另一个方面,并且为进一步改进正确配对,包含(a)至少两个能够特异性结合至ox40的fab片段、(b)能够特异性结合至fap的交叉fab片段和(c)由能够稳定缔合的第一亚基和第二亚基构成的fc结构域的双特异性抗原结合分子可含有不同的带电氨基酸取代(所谓的"带电残基")。将这些修饰引入交叉或非交叉的ch1和cl结构域中。在特定方面,本发明涉及一种双特异性抗原结合分子,其中在cl结构域之一中,123位(eu编号)的氨基酸已被精氨酸(r)取代和/或其中124位(eu编号)的氨基酸已被赖氨酸(k)取代;并且其中在ch1结构域之一中,147位(eu编号)和/或213位(eu编号)的氨基酸已被谷氨酸(e)取代。
[0458]
本发明的示例性抗体
[0459]
在一个方面,本发明提供特异性地结合至fap的新的抗体和抗体片段。这些抗体与已知的fap抗体4b9或28h1相比结合至不同的表位,这使得其尤其适于并入至可与其他fap靶向分子组合使用的双特异性抗原结合分子中。这些新抗体的特征进一步在于,其能以较高量产生且具有高效价,其显示高热稳定性(如通过聚集温度t
agg
所测量),或推测其具有优异pk性质且如通过biacore测定所测量其以高亲和力结合至人fap。
[0460]
在一个方面,提供一种特异性结合fap的抗体(克隆212),其中所述抗体包含:重链可变区(vhfap),其包含:(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包
含选自由seq id no:4、seq id no:11和seq id no:12组成的组的氨基酸序列,和(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),其包含:(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13和seq id no:14组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,和(vi)cdr-l3,其包含seq id no:8的氨基酸序列。
[0461]
在一个方面,提供一种特异性结合fap的人源化抗体,其中所述抗体包含:重链可变区(vhfap),其包含:(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包含选自由seq id no:4、seq id no:11和seq id no:12组成的组的氨基酸序列,和(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),其包含:(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13和seq id no:14组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,和(vi)cdr-l3,其包含seq id no:8的氨基酸序列。
[0462]
在另一个方面,提供与特异性地结合至fap的抗体竞争结合的抗体,其中所述抗体包含重链可变区(vhfap)中的任一者,这些vhfap包含选自由seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19和seq id no:20组成的组的氨基酸序列;以及轻链可变区(v
l
fap)中的任一者,这些v
l
fap包含选自由seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25和seq id no:26组成的组的氨基酸序列。
[0463]
在一个方面,提供与特异性地结合至fap的抗体竞争结合的抗体,其中所述抗体包含有包含seq id no:15的氨基酸序列的重链可变区vh和包含seq id no:21的氨基酸序列的轻链可变区vl。
[0464]
在进一步的方面,提供特异性地结合至fap的抗体,其中所述抗体包含
[0465]
(a)重链可变区(vhfap),其包含seq id no:15的氨基酸序列,以及轻链可变区(v
l
fap),其包含seq id no:21的氨基酸序列;
[0466]
(b)重链可变区(vhfap),其包含seq id no:16的氨基酸序列,以及轻链可变区(v
l
fap),其包含seq id no:21的氨基酸序列;
[0467]
(c)重链可变区(vhfap),其包含seq id no:16的氨基酸序列,以及轻链可变区(v
l
fap),其包含seq id no:22的氨基酸序列;或者
[0468]
(d)重链可变区(vhfap),其包含seq id no:19的氨基酸序列,以及轻链可变区(v
l
fap),其包含seq id no:25的氨基酸序列。
[0469]
在进一步的方面,提供特异性地结合至fap的抗体,其包含有包含seq id no:15的氨基酸序列的重链可变区(vhfap)以及包含seq id no:21的氨基酸序列的轻链可变区(v
l
fap)。
[0470]
在另一个方面,本发明提供特异性地结合至ox40的新的抗体和抗体片段。这些抗体是ox40抗体49b4的变体,并且与49b4相比具有较少的正电荷区片。这些新抗体与49b4相比理应具有改进的pk性质,并且如通过biacore测定所测量,其以高亲和力结合至人ox40。
[0471]
因此,提供特异性地结合至ox40的人源化抗体,其中所述抗体包含
[0472]
(a)重链可变区(vhox40),其包含seq id no:59的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列,
[0473]
(b)重链可变区(vhox40),其包含seq id no:60的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列,
[0474]
(c)重链可变区(vhox40),其包含seq id no:61的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。
[0475]
多核苷酸
[0476]
本发明进一步提供编码如本文所述的双特异性抗原结合分子或其片段的分离的核酸或编码如本文所述的抗体的分离的核酸。
[0477]
编码本发明的双特异性抗原结合分子的分离的多核苷酸可以表达为编码完整抗原结合分子的单个多核苷酸,或表达为共表达的多个(例如两个或更多个)多核苷酸。由共表达的多核苷酸编码的多肽可以经由例如二硫键或其他手段缔合以形成功能性抗原结合分子。举例而言,免疫球蛋白的轻链部分可以由来自免疫球蛋白的重链部分的单独多核苷酸编码。当共表达时,重链多肽将与轻链多肽缔合以形成免疫球蛋白。
[0478]
在一些方面,分离的多核苷酸编码如本文所述的包含在根据本发明的双特异性分子中的多肽。
[0479]
在一个方面,本发明涉及分离的多核苷酸,其编码包含以下各项的双特异性抗原结合分子:(a)至少两个能够特异性结合至ox40的抗原结合结构域;(b)能够特异性结合至fap的抗原结合结构域,其包含:重链可变区(vhfap),所述vhfap包含(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包含选自由seq id no:4、seq id no:11和seq id no:12构成的群的氨基酸序列,以及(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13及seq id no:14构成的群的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,以及(vi)cdr-l3,其包含seq id no:8的氨基酸序列;以及(c)由能够稳定缔合的第一亚基和第二亚基构成的fc结构域。
[0480]
在某些实施例中,多核苷酸或核酸是dna。在其他实施例中,本发明的多核苷酸是rna,例如以信使rna(mrna)的形式。本发明的rna可以是单链或双链的。
[0481]
重组方法
[0482]
本发明的双特异性抗原结合分子可通过例如重组产生获得。对于重组产生,提供一种或多种编码双特异性抗原结合分子或其多肽片段的多核苷酸。将一种或多种编码双特异性抗原结合分子的多核苷酸分离并插入至一种或多种载体中以用于在宿主细胞中进一步克隆和/或表达。此类多核苷酸可使用常规方法容易地分离并且测序。在本发明的一个方面,提供一种载体,优选为表达载体,该载体包含本发明的多核苷酸中的一种或多种多核苷酸。可以使用本领域技术人员熟知的方法来构建含有双特异性抗原结合分子(片段)的编码序列以及适当转录/翻译控制信号的表达载体。这些方法包括体外重组dna技术、合成技术和体内重组/遗传重组。参见例如以下文献所述的技术:maniatis等人,molecular cloning:a laboratory manual,cold spring harbor laboratory,n.y.(1989);和ausubel等人,current protocols in molecular biology,greene publishing associates and wiley interscience,n.y.(1989)。表达载体可以是质粒、病毒的一部分,或者可以是核酸片段。表达载体包括表达盒,编码双特异性抗原结合分子或其多肽片段的多核苷酸(即编码区)与启动子和/或其他转录或翻译控制元件可操作缔合地克隆至所述表达盒中。如本文所用,“编码区”是核酸的一部分,该部分由翻译成氨基酸的密码子组成。尽管“终止密码子”(tag、tga或taa)未被翻译成氨基酸,但其(如果存在的话)可被认为是编码
区的一部分,而任何侧翼序列,例如启动子、核糖体结合位点、转录终止子、内含子、5'和3'非翻译区等不是编码区的一部分。两个或更多个编码区可存在于单个多核苷酸构建体中(例如在单个载体上),或在单独的多核苷酸构建体中(例如在单独的(不同的)载体上)。此外,任何载体可含有单一编码区,或可包含两个或更多个编码区,例如本发明的载体可以编码一种或多种多肽,该一种或多种多肽在翻译后或翻译时通过蛋白水解切割分离成最终的蛋白质。此外,本发明的载体、多核苷酸或核酸可编码异源编码区,所述异源编码区与编码本发明的双特异性抗原结合分子或其多肽片段的多核苷酸或其变体或衍生物融合或不融合。异源编码区包括但不限于特化元件或基序,诸如分泌信号肽或异源功能结构域。可操作缔合是当基因产物(例如多肽)的编码区以某种方式与一个或多个调控序列缔合,以使基因产物的表达处于调控序列的影响或控制下。如果启动子功能的诱导导致编码所需基因产物的mrna的转录,并且如果两个dna片段之间的键结性质不干扰表达调控序列指导基因产物表达的能力或干扰待转录的基因模板的能力,则这两个dna片段(诸如多肽编码区和与其相关的启动子)是“可操作地缔合的”。因此,如果启动子能够影响该核酸的转录,则启动子区域将与编码多肽的核酸可操作地缔合。启动子可以是细胞特异性启动子,该细胞特异性启动子仅在预定细胞中指导dna的实质转录。除启动子外,其他转录控制元件,例如增强子、操纵子、阻遏物和转录终止信号,可以与多核苷酸可操作地缔合以指导细胞特异性转录。
[0483]
本文公开了合适的启动子和其他转录控制区。多种转录控制区是本领域技术人员已知的。这些转录控制区包括但不限于在脊椎动物细胞中起作用的转录控制区,诸如但不限于来自巨细胞病毒的启动子和增强子区段(例如立即早期启动子结合内含子-a)、猿猴病毒40(例如早期启动子)和逆转录病毒(诸如例如劳氏肉瘤病毒)。其他转录控制区包括来源于脊椎动物基因(诸如肌动蛋白、热休克蛋白、牛生长激素和兔珠蛋白)的那些转录控制区,以及能够控制真核细胞中基因表达的其他序列。其他合适的转录控制区包括组织特异性启动子和增强子以及诱导型启动子(例如四环素可诱导启动子)。类似地,各种翻译控制元件是本领域普通技术人员已知的。这些翻译控制元件包括但不限于核糖体结合位点、翻译起始和终止密码子,以及来源于病毒系统的元件(特别是内部核糖体进入位点,或ires,也称为cite序列)。表达盒还可以包括其他特征,诸如复制起点,和/或染色体整合元件,诸如逆转录病毒长末端重复序列(ltr),或腺相关病毒(aav)反向末端重复序列(itr)。
[0484]
本发明的多核苷酸和核酸编码区可以与编码分泌肽或信号肽的附加编码区缔合,所述附加编码区指导由本发明的多核苷酸编码的多肽的分泌。举例而言,如果需要分泌双特异性抗原结合分子或其多肽片段,可以将编码信号序列的dna置于编码本发明的本发明的双特异性抗原结合分子或其多肽片段的核酸的上游。根据信号假设,由哺乳动物细胞分泌的蛋白质具有信号肽或分泌前导序列,一旦已经起始跨粗面内质网输出生长的蛋白质链,该信号肽或分泌前导序列就被从成熟蛋白质上切割下来。本领域普通技术人员知道由脊椎动物细胞分泌的多肽通常具有与所述多肽的n末端融合的信号肽,所述信号肽被从翻译的多肽上切割下来以产生所述多肽的分泌或“成熟”形式。在某些实施例中,使用天然信号肽(例如免疫球蛋白重链或轻链信号肽),或保留指导与其可操作地缔合的多肽分泌的能力的该序列的功能性衍生物。另选地,可以使用异源哺乳动物信号肽或其功能衍生物。举例而言,野生型前导序列可以被人组织纤溶酶原活化剂(tpa)或小鼠β葡糖醛酸酶的前导序列取代。
[0485]
dna编码可用于促进后续纯化的短蛋白序列(例如组氨酸标签)或帮助标记融合蛋白的dna可包含在编码本发明的双特异性抗原结合分子或其多肽片段的多核苷酸的内部或末端。
[0486]
在本发明的另一方面,提供了包含一种或多种本发明的多核苷酸的宿主细胞。在某些方面,提供了包含一种或多种本发明的载体的宿主细胞。多核苷酸和载体可以单独或组合地渗入本文中分别关于多核苷酸和载体描述的任何特征。在一个方面,宿主细胞包含(例如,已转化或转染)载体,该载体包含编码本发明的双特异性抗原结合分子(的一部分)的多核苷酸。如本文所用,术语“宿主细胞”是指可以被工程化改造以产生本发明的融合蛋白或其片段的任何种类的细胞系统。适于复制和支持抗原结合分子表达的宿主细胞是本领域中熟知的。此类细胞可以用特定的表达载体适当地转染或转导,并且可以生长大量含有载体的细胞以用于接种大规模发酵罐来获得足够量的抗原结合分子用于临床应用。合适的宿主细胞包括原核微生物,诸如大肠杆菌,或各种真核细胞,诸如中国仓鼠卵巢细胞(cho)、昆虫细胞等。举例而言,多肽可以在细菌中产生,特别是当不需要糖基化时。多肽在表达后可以在可溶性级分中从细菌细胞糊状物中分离,并可以进一步纯化。除原核生物外,诸如丝状真菌或酵母之类的真核微生物也是用于编码多肽的载体的合适克隆或表达宿主,包括这样的真菌和酵母菌株,该真菌和酵母菌株的糖基化途径已经被“人源化”,从而导致产生具有部分或完全人糖基化模式的多肽。参见gerngross,nat biotech 22,1409-1414(2004)和li等人,nat biotech 24,210-215(2006)。
[0487]
用于表达(糖基化)多肽的合适宿主细胞还来源于多细胞生物(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物细胞和昆虫细胞。已经鉴定出了可以与昆虫细胞结合使用,特别是用于转染草地夜蛾(spodoptera frugiperda)细胞的许多杆状病毒株。植物细胞培养物也可用作宿主。参见例如美国专利号5,959,177、6,040,498、6,420,548、7,125,978和6,417,429(描述了用于在转基因植物中产生抗体的plantibodies
tm
技术)。脊椎动物细胞也可用作宿主。举例而言,适于在悬浮液中生长的哺乳动物细胞系可能是有用的。有用的哺乳动物宿主细胞系的其他实例为由sv40转化的猴肾cv1系(cos-7);人胚肾系(293或293t细胞,如例如在graham等人,j gen virol36,59(1977)中所述)、幼仓鼠肾细胞(bhk)、小鼠塞尔托利氏细胞(tm4细胞,如例如在mather,biol reprod 23,243-251(1980)中所述)、猴肾细胞(cv1)、非洲绿猴肾细胞(vero-76)、人宫颈癌细胞(hela)、犬肾细胞(mdck)、布法罗大鼠肝细胞(brl 3a)、人肺细胞(w138)、人肝细胞(hep g2)、小鼠乳腺肿瘤细胞(mmt 060562)、tri细胞(如例如在mather等人,annals n.y.acad sci 383,44-68(1982)中所述)、mrc 5细胞,以及fs4细胞。其他有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(cho)细胞,包括dhfr-cho细胞(urlaub等人,proc natl acad sci usa 77,4216(1980));以及骨髓瘤细胞系,诸如yo、ns0、p3x63和sp2/0。关于适用于蛋白质生产的某些哺乳动物宿主细胞系的综述,请参见例如yazaki和wu,methods in molecular biology,第248卷(b.k.c.lo编辑,humana press,totowa,nj),第255-268页(2003)。宿主细胞包括培养细胞,例如仅举几个例子而言哺乳动物培养细胞、酵母细胞、昆虫细胞、细菌细胞和植物细胞,还包括转基因动物、转基因植物或培养植物或动物组织中所包含的细胞。在一个实施例中,宿主细胞是真核细胞,优选哺乳动物细胞,诸如中国仓鼠卵巢(cho)细胞、人胚肾(hek)细胞或淋巴细胞(例如,y0、ns0、sp20细胞)。用于在这些系统中表达外源基因的标准技术是本领域已知的。
可以对表达包含免疫球蛋白的重链或轻链的多肽的细胞进行工程化改造,以便也表达另一条免疫球蛋白链,使得表达的产物为具有重链和轻链的免疫球蛋白。
[0488]
在一个方面,提供一种产生本发明的双特异性抗原结合分子或其多肽片段的方法,其中所述方法包括在适于表达本发明的双特异性抗原结合分子或其多肽片段的条件下培养包含编码如本文提供的本发明的双特异性抗原结合分子或其多肽片段多核苷酸的宿主细胞,以及从宿主细胞(或宿主细胞培养基)中回收本发明的双特异性抗原结合分子或其多肽片段。
[0489]
如本文所述制备的本发明的双特异性分子可通过本领域已知的技术纯化,这些技术为诸如高效液相色谱法、离子交换色谱法、凝胶电泳法、亲和色谱法、尺寸排阻色谱法等。用于纯化特定蛋白质的实际条件将部分取决于诸如净电荷、疏水性、亲水性等因素,并且对于本领域技术人员而言将是显而易见的。对于亲和色谱法纯化,可以使用双特异性抗原结合分子结合的抗体、配体、受体或抗原。举例而言,对于本发明融合蛋白的亲和色谱纯化,可以使用具有蛋白a或蛋白g的基质。基本上如实例中所述,可使用顺序蛋白a或g亲和色谱和尺寸排阻色谱来分离抗原结合分子。双特异性抗原结合分子或其片段的纯度可以通过各种熟知的分析方法中任一者来确定,所述熟知的分析方法包括凝胶电泳法、高压液相色谱法等。举例而言,实例中所述的表达的双特异性抗原结合分子被显示为得到完整并且适当组装,如还原和非还原sds-page所示。
[0490]
测定
[0491]
本文提供的抗原结合分子可以通过本领域已知的各种测定来表征其结合特性和/或生物学活性。特别地,它们的特征在于实例中更详细描述的测定。
[0492]
1.结合测定
[0493]
可以例如通过使用表达人成纤维细胞活化蛋白(fap)的鼠成纤维细胞系和流式细胞术(facs)分析来评价本文提供的双特异性抗原结合分子与相应靶标表达细胞的结合。可通过使用如实例3.1中所述的活化人pbmc来测定本文所提供的双特异性抗原结合分子与ox40的结合。
[0494]
2.活性测定
[0495]
测试本发明的双特异性抗原结合分子的生物学活性。生物学活性可包括双特异性抗原结合分子的功效和特异性。通过与靶抗原结合后ox40受体的激动性信号传导的测定证明了其功效和特异性。此外,如实例4.1中所述,经由人ox40阳性nf b报道细胞中诱导的nfκb活化来测量ox40信号传导的刺激。
[0496]
药物组合物、制剂和施用途径
[0497]
在进一步的方面,本发明提供了包含本文提供的双特异性抗原结合分子中任一者的药物组合物,其例如用于以下治疗方法中的任一者中。在一个方面,药物组合物包含本文所提供的双特异性抗原结合分子中的任何一者以及至少一种药用赋形剂。在另一个方面,药物组合物包含本文提供的双特异性抗原结合分子中任一者以及如下文所述的至少一种附加治疗剂。
[0498]
本发明的药物组合物包含溶于或分散于药用载体中的一种或多种双特异性抗原结合分子治疗有效量。术语“药用或药理学可接受”是指分子实体和组合物在所采用的剂量和浓度下通常对接受者无毒,即当视情况而定施用于动物(例如人)时不产生不利的、过敏
的或其他不良反应。含有根据本发明所述的至少一种双特异性抗原结合分子和任选地附加活性成分的药物组合物的制备将是鉴于本公开而为本领域的技术人员已知的,如remington's pharmaceutical sciences(第18版,mack printing company,1990)所例示,所述文献以引用方式并入本文。特别地,该组合物是冻干制剂或水溶液。如本文所用,“药用赋形剂”包括任何和所有溶剂、缓冲剂、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如抗细菌剂、抗真菌剂)、等渗剂、盐、稳定剂及它们的组合,如对本领域的普通技术人员所知。
[0499]
肠胃外组合物包括设计用于注射(例如,皮下、皮内、病灶内、静脉内、动脉内、肌内、鞘内或腹膜内注射)的那些组合物。为了注射,可在水溶液中配制本发明的双特异性抗原结合分子,优选在生理相容性缓冲剂诸如hanks溶液、林格氏溶液或生理盐水中配制。溶液可含有配制剂(formulatory agent),诸如悬浮剂、稳定剂和/或分散剂。另选地,双特异性抗原结合分子可以是粉末形式,用于在使用前用合适的媒介物(例如无菌无热原水)构建。根据需要,通过将本发明的抗原结合分子以所需的量与下面列举的各种其他成分一起掺入适当的溶剂中,来制备无菌可注射溶液。例如,无菌可以通过无菌过滤膜过滤而容易地实现。通常,通过将各种灭菌的活性成分掺入含有基础分散介质和/或其他成分的无菌媒介物中来制备分散体。在用于制备无菌可注射溶液、悬浮液或乳液的无菌粉末的情况下,优选的制备方法是真空干燥或冻干技术,所述真空干燥或冻干技术产生来自先前无菌过滤的液体介质的活性成分加上任何附加所需成分的粉末。如果需要的话,液体介质应适当缓冲,并且在注射之前应首先使用足够的盐水或葡萄糖来使液体稀释剂等渗。该组合物必须是在制造和贮存条件下稳定的,并且保存为抗诸如细菌和真菌等微生物的污染作用。应当理解,内毒素污染应以例如低于0.5ng/mg蛋白的安全水平保持最低。合适的药用赋形剂包括但不限于:缓冲剂,诸如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和蛋氨酸;防腐剂(诸如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯,诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;间甲酚);低分子量(少于约10个残基)多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,诸如edta;糖,诸如蔗糖、甘露醇、海藻糖或山梨糖醇;成盐抗衡离子,诸如钠;金属络合物(例如锌蛋白络合物);和/或非离子表面活性剂,诸如聚乙二醇(peg)。水性注射悬浮液可含有增加悬浮液粘度的化合物,诸如羧甲基纤维素钠、山梨糖醇、葡聚糖等。任选地,悬浮液还可含有合适的稳定剂或增大化合物溶解度的试剂,以允许制备高浓度溶液。另外,活性化合物的悬浮液可以制备成适当的油性注射悬浮液。合适的亲脂性溶剂或载体包括脂肪油,诸如芝麻油;或合成脂肪酸酯,诸如油酸乙酯或甘油三酯;或脂质粒。
[0500]
活性成分可以包埋在例如通过凝聚技术或通过界面聚合而制备的微胶囊(例如分别为羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊)中;在胶体药物递送系统(举例而言,脂质粒、白蛋白微球、微乳液、纳米粒子和纳米胶囊)中;或在粗乳液中。此类技术在remington's pharmaceutical sciences(第18版,mack printing company,1990)中公开。可以制备缓释制备物。缓释制备物的合适示例包括含有多肽的固态疏水聚合物的半透性基质,所述基质是例如膜或微胶囊等成型制品的形式。在特定实施例中,可注射组合物
的延长吸收可以通过在所述组合物中使用延迟吸收的试剂(例如单硬脂酸铝、明胶或它们的组合)来实现。
[0501]
本文的示例性药用赋形剂还包括间质药物分散剂,诸如可溶中性活性透明质酸酶糖蛋白(shasegp),例如人可溶性ph-20透明质酸酶糖蛋白,诸如rhuph20(baxter international,inc.)。某些示例性shasegp和使用方法,包括rhuph20,描述于美国专利公开号2005/0260186和2006/0104968中。在一个方面,将shasegp与一种或多种另外的糖胺聚糖酶(诸如软骨素酶)组合。
[0502]
示例性的冻干抗体制剂描述于美国专利号6,267,958中。水性抗体制剂包括在美国专利号6,171,586和wo2006/044908中描述的那些,后一者中的制剂包含组氨酸-乙酸盐缓冲剂。
[0503]
除了先前描述的组合物的外,抗原结合分子也可以配制成长效制备物。此类长效制剂可以通过植入(例如皮下或肌内植入)或通过肌内注射施用。因此,举例而言,融合蛋白可以用合适的聚合或疏水材料(例如配制成可接受的油中的乳剂)或离子交换树脂配制,或配制成微溶衍生物(例如配制成微溶盐)。
[0504]
包含本发明的双特异性抗原结合分子的药物组合物可通过常规的混合、溶解、乳化、包封、包埋或冻干工艺进行生产。药物组合物可以使用一种或多种生理上可接受的载体、稀释剂、赋形剂或助剂以常规方式配制,所述载体、稀释剂、赋形剂或助剂有助于将蛋白质加工成可以在药学上使用的制备物。适当的配方取决于所选择的施用途径。
[0505]
双特异性抗原结合分子可以配制成以游离酸或碱、中性或盐形式的组合物。药用盐是基本上保留游离酸或碱的生物活性的盐。这些药用盐包括酸加成盐,例如用蛋白质性质组合物的游离氨基形成的酸加成盐,或用无机酸(诸如盐酸或磷酸)或有机酸(诸如乙酸、草酸、酒石酸或扁桃酸)形成的酸加成盐。用游离羧基形成的盐也可以衍生自无机碱,诸如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁;或者有机碱,诸如异丙胺、三甲胺、组氨酸或普鲁卡因。与相应的游离碱形式相比,药用盐倾向于更易溶于水性和其他质子溶剂中。
[0506]
本文的组合物还可含有多于一种对于所治疗的特定适应症是必需的活性成分,优选是具有不会彼此不利地影响的互补活性的活性成分。此类活性成分适当地以对预期目的有效的量组合存在。
[0507]
待用于体内施用的制剂通常是无菌的。例如,无菌可以通过无菌过滤膜过滤而容易地实现。
[0508]
治疗方法和组合物
[0509]
本文提供的双特异性抗原结合分子中任一者可用于治疗方法中。为了用于治疗方法中,本发明的双特异性抗原结合分子可按照符合良好医学实践的方式配制、投配和施用。在这种情况下需要考虑的因素包括所治疗的特定疾患、所治疗的特定哺乳动物、个体患者的临床病症、疾患的原因、药剂的递送部位、施用方法、施用的时间安排,以及执业医师已知的其他因素。
[0510]
在一个方面,将本发明的双特异性抗原结合分子提供为用作药物。
[0511]
在进一步的方面,提供了本发明的双特异性抗原结合分子,其用于(i)诱导免疫刺激,(ii)刺激肿瘤特异性t细胞应答,(iii)引起肿瘤细胞凋亡,(iv)治疗癌症,(v)延迟癌症
进展,(vi)延长癌症患者的存活期,(vii)治疗感染。在特定方面,提供了用于治疗疾病特别是用于治疗癌症的本发明的双特异性抗原结合分子。
[0512]
在某些方面,提供了用于治疗方法中的本发明的双特异性抗原结合分子。在一个方面,本发明提供一种如本文所述的双特异性抗原结合分子,其用于治疗有需要的个体的疾病。在某些方面,本发明提供一种用于治疗患有疾病的个体的方法中的双特异性抗原结合分子,该方法包括向所述个体施用治疗有效量的双特异性抗原结合分子。在某些方面,待治疗的疾病是癌症。需要治疗的受试者、患者或“个体”通常是哺乳动物,更特别是人。
[0513]
在一个方面,提供一种方法,其用于i)诱导免疫刺激,(ii)刺激肿瘤特异性t细胞应答,(iii)引起肿瘤细胞凋亡,(iv)治疗癌症,(v)延迟癌症进展,(vi)延长癌症患者的存活期或(vii)治疗感染,其中所述方法包括向有需要的个体施用治疗有效量的本发明的双特异性抗原结合分子。
[0514]
在进一步的方面,本发明提供了本发明的双特异性抗原结合分子用于生产或制备用于治疗有需要的个体的疾病的药物的用途。在一个方面,药物用于治疗疾病的方法中,该方法包括向具有所述疾病的个体施用治疗有效量的所述药物。在某些方面,待治疗的疾病是增殖性疾患,特别是癌症。癌症的示例包括但不限于膀胱癌、脑癌、头颈癌、胰腺癌、肺癌、乳腺癌、卵巢癌、子宫癌、宫颈癌、子宫内膜癌、食道癌、结肠癌、结直肠癌、直肠癌、胃癌、前列腺癌、血癌、皮肤癌、鳞状细胞癌、骨癌以及肾癌。癌症的其他示例包括恶性肿瘤、淋巴瘤(例如,霍奇金淋巴瘤和非霍奇金淋巴瘤)、母细胞瘤、肉瘤和白血病。可以使用本发明的双特异性抗原结合分子或抗体治疗的其他细胞增殖疾患包括但不限于位于以下部位中的肿瘤:腹部、骨骼、乳腺、消化系统、肝脏、胰腺、腹膜、内分泌腺(肾上腺、甲状旁腺、垂体、睾丸、卵巢、胸腺、甲状腺)、眼、头颈部、神经系统(中枢神经系统和外周神经系统)、淋巴系统、骨盆、皮肤、软组织、脾脏、胸部以及泌尿种系统。还包括癌前病症或病变和癌转移。在某些实施例中,癌症选自由以下项组成的组:肾细胞癌、皮肤癌、肺癌、结直肠癌、乳腺癌、脑癌、头颈癌。本领域的技术人员易于认识到,在许多情况下,本发明的双特异性抗原结合分子或抗体可能无法治越,但可能提供益处。在一些方面,具有某些益处的生理变化也被视为具有治疗益处。因此,在一些方面,提供生理变化的本发明的双特异性抗原结合分子或抗体的量被视为“有效量”或“治疗有效量”。
[0515]
为了预防或治疗疾病,本发明的双特异性抗原结合分子的适当剂量(当单独使用或与一种或多种附加治疗剂联合使用时)将取决于待治疗疾病的类型、施用途径、患者体重、具体分子、疾病的严重程度和进程、本发明的双特异性抗原结合分子是出于预防还是治疗目的施用、先前或同时进行的治疗性干预、患者的临床病史和对双特异性抗原结合分子的应答以及主治医师的酌处权。在任何情况下,负责施用的执业者将针对个体受试者来确定组合物中活性成分的浓度和适当剂量。本文考虑了各种投配时间安排,包括但不限于在各个时间点处的单次或多次施用、推注施用,以及脉冲输注。
[0516]
本发明的双特异性抗原结合分子适于在一次或在一系列治疗中施用于患者。取决于疾病的类型和严重性,约1μg/kg至15mg/kg(例如0.1mg/kg-10mg/kg)的双特异性抗原结合分子可以是例如通过一次或多次单独施用或通过连续输注而施用于患者的初始候选剂量。取决于上述因素,一种典型的日剂量的范围可以为约1μg/kg至100mg/kg或更多。对于数天或更长时间的重复施用,取决于病症,治疗通常会持续直至发生所需的疾病症状抑制。本
发明的双特异性抗原结合分子的一种示例性剂量的范围为约0.005mg/kg至约10mg/kg。在其他示例中,剂量还可包括每次施用约1μg/kg体重、约5μg/kg体重、约10μg/kg体重、约50μg/kg体重、约100μg/kg体重、约200μg/kg体重、约350μg/kg体重、约500μg/kg体重、约1mg/kg体重、约5mg/kg体重、约10mg/kg体重、约50mg/kg体重、约100mg/kg体重、约200mg/kg体重、约350mg/kg体重、约500mg/kg体重至约1000mg/kg体重或更多,以及其中可推导出的任何范围。在从本文所列数字可推导出的范围的示例中,可以基于上述数字施用约0.1mg/kg体重至约20mg/kg体重、约5μg/kg体重至约1mg/kg体重等的范围。因此,可以向患者施用约0.5mg/kg、2.0mg/kg、5.0mg/kg或10mg/kg(或它们的任何组合)的一种或多种剂量。此类剂量可以间歇地施用,例如每周或每三周施用(例如,使得患者接受约2至约20或例如约6个剂量的融合蛋白)。在特定方面,双特异性抗原结合分子将每三周施用一次。可施用初始较高负荷剂量,然后施用一种或多种较低剂量。然而,其他剂量方案可能有用。通过常规技术和测定可以容易地监测该疗法的进展。
[0517]
本发明的双特异性抗原结合分子将通常以有效实现预期目的量使用。为用于治疗或预防病症,将本发明的双特异性抗原结合分子或其药物组合物以治疗有效量施用或施加。治疗有效量的确定完全在本领域技术人员的能力范围内,特别是根据本文提供的详细公开内容。对于全身施用,最初可以根据体外测定(诸如细胞培养测定)来估计治疗有效剂量。可以随后在动物模型中配制剂量,以实现包括如在细胞培养中测定的ic
50
循环浓度范围。此类信息可用于更准确地确定对人的有用剂量。还可以使用本领域熟知的技术来根据体内数据(例如动物模型)估计初始剂量。本领域的普通技术人员可以基于动物数据来容易地优化对人的施用。
[0518]
剂量和间隔可以单独地调节,以提供足以维持疗效的本发明的双特异性抗原结合分子的血浆水平。通过注射施用的常用患者剂量的范围是约0.1至50mg/kg/天,通常约0.1至1mg/kg/天。通过每天施用多个剂量可以实现治疗有效的血浆水平。可以例如通过hplc来测量血浆中的水平。在局部施用或选择性摄入的情况下,本发明的双特异性抗原结合分子或抗体的有效局部浓度可能与血浆浓度无关。本领域的技术人员将能够在无需过度实验的情况下优化治疗有效的局部剂量。
[0519]
本文所述的治疗有效剂量的本发明的双特异性抗原结合分子通常将提供治疗益处而不会引起显著的毒性。融合蛋白的毒性和治疗功效可通过细胞培养或实验动物中的标准药学程序来测定。细胞培养测定和动物研究可以用于测定ld
50
(致死群体的50%的剂量)和ed
50
(在群体的50%中治疗有效的剂量)。毒性和疗效之间的剂量比是治疗指数,所述治疗指数可以表示为比率ld
50
/ed
50
。表现出大治疗指数的双特异性抗原结合分子是优选的。在一个方面,本发明的双特异性抗原结合分子或抗体表现出高治疗指数。从细胞培养测定和动物研究获得的数据可用于配制适用于人的一系列剂量。剂量优选在包括毒性很小或没有毒性的ed50的循环浓度范围内。剂量可以取决于多种因素而在该范围内变化,所述多种因素为例如所采用的剂型、所利用的施用途径、受试者的病症等。确切的配方、施用途径和剂量可以由个别医生根据患者的病症来选择(参见例如fingl等人,1975,在:the pharmacological basis of therapeutics,第1章,第1页中,该文献的全部内容以引用方式并入本文中)。
[0520]
用本发明的融合蛋白治疗的患者的主治医师将知道如何以及何时由于毒性、器官
功能障碍等终止、中断或调节施用。相反地,如果临床应答不充分(排除毒性),则主治医师也会知道将治疗调节到更高水平。在目标疾患的管理中施用的剂量的大小将随着待治疗病症的严重程度、施用途径等而变化。举例而言,可以部分地通过标准预后评价方法来评价病症的严重性。此外,剂量和可能的剂量频率也将根据个体患者的年龄、体重和应答而变化。
[0521]
其他药剂和治疗
[0522]
本发明的双特异性抗原结合分子可在治疗中与一种或多种其他药剂联合施用。例如,本发明的双特异性抗原结合分子可以与至少一种另外的治疗剂共同施用。术语“治疗剂”包括可以施用用于治疗需要此类治疗的个体的症状或疾病的任何药剂。此类附加治疗剂可包含适合于所治疗的具体适应症的任何活性成分,优选地是具有不会彼此不利地影响的互补活性的活性成分。在某些方面,另外的治疗剂是另一种抗癌剂,例如微管破坏剂、抗代谢物、拓扑异构酶抑制剂、dna嵌入剂、烷化剂、激素疗法、激酶抑制剂、受体拮抗剂、肿瘤细胞凋亡活化剂,或抗血管生成剂。在某些方面,附加治疗剂为免疫调节剂、细胞生长抑制剂、细胞粘附抑制剂、细胞毒性剂或细胞抑制剂、细胞凋亡活化剂或增加细胞对细胞凋亡诱导剂的敏感性的药剂。
[0523]
因此,提供了本发明的双特异性抗原结合分子或包含它们的药物组合物,其用于治疗癌症,其中所述双特异性抗原结合分子与化学治疗剂、放射和/或用于癌症免疫疗法的其他药剂联合施用。
[0524]
此类其他药剂适当地以对预期目的有效的量组合存在。此类其他药剂的有效量取决于所用融合蛋白的量、疾患或治疗的类型,以及上面讨论的其他因素。本发明的双特异性抗原结合分子或抗体通常以与本文所述相同的剂量和施用途径,或本文所述剂量的约1%至99%,或以任何剂量且通过经验/临床上确定为合适的途径使用。用于癌症免疫疗法的其他药剂也可包括疫苗、类铎受体(tlr)剂及溶瘤病毒。
[0525]
上述此类联合疗法涵盖联合施用(其中两种或更多种治疗剂被包含在同一组合物或单独的组合物中),以及单独施用,在分开施用的情况下,本发明的双特异性抗原结合分子或抗体的施用可以在施用附加治疗剂和/或佐剂之前、同时和/或之后发生。
[0526]
在进一步的方面,提供用于治疗癌症的如上文所述的双特异性抗原结合分子,其中所述双特异性抗原结合分子与另一免疫调节剂联合施用。
[0527]
术语“免疫调节剂”是指影响免疫系统的任何物质,包括单克隆抗体。本发明的分子可被认为是免疫调节剂。免疫调节剂可用作治疗癌症的抗肿瘤剂。在一个方面,免疫调节剂包括但不限于抗ctla4抗体(例如,伊匹单抗)、抗pd1抗体(例如,纳武单抗或帕博利珠单抗)、pd-l1抗体(例如,阿特珠单抗、阿维单抗或德瓦鲁单抗)、icos抗体、4-1bb抗体和gitr抗体。在进一步的方面,提供用于治疗癌症的如上文所述的双特异性抗原结合分子,其中所述双特异性抗原结合分子与阻断pd-l1/pd-1相互作用的药剂联合施用。在一个方面,阻断pd-l1/pd-1相互作用的药剂是抗pd-l1抗体或抗pd1抗体。更特别地,该阻断pd-l1/pd-1相互作用的药剂是抗pd-l1抗体、特别是选自由阿替利珠单抗、德瓦鲁单抗、帕博利珠单抗及纳武利尤单抗组成的组的抗pd-l1抗体。在一个具体方面,阻断pd-l1/pd-1相互作用的药剂为阿特珠单抗(mpdl3280a、rg7446)。在另一个方面,阻断pd-l1/pd-1相互作用的药剂是抗pd-l1抗体,其包含seq id no:149的重链可变结构域vh(pdl-1)和seq id no:150的轻链可变结构域vl(pdl-1)。在另一个方面,阻断pd-l1/pd-1相互作用的药剂是抗pd-l1抗体,其包
含seq id no:151的重链可变结构域vh(pdl-1)和seq id no:152的轻链可变结构域vl(pdl-1)。在另一个方面,该阻断pd-l1/pd-1相互作用的药剂是抗pd1抗体、特别是选自帕博利珠单抗或纳武利尤单抗的抗pd1抗体。此类其他药剂适当地以对预期目的有效的量组合存在。此类其他药剂的有效量取决于所用双特异性抗原结合分子的量、疾患或治疗的类型,以及上面讨论的其他因素。如本文上文所述的双特异性抗原结合分子通常以与如本文所述相同的剂量和施用途径,或本文所述剂量的约1%至99%,或以任何剂量且通过经验/临床上确定为合适的途径使用。
[0528]
在一个方面,提供用于治疗癌症的双特异性激动性ox40抗原结合分子或药物组合物,其中所述双特异性激动性ox40抗原结合分子用于与t细胞活化性抗cd3双特异性抗体联合施用。在一个方面,对肿瘤相关抗原具有特异性的t细胞活化性抗cd3双特异性抗体是抗cea/抗cd3双特异性抗体。
[0529]
在特定方面,联合使用的抗cd3双特异性抗体包含第一抗原结合结构域,其包含重链可变区(vhcd3),其包含seq id no:117的cdr-h1序列、seq id no:118的cdr-h2序列和seq id no:119的cdr-h3序列;和/或轻链可变区(v
l
cd3),其包含seq id no:120的cdr-l1序列、seq id no:121的cdr-l2序列和seq id no:122的cdr-l3序列。更特别地,所述抗cd3双特异性包含第一抗原结合结构域,其包含与seq id no:123的氨基酸序列至少90%、95%、96%、97%、98%或99%相同的重链可变区(vhcd3)和/或与seq id no:124的氨基酸序列至少90%、95%、96%、97%、98%或99%相同的轻链可变区(v
l
cd3)。在进一步的方面,抗cd3双特异性抗体包含:重链可变区(vhcd3),其包含seq id no:123的氨基酸序列;和/或轻链可变区(v
l
cd3),其包含seq id no:124的氨基酸序列。
[0530]
在另一个方面,联合使用的抗cd3双特异性抗体包含第一抗原结合结构域,其包含重链可变区(vhcd3),其包含seq id no:125的cdr-h1序列、seq id no:126的cdr-h2序列和seq id no:127的cdr-h3序列;和/或轻链可变区(v
l
cd3),其包含seq id no:128的cdr-l1序列、seq id no:129的cdr-l2序列和seq id no:130的cdr-l3序列。更特别地,所述抗cd3双特异性包含第一抗原结合结构域,其包含与seq id no:131的氨基酸序列至少90%、95%、96%、97%、98%或99%相同的重链可变区(vhcd3)和/或与seq id no:132的氨基酸序列至少90%、95%、96%、97%、98%或99%相同的轻链可变区(v
l
cd3)。在进一步的方面,抗cd20/抗cd3双特异性抗体包含:重链可变区(vhcd3),其包含seq id no:131的氨基酸序列;和/或轻链可变区(v
l
cd3),其包含seq id no:132的氨基酸序列。
[0531]
在另一个方面,联合使用的抗cd3双特异性抗体包含第一抗原结合结构域,其包含重链可变区(vhcd3),其包含seq id no:133的cdr-h1序列、seq id no:134的cdr-h2序列和seq id no:135的cdr-h3序列;和/或轻链可变区(v
l
cd3),其包含seq id no:136的cdr-l1序列、seq id no:137的cdr-l2序列和seq id no:138的cdr-l3序列。更特别地,所述抗cd3双特异性包含第一抗原结合结构域,其包含与seq id no:139的氨基酸序列至少90%、95%、96%、97%、98%或99%相同的重链可变区(vhcd3)和/或与seq id no:140的氨基酸序列至少90%、95%、96%、97%、98%或99%相同的轻链可变区(v
l
cd3)。在进一步的方面,抗cd20/抗cd3双特异性抗体包含:重链可变区(vhcd3),其包含seq id no:139的氨基酸序列;和/或轻链可变区(v
l
cd3),其包含seq id no:140的氨基酸序列。
[0532]
在一个特定方面,抗cea/抗cd3双特异性抗体包含与seq id no:141所示的序列至
少95%、96%、97%、98%或99%相同的多肽,与seq id no:142所示的序列至少95%、96%、97%、98%或99%相同的多肽,与seq id no:143所示的序列至少95%、96%、97%、98%或99%相同的多肽,以及与seq id no:144所示的序列至少95%、96%、97%、98%或99%相同的多肽。在又一特定实施例中,双特异性抗体包含seq id no:141所示的多肽序列、seq id no:142所示的多肽序列、seq id no:143所示的多肽序列和seq id no:144所示的多肽序列(cea tcb)。
[0533]
在另一个特定方面,抗cea/抗cd3双特异性抗体包含与seq id no:145所示的序列至少95%、96%、97%、98%或99%相同的多肽,与seq id no:146所示的序列至少95%、96%、97%、98%或99%相同的多肽,与seq id no:147所示的序列至少95%、96%、97%、98%或99%相同的多肽,以及与seq id no:148所示的序列至少95%、96%、97%、98%或99%相同的多肽。在又一特定实施例中,双特异性抗体包含seq id no:145所示的多肽序列、seq id no:146所示的多肽序列、seq id no:147所示的多肽序列和seq id no:148所示的多肽序列(ceacam5 tcb)。
[0534]
具体的双特异性抗体进一步描述于pct公开号wo 2014/131712 a1中。在进一步的方面,抗cea/抗cd3双特异性抗体还可以包含双特异性t细胞接合物在进一步的方面,抗cea/抗cd3双特异性抗体是如wo2007/071426或wo 2014/131712中所述的双特异性抗体。
[0535]
上述此类联合疗法涵盖联合施用(其中两种或更多种治疗剂被包含在同一组合物或分开的组合物中),以及分开施用,在分开施用的情况下,双特异性抗原结合分子的施用可以在施用另外的治疗剂和/或佐剂之前、同时和/或之后进行。
[0536]
制品
[0537]
在本发明的另一方面,提供一种制品,其含有可用于治疗、预防和/或诊断上述疾患的物质。该制品包括容器和在所述容器上或与所述容器相关的标签或包装插页(package insert)。合适的容器包括例如瓶子、小瓶、注射器、静脉注射(iv)溶液袋等。所述容器可以由诸如玻璃或塑料等多种材料形成。所述容器容纳组合物,所述组合物单独或与另一种有效用于治疗、预防和/或诊断所述病症的组合物组合,并且所述容器可具有无菌入口(例如所述容器可以是静脉注射溶液袋或具有可用皮下注射针刺穿的塞子的小瓶)。组合物中的至少一种活性剂是本发明的双特异性抗原结合分子。
[0538]
标签或包装插页指示该组合物用于治疗所选择的病症。此外,制品可包括(a)第一容器,所述第一容器中含有包含本发明的双特异性抗原结合分子的组合物;以及(b)第二容器,所述第二容器中含有包含另外的细胞毒性剂或其他治疗剂组合物。本发明该实施例中的制品还可包含包装插页,所述包装插页指示所述组合物可用于治疗特定病症。
[0539]
另选地或另外地,所述制品还可包括第二(或第三)容器,所述第二(或第三)容器包括药用缓冲液,诸如抑菌性注射用水(bwfi)、磷酸盐缓冲盐水、林格氏溶液和葡萄糖溶液。制品还可以包括从商业和用户角度所需的其他物质,包括其他缓冲剂、稀释剂、过滤器、针头和注射器。
[0540]
表b(序列):
[0541]
[0542]
[0543]
[0544]
[0545]
[0546]
[0547]
[0548]
[0549]
[0550]
[0551]
[0552][0553]
以下编号的段落描述了本发明的各方面:
[0554]
1.一种双特异性抗原结合分子,其包含:
[0555]
(a)至少两个能够特异性结合至ox40的抗原结合结构域;
[0556]
(b)能够特异性结合至成纤维细胞活化蛋白(fap)的抗原结合结构域,其包含:重链可变区(vhfap),所述vhfap包含:
[0557]
(i)cdr-h1,其包含seq id no:3的氨基酸序列,(ii)cdr-h2,其包含选自由seq id no:4、seq id no:11和seq id no:12组成的组的氨基酸序列,和(iii)cdr-h3,其包含seq id no:5的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含:(iv)cdr-l1,其包含选自由seq id no:6、seq id no:13和seq id no:14组成的组的氨基酸序列,(v)cdr-l2,其包含seq id no:7的氨基酸序列,和(vi)cdr-l3,其包含seq id no:8的氨基酸序列;以及
[0558]
(c)fc区,其由能够稳定缔合的第一亚基和第二亚基构成。
[0559]
2.根据段落1所述的双特异性抗原结合分子,其中所述fc区包含降低抗体与fc受体的结合亲和力和/或效应子功能的一个或多个氨基酸取代。
[0560]
3.根据段落1或2所述的双特异性抗原结合分子,其中所述能够特异性结合至fap的抗原结合结构域包含:重链可变区(vhfap),所述vhfap包含与seq id no:9的氨基酸序列至少约90%相同的氨基酸序列;以及轻链可变区(v
l
fap),所述v
l
fap包含与seq id no:10的氨基酸序列至少约90%相同的氨基酸序列。
[0561]
4.根据段落1至3中任一项所述的双特异性抗原结合分子,其中能够与fap特异性结合的抗原结合结构域包含:
[0562]
重链可变区(vhfap),其包含选自由以下项组成的组的氨基酸序列:seq id no:15、seq id no:16、seq id no:17、seq id no:18、seq id no:19和seq id no:20;以及
[0563]
轻链可变区(v
l
fap),其包含选自由以下项组成的组的氨基酸序列:seq id no:21、seq id no:22、seq id no:23、seq id no:24、seq id no:25和seq id no:26。
[0564]
5.根据段落1至4中任一项所述的双特异性抗原结合分子,其中能够与fap特异性结合的抗原结合结构域包含:
[0565]
(a)重链可变区(vhfap),其包含seq id no:15的氨基酸序列,以及轻链可变区(v
l
fap),其包含seq id no:21的氨基酸序列;或者
[0566]
(b)重链可变区(vhfap),其包含seq id no:16的氨基酸序列,以及轻链可变区(v
l
fap),其包含seq id no:21的氨基酸序列;或者
[0567]
(c)重链可变区(vhfap),其包含seq id no:16的氨基酸序列,以及轻链可变区
(v
l
fap),其包含seq id no:22的氨基酸序列;或者
[0568]
(d)重链可变区(vhfap),其包含seq id no:19的氨基酸序列,以及轻链可变区(v
l
fap),其包含seq id no:25的氨基酸序列。
[0569]
6.根据段落1至4中任一项所述的双特异性抗原结合分子,其中能够与fap特异性结合的抗原结合结构域包含:重链可变区(vhfap),其包含seq id no:15的氨基酸序列;以及轻链可变区(v
l
fap),其包含seq id no:21的氨基酸序列。
[0570]
7.根据段落1至6中任一项所述的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:
[0571]
(i)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:27的氨基酸序列,(ii)cdr-h2,其包含seq id no:28的氨基酸序列,和(iii)cdr-h3,其包含seq id no:29的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:30的氨基酸序列,(v)cdr-l2,其包含seq id no:31的氨基酸序列,和(vi)cdr-l3,其包含seq id no:32的氨基酸序列;或者
[0572]
(ii)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:35的氨基酸序列,(ii)cdr-h2,其包含seq id no:36的氨基酸序列,和(iii)cdr-h3,其包含seq id no:37的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:38的氨基酸序列,(v)cdr-l2,其包含seq id no:39的氨基酸序列,和(vi)cdr-l3,其包含seq id no:40的氨基酸序列;或者
[0573]
(iii)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:43的氨基酸序列,(ii)cdr-h2,其包含seq id no:44的氨基酸序列,和(iii)cdr-h3,其包含seq id no:45的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:46的氨基酸序列,(v)cdr-l2,其包含seq id no:47的氨基酸序列,和(vi)cdr-l3,其包含seq id no:48的氨基酸序列;或者
[0574]
(iv)重链可变区(vhox40),其包含:(i)cdr-h1,其包含seq id no:51的氨基酸序列,(ii)cdr-h2,其包含seq id no:52的氨基酸序列,和(iii)cdr-h3,其包含seq id no:53的氨基酸序列;以及轻链可变区(v
l
ox40),其包含:(iv)cdr-l1,其包含seq id no:54的氨基酸序列,(v)cdr-l2,其包含seq id no:55的氨基酸序列,和(vi)cdr-l3,其包含seq id no:56的氨基酸序列。
[0575]
8.根据段落1至7中任一项所述的双特异性抗原结合分子,其中能够特异性结合至ox40的抗原结合结构域包含:
[0576]
(i)重链可变区(vhox40),其包含seq id no:33的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列,或者
[0577]
(ii)重链可变区(vhox40),其包含seq id no:41的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:42的氨基酸序列,或者
[0578]
(iii)重链可变区(vhox40),其包含seq id no:49的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:50的氨基酸序列,或者
[0579]
(iv)重链可变区(vhox40),其包含seq id no:57的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:58的氨基酸序列。
[0580]
9.根据段落1至7中任一项所述的双特异性抗原结合分子,其中能够特异性结合至
ox40的抗原结合结构域包含:
[0581]
(i)重链可变区(vhox40),其包含seq id no:59的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列,或者
[0582]
(ii)重链可变区(vhox40),其包含seq id no:60的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列,或者
[0583]
(iii)重链可变区(vhox40),其包含seq id no:61的氨基酸序列,以及轻链可变区(v
l
ox40),其包含seq id no:34的氨基酸序列。
[0584]
10.根据段落1至9中任一项所述的双特异性抗原结合分子,其中所述fc区是igg,特别是igg1 fc区或igg4 fc区。
[0585]
11.根据段落1至10中任一项所述的双特异性抗原结合分子,其中所述fc区属于人igg1亚类,其具有氨基酸突变l234a、l235a和p329g(根据kabat eu索引编号)。
[0586]
12.根据段落1至15中任一项所述的双特异性抗原结合分子,其中所述双特异性抗原结合分子包含
[0587]
(a)至少两个能够特异性结合至ox40的fab片段,它们各自连接至所述fc区的其中一个亚基的n末端;和
[0588]
(b)一个能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
[0589]
(c)所述由能够稳定缔合的第一亚基和第二亚基构成的fc区。
[0590]
13.根据段落12所述的双特异性抗原结合分子,其中所述能够特异性结合至fap的交叉fab片段的vh-cκ链与所述fc区的其中一个亚基的c末端融合。
[0591]
14.根据段落1至13中任一项所述的双特异性抗原结合分子,其由以下项组成:
[0592]
(aa)第一fab片段,其能够特异性结合至ox40;
[0593]
(ab)第二fab片段,其能够特异性结合至ox40;
[0594]
(b)能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
[0595]
(c)所述由能够稳定缔合的第一亚基和第二亚基构成的fc区,其中所述第一fab片段(ai)在vh-ch1链的c末端与所述第一亚基的n末端融合且所述第二fab片段(aii)在vh-ch1链的c末端与所述第二亚基的n末端融合。
[0596]
15.根据段落1至13中任一项所述的双特异性抗原结合分子,其由以下项组成:
[0597]
(aa)第一fab片段,其能够特异性结合至ox40;
[0598]
(ab)第二fab片段,其能够特异性结合至ox40;
[0599]
(ac)第三fab片段,其能够特异性结合至ox40;
[0600]
(b)能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
[0601]
(c)由能够稳定缔合的第一亚基和第二亚基构成的fc区,其中所述第二fab片段(ab)在vh-ch1链的c末端与所述第一fab片段(aa)的vh-ch1链的n末端融合,所述第一fab片段(aa)的vh-ch1链又在其c末端与所述第一亚基的n末端融合,并且所述第三fab片段(ac)在fab重链的c末端与所述第二亚基的n末端融合。
[0602]
16.根据段落1至13中任一项所述的双特异性抗原结合分子,其由以下项组成:
[0603]
(aa)第一fab片段,其能够特异性结合至ox40;
[0604]
(ab)第二fab片段,其能够特异性结合至ox40;
[0605]
(ac)第三fab片段,其能够特异性结合至ox40;
[0606]
(ad)第四fab片段,其能够特异性结合至ox40;
[0607]
(b)能够特异性结合至fap的交叉fab片段,其与所述fc区的其中一个亚基的c末端融合;以及
[0608]
(c)由能够稳定缔合的第一亚基和第二亚基构成的fc区,其中所述第二fab片段(ab)在vh-ch1链的c末端与所述第一fab片段(aa)的vh-ch1链的n末端融合,所述第一fab片段(aa)的vh-ch1链又在其c末端与所述第一亚基的n末端融合,并且所述第四fab片段(ad)在vh-ch1链的c末端与所述第三fab片段(ac)的vh-ch1链的n末端融合,所述第三fab片段(ac)的vh-ch1链又在其c末端与所述第二亚基的n末端融合。
[0609]
17.一种分离的核酸,其编码根据段落1至16中任一项所述的双特异性抗原结合分子。
[0610]
18.一种表达载体,其包含根据段落17所述的分离的核酸。
[0611]
19.一种宿主细胞,其包含根据段落17所述的分离的核酸或根据段落18所述的表达载体。
[0612]
20.一种产生双特异性抗原结合分子的方法,其包括在适合于表达所述双特异性抗原结合分子的条件下培养根据段落19所述的宿主细胞,并且分离所述双特异性抗原结合分子。
[0613]
21.一种药物组合物,其包含根据段落1至16中任一项所述的双特异性抗原结合分子以及药用载体。
[0614]
22.根据段落21所述的药物组合物,其进一步包含另外的治疗剂。
[0615]
23.根据段落1至16中任一项所述的双特异性抗原结合分子或根据段落21所述的药物组合物,其用作药物。
[0616]
24.根据权利要求1至16中任一项所述的双特异性抗原结合分子或根据段落21所述的药物组合物,其用于
[0617]
(i)诱导免疫刺激,
[0618]
(ii)刺激肿瘤特异性t细胞应答,
[0619]
(iii)引起肿瘤细胞凋亡,
[0620]
(iv)治疗癌症,
[0621]
(v)延缓癌症发展,
[0622]
(vi)延长癌症患者的存活期,
[0623]
(vii)治疗感染。
[0624]
25.根据段落1至16中任一项所述的双特异性抗原结合分子或根据段落21所述的药物组合物,其用于治疗癌症。
[0625]
26.根据段落1至16中任一项所述的双特异性抗原结合分子或根据段落21所述的药物组合物,其用于治疗癌症,其中所述双特异性抗原结合分子或药物组合物用于与化学治疗剂、放射和/或用于癌症免疫疗法的其他药剂联合施用。
[0626]
27.根据段落1至16中任一项所述的激动性双特异性抗原结合分子或根据段落21
所述的药物组合物在制造用于治疗癌症的药物中的用途。
[0627]
28.一种治疗患有癌症的个体的方法,其包括向所述个体施用有效量的根据段落1至16中任一项所述的双特异性抗原结合分子或根据段落21所述的药物组合物。
[0628]
实例
[0629]
以下是本发明的方法和组合物的实例。应当理解,在给出以上提供的一般描述的情况下,可以实践各种其他实施例。
[0630]
重组dna技术
[0631]
使用标准方法来操纵dna,如在sambrook等人,molecular cloning:a laboratory manual;cold spring harbor laboratory press,cold spring harbor,new york,1989中所述。根据制造商的说明来使用分子生物学试剂。关于人免疫球蛋白轻链和重链的核苷酸序列的一般信息在以下参考文献中给出:kabat,e.a.等人,(1991)sequences of proteins of immunological interest,第五版,nih publication no 91-3242。
[0632]
dna测序
[0633]
通过双链测序确定dna序列。
[0634]
基因合成
[0635]
通过使用适当模板进行pcr生成所需的基因区段,或由geneart ag(regensburg,germany)通过自动化基因合成从合成寡核苷酸和pcr产物合成所需的基因区段。在确切的基因序列不可用的情况下,基于最接近的同源物的序列设计寡核苷酸引物,并且通过rt-pcr从来源于合适的组织的rna中分离出基因。将侧接有单个限制性内切酶切割位点的基因区段克隆到标准克隆/测序载体中。从转化的细菌中纯化出质粒dna,并通过紫外光谱法确定浓度。通过dna测序来确认亚克隆基因片段的dna序列。设计具有合适限制性位点的基因区段,以允许亚克隆到相应的表达载体中。所有构建体均设计有5’端dna序列,该序列编码前导肽,该前导肽靶向真核细胞分泌的蛋白。
[0636]
蛋白纯化
[0637]
参照标准方案从过滤的细胞培养物上清液中纯化蛋白。简言之,将抗体施加至蛋白a琼脂糖柱(ge healthcare)并用pbs洗涤。在ph 3.0下实现抗体的洗脱,之后立即中和样品。通过离子交换色谱法(poros xs),利用平衡缓冲液(20mm his,ph 5.5,1,47ms/cm)以及洗脱缓冲液(20mm his、500mm nacl,ph 5.5,49.1ms/cm)(梯度:至100%洗脱缓冲液,60cv)将聚集蛋白质与单体抗体分离。在一些情况中,随后在pbs中或在20mm组氨酸、140mm nacl ph 6.0中实施尺寸排阻色谱法(superdex 200,ge healthcare)。将单体抗体级分合并,使用例如millipore amicon ultra(30mwco)离心浓缩器浓缩(若需要),冷冻并储存在-20℃或-80℃下。提供样品的部分以例如通过sds-page、尺寸排阻色谱法(sec)或质谱法来进行后续的蛋白质分析和分析表征。
[0638]
sds-page
[0639]
根据制造商的说明使用预制凝胶系统(invitrogen)。特别地,使用10%或4-12%bis-tris预制凝胶(ph 6.4)和mes(还原凝胶,具有抗氧化剂电泳缓冲添加剂)或mops(非还原凝胶)电泳缓冲液。
[0640]
ce-sds
[0641]
通过ce-sds使用微流控labchip技术分析双特异性和对照抗体的纯度、抗体完整
性和分子量(caliper life science,usa)。使用ht protein express试剂盒根据制造商的说明制备5μl蛋白溶液用于ce-sds分析,并使用ht protein express芯片在labchip gxii系统上进行分析。使用labchip gx软件第3.0.618.0版对数据进行分析。
[0642]
分析型尺寸排阻色谱法
[0643]
使用biosuite 250 5μm.7.8
×
300分析型粒径筛析管柱(tosoh),在200mm k-phosophat 250mm kcl ph 6.2运行缓冲液中在25℃下分析分子的聚集体含量。
[0644]
质谱法
[0645]
本节描述了对具有vh/vl或ch/cl交换(crossmab)的多特异性抗体的表征,重点在于所述多特异性抗体的正确装配。通过对脱糖基化的完整crossmab和脱糖基化/fabalactica或者另选地脱糖基化/gingiskhan消化的crossmab进行电喷雾电离质谱法(esi-ms),来分析预期的一级结构。
[0646]
在37℃下以1mg/ml的蛋白质浓度将crossmab用磷酸盐或tris缓冲液中的n-糖苷酶f脱糖基化至多17h。fabalactica或gingiskhan(genovis ab;瑞典)消化是在供应商供应的缓冲液中进行,该缓冲液中含有100μg去糖基化的crossmab。在质谱法之前,将样品经由hplc在sephadex g25柱(ge healthcare)上脱盐。在配备有triversa nanomate源(advion)的maxis4g uhr-qtof ms系统(bruker daltonik)上经由esi-ms来测定总质量。
[0647]
实例1
[0648]
生成抗成纤维细胞活化蛋白(fap)的新抗体
[0649]
1.1小鼠的免疫接种
[0650]
balb/c和nmri小鼠用于免疫接种。根据附录a“动物的住宿和照料指南”将动物圈养在aaalaci认可的动物设施中。所有动物免疫接种方案和实验均已获得上巴伐利亚行政区政府批准(许可号55.2-1-54-2531-19-10),并根据德国动物福利法和欧洲议会和理事会指令2010/63进行。6-8周龄的balb/c和nmri小鼠(n=5)接受了共价附接至his标签(seq id no:62)的人成纤维细胞活化蛋白α(氨基酸27-759;登录号np_004451)的细胞外结构域的四轮免疫接种。在每次免疫接种之前,用氧气和异氟烷的混合气体麻醉小鼠。第一次免疫接种时,将溶于ph 7.4的pbs中的30μg蛋白与等体积的cfa(bd difco,#263810)混合并腹膜内(i.p.)施用。在第6周皮下(s.c.)施用另外10μg在abisco佐剂中乳化的蛋白。在第10周,腹膜内施用第三剂不含佐剂的5μg蛋白。最后,在使用杂交瘤技术制备用于抗体开发的脾细胞前三天,使小鼠经受50μg蛋白质的静脉内(i.v.)加强免疫。通过elisa测试血清的抗原特异性总igg抗体产生。在最后一次免疫后三天,使小鼠安乐死且无菌分离脾脏并准备用于生成杂交瘤。分离小鼠淋巴细胞并使用基于peg的标准方案与小鼠骨髓瘤细胞系融合以产生杂交瘤。将得到的杂交瘤细胞以约104个涂布在平底96孔微量滴定板中,然后在选择性培养基中温育约两周,然后筛选抗原特异性抗体的产生。一旦发生广泛的杂交瘤生长,重新涂布分泌抗体的杂交瘤。通过elisa筛选杂交瘤上清液用于与重组人成纤维细胞活化蛋白α(hufap)的特异性结合,然后使用biacore测量来评价对重组hufap的动力学结合参数。
[0651]
杂交瘤的培养:在37℃和5%co2下,将所产生的mumab杂交瘤在rpmi 1640(pan
–
目录号(cat.no.)po4-17500)中培养,其补充有2mm左旋谷氨酰胺(gibco-cat.no.35050-038)、1mm丙酮酸钠(gibco-cat.no.11360-039)、1x neaa(gibco-cat.no.11140-035)、10%fcs(paa-cat.no.a15-649)、1x pen strep(roche-cat.no.1074440)、1x nutridoma cs
(roche-cat.no.1363743)、50μm巯基乙醇(gibco-cat.no.31350-010)和50u/ml小鼠il 6(roche-cat.no.1 444 581)。
[0652]
1.2抗hufap克隆的形式依赖性结合
[0653]
为了确定抗fap克隆在c末端融合至fc结构域时是否不会丧失其结合特性,制备以下构建体:包含fc杵链和fc臼链的构建体,其中vh结构域融合至fc杵链的c末端并且vl结构域融合至fc臼链的c末端(c末端vh/vl融合),以及包含fc杵链和fc臼链的构建体,其中整个fab以vh结构域融合至fc杵链的c末端(c末端fab融合)。fc杵链具有seq id no:82的氨基酸序列,并且fc臼链具有seq id no:83的氨基酸序列。
[0654]
与抗体相比,构建体对生物素化的重组人fap和生物素化的重组食蟹猴fap的亲和力示出于下表3中。
[0655]
表3:如通过biacore测量的对人fap和食蟹猴fap的亲和力
[0656][0657]
如上文所述,还已经确定了构建体与fap转染的hek细胞的细胞结合。ec
50
值示出于表4中。所有抗fap抗体的c末端融合构建体均能够与人和食蟹猴fap结合,然而其中整个fab以vh结构域融合至fc杵链的c末端的构建体优于其中vh结构域融合至fc杵链的c末端并且vl结构域融合至fc臼链的c末端的那些构建体。
[0658]
表4:与表达hufap的细胞的细胞结合
[0659][0660][0661]
1.3抗hufap抗体与fap克隆4b9和28h1的竞争性细胞结合
[0662]
与fap克隆4b9相比,测试了所得克隆的结合行为。fap克隆4b9和28h1的产生和制备描述于wo 2012/020006 a2中,所述专利以引用方式并入本文。为了确定鼠fap克隆是否
将不同的表位识别为克隆4b9和28h1,进行了与在转染的hek细胞上表达的人fap的竞争结合。
[0663]
简言之,用细胞解离缓冲液收获靶细胞,用facs缓冲液(pbs+2%fcs+5mm edta+0.25%钠酸)洗涤,并接种到96-u底板中(1x105细胞/孔)。将未标记的一级抗人fap抗体(mu igg1)加入至细胞中(终浓度60μg/ml至0.2μg/ml;1:3稀释),并在4℃下温育20分钟,然后加入alexafluor647标记的抗fap抗体4b9或28h1(终浓度20μg/ml)。在4℃下温育30分钟后,将细胞洗涤,固定,并使用miltenyi macsquant测量af647标记的克隆4b9和28h1的荧光信号强度。
[0664]
鉴定了10种杂交瘤衍生的鼠抗体(命名为克隆209、210、211、212、213、214、215、216、217和218),它们没有竞争与抗fap抗体4b9或28h1结合。
[0665]
1.4抗hufap鼠抗体的靶标结合特异性
[0666]
成纤维细胞活化蛋白(fap,fap-α,seprase)是ii型跨膜丝氨酸蛋白酶,其属于脯氨酰寡肽酶家族。该家族包含丝氨酸蛋白酶,其在脯氨酸残基之后优先切割肽。在人蛋白组中表达的该家族的其他重要成员为脯氨酰寡肽酶(prep)和二肽基肽酶(dpp)。dpp-iv为fap的最接近同源物。与fap相比,dpp-iv普遍表达,并在各种生物学过程(诸如t细胞共刺激、趋化因子生物学、葡萄糖代谢和肿瘤发生)中起作用,因此所需的抗人fap抗体不应与人dpp-iv结合。
[0667]
使用人fap或人dppiv转染的hek细胞通过流式细胞术确定与人fap和人dpp-iv的结合。简言之,用细胞解离缓冲液收获靶细胞,用facs缓冲液(pbs+2%fcs+5mm edta+0.25%钠酸)洗涤,并接种到96-u底板中(1x105细胞/孔)。将未标记的一级抗体加入至细胞中(终浓度10μg/ml),并在4℃下温育30分钟。洗涤后,将细胞与山羊抗小鼠igg-pe f(ab')2(serotec)在黑暗中在4℃下一起温育30分钟。之后,将细胞洗涤,固定并使用bd facs canto
tm
ii测量。10种杂交瘤衍生的抗人fap抗体中的任一者均未检测到与人dpp-iv的非特异性结合。
[0668]
1.5 huigg1_lala_pg形式的抗hufap抗体的生成
[0669]
用标准测序方法确定了新抗hufap抗体的dna序列。基于vh和vl结构域,根据wo 2012/130831 a1中所述的方法,将新抗fap抗体表达为具有效应子沉默fc(p329g;l234,l235a)的huigg1抗体,以消除与fc 受体的结合。详细地,通过与编码不同肽链的表达载体悬浮生长的hek293-f细胞的瞬时转染来表达抗体。根据细胞供应商的说明,使用抗体载体的maxiprep(qiagen,germany)制剂,基于f17的培养基(invitrogen,usa),peipro(polyscience europe gmbh)和初始细胞密度为1-2百万活细胞/ml,在不含血清的freestyle 293表达培养基(invitrogen)中,进行至hek293-f细胞(invitrogen,usa)中的转染。在摇瓶或搅拌的发酵罐中培养7天后,通过以14000g离心30分钟收集细胞培养上清液,并且通过0.22μm过滤器过滤。
[0670]
使用mabselectsure-sepharose
tm
(ge healthcare,sweden)色谱通过亲和色谱法从细胞培养上清液中纯化抗体。简言之,将无菌过滤的细胞培养上清液捕获在用pbs缓冲液(10mm na2hpo4、1mm kh2po4、137mm nacl和2.7mm kcl,ph 7.4)平衡的mabselect sure树脂上,用平衡缓冲液洗涤并用25mm柠檬酸盐(ph 3.0)洗脱。用1m tris(ph 9.0)中和后,通过尺寸排阻色谱法(superdex 200,ge healthcare)在20mm组氨酸、140mm nacl(ph 6.0)中将
聚集蛋白与单体抗体种类分离。将单体蛋白质部分合并,使用(例如)millipore amicon ultra(30kd mwco)离心浓缩机浓缩(若需要)并储存在-80℃下。使用样品等分试样,通过(例如)ce-sds、尺寸排阻色谱法、质谱法及内毒素测定进行后续分析表征。
[0671]
1.6抗hufap抗体的细胞结合
[0672]
具有人igg1 p329g lala fc的抗fap抗体与人fap的结合是通过流式细胞术使用人fap转染的hek细胞确定的。简言之,用细胞解离缓冲液收获靶细胞,用facs缓冲液(pbs+2%fcs+5mm edta+0.25%钠酸)洗涤,并接种到96-u底板中(1x105细胞/孔)。将未经标记的一级抗体加入到细胞中(最终浓度10μg/ml至0.64ng/ml;1:5稀释度)且在4℃下温育30min。洗涤后,使细胞与pe结合的affipure f(ab)2片段fc特异性山羊抗人igg(jackson immunoresearch)一起在黑暗中在4℃下温育30min。之后,将细胞洗涤,固定并使用bd facs lsr fortessa
tm
测量。
[0673]
如先前所见,所有抗fap抗体显示出与人fap的相似结合。所选结合物的ec
50
值示出于下表1中。
[0674]
表1:抗fap抗体与hufap表达细胞的细胞结合
[0675][0676]
1.7抗hufap抗体的细胞内化
[0677]
使用人fap转染的hek细胞作为靶标,确定fap结合物的内化。简言之,用细胞解离缓冲液收获靶细胞,用冷facs缓冲液(pbs+2%fcs+5mm edta+0.25%钠酸)洗涤,并以1.5x106细胞/ml重悬于冷facs缓冲液中。将细胞分配在15ml管中(每个管在2ml中含有3x106个细胞)。将2ml抗人fap抗体溶液加入到细胞中(终浓度20μg/ml),并在4℃下温育45分钟。之后,将细胞洗涤,重悬于冷facs缓冲液中,并将时间点为“0”的细胞立即涂布到96-u底板(1.5x105细胞/孔)中,并保持在4℃下,而将所有其他细胞离心,重悬于含有10%fcs和1%glutamax(1.5x106细胞/ml)的温rpmi1640培养基中,并在加湿培养箱(5%co2)转变至37℃。在每个指示的时间点之后,将100μl/管的细胞悬浮液转移至板上,立即用冷facs缓冲液冷却并保存在冰箱中,直到收集了所有时间点为止。在收集到所有时间点后,用冷的facs缓冲液洗涤细胞且使其与pe标记的二级抗体一起在4℃下温育30min。之后,洗涤细胞,固定并使用bd facs canto
tm
ii进行测量。
[0678]
由标记的二级抗体引起的信号随时间保持几乎恒定,这意味着随着时间的推移未观察到抗体的丢失,所有测试的抗hu fap抗体均未被内化。
[0679]
1.8抗hufap抗体的结合动力学
[0680]
为了评价人fap结合动力学,根据制造商的说明,将生物素化的人fap固定在s系列
biacore capture芯片(ge healthcare 28-9202-34)上,产生大约20个共振单位(ru)的表面密度。使用hbs-p+(10mm hepes,150mm nacl ph 7.4,0.05%表面活性剂p20)作为运行和稀释缓冲液。依次注射一系列稀释的抗hufap fab(3.7
–
300nm,1:3稀释),每次120s,以30μl/分钟的流速(单循环动力学)监测解离1800s。通过注射6m盐酸胍、0.25m naoh 120s使表面再生。通过减去空白注射并通过减去从没有捕获人fap的对照流通池获得的应答来校正大折射率偏差。使用biacore评价软件内的1:1 langmuir结合模型进行曲线拟合。亲和力数据示出于下表2中。
[0681]
表2:如通过biacore测量的抗fapfab对人fap的亲和力
[0682]
样品id克隆ka(1/ms)kd(1/s)kd 4b9_fab1.82e+067.80e-04430pmp1ad9427_fab2093.50e+061.77e-03510pmp1ad9436_fab2101.87e+06《e-06《10pmp1ad9437_fab2118.13e+054.61e-0560pmp1ad9438_fab2121.06e+06《e-06《10pmp1ad9440_fab2141.99e+06《e-06《10pm
[0683]
1.9如通过biacore确定的抗人fap克隆的竞争性结合
[0684]
使用基于biacore t200仪器的表面等离子体共振(spr)试验进行表位分仓。fap抗原被固定化的抗his抗体捕获。在第一步中,注射fap结合物直至饱和。随后注射第二fap结合物。该试验设计示意性示出于图3c中。加入第二抗体后结合信号的增加表明其与第一抗体不同的表位结合。没有另外的结合表明第一抗体和第二抗体识别相同的表位区。
[0685]
通过胺偶联(ge healthcare试剂盒br-1000-50)将浓度为20μg/ml的抗his抗体(ge healthcare试剂盒28-9950-56)固定在cm5传感器芯片(ge healthcare br-1005-30)的表面上。注射时间为600秒,以10μl/分钟的流速在两个流通池上产生12000个应答单位(ru),一个用作参考,并且一个用作活性流通池。运行缓冲液为hbs-n(ge healthcare br-1006-70)。为了测量,使用pbs-p+(ge healthcare 28-9950-84)作为运行缓冲液和稀释缓冲液。将流通池温度设为25℃,样品区室设为12℃。对于整个运行,将流速设为10μl/min。
[0686]
在活性流通池中以20μg/ml的浓度捕获his标记的fap抗原180秒。在两个流通池中以10μg/ml的浓度依次注射第一抗体和第二抗体(fap结合物),各自持续120秒。每个循环后,用10mm甘氨酸(ph 1.5)持续60秒使表面再生(ge healthcare br-1003-54)。
[0687]
结果示出于下表5中:
[0688]
表5:抗fap抗体与4b9的竞争性结合
[0689] 4b92092102112122144b9竞争性结合同时结合同时结合同时结合同时结合同时结合209同时结合竞争性结合同时结合同时结合同时结合同时结合210同时结合同时结合竞争性结合竞争性结合竞争性结合竞争性结合211同时结合同时结合竞争性结合竞争性结合竞争性结合竞争性结合212同时结合同时结合竞争性结合竞争性结合竞争性结合竞争性结合214同时结合同时结合竞争性结合竞争性结合竞争性结合竞争性结合
[0690]
因此,鉴定了三个表位仓。没有一种抗fap抗体与抗体4b9(表位仓1)竞争结合。抗
体210、211、212和214彼此竞争结合并因此形成一个基团(表位仓3),而抗体209与任何其他抗体(表位仓2)不竞争结合。
[0691]
1.9抗fap抗体的热稳定性评价
[0692]
在20mm组氨酸/组氨酸氯化物、140mm nacl、ph 6.0中,以1mg/ml的浓度制备样品,通过经由0.4μm滤板离心而转移到384孔光学板中,并用石蜡油覆盖。在dynapro读板仪(wyatt)上通过动态光散射重复测量流体动力学半径,同时将样品以0.05℃/分钟的速度从25℃加热到80℃。另选地,将样品转移到10μl微量比色皿阵列中,并用optim1000仪器(avacta inc.)记录了静态光散射数据和266nm激光激发后的荧光数据,同时将它们以0.1℃/分钟的速度从25℃加热到90℃。聚集开始温度(t
agg
)定义为流体动力学半径(dls)或散射光强度(optim1000)开始增加时的温度。解链温度定义为显示荧光强度相对于波长的曲线图中的拐点。所选抗fap抗体的聚集起始温度示出于表6中。
[0693]
表6:抗fap抗体的聚集起始温度
[0694] 4b9209210212214t
agg
(℃)6066616761
[0695]
选择抗fap克隆212用于人源化,因为它以与抗体4b9相当高的亲和力与人fap结合,并显示出有利于开发的特性。经由电脑模拟,对其序列的分析表明只有一个预测的降解热点(401位处的trp)。鼠克隆212的序列示出于表7中。
[0696]
表7:鼠抗fap克隆212的可变结构域的氨基酸序列
[0697][0698]
1.10抗fap克隆212的人源化
[0699]
1.10.1方法
[0700]
通过查询人v区和j区序列的blastp数据库来鉴定鼠输入序列(裁剪至可变部分)的合适的人受体框架。选择人受体框架的选择标准是序列同源性、相同或相似的cdr长度和人种系的估计频率,而且还有vh-vl结构域界面上某些氨基酸的保守性。在种系鉴定步骤之后,将鼠输入序列的cdr移植到人受体框架区上。这些初始cdr移植物和亲本抗体之间的每个氨基酸差异被评估对相应可变区的结构完整性的可能影响,并且在认为适当时引入对亲本序列的“回复突变”。结构评估基于亲代抗体和人源化变体两者的fv区同源性模型,该模型通过内部抗体结构同源性建模方案创建得到,其使用biovia discovery studio environment版本17r2实现。在一些人源化变体中,包括“正向突变”,即,将亲本结合物的给定cdr位置上发生的原始氨基酸改变为人受体种系的等效位置上发现的氨基酸的氨基酸交换。目的是增加人源化变体的总体人特征(在框架区之外),以进一步降低免疫原性风险。
[0701]
内部开发的经由电脑模拟的工具用于预测配对的vh和vl人源化变体的vh-vl结构域方向(参见wo 2016/062734)。将结果与亲本结合物的预测vh-vl结构域取向进行比较,以选择在几何结构上与原始抗体接近的构架组合。基本原理是检测vh-vl界面区中可能的氨
基酸交换,这些交换可能导致两个结构域的配对发生破坏性变化,进而对结合特性产生不利作用。
[0702]
1.10.2受体框架的选择及其适应
[0703]
选择了以下受体框架:
[0704]
表8:受体框架
[0705][0706]
后cdr3框架区改编自人ighj种系ighj6*01/02(yyyyygmdvwgqgttvtvss,seq id no:84)和人igkj种系igkj4*01/02(ltfgggtkveik,seq id no:85)。与受体框架相关的部分以粗体显示。
[0707]
基于结构上的考虑,在位置h43(q》k)、h44(g》s)、h48(m》i)、h71(r》i)、h73(t》k)、h93(a》t)[vh1]、h49(s》g)、h71(r》i)、h73(n》k)、h78(l》a)、h93(a》t)、h94(k》r)[vh2]、l36(y》f)、l43(a》p)、l87(y》f)[vl1]和l36(y》f)、l42(k》q)、l43(a》p)、l85(t》m)、l87(y》f)[vl2]处引入了从人受体框架到亲本结合物中氨基酸的回复突变。
[0708]
此外,位置h60(n》a)、h64(k》q)[vh1]、h60(n》a)、h61(q》d)、h62(k》s)、h63(f》v)[vh2]、l33(i》l)、l34(n》a)[vl1]和l27b(v》i)、l33(i》l)[vl2]被认定为正向突变的有希望的候选者。所有位置均在kabat eu编号方案中给出。
[0709]
表9:变体列表
[0710][0711][0712]
备注:回复突变冠以前缀b,正向突变冠以前缀f,例如bm48i是指在48位(kabat)上从蛋氨酸到异亮氨酸的回复突变(人种系氨基酸到亲本抗体氨基酸)。
[0713]
所得基于受体框架的人源化fap抗体的vh和vl结构域可参见下表10。
[0714]
表10:人源化fap抗体的vh和vl结构域的氨基酸序列
[0715][0716][0717]
1.10.3新人源化抗fapfab
[0718]
基于vh和vl的新人源化变体,表达了新的抗fapfab。
[0719]
表11:表达为fab的vh/vl组合的命名
[0720] vl1g1avl1g2avl1g3avl2g1avl2g2avl2g3avh1g1ap1ae1689
ꢀꢀꢀꢀꢀ
vh1g2ap1ae1690p1ae1693
ꢀꢀꢀꢀ
vh1g3a
ꢀꢀꢀꢀꢀꢀ
vh2g1a
ꢀꢀꢀꢀꢀꢀ
vh2g2a
ꢀꢀꢀꢀ
p1ae1702 vh2g3a
ꢀꢀꢀꢀꢀꢀ
[0721]
与抗fap抗体4b9相比,分析了基于克隆212的新人源化抗fap变体的亲和力。此外,计算人源化变体的人化程度,并且测量其聚集起始温度。
[0722]
表12:如通过biacore测量的克隆212人源化变体的亲和力
[0723][0724]
抗体p1ae1689在下文中称为fap抗体1g1a。
[0725]
1.11 fcrn/肝素结合和经由电脑模拟的电荷分布
[0726]
在经由电脑模拟模型中,计算抗体4b9和1g1a在pbs(ph 7.4)中的电荷分布。根据该模型,4b9具有大阳性斑块,这有时与肝素结合的增加有关。另一方面,1g1a显示出大负电荷斑块,这可能表明肝素的相互作用弱。
[0727]
通过使用fcrn亲和柱和ph梯度以及肝素亲和柱和ph梯度对两种抗体进行色谱分析,证实了这些预测。wo 2015/140126公开了一种用于基于fcrn亲和色谱柱上确定的保留时间来预测抗体的体内半衰期的方法,而肝素结合与细胞表面结构的非特异性相互作用有关。
[0728]
实例2
[0729]
靶向ox40和成纤维细胞活化蛋白(fap)的双特异性抗原结合分子的生成和产生
[0730]
2.1靶向ox40和成纤维细胞活化蛋白(fap)的双特异性抗原结合分子的生成
[0731]
将编码抗ox40抗体(如wo 2017/055398 a2中所述的克隆49b4、8h9和clc563,或如wo 2015/153513 a1中所述的moxr0916)以及抗fap抗体1g1a的可变重链和轻链结构域的cdna与人igg1的相应恒定重链或轻链框内克隆至适宜表达质粒中。通过由mpsv核心启动子和cmv增强子元件组成的嵌合mpsv启动子来驱动重链和轻链的表达。表达盒也在cdna的3’端含有合成聚a信号。另外,质粒载体含有复制起点(ebv orip)以用于质粒的游离维持。
[0732]
以2+1、3+1和4+1形式制备双特异性ox40-fap抗体,其由两个、三个或四个ox40结合部分与一个位于fc的c末端的fap结合臂组合组成(图1a至图1c)。这些双特异性ox40-fap抗体包括如实例1中所述的抗fap克隆212(1g1a)。为生成2+1、3+1和4+1抗原结合分子,使用杵臼结构技术来实现异二聚化。将s354c/t366w突变引入第一重链hc1(fc杵重链)中,并且将y349c/t366s/l368a/y407v突变引入第二重链hc2(fc臼重链)中。在2+1、3+1和4+1抗原结合分子中,如wo 2010/145792 al中所述的crossmab技术确保正确轻链配对。与双特异性形式无关,在所有情况中,根据wo 2012/130831 a1中所述的方法,使用效应子沉默fc结构域(p329g;l234a、l235a)来消除与fcγ受体的结合。双特异性分子的序列示于下表13中。
[0733]
所有基因均在由mpsv核心启动子与cmv启动子增强子片段组合组成的嵌合mpsv启动子的控制下瞬时表达。表达载体也含有用于在含有ebna(埃-巴二氏病毒(epstein barr virus)核抗原)的宿主细胞中游离型复制的orip区。
[0734]
表13:双特异性抗原结合分子的氨基酸序列
[0735]
[0736]
[0737]
[0738]
[0739]
[0740]
[0741]
[0742]
[0743]
[0744]
[0745]
[0746]
[0747]
[0748]
[0749][0750]
为进行比较,制备以下分子:
[0751]
分子p1ad4524或ox40(49b4)
×
fap(4b9)(4+1)双特异性分子包含四个ox40(49b4)结合fab片段与一个fap(4b9)结合部分的组合作为vh和vl结构域,其中所述vh结构域融合在fc杵链的c末端且该vl结构域融合在fc臼链的c末端(对于ox40为四价且对于fap为单价)。该分子包含有一条包含seq id no:113的氨基酸序列的重链、一条包含seq id no:114的氨基酸序列的重链和四条各自包含seq id no:115的氨基酸序列的轻链。分子p1ad3690是包含四个ox40(49b4)结合fab片段的非靶向ox40激动剂。此分子包含有两条包含seq id no:116的氨基酸序列的重链和四条各自包含seq id no:115的氨基酸序列的轻链。这些分子的生成和产生描述于wo 2017/060144 a1中。
[0752]
2.2靶向fap和ox40的双特异性抗原结合分子的产生
[0753]
通过使用聚乙烯亚胺(pei)用哺乳动物表达载体共转染悬浮生长的hek293-ebna细胞或使用evifect(evitria ag,switzerland)用哺乳动物表达载体共转染悬浮生长的
cho k1细胞来产生这些分子。用相应的表达载体转染细胞。
[0754]
通过用编码4种不同肽链的表达载体瞬时转染悬浮生长的hek细胞来表达抗体构建体。根据细胞供货商的说明书,使用maxiprep(macherey-nagel)抗体载体制剂、expi293f
tm
表达培养基(gibco
tm
)、expifectamine
tm
293试剂(gibco
tm
)以及在opti-1
×
减血清培养基中2-3百万个活细胞/ml的初始细胞密度实施对expi293f
tm
细胞(gibco
tm
)的转染。在转染后当天(第1天,转染后18-22小时),将expifectamine
tm
293转染增强剂1和expifectamine
tm
293转染增强剂2加入到转染培养物中。使转染培养物在37℃下在8%co2的潮湿气氛中振荡温育。在摇瓶或搅拌的发酵罐中培养7天后,通过以3000-5000g离心20-30分钟收集细胞培养上清液,并且通过0.22μm过滤器过滤。
[0755]
对于cho k1细胞中的产生,使cho k1细胞在evigrow培养基(一种化学性界定的无动物组分、无血清培养基)(evitria ag,switzerland)中生长,并且用evifect(evitria ag,switzerland)转染。转染后,使细胞在37℃和5%co2下于evimake(一种化学性界定的无动物组分、无血清培养基)(evitria ag,switzerland)中保持7天。7天后,收集培养上清液,以供通过在rotanta 460rc中以最大速度离心45min进行纯化。将溶液无菌过滤(0.22μm过滤器)且保持在4℃下。通过蛋白质a-hplc或蛋白质a-生物层干涉测量法(bli)来测定培养基中分子的浓度。
[0756]
使用mabselectsure-sepharose
tm
(ge healthcare,sweden)色谱通过亲和色谱法从细胞培养上清液中纯化抗体。简言之,将无菌过滤的细胞培养上清液捕获在用pbs缓冲液(10mm na2hpo4、1mm kh2po4、137mm nacl和2.7mm kcl,ph 7.4)平衡的mabselect sure树脂上,用平衡缓冲液洗涤并用100mm乙酸钠(ph 3.0)洗脱。在用1m tris ph 9.0中和后,通过离子交换色谱法(poros xs),利用平衡缓冲液(20mm his,ph 5.5,1,47ms/cm)以及洗脱缓冲液(20mm his,500mm nacl,ph 5.5,49.1ms/cm)(梯度:至100%洗脱缓冲液,60cv)将聚集蛋白质与单体抗体种类分离。在一些情况中,随后在20mm组氨酸、140mm nacl(ph 6.0)中实施尺寸排阻色谱法(superdex 200,ge healthcare)。将单体蛋白质部分合并,并且使用(例如)millipore amicon ultra(30kd mwco)离心浓缩机浓缩(若需要)。将纯化的蛋白质储存在-80℃下。使用nanodrop分光光度计实施蛋白质定量,并且通过变性和还原条件下的ce-sds以及分析型sec进行分析。使用样品等分试样,通过(例如)ce-sds、尺寸排阻色谱法、质谱法及内毒素测定进行后续分析表征。
[0757]
通过ce-sds分析,在存在及不存在还原剂的情况下分析最终纯化步骤后的双特异性抗原结合分子的纯度和分子量。根据制造商的说明书使用caliper labchip gxii系统(caliper lifescience)。
[0758]
使用tskgel g3000 sw xl分析型粒径筛析管柱(tosoh)在25℃下在25mm磷酸钾、125mm氯化钠、200mm l-精氨酸单盐酸盐、0.02%(w/v)nan3(ph 6.7)运行缓冲液中来分析双特异性抗原结合分子的聚集体含量。
[0759]
表14:双特异性ox40抗原结合分子的产率和质量
[0760][0761][0762]
2.3靶向ox40和成纤维细胞活化蛋白(fap)的其他双特异性抗原结合分子的生成-电荷区片变体
[0763]
类似于实例2.1,已制备4+1双特异性形式的不同变体,其由四个ox40结合部分与一个位于fc结构域c末端的fap结合交叉fab组合组成。在所有这些构建体中,抗ox40抗体的可变重链和轻链结构域对应于如wo 2017/055398 a2中所述的ox40克隆49b4。实例1中描述fap抗体1g1a的产生和制备。为生成4+1抗原结合分子,使用杵臼结构技术来实现异二聚化。将s354c/t366w突变引入第一重链hc1(fc杵重链)中,并且将y349c/t366s/l368a/y407v突变引入第二重链hc2(fc臼重链)中。此外,如wo 2010/145792 a1中所述的crossmab技术确
保正确轻链配对。与双特异性形式无关,在所有情况中,已根据wo 2012/130831 al中所述的方法,使用效应子沉默fc(p329g;l234a、l235a)来消除与fcγ受体的结合。双特异性抗原结合分子的氨基酸序列示于表15中。
[0764]
所有基因均在由mpsv核心启动子与cmv启动子增强子片段组合组成的嵌合mpsv启动子的控制下瞬时表达。表达载体也含有用于在含有ebna(埃-巴二氏病毒核抗原)的宿主细胞中游离型复制的orip区。
[0765]
表15:双特异性抗原结合分子的氨基酸序列
[0766]
[0767]
[0768]
[0769]
[0770]
[0771][0772]
2.4靶向fap和ox40的双特异性抗原结合分子的产生(电荷区片变体)
[0773]
通过与编码4条不同肽链的表达载体悬浮生长的hek细胞的瞬时转染来表达抗体。根据细胞供货商的说明书,使用maxiprep(qiagen)抗体载体制剂、freestyle
tm f17培养基(invitrogen,usa)、转染试剂(polyscience europe gmbh)以及在无血清freestyle 293表达培养基(invitrogen)中1-2百万个活细胞/ml的初始细胞密度来实施对hek293-f细胞(invitrogen)的转染。在摇瓶或搅拌的发酵罐中培养7天后,通过以14000xg离心30分钟收集细胞培养上清液,并且通过0.22mm过滤器过滤。
[0774]
使用mabselectsure-sepharose
tm
(ge healthcare,sweden)色谱通过亲和色谱法从细胞培养上清液中纯化抗体。简言之,将无菌过滤的细胞培养上清液捕获在用pbs缓冲液(10mm na2hpo4、1mm kh2po4、137mm nacl和2.7mm kcl,ph 7.4)平衡的mabselectsure树脂上,用平衡缓冲液洗涤并用ph 3.0的25mm柠檬酸盐洗脱。用1m tris缓冲液(ph 9.0)中和后,通过尺寸排阻色谱法(superdex 200,ge healthcare)在20mm组氨酸、140mm nacl(ph 6.0)中将聚集蛋白与单体抗体种类分离。将单体蛋白质部分合并,使用(例如)millipore amicon ultra(30kd mwco)离心浓缩机浓缩(若需要)并储存在-80℃下。使用样品等分试样,通过(例如)ce-sds、尺寸排阻色谱法、质谱法及内毒素测定进行后续分析表征。
[0775]
表16:双特异性ox40抗原结合分子的产率和质量
[0776]
[0777][0778]
实例3
[0779]
靶向ox40和fap的双特异性抗原结合分子的表征
[0780]
3.1 fap靶向的抗ox40双特异性抗原结合分子与原初人pbmc和活化人pbmc的结合
[0781]
通过聚蔗糖密度梯度离心分离人pbmc。自苏黎世献血中心(z
ü
rich blood donation center)获得血沉棕黄层。为分离新鲜外周血单核细胞(pbmc),用相同体积的dpbs(gibco by life technologies,目录号14190326)稀释血沉棕黄层。向50ml聚丙烯离心管(tpp,目录号91050)中供应15ml histopaque 1077(sigma life science,目录号10771,聚蔗糖和泛影酸钠,调整至1.077g/ml的密度),并且使血沉棕黄层溶液分层在histopaque 1077上方。使管在室温和低加速度下以400
×
g无间断地离心30min。之后,自界面收集pbmc,用dpbs洗涤三次且冷冻用于后续使用。使pbmc解冻,洗涤且重悬于aim-v培养基(thermofischer,目录号12055091)中。pbmc在未受刺激的情况下使用(在静息人pbmc上结合),或刺激其以在t细胞的细胞表面上接受强的人类ox40表达(在活化人pbmc上结合)。因此,在经[2g/ml]抗人cd3(克隆okt3)以及[2g/ml]抗人cd28(克隆cd28.2)预包覆2小时的6孔组织培养板中,使解冻的pbmc于aim-v培养基中在37℃/5%co2下培养三天。
[0782]
为进行检测,将ox40原初人pbmc和活化人pbmc混合。为能够区分原初人pbmc与活化人pbmc,在结合测定之前使用efluor670细胞增殖染料(ebioscience,目录号65-0840-85)标记原初细胞。接着将1
×
105个efluor670标记的原初人pbmc与未经标记的活化人pbmc的1:1混合物加入到圆底96孔板(tpp,目录号92097)的每一孔中,并且实施结合测定。
[0783]
首先将细胞用dpbs中的zombie aqua可固定活力染料(biolegend,目录号423102)染色10min,之后在黑暗中在4℃下在50μl/孔含有滴定的抗ox40双特异性抗体构建体的facs缓冲液中温育90分钟。在用过量的facs缓冲液洗涤三次后,在黑暗中在4℃下使细胞在25μl/孔含有荧光标记的抗人cd4(克隆okt-4,小鼠igg2b,biolegend,目录号317434)、抗人cd8(克隆rpa-t8,小鼠igg1k,biolegend,目录号301042)以及异硫氰酸荧光黄(fitc)结合的affinipure抗人igg fcγ片段特异性山羊igg f(ab`)2片段(jackson immunoresearch,目录号109-096-098)的混合物的facs缓冲液中染色30分钟。最后使样品重悬于20μl/孔facs缓冲液中,并且在同一天使用ique细胞筛选器和forecyt软件(sartorius)获取。
[0784]
如图2a和2c中可见,四价形式(4+1)的双特异性ox40(49b4)
×
fap抗原结合分子较三价(3+1)或二价(2+1)形式更佳地结合至ox40(49b4克隆的亲合力)。随着ox40在t细胞上的天然流行,双特异性形式与活化cd4 t细胞的结合强于cd8 t细胞,并且不与靶标阴性细
胞结合(静息cd4和cd8 t细胞,图2b和2d)。如图3a和3c中所示,包含克隆8h9的双特异性抗原结合分子以亚纳摩尔亲和力结合至ox40阳性细胞且强度与三价和二价抗体相当。随着ox40在t细胞上的天然流行,构建体与活化cd4 t细胞的结合强于cd8 t细胞,并且不与靶标阴性细胞结合(静息cd4和cd8 t细胞,图3b和3d)。在图4a和4c中,已显示,包含克隆mox0916的双特异性抗体以亚纳摩尔亲和力结合至ox40阳性细胞,其强度与三价或二价抗体相当。随着ox40在t细胞上的天然流行,构建体与活化cd4 t细胞的结合强于cd8 t细胞,并且不与靶标阴性细胞结合(静息cd4和cd8 t细胞,参见图4b和4d)。如图5a和5c中所示,包含克隆clc-563的双特异性抗体以纳摩尔亲和力结合至ox40阳性细胞,其强度与三价和二价抗体相当。随着ox40在t细胞上的天然流行,构建体与活化cd4 t细胞的结合强于cd8 t细胞,并且不与靶标阴性细胞结合(静息cd4和cd8 t细胞,参见图5b和5d)。
[0785]
在图6a和6c中,已显示,与亲代抗体49b4相比,包含基于49b4氨基酸变体的克隆的所有双特异性抗原结合分子均显示与ox40阳性细胞的结合略有改进。随着ox40在t细胞上的天然流行,构建体与活化cd4 t细胞的结合强于cd8 t细胞,并且不与靶标阴性细胞结合(静息cd4和cd8 t细胞,参见图6b和6d)。
[0786]
在另一实验中,测试靶向ox40和fap的双特异性抗原结合分子与不同的c末端变体的结合。使用解冻、洗涤且重悬于含有(10%(v/v)胎牛血清(fcs,sigma,目录号f4135)的rpmi培养基(gibco,目录号72400-021)中的pbmc。刺激pbmc以在t细胞的细胞表面上接受强的人ox40表达(在活化人pbmc上结合)。因此,在经[2g/ml]抗人cd3(克隆okt3)以及[2g/ml]抗人cd28(克隆cd28.2)预包覆2小时的6孔组织培养板中,使解冻的pbmc于含有10%fcs的rpmi培养基中在37℃/5%co2下培养三天。为进行检测,将2
×
105个活化人pbmc加入到圆底96孔板(tpp,目录号92097)的每一孔中,并且实施结合测定。首先将细胞用dpbs中的live/dead
tm
可固定aqua死细胞染色剂(molecular probes,目录号l34957)染色20min,在一个洗涤步骤(200μl 4℃facs缓冲液)后,在50μl/孔含有滴定的抗ox40双特异性抗原结合分子的facs缓冲液中在黑暗中在4℃下温育90分钟。在用过量的facs缓冲液洗涤一次后,在黑暗中在4℃下使细胞在50μl/孔含有荧光标记的抗人cd4(克隆a161a1,biolegend,目录号357406)、抗人cd8(克隆sk1,biolegend,目录号344742)以及藻红素(pe)结合的affinipure抗人igg fcγ片段特异性山羊igg f(ab`)2片段(jackson immunoresearch,目录号109-116-098)的混合物的facs缓冲液中染色30分钟。最后使样品重悬于100μl/孔facs缓冲液中,并且在同一天使用bd fortessa运行的facs diva软件获取。
[0787]
如图34a至34f中可见,所测试的所有双特异性fap-ox40双特异性抗体均结合至活化cd4 t细胞。随着ox40在t细胞上的天然流行,双特异性形式与活化cd4 t细胞的结合强于cd8 t细胞(图34a、34c、34e相对于34b、34d和34f)。对于所测试的所有化合物,d和s变体均显示出相当的结合性质(比较每一图中的空心对实心符号)。
[0788]
3.2与表达人fap的肿瘤细胞的结合
[0789]
使用表达人成纤维细胞活化蛋白(hufap)的nih/3t3-hufap克隆19细胞来测试与细胞表面fap的结合。通过用表达载体petr4921转染小鼠胚胎成纤维细胞nih/3t3细胞系(atcc crl-1658)以在1.5μg/ml嘌呤霉素选择下表达hufap来产生此细胞系。使用表达nuclight red荧光蛋白的a549 nuclight
tm
red细胞(essen bioscience,目录号4491)测试与ox40阴性fap阴性肿瘤细胞结合的缺乏,该nuclight red荧光蛋白受限于细胞核,以容许
与未经标记的人fap阳性nih/3t3-hufap克隆19细胞分开。遵循标准essen方案,在存在8μg/ml聚凝胺的情况下,用essen cellplayer nuclight red慢病毒(essen bioscience,目录号4476;ef1α,嘌呤霉素)以3(tu/细胞)的moi转导亲代a549(atcc ccl-185)。此得到≥70%的转导效率。或者,使用人子宫颈腺癌细胞系hela细胞系(atcc,ccl2)测试与ox40阴性fap阴性肿瘤细胞结合的缺乏。使用无酶细胞解离缓冲液进行剥离,以保存胰蛋白酶敏感性表面蛋白质。
[0790]
将5
×
104个未经标记的nih/3t3-hufap克隆19细胞以及a549 nuclight
tm
red细胞在facs缓冲液中的混合物加入到圆底96孔板(tpp,目录号92097)的每一孔中,并且实施结合测定。首先将细胞用dpbs中的zombie aqua可固定活力染料(biolegend,目录号423102)染色10min,之后在黑暗中在4℃下在50μl/孔含有滴定的抗ox40双特异性抗体构建体的facs缓冲液中温育75分钟。之后,将细胞用200μl 4℃facs缓冲液洗涤三次且通过短暂涡旋重悬。将细胞用25μl/孔含有异硫氰酸荧光黄(fitc)结合的affinipure抗人igg fcγ片段特异性山羊igg f(ab`)2片段(jackson immunoresearch,目录号109-096-098)的4℃冷的二级抗体溶液进一步染色,并且在黑暗中在4℃下温育30分钟。最后使样品重悬于20μl/孔facs缓冲液中,并且在同一天使用ique细胞筛选器和forecyt软件(sartorius)获取。
[0791]
如图2e、3e、4e、5e和6e中可见,共有fap(1g1a)抗原结合结构域的所有双特异性抗原结合分子与人fap阳性成纤维细胞(nih/3t3-hufap-克隆19)的结合均相当。仅在图3e中显示,当克隆8h9并入在双特异性抗原结合分子中时,尽管共有相同的fap(1g1a)抗原结合结构域,与人fap阳性成纤维细胞(nih/3t3-hufap-克隆19)的结合略有增强。未观察到与靶标阴性细胞的结合(a549-nlr细胞,图2f、3f、4f、5f以及6f)。
[0792]
在另一实验中,将2
×
105个nih/3t3-hufap克隆19细胞以及hela细胞在facs缓冲液中的混合物加入到圆底96孔板(tpp,目录号92097)的每一孔中,并且实施结合测定。首先将细胞用dpbs中的live/dead
tm
可固定aqua死细胞染色剂(molecular probes,目录号l34957)染色20min,在一个洗涤步骤(200μl 4℃facs缓冲液)后,在50μl/孔含有滴定的抗ox40双特异性抗体构建体的facs缓冲液中在黑暗中在4℃下温育75分钟。之后,将细胞在4℃下用200μl facs缓冲液洗涤一次且通过短暂涡旋重悬。将细胞用50μl/孔含有藻红素(pe)结合的affinipure抗人igg fcγ片段特异性山羊igg f(ab`)2片段(jackson immunoresearch,目录号109-116-098)的4℃冷的二级抗体溶液进一步染色,并且在黑暗中在4℃下温育30分钟。最后使样品重悬于100μl/孔facs缓冲液中,并且在同一天使用bd fortessa运行的facs diva软件获取。
[0793]
所有共有fap(1g1a)抗原结合结构域但包含c末端s或d变体的双特异性抗原结合分子与人fap阳性成纤维细胞(nih/3t3-hufap-克隆19)的结合均相当,这意味着变体对与fap的结合无影响(参见下表17中的数据)。当靶向阴性细胞(hela细胞)时,未观察到结合。
[0794]
3.3对双特异性抗原结合分子的细胞结合性质的汇总
[0795]
为评价fap靶向的ox40抗体的结合性质,使人fap阴性肿瘤细胞(a549-nlr或hela)、fap阳性成纤维细胞(nih/3t3-hufap-克隆19)、ox40阳性活化pbmc(活化cd4和cd8 t细胞)以及ox40阴性静息pbmc(静息cd4和cd8 t细胞)与测试抗体的指示连续稀释液一起温育,接着通过针对人fcγ的荧光标记的2级抗体进行检测。
[0796]
所有fap靶向的ox40抗原结合分子均有效地结合至表达人fap的靶细胞且不与靶
标阴性细胞结合。这有望在患者中转化为直接肿瘤靶向以及分子富集。随着ox40在t细胞上的天然流行,所有构建体与活化cd4 t细胞的结合均强于cd8 t细胞。包含克隆49b4的双特异性抗原结合分子以四价形式(4+1)较以三价(3+1)或二价(2+1)形式更佳地结合至ox40(克隆的亲合力;参见图2a和2c)。与四价形式的亲代抗体相比,所有基于49b4氨基酸变体的双特异性抗原结合分子均显示与ox40阳性细胞的结合略有改进(参见图6a和6c)。克隆8h9(图3a和3c)以及mox0916(图4a和4c)以亚纳摩尔亲和力结合,而克隆clc-563(图5a和5c)以纳摩尔亲和力结合至ox40阳性细胞,其强度与三价和二价形式相当。对于所测试的所有c末端变体,d和s变体均显示相当的结合性质。所有双特异性抗原结合分子的fap结合均在相当的纳摩尔范围内。
[0797]
与活化的人cd4 t细胞以及fap阳性肿瘤细胞结合的ec
50
值汇总于表17中。
[0798]
表17:fap靶向的ox40抗原结合分子与细胞表面人fap和人ox40结合的ec
50
值(在cd4
+
t细胞上)
[0799][0800][0801]
3.4靶向ox40和fap的双特异性抗原结合分子的生物物理学和生物化学表征
[0802]
3.4.1热稳定性的测定
[0803]
通过动态光散射(dls)且通过使用optim 2仪器(avacta analytical,uk)施加温度斜坡监测温度依赖性内在蛋白荧光来监测实例2中所制备的fap靶向的ox40抗原结合分子的热稳定性。将10μg蛋白质浓度为1mg/ml的经过滤的蛋白质样品一式两份施加至optim 2仪器。使温度以0.1℃/min自25℃斜升至85℃,收集350nm/330nm下的荧光强度比率及266nm下的散射强度。结果如表18所示。实例2中所产生的所有测试fap-ox40分子的聚集温度(t
agg
)均优于如wo 2017/060144 a1中所述的先前所述ox40(49b4)
×
fap(4b9)(4+1)双特异性分子(分子p1ad4524)。
[0804]
3.4.2疏水相互作用色谱法(hic)
[0805]
通过将20μg样品注入到用25mm磷酸钠、1.5m硫酸铵,ph 7.0平衡的hic-醚-5pw(tosoh)柱上来确定表观疏水性。在60分钟内,使用0至100%的缓冲液b(25mm磷酸钠,ph 7.0)的线性梯度进行洗脱。将保留时间与具有已知疏水性的蛋白质标准品进行比较。对于含有克隆8h9以及克隆49b4的带电区片变体的fap
×
ox40双特异性抗原结合分子,获得高hic保留时间。已显示增加的非特异性相互作用与高hic保留时间相关。
[0806]
3.4.3 fcrn亲和色谱法
[0807]
如所述,使fcrn表达、纯化和生物素化(schlothauer等人,mabs 2013,5(4),576-86)。为了进行偶联,将制备的受体加入到链霉亲和素-琼脂糖(ge healthcare)中。将所得的fcrn-琼脂糖基质填充在柱壳体中。用20mm的2-(n-吗啉)-乙磺酸(mes)和140mm nacl,ph 5.5(洗脱液a)以0.5ml/min的流速平衡该柱。将30μg抗体样品用洗脱液a以1:1的体积比稀释,然后施加到fcrn柱上。将该柱用5倍柱体积的洗脱液a 洗涤,然后用35倍柱体积的从20%至100%的20mm tris/hcl和140mm nacl,ph 8.8的线性梯度(洗脱液b)进行洗脱。用25℃的柱温箱执行分析。通过连续测量280nm下的吸光度来监测洗脱图谱。将保留时间与具有已知亲和力的蛋白质标准品进行比较。
[0808]
3.4.4肝素亲和色谱法
[0809]
通过将30-50μg样品注射至经50mm tris(ph 7.4)平衡的tskgel肝素-5pw(tosoh)管柱上来测定肝素亲和力。在37分钟内,使用0至100%的缓冲液b(50mm tris,1m nacl,ph 7.4mm)的线性梯度进行洗脱。将保留时间与具有已知亲和力的蛋白质标准品进行比较。
[0810]
表18:所测试的fap
×
ox40双特异性抗体的生物物理学和生物化学性质
[0811][0812]
3.5在应激后通过表面等离子体共振(spr)表征结合效能
[0813]
使用biacore t200仪器(ge healthcare),通过表面等离子体共振定量由在37℃、ph 7.4下以及在40℃、ph 6下温育分子14天所引起的结合效能的降低。使用在-80℃和ph 6下储存的样品作为参照。参照样品以及在40℃下受应激的样品是在20mm组氨酸缓冲液、140mm nacl(ph 6.0)中,并且在37℃下受应激的样品是在pbs缓冲液(ph 7.4)中,所有样品的浓度均为1.0mg/ml。在应激期(14天)后,将pbs缓冲液中的样品透析回至20mm组氨酸缓冲液、140mm nacl(ph 6.0)中以供进一步分析。
[0814]
所有spr实验均在25℃下利用hbs-p+缓冲液(10mm hepes、150mm nacl ph 7.4、0.05%表面活性剂p20)作为运行及稀释缓冲液来实施。将生物素化的人ox40和fap以及生物素化的抗hu igg(capture select,thermo scientific,编号7103262100)固定在s系列传感器芯片sa (ge healthcare,编号29104992)上,产生至少1000个共振单位(ru)的表面密度。以5μl/min的流速注射浓度为2μg/ml的fap-ox40双特异性抗体达30s,并且监测解离
120s。通过注射10mm甘氨酸缓冲液(ph 1.5)达60s使表面再生。通过减去空白注射且通过减去自空白对照流通池获得的反应来校正本体折射率差异。为了评价,在进样结束后5秒采取结合应答。
[0815]
为使结合信号归一化,将ox40和fap结合除以抗hu igg反应(在经固定的抗hu igg抗体上捕获fap
×
ox40双特异性抗体时获得的信号(ru))。通过将每个温度加压样品与相应的加压力样品进行比较来计算相对结合活性。如表19中所示,与如wo 2017/060144 a1中所述的先前所述的fap-ox40双特异性抗体相比,实例2中所制备的所有fap
×
ox40双特异性抗体在应激时均显示与ox40和fap的结合改进。
[0816]
表19:在ph 6/40℃或ph 7.4/37℃下温育2周后,fap-ox40双特异性抗体对人ox40和fap的结合活性
[0817][0818][0819]
实例4
[0820]
fap靶向的抗人ox40抗原结合分子的功能性质
[0821]
4.1表达人ox40和报道基因nfkb-荧光素酶的hela细胞
[0822]
ox40与其配体的激动性结合经由活化核因子κb(nfb)而诱导下游信号传导(a.d.weinberg等人,j.leukoc.biol.2004,75(6),962-972)。生成重组报道细胞系hela_hox40_nfkb_luc1,以在其表面上表达人ox40。另外,其含有报道质粒,该质粒含有处于nf b敏感性增强子区段控制下的荧光素酶基因。ox40触发诱导nf b的剂量依赖性活化,其易位至细胞核,在此处其结合在报道质粒的nf b敏感性增强子上,以增加荧光素酶蛋白的表达。荧光素酶催化荧光素氧化,从而产生发光的氧化荧光素。此可通过亮度计来定量。
[0823]
因此,对各种fap靶向的ox40抗原结合分子在hela_hox40_nfkb_luc1报道细胞中
诱导nf b活化的能力进行分析以作为生物活性的量度。
[0824]
我们测试呈二价、三价和四价fap靶向交叉fab形式的所选fap靶向的ox40抗原结合分子单独以及在通过二级抗体或fap
+
成纤维细胞细胞是将构建体超交联的情况下的nf b活化能力。使用表达人成纤维细胞活化蛋白(hufap)的nih/3t3-hufap克隆19来测试细胞表面fap对fap结合抗体的交联。通过用表达载体petr4921转染小鼠胚胎成纤维细胞nih/3t3细胞系(atcc crl-1658)以在1.5μg/ml嘌呤霉素选择下表达hufap来产生此细胞系。
[0825]
使贴壁hela_hox40_nfkb_luc1细胞以0.2
×
105个细胞/孔的细胞密度培养过夜,并且利用含有滴定的抗ox40抗原结合分子的测定培养基刺激6小时。为测试由二级抗体所产生的超交联的效应,以1:2比率(一级抗体对二级抗体)添加25l/孔含有二级抗体抗人igg fcγ片段特异性山羊igg f(ab`)2片段(jackson immunoresearch,109-006-098)的培养基。为测试由细胞表面fap结合所产生的超交联的效应,使25l/孔含有fap
+
肿瘤细胞(nih/3t3-hufap克隆19)的培养基以3:1比率共培养(每孔中fap
+
肿瘤细胞为报道细胞的三倍)。
[0826]
温育后,吸出测定上清液且将板用dpbs洗涤两次。根据制造商说明书,使用荧光素酶1000测定系统及报道基因溶解缓冲液(均来自promega,目录号e4550及目录号e3971)对光发射进行定量。简言之,通过每孔添加30l1
×
溶解缓冲液使细胞在干冰上溶解30分钟。使细胞在37℃下解冻20分钟,之后向每孔中添加100l所提供的荧光素酶测定试剂。立即利用spark10m tecan微板读数仪使用500ms积分时间对光发射进行定量,而不用任何滤波器收集所有波长。通过hela_hox40_nfkb_luc1细胞的基础发光校正所发射的相对光单位(url),并且使用prism7(graphpad software,usa)针对一级抗体浓度对数进行作图。使用内置s形剂量反应拟合曲线。
[0827]
图7a至7c中显示包含ox40克隆49b4的呈4+1、3+1和2+1形式的双特异性抗原结合分子的nf b活化,这些双特异性抗原结合分子与表达人fap的nih/3t3成纤维细胞交联、与2:1比率的二级抗体交联或没有进一步交联。图8a至8c显示包含ox40克隆8h9的呈3+1和2+1形式的双特异性抗原结合分子的nf b活化。图9a至9c显示包含ox40克隆moxr0916的呈3+1和2+1形式的双特异性抗原结合分子的nf b活化,并且图10a至10c中显示包含ox40克隆clc563的呈3+1和2+1形式的双特异性抗原结合分子的nf b活化。图11a至11c展示包含ox40克隆49b4的氨基酸变体的呈4+1形式的双特异性抗原结合分子的nf b活化。
[0828]
因此,我们测试呈二价、三价和四价fap靶向交叉fab形式的所选双特异性ox40抗原结合分子单独以及在通过二级抗体或fap
+
成纤维细胞细胞是将分子超交联的情况下的nfκb活化能力。使用表达人成纤维细胞活化蛋白(hufap)的nih/3t3-hufap克隆19来测试细胞表面fap对fap结合抗体的交联。所有ox40抗原结合分子均诱导剂量依赖性nkκb活化。由于在不存在构建体的进一步外部交联的情况下已组装三聚体核心ox40受体信号传导单元,因此以四价和三价使用ox40抗体诱导一定的nfκb活化。具有二价形式(2+1)的ox40抗原结合分子相应地显示较少的生物活性(49b4:图7;8h9:图8,moxr0916:图9;clc-563:图10)。表达人fap的成纤维细胞经由fap结合部分或二级交联抗体经由ox40抗原结合分子的fc区所引起的额外交联进一步增加所有抗原结合分子的nfκb活化。对于低纳摩尔二价ox40抗体(49b4、clc-563)而言,较高的ox40价在生物活性方面也产生亲合力增益(4+1》3+1》2+1),而对于亚纳摩尔二价ox40结合剂(8h9、moxr0916)而言,未观察到3+1相对于2+1形式的益处。呈4+1形式的49b4的所有氨基酸变体诱导剂量依赖性nkκb活化的程度均与呈4+1形式的亲
代抗体类似(图11)。
[0829]
没有进一步交联及具有由细胞表面人fap(nih/3t3 hufap克隆19)所产生的交联的nfκb诱导剂量反应曲线的ec
50
值汇总于表20中。
[0830]
表20:在存在或不存在细胞表面人fap
+
成纤维细胞的情况下,呈fap靶向形式的ox40抗原结合分子活化nf b的剂量反应的ec
50
值
[0831][0832][0833]
在另一实验中,使贴壁hela_hox40_nfkb_luc1细胞以0.3
×
105个细胞/孔的细胞密度培养过夜,并且利用含有滴定的抗ox40抗原结合分子的测定培养基刺激6小时。为测试由细胞表面fap结合所产生的超交联的效应,使25μl/孔含有fap
+
肿瘤细胞(nih/3t3-hufap克隆19)的培养基以3:1比率共培养(每孔中fap
+
肿瘤细胞为报道细胞的三倍)。
[0834]
温育后,吸出测定上清液且将板用dpbs洗涤两次。根据制造商说明书,使用荧光素酶1000测定系统及报道基因溶解缓冲液(均来自promega,目录号e4550及目录号e3971)对光发射进行定量。简言之,通过每孔添加30μl 1
×
溶解缓冲液使细胞在干冰上溶解30分钟。使细胞在37℃下解冻20分钟,之后向每孔中添加100μl所提供的荧光素酶测定试剂。立即利用spark10m tecan微板读数仪使用500ms积分时间对光发射进行定量,而不用任何滤波器收集所有波长。通过hela_hox40_nfkb_luc1细胞的基础发光校正所发射的相对光单位(url),并且使用prism7(graphpad software,usa)针对一级抗体浓度对数进行作图。使用内置s形剂量反应拟合曲线。
[0835]
因此,我们测试包含克隆ox40(49b4_k23e_k73e)或ox40(clc563)的呈3+1和4+1形式作为d和s变体的所选双特异性ox40抗原结合分子单独以及在通过fap
+
成纤维细胞细胞是将分子超交联的情况下的nfκb活化能力。结果在图35a至图35f中示出。所有ox40抗原结合分子均诱导剂量依赖性nkκb活化。由于在不存在构建体的进一步外部交联的情况下已组装三聚体核心ox40受体信号传导单元,因此以四价和三价使用ox40抗体诱导一定的nfκb活化(图35b、35d和35f)。表达人fap的成纤维细胞经由fap结合部分的额外交联进一步增加所
有抗原结合分子的nfκb活化(图35a、35c和35e)。d和s变体的生物活性具有相当的强度。
[0836]
没有进一步交联及具有由细胞表面人fap(nih/3t3 hufap克隆19)所产生的交联的nfκb诱导剂量反应曲线的ec
50
值汇总于表21中。
[0837]
表21:在存在或不存在细胞表面人fap
+
成纤维细胞的情况下,呈fap靶向形式的ox40抗原结合分子(d和s变体)活化nf b的剂量反应的ec
50
值
[0838][0839]
4.2ox40介导的次最佳tcr的共刺激触发静息人pbmc和由细胞表面fap所产生的超交联
[0840]
如实例4.1中所示,添加fap
+
肿瘤细胞因提供ox40受体的强寡聚化而可强烈地增加人ox40阳性报道细胞系中由fap靶向的ox40抗原结合分子诱导的nf b活性。同样地,我们在原代t细胞测定中测试所有构建体在nih/3t3-hufap克隆19细胞存在下拯救静息人pbmc细胞的次最佳tcr刺激的能力。
[0841]
人pbmc制剂含有(1)静息ox40阴性cd4
+
和cd8
+
t细胞以及(2)在细胞表面上具有各种fc-γ受体分子的抗原呈现细胞(例如b细胞以及单核球)。人igg1同种型的抗人cd3抗体可以其fc部分结合至本发明的fc-γ受体分子,并且介导静息ox40阴性cd4和cd8 t细胞上延长的tcr活化。接着,这些细胞在若干小时内开始表达ox40。针对ox40的功能激动性化合物可经由存在于活化cd8
+
和cd4
+
t细胞上的ox40受体发出信号,并支持tcr介导的刺激。
[0842]
在经辐照的fap
+
nih/3t3-hufap克隆19细胞以及滴定的双特异性ox40抗原结合分子存在下,利用次最佳浓度的抗cd3抗体将静息人pbmc刺激四天。通过流式细胞术,经由监测总细胞计数(cd4
+
或cd8
+
t细胞)并用针对t细胞活化标志物(cd4
+
t细胞上的cd25表达)的荧光标记抗体共染色,分析对t细胞存活期和增殖的效应。使用细胞解离缓冲液(invitrogen,目录号13151-014),在37℃下收获小鼠胚胎成纤维细胞nih/3t3-hufap克隆19细胞达10分钟。将细胞用dpbs洗涤一次。在x射线辐照器中,使用4500rad的剂量辐照nih/3t3-hufap克隆19细胞,以防止肿瘤细胞系随后生长超过人pbmc。在无菌96孔圆底粘附组织培养板(tpp,目录号92097)中,使经辐照的细胞以0.2
×
105个细胞/孔的密度于t细胞培养基中在37℃/5%co2下培养过夜。
[0843]
通过聚蔗糖密度离心使人pbmc自新鲜血液分离。将细胞以0.6
×
105个细胞/孔的密度加入到每一孔中。以指示浓度添加最终浓度为[10nm]的抗人cd3抗体(克隆v9,人igg1),以及fap靶向的ox40抗原结合分子。在分析之前,使细胞在37℃/5%co2下温育四天。
[0844]
首先将细胞用dpbs中的zombie aqua可固定活力染料(biolegend,目录号423102)染色10min,之后在4℃下用荧光染料结合的抗体抗人cd4(克隆rpa-t4,biolegend,目录号300532)、cd8(克隆rpa-t8,biolegend,目录号3010441)以及cd25(克隆m-a251,biolegend,
目录号356112)表面染色20min。将细胞团粒用facs缓冲液洗涤两次。最后使样品重悬于20μl/孔facs缓冲液中,并且在同一天使用ique细胞筛选器和forecyt软件(sartorius)获取。表22汇总在次最佳tcr刺激原代人pbmc后,呈fap靶向形式的双特异性ox40抗原结合分子对cd4
+
t细胞上cd25上调的剂量反应的ec
50
值。
[0845]
表22:在次最佳tcr刺激原代人pbmc后,对cd4
+
t细胞上cd25上调的剂量反应的ec
50
值
[0846][0847][0848]
如图12至17中所示,利用非靶向的抗ox40(49b4)4+0形式进行共刺激几乎不拯救次最佳tcr刺激的cd4和cd8 t细胞。fap靶向的四价、三价和二价ox40抗原结合分子在nih/3t3-hufap克隆19细胞存在下的超交联强烈地促进人cd4 t细胞的存活期并诱导所测试的所有ox40克隆在这些细胞中的活化表型增强(49b4:图12和13;8h9:图14,clc563:图16,moxr0916:图15)。呈4+1形式的49b4的所有氨基酸变体均支持t细胞活化,其程度至少与呈4+1形式的亲代抗体类似,甚至略有改进(图17)。
[0849]
各种抗原结合分子的生物活性(如根据cd4
+
t细胞上的cd25上调来测量)曲线下的归一化面积示于图18中。ox40支持的t细胞活化的主要增强是通过fap介导的超交联来实现,并且由此实现ox40抗原结合分子的细胞表面固定(比较图18以及表19中49b4 4+0对4+1抗原结合分子的归一化auc)。ox40价的增加仍增加靶向的ox40激动剂抗原结合分子的激动性能力,但程度低于fap交联(比较图18以及表19中4+1对3+1对2+1形式的归一化auc)。对于亲合力克隆49b4,观察到较高价的激动力增加最强,其中四价的归一化auc为二价形式中的一者的双倍。此指示,当为靶向的ox40激动剂选择高亲和力以及较小亲合力驱动的ox40克隆时,二价和三价分子可在体外原代t细胞测定中维持与四价49b4相似的活性。
[0850]
最佳t细胞共刺激的分子设计要求似乎与ox40受体下游的纯nf b活化略有不同。第一种需要对多种ox40激动性抗体进行强表面固定,这无法由ox40抗体的抗体固有价完全补偿。后者需要通过抗体固有多价ox40接合进行高度的ox40受体寡聚化,这无法通过激动
剂的表面固定完全补偿。
[0851]
这可能反映对调节原代t细胞(称为t细胞突触)内的磷酸化及去磷酸化事件的反应进行空间限制以获得最佳tcr接合的需要。全功能t细胞突触组装各种信号传导组分(例如经由脂质筏)以实现全功能性。突触组分的横向移动性减少对此有利,fap靶向的ox40抗原结合分子对ox40的细胞表面固定也可能如此。
[0852]
在测试c末端s和d变体的另一实验中,根据制造商的说明书,将人pbmc用cfse增殖试剂盒(thermo fisher,目录号c34554)以0.2[μm]cfse的最终浓度在室温下标记10分钟。将细胞以0.6
×
105个细胞/孔的密度加入到每一孔中的t细胞培养基中。以指示浓度添加最终浓度为[10nm]的抗人cd3抗体(克隆v9,人igg1),以及fap靶向的ox40抗原结合分子,二者均于t细胞培养基中制备。在分析之前,使细胞在37℃/5%co2下温育四天。
[0853]
首先将细胞用dpbs中的live/dead
tm
可固定aqua死细胞染色剂(molecular probes,目录号l34957)染色20min,之后为一个洗涤步骤(200μl 4℃facs缓冲液)。此后,在4℃下用荧光染料结合的抗体抗人cd4(克隆okt4,biolegend,目录号317440)、cd8(克隆sk-1,biolegend,目录号344714)以及cd25(克隆bc96,biolegend,目录号302626)表面染色30min。将细胞团粒用dpbs洗涤两次。最后使样品重悬于100μl/孔facs缓冲液中,并且在同一天使用bd fortessa运行的facs diva软件获取。表23汇总在次最佳tcr刺激原代人pbmc后,呈fap靶向形式的双特异性ox40抗原结合分子对cd4+t细胞上cd25上调的剂量反应的ec
50
值。
[0854]
表23:在次最佳tcr刺激原代人pbmc后,对cd4
+
t细胞上cd25上调的剂量反应的ec
50
值
[0855]
分子id抗ox40克隆变体形式ec
50
[nm]p1af6455clc-563s3+10.003p1af6454clc-563d3+10.001p1af7217clc-563s4+10.002p1af7205clc-563d4+10.001p1af645749b4 aa变体k23e_k73es4+10.001p1af645649b4 aa变体k23e_k73ed4+10.001
[0856]
如图36a至36f中所示,利用非靶向的四价抗ox40(49b4)(4+0形式)进行共刺激仅在高于[1nm]的浓度下拯救次最佳tcr刺激的cd4和cd8 t细胞。fap靶向的四价和三价ox40抗原结合分子在nih/3t3-hufap克隆19细胞存在下的超交联强烈地促进在人cd4(图36a、36c和36e)以及cd8(图36b、36d和36f)中的增殖并诱导活化表型增强。clc563构建体的s变体的性能较d变体略差,但不为统计学上显著的(图36a至36d)。呈4+1形式的49b4的所有氨基酸变体均支持t细胞活化,其程度至少与呈4+1形式的亲代抗体类似,甚至略有改进。此处,在s与d变体之间未观察到差异(图36e和36f)。
[0857]
4.3ox40介导的共刺激增加cecam5 tcb复位向pbmc的溶解cea+肿瘤细胞的细胞因子的分泌
[0858]
一种临床上利用的募集患者自身免疫系统以对抗癌症的方式为t细胞双特异性抗体(tcb)。这些分子包含对t细胞上的t细胞受体(tcr)具有特异性的激动性抗cd3单元,以及对独特的癌症抗原具有特异性的靶向部分。tcb使多克隆t细胞复位向,以溶解在细胞表面
上表达相应靶抗原的癌细胞。在不存在此靶抗原的情况下,不会发生t细胞活化。此实例中所用的tcb为靶向癌胚抗原(cea)的ceacam5 tcb,并且详细地描述于wo 2016/079076a1中。取决于此主要刺激的强度及持续时间而定,触发tcr增加共刺激性分子的表达,例如肿瘤坏死因子受体(tnfr)超家族的成员ox40。此受体与其相应配体的伴随激动性连接进而促进标志性t细胞效应子功能,如某些促炎细胞因子(gm-csf、ifn-γ、il-2、tnf-α)的增殖、存活期和分泌(m.croft等人,immunol.rev.2009,229(1),173-191;i.gramaglia等人,j.immunol.1998,161(12),6510-6517;s.m.jensen等人,seminars in oncology 2010,37(5),524-532)。需要此共刺激来提高t细胞对抗肿瘤细胞的全部潜力、尤其是在弱肿瘤抗原引发的情况下,并且在首次攻击后维持抗肿瘤反应以容许形成保护性记忆。在某些具有强免疫抑制或耗竭表型的患者中,仅多克隆但肿瘤特异性t细胞募集(信号1)与肿瘤限制性阳性共刺激(信号2)的恢复相组合才可有助于足够的抗肿瘤功效和延长的适应性免疫保护。此可持续地驱动肿瘤微环境朝向免疫活化更高且免疫抑制更少的状态。ox40的fap依赖性共刺激也可有助于在较低的肿瘤内浓度下进行tcb介导的肿瘤细胞杀死,这将使全身性暴露及相关的副作用减少。另外,由于较低的tcb浓度仍可有效,因此治疗间隔可能延长。
[0859]
使用天然表达cea抗原的mkn45 nuclight red(nlr)细胞作为靶细胞。遵循制造商的说明书,在存在8μg/ml聚凝胺的情况下,用essen cellplayer nuclight red慢病毒试剂(essenbioscience,目录号4476;ef1α,嘌呤霉素)以5(tu/细胞)的moi转导mkn-45(dsmz;acc409)以稳定表达受限于细胞核的nuclight red荧光蛋白。此使得能够易于与非荧光效应t细胞或成纤维细胞分离并通过高通量生命荧光显微术监测肿瘤细胞生长。
[0860]
由表达人成纤维细胞活化蛋白(hufap)的nih/3t3-hufap克隆19提供细胞表面fap对fap结合抗体的交联(参见实例3.2)。通过聚蔗糖密度离心使人pbmc自新鲜血液分离(参见实例3.1)。
[0861]
将mkn45 nuclight red(nlr)细胞以0.1
×
105个细胞/孔的密度加入到每一孔中的t细胞培养基中。使nih/3t3-hufap克隆19在4600rad下预辐照,并且接着以0.1
×
105个细胞/孔的密度添加在每一孔中的t细胞培养基中。将人pbmc以0.5
×
105个细胞/孔的密度加入到每一孔中的t细胞培养基中。以指示浓度添加最终浓度为2nm的ceacam5 tcb,以及fap靶向的ox40抗原结合分子的滴定稀释液,二者均于t细胞培养基中制备。在分析之前,使细胞在37℃/5%co2下温育三天。样品以一式三份运行。
[0862]
72小时后,收集上清液,以供使用bio-plex pro人细胞因子8-plex测定目录号bio-rad m50000007a根据制造商的说明书对所选细胞因子进行后续分析。对于在相应测试浓度下的每一所测试的化合物,将一式三份样品合并成等份,并且分析混合物的细胞因子含量。计算相应细胞因子(gm-csf、il-2、tnf-α、ifn-)与仅tcb对照样品中的浓度相比的倍数增加且对fap-ox40抗体浓度进行作图。使用graphpad prism计算剂量-反应曲线,计算auc和ec
50
值并报告于表24中。gm-csf以及tnf-α的剂量反应曲线描绘于图37a至37f中,并且ifn-及il-2的剂量反应曲线描绘于图38a至38f中。以fap-ox40抗原结合分子ox40(clc563)
×
fap(1g1a_epkscd)3+1(在图中称为3+1clc563/h212-d)的auc对每一细胞因子的auc作归一化,并且在图39中绘制每一化合物的盒须图。
[0863]
表24:在fap-ox40共刺激原代人pbmc后,增加的tcb介导的细胞因子分泌的剂量反应的ec
50
值
[0864][0865][0866]
如图37a至37f以及图38a至38f中所示,利用非靶向的抗ox40(49b4)4+0形式进行共刺激不增强由ceacam5 tcb介导的肿瘤细胞溶解诱导的pbmc的细胞因子分泌。fap靶向的四价和三价ox40抗原结合分子在nih/3t3-hufap克隆19细胞存在下的超交联强烈地促进gm-csf的分泌(图37a、37c和37e)以及tnf-α的分泌(图37b、37d和37f),以及ifn-的分泌(图38a、38c和38e)以及il-2的分泌(图38b、38d和38f)。所测试的所有构建体的s变体的性能均较d变体略差,但不为统计学上显著的(图39)。呈4+1形式的49b4的氨基酸变体对t细胞活化的支持强于呈4+1形式的亲代克隆。此处,clc563作为四价较作为三价fap靶向的ox40激动剂显示更强的激动潜力(图39)。
[0867]
4.4 ox40介导的共刺激降低tgfβ诱导的foxp3表达
[0868]
cd4+foxp3+t调控细胞(treg)在免疫稳态以及外周耐受中起关键作用(sakaguchi s,yamaguchi t,nomura t,ono m,cell 2008,133(5),775-87)。其发育、谱系稳定性以及抑制功能依赖于转录因子foxp3的表达,该转录因子是treg身份(identity)的"主要"调控因子(hori s,nomura t,sakaguchi s,science 2003,299(5609),1057-61)。除其胸腺起源以外,cd4+foxp3+treg细胞也可在外周中自活化后的原初cd4+t细胞诱导,其通常称为诱导型treg(itreg)或外周treg(ptreg)(curotto de lafaille ma,lafaille j,immunity2009,30(5),626-35)。体外诱导itreg的最佳表征条件为转型生长因子β(tgf-β)与cd28共刺激的组合。此细胞因子强效地诱导重新foxp3表达,其使活化的常规t细胞程序化转化成itreg(chen w,jin w,hardegen n,lei kj,li l,marinos n,mcgrady g,wahl sm,j exp.med.2003,198(12),1875-86)。已描述ox40信号传导抑制foxp3表达和treg诱导(zhang x,xiao x,lan p等人,cell rep.2018,24(3),607-618)。实例4.1至4.3中显示,所有fap-ox40双特异性抗原结合分子均能够诱导nf b并促进tcr刺激,从而使得活化表型增强且细胞因子分泌增加。同样,我们在原代t细胞测定中测试所有构建体抑制tgf-β介导的foxp3诱导的能力。
[0869]
在利用针对cd28以及cd3的抗体活化t细胞期间,在tgfβ存在下培养含有原初cd4 t细胞的人pbmc制剂。foxp3诱导以及ox40表达在若干小时内发生。当提供由fap产生的交联时(此处fap抗原包覆至珠粒),针对ox40的功能激动性化合物(例如包含ox40克隆ox40(49b4_k23e_k73e)或ox40(clc563)的呈3+1和4+1形式作为d和s变体的双特异性抗原结合分子)可经由存在于活化cd4+t细胞上的ox40受体发出信号。这干扰treg诱导,其可通过foxp3表达减少看出。
[0870]
将无菌96孔圆底粘附组织培养板(tpp,目录号92097)用dpbs中的抗人cd3抗体
(ebioscience,目录号16-0037-85)以3μg/ml的浓度在37℃/5%co2下预包覆2小时。根据制造商的说明书,在室温下用dpbs中的生物素化的人fap抗原(roche,p1ad8986;1μg珠粒0.01μg蛋白质)将m-280链霉抗生物素蛋白(thermofisher,目录号11205d)包覆30分钟,之后在含有0.1%(w/v)bsa的dpbs中在4℃下长期储存。通过聚蔗糖密度离心使人pbmc自新鲜血液分离。根据制造商的说明书,在室温下将细胞用cfse增殖试剂盒(thermo fisher,目录号c34554)以0.4μm cfse的最终浓度标记10分钟。接着将细胞以1
×
105个细胞/孔的密度加入到预包覆板的每一孔中的无血清x-vivo15培养基(lonza,目录号be02-054q)中。添加重组人tgf-β(2ng/ml,r&d systems,目录号240-b-010)、单株抗人cd28(1μg/ml,ebioscience,目录号16-0289-85)以及fap包覆的珠粒(2
×
105个细胞/孔)。以指示浓度添加fap靶向的ox40抗原结合分子的滴定稀释液。在分析之前,使细胞在37℃/5%co2下温育三天。
[0871]
首先将细胞用dpbs中的live/dead
tm
可固定aqua死细胞染色剂(molecular probes,目录号l34957)染色10min,之后为一个洗涤步骤(200μl 4℃facs缓冲液)。此后,在4℃下用荧光染料结合的抗体抗人cd4(克隆rpa-t4,biolegend,目录号300532)、cd8(克隆rpa-t8,biolegend,目录号301042)以及cd25(克隆bc96,biolegend,目录号302610)表面染色30min。将细胞团粒用facs缓冲液洗涤两次,之后根据制造商的说明书,在黑暗中在室温下使细胞在foxp3固定/渗透化工作溶液(foxp3染色试剂盒,ebioscience,目录号00-5521)中固定并渗透化处理60分钟。在用1
×
perm缓冲溶液(foxp3染色试剂盒,ebioscience,目录号00-5521)洗涤两次后,在黑暗中在室温下将细胞用1
×
perm缓冲液中的针对foxp3的荧光染料结合的抗体(克隆29d6,biolegend,目录号20108)染色40分钟。将细胞团粒用1
×
perm缓冲液洗涤两次且最后重悬于100μl/孔facs缓冲液中,并且在同一天使用bd fortessa运行的facs diva软件获取。对活的cd4+cd25+treg单态细胞设门,并且报告αfoxp3抗体的mfi。通过不含ox40双特异性抗体的样品(由此仅存在tgbβ)的mfi校正每一浓度的foxp3 mfi。
[0872]
图40a至40c显示,fap-ox40双特异性抗原结合分子以剂量依赖性方式抑制在tgfβ存在下活化的静息cd4 t细胞上的foxp3诱导。每一fap-ox40双特异性抗体的d和s变体均显示相似的生物活性性质。在表25中,汇总cd4+cd25+treg细胞上foxp3抑制(foxp3 mfi)的fap-ox40激动剂剂量反应的ec
50
值。
[0873]
表25:fap-ox40抑制tgf暴露的静息cd4 t细胞上的foxp3诱导的ec
50
值
[0874]
分子id抗ox40克隆变体形式ec
50
[nm]p1af6455clc-563s3+10.25p1af6454clc-563d3+10.11p1af7217clc-563s4+10.01p1af7205clc-563d4+10.02p1af645749b4 aa变体k23e_k73es4+10.01p1af645649b4 aa变体k23e_k73ed4+10.02
[0875]
结果汇总
[0876]
为评价靶向的ox40抗原结合分子的结合性质,使人fap阴性肿瘤细胞(a549-nlr)、
fap阳性成纤维细胞(nih/3t3-hufap-克隆19)、ox40阳性活化pbmc(活化cd4和cd8 t细胞)以及ox40阴性静息pbmc(静息cd4和cd8 t细胞)与测试抗体的指示连续稀释液一起温育,接着通过针对人fcγ的荧光标记的2级抗体进行检测。所有fap靶向的ox40抗原结合分子均有效地结合至表达人fap的靶细胞且不与靶标阴性细胞结合。所有构建体的fap结合均在相当的纳摩尔范围内。这有望在患者中转化为直接肿瘤靶向以及分子富集。随着ox40在t细胞上的天然流行,所有fap靶向的ox40抗原结合分子与活化cd4 t细胞的结合均强于cd8 t细胞。含有亲合力结合剂ox40(49b4)的抗原结合分子以四价形式(4+1)较以三价或二价形式更佳地结合至ox40(ec
50
偏移》1000倍)。克隆49b4的突变氨基酸变体显示相当的行为。所有其他评价的ox40克隆的三价形式(3+1)与二价形式(2+1)相比均未显示亲合力增益。克隆8h9和moxr0916以亚纳摩尔亲和力结合,而克隆clc-563以纳摩尔亲和力结合至ox40阳性t细胞。
[0877]
四价和三价ox40抗原结合分子诱导人ox40阳性nf b报道细胞(hela_hox40_nfkb_luc1报道细胞)中的nfκb活化。这是由于在不存在构建体的进一步外部交联的情况下已组装三聚体核心ox40受体信号传导单元。二价形式本身相应地显示较低的生物活性。表达人fap的成纤维细胞经由fap结合部分或二级交联抗体经由ox40抗原结合分子的fc区所引起的对双特异性ox40激动剂的额外交联进一步增加所有抗原结合分子的nfκb活化。对于低纳摩尔二价ox40克隆(49b4、clc-563)而言,较高的ox40价在生物活性方面也产生亲合力增益(4+1》3+1》2+1),而对于亚纳摩尔二价ox40克隆(8h9、moxr0916)而言,未观察到3+1相对于2+1形式的益处。呈4+1形式的49b4的所有氨基酸变体诱导剂量依赖性nkκb活化的程度均与呈4+1形式的亲代抗体类似。即使在坪浓度和最佳交联条件下,二价和三价ox40抗原结合分子也未达到四价4+1形式的nf b活化水平。
[0878]
除在nf b报道子测定中以外,利用非靶向的抗ox40(49b4)4+0形式进行共刺激几乎不拯救次最佳tcr刺激的cd4和cd8 t细胞。然而,fap靶向的四价、三价和二价ox40抗原结合分子在nih/3t3-hufap克隆19细胞存在下的超交联强烈地促进人cd4 t细胞的存活期并诱导所测试的所有ox40克隆在这些细胞中的活化表型增强。49b4的所有氨基酸变体与呈相同形式的亲代抗体具有同等的生物活性。
[0879]
ox40支持的t细胞活化的主要增强是通过fap介导的超交联来实现,并且由此实现ox40的细胞表面固定。ox40价的增加仍增加fap靶向的ox40激动剂的激动性能力,但程度较低。为靶向的ox40激动剂选择较高亲和力以及较小亲合力驱动的ox40克隆容许达到与已利用二价和三价ox40抗原结合分子获得的四价ox40激动剂相似的生物活性。与t细胞活化相比,在实现最佳ox40受体刺激的分子设计要求方面的此差异可能反映对调节原代t细胞(称为t细胞突触)内的磷酸化及去磷酸化事件的反应进行空间限制以获得最佳tcr接合的需要。全功能t细胞突触组装各种信号传导组分(例如经由脂质筏)以实现全功能性。突触组分的横向移动性减少对此有利,fap靶向的ox40激动剂对ox40的细胞表面固定也可能如此。
[0880]
实例5
[0881]
pk性质的工程化改造
[0882]
5.1参照化合物的背景和性质
[0883]
在食蟹猴中的单一静脉内剂量hufcrn和单一静脉内剂量pk研究中探究如wo 2017/060144 a1中所述的双特异性抗原结合分子ox40(49b4)
×
fap(4b9)(4+1)(分子p1ad4524),并且观察到非典型的高清除率(》10-12ml/min/kg),如表26中所示。体内方案和
生物分析性测定描述于实例6中。
[0884]
hu fcrn小鼠携带人fcrn而非小鼠fcrn,并且因此视为较野生型小鼠(c57/bl6)更能预测在人中的清除率。实际上,野生型小鼠中的清除率(11.0ml/天/kg)相应地低于hufcrn小鼠(33.0ml/天/kg),这与通常的假设一致,即食蟹猴中的清除率可能对人更具预测性,例如野生型小鼠在异速转型后的清除率。在构建体血浆浓度-时间曲线中没有迹象指示靶标介导的处置(tmdd)(图19,对于猴极其类似),这是由于在猴中,据显示,增加剂量的清除率类似(参见表26)。
[0885]
表26:p1ad4524的单剂量pk参数
[0886][0887]
另外,表26显示在fcrn剔除小鼠中的清除率,其相应地高于常用人抗体的预期值(观察到野生型人抗体通常为约60-80ml/天/kg),但由于缺乏fcrn拯救机制,fcrn ko小鼠中的清除率始终较高。
[0888]
5.2表面电荷区片探究
[0889]
igg抗体的药物动力学依赖于fcrn结合,然而,已发现,抗体的可变结构域对抗原结合分子的清除率也具有影响。因此,已发现,具有较低等电点(pi)的抗体具有较长的半衰期(igawa等人,protein engineering,design&selection 2010.23,385-392)。zhang等人,anal.chem.2011,83,8501-8508已描述如何使抗体上的正电荷区片显露的方法。抗体构建体的非特异性清除通常与所谓的电荷区片相关,这些区片即抗体构建体表面上的区域,其主要显示正电荷且由此结合至细胞膜的带负电的糖萼,之后内化并降解而无需经由fcrn拯救。
[0890]
5.2.1 fap克隆的表面电荷区片探究
[0891]
所观察到的体内结果、尤其fcrn剔除(ko)小鼠中的高清除率指出分子p1ad4524的非特异性清除率较高,该分子为具有四重ox40(49b4)fab片段和单一fap(4b9)抗原结合结构域的抗原结合分子,其形式为单一结构域vh和vl各自分别地连接至fc区的c末端。
[0892]
因此,通过分子p1ad4524的等电位表面模拟来探究其表面是否将显示此类正电荷区片。类似于实例1.11,fap(4b9)抗原结合结构域显示具有显著大小的此正电荷区片(图20),其可造成不期望的高p1ad4524清除率。
[0893]
此外,与p1ad4524中所用类似的vh/vl片段也与如由holland等人,j.clin.immunol.2013,33,1192-1203公布的不相关分子一起包括在研究中。此vh/vl片段视为与免疫学发现的潜在的非特异性结合性质相关。因此,对于本发明的抗原结合分子,实施用携带fap结合剂的fab片段替代vh/vl片段。
[0894]
然后在hufcrn小鼠中测试与p1ad4524类似但包含c末端交叉fab而不是vh/vl片段的抗原结合分子p1ae6836,以检查vh/vl片段的省略是否将相应地降低清除率。
[0895]
结果在图21和表27中示出。vh/vl片段的省略以约7ml/天/kg降低清除率,但清除
率仍为约26ml/天/kg,并因此高于不超过10-12ml/天/kg的期望范围。
[0896]
表27:p1ad4524的单剂量pk参数
[0897][0898]
因此,需要对抗原结合分子进行进一步改变以降低分子的清除率。
[0899]
5.2.2 ox40(49b4)克隆的表面电荷区片探究
[0900]
由于fap(4b9)克隆上正电荷区片的消除不足以在hufcrn小鼠中达到至少低于12ml/天/kg的清除率,因此也探究ox40(49b4)克隆的潜在电荷区片,并且其fab区的模拟等电位表面示于图22a至22c中。ox40(49b4)克隆上的正电荷区片可能小于4b9 fap结合剂上的正电荷区片,但由于其在抗原结合分子中因其4+1价而出现四次,因此其可能与p1ae4524的高清除率相关。
[0901]
因此,决定也探究其他ox40抗体并尝试减少p1ae4524中的正电荷区片。
[0902]
5.3 ox40克隆的变化以及对体外pk参数的效应
[0903]
5.3.1替代性fap和ox40克隆的表面电荷区片探究
[0904]
除49b4结合剂的两种序列变体以外,也有三种不同的替代性ox40克隆可用并对其进行测试,以避免此类电荷区片。fab区的模拟等电位表面区域示于图23a至23c(克隆8h9)、图24a至24c(克隆clc563)以及图25a至25c(克隆moxr0916)中。替代性fap克隆1g1a的fab区的等电位表面区域示于图26中。
[0905]
由于存在电荷区片,按清除率可能增加的顺序,极粗略的排序大概为clc563《8h9《moxro916,但此需要测试并通过独立的药物动力学数据予以确认,这是由于对等电位表面的目视检查不为定量的。随后通过额外体外数据对这三种不同的结合剂进行探究,并且在选择时也需考虑所得构建体的生物活性,以在药理学生物活性与清除率之间达到平衡。
[0906]
vh/vl片段上的fap克隆4b9在连接至抗原结合分子c末端的交叉fab片段中由fap克隆1g1a替代。如图20d至20f中所示,此fap克隆未显示明显的正电荷区片。
[0907]
5.3.2 arc体外测定结果
[0908]
利用可获得克隆的每一潜在抗原结合分子实施新的hufcrn小鼠pk研究是不可行的。因此,通过体外测定实施预选,其探究在中性ph(ph 7.4,与fcrn的结合较低)以及在ph 6.0(与fcrn的结合较强)下加载至上皮细胞的化合物的回收率差异。为通过fcrn获得更佳拯救,这两个ph值之间的回收率偏移应较高(野生型抗体》10)且在ph 7.4下的值应较低(对于正常人野生型抗体《0.10-0.20),否则存在非特异性结合,预期随后清除。该测定始终以野生型抗体和不与fcrn结合的抗体作对照,以在每一实验中具有内部对照。
[0909]
在下表28中将体外arc测定的结果制成表格。
[0910]
表28:各种抗原结合分子的arc体外测定结果
[0911][0912]
自表28中显而易见,在arc测定中,价(存在于抗原结合分子中的ox40结合剂数目)对ph偏移具有显著影响。在相同的同源物系列中,较高的价(4+1对3+1和3+1对2+1)导致较低的偏移及据推测较高的清除率。
[0913]
2+1 8h9构建体获得最高的ph偏移值,4+1化合物始终具有最低的ph偏移,这表明fcrn拯救较低且清除率较高。
[0914]
ph7.4下的值提示非特异性结合较高,并且原始化合物p1ad4524在ph 7.4下的确显示最高值。因此,arc测定的结果与fcrn ko小鼠中p1ad4524的高清除率及所观察到的电荷区片一致。类似地,根据这些体外结果,3+1 8h9构建体也可能具有高非特异性清除率。
[0915]
与含有ox40(49b4)氨基酸变体的4+1抗原结合分子中电荷区片的至少部分去除一致,化合物p1ae9167、p1ae9176及在较小程度上p1ae9169在ph 7.4下具有较低的值,这表明非特异性结合较低,并且为正电荷区片对非特异性抗体清除率的负面影响增加进一步证据。
[0916]
更通常,可自arc测定的结果得出如下结论:去除电荷区片可降低非特异性清除率且较高的价使得清除率较高,这可能与pyzik等人,front.immunol.2019,10:1540,doi:10.3389/fimmu.2019.01540所公布的近期观察结果一致。
[0917]
5.3.3在hufcrn中体内探究所选抗原结合分子
[0918]
基于体外arc测定和生物活性数据,选择三种化合物在hufcrn小鼠中进行体内研究:p1ae8870(ox40(8h9)
×
fap(1g1a)2+1)、p1ae8873(ox40(8h9)
×
fap(1g1a)3+1)以及p1ae9176(ox40(49b4_k23e_k73e)
×
fap(1g1a)4+1)。结果如表29所示。arc测定的结果与hufcrn小鼠中的体内结果具有良好相关性。
[0919]
表29:三种所选抗原结合分子对原始化合物p1ad5424的hufcrn小鼠pk的结果
[0920][0921]
基于这些体外和动物体内结果,可得出如下结论:去除fap抗体上的电荷区片以约7ml/天/kg降低hufcrn小鼠中的清除率,并且ox40抗体的较高价(例如4+1对2+1)与hufcrn小鼠中的较高清除率相关,该小鼠可为人患者的良好替代物。
[0922]
5.4呈4+1和3+1形式的所选抗原结合分子的pk性质的比较
[0923]
5.4.1所选抗原结合分子的背景和性质
[0924]
与相应3+1构建体(3
×
clc563)相比,在体外测定中,ox40(clc563)
×
fap(1g1a)双特异性抗原结合分子的4+1变体(4
×
clc563)往往显示改进的活性性质。因此,比较这两种变体的药物动力学(pk)性质令人关注。
[0925]
在人fcrn小鼠(hu fcrn)以及fcrn ko小鼠的单一静脉内剂量pk研究中探究双特异性抗原结合分子ox40(clc563)x fap(1g1a)3+1(分子p1af6454,s变体),并且与原始4+1构建体p1ad4524相比,观察到相应地改进的较低清除率(目标:对于hufcrn小鼠,《10-12ml/天/kg),如表29中所示。体外和体内方案以及生物分析性测定描述于实例6.5中。
[0926]
hu fcrn小鼠携带人fcrn而非小鼠fcrn,并且因此视为较野生型小鼠(c57/bl6)更能预测在人中的清除率。没有迹象指示靶标介导的处置(tmdd),如例如在构建体血浆浓度-时间曲线中低于某一浓度临限值的更快清除(图41)。
[0927]
另外,表30显示在fcrn剔除小鼠中的清除率,其相应地高于常用人抗体的预期值(观察到野生型人抗体通常为约60-80ml/天/kg),但由于缺乏fcrn拯救机制,fcrn ko小鼠中的清除率始终较高。
[0928]
表30:p1af6455/p1af6454(3+1)对p1ad4524(4+1)的单剂量pk参数
[0929][0930]
5.4.2自3+1至4+1的价变化以及对体外pk参数的效应
[0931]
利用可获得克隆的每一潜在抗原结合分子实施新的hufcrn小鼠pk研究是不可行的。因此,通过两个体外测定(arc测定和luca测定)实施预选。arc测定已描述于实例5.3.2中。
[0932]
luca测定利用与所关注的抗体构建体共价附接的染料在体外程序期间的荧光强度的ph依赖性差异。接着使具有附接染料的构建体与表达人fcrn的人原代肝脏内皮细胞一起温育。若经标记的构建体由内皮细胞中的fcrn充分再循环,则内皮细胞中的荧光保持较低,但若经标记的构建体未充分再循环且在晚期胞内体中处理并在溶酶体中降解,则荧光
增加,这是由于在这些晚期胞内体和溶酶体中,ph降低。luca值越高,则体内清除率越高。
[0933]
于下表31中将体外arc和luca测定的结果制成表格。
[0934]
表31:各种抗原结合分子的arc和luca体外测定的结果
[0935][0936]
自表31中显而易见,价(存在于抗原结合分子中的ox40结合剂数目)对arc测定的结果具有细微影响,这显示与4+1构建体相比,3+1变体的arc比率更高,即若存在非特异性摄取(ph7.4 arc评分相当,此处确实为此情况),则理论上预期3+1构建体的体内清除率更低。
[0937]
与arc测定结果相比,luca测定提示4+1构建体具有微小优点,这是由于此处luca值应与移交至晚期胞内体的构建体部分相关,这指示较高的luca值具有较高的清除率。
[0938]
总体而言,体外测定中的差异往往相当细微,因此在hu fcrn和fcrn ko小鼠中实施构建体的体内研究,这是由于根据pyzig等人,front.immunol.2019,10,1540(doi:10.3389/fimmu.2019.01540),如通过arc测定中的差异(尽管中等)所指示,较高的价可能与较高的清除率相关。
[0939]
5.4.3在hu fcrn和fcrn ko小鼠体内探究所选抗原结合分子
[0940]
基于体外arc测定和生物活性数据,选择以下化合物在hufcrn小鼠中进行体内研究:p1ae6455(ox40(clc563)
×
fap(1g1a)3+1,呈c末端s变体)、p1af7217(ox40(clc563)
×
fap(1g1a)4+1,呈c末端s变体)以及p1af7205(呈4+1构建体的相应c末端d变体)。结果如表32所示。对于fcrn ko小鼠中的体内研究,将p1ae6455替代为p1ae6454(ox40(clc563)
×
fap(1g1a)3+1,呈c末端d变体)。hufcrn小鼠中的体内结果与arc测定的结果具有良好等级次序相关性。
[0941]
表32:三种所选抗原结合分子对p1ad5424的hufcrn小鼠pk的结果
7.4替代缓冲液以进行"追踪"。2小时后测量igg分子自细胞的释放(追踪),并且通过igg elisa进行定量,其中计算每一条件的平均量(以ng计)。对顶端和基底外侧区室二者进行取样以分别代表再循环和胞吞转送作用。在ph 7.4下,igg仅经由流体相胞饮摄取。此研究揭示igg例如由于其物理化学性质以及随后与细胞表面的相互作用而经历非特异性摄取的敏感性。
[0952]
在两个ph值下计算最终arc评分:
[0953]
6.0=ng igg再循环ph 6.0+ng igg胞吞转送ph 6.0
[0954]
7.4=ng igg再循环ph 7.4+ng igg胞吞转送ph 7.4
[0955]
方程式1两个ph值的arc评分公式。
[0956]
6.3分析血清样品中的分析物浓度以用于hufcrn小鼠研究
[0957]
对于hufcrn和fcrn ko小鼠研究,通过针对小鼠血清的探究性elisa测定来测定小鼠血清中分析物的浓度,该测定使用对人抗体(cκ和ch1区)具有特异性的捕获和检测试剂。定量限值为69ng/ml。stubenrauch等人,journal of pharmaceutical and biomedical analysis 2013,72,208-215描述对食蟹猴血清的测定,并且使其适用于小鼠血浆。
[0958]
6.4分析血清中的抗药物抗体以用于hufcrn小鼠研究
[0959]
对于hufcrn和fcrn ko小鼠研究,通过探究性elisa测定测量小鼠血清中针对药物的抗药物抗体,该测定使用抗人igg fab片段(cκ和ch1区)作为小鼠血清中的捕获试剂且抗小鼠igg抗体作为检测试剂。stubenrauch等人,journal of pharmaceutical and biomedical analysis 52(2010)249-254描述对食蟹猴血清的测定,并且使其适用于小鼠血浆。
[0960]
6.5体内研究:hu fcrn小鼠以及fcrn ko小鼠pk研究
[0961]
以缓慢浓注形式向四只雄性hufcrn tg32+/+小鼠静脉内施用测试化合物(5mg/kg),并且在投药后0.0833h、7h、24h、48h、72h、168h、336h、408h及504h,通过微量取样收集20微升k3edta血液。通过离心制备血浆并冷冻储存,直至在干冰上运送,以通过部分6.3和6.4中所述的通用测定来分析人抗体的浓度和抗药物抗体的出现。
[0962]
此外,以缓慢浓注形式向三只雄性fcrn ko小鼠静脉内施用测试化合物(5mg/kg),并且在投药后0.167小时、2小时、7小时、24小时、30小时、48小时、72小时和96小时,通过微量取样收集20微升k3edta血液。通过离心制备血浆并冷冻储存,直至在干冰上运送,以通过部分6.3和6.4中所述的通用测定来分析人抗体的浓度和抗药物抗体的出现。通过已确立的非区室程序实施药物动力学评价。
[0963]
6.6用于估计抗体的非特异性清除率的luca测定
[0964]
建立体外测定,以供预测治疗性抗原结合分子在原代人肝脏内皮细胞中的非特异性清除率。通过用ph敏感性染料标记抗原结合分子来获取数据,该ph敏感性染料在溶酶体(酸性ph 5.5)中累积时展现高荧光,并且在细胞外(中性ph 7.4)保留时展现低荧光。使人或动物内皮细胞与经标记的抗体一起温育2小时和4小时,并且使用流式细胞仪记录荧光读出。使用几何平均强度进行线性回归分析。当以标准抗体作归一化时,所提取的斜率形成所谓的相对luca速率。
[0965]
为测试在luca测定中所检测到的清除率是否仅由诸如胞饮等非特异性摄取机制介导,对测定进行修改以也测试潜在靶标介导(或脱靶介导)的药物处置(tmdd)。因此,使细
胞与等效未经标记的抗体对应体一起预温育,以使促成清除的靶标饱和。为监测效应,将不同浓度的未经标记抗体在经标记抗体之前以及与其一起施加至细胞。若分子表现出潜在tmdd,则相对luca速率将随未经标记抗体的浓度增加而降低。
[0966]
抗体标记:根据制造商说明书,使用siteclick
tm
抗体叠氮基修饰试剂盒(thermo fisher scientific)标记抗体。简言之,通过β-半乳糖苷酶去除fc区的n连接的半乳糖残基,并且经由β-1,4-半乳糖基转移酶(galt)由含叠氮化物的半乳糖(galnaz)替代。此叠氮化物修饰使得能够进行sdibo修饰染料的无铜结合。ph敏感性胺反应性染料(523nm)是购自promega,并且偶联至磺基dbco peg4胺。以2倍的摩尔染料过量标记抗体。使用mwco为50kd的ultra-2离心过滤器(emd millipore,编号ufc200324)去除过量染料,并且使抗体于20mm组氨酸缓冲液(ph 5.5)中重新缓冲。利用nanodrop光谱仪在280nm和532nm下测定经标记抗体的浓度[1]以及染料对抗体比率(dar)[2]。
[0967]
cab=[a280nm-[a280nm*cf染料]]/εmab
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[1]
[0968]
dar=[a532nm*mwmab]/[cmab*ε染料]
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[2]
[0969]
ε染料=47225
[0970]
cf染料=0.36
[0971]
细胞维持和制备:冷冻保存的人肝脏源性内皮细胞(hlec-p2)是购自lonza(lonza,编号hlecp2)。使细胞维持在补充有egm
tm-2mv微血管内皮细胞生长培养基singlequots
tm
(lonza,编号cc-4176)的ebm
tm-2内皮细胞生长基础培养基-2(lonza,编号cc-3156)中。在抗体处理前五天,将细胞平铺至胶原i包覆的100mm培养皿(biocoat
tm
,编号354450)上,并且在处理前两天,在胶原i包覆的96孔板(biocoat
tm
,编号354407)中以4
×
104个细胞/孔的细胞密度继代培养,以容许粘附48小时。24小时后更换培养基,并且使细胞保持在37℃和5%co2下。
[0972]
在实验当天,将细胞用200μl预温热的培养基洗涤两次,并且随后于培养基中与400nm经标记抗体或作为阴性对照的20mm组氨酸缓冲液(ph 5.5)一起温育。若测试潜在tmdd,则使细胞与未经标记的对应体(0μm、0.2μm、0.6μm、1.2μm、3μm、6,2μm)一起在37℃下预温育30min,之后添加经标记抗体。2小时和4小时后,去除抗体溶液且将细胞用200μl冰冷的dpbs(不含mg和ca)洗涤一次并通过在37℃下施加100μl胰蛋白酶(含有edta)达2.5分钟分离。通过添加100μl facs缓冲液(20%fcs,1mm edta于dpbs中)使胰蛋白酶不活化。
[0973]
质量控制:生物物理学结合性质是影响清除机制的关键决定因素。因此,评估抗体的结合亲和力在标记过程期间是否发生变化是重要的。先前已显示,肝素色谱法及新生fc受体结合预测体外抗体清除(kraft等人,mabs 2020)。在本文中,此方法用于解释由点击标记引入的潜在异常结合性质。为确认不存在未结合的染料并验证以光谱仪所测量的浓度,对经标记抗体实施尺寸排阻色谱法。使用biosuite diol(oh)管柱(waters,186002165),利用磷酸二氢钾缓冲液(ph 6.2)作为流动相,以0.5ml/min的流速分离样品。使用检测器在280nm和532nm下定量并分析经标记抗体。提取280nm和532nm下的曲线下面积(auc)以计算浓度。计算所有抗体的auc的几何平均值,并且鉴别每一抗体与此几何平均值的偏差。对于在此测定中可靠的抗体,预期与几何平均值的差异低于15%。
[0974]
流式细胞术和药物动力学分析:使用配备有在488nm下激发的激光及在585nm/
540nm下收集发射光的滤波器的analyzer 10(miltenyi biotec)获取内化抗体的平均荧光强度(mfi,更具体而言几何平均值(geometric mean、geo-mean))。对于两个时间点(2小时和4小时),使用完全相同的条件、增益的门控。使用flojo_v10软件实施数据提取。自所有几何平均值减去阴性对照值,之后以dar作归一化。使用graphpad prism将每一抗体的归一化几何平均值绘制为线性回归曲线,以提取斜率(120min和240min的几何平均mfi/min)。选择两种标准抗体以使斜率归一化:将莫维珠单抗(motavizumab)-yte(g.j.robbie等人,antimicrob.agent chemother.2013,57(12),6147)设为0,并且将cd20-cd3 tcb(hutchings等人,blood 2019,134,2871)设为1。使用tibco spotfire软件,针对已公布的体内人、食蟹猴和hfcrn tg32+/+小鼠清除率值绘制最终斜率。
[0975]
体内药物动力学数据:人和食蟹猴清除率值自fda、ema和ncbi所发布的研究综述或与临床药理学家的个人交流汇编而成。若可获得若干个清除率值,则使用描述分子的非特异性清除率的剂量线性清除率。在线性药物动力学的情况下,通过标准非区室方法测定参数。根据以下公式计算清除率:
[0976]
清除率=剂量/浓度-时间曲线下面积
[0977]
在非线性药物动力学的情况下,经由以下替代性方法测定清除率的线性分数:任一清除率值均在高剂量水平下iv施用后估计,在高剂量水平下,额外非线性清除路径几乎饱和。或者,建立包含线性以及非线性可饱和清除率项的pk模型。在这些情况中,使用模型确定的线性清除分数进行关联。
[0978]
自如下内部实施的研究获得鼠类清除率:
[0979]
小鼠:使用小鼠fcrnα-链基因缺陷、但人fcrnα-链基因半合子转基因的b6.cg-fcgrt tm1dcr tg(fcgrt)276dcr小鼠(mufcrn-/-hufcrn tg+/-,品系276)用于药物动力学研究。在特定无病原体条件下进行小鼠饲养。小鼠自jackson laboratory(bar harbor,me,usa)获得(雌性,4-10周龄,投药时体重17-22g)。所有动物实验均由德国上巴伐利亚政府批准(许可号55.2-1-54-2532.2-28-10),并且根据欧盟实验动物照护和使用规范(european union normative for care and use of experimental animals)在aaalac认证的动物设施中实施。将动物圈养在标准笼中,并且在整个研究期期间自由获取食物和水。
[0980]
药物动力学研究:经由侧尾静脉,以5mg/kg的剂量水平i.v.注射单剂量的抗体。将小鼠分成3组,每组6只小鼠,总计覆盖9个血清收集时间点(投药后0.08小时、2小时、8小时、24小时、48小时、168小时、336小时、504小时和672小时)。使每一小鼠经受两次眼眶后出血,其是在isoflurane
tm
(cp-pharma gmbh,burgdorf,germany)的轻度麻醉下实施;在安乐死时收集第三个血液样品。将血液收集至血清管中(microvette 500z-gel,sarstedt,n
ü
mbrecht,germany)。温育2h后,使样品以9.300g离心3min以获得血清。离心后,在-20℃下冷冻储存血清样品直至分析。
[0981]
人抗体血清条件的测定:通过特异性酶联免疫测定测定鼠类血清中优特克单抗(ustekinumab)、巴列津单抗(briakinumab)、mab 8以及mab 9抗体的浓度。分别使用对抗体具有特异性的生物素化白介素12及地高辛(digoxigenin)标记的抗人-fc小鼠单株抗体(roche diagnostics,penzberg,germany)进行捕获和检测。将链霉抗生物素蛋白包覆的微量滴定板(roche diagnostics,penzberg,germany)用在测定缓冲液(roche diagnostics,penzberg,germany)中稀释的生物素化捕获抗体包覆1h。洗涤后,添加各种稀释度的血清样
品,之后为1h的另一温育步骤。重复洗涤后,通过随后与检测抗体一起温育,之后与结合至辣根过氧化物酶(hrp;roche diagnostics,penzberg,germany)的抗地高辛抗体一起温育来检测结合的人抗体。使用abts(2,2连氮基-二[3-乙基苯并噻唑啉磺酸];roche diagnostics,germany)作为hrp底物以形成有色反应产物。使用tecan sunrise读板仪(switzerland),在405nm下读取所得反应产物的吸光度,参照波长为490nm。所有血清样品、阳性和阴性对照样品均以一式两份分析且针对参照标准品进行校准。
[0982]
pk分析使用winnonlin
tm
1.1.1(pharsight,ca,usa),通过非区室分析计算药物动力学参数。简言之,由于抗体呈非线性减少,因此通过对数梯形法计算曲线下面积(auc0-inf)值,并使用表观终末速率常数λz外推至无穷大,自在最后一个时间点所观察到的浓度外推。血浆清除率计算为剂量率(d)除以auc0-inf。表观终末半衰期(t1/2)是自方程式t1/2=ln2/λz得出。
[0983]
实例7
[0984]
先前存在的抗药物抗体反应性的评价和改进
[0985]
7.1先前存在的抗药物抗体(ada)反应性的评价
[0986]
为评价先前存在的igg干扰的根本原因,在人个体血浆样品中实施探究性elisa以检测抗药物抗体(ada)。其使用针对药物fc结构域中的氨基酸突变l234a、l235a和p329g("pglala修饰")的生物素化抗pglala抗体作为捕获试剂以及地高辛标记的fc受体i(cd64)作为检测试剂,该检测试剂与作为ada-药物复合物的一部分的不具有pglala修饰的人igg结合。为比较先前存在的igg对不同药物分子的干扰,在同一组原初人个体血浆样品上实施此测定。
[0987]
在第一步中,将2μg/ml生物素化抗pglala抗体包覆至经链霉抗生物素蛋白包覆的微量滴定板。与此同时,使原初人个体血浆样品(bioivt)与含有6.7
×
10-9
mol/l相应药物分子的缓冲液一起在室温下预温育30分钟,以容许形成药物-抗药物抗体复合物。在温育样品以及洗涤步骤后,可利用0.5μg/ml地高辛标记的fc受体i(cd64)检测作为免疫复合物的一部分且结合至表面的不具有pglala修饰的人igg。洗涤后,添加多克隆抗地高辛-辣根过氧化物酶(hrp)结合物(50mu/ml)并温育。在另一洗涤步骤且将abts(2,2'-连氮基双[3-乙基苯并噻唑磷-6-磺酸]-二铵盐)底物溶液加入到微量滴定板中后,抗体酶结合物的hrp催化呈色反应。elisa读数仪测量405nm波长下的吸收。(wessels等人,bioanalysis 2017,9(11),849-859)。
[0988]
7.2先前存在的抗药物抗体(ada)反应性的改进
[0989]
在原初人血浆样品中探究如wo 2017/060144 a1中所述的双特异性抗原结合分子ox40(49b4)
×
fap(4b9)(4+1)(分子p1aa1119)的先前存在的igg干扰。如图27a中所示,观察到高信号具有高发生率。holland等人,j.clin.immunol.2013,33,1192-1203公布,与另一分子类型中的p1aa1119中所包括者类似的vh/vl片段已显示出对人抗vh自体抗体的反应性。因此,对由携带fap结合剂的fab片段替代vh/vl片段是否可导致本发明的抗原结合分子的ada反应性减少存在质疑。
[0990]
产生与p1aa1119类似、但具有携带fap结合剂的fab片段的抗原结合分子p1ae6836,并且如图27a至27c中所示,在同一组原初人血浆样品中研究先前存在的igg反应性。p1ae6836仍显示先前存在的igg干扰,与p1aa1119相比信号减少,并且在不同的个别人
样品中,指示针对携带fap结合剂的fab片段的先前存在的抗药物抗体类型不同(图27b)。类似但包含人源化fap克隆1g1a的分子(p1ae6838,图27c)证实包含fap 4b9克隆的分子(p1ae6836)所获得的结果,指示fap克隆不为先前存在的igg反应性的根本原因。
[0991]
如图28中可见,所有共有fap(1g1a)抗原结合结构域但具有不同的抗ox40克隆(49b4、8h9、mox0916和clc-563)的双特异性抗原结合分子均显示相同的先前存在的igg干扰,这指示ox40克隆不为先前存在的igg反应性的根本原因。
[0992]
在图29a中,利用对照分子测试人个体血浆样品的亚组,这些对照分子包含ox40(49b4)克隆(p1ad3690)(4+0)、包含四个ox40(49b4)fab片段的非靶向分子、包含人源化fap(1g1a)fab片段的fap(1g1a)分子(p1ae1689)以及种系对照抗体(p1ad5108、dp47)。这些分子不引起先前存在的igg反应性,并且因此显示低背景信号。图29b显示,ox40的所有价(2+1、3+1和4+1)均产生先前存在的igg干扰,其中信号高度存在2+1》3+1》4+1的略微增加趋势,此推测是由于空间位阻所致。
[0993]
文献(kim等人,mabs 2016,8,1536-1547)表明,与侵袭性疾病相关的若干蛋白酶能够在铰链区裂解抗体,由此生成抗铰链抗体的新表位。因此,我们制备在fab片段的ch1结构域中具有不同c末端氨基酸的分子,该fab片段与fc结构域的c末端融合且由此具有"游离"铰链样区。而原始双特异性抗体具有epksc(seq id no:163)的c末端氨基酸序列,产生具有epkscd(seq id no:164)以及epkscs(seq id no:165)的c末端氨基酸序列的变体。
[0994]
为评价抗原结合分子ox40(49b4)
×
fap(1g1a)(3+1)的c末端延伸变体,测试同一组人个体血清样品(图30a),并且减去其单独背景信号(图30c)。通过在没有药物分子的情况下实施测定来测量单独背景信号(图30b)。
[0995]
在分子ox40(moxr0916)
×
fap(1g1a)(3+1)(p1af4845)中,在上部铰链区的此位置生成天然天冬氨酸盐对c末端的延伸(图31b)。与具有游离c末端的分子p1ae8786相比,此修饰使得先前存在的igg反应性降低(图31a)。为完全消除先前存在的igg反应性,生成具有c末端丝氨酸的变体。此丝氨酸并不天然位于上部铰链区的此位置。如图31c中所示,分子p1af4851的丝氨酸对c末端的延伸使得先前存在的igg反应性的完全消除。
[0996]
图32a至32c显示呈2+1形式的各自的分子集,并且对以下的先前结果予以证实:与具有游离c末端epksc的分子ox40(49b4)
×
fap(1g1a)(2+1)(p1ae6840,图32a)相比,天冬氨酸盐的c末端延伸(具有epkscd末端的分子ox40(moxr0916)
×
fap(1g1a)(2+1),p1af4852,图32b)降低与血浆中的先前存在抗体的反应性,而c末端丝氨酸(具有epkscs末端的分子ox40(moxr0916)
×
fap(1g1a)(2+1),p1af4858,图32c)消除与血浆中的先前存在抗体的反应性。
[0997]
如图33中可见,三种其他分子实例加强如下发现:额外c末端丝氨酸完全消除先前存在的ada反应性(图33b、33d和33f),而c末端天冬氨酸盐降低不期望的干扰(图33a、33c和33e)。
[0998]
实例8
[0999]
在体外24小时人全血测定中评价fap靶向的抗ox40双特异性抗原结合分子的细胞因子释放风险
[1000]
为评价在人中第一次投药时与细胞因子释放相关的潜在安全性风险,对来自10名健康供体的新鲜未经稀释的人全血样品进行fap
×
ox40双特异性介导的细胞因子分泌的体
外非glp测试。使血液样品与浓度为0.1、1、10及50g/ml的fap
×
ox40双特异性分子一起温育24小时,并且测量血浆中细胞因子的随后释放。使用(一种抗egfr igg1mab)作为阴性比较物,并且使用(一种人源化抗cd52igg1,已知在超过90%的接受者中诱导首次输注反应(irr))作为阳性比较物。
[1001]
8.1材料和方法
[1002]
8.1.1.测试分子
[1003]
测试以下fap靶向的抗ox40双特异性抗原结合分子:
[1004]
c1:ox40(clc563)
×
fap(1g1a_epkscd)3+1(p1af6454),浓度c=5.8mg/ml,20mm his/hiscl,140mm nacl,ph 6.0,以-80℃接收,并且在解冻后储存在4℃下,
[1005]
c2:ox40(clc563)
×
fap(1g1a_epkscs)3+1(p1af6455),c=2.0mg/ml,20mm his/hiscl,140mm nacl,ph 6.0,以-80℃接收,并且在解冻后储存在4℃下,
[1006]
c3:ox40(49b4)
×
fap(4b9)4+1(p1ad4524、ro7194691),c=10.0mg/ml,20mm his/hiscl,140mm nacl,ph 6.0,以-80℃接收,并且在解冻后储存在4℃下,
[1007]
c4:ox40(clc563)
×
fap(1g1a_epkscs)4+1(p1af7217),c=9.73mg/ml,20mm his/hiscl,140mm nacl,ph 6.0,以-80℃接收,并且在解冻后储存在4℃下,
[1008]
c5:ox40(clc563)
×
fap(1g1a_epkscd)4+1(p1af7205),c=10.28mg/ml,20mm his/hiscl,140mm nacl,ph 6.0,以-80℃接收,并且在解冻后储存在4℃下,
[1009]
c6:ox40(49b4_k23e_k73e)
×
fap(1g1a_epkscs)4+1(p1af6457),c=10.40mg/ml,20mm his/hiscl,140mm nacl,ph 6.0,以-80℃接收,并且在解冻后储存在4℃下,以及
[1010]
c7:ox40(49b4_k23e_k73e)
×
fap(1g1a_epkscd)4+1(p1af6456),c=10.17mg/ml,20mm his/hiscl,140mm nacl,ph 6.0,以-80℃接收,并且在解冻后储存在4℃下。
[1011]
表33:所测试的fap靶向的抗ox40双特异性抗原结合分子
[1012][1013]
8.1.2.对照物质
[1014]
使用以下分子作为对照:
[1015]
低风险比较物:erbitux,即西妥昔单抗(cetuximab),重组抗egfr,嵌合igg1,merck serono,usa,原液5mg/ml,无菌液体,储存在4℃下。
[1016]
高风险比较物:即阿伦单抗(alemtuzumab),重组抗cd52,人源化igg1,genzyme,usa,原液10mg/ml,无菌液体,储存在4℃下。
[1017]
lps:源自马流产沙门菌(salmonella abortus)的脂多醣,sigma,产品号l5886,原液浓度:1mg/ml
[1018]
pbs:杜贝克氏磷酸盐缓冲液盐水(dulbecco's phosphate-buffered saline),gibco编号14190
[1019]
8.1.3.人全血测定
[1020]
将来自健康供体的静脉血收集在含有锂肝素作为抗凝剂的vacutainer管(roche medical center,basel,switzerland)中,并且保持在室温下直至起始测定(1-3小时内)。
[1021]
预验证实验揭示在3小时内处理血液的最佳性能条件,否则会发生红血球溶解。通过以一式三份向含有5μl待测试项目的96孔板的u底孔中添加195μl血液(1:40),最终测试项目的浓度范围为0,1至50g/ml抗原结合分子。选择此浓度范围以覆盖如自早期研究中已知的在施用p1ad4524后的预知暴露。
[1022]
这些条件确保关于实用性以及效率的最佳性能,以获得至少70 1血浆及足够的细胞以分别进行多细胞因子分析和细胞亚组列举。通过包括分别含有pbs或媒介物以及lps的对照来评估血细胞的内源性活化和反应性。在37℃与5%co2下温育24小时后,通过以1800g离心5min分离细胞以及血浆。使血浆样品在-80℃下储存,直至分析细胞因子含量。
[1023]
8.1.4.多重细胞因子测定
[1024]
对以1:5稀释的冷冻血浆样品实施细胞因子浓度的测定。预测试揭示,新鲜与解冻样品之间的细胞因子水平并无差异。使用人细胞因子化学发光测定试剂盒(aushon ciraplex,目录号101-269-1-ab)以及signatureplustm成像系统和cirasoft分析软件,通过elisa来测定分析物浓度。结果以pg/ml表示。为高于uloq浓度的值指派最高标准的浓度,如下所示:ifn,500pg/ml;il-6,2000pg/ml;il-8,4000pg/ml;tnfα,1000pg/ml。为低于lloq水平的样品值指派lloq浓度:ifn,0.24pg/ml;il-6,0.98pg/ml;il-8,1.95pg/ml;tnfα,1.95pg/ml。
[1025]
8.2结果和结论
[1026]
在此测定中,相对于阴性比较物ox40(49b4)
×
fap(4b9)4+1(p1ad4524,c3)导致分泌il-6、il-8,最大阳性反应为33%及33%,并且最大中值细胞因子分别上调1.0倍(il-6)以及2.73倍(il-8)。对于il-6在10μg/ml p1ad4524下且对于il-8在50μg/ml p1ad4524下观察到最高反应者频率和最大中值上调。
[1027]
相比之下,对于如本文所述的双特异性fap
×
ox40抗原结合分子组(c1、c4、c5、c6和c7),观察到il-6及il-8释放较少,c2除外,其在50μg/ml下的il-8反应者频率甚至略有升高(44%)。在所有测试分子中,c1具有最佳的细胞因子概况(最低il-6及il-8释放)。c1和c2显示无ifn反应者,而c3具有22%反应者。在所测试的所有构建体中,tnf-反应较低(0-11%)。
[1028]
图42a和42b显示在添加不同浓度的测试分子后,每名供体血液样品中的il-6分泌,il-8分泌示于图43a和43b中。
[1029]
实例9
[1030]
免疫原性风险评价
[1031]
使用体外dc:cd4
+
t细胞再刺激测定评价序列相关的免疫原性风险,并且使用对人igg1抗体耐受的转基因小鼠评价与作用模式相关的免疫原性。
[1032]
9.1 dc-t细胞测定
[1033]
fap
×
ox40双特异性抗原结合分子的序列相关的免疫原性使用dc:cd4
+
t细胞再刺
激测定进行,以用于评估来自30名健康人供体的pbmc的t细胞活化。所有蛋白质均在相同的30名健康供体中进行测试,并且通过ifn fluorospot评估每一条件诱导的cd4
+
t细胞反应。
[1034]
9.1.1.材料
[1035]
作为对照,根据制造商的推荐,在无菌条件下重构钥孔帽贝血蓝蛋白(klh)且以一次性使用等分试样储存在-80℃下。包括贝伐珠单抗和/或阿达木单抗作为基准蛋白质。由f.hoffmann-la roche ag供应,并且以一次性使用等分试样储存在+4℃。对于dc刺激阶段和apc再刺激阶段二者,均以300nm的最终浓度使用。
[1036]
所测试的fap
×
ox40双特异性抗原结合分子为ox40(clc563)
×
fap(1g1a_epkscd)3+1(p1af6454)以及ox40(clc563)
×
fap(1g1a_epkscs)3+1(p1af6455)。在早期实验中,也测试p1ad4524。
[1037]
对于供体细胞,所有样品均根据由当地rec(研究伦理委员会)批准的伦理方案来收集,并且在样品捐赠之前自每一供体获得书面知情同意书。来自健康供体的pbmc在抽血六小时内自全血制备。使细胞冷冻保存在气相氮中,直至用于测定中。通过利用阳性对照(诸如klh)活化7天来分析每一pbmc制剂的质量及功能,以评估原初t细胞反应。30名健康供体的mhc-ii类同种异型广泛覆盖多样性,并且本研究中的hla-drb1频率与世界群体匹配。
[1038]
9.1.2.方法
[1039]
9.1.2.1dc:cd4+t细胞再刺激测定(根据lonza方案)
[1040]
通过磁珠选择(miltenyi biotec)自冷冻pbmc样品分离单核球,并且使用gm-csf以及il4使其分化成不成熟dc(idc)。接着收获idc,洗涤且在37℃下加载每一个别测试蛋白质持续4小时。接着添加含有tnf以及il-1b的dc成熟混合剂再持续40-42小时,以使dc活化/成熟(mdc)。通过流式细胞术评估关键dc表面标志物(cd11c、cd14、cd40、cd80、cd83、cd86、cd209和hla-dr)在不成熟及成熟阶段中的表达,以确保dc在t细胞相互作用之前经活化。接着使1
×
105个mdc与1
×
106个自体cd4+t细胞(通过负磁选分离)在潮湿气氛中在37℃、5%co2下共培养6天。在第6天,使用负向磁珠选择自pbmc分离自体单核球,并且加载最初用于加载dc的所选蛋白质/肽。在潮湿气氛中在37℃、5%co2下温育4小时后,将5
×
104个单核球/孔连同相应的dc:cd4共培养物以一式四份(2.5
×
105个cd4
+
t细胞/孔)加入到抗inf/抗il-5预包覆的fluorospot板(mabtech)。在潮湿气氛中使fluorospot板在37℃、5%co2下温育40-42小时。温育后,使用内部程序使fluorospot板显色,并且使用iristm fluorospot读数器(mabtech)在每一测试条件下对每一细胞因子评估每孔中的斑点形成细胞(sfc)。
[1041]
也在不成熟及成熟阶段对单核球源性dc实施表面标志物qc检查,以确定测试化合物对dc分化的任何可能的影响,并且容许在随后与cd4
+
t细胞共培养之前评估dc的质量。使用荧光标记抗体和easycyte8ht流式细胞仪,通过流式细胞术评估表面标志物。
[1042]
9.1.2.2数据管理和qc
[1043]
对所有实验数据实施有据可查的qc和qa程序。使用excel及统计学程序"r"进行后续数据分析,使用graphpad prism用于数据的图形表示。
[1044]
9.1.2.3统计学分析
[1045]
反应频率:以供体水平分析数据,以确定每一个别测试条件是否在每一供体中诱
导显著的t细胞反应。利用任意分布重采样(distribution free resampling,dfr)方法(moodie等人,2010)评价因应于每一测试条件的每孔的斑点形成单位(sfu)(即每孔的细胞因子分泌细胞的数目)。dfr方法是非参数统计测试,其将每一供体的每一测试条件与参照条件进行比较,并且指示测试条件与参照条件之间的差异是否在统计学上显著。此方法的两个所述变化形式为dfr(eq)以及dfr(2
×
)。
[1046]
dfr(eq)利用置换重采样且容许最大假阳性率为5%(p≤0.05)且最小为1%(p≤0.01)。dfr(2
×
)用bootstrap检验替代置换重采样且经由应用更严格的虚无假设将假阳性率控制至《1%(p《0.01),所述虚无假设并入最小反应临限值,其中实验结果必须最少为相关阴性对照的2倍,以便判断为在统计学上显著。这两种dfr方法与westfall-young步降max t方法(单向)结合,以计算p值并考虑多重比较。在此项目中,使用dfr(2
×
)确定统计学上显著的cd4
+
t细胞反应。
[1047]
反应强度:通过将测试条件下的sfu/孔除以空白(仅测定培养基)的sfu/孔,计算每一供体在每一测试条件下的刺激指数(si),以突出每一供体中t细胞反应的量级。接着计算每一测试条件的30名供体群体的几何平均值以及中值和四分位距。
[1048]
9.1.2.4免疫原性的群体分析
[1049]
为评估每一样品对整个30名供体群体的影响,计算每一供体在每一测试条件下的刺激指数(si)。通过将测试条件下的sfu/孔除以空白(仅测定培养基)计算刺激指数,以突出每一供体中t细胞反应的量级。接着计算每一测试条件的30名供体群体的几何平均值以及中值和四分位距。
[1050]
9.1.3.结果和结论
[1051]
klh(阳性对照)是cd4+t细胞的强效刺激剂且在大多数供体中诱导高ifn(100%)以及il-5(93.3%)反应,而贝伐珠单抗(avastin,阴性对照)基于ifn和il-5读出显示低反应。化合物p1af6454和p1af6455二者均诱导对ifn(p1af6454:6.6%及p1af6455:10%)(图44a和44b)以及对il-5(二者均为6.6%)的低供体t细胞反应频率。基于先前验证实验,将低反应者频率的临限值设置为高于10%;因此,所测试的两种化合物均视为与序列相关的免疫原性风险较低相关。
[1052]
相比之下,与新的fap
×
ox40抗原结合分子p1af6454和p1af6455相比,p1ad4524诱导较高的对inf的供体t细胞反应频率(33%)以及较高的inf刺激(刺激指数为2.5)(图45a和45b)。
[1053]
9.2评估fap-ox40候选者在对人igg1抗体免疫耐受的转基因小鼠中引发抗药物抗体(ada)的潜力的4周免疫原性研究
[1054]
本研究的目的为通过在c57bl/6-tg(higg1,k,l)转基因小鼠模型中测试fap-ox40分子来研究其免疫原性潜力。与c57bl/6野生型小鼠相比,c57bl/6-tg(higg1,k,l)转基因小鼠具有转基因非重排人ig重链和轻链基因座。在b细胞分化时,这些转基因基因座经历功能性ig基因重排,随后b细胞表达可溶性人igg1。因此,c57bl/6-tg(higg1,k,l)转基因小鼠的免疫系统对大范围的人igg1抗体耐受,并且可用作体内模型以评估基于igg1的药物化合物的免疫原性,并潜在地预测在人中的药物特异性免疫原性。对于每一测试项目,在第1天、第5天、第8天、第12天、第15天、第19天及第22天,每次注射向10只野生型小鼠以及10只转基因小鼠皮下施用10μg/小鼠。在1天、第8天、第15天、第22天及第29天制备血液样品以进行
igg测量,以监测潜在ada反应的进展。使用对所注射化合物具有特异性的小鼠igg抗体的基于elisa的检测作为免疫学读出。
[1055]
9.2.1.材料
[1056]
所测试的fap
×
ox40双特异性抗原结合分子为ox40(clc563)
×
fap(1g1a_epkscd)3+1(p1af6454)、ox40(clc563)
×
fap(1g1a_epkscs)3+1(p1af6455)以及ox40(49b4)
×
fap(4b9)4+1(p1ad4524)。
[1057]
该实验中所用的小鼠品系为c57bl/6野生型小鼠以及-c57bl/6-tg(higg1,k,l)转基因小鼠。
[1058]
9.2.2.方法
[1059]
elisa测试:将nunc maxisorp平底96孔elisa板用每孔100μl 1μg/ml在nahco
3 100mm缓冲液中的测试化合物在+4℃下包覆过夜。第二天,将elisa板用pbs+0.05%tween洗涤三次。对于封阻,将100μl pbs+2%bsa加入到每一孔中且使elisa板在室温下温育两小时。在圆底稀释板的第一列中,将血清以1:50稀释于pbs+1%fbs中,之后为1:3连续稀释步骤,在pbs+1%fbs中稀释七次。将elisa板用pbs+0.05%tween洗涤三次,并且将100μl经稀释血清自稀释板转移至elisa板中。在室温下温育两小时后,将elisa板用pbs+0.05%tween洗涤三次。为检测经免疫小鼠血清中的小鼠抗药物抗体(ada),每孔添加100μl以1:2000稀释于pbs+1%bsa中的结合的山羊抗小鼠igg碱性磷酸酶(jackson目录号115-055-071)。在室温下温育一小时后,将elisa板用pbs+0.05%tween洗涤三次。每孔添加100μl即用型底物磷酸对硝基苯酯(life technologies目录号002212),并且在室温下温育十分钟后,利用versamax elisa读数仪读取405nm下的光学密度(od)作为终点测量值。
[1060]
统计学分析:此测定的主要读出在本质上视为二元的(不同的免疫反应对无明显反应),这是由于来自elisa的od变化无法在不同的抗体检测测定之间进行比较,并且由此容易地转化为通用定量测量。决定将重点放在每个测试项目两个群组的十只小鼠中的反应频率上。为可再现地鉴别免疫反应,我们定义高于基线以称为阳性反应的6σ标准。将在至少一个时间点达到高于背景6个标准偏差(sd)的od值的动物计为反应者。为确定平均背景水平及背景标准偏差,我们在第1天(治疗前,n=20)验证没有证据表明两种基因型的基线水平或分布有明显的初始差异(分别t检验和f检验,p值>0.05)后,将转基因及野生型组读出合并。如在几个样品数据集中所证实,通过此方法鉴别的反应者与通过人直觉自图表所鉴别的反应者非常一致。基于二项分布模型,计及所观察到的反应数和组大小(n=10),计算反应率的95%置信区间。以1:50的稀释度获取elisa od值,在自所执行的稀释曲线确保基线清晰且没有(基质效应)后,得到最大信号。使用定制r脚本直接自读板仪形式输入od值,用于处理体内免疫原性数据、对其进行分析并使其可视化。
[1061]
9.2.3.结果和结论
[1062]
用p1af6455治疗的两个单独小鼠组的elisa结果示于图46中。这些elisa分析揭示,6/10(60%)的c57bl/6野生型小鼠引发ig免疫反应,如通过免疫小鼠血清中存在针对此化合物的ada所测量。鉴于p1af6455是完全人igg1抗体且因此预期会被鼠类免疫系统视为外源的,因此预计会出现此显著的免疫反应。相比之下,0/10(0%)的c57bl/6-tg(higg1,k,l)转基因小鼠产生针对p1af6455的抗体反应。
[1063]
用p1af6454治疗的两个单独小鼠组的elisa结果示于图47中。这些elisa分析揭
示,0/10(0%)的c57bl/6野生型小鼠引发ig免疫反应,如通过免疫小鼠血清中存在针对此化合物的ada所测量。与c57bl/6野生型小鼠中的情况相当,在c57bl/6-tg(higg1,k,l)转基因小鼠中未观察到针对p1af6454的ada反应者(0/10(0%))。此结果指示,p1af6454在c57bl/6野生型小鼠以及c57bl/6-tg(higg1,k,l)转基因小鼠中均不产生抗体反应。
[1064]
用p1ad4524治疗的两个单独小鼠组的elisa结果示于图48中。这些elisa分析揭示,5/8(62.5%)的c57bl/6野生型小鼠引发ig免疫反应,如通过免疫小鼠血清中存在针对此化合物的ada所测量。鉴于p1ad4524是完全人igg1抗体且因此预期会被鼠类免疫系统视为外源的,因此预计会出现此显著的免疫反应。6/9(66.7%)的c57bl/6-tg(higg1,k,l)转基因小鼠产生针对ro7194691的抗体反应,这突出在人中的高免疫原性风险。
[1065]
体内免疫原性研究展示p1ad4524的高免疫原性风险,并且相比之下,化合物p1af6454和p1af6455诱导体液性免疫反应的倾向较低。所观察到的差异可能归因于三种所测试化合物之间序列性质的改变。p1af6454和p1af6455中的这些序列改变可能影响化合物源性肽的mhc ii类呈现或可能产生无法诱导免疫原性t细胞以及b细胞反应的非免疫原性肽序列。
[1066]
实例10
[1067]
fap
×
ox40双特异性抗原结合分子与ceacam5 tcb的组合在人源化小鼠中的mkn45异种移植物中的功效研究
[1068]
此处所述的功效研究的目的在于,在完全人源化的nsg小鼠中选择就肿瘤消退而言在体内最强效的fap
×
ox40双特异性抗原结合分子。
[1069]
人mkn45细胞(人胃癌)最初获自atcc,并且扩增后保藏在glycart内部细胞库。细胞在含有10%fcs的dmem中在37℃、5%co2的水饱和气氛中培养。体外传代7用于皮下注射,存活率为98%。人成纤维细胞nih-3t3最初获自atcc,在roche nutley进行工程改造以表达人fap,并在含10%小牛血清、1x丙酮酸钠和1.5g/ml嘌呤霉素的dmem中培养。克隆39以体外传代数5和》95%的存活率使用。
[1070]
将混合有50微升matrigel的50微升细胞悬液(1x10
6 mkn45细胞+1x10
6 3t3-hufap)用22g至30g针头皮下注射到麻醉小鼠的侧面。
[1071]
根据规定指南(gv-solas;felasa;tierschg),将实验开始时为4-5周龄的雌性nsg小鼠(jackson实验室)维持在不含特定病原体的条件下,日循环为12h光照/12h黑暗。实验研究方案经过地方政府的审查和批准(p2011/128)。到达之后,将动物维持一周以适应新环境并进行观察。定期进行连续健康状态监测。
[1072]
对雌性nsg小鼠i.p.注射15mg/kg的白消安,接着在一天后i.v.注射从脐带血中分离的1x105个人造血干细胞。在干细胞注射后第14-16周,对小鼠进行舌下放血并且通过流式细胞术针对成功的人源化对血液进行分析。将有效移植的小鼠根据它们的人t细胞频率随机化为不同的处理组。此时,如所述用肿瘤/成纤维细胞混合物注射小鼠(图49),并且在肿瘤大小达到大约200mm3时(第29天),每周用化合物或组氨酸缓冲液(媒介物)治疗一次。向所有小鼠静脉注射200μl适当的溶液。为了获得每200μl适量的化合物,在需要时用组氨酸缓冲液稀释贮备溶液(表34)。
[1073]
表34:体内实验中所用的组合物
[1074][1075][1076]
使用卡尺每周测量肿瘤生长两次,并按下式计算肿瘤体积:
[1077]
tv:(w2/2)xl(w:宽度,l:长度)
[1078]
在第50天,研究终止。
[1079]
图50a显示肿瘤生长动力学(平均值,+sem),并且图50b显示研究终止时每个个体小鼠以及组与基线(治疗开始)相比的肿瘤体积变化百分比。如本文所述,含有clc563克隆的呈3+1形式的fap
×
ox40构建体与ceacam5-tcb组合显现最佳的抗肿瘤活性。在该治疗组中,8只小鼠中有5只显示肿瘤消退(瀑布图)。
[1080]
***
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1