生物体功能调整剂、表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂、脂联素产生促进剂、功能性食品、化妆料以及生物体功能调整剂的制造方法与流程
1.本发明涉及一种生物体功能调整剂、表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂、脂联素(adiponectin)产生促进剂、功能性食品、化妆料以及生物体功能调整剂的制造方法。
背景技术:
2.国际公开第2017/014149号(专利文献1)、woo等人的论文(非专利文献1)以及小林等人的发表(非专利文献2)报告了胶原蛋白肽具有抗肥胖作用。日本特开2018-023326号公报(专利文献2)公开了通过用乳酸菌使胶原蛋白发酵而得到胶原蛋白肽。
3.现有技术文献
4.专利文献
5.专利文献1:国际公开第2017/014149号
6.专利文献2:日本特开2018-023326号公报。
7.非专利文献
8.非专利文献1:m woo et al.,"anti-obesity effects of collagen peptide derived from skate(raja kenojei)skin through regulation of lipid metabolism",marine drugs,2018,vol.16(9),306
9.非专利文献2:小林等人,“鲑皮胶原蛋白肽经口摄取时的肝脏的基因表达变动与抗肥胖效果”、2012年日本食品科学工学会大会讲演集,2012年8月29日,vol.59th page.97。
技术实现要素:
10.发明所要解决的问题
11.上述专利文献2未公开通过用曲使胶原蛋白、明胶以及明胶分解物中的任意种发酵而得到胶原蛋白肽。而且,在上述专利文献1、上述非专利文献1以及上述非专利文献2中报告过具有抗肥胖作用的胶原蛋白肽不是通过用曲使胶原蛋白、明胶以及明胶分解物中的任意种发酵而得到的胶原蛋白肽(以下记作“发酵胶原蛋白肽”)。即,发酵胶原蛋白肽所具有的针对生物体的作用效果尚未阐明。
12.鉴于上述实际情况,本发明的目的在于提供包含具有选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子(adipocytokine)量的调整作用构成的组中的至少一种作用的发酵胶原蛋白肽的生物体功能调整剂、表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂、脂联素产生促进剂、功能性食品、化妆料以及生物体功能调整剂的制造方法。
13.用于解决问题的方案
14.本发明人等发现,通过用曲使四足动物的皮、皮肤、骨、软骨和肌腱、以及鱼的骨、皮以及鳞等包含胶原蛋白的原料、胶原蛋白、明胶以及明胶分解物中的任意种发酵而得到的发酵胶原蛋白肽具有选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种作用,完成了本发明。
15.即,本发明具有以下所述的特征。
16.〔1〕本发明的生物体功能调整剂包含发酵胶原蛋白肽,上述发酵胶原蛋白肽具有选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种作用。
17.〔2〕优选的是,上述发酵胶原蛋白肽包含胶原蛋白肽和选自由异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛构成的组中的至少一种的第一化合物。
18.〔3〕优选的是,上述发酵胶原蛋白肽包含胶原蛋白肽和选自由异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛构成的组中的至少三种的第一化合物。
19.〔4〕本发明的表皮代谢促进剂包含上述生物体功能调整剂。
20.〔5〕本发明的脂肪蓄积抑制剂包含上述生物体功能调整剂。
21.〔6〕本发明的脂联素产生促进剂包含上述生物体功能调整剂。
22.〔7〕本发明的脂肪分解促进剂包含上述生物体功能调整剂。
23.〔8〕本发明的功能性食品包含上述生物体功能调整剂。
24.〔9〕本发明的化妆料包含上述生物体功能调整剂。
25.〔10〕本发明的生物体功能调整剂的制造方法为包含发酵胶原蛋白肽的生物体功能调整剂的制造方法,所述生物体功能调整剂的制造方法包括:准备包含曲霉菌的曲和胶原蛋白原料的工序;以及通过用上述曲使上述胶原蛋白原料发酵,得到包含上述发酵胶原蛋白肽的生物体功能调整剂的工序,上述曲霉菌的菌种是属于曲霉(aspergillus)属的菌种,上述胶原蛋白原料是下述原料中的至少任意种:选自由以下的第一组~第六组构成的组中的至少一种;从选自上述组中的至少一种中提取出的胶原蛋白;通过处理上述胶原蛋白而得到的明胶;以及通过水解上述明胶而得到的明胶分解物。
26.第一组:由牛的皮、皮肤、骨、软骨以及肌腱构成的组。
27.第二组:由猪的皮、皮肤、骨、软骨以及肌腱构成的组。
28.第三组:由羊的皮、皮肤、骨、软骨以及肌腱构成的组。
29.第四组:由鸡的皮、皮肤、骨、软骨以及肌腱构成的组。
30.第五组:由鸵鸟的皮、皮肤、骨、软骨以及肌腱构成的组。
31.第六组:由鱼的骨、皮以及鳞构成的组。
32.〔11〕本发明的生物体功能调整剂包含通过用曲使胶原蛋白原料发酵而制造的发酵胶原蛋白肽。
33.发明效果
34.根据上述内容,可以提供包含具有选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种作用的发酵胶原蛋白肽的生物体功能调整剂、表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂、脂联素产生促进剂、功能性食品、化妆料以及生物体功能调整剂的制造方法。
附图说明
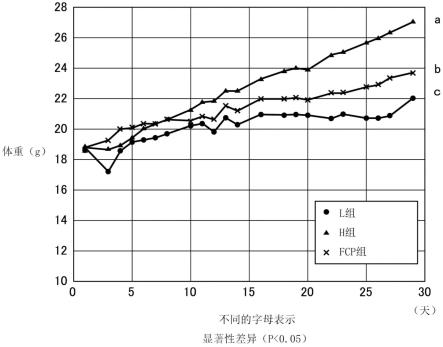
35.图1是表示第一试验中的各组小鼠的体重的变化的图表。
36.图2是表示第一试验中的各组小鼠的肠管膜脂肪量的图表。
37.图3是表示第一试验中的各组小鼠的肾脏周围脂肪量的图表。
38.图4是表示第一试验中的各组小鼠的精巢周围脂肪量的图表。
39.图5是表示第一试验中的各组小鼠的总内脏脂肪量的图表。
40.图6是表示第一试验中的各组小鼠的血清中的瘦素(leptin)浓度的图表。
41.图7是表示第一试验中的各组小鼠的血清中的脂联素浓度的图表。
42.图8是表示第一试验中的各组小鼠的肝脏中的fas活性的强度的图表。
43.图9是表示第一试验中的各组小鼠的肝脏中的cpt活性的强度的图表。
44.图10是表示第二试验中的各组小鼠的血清中的瘦素浓度的图表。
45.图11是表示第二试验中的各组小鼠的血清中的脂联素浓度的图表。
46.图12是表示第七试验中的各组小鼠的体重的变化的图表。
47.图13是表示第八试验中的各组小鼠的体重的图表。
48.图14是表示第八试验中的各组小鼠的肠管膜脂肪量的图表。
49.图15是表示第八试验中的各组小鼠的肾脏周围脂肪量的图表。
50.图16是表示第八试验中的各组小鼠的精巢周围脂肪量的图表。
51.图17是表示第八试验中的各组小鼠的总内脏脂肪量的图表。
52.图18是表示第八试验中的各组小鼠的血清中的血糖值的图表。
53.图19是表示第八试验中的各组小鼠的血清中的胰岛素量的图表。
54.图20是表示第八试验中的各组小鼠的血清中的瘦素浓度的图表。
55.图21是表示第八试验中的各组小鼠的肝脏中的fas活性的强度的图表。
56.图22是表示第八试验中的各组小鼠的肝脏中的cpt活性的强度的图表。
具体实施方式
57.以下,将进一步详细地说明本发明的实施方式(以下,也记作“本实施方式”)。在此,本说明书中“a~b”这样的形式的描述是指范围的上限和下限(即a以上且b以下),并且在没有记载a的单位,仅记载b的单位的情况下,a的单位与b的单位相同。
58.就本说明书中的“生物体功能调整剂”、“表皮代谢促进剂”、“脂肪蓄积抑制剂”、“脂肪分解促进剂”、“脂联素产生促进剂”以及“发酵胶原蛋白肽”而言,其状态有时为粉末等固体,也有时为溶解于水的水溶液等液体。而且,本说明书中的“发酵胶原蛋白肽”是指用曲使后述的胶原蛋白原料发酵而得到的肽混合物。本说明书中的“发酵”是指利用曲中所含的曲霉菌所具有的活性而由原料生成有益的有机物的整个过程,与利用微生物所具有的活性而由原料生成非有益的有机物的“腐败”区别开来。
59.关于本说明书中的“明胶”这一术语,有时分别用于指代物质名、明胶凝胶以及明胶溶液。此外,关于“胶原蛋白肽”这一术语,也与上述明胶同样地,有时分别用于指代物质名和胶原蛋白肽溶液。
60.本说明书中的“胶原蛋白原料”有时用于统称如下情况:选自由以下的第一组~第六组构成的组中的至少一种“其物质本身”;从选自由以下的第一组~第六组构成的组中的
至少一种中提取出的“胶原蛋白”;通过使用热水提取等公知的方法处理上述胶原蛋白而得到的“明胶”;以及通过水解上述明胶而得到的“明胶分解物”。而且,在上述明胶的“水解”中,使用酸的水解、使用碱的水解、使用酶的水解以及使用加热的水解均包含在内。
61.第一组:由牛的皮、皮肤、骨、软骨以及肌腱构成的组。
62.第二组:由猪的皮、皮肤、骨、软骨以及肌腱构成的组。
63.第三组:由羊的皮、皮肤、骨、软骨以及肌腱构成的组。
64.第四组:由鸡的皮、皮肤、骨、软骨以及肌腱构成的组。
65.第五组:由鸵鸟的皮、皮肤、骨、软骨以及肌腱构成的组。
66.第六组:由鱼的骨、皮以及鳞构成的组。
67.〔生物体功能调整剂〕
68.本实施方式的生物体功能调整剂包含发酵胶原蛋白肽。上述发酵胶原蛋白肽具有选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种作用。具备这样的特征的生物体功能调整剂可以对生物体起到选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种作用(以下,也称为“生物体功能调整作用”)。
69.<发酵胶原蛋白肽>
70.如上所述,本实施方式的生物体功能调整剂包含发酵胶原蛋白肽。就上述发酵胶原蛋白肽而言,优选的是,包含胶原蛋白肽和选自由异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛构成的组中的至少一种的第一化合物。就上述发酵胶原蛋白肽而言,更优选的是,包含胶原蛋白肽和选自由异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛构成的组中的至少三种的第一化合物。由此,能够对生物体更充分起到选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种生物体功能调整作用。此外,如后所述,本实施方式的生物体功能调整剂能够通过用曲使胶原蛋白原料发酵而制造。即,本实施方式的生物体功能调整剂是包含发酵胶原蛋白肽的生物体功能调整剂。
71.在此,就上述发酵胶原蛋白肽而言,像以往的胶原蛋白肽所具有的那样的臭味(所谓胶原蛋白臭)受到上述第一化合物抑制。因此,上述生物体功能调整剂能将除臭处理等简化,或者不进行除臭处理等,例如可以用于后述的表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂、脂联素产生促进剂、功能性食品、化妆料。
72.(胶原蛋白肽)
73.如上所述,发酵胶原蛋白肽优选包含胶原蛋白肽。该胶原蛋白肽在表观上与以往公知的胶原蛋白肽相同。即,发酵胶原蛋白肽中所含的胶原蛋白肽在表观上作为肽混合物,可以包含通过对胶原蛋白或明胶进行以往公知的处理而得到的二肽、三肽、寡肽及多肽等各种肽。其中,如上所述,发酵胶原蛋白肽能够通过用曲使胶原蛋白原料发酵而得到。因此,上述发酵胶原蛋白肽中所含的胶原蛋白肽能够通过用曲使胶原蛋白原料发酵而得到,并与后述的第一化合物一起产生。
74.〈重均分子量〉
75.发酵胶原蛋白肽中所含的胶原蛋白肽的重均分子量优选为20000以下。在上述胶
原蛋白肽的重均分子量为20000以下的情况下,生物体功能调整剂可以以不进行追加处理的方式简便地应用于表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂、脂联素产生促进剂、功能性食品以及化妆料的各用途。上述胶原蛋白肽的重均分子量更优选为10000以下,进一步优选为6000以下。上述胶原蛋白肽的重均分子量的下限值为76。在上述胶原蛋白肽的重均分子量为上述的范围的情况下,生物体功能调整剂能够在表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂、脂联素产生促进剂、功能性食品或化妆料的各用途中,充分起到对生物体的上述作用。
76.在此,上述生物体功能调整剂中所含的上述胶原蛋白肽的重均分子量可以通过在以下的测定条件下执行尺寸排阻层析色谱(sec)而求出。需要说明的是,本发明人等已经确认了本测定方法对于超过12000的分子量的测定也具有稳健性。
77.设备:高效液相色谱(hplc)(tosoh株式会社制)。
78.色谱柱:tskgel(注册商标)g2000sw
xl
。
79.色谱柱温度:40℃。
80.洗脱液:45质量%乙腈(包含0.1质量%tfa)。
81.流速:1.0ml/分钟。
82.注入量:10μl。
83.检测:uv214nm。
84.分子量标记物:使用以下五种。
85.细胞色素(cytochrom)c mw:12000。
86.抗蛋白酶肽(aprotinin)mw:6500。
87.杆菌肽(bacitracin)mw:1450。
88.甘氨酸-甘氨酸-酪氨酸-精氨酸(gly-gly-tyr-arg)mw:451。
89.甘氨酸-甘氨酸-甘氨酸(gly-gly-gly)mw:189。
90.(第一化合物)
91.如上所述,发酵胶原蛋白肽优选包含选自由异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛构成的组中的至少一种的第一化合物,更优选包含至少三种上述第一化合物。上述发酵胶原蛋白肽中,第一化合物可被认为是通过用曲使胶原蛋白原料发酵而与胶原蛋白肽一起产生的。第一化合物可以作为标记物发挥功能,该标记物表示上述发酵胶原蛋白肽是通过用曲使胶原蛋白原料发酵而得到的物质。
92.发酵胶原蛋白肽作为第一化合物有时包含异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛中的任一种的第一化合物。发酵胶原蛋白肽作为第一化合物有时包含异戊醛和1-辛烯-3-醇,有时包含异戊醛和苯乙醛,有时包含异戊醛和甲硫基丙醛,有时包含1-辛烯-3-醇和苯乙醛,有时包含1-辛烯-3-醇和甲硫基丙醛,有时包含苯乙醛和甲硫基丙醛。
93.发酵胶原蛋白肽作为第一化合物有时包含异戊醛、1-辛烯-3-醇以及苯乙醛,有时包含异戊醛、1-辛烯-3-醇以及甲硫基丙醛,有时包含异戊醛、苯乙醛以及甲硫基丙醛,有时包含1-辛烯-3-醇、苯乙醛以及甲硫基丙醛。发酵胶原蛋白肽也有时包含四种(异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛)第一化合物。在这些情况下,生物体功能调整剂能够对生物体更充分起到选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分
解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种作用。
94.(异戊醛)
95.异戊醛是也被称为异缬草醛、3-甲基丁醛(3-methylbutanal)或3-甲基丁醛(3-methylbutyraldehyde)的化合物,是从以往作为香料(食品添加剂)等被利用的化合物。
96.(1-辛烯-3-醇)
97.1-辛烯-3-醇为不饱和醇的一种,是从以往起已知的对松茸的香气有贡献的成分的化合物。
98.(苯乙醛)
99.苯乙醛为芳香族醛的一种,是从以往起作为香水(fragrances)和香精(flavors)的调合原料等被利用的化合物。
100.(甲硫基丙醛)
101.甲硫基丙醛(methional)为有机硫化合物的一种,是也被称为3-甲基硫代-1-丙醛的化合物。甲硫基丙醛是从以往起已知的酱油中所含的化合物。而且,甲硫基丙醛具有减弱肉和鱼的腥味的作用。
102.(含量)
103.第一化合物优选作为其总量(至少一种或其以上的合计),在上述生物体功能调整剂中包含0.05ppm以上。即,上述生物体功能调整剂优选包含0.05ppm以上的上述第一化合物。而且,第一化合物更优选作为其总量在上述生物体功能调整剂中包含0.4ppm以上。即,上述生物体功能调整剂更优选包含0.4ppm以上的上述第一化合物。上述生物体功能调整剂中的第一化合物的含量的下限值没有特别限定,优选作为第一化合物的总量包含0.01ppm以上。第一化合物的含量的上限值也没有特别限定,优选作为第一化合物的总量为5ppm以下。
104.上述生物体功能调整剂中所含的上述第一化合物的定性和定量可以根据以下方式求出。首先,通过后述的制造方法得到生物体功能调整剂的干燥粉末。进而,通过将上述干燥粉末0.5g溶解于4.5ml的ro水,得到测定用样品。接着,将上述测定用样品投入气相色谱质量分析仪(商品名:“7890a gc系统”、安捷伦科技公司制,以及商品名:“jms-q1050gc”、日本电子株式会社制),使其气化后,使用作为载气的超高纯度氦气使其移动到上述分析仪所具备的色谱柱中,由此对上述测定用样品中所含的成分按化合物逐一分离。进而,用上述分析仪所具备的检测器检测上述化合物,通过对由上述检测器所得到的数据(光谱数据)和设为标准的数据进行比较,能够进行上述第一化合物的定性。同时,通过基于由上述检测器所得到的上述光谱数据(峰面积),能够进行上述第一化合物的定量。
105.〔表皮代谢促进剂〕
106.本实施方式的表皮代谢促进剂包含上述生物体功能调整剂。上述表皮代谢促进剂通过上述生物体功能调整剂所具有的表皮代谢促进作用,能够促使例如皮肤表面(表皮中)的黑素(melanin)颗粒从皮肤表面排出而不以斑点、雀斑等形式留存。具体而言,上述表皮代谢促进剂能够使选自由谷氨酰胺转移酶1(tgm1)、内披蛋白(ivl)以及角蛋白10(krt10)构成的组中的至少一种基因的表达量亢进。已知这些基因有助于构成表皮的各层(角质层、颗粒层、有棘层以及基底层)的成熟分化,由此可以认为,通过上述基因的表达亢进,表皮中
的代谢(所谓再生(turnover))得到促进。而且,在表皮中的代谢得到促进的基础上,有可能会得到皮肤的保湿效果、皮肤的皱纹预防和/或皱纹改善效果等。
107.上述表皮代谢促进剂中的生物体功能调整剂的浓度有时为0.01~100质量%。上述表皮代谢促进剂中的生物体功能调整剂的浓度由于第一化合物的含量极其微少而被设为意味着上述生物体功能调整剂中的胶原蛋白肽的浓度的值。因此,上述表皮代谢促进剂中的生物体功能调整剂的浓度可以通过以往公知的胶原蛋白肽的浓度测定方法而求出。例如,上述表皮代谢促进剂中的生物体功能调整剂的浓度可以通过利用氯胺t法对胶原蛋白肽中的羟脯氨酸的质量百分比进行测定而求出。而且,也可以通过使用氨基酸分析仪对胶原蛋白肽中的羟脯氨酸的质量百分比进行测定而求出。
108.〔脂肪蓄积抑制剂〕
109.本实施方式的脂肪蓄积抑制剂包含上述生物体功能调整剂。上述脂肪蓄积抑制剂通过上述生物体功能调整剂所具有的脂肪蓄积抑制作用,能得到在肝脏、肠管、肾脏、精巢等中的脂肪(所谓内脏脂肪)的蓄积抑制效果。此外,上述脂肪蓄积抑制剂基于上述生物体功能调整剂所具有的生物体内的脂肪细胞因子量的调整作用,通过已知作为食欲抑制激素的瘦素的血中浓度减少作用、以及已知与体内的内脏脂肪量逆相关的脂联素的血中浓度增加作用,能得到脂肪蓄积抑制效果。上述瘦素和脂联素作为被分类为由脂肪细胞分泌的脂肪细胞因子的蛋白质是公知的。即,本实施方式的脂联素产生促进剂包含上述生物体功能调整剂。
110.上述脂肪蓄积抑制剂中的生物体功能调整剂的浓度有时为0.01~100质量%。上述脂联素产生促进剂中的生物体功能调整剂的浓度也可以设为0.01~100质量%。上述脂肪蓄积抑制剂和脂联素产生促进剂中的生物体功能调整剂的浓度由于第一化合物的含量极其微少而被设为意味着上述生物体功能调整剂中的胶原蛋白肽的浓度的值。因此,上述脂肪蓄积抑制剂和脂联素产生促进剂中的生物体功能调整剂的浓度可以采用与上述表皮代谢促进剂中的生物体功能调整剂的浓度测定方法相同的方法测定。
111.〔脂肪分解促进剂〕
112.本实施方式的脂肪分解促进剂包含上述生物体功能调整剂。上述脂肪分解促进剂通过上述生物体功能调整剂所具有的脂肪分解促进作用,能得到在肝脏、肠管、肾脏、精巢等中的脂肪(所谓内脏脂肪)的分解促进效果。上述脂肪分解促进剂中的生物体功能调整剂的浓度有时为0.01~100质量%。上述脂肪分解促进剂中的生物体功能调整剂的浓度由于第一化合物的含量极其微少而被设为意味着上述生物体功能调整剂中的胶原蛋白肽的浓度的值。因此上述脂肪分解促进剂中的生物体功能调整剂的浓度可以采用与上述表皮代谢促进剂中的生物体功能调整剂的浓度测定方法相同的方法测定。
113.<用法和用量等>
114.在此,上述的表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂以及脂联素产生促进剂作为添加剂、医药品或医药部外品等,能够以经口或非经口的各种形态来给药。作为其形态,在经口给药的情况下,例如可以设为片剂、颗粒剂、胶囊剂、粉剂、液剂、悬浊制剂、乳化制剂、膏剂等剂型。而且也可以将上述剂型混合于后述的功能性食品。
115.上述表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂以及脂联素产生促进剂在非经口性给药的情况下,例如可以设为向体内的注入剂、注射剂、经皮剂(涂布剂、贴剂以
及气雾剂)、坐剂、点鼻剂以及吸入剂等剂型。作为上述表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂以及脂联素产生促进剂的优选剂型,可列举出片剂、颗粒剂、胶囊剂、粉剂、液剂以及经皮剂等。
116.上述表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂以及脂联素产生促进剂的给药量根据对象的年龄、性别、体重、感受性差异、给药方法、给药间隔、制剂的种类等而不同。在对上述表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂以及脂联素产生促进剂进行经口给药的情况下,各自的所述给药量,例如成人每天优选为0.0001~2500mg/kg,更优选为0.0001~500mg/kg。就上述表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂以及脂联素产生促进剂而言,其剂型例如在片剂的情况下可以制成如下片剂,该片剂以0.001~80质量%来包含表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂或脂联素产生促进剂,例如在粉剂的情况下可以制成如下粉剂,该粉剂以0.001~100质量%来包含表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂或脂联素产生促进剂。上述表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂以及脂联素产生促进剂的给药量可以参考进行非经口给药的情况、进行经口给药的情况的给药量而适当决定。上述表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂以及脂联素产生促进剂可以每天分为一次~数次来给药,或者也可以一天~数天给药一次。
117.上述表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂以及脂联素产生促进剂在不对本发明的效果带来不良影响的范围内,可以适当含有其他有效成分、制剂用载体等。作为其他有效成分,例如可列举出(
±
)-α-生育酚磷酸酯二钠盐、肝素类似物、尿囊素、甘草酸、甘草次酸(glycyrrhetin)、d型氨基酸、氨基硅烷化合物、银椴甙(tiliroside)、柚子提取物、α-葡糖基橙皮苷、桑叶提取物、山竹(mangosteen)果皮提取物、α-倒捻子素(mangosteen)、γ-倒捻子素、可可籽提取物、可可外皮提取物、高丽人参提取物、荔枝多酚、豆科四角豆(psophocarpus)提取物、滨海前胡(长命草)提取物、乳酸菌、光甘草啶、小米草提取物、葛花干燥物提取物、莼菜提取物、皱盖钟菌提取物、藏花精提取物、n-乙酰葡糖胺、鹅肌肽、树莓酮等。而且,作为对医药制剂进行制剂化时使用的药学上可接受的载体,可列举出稀释剂、结合剂(糖浆、阿拉伯树胶、明胶、山梨糖醇、黄蓍胶、聚乙烯吡咯烷酮)、赋形剂(乳糖、蔗糖、玉米淀粉、磷酸钾、山梨糖醇、甘氨酸)、润滑剂(硬脂酸镁、滑石、聚乙二醇、二氧化硅)、崩解剂(马铃薯淀粉)以及润湿剂(月桂基硫酸钠)等。
118.〔功能性食品〕
119.本实施方式的功能性食品包含上述生物体功能调整剂。作为上述功能性食品,例如可以例示特定保健用食品和功能性标示食品。上述功能性食品例如作为特定保健用食品或功能性标示食品,可以起到上述生物体功能调整剂所具有的选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种作用。上述功能性食品例如可以将上述特定保健用食品或功能性标示食品中的生物体功能调整剂的浓度设为0.01~100质量%。上述功能性食品中的生物体功能调整剂的浓度由于第一化合物的含量极其微少而被设为意味着上述生物体功能调整剂中的胶原蛋白肽的浓度的值。因此上述功能性食品中的生物体功能调整剂的浓度可以采用与上述表皮代谢促进剂中的生物体功能调整剂的浓度测定方法相同的方法测定。
120.〔化妆料〕
121.本实施方式的化妆料包含上述生物体功能调整剂。上述化妆料基于例如上述生物体功能调整剂所具有的表皮代谢促进作用,能够提供具有美白效果、保湿效果、皱纹预防和/或皱纹改善效果等的化妆料。上述化妆料中的生物体功能调整剂的浓度有时为0.01~100质量%。上述化妆料中的生物体功能调整剂的浓度由于第一化合物的含量极其微少而被设为意味着上述生物体功能调整剂中的胶原蛋白肽的浓度的值。因此上述化妆料中的生物体功能调整剂的浓度可以采用与上述表皮代谢促进剂中的生物体功能调整剂的浓度测定方法相同的方法测定。
122.〔生物体功能调整剂的制造方法〕
123.本实施方式的生物体功能调整剂的制造方法为包含发酵胶原蛋白肽的生物体功能调整剂的制造方法。上述生物体功能调整剂的制造方法包括:准备包含曲霉菌的曲和胶原蛋白原料的工序(第一工序);以及通过用上述曲使上述胶原蛋白原料发酵,得到包含上述发酵胶原蛋白肽的生物体功能调整剂的工序(第二工序)。
124.上述生物体功能调整剂的制造方法中,上述曲霉菌的菌种是属于曲霉属的菌种。上述胶原蛋白原料是下述原料中的至少任意种:选自由以下的第一组~第六组构成的组中的至少一种;从选自上述组中的至少一种中提取出的胶原蛋白;通过处理上述胶原蛋白而得到的明胶;以及通过水解上述明胶而得到的明胶分解物。
125.第一组:由牛的皮、皮肤、骨、软骨以及肌腱构成的组。
126.第二组:由猪的皮、皮肤、骨、软骨以及肌腱构成的组。
127.第三组:由羊的皮、皮肤、骨、软骨以及肌腱构成的组。
128.第四组:由鸡的皮、皮肤、骨、软骨以及肌腱构成的组。
129.第五组:由鸵鸟的皮、皮肤、骨、软骨以及肌腱构成的组。
130.第六组:由鱼的骨、皮以及鳞构成的组。
131.具备这样的特征的生物体功能调整剂的制造方法,能够制造包含具有选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种作用的发酵胶原蛋白肽的生物体功能调整剂。
132.就在通过上述制造方法制造的生物体功能调整剂中能够具有选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种作用的理由而言,虽然详细尚不明确,但可以认为是根据以下机理。即,上述制造方法包括通过用曲使胶原蛋白原料发酵而得到包含发酵胶原蛋白肽的生物体功能调整剂的工序(第二工序)。已知上述曲包含通过曲霉菌繁殖而产生的多种多样的酶。因此,在第二工序中,有可能通过这些多种多样的酶进行作用,胶原蛋白原料中的多肽和曲中的糖质等被分解、或被氧化还原。
133.由此,在第二工序中,在通过上述多种多样的酶进行作用而产生发酵胶原蛋白肽时,推测上述发酵胶原蛋白肽中包含如下胶原蛋白肽,该胶原蛋白肽包含具有上述的表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用中的至少任意种生理活性的二肽、三肽、寡肽或多肽。此外,在通过上述多种多样的酶进行作用而产生发酵胶原蛋白肽时,还推测上述发酵胶原蛋白肽中包含具有上述作用中的至少任意种生理活性的化合物(非肽)。由此可以认为,通过上述制造方法,能得到包含具有选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂
肪细胞因子量的调整作用构成的组中的至少一种作用的发酵胶原蛋白肽的生物体功能调整剂。以下,对本实施方式的生物体功能调整剂的制造方法中的各工序进行说明。
134.<第一工序>
135.第一工序为准备包含曲霉菌的曲和胶原蛋白原料的工序。第一工序是以为了制造上述生物体功能调整剂而准备必需的各材料(包含曲霉菌的曲和胶原蛋白原料)为目的而执行的。
136.(胶原蛋白原料)
137.如上所述,胶原蛋白原料是如下至少任意种情况:选自由以下的第一组~第六组构成的组中的至少一种“其物质本身”;从选自由以下的第一组~第六组构成的组中的至少一种中提取出的“胶原蛋白”;通过使用热水提取等公知的方法处理上述胶原蛋白而得到的“明胶”;以及通过水解上述明胶而得到的“明胶分解物”。
138.第一组:由牛的皮、皮肤、骨、软骨以及肌腱构成的组。
139.第二组:由猪的皮、皮肤、骨、软骨以及肌腱构成的组。
140.第三组:由羊的皮、皮肤、骨、软骨以及肌腱构成的组。
141.第四组:由鸡的皮、皮肤、骨、软骨以及肌腱构成的组。
142.第五组:由鸵鸟的皮、皮肤、骨、软骨以及肌腱构成的组。
143.第六组:由鱼的骨、皮以及鳞构成的组。
144.即,优选的是,在第一工序中,准备选自由下述成分构成的组中的至少一种作为上述胶原蛋白原料:选自由上述第一组~第六组构成的组中的至少一种;上述胶原蛋白;上述明胶;以及上述明胶分解物。第一工序中可以准备选自它们中的一种的胶原蛋白原料,也可以组合准备两种以上的胶原蛋白原料。上述第一组~第六组构成的组、上述胶原蛋白、上述明胶以及上述明胶分解物均能通过以往公知的方法来准备。
145.在此,上述明胶更优选通过如下方法而得到:对从选自由上述第一组~第六组构成的组中的至少一种中提取出的胶原蛋白,依次执行由酸处理或碱处理实现的前处理、热水提取、精制处理以及杀菌处理。由此,可以准备对人体等安全性高的明胶,由此能够将想要在本实施方式中制造的生物体功能调整剂应用于上述表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂、脂联素产生促进剂、功能性食品以及化妆料的各用途。而且,这样的明胶的经济性也优异。由上述的酸处理或碱处理实现的前处理、热水提取、精制处理以及杀菌处理均能通过以往公知的方法来执行。
146.上述明胶分解物可以通过对上述明胶进行使用以往公知的酸的水解、使用碱的水解、使用酶的水解以及使用加热的水解而得到。明胶分解物的重均分子量不应特别限定,例如优选为20000以下,更优选为10000以下。上述明胶分解物的重均分子量的下限值为76。上述明胶分解物的重均分子量可以通过与上述胶原蛋白肽的重均分子量相同的测定方法而求出。
147.(包含曲霉菌的曲)
148.包含曲霉菌的曲只要选择能通过执行后述的第二工序而得到本实施方式的效果的曲,就可以通过以往公知的方法进行准备。即,将成为曲霉菌种的曲霉菌在米、大麦、小麦或大豆等杂粮中植菌,接着通过使其在上述米、大麦、小麦或杂粮中繁殖而得。优选的是,上述曲霉菌以相对于上述米、大麦、小麦或杂粮成为0.01~1质量%的量而植菌。在本说明书
中的“杂粮”中,除了上述的大豆以外,糠、麸、豆渣以及脱脂大豆均包含在内。优选的是,在包含曲霉菌的曲的准备中,通过设置用于防止其他细菌的混入的曲霉菌室,调整容易曲霉菌繁殖的环境,在上述曲霉菌室进行必需的作业。
149.上述曲霉菌的菌种优选为属于曲霉属的菌种。上述曲霉菌的菌种进一步优选选自由酱油曲霉(aspergillus sojae)、米曲霉(aspergillus oryzae)以及琉球曲霉(aspergillus luchuensis)构成的组中的至少一种。这些菌种已确认对人体等是安全的,因此本实施方式中制造的生物体功能调整剂可以容易地应用于表皮代谢促进剂、脂肪蓄积抑制剂、脂肪分解促进剂、脂联素产生促进剂、功能性食品以及化妆料的各用途。第一工序中,可以准备包含选自这些菌种组中的一种的曲,也可以准备包含选自上述菌种组中的两种以上的曲。
150.<第二工序>
151.第二工序为通过用上述曲使上述胶原蛋白原料发酵,得到包含上述发酵胶原蛋白肽的生物体功能调整剂的工序。第二工序是以得到生物体功能调整剂中所含的发酵胶原蛋白肽为目的而执行的。第二工序中,例如将上述胶原蛋白原料和上述曲投入温水,并且将它们在温水中培养规定时间,从而用上述曲使上述胶原蛋白原料发酵,由此能够得到包含上述发酵胶原蛋白肽的生物体功能调整剂。培养时的ph的值优选为2~10,更优选为5~8。在培养时的ph的值小于2或超过10的情况下,胶原蛋白原料的低分子化、胶原蛋白臭的降低化等恐怕会变得不充分。
152.具体而言,优选的是,由0.1~75质量%的上述胶原蛋白原料、以干燥质量(干燥重量)计为0.1~20质量%的上述曲、以及5~99.8质量%的水制备以它们的合计计为100质量%的分散液,进而将上述分散液调整为ph2~10,然后一边以10~65℃维持上述分散液的温度一边培养1~24小时。由此,能够先得到含有发酵胶原蛋白肽的发酵物。
153.此外,上述发酵物也优选通过以下方法得到。即,首先由干燥质量(干燥重量)0.1~40质量%的上述曲和60~99.9质量%的水制备以它们的合计计为100质量%的分散液,一边以10~65℃维持上述分散液的温度一边培养1~24小时,利用尼龙制的网进行粗滤,进行利用硅藻土和纤维素的过滤,得到曲提取液。接着,由0.1~75质量%的上述胶原蛋白原料和0.1~99.9质量%的上述曲提取液制备以它们的合计计为100质量%的分散液,进而将上述分散液调整为ph2~10,然后一边以10~65℃维持上述分散液的温度一边培养1~24小时。通过该方法,也能够得到含有发酵胶原蛋白肽的发酵物。在通过用该方法得到发酵物的情况下,能够在不对该发酵物执行后述的分离处理工序的情况下得到包含发酵胶原蛋白肽的生物体功能调整剂。其中,不排除对该发酵物执行后述的精制工序和除臭工序中的至少任意种。
154.在此,培养时的温水的温度优选为15~60℃,更优选为20~50℃。在培养时的温水的温度低于10℃或超过65℃的情况下,由于通过曲进行的发酵的效率降低,有可能无法充分得到发酵胶原蛋白肽。
155.而且,培养时间优选为2~18小时,进一步优选为4~8小时。在培养时间超过24小时的情况下,经济上恐怕会变得低效。在培养时间低于1小时的情况下,通过曲进行的发酵恐怕会变得不充分。
156.培养时的温水中的胶原蛋白原料的含量优选为10~45质量%,更优选20~40质
量%。在培养时的温水中的胶原蛋白原料的含量小于0.1质量%的情况下,经济上恐怕会变得低效。在培养时的温水中的胶原蛋白原料的含量超过75质量%的情况下,作业恐怕会变得低效率。
157.由上述曲、上述胶原蛋白原料以及水组成的分散液中的曲的含量以干燥质量(干燥重量)计优选为1~15质量%,更优选为5~10质量%。在培养时的温水中的曲的含量以干燥质量(干燥重量)计小于0.1质量%的情况下,通过曲进行的发酵恐怕会变得不充分。在培养时的温水中的曲的含量以干燥质量(干燥重量)计超过20质量%的情况下,经济上恐怕会变得低效。上述曲提取液中的曲的含量优选为2~25质量%,更优选为8~16质量%。在以曲提取液中的干燥质量(干燥重量)计小于0.1质量%的情况下,通过曲进行的发酵恐怕会变得不充分。在曲提取液中的曲的含量以干燥质量(干燥重量)计超过40质量%的情况下,经济上恐怕会变得低效。
158.第二工序中,在通过上述工序得到上述发酵物后,根据目的将其温度设为75℃以上,从而使曲霉菌的作用(活性)失活,由此能够中止通过曲进行的胶原蛋白原料的发酵。具体而言,对上述发酵物中的胶原蛋白肽的重均分子量进行测定,当确认到与胶原蛋白原料相比低分子化、或培养时间经过了规定时间,例如经过了24小时时,将上述发酵物的温度设为75℃以上,由此也可以中止通过曲进行的胶原蛋白原料的发酵。发酵物中的胶原蛋白肽的重均分子量可以采用例如与上述胶原蛋白肽的重均分子量的测定方法相同的方法测定。
159.(其他工序)
160.为了从上述发酵物中分离得到包含发酵胶原蛋白肽的生物体功能调整剂,第二工序优选包括分离处理工序。该分离处理工序可以应用以往公知的分离处理。例如能够通过使用尼龙制的网的粗滤、离心分离、使用市售的滤纸的滤纸过滤等分离处理,从上述发酵物中分离发酵胶原蛋白肽。由此,能得到包含如下发酵胶原蛋白肽的生物体功能调整剂,该发酵胶原蛋白肽优选包含胶原蛋白肽和选自由异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛构成的组中的至少一种的、更优选为选自该组中的三种的第一化合物。需要说明的是,上述发酵物包含发酵胶原蛋白肽,因此也可以将上述发酵物本身视为生物体功能调整剂。
161.而且,第二工序优选包括对通过应用上述分离处理工序而得到的生物体功能调整剂或上述发酵物,以提高其透明度等为目的而进行精制处理的工序(精制工序)。该精制工序中,可以应用以往公知的精制处理,例如可以进行使用了硅藻土的精制处理、或者利用微滤的精制处理等。而且,也可以进行使用活性炭等的除臭处理(除臭工序)。
162.如上方式得到的生物体功能调整剂可以直接以溶液的状态保存。而且,对于溶液的状态的生物体功能调整剂也可以通过使用以往公知的喷雾或滚筒干燥等方法而得到生物体功能调整剂的干燥粉末,并以该状态保存。进而,通过对上述生物体功能调整剂的干燥粉末使用以往公知的制剂技术,能够形成如上述那样的各种剂型。
163.<作用效果>
164.综上,本实施方式的生物体功能调整剂的制造方法能够得到如下生物体功能调整剂,该生物体功能调整剂包含发酵胶原蛋白肽,并基于上述发酵胶原蛋白肽而具有选自由表皮代谢促进作用、脂肪蓄积抑制作用、脂肪分解促进作用以及生物体内的脂肪细胞因子量的调整作用构成的组中的至少一种生物体功能调整作用。
165.实施例
166.以下,列举出实施例对本发明更详细地进行说明,但本发明不限于此。以下的说明中,试样1~试样5和试样41~试样49为实施例的生物体功能调整剂,试样101~试样104为比较例的胶原蛋白肽或明胶。
167.〔试样的制作〕
168.<试样1>
169.(第一工序)
170.根据以下方式,准备包含曲霉菌的曲和胶原蛋白原料。
171.〈包含曲霉菌的曲的准备〉
172.作为包含曲霉菌的曲,准备植菌了酱油曲霉的大麦麸曲(株式会社樋口松之助商店制)。
173.〈胶原蛋白原料的准备〉
174.作为胶原蛋白原料,准备源自猪皮的明胶(商品名:“bcn-hl”、新田明胶株式会社制、重均分子量:约65000)。
175.(第二工序)
176.根据以下方式,通过用上述曲使上述胶原蛋白原料发酵,得到包含发酵胶原蛋白肽的发酵物。首先制备由上述胶原蛋白原料5g、上述大麦麸曲1g(干燥重量)以及ro水50ml组成的分散液,一边以40℃维持上述分散液的温度一边培养5小时。然后,将上述分散液的温度设为75℃,将上述分散液以75℃附近的温度维持10分钟,从而使上述大麦麸曲中的曲霉菌失活,由此得到包含发酵胶原蛋白肽的发酵物。
177.接着,通过使用advantec滤纸no.2(东洋滤纸株式会社制)对上述发酵物进行过滤,得到试样1的生物体功能调整剂。
178.试样1的生物体功能调整剂为水溶液,在测定其重均分子量时,确认到与上述胶原蛋白原料的重均分子量相比,所述试样1的生物体功能调整剂被低分子化。此外,由使用了上述气相色谱质量分析仪的分析确认到,试样1的生物体功能调整剂包含异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛作为第一化合物。
179.<试样2>
180.第二工序中制备由上述胶原蛋白原料1kg、上述大麦麸曲200g(干燥重量)以及ro水1500ml组成的分散液,一边以40℃维持上述分散液的温度一边培养6小时。然后,将上述分散液的温度设为70℃,将上述分散液以70℃附近的温度维持1小时,从而使上述大麦麸曲中的曲霉菌失活,由此得到包含发酵胶原蛋白肽的发酵物。而且,使用advantec滤纸no.5(东洋滤纸株式会社制)对上述发酵物进行过滤,而且通过进行硅藻土过滤而进行精制。除此之外,通过与得到试样1的方法相同的方法得到试样2的生物体功能调整剂。
181.需要说明的是,关于试样2的生物体功能调整剂,通过使用喷雾干燥机(株式会社大川原制作所制)制成干燥粉末。
182.试样2的生物体功能调整剂为干燥粉末,在测定其重均分子量时,确认到与上述胶原蛋白原料的重均分子量相比,所述试样2的生物体功能调整剂被低分子化。此外,由使用了上述气相色谱质量分析仪的分析确认到,试样2的生物体功能调整剂包含异戊醛、苯乙醛以及甲硫基丙醛作为第一化合物。
183.<试样3>
184.(第一工序)
185.根据以下方式,准备包含曲霉菌的曲和胶原蛋白原料。
186.〈包含曲霉菌的曲的准备〉
187.作为包含曲霉菌的曲,准备植菌了酱油曲霉的大麦麸曲(株式会社樋口松之助商店制)。
188.〈胶原蛋白原料的准备〉
189.作为胶原蛋白原料,准备源自猪皮的明胶(商品名:“bcn-hl”、新田明胶株式会社制、重均分子量:约65000)。
190.(第二工序)
191.根据以下方式,通过用上述曲使上述胶原蛋白原料发酵,得到包含发酵胶原蛋白肽的发酵物。首先制备由上述大麦麸曲13质量%(干燥重量)、ro水87质量%组成的分散液,一边以40℃维持上述分散液的温度一边搅拌1小时。然后,利用尼龙制的网进行粗滤,进行利用硅藻土和纤维素的过滤,由此得到曲提取液。接着,制备由上述胶原蛋白原料40质量%、上述曲提取液60质量%组成的分散液,一边以40℃维持上述分散液的温度一边培养6小时。然后,将分散液的温度设为80℃,通过将上述分散液以80℃附近的温度维持60分钟而进行低温杀菌,并且使用喷雾干燥机(株式会社大川原制作所制)制成干燥粉末,由此得到试样3的生物体功能调整剂。
192.试样3的生物体功能调整剂为干燥粉末,在测定其重均分子量时,确认到与上述胶原蛋白原料的重均分子量相比,所述试样3的生物体功能调整剂被低分子化。此外,由使用了上述气相色谱质量分析仪的分析确认到,试样3的生物体功能调整剂包含异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛作为第一化合物。
193.<试样4>
194.制备由上述胶原蛋白原料40质量%、上述曲提取液60质量%组成的分散液,在一边以40℃维持分散液的温度一边培养6小时后,将分散液的温度设为60℃,通过将上述分散液以60℃附近的温度维持60分钟而进行低温杀菌,除此以外,通过与得到试样3相同的方法得到试样4的生物体功能调整剂。
195.试样4的生物体功能调整剂为干燥粉末,在测定其重均分子量时,确认到与上述胶原蛋白原料的重均分子量相比,所述试样4的生物体功能调整剂被低分子化。此外,由使用了上述气相色谱质量分析仪的分析确认到,试样4的生物体功能调整剂包含异戊醛、1-辛烯-3-醇、苯乙醛以及甲硫基丙醛作为第一化合物。
196.<试样5>
197.(第一工序)
198.根据以下方式,准备包含曲霉菌的曲和胶原蛋白原料。
199.〈包含曲霉菌的曲的准备〉
200.作为包含曲霉菌的曲,准备植菌了酱油曲霉的大麦麸曲(株式会社樋口松之助商店制)。
201.〈胶原蛋白原料的准备〉
202.作为胶原蛋白原料,准备源自罗非鱼的鳞的明胶(新田明胶株式会社制、重均分子量:约150000)。
203.(第二工序)
204.根据以下方式,通过用上述曲使上述胶原蛋白原料发酵,得到包含发酵胶原蛋白肽的发酵物。首先制备由上述胶原蛋白原料10质量%、上述大麦麸曲2质量%(干燥重量)以及ro水88质量%组成的分散液,一边以40℃维持上述分散液的温度一边培养6小时。然后,将上述分散液的温度设为75℃,将上述分散液以75℃附近的温度维持60分钟,从而使上述大麦麸曲中的曲霉菌失活,由此得到包含发酵胶原蛋白肽的发酵物。
205.接着,对上述发酵物以离心加速度1610g进行30分钟离心分离,得到其上清液,由此得到试样5的生物体功能调整剂。
206.试样5的生物体功能调整剂为水溶液,在测定其重均分子量时,确认到与上述胶原蛋白原料的重均分子量相比,所述试样5的生物体功能调整剂被低分子化。此外,由使用了上述气相色谱质量分析仪的分析确认到,试样5的生物体功能调整剂包含异戊醛、1-辛烯-3-醇以及苯乙醛作为第一化合物。
207.<试样101>
208.准备胶原蛋白肽(商品名:“collapep pu”、新田明胶株式会社制、重均分子量:630)的干燥粉末作为试样101。由使用了上述气相色谱质量分析仪的分析确认到,试样101不包含第一化合物。
209.<试样102>
210.准备源自猪皮的明胶(商品名:“bcn-hl”、新田明胶株式会社制、重均分子量:约65000)的干燥粉末作为试样102。样品102不包含胶原蛋白肽,并且由使用了上述气相色谱质量分析仪的分析确认到不包含第一化合物。
211.<试样103>
212.准备胶原蛋白肽(商品名:“cp prototype”、新田明胶株式会社制、重均分子量:500~1000)的干燥粉末作为试样103。由使用了上述气相色谱质量分析仪的分析确认到,试样103不包含第一化合物。
213.<试样104>
214.准备胶原蛋白肽(商品名:“scp-5200”、新田明胶株式会社制、重均分子量:3000~6000)的干燥粉末作为试样104。由使用了上述气相色谱质量分析仪的分析确认到,试样104不包含第一化合物。
215.〔第一试验〕
216.通过向小鼠给药试样2的生物体功能调整剂,对上述生物体功能调整剂是否具有脂肪蓄积抑制作用进行了试验。具体而言,按照以下方式执行了第一试验。
217.<试验方法>
218.通过从日本crea株式会社购入5周龄的雄性c57bl/6j小鼠30只来进行准备。将上述小鼠分为如下三组(n=10):低脂肪食摄取组(以下,也记作“l组”)、高脂肪食摄取组(以下,也记作“h组”)、以及高脂肪食和试样2(5质量%)摄取组(以下,也记作“fcp组”),通过分别给予与各组相应的饲料,进行了30天的饲养(配对饲养)。饲养中,每天在规定的时间测定小鼠的饲料摄取量和体重。将给予上述的各组小鼠的饲料组成(单位为质量%)示于表1。需要说明的是,表1中也明确表示出在后述的第二试验中使用的饲料的组成。
219.[表1]
[0220][0221]
接着,在对各组的上述小鼠用异氟烷麻醉后,进行断头采血和解剖而得到内脏脂肪、血清以及肝脏。作为上述内脏脂肪,摘出肠管膜脂肪、肾脏周围脂肪以及精巢周围脂肪。在测定出各脏器中的脂肪量(质量(g))后,通过将它们加和而求出总内脏脂肪量。进而,由上述血清对血清中的瘦素和脂联素的浓度进行了定量。作为定量法使用elisa法,对于瘦素浓度,按照小鼠瘦素测定试剂盒(目录编号:“ms333”、株式会社森永生科学研究所制)的方案而求出。对于脂联素浓度,按照lbis高分子脂联素-小鼠/大鼠(目录编号:“634-13071”、富士胶片和光纯药株式会社制)的方案而求出。
[0222]
对于肝脏,进行了以下处理。首先将上述肝脏0.5g用1.15质量%氯化钾(kcl)溶液2.5ml进行均匀化,放入进行过冰冷的试验管中。进而,将上述试验管离心分离(重力加速度9830g、10分钟、4℃),将其上清液制成粗酶液。接着,对于上述粗酶液,基于nepokroeff等人(methods enzymol,35:37-44,1975)和kelley等人(biochem.j,235:87-90,1986)所述的方法,根据在100μm的丙二酸单酰辅酶a和25μm的乙酰辅酶a存在下的napdh的减少速度来测定(波长340nm)酶活性,由此求出脂肪酸合成酶(fas)活性的强度。进而,对于上述粗酶液,基于markwell等人(j biol.chem,248:3426-3432,1973)所述的方法,根据在2mm的棕榈酰辅酶a和125mm的l-肉毒碱存在下的二硫硝基苯甲酸(dtnb)的反应速度测定(波长412nm)酶活性,由此求出脂肪酸分解酶(肉毒碱棕榈酰转移酶:cpt)活性的强度。将结果示于图1~图9。对于图1~图9中各组(l组、h组以及fcp组)之间的显著性差异,进行bonferrioni多重比较检验,将p<0.05判定为在统计学上显著。
[0223]
<考察>
[0224]
图1是表示第一试验中的各组小鼠的体重的变化的图表。根据图1,可理解为相对于h组,fcp组的体重增加受到显著抑制。
[0225]
图2是表示第一试验中的各组小鼠的肠管膜脂肪量的图表。图3是表示第一试验中的各组小鼠的肾脏周围脂肪量的图表。图4是表示第一试验中的各组小鼠的精巢周围脂肪量的图表。图5是表示第一试验中的各组小鼠的总内脏脂肪量的图表。根据图2~图5,评价
为相对于h组的情况,fcp组的各脏器中的脂肪蓄积受到显著抑制。由此表明,在fcp组中能得到脂肪蓄积抑制效果。
[0226]
图6是表示第一试验中的各组小鼠的血清中的瘦素浓度的图表。图7是表示第一试验中的各组小鼠的血清中的脂联素浓度的图表。根据图6~图7,评价为相对于h组的情况,fcp组中的瘦素的血中浓度显著减少,并且相对于h组的情况,fcp组中的脂联素的血中浓度显著增加。由此表明,在fcp组中,通过生物体内的脂肪细胞因子量的调整作用,能得到脂肪蓄积抑制效果。
[0227]
图8是表示第一试验中的各组小鼠的肝脏中的fas活性的强度的图表。图9是表示第一试验中的各组小鼠的肝脏中的cpt活性的强度的图表。根据图8~图9,评价为相对于h组的情况,fcp组中的脂肪酸的合成受到显著抑制,并且相对于h组的情况,fcp组中的脂肪酸的分解得到显著促进。由此表明,在fcp组中能得到脂肪蓄积抑制效果。
[0228]
〔第二试验〕
[0229]
通过向小鼠给药试样2的生物体功能调整剂,对上述生物体功能调整剂是否具有脂肪蓄积抑制作用进行了试验。具体而言,按照以下方式执行了第二试验。
[0230]
<试验方法>
[0231]
通过从日本crea株式会社购入5周龄的雄性c57bl/6j小鼠40只来进行准备。将上述小鼠分为如下五组(n=8):l组、h组、fcp组、高脂肪食和试样101(5质量%)摄取组(以下,也记作“cp组”)以及高脂肪食和试样102(5质量%)摄取组(以下,也记作“gl组”),通过分别给予与各组相应的饲料,进行了30天的饲养(配对饲养)。饲养中,每天在规定的时间测定小鼠的饲料摄取量和体重。给予上述的各组小鼠的饲料的组成如上述表1所示。
[0232]
接着,在对各组的上述小鼠用异氟烷麻醉后,进行断头采血和解剖而得到内脏脂肪和血清。接着通过与上述第一试验相同的方法,由上述内脏脂肪求出各脏器中的脂肪量和总内脏脂肪量。进而,通过与上述第一试验相同的方法,由上述血清对血清中的瘦素和脂联素的浓度进行了定量。将各脏器中的脂肪量和总内脏脂肪量(单位为g)的结果示于表2。关于血清中的瘦素浓度和脂联素浓度的结果,示于图10~图11。对于图10~图11中各组(l组、h组、gl组、cp组以及fcp组)之间的显著性差异,进行bonferrioni多重比较检验,将p<0.05判定为在统计学上显著。
[0233]
[表2]
[0234] l组h组gl组cp组fcp组肠管膜脂肪量0.311
±
0.0240.500
±
0.0340.553
±
0.0550.453
±
0.0290.339_
±
0.012肾脏周围脂肪量0.089
±
0.0030.388
±
0.0370.375
±
0.0440.344
±
0.0250.225
±
0.019精巢周围脂肪量0.398
±
0.0161.09
±
0.051.08
±
0.120.945
±
0.0570.728
±
0.027总内脏脂肪量0.798
±
0.0301.98
±
0.112.01
±
0.211.74
±
0.101.29
±
0.05
[0235]
《考察》
[0236]
根据表2,评价为相对于h组的情况,fcp组的各脏器中的脂肪蓄积受到抑制。而且,评价为相对于cp组和gl组的情况,fcp组的各脏器中的脂肪蓄积也受到抑制。由此表明,在fcp组中能得到脂肪蓄积抑制效果。
[0237]
图10是表示第二试验中的各组小鼠的血清中的瘦素浓度的图表。图11是表示第二试验中的各组小鼠的血清中的脂联素浓度的图表。根据图10~图11,评价为相对于h组的情
况,fcp组中的瘦素的血中浓度减少,并且相对于h组的情况,fcp组中的脂联素的血中浓度增加,而且,评价为相对于cp组和gl组的情况,fcp组中的瘦素的血中浓度减少,并且相对于cp组和gl组的情况,fcp组中的脂联素的血中浓度增加。由此表明,在fcp组中,基于生物体内的脂肪细胞因子量的调整作用,能得到脂肪蓄积抑制效果。
[0238]
〔第三试验〕
[0239]
通过将试样1和试样2的生物体功能调整剂、以及试样101及试样103添加到由源自小鼠的前脂肪细胞(3t3-l1、传代数:5代、9pdl)分化而成的脂肪细胞中,对试样1和试样2的生物体功能调整剂是否具有脂肪蓄积抑制作用进行了试验。具体而言,按照以下方式执行了第三试验。
[0240]
《试验方法》
[0241]
通过培养基(dmem/f12培养基(传代培养基、目录编号:“11330-032”、gibco公司制、含有10质量%fbs、青霉素以及链霉素),对上述源自小鼠的前脂肪细胞(研究资源库制、资源编号jcrb9014、lot.no.01282009)进行了预培养。接着,由经该预培养的培养基和上述细胞制备出上述细胞为3
×
104cell/ml的细胞悬浊液。进而,将该细胞悬浊液以5ml逐一接种于60mm培养皿(目录编号:corning、cat.no.430166)的各培养皿,在37℃(5体积%co2)的条件下培养了两天。接着,将各培养皿中的上述培养基替换为分化诱导培养基,其中以最终浓度分别成为0.5mm和1μm的方式添加了脂肪生成检测试剂盒(目录编号:“ecm950”、millipore公司制)所附带的异丁基甲基黄嘌呤(ibmx)和地塞米松,在37℃(5体积%co2)的条件下进一步培养了两天。然后,进而将上述分化诱导培养基替换为分化培养基,其中以最终浓度成为10μg/ml的方式添加脂肪生成检测试剂盒(目录编号:“ecm950”、millipore公司制)所附带的胰岛素,在37℃(5体积%co2)的条件下培养了两天。在确认到各培养皿中的上述细胞已分化成脂肪细胞的基础上,将上述分化培养基替换为上述传代培养基。对于该传代培养基中的脂肪细胞,以最终浓度成为0.1质量%的方式添加试样1和试样2的生物体功能调整剂、以及试样101及试样103,以最终浓度成为2μg/ml的方式添加氯化小檗碱(berberine)溶液(目录编号:“027-11781”、富士胶片和光纯药株式会社制),并且对剩余的上述传代培养基中的脂肪细胞添加ro水,在37℃(5体积%co2)的条件下培养了两天。需要说明的是,关于试样1、试样2、试样101、试样103、氯化小檗碱溶液以及ro水,分别被添加到三个培养皿中。然后,将上述传代培养基更换为新的传代培养基,并且以最终浓度成为0.1质量%的方式重新添加试样1、试样2、试样101、试样103,以最终浓度成为2μg/ml的方式重新添加氯化小檗碱溶液,并且将ro水重新添加到相应的各培养皿中。
[0242]
接着,按照上述脂肪生成检测试剂盒的方案,在常温下向各培养皿中添加了上述试剂盒所附带的油红o(oil red o)溶液。即,对添加了试样1、试样2、试样101、试样103、氯化小檗碱溶液以及ro水的各培养基中的脂肪细胞,用pbs(磷酸缓冲生理盐水)进行了两次清洗,接着向各培养皿中添加了36质量%浓度的上述油红o溶液1.25ml。然后,用60质量%浓度的异丙醇2.5ml进行了两次清洗,通过添加99质量%浓度的异丙醇625μl,从各培养皿中得到包含脂肪细胞和油红o的提取液。将上述提取液200μl转移到96孔板上,通过吸光度计(商品名:“synergy htx”、biotech japan公司制)测定了od520nm的吸光度。上述od520nm的吸光度越是高值,则评价为越发生脂肪细胞中的脂肪蓄积。在此,由添加了ro水的培养皿中得到的提取液成为空白试验。此外,由添加了氯化小檗碱溶液的培养皿中得到的提取液
成为阳性对照。
[0243]
基于以下计算式求出添加了各试样、氯化小檗碱溶液或ro水的脂肪细胞中的脂肪蓄积率。
[0244]
脂肪蓄积率(%)=[(各试样的od520nm的测定值)/(空白试验的od520nm的测定值)
×
100]。
[0245]
将结果示于表3。表3中示出了各试样等中三个检体的脂肪蓄积率的平均值(平均)和标准差。而且,表3中,还通过对各测定值进行统计处理,判定了与脂肪蓄积是否受到抑制有关的显著性差异。关于上述统计处理,使用了分析处理软件(商品名:“stat mate v”、株式会社atoms制)。关于上述显著性差异,通过基于置信率95%的置信区间的单因素方差分析(one-way anova),以及进行了图基检验作为事后检验来进行了判定。表3中用***表示p<0.001,用**表示p<0.01,用*表示p<0.05。
[0246]
[表3]
[0247][0248]
<考察>
[0249]
根据表3,评价为与试样101和试样103相比,试样1和试样2的生物体功能调整剂的脂肪细胞中的脂肪蓄积受到抑制。
[0250]
〔第四试验〕
[0251]
通过将后述的试样41~试样49的生物体功能调整剂添加到源自小鼠的前脂肪细胞(3t3-l1、传代数:7代、13pdl)分化而成的脂肪细胞中,对试样41~试样49的生物体功能调整剂是否具有脂肪蓄积抑制作用进行了试验。具体而言,按照以下方式执行了第四试验。
[0252]
<试验方法>
[0253]
(试样41~试样49的制作)
[0254]
将第二工序中用上述曲使胶原蛋白原料发酵的条件设为如表4所示,除此以外,通过与得到试样2的生物体功能调整剂相同的方法制作出试样41~试样49的生物体功能调整剂。需要说明的是,试样43的用上述曲使胶原蛋白原料发酵的条件与试样2相同。在表4中还示出了各试样中所含的胶原蛋白肽的重均分子量。
[0255]
[表4]
[0256]
样品反应温度(℃)反应时间(小时)反应ph重均分子量(mw)试样414025.572995试样424045.571949试样434065.571747试样446025.752536
试样456045.752286试样466065.752182试样474026.472727试样484046.471762试样494066.471578
[0257]
(试验方法)
[0258]
将源自小鼠的前脂肪细胞(3t3-l1)的传代数设为“7代、13pdl”,并且,将对上述培养皿中的脂肪细胞进行添加的试样41~试样49的最终浓度设为0.2质量%。除此以外,通过与上述第三试验相同的方法,按照以下方式执行了第四试验。将结果示于表5。
[0259]
[表5]
[0260][0261]
<考察>
[0262]
根据表5,试样41~试样49的生物体功能调整剂被评价为相对于空白试验,脂肪细胞中的脂肪蓄积均受到抑制。需要说明的是,在第四试验中未对与脂肪蓄积的抑制有关的显著性差异的有无进行判定。
[0263]
〔第五试验〕
[0264]
通过向人正常表皮角化细胞nhek(nb)(目录编号:“kk4009”、lot.05298、仓敷纺绩株式会社制)中添加试样1和试样2的生物体功能调整剂、以及试样104,对试样1和试样2的生物体功能调整剂是否具有表皮代谢促进作用进行了试验。具体来说,按照以下方式执行了第五试验。
[0265]
<试验方法>
[0266]
通过培养基(商品名:“humedia kg2”、仓敷纺绩株式会社制)对人正常表皮角化细胞nhek(nb)(仓敷纺绩株式会社制)进行了预培养。接着,通过由经该预培养的培养基和上述细胞制备出上述细胞为1.5
×
104cell/ml的细胞悬浊液,将上述细胞悬浊液以3
×
104cell逐一接种于6孔板(目录编号:“353046”、falcon公司制)的各孔,培养了四天。接着,在确认到上述细胞在上述板内90面积%变得亚汇合后,将培养皿内的培养基替换为试验培养基(商品名:“humedia kb2”、仓敷纺绩株式会社制)。进而,逐一向各板的各孔中以最终浓度成为0.1质量%浓度的方式添加试样1和试样2的生物体功能调整剂、试样104以及ro水,并且
在37℃(5体积%co2)的条件下进行培养。在此,对用于测定后述的角蛋白10(krt10)的基因表达量的上述板内的细胞进行了24小时培养,对用于测定后述的内披蛋白(ivl)和谷氨酰胺转移酶1(tgm1)的基因表达量的上述板内的细胞进行了48小时培养。
[0267]
然后,用pbs对各孔进行两次清洗,在各孔中逐一添加trizol试剂(目录编号:“15506-026”、thermo fisher scientific公司制)1ml,在该1分钟后使用刮刀,由此将各孔内的全部细胞回收至1.5ml离心管。接着,在按照trizol的方案从上述细胞中提取出总rna后,通过测定260nm的吸光度以便将总rna制备成1μg/ml浓度。对当通过用a260/a280计算时总rna的纯度显示为1.8以上的值的总rna进行了使用。通过使用high capacity rnato cdnakit(目录编号:“4387406”、life technologies公司制)进行上述全部rna的逆转录,得到cdna,将该cdna提供给实时rt-pcr。
[0268]
上述实时rt-pcr中,作为目标基因,对试样逐一测定了krt10(引物:hs01043114_gl、thermo fisher scientific公司制)、tgm1(引物:hs01070310_ml、thermo fisher scientific公司制)以及ivl(引物:hs00846307_sl、thermo fisher scientific公司制)的mrna量。作为内标(校正基因),使用了gapdh(目录编号:“4352934e”、thermo fisher scientific公司制)。计算使用了校准曲线法。作为引物和探针,使用了fam染料。实时rt-pcr利用设备(商品名:“step one plus”、applied biosystems制)来进行,使用了试剂盒(商品名:“taqman(注册商标)fast advanced master mix”、目录编号:“4444556”、applied biosystems公司制)。pcr条件为,将初期变性(95℃、20秒、1个循环)、退火(95℃、1秒)以及延伸(60℃,20秒)进行了40个循环。在此由添加了ro水的孔中得到的总rna(cdna)成为空白试验。将结果示于表6~表8。
[0269]
表6中,示出了试样1和试样2、以及试样104中的krt10的基因表达量相对于空白试验的相对值(各三个检体的平均值(平均)和标准差)。表7中,示出了试样2和试样104中的tgm1的基因表达量相对于空白试验的相对值(各三个检体的平均值(平均)和标准差)。表8中,示出了试样1和试样2、以及试样104中的ivl的基因表达量相对于空白试验的相对值(各三个检体的平均值(平均)和标准差)。而且在表6~表8中还示出了与各基因的表达是否亢进有关的显著性差异,其中各基因的表达是否亢进是通过对各测定值进行统计处理而判定出的。在上述统计处理中,使用了分析处理软件(商品名:“excel”、微软公司制)。对于上述显著性差异,通过进行配对t检验来进行判定,用***表示p<0.001,用**表示p<0.01,用*表示p<0.05。
[0270]
[表6]
[0271][0272]
[表7]
[0273][0274]
[表8]
[0275][0276]
<考察>
[0277]
根据表6~表8,试样1和试样2的生物体功能调整剂能够使人的表皮细胞中krt10、tgm1以及ivl的基因的表达量亢进。由此表明,通过上述的基因的表达亢进,表皮中的代谢得到促进。
[0278]
〔第六试验〕
[0279]
通过使用上述的试样41~试样49的生物体功能调整剂进行上述第五试验,对试样41~试样49的生物体功能调整剂是否具有表皮代谢促进作用进行了试验。将结果示于表9~表11。
[0280]
表9中,示出了试样41~试样49中的krt10的基因表达量相对于空白试验的相对值(各三个检体的平均值(平均)和标准差)。表10中,示出了试样41~试样49中的tgm1的基因表达量相对于空白试验的相对值(各三个检体的平均值(平均)和标准差)。表11中,示出了试样41~试样49中的ivl的基因表达量相对于空白试验的相对值(各三个检体的平均值(平均)和标准差)。需要说明的是,在第六试验中未对与表皮代谢促进作用(上述的基因的表达亢进)有关的显著性差异的有无进行判定。
[0281]
[表9]
[0282][0283]
[表10]
[0284][0285]
[表11]
[0286][0287]
<考察>
[0288]
根据表9~表11,试样41~试样49的生物体功能调整剂能使人的表皮细胞中krt10、tgm1以及ivl的基因的表达量亢进。由此表明,通过上述的基因的表达亢进,表皮中的代谢得到促进。
[0289]
〔第七试验〕
[0290]
根据与上述第一试验相同的要领,通过向小鼠给药试样2的生物体功能调整剂,关于上述生物体功能调整剂是否具有脂肪蓄积抑制作用,以小鼠的体重的变化作为指标进行了试验。其中,对于fcp组,将所摄取的试样2的浓度设为上述第一试验的半量(含有2.5质量%fcp的饲料)。
[0291]
<考察>
[0292]
图12是表示第七试验中的各组小鼠的体重的变化的图表。根据图12,可理解为相对于h组,fcp组的体重增加受到显著抑制。
[0293]
〔第八试验〕
[0294]
通过对因糖负荷而肥胖的小鼠给药试样3和试样4的生物体功能调整剂,对上述生
物体功能调整剂是否具有脂肪蓄积抑制作用进行了试验。具体而言,按照以下方式执行了第八试验。
[0295]
<试验方法>
[0296]
通过从日本crea株式会社购入5周龄的雄性c57bl/6j小鼠48只来进行准备。对于上述小鼠,通过使其摄取标准饮食(ain-93g精制饲料)和包含15质量%果糖(富士胶片和光纯药工业株式会社制)的水(以下也记作“15质量%果糖水”)42天,有意地使上述小鼠的体重增加。接着,将体重已增加的上述小鼠48只以成为各组间体重恒定的方式分为如下六组(n=8):标准组(a组),摄取上述标准饮食和水;阴性对照组(b组),摄取上述标准饮食和15质量%果糖水;fcp-3组(c组),摄取由标准饮食中所含的20质量%的酪蛋白中的6质量%替换为试样3的生物体功能调整剂而成的饵料、和15质量%果糖水;fcp-4组(d组),摄取由标准饮食中所含的20质量%的酪蛋白中的6质量%替换为试样4的生物体功能调整剂而成的饵料、和15质量%果糖水;collapep pu组(e组),摄取由标准饮食中所含的20质量%的酪蛋白中的6质量%替换为试样101而成的饵料、和15质量%果糖水;以及scp-5200组(f组),摄取由标准饮食中所含的20质量%的酪蛋白中的6质量%替换为试样104而成的饵料、和15质量%果糖水。
[0297]
然后,通过对各组小鼠,在35天内给予相应的饵料和水来进行了饲养(配对饲养)。在饲养中,每天在规定的时间测定各小鼠的饲料摄取量和体重。将给予上述各组小鼠的饵料(单位为质量%)和水分的一览示于表12。需要说明的是,表12中的“水/15质量%果糖水”的项目中的“w”表示给予了水,“f”表示给予了果糖水。在此,标准饮食(ain-93g精制饲料)的组成为酪蛋白20质量%、玉米淀粉26.75质量%、蔗糖10质量%、玉米油20质量%、α玉米淀粉13.2质量%、纤维素5质量%、酒石酸氢胆碱(choline bitartrate)0.25质量%、矿物质混合物(ain-93)3.5质量%、维生素混合物(ain-93g)1质量%以及l-胱氨酸0.3质量%。
[0298]
[表12]
[0299][0300]
接着,在对各组的上述小鼠用异氟烷麻醉后,进行断头采血和解剖而得到内脏脂肪、血清以及肝脏。作为上述内脏脂肪,摘出肠管膜脂肪、肾脏周围脂肪以及精巢周围脂肪。在测定出各脏器中的脂肪量(质量(g))后,通过将它们加和而求出总内脏脂肪量。进而,由上述血清对血清中的血糖值、胰岛素量以及瘦素浓度进行了定量。血糖值的测定使用了葡萄糖传感器(株式会社三和化学研究所制)。对于胰岛素量的测定,使用了lbis胰岛素-小鼠t(富士胶片和光纯药工业株式会社制)。对于瘦素浓度,按照森永小鼠/大鼠瘦素测定试剂盒(株式会社森永生科学研究所制)的方案而求出。
[0301]
对于肝脏,进行了以下处理。首先将上述肝脏0.5g用1.15质量%氯化钾(kcl)溶液2.5ml进行均匀化,放入进行过冰冷的试验管中。进而,将上述试验管离心分离(重力加速度9830g、10分钟、4℃),将其上清液制成粗酶液。接着,对于上述粗酶液,基于nepokroeff等人(methods enzymol,35:37-44,1975)和kelley等人(biochem.j,235:87-90,1986)所述的方法,根据在100μm的丙二酸单酰辅酶a和25μm的乙酰辅酶a存在下的napdh的减少速度来测定(波长340nm)酶活性,由此求出脂肪酸合成酶(fas)活性的强度。进而,对于上述粗酶液,基于markwell等人(j biol.chem,248:3426-3432,1973)所述的方法,根据在2mm的棕榈酰辅酶a和125mm的l-肉毒碱存在下的二硫硝基苯甲酸(dtnb)的反应速度测定(波长412nm)酶活性,由此求出脂肪酸分解酶(肉毒碱棕榈酰转移酶:cpt)活性的强度。将结果示于图13~图22。对于图13~图22中各组(a组~f组)间的显著性差异,进行图基hsd多重比较检验,将p<0.05判定为在统计学上显著。
[0302]
<考察>
[0303]
图13是表示第八试验中的各组小鼠的体重的图表。根据图13,可理解为相对于a组,b组、e组以及f组的体重增加未能受到抑制,但相对于a组,c组和d组的体重增加受到显著抑制。
[0304]
图14是表示第八试验中的各组小鼠的肠管膜脂肪量的图表。图15是表示第八试验中的各组小鼠的肾脏周围脂肪量的图表。图16是表示第八试验中的各组小鼠的精巢周围脂肪量的图表。图17是表示第八试验中的各组小鼠的总内脏脂肪量的图表。根据图14~图17,评价为相对于b组、e组以及f组的情况,c组和d组的各脏器中的脂肪蓄积受到显著抑制或者存在抑制倾向。由此表明,在c组和d组中能在受到果糖的负荷下得到内脏脂肪的蓄积抑制效果。
[0305]
图18是表示第八试验中的各组小鼠的血清中的血糖值的图表。图19是表示第八试验中的各组小鼠的血清中的胰岛素量的图表。根据图18表明,与b组相比,c组和d组的血糖值显著降低。而且,根据图19表明,与b组、e组以及f组相比,c组和d组的胰岛素量显著降低。
[0306]
图20是表示第八试验中的各组小鼠的血清中的瘦素浓度的图表。根据图20表明,在c组和d组中,通过生物体内的瘦素产生量减少,即使受到了果糖的负荷,也能得到内脏脂肪的蓄积抑制效果。
[0307]
图21是表示第八试验中的各组小鼠的肝脏中的fas活性的强度的图表。根据图21,评价为与b组、e组以及f组的情况相比,c组和d组中的脂肪酸的合成受到显著抑制。由此表明,在c组和d组中,通过脂肪酸的合成受到抑制,能在受到果糖的负荷下得到内脏脂肪的蓄积抑制效果。而且,图22是表示第八试验中的各组小鼠的肝脏中的cpt活性的强度的图表。根据图22,评价为与b组、e组以及f组的情况相比,c组和d组中的脂肪酸的分解得到显著促进。由此表明,在c组和d组中,通过脂肪酸的分解得到促进,能在受到果糖的负荷下得到内脏脂肪的蓄积抑制效果。
[0308]
〔第九试验〕
[0309]
通过对适合观察皮肤中的变化的hos:hr-1小鼠给药试样3的生物体功能调整剂,对上述生物体功能调整剂是否具有皮肤代谢促进作用进行了试验。具体而言,按照以下方式执行了第九试验。
[0310]
<试验方法>
[0311]
通过从株式会社星野试验动物饲养所购入7周龄的雌性hos:hr-1小鼠15只来进行准备,同时将上述小鼠饲养直至8周龄。然后,将上述小鼠以每组5只地分为如下三组(n=5):x组,摄取作为标准饮食的labo mr stock饲料(日本农产工业株式会社制)和水;y组,摄取hr-ad用精制饲料和水;以及z组,摄取添加了5质量%的试样3的生物体功能调整剂的hr-ad用精制饲料和水。然后,通过对各组小鼠,在8周(56天)内给予相应的饲料和水来进行了饲养。在饲养中,每周一次对各小鼠的饲料摄取量和体重进行测定且进行了照片拍摄。而且,从各组小鼠中分别选择在饲养开始前和饲养结束时使其安乐死的小鼠,对该安乐死的小鼠的背部和腹部(腰部)的皮肤进行了采集。进而,对与上述皮肤相关的h.e.染色标本进行了制作,进行包括测定上述皮肤的角质层的厚度等在内的病理组织学的观察。将上述小鼠的背部(颈背部和背部中央)和腹部(腰部)的各部中测定出的皮肤的角质层的厚度示于表13。hr-ad用精制饲料是指一种可评价特应性皮炎的饲料,因为特应性皮炎(ad)样症状是由多不饱和脂肪酸(n-6pufas)的缺乏引起的。其组成中:作为氨基酸,含有0.75质量%的精氨酸、0.60质量%的组氨酸、1.03质量%的异亮氨酸、2.02质量%的亮氨酸、1.69质量%的赖氨酸、0.69质量%的蛋氨酸、1.17质量%的酪氨酸、0.62质量%的丙氨酸、2.32质量%的脯氨酸、1.03质量%的苯丙氨酸、0.07质量%的色氨酸、1.27质量%的缬氨酸、0.08质量%的胱氨酸、0.39质量%的甘氨酸、0.87质量%的苏氨酸、1.18质量%的丝氨酸、1.47质量%的天冬氨酸、4.74质量%的谷氨酸;作为维生素,在1kg中含有32157iu的维生素a、4799iu的维生素d3、160mg的维生素e、5mg的维生素k、868.2mg的胆碱、0.09mg的叶酸、320mg的烟酸、0.8mg的生物素、13mg的维生素b1、16.3mg的维生素b2、52.7mg的维生素b6、0.08mg的维生素b12、129.6mg的维生素c、29.7mg的泛酸;作为矿物质,含有0.9质量%的钙、0.33质量%的氯、0.02质量%的镁、0.77质量%的磷、0.42质量%的钾、0.2质量%的钠、0.00质量%的硒、0.22mg/kg的碘、276.78mg/kg的铁、0.002质量%的钴、79.28mg/kg的锰、122.52mg/kg的锌、21.50mg/kg的铜。在表13中,“mean”是指中间值,“s.d.”是指标准差。
[0312]
[表13]
[0313][0314]
**:p<0.01学生t检验对比标准饮食组
[0315]
$:p<0.05$$:p<0.01 welch-t检验对比标准饮食组
[0316]
+:p<0.05++:p<0.01 dunnett-t检验对比hr-ad饮食组
[0317]
《考察》
[0318]
首先,在y组中,在背部(颈背部和背部中央)和腹部(腰部)的皮肤上观察到落屑,并且确认到角质层的厚度显著增加。由此确认到:y组小鼠作为伴有皮肤的干燥和表皮的肥
厚的特应性皮炎样模型是成立的。另一方面,与y组相比,在z组中皮肤的干燥状态没有变化,但如表13所示,颈背部的角质层的厚度为显著低值,可以认为基于上述生物体功能调整剂的皮肤代谢促进作用,表皮的肥厚受到抑制。
[0319]
〔第十试验〕
[0320]
通过使20~70岁以下的健康男女摄取试样4的生物体功能调整剂,对上述生物体功能调整剂对于人是否具有脂肪蓄积抑制作用进行了试验。具体而言,按照以下方式执行了第十试验。
[0321]
<试验方法>
[0322]
本试验是根据“赫尔辛基宣言(2004年东京注释追加版)”和“有关流行病学研究的伦理方针(2004年文部科学省/厚生劳动省公告1号)”,遵守本试验实施计划书而实施的。本试验的方案由伦理审查委员会承认(承认编号:rcb2020-001-02),并进行了umin注册(umin000040736)。此外,在本试验中,在经书面得到受试者的同意后,实施了随机化双盲安慰剂对照并行组间试验。在本试验中,总共进行了三次测定,即对筛选分配的时间点、在摄入前(0time)的时间点、以及从上述摄取前的时间点起以绝对干燥量5.0g/天摄取被验食品三个月后的时间点进行测定,一次测定过程设有一周的调整过程。以下,对具体的试验内容进行说明。
[0323]
1)受试者的选定标准
[0324]
根据上述方案,选择标准设为:i)20岁以上且70岁以下的男女;ii)试验开始前一年内,在体检中未发现异常的健康人;iii)初期内脏脂肪面积为80cm2以上的人;以及iv)能够在未来六个月内维持80%以上的摄取率的人。此外,排除标准设为:a)有重度疾病史的人;b)体检中在肝功能和肾功能检查值中显示异常的人;c)表现出心肺功能障碍的人;d)对食物和药剂过敏的人;e)接受过消化管的手术的人;f)经医生判断为患慢性或急性传染病中的人;g)在本试验开始时正参与着其他临床试验中的人;h)从事剧烈运动的人和减肥中的人;i)孕妇;以及j)其他经试验责任人或试验负责人判断为不合适的人。
[0325]
2)受试者的分配
[0326]
在109名同意参加本试验的人中,依据选定标准将55人组织到本试验中。试验责任医生以确保筛选时不会导致内脏脂肪面积在组间变得不均衡的方式,使用随机数编制了分层随机分配表,并将其密封。上述分配表仅提供给试验食品管理负责人。将后述的试验食品分发给上述的55名试验参加者。盲检化的对象为包括组织者、试验责任医生、试验从业者和试验食品管理负责人在内的所有试验实施机关的工作人员、以及伦理审查委员会的构成成员。上述分配表的开封在试验结束后由统计分析负责人进行。
[0327]
3)试验食品
[0328]
作为试验食品,使用了试样101(cp组)和试样4(fcp组)。作为对照食品(pl组(安慰剂组)),使用麦芽糖糊精(商品名:“pinedex#2”、松谷化学工业公司制)。
[0329]
4)摄取方法
[0330]
将上述试验食品和对照食品分别放入铝袋中,并以其内容物不可知的方式分发。使试验参加者(受试者)自行在喜好的时机摄取各食品(5.0g/天)三个月。下试验参加者忘记摄取时,指示其在当天内以1天1包(5.0g)为限进行服用。
[0331]
5)评价项目
[0332]
5-1)试验日程
[0333]
各种测定在摄取前(0time)和摄取后三个月(3months)时进行实施,将各时间点的实测值和距摄取前的变化量用作结果。
[0334]
5-2)内脏脂肪面积的测定
[0335]
对于内脏脂肪面积,使用了dualscan hds-2000(omron株式会社制、医疗设备批准编号:22300bzx00104000)进行了测定。上述dualscan hds-2000是一种内脏脂肪测定设备,能够通过采用双阻抗法而简单且安全地计算出内脏脂肪面积,其中通过从两条路径流过电流来识别内脏脂肪和腹部皮下脂肪,能够无创地测定内脏脂肪面积而没有受到辐射的风险。
[0336]
5-3)肤质的测定
[0337]
肤质的测定仅对得到同意拍摄面部照片的受试者进行实施。受试者中的男性仅洗脸、女性卸妆并洗脸,然后,在室温下适应了20分钟以上再进行测定。上述测定使用roboskin分析仪(涉谷工业株式会社制)进行了实施。详细而言,对面部的正面、向右方向和向左方向的照片进行了拍摄,并通过roboskin分析的算法评价了色素沉淀。
[0338]
6)统计分析
[0339]
关于统计分析,使用了windows(注册商标)用的statmatev(株式会社atoms公司制)来进行。所有统计分析均通过双侧检验进行,在置信区间95%内,显著性差异水平设定为5%。使用威尔科克森符号秩检验进行摄取前后的组内比较。使用曼-惠特尼u检验进行fcp组与pl组、cp组与pl组这两组间的比较。使用单因素方差分析检验进行了fcp组、pl组以及cp组这三组间的组间的比较,进而进行了图基检验中的双侧检验作为事后检验,从而计算显著性差异。将内脏脂肪面积的变化示于表14,将肤质(色素沉淀的增减评价)的结果示于表15。
[0340]
[表14]
[0341][0342]
平均
±
标准差
[0343]
组内对照:曼-惠特尼u检验、$p<0.05,$$p<0.01(对比pl组)
[0344]
组内对照:威尔科克森符号秩检验、#p<0.05,##p<0.01(对比摄取前)
[0345]
[表15]
[0346][0347]
平均
±
标准差
[0348]
组内对照:曼-惠特尼u检验、$p<0.05,$$p<0.01(对比pl组)
[0349]
组内对照:威尔科克森符号秩检验、#p<0.05,##p<0.01(对比摄取前)
[0350]
组内对照:基于方差分析的图基检验、*p<0.05,**p<0.01(对比pl组)
[0351]
《考察》
[0352]
根据表14,在内脏脂肪面积中,就cp组而言,未确认到与pl组和摄取前的显著性差异。然而,确认到了fcp组与摄取前的显著性差异。而且,不同阶层的男性的110cm2以上的组中,与pl组相比,fcp组的内脏脂肪面积显著减少。在肤质(色素沉淀的增减评价)中,与pl组相比,fcp组的面积和数量均显著减少。同时,与pl组相比,δ(摄取后三个月-摄取前)也显著减少。此外,根据表15,肤质(色素沉淀的增减评价)中,与pl组相比,cp组的δ(摄取后三个月-摄取前)显著减少。
[0353]
受试者中有7人在第三个月的测定中因不得已的事由不能来医院而被剔除。在剔除者以外的受试者中,没有因试验食品的摄取而发生不良事件。综上表明,试样4的生物体功能调整剂的5.0g/天的三个月摄取是安全的,并且上述生物体功能调整剂的摄取使在内脏脂肪面积110cm2以上的男性健康人中的内脏脂肪面积减少。在内脏脂肪面积110cm2以上的受试者中显现出显著性差异的原因被推测是:与小于110cm2的人相比,其内脏脂肪量多,因此容易通过上述生物体功能调整剂的摄取来燃烧内脏脂肪,并容易在三个月内就显现出差异。因此,可以认为即使是内脏脂肪面积小于110cm2的人,通过继续上述生物体功能调整剂的摄取也有可能得到同样的效果。此外表明,上述生物体功能调整剂的摄取不仅抑制内脏脂肪面积,还同时抑制肌肤的色素沉淀。
[0354]
〔第十一试验〕
[0355]
通过将试样5的生物体功能调整剂添加到源自小鼠的前脂肪细胞(3t3-l1、传代数:7代、13pdl)分化而成的脂肪细胞中,对试样5的生物体功能调整剂是否具有脂肪蓄积抑制作用进行了试验。具体而言,按照以下方式执行了第十一试验。
[0356]
(试验方法)
[0357]
将添加到上述脂肪细胞中的试样替换成试样5,除此以外,通过与上述第三试验相同的方法,按照以下方式执行了第十一试验。将结果示于表16。
[0358]
[表16]
[0359][0360]
<考察>
[0361]
根据本试验和第三试验的结果,就试样5而言,与试样1和试样2同样地确认到脂肪蓄积抑制效果。由此可确认,即使原料不同,也能得到同样的效果。
[0362]
〔总结〕
[0363]
综上可理解为试样1~试样5和试样41~49的生物体功能调整剂具有脂肪蓄积抑制作用和表皮代谢促进作用。而且还表明,试样1~试样5和试样41~49具有生物体内的脂肪细胞因子量的调整作用。
[0364]
本文公开的实施方案和实施例应被认为是说明性的,而不是以任何方式进行限制。本发明的范围由所附权利要求书而不是上述说明书给出,并且落入所附权利要求书及其等同物范围内的所有改变均包含在其中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1