用于炎性肠病的组合疗法的制作方法
1.本公开内容总体上涉及用于治疗或预防炎性肠病的方法。
2.背景
3.炎性肠病是复杂的胃肠道特发特应性状况,其在工业化国家日益流行,并且估计仅在美国就有多于一百万患者。炎性肠病有两种主要的亚型,克罗恩病和溃疡性结肠炎。克罗恩病可以发生在下胃肠道的任何部位,尽管它主要影响回肠和大肠。溃疡性结肠炎大多局限于结肠,并且可以使个体易患结肠炎相关癌症,通常为结肠直肠癌。
4.克罗恩病和溃疡性结肠炎的病因尚未完全阐明,但它们被认为是肠黏膜的炎性状况,其特征在于使针对胃肠道共生微生物群(commensal microbiota)的免疫应答改变和失调。在症状上,这些疾病与腹痛、腹泻(通常有血)以及各种其他临床表现诸如关节炎和葡萄膜炎相关。
5.多年来,类固醇(特别是皮质类固醇,诸如泼尼松)是炎性肠病的主要治疗选择。然而,类固醇的长期使用与显著的不希望的副作用相关,并且该疾病可能成为类固醇难治性的。目前用于治疗克罗恩病和溃疡性结肠炎两者的非基于类固醇的治疗选择包括氨基水杨酸(诸如5-氨基水杨酸、柳氮磺胺吡啶、美沙拉明)、抗生素(诸如环丙沙星和甲硝唑)、免疫抑制剂(诸如环孢菌素a、他克莫司、硫唑嘌呤、甲氨蝶呤)、肿瘤坏死因子(tnf)拮抗剂(诸如英利昔单抗、阿达木单抗)和janus激酶(jak)抑制剂(诸如托法替尼)。然而,患者对这些治疗的响应随着疾病的严重程度而变化,并且也可能随着活动性炎症和缓解的周期而变化。
6.对于开发新的和改进的用于治疗炎性肠病的治疗选择存在持续的需求。
7.本公开内容的概述
8.本发明的第一方面提供了用于治疗炎性肠病或其至少一种症状的方法,该方法包括向有相应需要的受试者施用有效量的:
9.(i)选自免疫抑制剂和氨基水杨酸的化合物;和
10.(ii)一种或更多种乳杆菌属(lactobacillus)物种和/或来源于在其中已经培养了所述一种或更多种乳杆菌属物种的培养基的培养物上清液或无细胞培养物滤液,所述一种或更多种乳杆菌属物种选自布氏乳杆菌(lactobacillus buchneri)、类干酪乳杆菌(lactobacillus paracasei)、玉米乳杆菌(lactobacillus zeae)、芜菁乳杆菌(lactobacillus rapi)、类谷糠乳杆菌(lactobacillus parafarraginis)和食二酸乳杆菌(lactobacillus diolivorans)。
11.炎性肠病可以是急性状况或慢性状况。通常,炎性肠病是溃疡性结肠炎或克罗恩病。在示例性实施方案中,炎性肠病是溃疡性结肠炎。溃疡性结肠炎可以是慢性溃疡性结肠炎。
12.炎性肠病的症状可以是临床症状,例如,粪便稠度差、存在便血、腹痛或腹泻,或者可以是生理症状,包括促炎性细胞因子的表达升高。
13.在实施方案中,免疫抑制剂是钙调神经磷酸酶抑制剂。在示例性实施方案中,钙调神经磷酸酶抑制剂是环孢菌素a。
14.在实施方案中,免疫抑制剂是tnf抑制剂。在示例性实施方案中,tnf抑制剂是阿达木单抗。
15.在实施方案中,免疫抑制剂是jak抑制剂。在示例性实施方案中,jak抑制剂是托法替尼。
16.在示例性实施方案中,氨基水杨酸是5-氨基水杨酸。
17.一种或更多种乳杆菌属物种可以包括所述乳杆菌属物种中的至少三种,任选地包括布氏乳杆菌(l.buchneri)、类干酪乳杆菌(l.paracasei)和玉米乳杆菌(l.zeae)的组合。因此,在实施方案中,该方法包括向受试者施用布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
18.在实施方案中,该方法包括向受试者施用有效量的环孢菌素a以及布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
19.在实施方案中,该方法包括向受试者施用有效量的tnf抑制剂,任选地阿达木单抗,以及布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
20.在实施方案中,该方法包括向受试者施用有效量的jak抑制剂,任选地托法替尼,以及布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
21.在实施方案中,该方法包括向受试者施用有效量的5-氨基水杨酸以及布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
22.免疫抑制剂或氨基水杨酸和一种或更多种乳杆菌属物种、来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液,可以被配制在同一组合物中用于施用。可选地,免疫抑制剂或氨基水杨酸和一种或更多种乳杆菌属物种可以在单独的组合物中施用。这样的分别施用可以是顺序性的或同时的。
23.免疫抑制剂或氨基水杨酸和一种或更多种乳杆菌属物种、来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液,可以通过相同或不同的途径(例如,口服、舌下、表面(topically)或肠胃外)施用。
24.本公开内容的第二方面提供了用于减少患有炎性肠病的受试者中一种或更多种促炎性细胞因子的表达的方法,该方法包括向受试者施用有效量的:
25.(i)选自免疫抑制剂和氨基水杨酸的化合物;和
26.(ii)一种或更多种乳杆菌属物种和/或来源于在其中已经培养了所述一种或更多种乳杆菌属物种的培养基的培养物上清液或无细胞培养物滤液,所述一种或更多种乳杆菌属物种选自布氏乳杆菌、类干酪乳杆菌、玉米乳杆菌、芜菁乳杆菌、类谷糠乳杆菌和食二酸乳杆菌。
27.在实施方案中,促炎性细胞因子选自il-6、kc-gro、tnfα和il-1β。
28.在特定实施方案中,化合物选自:钙调神经磷酸酶抑制剂,任选地环孢菌素a;tnf抑制剂,任选地阿达木单抗;jak抑制剂,任选地托法替尼;和5-氨基水杨酸。
29.一种或更多种乳杆菌属物种可以包括所述乳杆菌属物种中的至少三种,任选地包
括布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌的组合。因此,在实施方案中,该方法包括向受试者施用布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
30.在特定实施方案中,该方法包括向受试者施用有效量的环孢菌素a以及布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
31.本公开内容的第三方面提供了以下在制备用于治疗炎性肠病或其至少一种症状的药物中的用途:
32.(i)选自免疫抑制剂和氨基水杨酸的化合物;和
33.(ii)一种或更多种乳杆菌属物种和/或来源于在其中已经培养了所述一种或更多种乳杆菌属物种的培养基的培养物上清液或无细胞培养物滤液,所述一种或更多种乳杆菌属物种选自布氏乳杆菌、类干酪乳杆菌、玉米乳杆菌、芜菁乳杆菌、类谷糠乳杆菌和食二酸乳杆菌。
34.在特定实施方案中,化合物选自:钙调神经磷酸酶抑制剂,任选地环孢菌素a;tnf抑制剂,任选地阿达木单抗;jak抑制剂,任选地托法替尼;和5-氨基水杨酸。
35.在特定实施方案中,一种或更多种乳杆菌属物种包括布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌。因此,在实施方案中,该药物包含布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
36.在实施方案中,该药物包含环孢菌素a以及布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
37.在实施方案中,该药物包含tnf抑制剂,任选地阿达木单抗,以及布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
38.在实施方案中,该药物包含jak抑制剂,任选地托法替尼,以及布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
39.在实施方案中,该药物包含5-氨基水杨酸以及布氏乳杆菌、类干酪乳杆菌和玉米乳杆菌或来自其的一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合。
40.根据上述方面和实施方案,并如本文描述和例示的,通常免疫抑制剂或氨基水杨酸与一种或更多种乳杆菌属物种的组合是协同性组合。
41.附图简述
42.在本文中参考附图仅通过非限制性实例的方式来描述本公开内容的示例性实施方案。
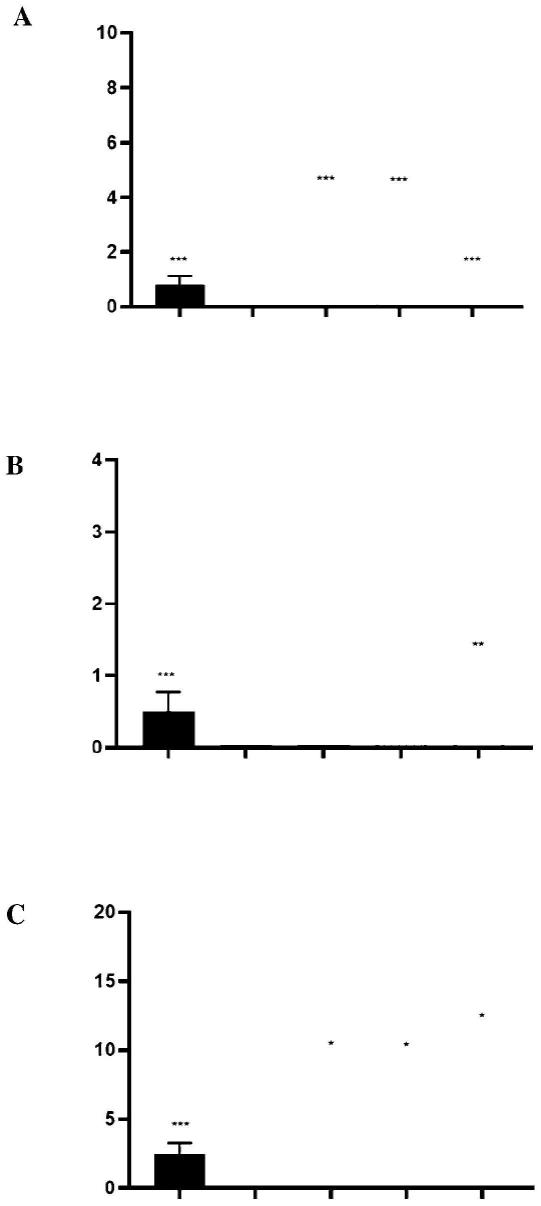
43.图1.在如实施例1中描述的治疗之后,在3%dss诱导的结肠炎模型的小鼠中的便血(a)、粪便稠度(b)和疾病活动指数(c)评分。从左到右:分别为如实施例1中描述的第1组至第5组。*,p《0.05,与第2组相比的dunnett检验。**,p《0.01,与第2组相比的dunnett检验。***,p《0.001,与第2组相比的dunnett检验。
44.图2.在如实施例1中描述的治疗之后,在3%dss诱导的结肠炎模型的小鼠中的结肠黏膜细胞因子表达分析(a,il-6;b,kc-gro;c,tnfα;d,il-1β)。从左到右:分别为如实施
例1中描述的第1组至第5组。对于a-c:**,p《0.01,与第2组相比的dunnett检验;***,p《0.001,与第2组相比的dunnett检验。对于d:**,p《0.005,与第2组相比的dunnett检验。
45.图3.在如实施例1中描述的治疗之后,在3%dss诱导的结肠炎模型的小鼠结肠中溃疡和炎症的总的、近端、中间和远端综合评分。从左到右:如实施例1中描述的第1组至第5组。*,p《0.05,与第2组相比的dunnett检验。***,p《0.001,与第2组相比的dunnett检验。
46.图4.在如实施例1中描述的治疗之后,在3%dss诱导的结肠炎模型的小鼠中的结肠长度(mm)。从左到右:如实施例1中描述的第1组至第5组。*,p《0.05,与第2组相比的dunnett检验。***,p《0.001,与第2组相比的dunnett检验。
47.图5.在如实施例2中描述的治疗后第1天至第11天,在3%dss诱导的结肠炎模型的小鼠中的便血(a)、粪便稠度(b)和疾病活动指数(c)评分:圆形,未处理小鼠;方形,3%dss+媒介物(对照);三角形,3%dss+乳杆菌属svt菌株;倒三角形,3%dss+5-asa;菱形,3%dss+乳杆菌属svt菌株+5-asa。
48.图6.在如实施例3中描述的治疗后第1天至第11天,在3%dss诱导的结肠炎模型的小鼠中的便血(a)、粪便稠度(b)和疾病活动指数(c)评分。数字1至5(用虚线表示)分别代表实施例3的治疗组1至5:圆形(1),未处理小鼠;方形(2),3%dss+媒介物(对照);三角形(3),3%dss+乳杆菌属svt菌株;圆形(4),3%dss+托法替尼;方形(5),3%dss+乳杆菌属svt菌株+托法替尼。
49.图7.在如实施例4中描述的治疗后第1天至第11天,在3%dss诱导的结肠炎模型的小鼠中的便血(a)、粪便稠度(b)和疾病活动指数(c)评分。数字1至5(用虚线表示)分别代表实施例4的治疗组1至5:圆形(1),未处理小鼠;方形(2),3%dss+媒介物(对照);三角形(3),3%dss+乳杆菌属svt菌株;三角形(4),3%dss+阿达木单抗;倒三角形(5),3%dss+乳杆菌属svt菌株+阿达木单抗。
50.详述
51.除非另有定义,否则本文中所使用的全部技术术语和科学术语具有与本公开内容所属领域的普通技术人员通常所理解的相同得含义。尽管与本文描述的那些相似或等同的任何方法和材料都可以用于实践或测试本公开内容,但描述了典型的方法和材料。
52.冠词“一(a)”和“一(an)”在本文用于指一个或多于一个(即至少一个)的该冠词的语法对象。例如,“要素(an element)”意指一个要素或多于一个要素。
53.在本说明书的上下文中,术语“约”被理解为是指本领域技术人员在实现相同功能或结果的上下文中将认为等同于所叙述的值的数字的范围。
54.在整个本说明书和所附的权利要求书中,除非上下文另有要求,词语“包含(comprise)”和变化形式诸如“包含(comprises)”或“包含(comprising)”将被理解为暗示包括陈述的整数或步骤或者整数或步骤的组,但不排除任何其他整数或步骤或者整数或步骤的组。
55.如本文使用的,术语“有效量”在其含义内包括无毒的但足以提供期望的治疗效果的组合物的量。所需的确切量将根据诸如被治疗的物种、受试者的年龄和一般状况、被治疗状况的严重程度、被施用的特定剂以及施用的模式等等因素因受试者而异。对于任何给定的病例,适当的“有效量”可以由本领域普通技术人员仅使用常规实验确定。
56.如本文使用的术语“受试者”是指哺乳动物,并且包括人类、灵长类动物、家畜动物
(例如,牛、奶牛、马、免羊、猪)、实验室实验动物(test animal)(例如,小鼠、兔、大鼠、豚鼠)、伴侣动物(例如,犬、猫)、表演动物(例如,赛马(racehorse))和圈养野生动物。在示例性实施方案中,哺乳动物是人类。
57.如本文使用的,术语“治疗(treating)”、“治疗(treatment)”等是指补救或以其他方式阻碍、延缓或逆转炎性肠病的进展或者这种疾病的至少一种症状的任何和所有应用,包括降低疾病的严重程度。因此,治疗不一定意味着治疗受试者直至疾病完全消除或从疾病恢复。
58.术语“任选地”在本文用于意指随后描述的特征可以存在或可以不存在,或者随后描述的事件或情况可以发生或可以不发生。因此,本说明书将被理解为包括和涵盖其中存在该特征的实施方案和其中不存在该特征的实施方案,以及其中该事件或情况发生的实施方案和其中该事件或情况不发生的实施方案。
59.在本说明书的上下文中,术语“微生物生物治疗剂”被赋予其最广泛的含义,并且被理解为指当以有效量施用至受试者时促进受试者中的健康益处的微生物细胞群体或制品或者微生物细胞群体或制品的组分。
60.在本说明书的上下文中,术语“益生元(prebiotic)”被赋予其最广泛的含义,并且被理解为是指刺激共生有益细菌在消化系统中的生长和/或活性的任何不可消化的物质。
61.在本说明书的上下文中,术语“食品(food)”、“食品(foods)”、“饮料(beverage)”或“饮料(beverages)”包括但不限于健康食品和饮料、功能食品和饮料以及用于特定健康用途的食品和饮料。当本发明的这种食品或饮料用于除了人类以外的受试者时,该术语可以用于包括饲料。
62.本文提供了用于治疗炎性肠病或其至少一种症状的方法,该方法包括向有相应需要的受试者施用有效量的:
63.(i)选自免疫抑制剂和氨基水杨酸的化合物;和
64.(ii)一种或更多种乳杆菌属物种和/或来源于在其中已经培养了所述一种或更多种乳杆菌属物种的培养基的培养物上清液或无细胞培养物滤液,所述一种或更多种乳杆菌属物种选自布氏乳杆菌、类干酪乳杆菌、玉米乳杆菌、芜菁乳杆菌、类谷糠乳杆菌和食二酸乳杆菌。
65.本文还提供了减少患有炎性肠病的受试者中一种或更多种促炎性细胞因子的表达的方法,该方法包括向受试者施用有效量的:
66.(i)选自免疫抑制剂和氨基水杨酸的化合物;和
67.(ii)一种或更多种乳杆菌属物种和/或来源于在其中已经培养了所述一种或更多种乳杆菌属物种的培养基的培养物上清液或无细胞培养物滤液,所述一种或更多种乳杆菌属物种选自布氏乳杆菌、类干酪乳杆菌、玉米乳杆菌、芜菁乳杆菌、类谷糠乳杆菌和食二酸乳杆菌。
68.本公开内容的方法涉及的炎性肠病可以选自例如溃疡性结肠炎、克罗恩病、缺血性结肠炎、小肠结肠炎、抗生素相关性出血性结肠炎(aahc)、显微镜下结肠炎和结肠袋炎。在特定实施方案中,炎性肠病选自溃疡性结肠炎和克罗恩病。溃疡性结肠炎可以是急性或慢性溃疡性结肠炎。
69.与炎性肠病相关的至少一种症状可以是临床症状或生理症状,包括例如腹泻,粪
便稠度差,存在便血,腹痛,小肠、大肠或结肠上皮衬里(epithelial lining)溃疡,或者一种或更多种促炎性细胞因子相对于未患炎性肠病的个体中观察到的表达水平的表达升高。本领域技术人员将容易理解,本公开内容的范围不应通过提及这些示例性症状而受限,并且存在本公开内容将包括的炎性肠病的其他症状。
70.根据本公开内容的实施方案,表达可以被减少的促炎性细胞因子包括但不限于白细胞介素诸如il-6和il-1β,kc-gro(角质形成细胞趋化因子/人类生长调节致癌基因)和tnfα。
71.在其中方法减少患有炎性肠病的受试者中一种或更多种促炎性细胞因子的表达的本公开内容的实施方案中,所观察到的减少是相对于在不存在所述治疗的情况下的受试者中观察到的促炎性细胞因子的表达水平。这样的减少可以包括促炎性细胞因子表达水平的正常化。
72.本公开内容的方法可以抑制与炎性肠病相关的炎症。术语“抑制(inhibit)”及其变化形式诸如“抑制(inhibition)”、“抑制(inhibits)”、“减少(reduces)”、“减少(reducing)”等,在本文中可互换地使用以表示与炎性肠病相关的炎症的严重程度的改善(即,减少)。
73.本公开内容的方法采用免疫抑制剂或氨基水杨酸与一种或更多种乳杆菌属物种和/或来源于在其中已经培养了所述一种或更多种乳杆菌属物种的培养基的培养物上清液或无细胞培养物滤液的组合的施用,所述一种或更多种乳杆菌属物种选自布氏乳杆菌、类干酪乳杆菌、玉米乳杆菌、芜菁乳杆菌、类谷糠乳杆菌和食二酸乳杆菌。如本文例示的,通常免疫抑制剂或氨基水杨酸与一种或更多种乳杆菌属物种的组合是协同性组合。
74.在特定实施方案中,免疫抑制剂可以是钙调神经磷酸酶抑制剂、硫嘌呤、tnf抑制剂或jak抑制剂。示例性钙调神经磷酸酶抑制剂包括但不限于环孢菌素a、他克莫司及其类似物。示例性硫嘌呤包括但不限于硫唑嘌呤、6-巯基嘌呤及其类似物。示例性tnf抑制剂包括但不限于单克隆抗体,诸如阿达木单抗、英利昔单抗、那他珠单抗、赛妥珠单抗、戈利木单抗及其生物类似药(biosimilars),但不包括依那西普。在特定实施方案中,氨基水杨酸是5-氨基水杨酸(美沙拉嗪)或柳氮磺胺吡啶或其类似物。jak抑制剂可以是选择性或非选择性抑制剂,并且可以是例如jak1抑制剂、jak2抑制剂、jak1/jak2抑制剂、jak3抑制剂或tyk2抑制剂。示例性jak抑制剂包括但不限于托法替尼、巴瑞替尼(baracitinib)、乌帕替尼(upadacitinib)、鲁索替尼(ruxolitinib)、奥拉替尼(oclacitinib)、吡西替尼(peficitinib)、非戈替尼(filgotinib)、菲卓替尼(fedracitinib)、deucravacitinib和阿布昔替尼(abrocitinib)。
75.在一些实施方案中,免疫抑制剂或氨基水杨酸是一种已知的当作为唯一治疗剂在炎性肠病治疗中使用时具有至少部分效力的治疗剂。
76.在示例性实施方案中,化合物选自:钙调神经磷酸酶抑制剂,任选地环孢菌素a;tnf抑制剂,任选地阿达木单抗;jak抑制剂,任选地托法替尼;和5-氨基水杨酸。
77.本公开内容的方法采用一种或更多种乳杆菌属物种和/或来源于在其中已经培养了所述一种或更多种乳杆菌属物种的培养基的培养物上清液或无细胞培养物滤液的施用,所述一种或更多种乳杆菌属物种选自布氏乳杆菌,类干酪乳杆菌、玉米乳杆菌、芜菁乳杆菌、类谷糠乳杆菌和食二酸乳杆菌。鉴于一些分类学上的差异和不确定性,玉米乳杆菌在别
处也可能被称为干酪乳杆菌(lactobacillus casei)。然而,为了本公开内容的目的,保留玉米乳杆菌命名。
78.在以下讨论中,在施用乳杆菌属物种或来源于在其中已经培养了乳杆菌的培养基的培养物上清液或无细胞培养物滤液的上下文中,以及在包含乳杆菌属物种或来源于在其中已经培养了乳杆菌的培养基的培养物上清液或无细胞培养物滤液的组合物的情况下,术语“乳杆菌属/乳杆菌”不仅可以用于指本文定义的特定乳杆菌属物种本身,而且还更广泛地指来源于在其中已经培养了本文定义的特定乳杆菌属物种的培养基的培养物上清液或无细胞培养物滤液。在特定实施方案中,在施用乳杆菌属物种本身的情况下,细胞是可繁殖性存活的。
79.如本文使用的术语“培养物(culture)”是指液体培养物和平板培养物两者。如本文使用的,“培养”是指生物体在各种类型的培养基上或培养基中的繁殖。“纯的”培养物是在不存在其他物种或类型的情况下生长的生物体群体。物种或菌株的“基本上纯的培养物”是指除了期望的物种或菌株之外基本上不含其他微生物的培养物。换句话说,基本上纯的培养物基本上不含其他污染物,其他污染物可以包括微生物污染物以及不期望的化学污染物。待施用的培养物可以包括培养至例如稳定期或对数期(任选地对数早期、对数中期或对数晚期)的细胞。类似地,待施用的培养物上清液或无细胞培养物滤液可以从培养至例如稳定期或对数期(任选地对数早期、对数中期或对数晚期)的细胞制备。
80.可以使用本领域技术人员已知的任何方法制备无细胞培养物滤液。仅通过实例的方式:本文公开的一种或更多种乳杆菌属物种可以从琼脂斜面接种到合适的营养培养基,并生长至对数晚期。细菌细胞可以通过使液体培养物通过过滤器来收获,并且上清液(“培养物滤液”)可以被过滤灭菌,例如通过0.2μm过滤器,以去除任何剩余的细胞。培养物滤液随后可以冻干或冷冻干燥,并根据需要在去离子水中以浓缩形式重构。然后可以将培养物滤液过滤-灭菌并稀释到适当的浓度以供使用。在另一实例中,无细胞滤液可以在无菌水中稀释(例如10分之1)而无需冷冻干燥或冻干。本领域技术人员将理解,若要被视为无细胞培养物滤液或培养物上清液,不必从培养物中去除每个存活细胞,而是滤液或上清液基本上或主要不含培养的细胞就足够了。在一些实施方案中,术语无细胞培养物滤液和培养物上清液在本文中可以互换使用。任选地,培养物上清液可以由于不存在一个或更多个过滤步骤而不同于无细胞培养物滤液。也就是说,培养物上清液可以通过将生长到例如稳定期或对数期(任选地对数早期、对数中期或对数晚期)的培养物离心来制备。
81.本公开内容的方法可以包括施用乳杆菌属物种布氏乳杆菌、类干酪乳杆菌、玉米乳杆菌、芜菁乳杆菌、类谷糠乳杆菌和食二酸乳杆菌中的任何两种、三种、四种、五种或全部六种,或者来源在于其中已经培养了所述乳杆菌中的两种、三种、四种、五种或全部六种的培养基的培养物上清液或无细胞培养物滤液。在这样的实施方案中,细菌可以单独培养或一起培养。因此,施用可以包括施用包含本文描述的乳杆菌属物种中的两种、三种、四种、五种或全部六种的组合的组合物。类似地,在施用来源于在其中已经培养了所述乳杆菌中的两种、三种、四种、五种或全部六种的培养基的培养物上清液或无细胞培养物滤液的情况下,培养物上清液或无细胞培养物滤液可以来源于单独地培养乳杆菌属物种(所述上清液或无细胞培养物滤液在施用前被组合),或者可以来源于本文描述的乳杆菌属物种中的两种、三种、四种、五种或全部六种的组合培养物。
82.在示例性实施方案中,本公开内容的方法包括施用布氏乳杆菌、类干酪乳杆菌、玉米乳杆菌或其培养物上清液或无细胞培养物滤液的组合。
83.布氏乳杆菌可以是先前在wo2013/063658中描述的以登录号v11/022946可得的布氏乳杆菌lb23。布氏乳杆菌可以是根据布达佩斯条约于2019年2月27日以登录号lmg p-31293保藏在比利时微生物协调保藏中心(belgian co-ordinated collections of micro-organisms,bccm)的布氏乳杆菌svt 06b1(其在别处可能被称为替代名称svt-23)。
84.类干酪乳杆菌可以是先前在wo2014/172758中描述的以登录号v12/022849可得的类干酪乳杆菌lp9(在其中指定为菌株“t9”)。类干酪乳杆菌可以是根据布达佩斯条约于2019年2月27日以登录号lmg p-31290保藏在比利时微生物协调保藏中心(bccm)的类干酪乳杆菌svt 04p1(其在别处可能被称为替代名称svt-09)。
85.玉米乳杆菌可以是先前在wo2013/063658中描述的以登录号v11/022948可得的玉米乳杆菌lz26。玉米乳杆菌可以是根据布达佩斯条约于2019年2月27日以登录号lmg p-31295保藏在比利时微生物协调保藏中心(bccm)的玉米乳杆菌svt 08z1(其在别处可能被称为替代名称svt-26)。
86.芜菁乳杆菌可以是先前在wo2013/063658中描述的以登录号v11/022947可得的芜菁乳杆菌lr24。芜菁乳杆菌可以是根据布达佩斯条约于2019年2月27日以登录号lmg p-31294保藏在比利时微生物协调保藏中心(bccm)的芜菁乳杆菌svt 07r1(其在别处可能被称为替代名称svt-24)。
87.类谷糠乳杆菌可以是先前在wo2013/063658中描述的以登录号v11/022945可得的类谷糠乳杆菌lp18。类谷糠乳杆菌可以是根据布达佩斯条约于2019年2月27日以登录号lmg p-31292保藏在比利时微生物协调保藏中心(bccm)的类谷糠乳杆菌svt 05p2(其在别处可能被称为替代名称svt-18)。
88.食二酸乳杆菌可以是先前在wo2014/172758中描述的以登录号v12/022847可得的食二酸乳杆菌ld3(在其中指定为菌株“n3”)。食二酸乳杆菌可以是根据布达佩斯条约于2019年2月27日以登录号lmg p-31287保藏在比利时微生物协调保藏中心(bccm)的食二酸乳杆菌svt 01d1(其在别处可能被称为替代名称svt-03)。
89.在施用乳杆菌属生物体本身的情况下,根据本公开内容的方法待被施用的单独乳杆菌属物种的浓度将取决于多种因素,包括所采用的单独物种的身份和数目、待被治疗的炎性肠病的确切性质和严重程度、应用组合物的形式和应用组合物的手段。对于任何给定的病例,适当的浓度可以由本领域普通技术人员仅使用常规实验确定。仅通过实例的方式,乳杆菌属物种的浓度,或在组合的情况下存在的每种物种的浓度可以是从约1
×
102cfu/ml至约1
×
10
12
cfu/ml,并且可以是约1
×
103cfu/ml、约2.5
×
103cfu/ml、约5
×
103cfu/ml、1
×
104cfu/ml、约2.5
×
104cfu/ml、约5
×
104cfu/ml、1
×
105cfu/ml、约2.5
×
105cfu/ml、约5
×
105cfu/ml、1
×
106cfu/ml、约2.5
×
106cfu/ml、约5
×
106cfu/ml、1
×
107cfu/ml、约2.5
×
107cfu/ml、约5
×
107cfu/ml、1
×
108cfu/ml、约2.5
×
108cfu/ml、约5
×
108cfu/ml、1
×
109cfu/ml、约2.5
×
109cfu/ml、或约5
×
109cfu/ml、约1
×
10
10
cfu/ml、约1.5
×
10
10
cfu/ml、约2.5
×
10
10
cfu/ml、约5
×
10
10
cfu/ml、约1
×
10
11
cfu/ml、约1.5
×
10
11
cfu/ml或约1
×
10
12
cfu/ml。
90.本公开内容还设想了使用本文描述的乳杆菌属物种的变体。如本文使用的,术语“变体”是指本文公开和例示的物种的天然存在的和特别开发的变体或突变体两者。变体可以具有或可以不具有与本文例示的特定物种鉴定的相同的生物学特征,条件是它们在治疗或预防炎性状况方面共有相似的有利特性。用于制备本文例示的变体的合适方法的说明性实例包括但不限于基因整合技术,诸如通过插入元件或转座子或通过同源重组介导的那些技术,用于修饰、插入、缺失、活化或沉默基因的其他重组dna技术,种内原生质体融合,通过用紫外光或x射线照射或通过用化学诱变剂诸如亚硝基胍、甲基甲烷磺酸酯、氮芥等处理进行诱变,以及噬菌体介导的转导。合适的且可适用的方法在本领域中是熟知的,并且尤其在以下中描述:例如,j.h.miller,experiments in molecular genetics,cold spring harbor laboratory press,cold spring harbor,n.y.(1972);j.h.miller,a short course in bacterial genetics,cold spring harbor laboratory press,cold spring harbor,n.y.(1992);和j.sambrook,d.russell,molecular cloning:a laboratory manual,第3版,cold spring harbor laboratory press,cold spring harbor,n.y.(2001)。
91.如本文使用的术语“变体”还涵盖在系统发育上与本文描述的乳杆菌属物种密切相关的微生物菌株,以及在一个或更多个系统发育信息标志物上与本文描述的物种具有大的序列同一性的菌株,所述标志物诸如rrna基因、延伸因子基因和起始因子基因、rna聚合酶亚基基因、dna旋转酶基因、热休克蛋白基因和reca基因。例如,如本文设想的“变体”菌株的16s rrna基因可以与本文公开的菌株共有约85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的序列同一性。
92.根据本公开内容,本文描述的乳杆菌属物种及其组合或来源于培养基的培养物上清液或无细胞培养物滤液通常以组合物的形式施用。在物种的组合或来源于培养多种物种的培养物上清液或无细胞培养物滤液的实施方案中,本领域技术人员将理解,待被施用的每种物种、上清液或培养物滤液不需要包含在相同的组合物中。在施用是分开的情况下,施用可以是顺序性的或同时的。
93.类似地,免疫抑制剂或氨基水杨酸可以与一种或更多种乳杆菌属物种或一种或更多种培养物上清液或一种或更多种无细胞培养物滤液在同一组合物中施用,或者可以在不同的组合物中施用。在免疫抑制剂或氨基水杨酸存在于不同组合物中的情况下,组合物可以顺序地或同时地施用。
94.根据本公开内容使用的组合物可以通过混合相关组分并将所得混合物配制成适于施用至受试者的剂型来制备。因此,组合物可以包含药学上可接受的载体、稀释剂、赋形剂和/或辅料。载体、稀释剂、赋形剂和辅料在与组合物的其他组分相容方面必须是“可接受的”,并且对接受组合物的受试者无害。制备用于施用的合适组合物的方法以及适于配制用于表面施用、口服施用或舌下施用的组合物的载体、稀释剂、赋形剂和辅料是本领域技术人员熟知的。在示例性实施方案中,组合物可以包含在细胞培养后浓缩(例如通过离心和/或过滤)去除多余培养基的一种或更多种微生物生物治疗性菌株。因此,组合物可以包含残余的食品级培养基中的一种或更多种微生物生物治疗性菌株。可选地,组合物可以与包含无菌等渗盐水或3%蔗糖的载体一起配制。
95.组合物可以通过任何方便或合适的途径施用,包括但不限于以下的各种途径:口服、舌下、含服、经直肠、表面、鼻内、眼内、经粘膜、经肠、肠内、肌肉内、皮下、髓内、鞘内、心
室内、脑内、膀胱内、静脉内或腹膜内。适当的途径可以取决于,例如,待被治疗的炎性肠病的性质和严重程度。在免疫抑制剂或氨基水杨酸在与一种或更多种乳杆菌属物种或一种或更多种培养物上清液或一种或更多种无细胞培养物滤液不同的组合物中施用的情况下,组合物的施用途径可以相同或不同。
96.仅通过实例的方式:包含一种或更多种乳杆菌属物种或者来源于在其中已经培养了所述一种或更多种乳杆菌属物种的培养基的培养物上清液或无细胞培养物滤液的组合物可以口服施用;包含氨基水杨酸的组合物可以口服施用;并且包含免疫抑制剂的组合物可以口服或通过注射施用。例如,包含托法替尼的组合物可以口服施用,并且包含阿达木单抗的组合物可以通过皮下注射施用。
97.因此,本公开内容的方法设想了在相同或不同的组合物中并且通过相同或不同的途径施用所描述的组合中的组分。本公开内容的方法的示例性实施方案包括口服施用一种或更多种乳杆菌属菌株和免疫抑制剂(诸如csa或托法替尼),其中乳杆菌属菌株与csa或托法替尼在相同或不同的组合物中。本公开内容的方法的示例性实施方案包括口服施用一种或更多种乳杆菌属菌株和asa,其中乳杆菌属菌株与asa在相同或不同的组合物中。本公开内容的方法的示例性实施方案包括口服施用一种或更多种乳杆菌属菌株和通过注射(任选地皮下注射)施用免疫抑制剂诸如阿达木单抗。
98.组合物可以根据本公开内容以任何合适的形式施用,通常以固体形式或液体形式施用。例如,可以使用本领域技术人员熟知的方法和技术将组合物配制成片剂、糖锭(troche)、胶囊、囊片(caplet)、酏剂、悬浮液、糖浆、薄片(wafer)、颗粒、粉末、凝胶、糊剂、溶液、乳膏、喷雾剂、悬浮液、可溶性袋剂(soluble sachet)、锭剂、泡腾片、咀嚼片、多层片剂等。对于口服施用,乳杆菌或组合物可以方便地掺入到多种饮料、食品、营养产品、营养补充剂、食品添加剂、药物、非处方药制剂和动物饲料补充剂中。对于表面应用,合适的媒介物包括但不限于洗剂、搽剂、凝胶、乳膏、软膏、泡沫、喷雾剂、油、粉末等。也可以将通常呈液体或半液体形式的组合物浸渍到经皮贴剂、膏药和伤口敷料诸如绷带或水胶体敷料中。
99.如本领域技术人员将理解的,药学上可接受的载体或稀释剂的选择将取决于施用途径以及待被治疗的状况的性质和严重程度和受试者。本领域技术人员可以容易地确定特定的载体或递送系统和施用途径。本领域技术人员将能够使用常规方法容易地确定在本公开内容的方法中有用的适当制剂。
100.例如,本公开内容的组合物可以被配制成用于以含有可接受的稀释剂(诸如盐水和无菌水)的液体形式施用,或者可以呈洗剂、乳膏或凝胶的形式,所述洗剂、乳膏或凝胶包含可接受的稀释剂或载体以赋予期望的质地、稠度、粘度和外观。可接受的稀释剂和载体是本领域技术人员所熟悉的,并且包括但不限于:乙氧基化表面活性剂和非乙氧基化表面活性剂、脂肪醇、脂肪酸、烃油(诸如棕榈油、椰子油和矿物油)、可可脂蜡、硅油、ph平衡剂、纤维素衍生物、乳化剂诸如非离子有机碱和无机碱、防腐剂、蜡酯、类固醇(steroid alcohol)、甘油三酯、磷脂诸如卵磷脂和脑磷脂、多元醇酯、脂肪醇酯、亲水性羊毛脂衍生物和亲水性蜂蜡衍生物。
101.乳杆菌可使用本领域熟知的药学上可接受的载体容易地被配制成适于口服施用的剂量。这些载体可以选自糖、淀粉、纤维素及其衍生物、麦芽、明胶、滑石、硫酸钙、植物油、合成油、多元醇、海藻酸、磷酸盐缓冲溶液、乳化剂、等渗盐水和无热原水。
102.根据本公开内容的用于口服使用的合适的载体、稀释剂、赋形剂和辅料的一些实例包括液体石蜡、羧甲基纤维素钠、甲基纤维素、海藻酸钠、阿拉伯胶、黄蓍胶、右旋糖、蔗糖、山梨醇、甘露醇、明胶和卵磷脂。此外,这些口服制剂可以包含合适的调味剂和着色剂。当以胶囊形式使用时,胶囊可以用延迟崩解的化合物诸如单硬脂酸甘油酯或二硬脂酸甘油酯包衣。辅料通常包括润滑剂(emollient)、乳化剂、增稠剂、防腐剂、杀细菌剂和缓冲剂。对于作为可注射溶液或悬浮液施用,无毒的、胃肠外可接受的稀释剂或载体可以包括林格氏溶液、等渗盐水、磷酸盐缓冲盐水、乙醇和1,2丙二醇。
103.用于口服施用的固体形式可以包含人类和兽医制药实践中可接受的粘合剂、甜味剂、崩解剂、稀释剂、调味剂、包衣剂、防腐剂、润滑剂(lubricant)和/或时间延迟剂。合适的粘合剂包括阿拉伯树胶、明胶、玉米淀粉、黄蓍胶、海藻酸钠、羧甲基纤维素或聚乙二醇。合适的甜味剂包括蔗糖、乳糖、葡萄糖、阿斯巴甜或糖精。合适的崩解剂包括玉米淀粉、甲基纤维素、聚乙烯吡咯烷酮、瓜尔胶、黄原胶、膨润土、海藻酸或琼脂。合适的稀释剂包括乳糖、山梨醇、甘露醇、右旋糖、高岭土、纤维素、碳酸钙、硅酸钙或磷酸二钙。合适的调味剂包括薄荷油、冬青油、樱桃调味剂、橙子调味剂或覆盆子调味剂。合适的包衣剂包括丙烯酸和/或甲基丙烯酸和/或它们的酯的聚合物或共聚物、蜡、脂肪醇、玉米醇溶蛋白、虫胶或谷蛋白。合适的防腐剂包括苯甲酸钠、维生素e、α-生育酚、抗坏血酸、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯或亚硫酸氢钠。合适的润滑剂包括硬脂酸镁、硬脂酸、油酸钠、氯化钠或滑石。合适的时间延迟剂包括单硬脂酸甘油酯或二硬脂酸甘油酯。
104.除了上述的剂之外,用于口服施用的液体形式可以包含液体载体。合适的液体载体包括水、油诸如橄榄油、花生油(peanut oil)、芝麻油、葵花油、红花油、落花生(arachis)油、椰子油、液体石蜡、乙二醇、丙二醇、聚乙二醇、乙醇、丙醇、异丙醇、甘油、脂肪醇、甘油三酯或其混合物。用于口服施用的悬浮液还可以包含分散剂和/或悬浮剂。合适的悬浮剂包括羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素、聚乙烯吡咯烷酮、海藻酸钠或乙酰醇。合适的分散剂包括卵磷脂、脂肪酸诸如硬脂酸的聚氧乙烯酯、聚氧乙烯山梨醇单油酸酯或二油酸酯、硬脂酸酯或月桂酸酯、聚氧乙烯山梨聚糖单油酸酯或二油酸酯、硬脂酸酯或月桂酸酯等。用于口服施用的乳液还可以包含一种或更多种乳化剂。合适的乳化剂包括如以上例示的分散剂或天然树胶,诸如瓜尔胶、阿拉伯胶或黄蓍胶。
105.用于制备合适的可胃肠外施用的组合物的方法将是本领域技术人员熟知的,并且更详细描述于例如remington's pharmaceutical science,第15版,mack publishing company,easton,pa.中,在此通过引入并入本文。
106.对于配制用于表面施用的组合物,药学上可接受的稀释剂的实例是脱矿质水或蒸馏水;盐水溶液;基于植物的油,诸如花生油(peanut oil)、红花油、橄榄油、棉籽油、玉米油、芝麻油诸如花生油(peanut oil)、红花油、橄榄油、棉籽油、玉米油、芝麻油、落花生(arachis)油或椰子油;有机硅油,包括聚硅氧烷,诸如甲基聚硅氧烷、苯基聚硅氧烷和甲基苯基聚硅氧烷;挥发性有机硅;矿物油,诸如液体石蜡、软石蜡或角鲨烷;纤维素衍生物,诸如甲基纤维素、乙基纤维素、羧甲基纤维素、羧甲基纤维素钠或羟丙基甲基纤维素;低级烷醇,例如乙醇或异丙醇;低级芳烷醇;低级聚亚烷基二醇或低级亚烷基二醇,例如聚乙二醇、聚丙二醇、乙二醇、丙二醇、1,3-丁二醇或甘油;脂肪酸酯,诸如棕榈酸异丙酯、肉豆蔻酸异丙酯或油酸乙酯;聚乙烯吡咯烷酮;琼脂;卡拉胶;黄蓍胶或阿拉伯树胶和凡士林胶
(petroleum jelly)。
107.在另外的实施方案中,组合物还可以包含悬浮剂和/或湿润剂,诸如聚维酮或丙二醇,和用于调节组合物粘度的中和剂,诸如氢氧化钠、三乙醇胺(tea)或乙二胺四乙酸(edta)。
108.根据待被治疗或预防的状况、状况的严重程度和期望的结果,本公开内容的组合物可以施用例如一周一次或更多次,任选地例如一周一次、每两天一次、一天一次、一天两次或一天三次。受试者的施用持续时间也将根据待被治疗或预防的状况、状况的严重程度和期望的结果而变化。待被受试者施用的组合物的量将根据一系列因素而变化,包括所施用的微生物的身份、待被治疗或预防的状况的性质和严重程度、受试者的年龄和一般健康状况以及期望的结果。合适的剂量方案可以由熟练的受授人员(skilled addressee)容易地确定。
109.在示例性实施方案中,可以将约1ml至约25ml的乳杆菌属物种的液体制剂以约105cfu/ml与10
12
cfu/ml之间的最终浓度以每天一次、每天两次或更频繁的基础施用至受试者。液体制剂的体积可以是例如约1ml、2ml、3ml、4ml、5ml、6ml、7ml、8ml、9ml、10ml、11ml、12ml、13ml、14ml、15ml、16ml、17ml、18ml、19ml、20ml、21ml、22ml、23ml、24ml或25ml。
110.免疫抑制剂或氨基水杨酸与一种或更多种乳杆菌属物种或一种或更多种培养物上清液或一种或更多种无细胞培养物滤液的组合可以联合一种或更多种其他治疗剂一起施用,其他治疗剂例如但不限于抗生素、抗微生物剂、抗菌剂、麻醉剂、抗炎剂、免疫抑制剂和其他治疗炎性状况需要的治疗剂,诸如类固醇和nsaid。相对于本文描述的组合物和本公开内容的主题,这样的另外的剂的施用可以在相同时间或在不同时间(即同时或顺序性的),并且可以通过相同或不同的途径施用。
111.可以采用的另外的抗炎剂的非限制性实例包括甾体化合物和非甾体化合物,诸如丙酸氯倍他索(clobetasol propionate)、二丙酸倍他米松、丙酸卤倍他索(halobetasol propionate)、双醋酸二氟拉松(diflorasone diacetate)、醋酸氟轻松(fluocinonide)、哈西奈德(halcinonide)、安西奈德(amcinonide)、去羟米松(desoximetasone)、曲安奈德(triamcinolone acetonide)、糠酸莫米松(mometasone furoate)、丙酸氟替卡松(fluticasone propionate)、二丙酸倍他米松(betamethasone dipropionate)、醋酸氟轻松(fluocinolone acetonide)、戊酸氢化可的松、丁酸氢化可的松、氟氢缩松(flurandrenolide)、曲安奈德、糠酸莫米松、曲安奈德、丙酸氟替卡松、地奈德(desonide)、醋酸氟轻松、戊酸氢化可的松、泼尼卡酯(prednicarbate)、曲安奈德、地奈德、氢化可的松、醋酸丙酸氢化可的松、丁酸丙酸氢化可的松、醋丙甲泼尼龙(methylprednisolone aceponate)、糠酸莫米松和泼尼卡酯。合适的非甾体抗炎化合物的非限制性实例包括吲哚美辛(indomethacin)、酮洛芬(ketoprofen)、联苯乙酸(felbinac)、双氯芬酸(diclofenac)、布洛芬(ibuprofen)、吡罗昔康(piroxicam)、苄达明(benzydamin)、乙酰水杨酸、二氟尼柳(diflunisal)、双水杨酯(salsalate)、萘普生(naproxen)、非诺洛芬(fenoprofen)、酮洛芬(ketoprofen)、氟比洛芬(flurbiprofen)、奥沙普秦(oxaprozin)、洛索洛芬(loxoprofen)、吲哚美辛、舒林酸(sulindac)、依托度酸(etodolac)、酮咯酸(ketorolac)、双氯芬酸(diclo-fenac)、萘丁美酮(nabumetone)、吡罗昔康(piroxicam)、美洛昔康(meloxicam)、替诺昔康(tenoxicam)、屈噁昔康(droxicam)、氯诺昔康
(lornoxicam)、伊索昔康(isoxicam)、甲芬那酸(mefenamic acid)、甲氯芬那酸(meclofenamic acid)、氟苯那酸(flufenamic acid)、托芬那酸(tolfenamic acid)、非罗考昔(firocoxib)和利克飞龙(licofelone)、半合成的糖胺聚糖醚、黄烷醇(flavanols)、类黄酮(flavonoids)、异黄酮(isoflavones)及衍生物。抗炎剂可以是细胞因子信号传导的抑制剂,诸如,例如环孢菌素a、6-硫鸟嘌呤、柳氮磺胺吡啶、美沙拉嗪(5-氨基水杨酸)、依那西普、泼尼松龙或巴柳氮。
112.抗感染剂可以是治疗受试者的感染的任何剂。在特定实施方案中,抗感染剂能够杀死或抑制感染性生物体的生长,该感染性生物体能够通过凋亡小体在细胞之间整体地或部分地转移。合适的抗感染剂包括但不限于抗病毒剂、抗细菌剂、抗原生动物剂或其组合。
113.说明性的抗病毒剂包括但不限于:硫酸阿巴卡韦(abacavir sulfate)、阿昔洛韦(acyclovir)特别是阿昔洛韦钠、阿德福韦(adefovir)、金刚烷胺(amantadine)特别是盐酸金刚烷胺、安普那韦(amprenavir)、安普利近(ampligen)、阿扎那韦(atazanavir)、西多福韦(cidofovir)、地瑞那韦(darunavir)、地拉韦啶(delavirdine)特别是甲磺酸地拉韦啶、地达诺新(didanosine)、二十二烷醇(docosanol)、度鲁特韦(dolutegravir)、依度尿苷(edoxudine)、依法韦仑(efavirenz)、恩曲他滨(emtricitabine)、埃替格韦(elvitegravir)、恩夫韦地(enfuvirtide)、恩替卡韦(entecavir)、泛昔洛韦(famciclovir)、福米韦生(fomivirsen)特别是福米韦生纳、膦甲酸(foscarnet)特别是膦甲酸钠、更昔洛韦(ganciclovir)、伊巴他滨(ibacitabine)、碘苷(idoxuridine)、咪喹莫特(imiquimod)、茚地那韦(indinavir)特别是硫酸茚地那韦、异丙肌苷(inosine pranobex)、拉米夫定(lamivudine)、洛匹那韦(lopinavir)、马拉维若(maraviroc)、美替沙腙(methisazone)、吗啉胍(moroxydine)、奈非那韦(nelfinavir)特别是甲磺酸奈非那韦、奈韦拉平(nevirapine)、硝唑尼特(nitazoxanide)、奥司他韦(oseltamivir)特别是磷酸奥司他韦、喷昔洛韦(penciclovir)、帕拉米韦(peramivir)、普拉康纳利(pleconaril)、鬼臼毒素(podophyllotoxin)、雷特格韦(raltegravir)、利巴韦林(ribavirin)、金刚乙胺(rimantadine)特别是盐酸金刚乙胺、利托那韦(ritonavir)、沙奎那韦(saquinavir)特别是甲磺酸沙奎那韦、索非布韦(sofosbuvir)、司他夫定(stavudine)、telaprivir、替诺福韦(tenofovir)、替拉那韦(tipranavir)、曲氟尿苷(trifluridine)、曲金刚胺(tromantadine)、乌芬诺韦(umifenovir)、伐昔洛韦(valaciclovir)特别是盐酸伐昔洛韦、缬更昔洛韦(valganciclovir)、维立韦罗(vicriviroc)、阿糖腺苷(vidarabine)、韦拉米啶(viramidine)、扎西他滨(zalcitabine)、扎那米韦(zanamivir)、齐多夫定(zidovudine)、以及其药学上可接受的盐及其组合。
114.说明性的抗菌剂包括但不限于喹诺酮类(quinolones)(例如,氨氟沙星(amifloxacin)、西诺沙星(cinoxacin)、环丙沙星(ciprofloxacin)、依诺沙星(enoxacin)、氟罗沙星(fleroxacin)、氟甲喹(flumequine)、洛美沙星(lomefloxacin)、萘啶酸(nalidixic acid)、诺氟沙星(norfloxacin)、氧氟沙星(ofloxacin)、左氧氟沙星(levofloxacin)、洛美沙星(lomefloxacin)、噁喹酸(oxolinic acid)、培氟沙星(pefloxacin)、罗索沙星(rosoxacin)、替马沙星(temafloxacin)、托氟沙星(tosufloxacin)、司帕沙星(sparfloxacin)、克林沙星(clinafloxacin)、加替沙星(gatifloxacin)、莫西沙星(moxifloxacin)、吉米沙星(gemifloxacin)和加雷沙星
(garenoxacin))、四环素类、甘氨环素类(glycylcyclines)和噁唑烷酮类(oxazolidinones)(例如,金霉素(chlortetracycline)、地美环素(demeclocycline)、多西环素(doxycycline)、赖甲环素(lymecycline)、美他环素(methacycline)、米诺环素(minocycline)、氧四环素(oxytetracycline)、四环素、替加环素(tigecycline);利奈唑胺(linezolide)、依哌唑胺(eperezolid))、糖肽类(glycopeptides)、氨基糖苷类(aminoglycosides)(例如,阿米卡星(amikacin)、阿贝卡星(arbekacin)、丁苷菌素(butirosin)、地贝卡星(dibekacin)、福提霉素(fortimicins)、庆大霉素(gentamicin)、卡那霉素(kanamycin)、新霉素、奈替米星(netilmicin)、核糖霉素(ribostamycin)、西索米星(sisomicin)、壮观霉素(spectinomycin)、链霉素(streptomycin)、妥布霉素(tobramycin))、β-内酰胺类(例如,亚胺培南(imipenem)、美罗培南(meropenem)、比阿培南(biapenem)、头孢克洛(cefaclor)、头孢羟氨苄(cefadroxil)、头孢羟唑(cefamandole)、头孢曲秦(cefatrizine)、头孢西酮(cefazedone)、头孢唑啉(cefazolin)、头孢克肟(cefixime)、头孢甲肟(cefmenoxime)、头孢地秦(cefodizime)、头孢尼西(cefonicid)、头孢哌酮(cefoperazone)、头孢雷特(ceforanide)、头孢噻肟(cefotaxime)、头孢替安(cefotiam)、头孢咪唑(cefpimizole)、头孢匹胺(cefpiramide)、头孢泊肟(cefpodoxime)、头孢磺啶(cefsulodin)、头孢他啶(ceftazidime)、头孢特仑(cefteram)、头孢替唑(ceftezole)、头孢布烯(ceftibuten)、头孢唑肟(ceftizoxime)、头孢曲松(ceftriaxone)、头孢呋辛(cefuroxime)、头孢唑南(cefuzonam)、头孢乙氰(cephacetrile)、头孢氨苄(cephalexin)、头孢来星(cephaloglycin)、头孢噻啶(cephaloridine)、头孢噻吩(cephalothin)、头孢匹林(cephapirin)、头孢拉定(cephradine)、头孢美唑(cefinetazole)、头孢西丁(cefoxitin)、头孢替坦(cefotetan)、氨曲南(azthreonam)、卡芦莫南(carumonam)、氟氧头孢(flomoxef)、拉氧头孢(moxalactam)、美西林(amidinocillin)、阿莫西林(amoxicillin)、氨苄青霉素(ampicillin)、阿洛西林(azlocillin)、羧苄青霉素(carbenicillin)、苄基青霉素(benzylpenicillin)、卡非西林(carfecillin)、氯唑西林(cloxacillin)、双氯西林(dicloxacillin)、甲氧西林(methicillin)、美洛西林(mezlocillin)、萘夫西林(nafcillin)、苯唑西林(oxacillin)、青霉素g、哌拉西林(piperacillin)、磺苄西林(sulbenicillin)、替莫西林(temocillin)、替卡西林(ticarcillin)、头孢托仑(cefditoren)、sc004、ky-020、头孢地尼(cefdinir)、头孢布烯(ceftibuten)、fk-312、s-1090、cp-0467、bk-218、fk-037、dq-2556、fk-518、头孢唑兰(cefozopran)、me1228、kp-736、cp-6232、ro 09-1227、opc-20000、ly206763)、利福霉素(rifamycins)、大环内酯类(macrolides)(例如阿奇霉素(azithromycin)、克拉霉素(clarithromycin)、红霉素(erythromycin)、竹桃霉素(oleandomycin)、罗他霉素(rokitamycin)、罗沙米星(rosaramicin)、罗红霉素(roxithromycin)、醋竹桃霉素(troleandomycin))、酮内酯类抗生素(ketolides)(例如泰利霉素(telithromycin)、喹红霉素(cethromycin))、香豆霉素(coumermycins)、林可酰胺类抗生素(lincosamides)(例如,克林霉素(clindamycin)、林可霉素(lincomycin))、氯霉素(chloramphenicol)、氯法齐明(clofazimine)、环丝氨酸(cycloserine)、氨苯砜(dapsone)、盐酸乙胺丁醇(ethambutol hydrochloride)、异烟肼(isoniazid)、吡嗪酰胺(pyrazinamide)、利福布汀(rifabutin)、利福平(rifampin)、利福喷丁(rifapentine)和硫酸链霉素。
115.说明性的抗原生动物剂包括但不限于阿托伐醌(atovaquone)、甲硝唑(metronidazole)(包括盐酸甲硝唑)、喷他脒(pentamidine)(包括羟乙基磺酸喷他脒)、氯喹(chloroquine)(包括盐酸氯喹和磷酸氯喹)、多西环素、硫酸羟基氯喹(hydroxychloroquine sulfate)、甲氟喹(mefloquine)(包括盐酸甲氟喹)、伯氨喹(primaquine)(包括磷酸伯氨喹)、乙胺嘧啶(pyrimethamine)、乙胺嘧啶(pyrimethamine)与磺胺多辛(sulfadoxine)、甲氧苄啶(trimethoprim)、磺胺甲噁唑(sulfamethoxazole)、克林霉素、奎宁(quinine)、奎尼丁(quinidine)、磺胺嘧啶(sulfadiazine)、蒿甲醚(artemether)、苯芴醇(lumefantrine)、青蒿琥酯(artesunate)、硝唑尼特、苏拉明(suramin)、美拉胂醇(melarsoprol)、依氟鸟氨酸(eflornithine)、硝呋莫司(nifurtimox)、葡萄糖酸锑盐(stibogluconate)(包括葡萄糖酸锑钠)、两性霉素b(amphotericin b)(包括两性霉素b脂质体)、米替福辛(miltefosine)、巴龙霉素(paromomycin)、酮康唑(ketoconazole)、伊曲康唑(itraconazole)、氟康唑(fluconazole)、以及其药学上可接受的盐及其组合。
116.说明性的免疫抑制剂包括但不限于:皮质类固醇,诸如,例如布地奈德(budesonide)、泼尼松和泼尼松龙;mtor抑制剂,诸如,例如西罗莫司(sirolimus)和依维莫司(everolimus);以及单克隆抗体,诸如,例如赛妥珠单抗、乌司奴单抗(ustekinumab)和维多珠单抗(vedolizumab)及其生物类似药。
117.在示例性实施方案中,本文描述的一种或更多种乳杆菌属物种以微生物生物治疗组合物的形式被提供和施用。这样的组合物还可以包含一种或更多种另外的微生物,诸如,例如鼠李糖乳杆菌(lactobacillus rhamnosus)、植物乳杆菌(lactobacillus plantarum)、保加利亚乳杆菌(lactobacillus bulgaricus)、干酪乳杆菌、嗜酸乳杆菌(lactobacillus acidophilus)、发酵乳杆菌(lactobacillus fermentum)、乳酸乳球菌(lactococcus lactis)、嗜热链球菌(streptococcus thermophilus)、短双歧杆菌(bifidobacterium breve)、两岐双岐杆菌(bifidobacterium bifidum)、乳双歧杆菌(bifidobacterium lactis)、动物双歧杆菌(bifidobacterium animalis)和布拉酵母菌(saccharomyces boulardii)。
118.微生物生物治疗组合物可以包含一种或更多种益生元组分。合适的益生元包括,例如,聚右旋糖、菊糖、果寡糖(fos)、木寡糖(xos)、半乳糖寡糖(gos)、甘露寡糖、基于蛋白的绿唇贻贝提取物,以及各种含益生元的食品,诸如生洋葱、生韭菜、生菊苣根(raw chickory root)和生朝鲜蓟(raw artichoke)。在某些实施方案中,益生元是果寡糖。
119.如本文描述的包含乳杆菌属物种的组合物可以以任何合适的形式(包括以上描述的任何剂型)施用。微生物生物治疗组合物可以以粉末的形式被提供至使用者,适于由使用者混合到任何类型的饮料或食品(例如水、果汁或酸奶)中,或者适合于在没有饮料或另外的食品的情况下作为粉末消耗。因此,微生物生物治疗组合物可以被方便地掺入多种食品和/或饮料产品、营养产品、补充剂、食品添加剂和非处方药制剂中。食品或食品添加剂可以是固体形式诸如粉末,或液体形式。饮料或食品的类型的具体实例包括但不限于基于水的、基于牛奶的、基于酸奶的、基于其他乳制品的、基于乳替代品诸如豆奶或燕麦奶的或者基于果汁的饮料、水、软饮料、碳酸饮料和营养饮料(包括饮料的浓缩原液和用于制备这样的饮料的干粉);烤焙产品诸如薄脆饼干(cracker)、面包、松饼、面包卷、百吉饼、饼干,谷物,棒
状物(bar)诸如燕麦坚果棒(muesli bar)、健康食物棒等,调味品,调味酱,蛋奶沙司,酸奶,布丁,预包装的冷冻的餐品,汤和糖果。
120.在本说明书中对任何先前的出版物(或来源于其的信息)或对任何已知的事项的引用不是并且不应当被视为确认或承认或以任何形式暗示该先前的出版物(或来源于其的信息)或已知的事项构成本说明书所涉及的领域中的公知常识的一部分。
121.现在将参考以下具体实施例来描述本公开内容,这些实施例不应被解释为以任何方式限制本发明的范围。
实施例
122.以下实施例是对本发明的说明,并且不应被解释为以任何方式限制遍布本说明书描述的公开内容的一般性质。
123.实施例1-dss诱导的结肠炎模型——环孢菌素a和微生物生物治疗剂
124.环孢菌素a(csa)是一种临床上用于治疗溃疡性结肠炎和克罗恩病的免疫抑制剂。在本研究中,本发明人使用右旋糖酐硫酸酯钠(dss)诱导的小鼠急性结肠炎模型来比较csa与以下的效力:(i)微生物生物治疗性细菌菌株类干酪乳杆菌(svt 04p1)、布氏乳杆菌(svt 06b1)和玉米乳杆菌(svt 08z1)的组合;和(ii)包含csa和微生物生物治疗剂类干酪乳杆菌(svt 04p1)、布氏乳杆菌(svt 06b1)和玉米乳杆菌(svt 08z1)的组合疗法。
125.dss来自mp biomedicals,储存于室温。基于所用的dss浓度(3%)和施用之间没有清除期(washout period)的持续8天的每日dss施用,本研究中使用的模型是特别有效的急性结肠炎模型。根据该方案施用3%dss的小鼠显示出结肠中溃疡、水肿、炎症和隐窝损失的明显组织病理学体征(数据未示出)。
126.将50只雌性c57bl/6ntac小鼠分为5个治疗组:
127.●
第1组-非治疗(阴性对照)组。n=10。
128.●
第2组-3%dss+媒介物(0.9%无菌盐水+2.5%蔗糖)。n=10。
129.●
第3组-3%dss+浓度为1.5
×
10
10
cfu/ml的svt 04p1、svt 06b1和svt 08z1的组合。n=10。
130.●
第4组-3%dss+剂量为40mg/kg的csa+媒介物(0.9%无菌盐水+2.5%蔗糖)。n=10。
131.·
第5组-3%dss+剂量为40mg/kg的csa+浓度为1.5
×
10
10
cfu/ml的svt 04p1、svt 06b1和svt 08z1的组合。n=10。
132.第2组至第5组的动物从第1天至第8天通过每天的无菌饮用水自由接受3%的dss,而第1组的动物持续仅接受无菌水作为饮用水。除了dss之外,第2组的动物从第1天至第7天以1ml的剂量体积通过口服管饲每日接受媒介物(0.9%无菌盐水+2.5%蔗糖)。除了dss之外,第3组动物在第1天至第7天以1ml的剂量体积通过口服管饲每日接受乳杆菌属菌株(1.5
×
10
10
cfu/ml)。除了dss之外,第4组的动物从第1天至第7天在以1ml的剂量体积通过口服管饲施用媒介物(0.9%无菌盐水+2.5%蔗糖)后1至2小时,以10ml/kg的剂量体积通过口服管饲每日接受剂量浓度为4mg/ml的csa(40mg/kg)。除了dss之外,第5组的动物从第1天至第7天在以1ml的剂量体积通过口服管饲施用乳杆菌属菌株(1.5
×
10
10
cfu/ml)后1至2小时,以10ml/kg的剂量体积通过口服管饲每日接受剂量浓度为4mg/ml的csa(40mg/kg)。
133.dss诱导的结肠炎的症状/特征(粪便稠度和发生便血)通过从第1天至第8天测量生命终点(in-life endpoint)来评估。评估在给药后1至2小时进行。
134.从第1天开始收集每只小鼠的粪便并检查其稠度。粪便稠度分级如下:正常=0;软,但仍然形成=1;非常软=2;腹泻=4。粪便中的便血使用hemoccult tape测试试剂盒(beckman coulter,根据制造商的说明书)来检测。便血的评分如下:阴性hemoccult=0;阳性hemoccult(条带上轻微的颜色)=1;阳性hemoccult(条带上较深的颜色)=2;可见的血迹=3;直肠大出血=4。还从第1天开始测量体重减轻百分比,分级为0(无)、1(1%-5%)、2(》5%-10%)、3(》10%-20%)和4(》20%)。
135.将粪便稠度评分、便血发生评分和体重减轻评分汇总,以给出总体疾病状态的加权生命评分,即疾病活动指数(dai)。
136.在研究结束时,对小鼠进行安乐死,然后确定结肠黏膜中的细胞因子表达,并对每只动物的结肠进行组织学检查。
137.如图1a所示,与第2组相比,第3治疗组至第5治疗组的小鼠的便血发生显著减少(p《0.001)。相对于第3组(仅乳杆菌属菌株组合)和第4组(仅csa),第5组(csa加乳杆菌属菌株组合)的便血发生明显减少。如图1b所示,第3组和第4组的粪便稠度虽然相对于第2组有所改善,但与第2组没有显著差异,而第5组的粪便稠度显著改善(p《0.01)。如图1c所示,与第2组相比,第3治疗组至第5治疗组的dai也显著改善(p《0.05)。
138.对结肠黏膜细胞因子表达的分析揭示,与第2组相比,第5组(csa加乳杆菌属菌株组合)的il-6(p《0.001)、kc-gro(角质形成细胞趋化因子/人类生长调节致癌基因)(p《0.001)、tnfα(p《0.001)和il-1β(p《0.005)的表达显著减少,并且相对于第3组(仅乳杆菌属菌株组合)和第4组(仅csa),第5组的这些细胞因子的表达有更大减少(参见图2)。
139.分析结肠样品的总体溃疡程度,受任何炎性变化侵害的切片的百分比,受正常结构消失、糜烂/溃疡和/或隐窝脓肿的严重炎性变化侵害的切片的百分比,以及由每个结肠区段的三个单独评分之和计算的总体综合评分。计算结肠样品的每个近端、中间和远端切片的评分,其中整个总体综合评分显示,与第2组相比,第4组和第5组的溃疡和炎症在统计学上显著减少(p《0.001)。观察到第3组的近端区段(p《0.05)以及第4组和第5组的近端区段(p《0.001)以及第4组和第5组的中间和远端切片(p《0.001)的评分在统计学上显著减少(图3)。值得注意的是,第5组(csa加乳杆菌属菌株组合)对dss诱导的显微镜下变化有最大的影响,因为它显著地导致了10只小鼠中的6只中dss诱导的变化的几乎完全的消除。与第2组相比,第4组和第5组的结肠长度也在统计学上显著增加(图4),这与炎症和溃疡的总体综合评分相关,其中第5组的长度显示出最大的统计学上显著的增加(p《0.001)。
140.临床上用于治疗炎性肠病(诸如溃疡性结肠炎)的许多治疗剂(包括环孢菌素a、柳氮磺胺吡啶和泼尼松龙)先前已经由相同的测试实验室(charles river laboratories(crl))在如本研究中使用的相同dss诱导的结肠炎模型中进行了测试。所有这些药物均未使生命疾病评分在统计学上改善到本研究的第5组治疗中观察到的程度。40mg/kg和80mg/kg的csa在较不严重的2%dss模型中显示出dai评分的一些降低,但在3%dss模型中不如第5组呈现的有效(数据未示出)。当与现有疗法相比时,本研究获得的结果代表了溃疡性结肠炎前瞻性治疗的显著进步。
141.实施例2-dss诱导的结肠炎模型——5-氨基水杨酸和微生物生物治疗剂
142.5-氨基水杨酸(asa)是一种临床上用于治疗溃疡性结肠炎和克罗恩病的免疫抑制剂。在本研究中,本发明人使用右旋糖酐硫酸酯钠(dss)诱导的小鼠急性结肠炎模型(如实施例1中描述的)来比较asa与以下的效力:(i)微生物生物治疗性细菌菌株类干酪乳杆菌(svt 04p1)、布氏乳杆菌(svt 06b1)和玉米乳杆菌(svt 08z1)的组合;和(ii)包含asa和微生物生物治疗剂类干酪乳杆菌(svt 04p1)、布氏乳杆菌(svt 06b1)和玉米乳杆菌(svt 08z1)的组合疗法。
143.将50只雌性c57bl/6ntac小鼠分为5个治疗组:
144.●
第1组-非治疗(阴性对照)组。n=10。
145.●
第2组-3%dss+媒介物(0.9%无菌盐水+2.5%蔗糖)。n=10。
146.●
第3组-3%dss+浓度为3.0
×
10
10
cfu/ml的svt 04p1、svt 06b1和svt 08z1的组合。n=10。
147.●
第4组-3%dss+剂量为75mg/kg的asa+媒介物(0.9%无菌盐水+2.5%蔗糖)。n=10。
148.●
第5组-3%dss+剂量为75mg/kg的asa+浓度为3.0
×
10
10
cfu/ml的svt 04p1、svt 06b1和svt 08z1的组合。n=10。
149.第2组至第5组的动物从第1天至第8天通过每天的无菌饮用水自由接受3%的dss,而第1组的动物持续仅接受无菌水作为饮用水。除了dss之外,第2组的动物从第1天至第7天以1ml的剂量体积通过口服管饲每日接受媒介物(0.9%无菌盐水+2.5%蔗糖)。除了dss之外,第3组动物在第1天至第7天以0.5ml的剂量体积通过口服管饲每日接受乳杆菌属菌株(3.0
×
10
10
cfu/ml)。除了dss之外,第4组的动物从第1天至第7天在以1ml的剂量体积通过口服管饲施用媒介物(0.9%无菌盐水+2.5%蔗糖)后1至2小时,以10ml/kg的剂量体积通过口服管饲每日接受剂量浓度为7.5mg/ml的asa(75mg/kg)。除了dss之外,第5组的动物从第1天至第7天在以0.5ml的剂量体积通过口服管饲施用乳杆菌属菌株(3.0
×
10
10
cfu/ml)后1至2小时,以10ml/kg的剂量体积通过口服管饲每日接受剂量浓度为7.5mg/ml的asa(75mg/kg)。在第5组中,asa在乳杆菌属菌株后1-2hrs施用。
150.dss诱导的结肠炎的症状/特征(粪便稠度和发生便血)通过从第1天至第11天如实施例1中描述地测量生命终点来评估。将粪便稠度评分、便血发生评分和体重减轻评分汇总,以给出总体疾病状态的加权生命评分,即疾病活动指数(dai)。
151.如图5所示,当与仅用asa治疗(第4组)相比时,乳杆菌属菌株加asa的组合(第5组)导致11天后粪便稠度和疾病活动的显著改善。
152.实施例3-dss诱导的结肠炎模型——托法替尼和微生物生物治疗剂
153.托法替尼(以商品名出售)是一种被处方用于治疗溃疡性结肠炎的小分子jak抑制剂。在本研究中,本发明人使用右旋糖酐硫酸酯钠(dss)诱导的小鼠急性结肠炎模型(如实施例1中描述的)来比较托法替尼与以下的效力:(i)微生物生物治疗性细菌菌株类干酪乳杆菌(svt 04p1)、布氏乳杆菌(svt 06b1)和玉米乳杆菌(svt 08z1)的组合;和(ii)包含托法替尼和微生物生物治疗剂类干酪乳杆菌(svt 04p1)、布氏乳杆菌(svt 06b1)和玉米乳杆菌(svt 08z1)的组合疗法。
154.将50只雌性c57bl/6ntac小鼠分为5个治疗组:
155.·
第1组-非治疗(阴性对照)组。n=10。
156.·
第2组-3%dss+媒介物(0.9%无菌盐水+2.5%蔗糖)。n=10。
157.●
第3组-3%dss+浓度为3.0
×
10
10
cfu/ml的svt 04p1、svt 06b1和svt 08z1的组合。n=10。
158.●
第4组-3%dss+剂量为30mg/kg的托法替尼+媒介物(0.9%无菌盐水+2.5%蔗糖)。n=10。
159.·
第5组-3%dss+剂量为30mg/kg的托法替尼+浓度为3.0
×
10
10
cfu/ml的svt 04p1、svt 06b1和svt 08z1的组合。n=10。
160.第2组至第5组的动物从第1天至第8天通过每天的无菌饮用水自由接受3%的dss,而第1组的动物持续仅接受无菌水作为饮用水。除了dss之外,第2组的动物从第1天至第7天以1ml的剂量体积通过口服管饲每日接受媒介物(0.9%无菌盐水+2.5%蔗糖)。除了dss之外,第3组动物在第1天至第7天以0.5ml的剂量体积通过口服管饲每日接受乳杆菌属菌株(3.0
×
10
10
cfu/ml)。除了dss之外,第4组的动物从第1天至第7天在以1ml的剂量体积通过口服管饲施用媒介物(0.9%无菌盐水+2.5%蔗糖)后1至2小时,以10ml/kg的剂量体积通过口服管饲每日接受剂量浓度为3mg/ml的托法替尼(30mg/kg)。除了dss之外,第5组的动物从第1天至第7天在以0.5ml的剂量体积通过口服管饲施用乳杆菌属菌株(3.0
×
10
10
cfu/ml)后1至2小时,以10ml/kg的剂量体积通过口服管饲每日接受剂量浓度为3mg/ml的托法替尼(30mg/kg)。在第5组中,托法替尼在乳杆菌属菌株后1-2hrs施用。
161.dss诱导的结肠炎的症状/特征(粪便稠度和发生便血)通过从第1天至第11天如实施例1中描述地测量生命终点来评估。将粪便稠度评分、便血发生评分和体重减轻评分汇总,以给出总体疾病状态的加权生命评分,即疾病活动指数(dai)。
162.如图6所示,当与仅用托法替尼治疗(第4组)相比时,乳杆菌属菌株加托法替尼的组合(第5组)导致11天后粪便稠度和疾病活动的显著改善。实施例4-dss诱导的结肠炎模型——阿达木单抗和微生物生物治疗剂
163.阿达木单抗(以商品名出售)是一种被处方用于治疗溃疡性结肠炎和克罗恩病的单克隆抗体tnf抑制剂。在本研究中,本发明人使用右旋糖酐硫酸酯钠(dss)诱导的小鼠急性结肠炎模型(如实施例1中描述的)来比较阿达木单抗与以下的效力:(i)微生物生物治疗性细菌菌株类干酪乳杆菌(svt 04p1)、布氏乳杆菌(svt 06b1)和玉米乳杆菌(svt 08z1)的组合;和(ii)包含阿达木单抗和微生物生物治疗剂类干酪乳杆菌(svt 04p1)、布氏乳杆菌(svt 06b1)和玉米乳杆菌(svt 08z1)的组合疗法。
164.将50只雌性c57bl/6ntac小鼠分为5个治疗组:
165.·
第1组-非治疗(阴性对照)组。n=10。
166.·
第2组-3%dss+媒介物(0.9%无菌盐水+2.5%蔗糖)。n=10。
167.·
第3组-3%dss+浓度为3.0
×
10
10
cfu/ml的svt 04p1、svt 06b1和svt 08z1的组合。n=10。
168.·
第4组-3%dss+剂量为3mg/kg的阿达木单抗+媒介物(0.9%无菌盐水+2.5%蔗糖)。n=10。
169.·
第5组-3%dss+剂量为3mg/kg的阿达木单抗+浓度为3.0
×
10
10
cfu/ml的svt 04p1、svt 06b1和svt 08z1的组合。n=10。
170.第2组至第5组的动物从第1天至第8天通过每天的无菌饮用水自由接受3%的dss,
而第1组的动物持续仅接受无菌水作为饮用水。除了dss之外,第2组的动物从第1天至第7天以1ml的剂量体积通过口服管饲每日接受媒介物(0.9%无菌盐水+2.5%蔗糖)。除了dss之外,第3组动物在第1天至第7天以0.5ml的剂量体积通过口服管饲每日接受乳杆菌属菌株(3.0
×
10
10
cfu/ml)。除了dss之外,第4组的动物从第1天至第7天在以1ml的剂量体积通过口服管饲施用媒介物(0.9%无菌盐水+2.5%蔗糖)后1至2小时,以10ml/kg的剂量体积通过皮下注射每日接受剂量浓度为0.3mg/ml的阿达木单抗(3mg/kg)。除了dss之外,第5组的动物从第1天至第7天在以0.5ml的剂量体积通过口服管饲施用乳杆菌属菌株(3.0
×
10
10
cfu/ml)后1至2小时,以10ml/kg的剂量体积通过皮下注射每日接受剂量浓度为0.3mg/ml的阿达木单抗(3mg/kg)。在第5组中,阿达木单抗在乳杆菌属菌株后1-2hrs施用。
171.dss诱导的结肠炎的症状/特征(粪便稠度和发生便血)通过从第1天至第11天如实施例1中描述地测量生命终点来评估。将粪便稠度评分、便血发生评分和体重减轻评分汇总,以给出总体疾病状态的加权生命评分,即疾病活动指数(dai)。
172.如图7所示,当与仅用阿达木单抗治疗(第4组)相比时,乳杆菌属菌株加阿达木单抗的组合(第5组)导致11天后粪便稠度和疾病活动的显著改善。
173.保藏详情
174.根据布达佩斯条约保藏的生物材料的详细情况已经在说明书中在前文提供。保藏的菌株先前已经在国际申请第pct/au2019/051092号中描述过。总之:
175.根据布达佩斯条约,类谷糠乳杆菌svt 05p2于2019年2月27日以登录号lmg p-31292保藏在比利时微生物协调保藏中心(bccm),联邦公共规划服务科学政策部(federal public planning service science policy),比利时布鲁塞尔科学街8号b-1000(8,rue de la science b-1000,brussels,belgium)。
176.根据布达佩斯条约,布氏乳杆菌svt 06b1于2019年2月27日以登录号lmg p-31293保藏在保藏在比利时微生物协调保藏中心(bccm),联邦公共规划服务科学政策部,比利时布鲁塞尔科学街8号b-1000。
177.根据布达佩斯条约,玉米乳杆菌svt 08z1于2019年2月27日以登录号lmg p-31295保藏在保藏在比利时微生物协调保藏中心(bccm),联邦公共规划服务科学政策部,比利时布鲁塞尔科学街8号b-1000。
178.根据布达佩斯条约,芜菁乳杆菌(l.rapi)svt 07r1于2019年2月27日以登录号lmg p-31294保藏在保藏在比利时微生物协调保藏中心(bccm),联邦公共规划服务科学政策部,比利时布鲁塞尔科学街8号b-1000。
179.根据布达佩斯条约,类干酪乳杆菌svt 04p1于2019年2月27日以登录号lmg p-31290保藏在保藏在比利时微生物协调保藏中心(bccm),联邦公共规划服务科学政策部,比利时布鲁塞尔科学街8号b-1000。
180.根据布达佩斯条约,食二酸乳杆菌svt 01d1于2019年2月27日以登录号lmg p-31287保藏在保藏在于比利时微生物协调保藏中心(bccm),联邦公共规划服务科学政策部,比利时布鲁塞尔科学街8号b-1000。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1