快速疫苗平台的制作方法
背景技术:
1、严重急性呼吸综合征冠状病毒2(sars-cov-2)流行病及其伴随的发病率和死亡率强调了诱导保护性和持久免疫应答的安全和有效疫苗的需要。该流行病还显示出满足紧急医疗需要,例如冠状病毒病2019(covid-19)的广泛传播的世界各地常规疫苗开发管线的严重缺陷。存在对一种新的疫苗开发平台的迫切和未满足的需要,其能够缩短安全有效的疫苗和治疗剂的上市时间,以治疗由快速发展的病原体如sars-cov-2引起的疾病或病症。
技术实现思路
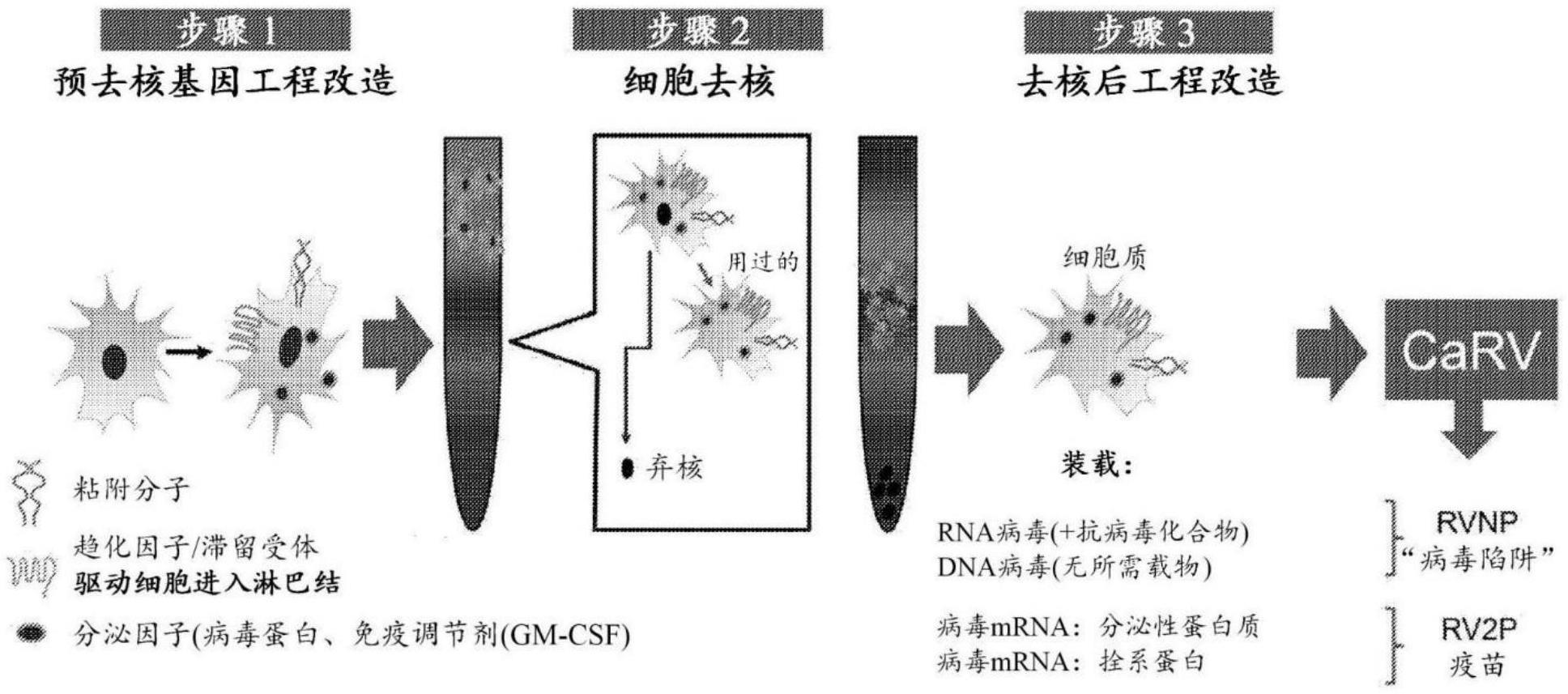
1、在一些实施方案中,本文描述了一种无细胞核的细胞,该无细胞核的细胞包含:一种或多种细胞内细胞器,所述细胞器用于在不存在细胞核的情况下合成或分泌抗病原体的疫苗。在一些实施方案中,病原体是病毒。在一些实施方案中,病毒是冠状病毒。在一些实施方案中,冠状病毒是严重急性呼吸综合征(sars)冠状病毒。在一些实施方案中,sars冠状病毒是严重急性呼吸综合征冠状病毒2(sars-cov-2)。在一些实施方案中,病毒是溶瘤病毒。在一些实施方案中,病原体是细菌。在一些实施方案中,细菌是炭疽芽孢杆菌、鼠疫耶尔森氏菌、土拉热弗朗西斯菌、布鲁氏菌、沙门氏菌、大肠杆菌o157:h7、志贺氏菌属(shigella)、鼻疽伯克霍尔德氏菌、类鼻疽伯克霍尔德氏菌(burkholderia pseudomallei)、鹦鹉热衣原体、贝氏考克斯菌(coxiella burnetii)、普氏立克次氏体(rickettsia prowazekii)、霍乱弧菌或微小隐孢子虫或其任何组合。在一些实施方案中,病原体是毒素。在一些实施方案中,毒素是肉毒梭菌毒素、产气荚膜梭菌的ε毒素、葡萄球菌肠毒素b或来自蓖麻的蓖麻毒素或其任何组合。在一些实施方案中,一种或多种细胞内细胞器是内质网或高尔基体。在一些实施方案中,疫苗偶联至无细胞核的细胞的表面。在一些实施方案中,疫苗包含将疫苗偶联至无细胞核的细胞表面的跨膜结构域。在一些实施方案中,无细胞核的细胞还包含含有粒细胞-巨噬细胞集落刺激因子的免疫调节剂。在一些实施方案中,无细胞核的细胞还包含归巢受体,该归巢受体包含:(a)白细胞唾液酸蛋白(leukosialin);(b)l-选择素、淋巴细胞功能相关抗原1;(c)极晚期抗原4;(a)至(c)中任一项的一部分;或(a)至(d)的任何组合。在一些实施方案中,无细胞核的细胞的直径为约1微米(μm)至100μm。在一些实施方案中,直径为约8μm。在一些实施方案中,无细胞核的细胞在低温休眠至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温休眠至少48小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温保存至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞在冻干至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞被低温保存(cryopreserved)、低温休眠(cryohybernated)或冻干(lyophilized)。在一些实施方案中,无细胞核的细胞被分离或纯化。在一些实施方案中,使用本文所述的台盼蓝染料排除法测量活力。在一些实施方案中,台盼蓝染料排除法通过以下方法进行:(a)离心悬浮液中的多个无细胞核的细胞的等分试样以产生细胞沉淀;(b)将细胞沉淀再悬浮于无血清培养基中以产生无血清细胞悬浮液;(c)将1份台盼蓝染料和1份无血清细胞悬浮液混合;(d)在(c)的3-5分钟内对多个无细胞核的细胞进行计数,其中多个无细胞核的细胞中的至少一些未被台盼蓝染料染色,这指示活力。在一些实施方案中,使用本文所述的膜联蛋白-5细胞表面染色测量活力。在一些实施方案中,无细胞核的细胞不是红细胞或红细胞前体。
2、在一些实施方案中,本文描述了一种药物制剂,其包含:本文所述的无细胞核的细胞或多个无细胞核的细胞;以及药学上可接受的赋形剂、稀释剂或载体。
3、在一些实施方案中,本文描述了一种生产疫苗的方法,该方法包括:(a)从细胞中去除细胞核以产生包含一种或多种细胞内细胞器的去核细胞(enucleated cell),所述细胞器用于合成或分泌抗病原体的疫苗;以及(b)将编码疫苗的外源性mrna引入去核细胞,其中去核细胞在不存在细胞核的情况下表达疫苗。在一些实施方案中,病原体是病毒。在一些实施方案中,病毒是冠状病毒。在一些实施方案中,冠状病毒是严重急性呼吸综合征(sars)冠状病毒。在一些实施方案中,sars冠状病毒是严重急性呼吸综合征冠状病毒2(sars-cov-2)。在一些实施方案中,病毒是溶瘤病毒。在一些实施方案中,病原体是细菌。在一些实施方案中,细菌是炭疽芽孢杆菌、鼠疫耶尔森氏菌、土拉热弗朗西斯菌、布鲁氏菌、沙门氏菌、大肠杆菌o157:h7、志贺氏菌属(shigella)、鼻疽伯克霍尔德氏菌、类鼻疽伯克霍尔德氏菌(burkholderia pseudomallei)、鹦鹉热衣原体、贝氏考克斯菌(coxiella burnetii)、普氏立克次氏体(rickettsia prowazekii)、霍乱弧菌或微小隐孢子虫或其任何组合。在一些实施方案中,病原体是毒素。在一些实施方案中,毒素是肉毒梭菌毒素、产气荚膜梭菌的ε毒素、葡萄球菌肠毒素b或来自蓖麻的蓖麻毒素或其任何组合。在一些实施方案中,将去核细胞储存在4℃或低于4℃以可逆地减慢或停止去核细胞的生物活性,并且随后在(b)中引入之前解冻。在一些实施方案中,将无细胞核的细胞冻干,并且随后在(b)中引入之前进行再水合。在一些实施方案中,将去核细胞储存在-120℃或低于-120℃以可逆地减慢或停止去核细胞的生物活性,并且随后在(b)中引入之前解冻。在一些实施方案中,(a)中从细胞中去除细胞核是在不分化细胞的情况下进行的。在一些实施方案中,一种或多种细胞内细胞器是内质网或高尔基体。在一些实施方案中,无细胞核的细胞的直径为约1微米(μm)至100μm。在一些实施方案中,直径为约8μm。在一些实施方案中,该方法还包括在(a)中去除细胞核之前,向细胞中引入具有编码免疫调节剂的核酸序列的外源性核酸分子,免疫调节剂包括粒细胞-巨噬细胞集落刺激因子。在一些实施方案中,该方法还包括在(a)中去除细胞核之前向细胞中引入具有编码归巢受体的核酸序列的外源性核酸分子,该归巢受体包含:白细胞唾液酸蛋白;l-选择素、淋巴细胞功能相关抗原1;极晚期抗原4;c-x-c趋化因子受体3型;cd44抗原;c-c趋化因子受体7型;其任何一种归巢受体的一部分;或其任何一种归巢受体的任何组合。在一些实施方案中,该方法还包括向无细胞核的细胞中引入包含编码免疫调节剂的序列的外源性mrna分子,该免疫调节剂包括粒细胞-巨噬细胞集落刺激因子。在一些实施方案中,该方法还包括向无细胞核的细胞中引入包含编码归巢受体的序列的外源性mrna分子,该归巢受体包含:白细胞唾液酸蛋白;l-选择素、淋巴细胞功能相关抗原1;极晚期抗原4;c-x-c趋化因子受体3型;cd44抗原;c-c趋化因子受体7型;其任何一种归巢受体的一部分;或其任何一种归巢受体的任何组合。在一些实施方案中,无细胞核的细胞不是红细胞或红细胞前体。
4、在一些实施方案中,本文描述了一种向对象递送抗严重急性呼吸综合征冠状病毒2(sars-cov-2)的疫苗的方法,该方法包括:向对象施用包含一种或多种细胞内细胞器的无细胞核的细胞,所述细胞器用于在不存在细胞核的情况下合成或分泌抗sars-cov-2的疫苗。在一些实施方案中,一种或多种细胞内细胞器是内质网或高尔基体。在一些实施方案中,无细胞核的细胞还包含含有粒细胞-巨噬细胞集落刺激因子的免疫调节剂。在一些实施方案中,无细胞核的细胞还包含归巢受体,该归巢受体包含:白细胞唾液酸蛋白;l-选择素、淋巴细胞功能相关抗原1;极晚期抗原4;c-x-c趋化因子受体3型;cd44抗原;c-c趋化因子受体7型;其任何一种归巢受体的一部分;或其任何一种归巢受体的任何组合。在一些实施方案中,无细胞核的细胞的直径为约1微米(μm)至100μm。在一些实施方案中,直径为约8μm。在一些实施方案中,施用包括全身施用。在一些实施方案中,无细胞核的细胞以约103个细胞/kg体重至约1012个细胞/kg体重的剂量施用。在一些实施方案中,在至少1小时、2小时、4小时、6小时、8小时、12小时、1天、2天、1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、2年、3年或4年内向对象施用无细胞核的细胞两次。在一些实施方案中,对象是人。在一些实施方案中,该方法还包括施用佐剂。在一些实施方案中,无细胞核的细胞不是红细胞或红细胞前体。
5、在一些实施方案中,本文描述了一种试剂盒,其包含:多个基本上不含细胞核的细胞,其中多个基本上不含细胞核的细胞中至少一个无细胞核的细胞包含一种或多种细胞内细胞器,所述细胞器用于在不存在细胞核的情况下合成或分泌抗病原体的疫苗;以及说明书,用于将多个基本上不含细胞核的细胞施用于对象。在一些实施方案中,多个基本上不含细胞核的细胞被低温保存、低温休眠或冻干。在一些实施方案中,试剂盒还包含说明书,用于在将多个基本上不含细胞核的细胞施用于对象之前恢复多个基本上不含细胞核的细胞的生物活性。在一些实施方案中,试剂盒还包含说明书,用于将编码疫苗的外源性mrna引入去核细胞。
6、在一些实施方案中,本文描述了一种无细胞核的细胞,该无细胞核的细胞包含一种或多种细胞内细胞器,所述细胞器用于在不存在细胞核的情况下合成病原体抗原或其病原体抗原结合片段的受体,其中受体或受体的表达水平对于无细胞核的细胞是外源性的。在一些实施方案中,一种或多种细胞内细胞器是内质网或高尔基体。在一些实施方案中,病原体抗原或其病原体抗原结合片段的受体偶联至无细胞核的细胞的表面。在一些实施方案中,病原体抗原或其病原体抗原结合片段的受体在无细胞核的细胞的细胞膜内包含跨膜结构域。在一些实施方案中,无细胞核的细胞还包含具有编码免疫调节剂或其部分的序列的外源性mrna分子,该免疫调节剂包括粒细胞-巨噬细胞集落刺激因子。在一些实施方案中,无细胞核的细胞的直径为约1微米(μm)至100μm。在一些实施方案中,直径为约8μm。在一些实施方案中,无细胞核的细胞在低温休眠至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温休眠至少48小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温保存至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞在冻干至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞被低温保存、低温休眠或冻干。在一些实施方案中,无细胞核的细胞被分离或纯化。在一些实施方案中,使用本文所述的台盼蓝染料排除法测量活力。在一些实施方案中,台盼蓝染料排除法通过以下方法进行:(a)离心悬浮液中的多个无细胞核的细胞的等分试样以产生细胞沉淀;(b)将细胞沉淀再悬浮于无血清培养基中以产生无血清细胞悬浮液;(c)将1份台盼蓝染料和1份无血清细胞悬浮液混合;(d)在(c)的3-5分钟内对多个无细胞核的细胞进行计数,其中多个无细胞核的细胞中的至少一些未被台盼蓝染料染色,这指示活力。在一些实施方案中,使用本文所述的膜联蛋白-5细胞表面染色测量活力。在一些实施方案中,无细胞核的细胞被分离或纯化。在一些实施方案中,细胞还包含阻断病原体抗原与其由宿主细胞产生的天然受体之间的结合的中和抗体。在一些实施方案中,中和抗体由无细胞核的细胞的一种或多种细胞内细胞器合成。在一些实施方案中,细胞还包含:归巢受体,该归巢受体包含:白细胞唾液酸蛋白;l-选择素、淋巴细胞功能相关抗原1;极晚期抗原4;c-x-c趋化因子受体3型;cd44抗原;c-c趋化因子受体7型;其任何一种归巢受体的一部分;或其任何一种归巢受体的任何组合。在一些实施方案中,病原体是病毒。在一些实施方案中,病毒是冠状病毒。在一些实施方案中,冠状病毒是严重急性呼吸综合征(sars)冠状病毒。在一些实施方案中,sars冠状病毒是严重急性呼吸综合征冠状病毒2(sars-cov-2)。在一些实施方案中,病毒是溶瘤病毒。在一些实施方案中,病原体是细菌。在一些实施方案中,细菌是炭疽芽孢杆菌、鼠疫耶尔森氏菌、土拉热弗朗西斯菌、布鲁氏菌、沙门氏菌、大肠杆菌o157:h7、志贺氏菌属(shigella)、鼻疽伯克霍尔德氏菌、类鼻疽伯克霍尔德氏菌(burkholderia pseudomallei)、鹦鹉热衣原体、贝氏考克斯菌(coxiella burnetii)、普氏立克次氏体(rickettsia prowazekii)、霍乱弧菌或微小隐孢子虫或其任何组合。在一些实施方案中,病原体是毒素。在一些实施方案中,毒素是肉毒梭菌毒素、产气荚膜梭菌的ε毒素、葡萄球菌肠毒素b或来自蓖麻的蓖麻毒素或其任何组合。在一些实施方案中,疫苗是本文所述的疫苗。在一些实施方案中,无细胞核的细胞不是红细胞或红细胞前体。
7、在一些实施方案中,本文描述了一种减少对象中由病原体引起的感染的方法或减少感染对象过程中的病原体的方法,该方法包括:将本文所述的无细胞核的细胞或本文所述的药物制剂施用于对象,从而在细胞中捕获具有病原体抗原的病原体并阻止病原体在细胞内繁殖。在一些实施方案中,在施用后少于或等于约14天病原体从对象中清除。在一些实施方案中,无细胞核的细胞释放中和抗体或纳米抗体,从而阻断病原体的病原体抗原与其由宿主细胞产生的天然受体之间的结合。在一些实施方案中,施用包括全身施用。在一些实施方案中,无细胞核的细胞以约103个细胞/kg体重至约1012个细胞/kg体重的剂量施用。在一些实施方案中,在至少1小时、2小时、4小时、6小时、8小时、12小时、1天、2天、1周、2周、3周、1个月、2个月、3个月、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、1年、2年、3年或4年内向对象施用无细胞核的细胞两次。在一些实施方案中,病原体是病毒。在一些实施方案中,病毒是冠状病毒。在一些实施方案中,冠状病毒是严重急性呼吸综合征(sars)冠状病毒。在一些实施方案中,sars冠状病毒是严重急性呼吸综合征冠状病毒2(sars-cov-2)。在一些实施方案中,病毒是溶瘤病毒。在一些实施方案中,病原体是细菌。在一些实施方案中,细菌是炭疽芽孢杆菌、鼠疫耶尔森氏菌、土拉热弗朗西斯菌、布鲁氏菌、沙门氏菌、大肠杆菌o157:h7、志贺氏菌属(shigella)、鼻疽伯克霍尔德氏菌、类鼻疽伯克霍尔德氏菌(burkholderia pseudomallei)、鹦鹉热衣原体、贝氏考克斯菌(coxiellaburnetii)、普氏立克次氏体(rickettsia prowazekii)、霍乱弧菌或微小隐孢子虫或其任何组合。在一些实施方案中,病原体是毒素。在一些实施方案中,毒素是肉毒梭菌毒素、产气荚膜梭菌的ε毒素、葡萄球菌肠毒素b或来自蓖麻的蓖麻毒素或其任何组合。在一些实施方案中,疫苗是本文所述的疫苗。在一些实施方案中,无细胞核的细胞还包含含有粒细胞-巨噬细胞集落刺激因子的免疫调节剂。在一些实施方案中,无细胞核的细胞还包含对淋巴组织中一种或多种细胞上表达的配体具有特异性的归巢受体。在一些实施方案中,归巢受体包含c-x-c趋化因子受体3型、白细胞唾液酸蛋白、cd44抗原、c-c趋化因子受体7型、l-选择素、淋巴细胞功能相关抗原1或极晚期抗原4或其组合。在一些实施方案中,无细胞核的细胞的直径为约1微米(μm)至100μm。在一些实施方案中,无细胞核的细胞的直径为约8μm。在一些实施方案中,无细胞核的细胞在低温休眠至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温休眠至少48小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温保存至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞在冻干至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞被低温保存、低温休眠或冻干。在一些实施方案中,无细胞核的细胞被分离或纯化。在一些实施方案中,使用本文所述的台盼蓝染料排除法测量活力。在一些实施方案中,台盼蓝染料排除法通过以下方法进行:(a)离心悬浮液中的多个无细胞核的细胞的等分试样以产生细胞沉淀;(b)将细胞沉淀再悬浮于无血清培养基中以产生无血清细胞悬浮液;(c)将1份台盼蓝染料和1份无血清细胞悬浮液混合;(d)在(c)的3-5分钟内对多个无细胞核的细胞进行计数,其中多个无细胞核的细胞中的至少一些未被台盼蓝染料染色,这指示活力。在一些实施方案中,使用本文所述的膜联蛋白-5细胞表面染色测量活力。在一些实施方案中,无细胞核的细胞不是红细胞或红细胞前体。
8、本文公开的方面提供了一种无细胞核的细胞,该细胞包含:一种或多种细胞内细胞器,所述细胞器用于在不存在细胞核的情况下合成或分泌抗病毒的疫苗,该病毒由与seqid no:1、301-347或501-512的一个或多个具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的序列编码。在一些实施方案中,无细胞核的细胞不是红细胞或红细胞前体。在一些实施方案中,无细胞核的细胞来源于一种或多种细胞内细胞器为内源的有核亲本细胞。在一些实施方案中,病毒是冠状病毒。在一些实施方案中,疫苗组合物是dna、rna、抗原肽、减毒活病毒或灭活病毒或其组合。在一些实施方案中,抗原肽包含与seq id no:2、3-7、151-154、251-260、401-447、551-562、651-660、751-761、851-859、951-984、1051-1057或1151-1153中的一个或多个具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的氨基酸序列。在一些实施方案中,抗原肽包含与seq idno:2、8、401-447或551-562中的一个或多个具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的氨基酸序列。在一些实施方案中,抗原肽由与seq id no:101-104、201-209、301-347、501-512、601-610、701-711、801-809、901-934、1001-1007或1101-1103中的一个或多个具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的核酸序列编码。在一些实施方案中,抗原肽还包含编码白蛋白或其部分的氨基酸序列。在一些实施方案中,疫苗偶联至细胞表面。在一些实施方案中,疫苗是分泌型的。在一些实施方案中,无细胞核的细胞还包含含有粒细胞-巨噬细胞集落刺激因子的免疫调节剂。在一些实施方案中,无细胞核的细胞还包含对淋巴组织中一种或多种细胞上表达的配体具有特异性的归巢受体。在一些实施方案中,归巢受体包含c-x-c趋化因子受体3型、白细胞唾液酸蛋白、cd44抗原、c-c趋化因子受体7型、l-选择素、淋巴细胞功能相关抗原1或极晚期抗原4或其组合。在一些实施方案中,无细胞核的细胞的直径为约1微米(μm)至100μm。在一些实施方案中,无细胞核的细胞的直径为约8μm。在一些实施方案中,无细胞核的细胞在低温休眠至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温保存至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温休眠至少48小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温保存至少48小时后是有活力的。在一些实施方案中,无细胞核的细胞在冻干至少24小时后是有活力的。在一些实施方案中,使用本文所述的台盼蓝染料排除法测量活力。在一些实施方案中,台盼蓝染料排除法通过以下方法进行:(a)离心悬浮液中的多个无细胞核的细胞的等分试样以产生细胞沉淀;(b)将细胞沉淀再悬浮于无血清培养基中以产生无血清细胞悬浮液;(c)将1份台盼蓝染料和1份无血清细胞悬浮液混合;(d)在(c)的3-5分钟内对多个无细胞核的细胞进行计数,其中多个无细胞核的细胞中的至少一些未被台盼蓝染料染色,这指示活力。在一些实施方案中,使用本文所述的膜联蛋白-5细胞表面染色测量活力。在一些实施方案中,无细胞核的细胞被低温保存、低温休眠或冻干。在一些实施方案中,在不存在细胞核的情况下疫苗的合成或分泌由无细胞核的细胞进行大于或等于约3天。在一些实施方案中,无细胞核的细胞位于药学上可接受的载体中。在一些实施方案中,无细胞核的细胞的剂量为约103个细胞/kg体重至约1012个细胞/kg体重。在一些实施方案中,无细胞核的细胞的剂量为至少或约103、104、105、106、107、108、109、1010、1011、1012个细胞/kg体重。在一些实施方案中,无细胞核的细胞的剂量为至多或约103、104、105、106、107、108、109、1010、1011、1012个细胞/kg体重。在一些实施方案中,无细胞核的细胞被分离和纯化。
9、本文公开的方面提供了一种无细胞核的细胞,该细胞包含:一种或多种细胞内细胞器,所述细胞器用于在不存在细胞核的情况下合成或分泌抗细菌或毒素的疫苗。在一些实施方案中,无细胞核的细胞不是红细胞或红细胞前体。在一些实施方案中,无细胞核的细胞来源于一种或多种细胞内细胞器为内源的有核亲本细胞。在一些实施方案中,毒素是肉毒梭菌毒素、产气荚膜梭菌的ε毒素、葡萄球菌肠毒素b或来自蓖麻的蓖麻毒素或其任何组合。在一些实施方案中,细菌是炭疽芽孢杆菌、鼠疫耶尔森氏菌、土拉热弗朗西斯菌、布鲁氏菌、沙门氏菌、大肠杆菌o157:h7、志贺氏菌属(shigella)、鼻疽伯克霍尔德氏菌、类鼻疽伯克霍尔德氏菌(burkholderia pseudomallei)、鹦鹉热衣原体、贝氏考克斯菌(coxiellaburnetii)、普氏立克次氏体(rickettsia prowazekii)、霍乱弧菌或微小隐孢子虫或其任何组合。在一些实施方案中,疫苗偶联至细胞表面。在一些实施方案中,疫苗是分泌型的。在一些实施方案中,无细胞核的细胞还包含含有粒细胞-巨噬细胞集落刺激因子的免疫调节剂。在一些实施方案中,无细胞核的细胞还包含对淋巴组织中一种或多种细胞上表达的配体具有特异性的归巢受体。在一些实施方案中,归巢受体包含c-x-c趋化因子受体3型、白细胞唾液酸蛋白、cd44抗原、c-c趋化因子受体7型、l-选择素、淋巴细胞功能相关抗原1或极晚期抗原4或其组合。在一些实施方案中,无细胞核的细胞的直径为约1微米(μm)至100μm。在一些实施方案中,无细胞核的细胞的直径为约8μm。在一些实施方案中,无细胞核的细胞在低温休眠至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温保存至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温休眠至少48小时后是有活力的。在一些实施方案中,无细胞核的细胞在低温保存至少48小时后是有活力的。在一些实施方案中,无细胞核的细胞在冻干至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞被低温保存、低温休眠或冻干。在一些实施方案中,无细胞核的细胞被分离或纯化。在一些实施方案中,使用本文所述的台盼蓝染料排除法测量活力。在一些实施方案中,台盼蓝染料排除法通过以下方法进行:(a)离心悬浮液中的多个无细胞核的细胞的等分试样以产生细胞沉淀;(b)将细胞沉淀再悬浮于无血清培养基中以产生无血清细胞悬浮液;(c)将1份台盼蓝染料和1份无血清细胞悬浮液混合;(d)在(c)的3-5分钟内对多个无细胞核的细胞进行计数,其中多个无细胞核的细胞中的至少一些未被台盼蓝染料染色,这指示活力。在一些实施方案中,使用本文所述的膜联蛋白-5细胞表面染色测量活力。在一些实施方案中,无细胞核的细胞被低温保存、低温休眠或冻干。在一些实施方案中,在不存在细胞核的情况下疫苗的合成或分泌由无细胞核的细胞进行大于或等于约3天。在一些实施方案中,无细胞核的细胞位于药学上可接受的载体中。在一些实施方案中,无细胞核的细胞的剂量为约103个细胞/kg体重至约1012个细胞/kg体重。在一些实施方案中,无细胞核的细胞的剂量为至少或约103、104、105、106、107、108、109、1010、1011、1012个细胞/kg体重。在一些实施方案中,无细胞核的细胞的剂量为至多或约103、104、105、106、107、108、109、1010、1011、1012个细胞/kg体重。在一些实施方案中,无细胞核的细胞被分离和纯化。
10、本文公开的方面提供了包含本文所述的多个无细胞核的细胞的细胞群。
11、本文公开的方面提供了向对象递送疫苗的方法,该方法包括将第一剂量的本文所述的多个细胞中的细胞施用于对象。在一些实施方案中,对象在施用后接种疫苗。在一些实施方案中,在将细胞从低温休眠或低温保存中取出后至少24小时进行施用。在一些实施方案中,在将细胞从低温休眠或低温保存中取出后至少48小时进行施用。在一些实施方案中,无细胞核的细胞在冻干至少24小时后是有活力的。在一些实施方案中,使用本文所述的台盼蓝染料排除法测量活力。在一些实施方案中,台盼蓝染料排除法通过以下方法进行:(a)离心悬浮液中的多个无细胞核的细胞的等分试样以产生细胞沉淀;(b)将细胞沉淀再悬浮于无血清培养基中以产生无血清细胞悬浮液;(c)将1份台盼蓝染料和1份无血清细胞悬浮液混合;(d)在(c)的3-5分钟内对多个无细胞核的细胞进行计数,其中多个无细胞核的细胞中的至少一些未被台盼蓝染料染色,这指示活力。在一些实施方案中,使用本文所述的膜联蛋白-5细胞表面染色测量活力。在一些实施方案中,细胞在不存在细胞核的情况下在对象中合成或分泌疫苗超过或等于约3天。在一些实施方案中,细胞在不存在细胞核的情况下在对象中合成或分泌疫苗约3至5天。在一些实施方案中,方法还包括在施用第一剂量的细胞后至少1个月将第二剂量的细胞群中的第二细胞施用于对象。在一些实施方案中,方法还包括在施用第一剂量的细胞后至少2个月将第三剂量的细胞群中的第二细胞施用于对象。
12、本文公开的方面提供了包括向有需要的对象施用无细胞核的细胞的方法,该无细胞核的细胞在不存在细胞核的情况下合成或分泌治疗剂,其中该治疗剂对治疗与病毒引起的感染有关的疾病或病症是治疗有效的,该疫苗由与seq id no:1具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的序列编码。在一些实施方案中,方法还包括治疗对象的疾病或病症。在一些实施方案中,治疗剂是:(a)白细胞介素10的激动剂;(b)白细胞介素10的拮抗剂;(c)白细胞介素6;(d)肿瘤坏死因子(tnf);(e)(a)至(d)中任一项的一部分;或(e)(a)至(d)中任一项的组合。在一些实施方案中,白细胞介素10的激动剂是白细胞介素10或其部分,其包含与seq id no:13具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的氨基酸序列。在一些实施方案中,白细胞介素10的激动剂或其部分还包含编码白蛋白或其部分的氨基酸序列。在一些实施方案中,治疗剂由细胞分泌。在一些实施方案中,白细胞介素6的激动剂或其部分包含与seq id no:14具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的氨基酸序列。在一些实施方案中,tnf的激动剂包含与seq idno:15具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的氨基酸序列。在一些实施方案中,无细胞核的细胞还包含对对象的肺组织中一种或多种细胞上表达的配体具有特异性的归巢受体。在一些实施方案中,归巢受体包含p-选择素糖蛋白配体1、c-c基序趋化因子受体2或c-x-c基序趋化因子受体4或其组合。在一些实施方案中,细胞还包含对对象的淋巴组织中一种或多种细胞上表达的配体具有特异性的归巢受体。在一些实施方案中,归巢受体包含c-x-c趋化因子受体3型、白细胞唾液酸蛋白、cd44抗原、c-c趋化因子受体7型、l-选择素、淋巴细胞功能相关抗原1或极晚期抗原4或其组合。在一些实施方案中,无细胞核的细胞还包含含有粒细胞-巨噬细胞集落刺激因子(gm-csf)的免疫调节剂。在一些实施方案中,疾病或病症是呼吸系统疾病或病症。在一些实施方案中,疾病或病症包括冠状病毒疾病(covid)的症状。在一些实施方案中,covid是covid-19。
13、本文公开的方面提供了包括向有需要的对象施用无细胞核的细胞的方法,该无细胞核的细胞在不存在细胞核的情况下合成或分泌治疗剂,其中治疗剂对于治疗至少部分由病原体感染引起的疾病或病症是治疗有效的。在一些实施方案中,病原体是病毒、细菌、真菌或毒素。在一些实施方案中,病毒是溶瘤病毒。在一些实施方案中,毒素是肉毒梭菌毒素、产气荚膜梭菌的ε毒素、葡萄球菌肠毒素b或来自蓖麻的蓖麻毒素或其任何组合。在一些实施方案中,细菌是炭疽芽孢杆菌、鼠疫耶尔森氏菌、土拉热弗朗西斯菌、布鲁氏菌、沙门氏菌、大肠杆菌o157:h7、志贺氏菌属(shigella)、鼻疽伯克霍尔德氏菌、类鼻疽伯克霍尔德氏菌(burkholderia pseudomallei)、鹦鹉热衣原体、贝氏考克斯菌(coxiella burnetii)、普氏立克次氏体(rickettsia prowazekii)、霍乱弧菌或微小隐孢子虫或其任何组合。在一些实施方案中,治疗剂是:(a)白细胞介素10的激动剂;(b)白细胞介素10的拮抗剂(例如,git27、as101、美索普兰(mesopram)或利妥昔单抗);(c)白细胞介素6;(d)肿瘤坏死因子(tnf);(e)(a)至(d)中任一项的一部分;或(e)(a)至(d)中任一项的组合。在一些实施方案中,白细胞介素10的激动剂是白细胞介素10或其部分,其包含与seq id no:13具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的氨基酸序列。在一些实施方案中,白细胞介素10的激动剂或其部分还包含编码白蛋白或其部分的氨基酸序列。在一些实施方案中,治疗剂由细胞分泌。在一些实施方案中,白细胞介素6的激动剂或其部分包含与seq id no:14具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的氨基酸序列。在一些实施方案中,tnf的激动剂包含与seq id no:15具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的氨基酸序列。在一些实施方案中,无细胞核的细胞还包含对对象的肺组织中一种或多种细胞上表达的配体具有特异性的归巢受体。在一些实施方案中,归巢受体包含p-选择素糖蛋白配体1、c-c基序趋化因子受体2或c-x-c基序趋化因子受体4或其组合。在一些实施方案中,细胞还包含对对象的淋巴组织中一种或多种细胞上表达的配体具有特异性的归巢受体。在一些实施方案中,归巢受体包含c-x-c趋化因子受体3型、白细胞唾液酸蛋白、cd44抗原、c-c趋化因子受体7型、l-选择素、淋巴细胞功能相关抗原1或极晚期抗原4或其组合。在一些实施方案中,无细胞核的细胞还包含含有粒细胞-巨噬细胞集落刺激因子(gm-csf)的免疫调节剂。在一些实施方案中,疾病或病症提供于表3-6中。
14、本文公开的方面提供了治疗病原体相关的疾病或病症的方法,该方法包括:(a)向患有由病原体引起的感染的对象施用多个基本上不含细胞核的细胞,从而通过以下步骤在体内将病原体与对象隔离:(i)允许病原体感染(a)中施用于对象的多个细胞中至少一个无细胞核的细胞;和(ii)在(i)之后,阻止病原体在至少一个无细胞核的细胞中繁殖;以及(b)通过以下步骤中的至少一个治疗病原体相关的疾病或病症:(i)在体内从多个细胞中的至少一种细胞去除或减少病原体;和(ii)从对象中基本上去除至少一个无细胞核的细胞。在一些实施方案中,至少一个无细胞核的细胞包含对对象的淋巴组织中的一种或多种细胞上表达的配体具有特异性的归巢受体。在一些实施方案中,归巢受体包含c-x-c趋化因子受体3型、白细胞唾液酸蛋白、cd44抗原、c-c趋化因子受体7型、l-选择素、淋巴细胞功能相关抗原1或极晚期抗原4或其组合。在一些实施方案中,病原体是冠状病毒。在一些实施方案中,冠状病毒由与seq id no:1具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的核酸序列编码。在一些实施方案中,至少一个无细胞核的细胞包含免疫调节剂,该免疫调节剂包括:(a)粒细胞-巨噬细胞集落刺激因子;(b)细胞因子;(c)(a)或(b)的一部分;或(d)(a)至(c)的任何组合。在一些实施方案中,至少一个无细胞核的细胞包含一种或多种足以合成或分泌(a)至(d)中的一种或多种的细胞内细胞器。在一些实施方案中,细胞因子包含与seq id no:13、14或15或其组合具有大于或等于约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的序列同一性的氨基酸序列。在一些实施方案中,细胞因子是分泌型的。在一些实施方案中,至少一个无细胞核的细胞的直径为约1微米(μm)至100μm。在一些实施方案中,至少一个无细胞核的细胞的直径为约8μm。在一些实施方案中,方法还包括在(a)中施用之前从低温休眠或低温保存中去除多个基本上不含细胞核的细胞。在一些实施方案中,在从低温休眠、低温保存或冻干中去除多个基本上不含细胞核的细胞后至少24小时内,多个基本上不含细胞核的细胞是有活力的。在一些实施方案中,无细胞核的细胞在冻干至少24小时后是有活力的。在一些实施方案中,无细胞核的细胞被低温保存、低温休眠或冻干。在一些实施方案中,无细胞核的细胞被分离或纯化。在一些实施方案中,使用本文所述的台盼蓝染料排除法测量活力。在一些实施方案中,台盼蓝染料排除法通过以下方法进行:(a)离心悬浮液中的多个无细胞核的细胞的等分试样以产生细胞沉淀;(b)将细胞沉淀再悬浮于无血清培养基中以产生无血清细胞悬浮液;(c)将1份台盼蓝染料和1份无血清细胞悬浮液混合;(d)在(c)的3-5分钟内对多个无细胞核的细胞进行计数,其中多个无细胞核的细胞中的至少一些未被台盼蓝染料染色,这指示活力。在一些实施方案中,使用本文所述的膜联蛋白-5细胞表面染色测量活力。在一些实施方案中,在(b)中治疗病原体相关的疾病或病症是通过从多个细胞中的至少一个细胞中去除或减少病原体。在一些实施方案中,至少一个细胞包含有效减少或去除来自该至少一个细胞的病原体的抗病毒剂。在一些实施方案中,在(b)中治疗病原体相关的疾病或病症是通过从对象中基本上去除至少一个无细胞核的细胞。在一些实施方案中,该多个细胞不是红细胞或红细胞前体。在一些实施方案中,至少一个无细胞核的细胞包含编码中和抗体的异源多核苷酸,该中和抗体阻断病原体与对象的细胞表达的病原体识别的受体之间的结合。
15、在一些实施方案中,方法还包括在不存在细胞核的情况下由至少一个无细胞核的细胞分泌中和抗体,从而减少或改善病原体与对象的细胞的病原体识别部分之间的结合。在一些实施方案中,病原体是病毒、细菌、毒素或真菌。在一些实施方案中,病毒是溶瘤病毒。在一些实施方案中,病毒是冠状病毒。在一些实施方案中,冠状病毒是sars-cov-2或其变体。在一些实施方案中,毒素是肉毒梭菌毒素、产气荚膜梭菌的ε毒素、葡萄球菌肠毒素b或来自蓖麻的蓖麻毒素或其任何组合。在一些实施方案中,细菌是炭疽芽孢杆菌、鼠疫耶尔森氏菌、土拉热弗朗西斯菌、布鲁氏菌、沙门氏菌、大肠杆菌o157:h7、志贺氏菌属(shigella)、鼻疽伯克霍尔德氏菌、类鼻疽伯克霍尔德氏菌(burkholderiapseudomallei)、鹦鹉热衣原体、贝氏考克斯菌(coxiella burnetii)、普氏立克次氏体(rickettsia prowazekii)、霍乱弧菌或微小隐孢子虫或其任何组合。
16、援引并入
17、在本说明书中提到的所有出版物、专利和专利申请都通过引用并入本文,其程度与每个单独的出版物、专利或专利申请被具体地和单独地指出通过引用并入的程度相同。就通过引用并入的出版物和专利或专利申请与本说明书中包含的公开内容相矛盾而言,本说明书旨在取代和/或优先于任何此类矛盾的材料。
- 还没有人留言评论。精彩留言会获得点赞!