用于心外膜ECG监测的测量探头和包括该探头的用于心外膜ECG监测的测量系统的制作方法
用于心外膜ecg监测的测量探头和包括该探头的用于心外膜ecg监测的测量系统
技术领域
1.本发明涉及一种用于心外膜ecg监测的测量探头以及包括这种探头的用于心外膜ecg监测的测量系统,该测量探头直接从跳动心脏的表面获取信号,以用于在手术过程期间、特别地在通过包括非泵送技术在内的技术对跳动心脏进行冠状动脉旁路移植期间监测和评估心脏状况,该测量探头允许在涉及自然心脏位置变化的手术期间精确地且不间断地获取信号。
背景技术:
2.本领域已知下述装置:所述装置允许通过将电极放置在患者皮肤表面上且直接放置在心脏上而在手术过程期间获取患者的ecg信号。
3.文献pl213307b1描述了用于在心脏手术期间监测心脏的系统和装置,其中,电极直接放置在患者心脏的表面上。该装置应用于评估手术部位区域处的心肌状况,该手术部位区域由心脏稳定器和可选的心脏定位器稳定。该系统包括带有连接至吸力泵和测量电极的腔室和吸气通道的心脏稳定器,测量电极通过测量接口与具有导抗测量模块的测量块连接,测量块连接至控制及数据采集系统。
4.专利文献pl213307b1中描述的装置是一种电极系统,电极应用于心脏稳定器臂中的吸盘的工作表面,即,装置通过负压附接至心脏表面。施加在心脏表面上的负压会导致局部血液外渗。该装置测量导抗(组织阻抗)。组织阻抗不是作为心肌缺血参数由心脏监测仪分析的参数。
5.文献us2014206973a1描述了远程监测心血管系统的生理参数的系统和装置、以及将传感器放置在心脏表面上的方法,这需要“夹紧”(刺穿)组织和/或真空诱导粘附。它是一种从心脏表面持续、永久(长期)监测信号的装置,但它不允许在标准心脏监测仪上实时显示ecg信号,尤其是在开胸手术期间更是如此。所描述的装置适于通过无线方式将ecg信号传输至另一装置,该另一装置记录所获取的信号,以便在保存之后进行分析。使用这种装置的目标人群是心肌衰竭和心律失常患者。没有描述该装置在心脏手术中的使用。
6.专利文献us2014206973a1中描述的装置不适用于记录胸部开放和心脏的非解剖位置的信号。在胸部闭合的情况下,不能旋转心脏,以在冠状动脉旁路移植手术期间进行改变时改变心脏的位置。所描述的装置由非手术——经皮技术提供。所描述的设备构造需要连接至皮下植入的信号记录(保存)装置。所描述的装置适于通过无线技术将ecg信号传输至另一装置,该另一装置记录所获取的信号以在保存之后进行分析。无线信号传输的要求排除了其在手术条件下(在手术室中)的功能。将所描述的装置从心脏表面移除可能会由于早期介入心外膜组织(例如,心外膜静脉)而导致出血。此外,描述还指出了为电极提供物理固定手段以将电极保持在心脏表面上的必要性,所述手段例如为负压。施加在心脏表面上的负压会对心外膜组织的结构产生不利影响,从而导致心脏组织或心包局部外渗(血肿)。所描述的装置不能在不中断组织连续性的情况下在心脏表面上重新定位,这是因为每次都
可能由于负压而出现组织刺穿或血肿——装置的任何重新定位都与出血风险相关并且增加组织损伤。此外,所描述的装置的重新定位需要处理(照管)物理固定手段(负压)传递系统。每次操纵都需要时间和执行额外动作。
7.此外,操作文献us2014206973a1中描述的系统可能需要将电极通过血管插入到心脏中,不建议将电极插入心脏内进行心脏操纵,这是因为位于心腔内的电极可能会刺穿或损坏心壁。所描述的装置中呈现的信号采集方法在组织内而不是在其表面上执行。因此,这是壁内测量,而不是心外膜测量。所描述的装置仅监测心脏的前壁。该装置不能安装在心脏的后壁处,这是因为仅心脏的重量就可能会导致针的离开对组织造成更大损伤,或者可能会导致负压固定系统的功能障碍。
8.现有技术中已知的解决方案在获取信号的定位元件中不提供灵活性。文献pl213307b1的解决方案提供了一种系统,其中,电极定位在稳定在固定位置中的心脏的表面上,从而不可能在改变心脏的位置的同时保持电极与心脏接触,而文献us2014206973a1的装置是一种被设计成由患者长期携带的侵入性装置,此外,文献us2014206973a1中公开的系统和装置并非直接应用于患者心脏。
9.此外,本领域中已知的解决方案均未提供具有下述尺寸的装置,当放置在心脏表面时,该装置能够在不覆盖器官的大部分区域的情况下容易地接近器官。
10.在许多情况下,心电图监测是必要的,这些情况中的一种情况是冠状动脉旁路移植手术。这种手术通常针对晚期冠状动脉硬化患者,特别地由于社会老龄化,这种手术的数量仍在增加。直到最近,进行这种手术的传统技术还采用利用体外循环机临时替代心肺功能,然而,考虑到一些术后并发症,在不使用体外循环(非体外循环冠状动脉旁路移植术——opcab)的情况下基于对跳动心脏进行的动脉旁路移植手术的技术越来越广泛地使用。与传统技术相比,这种技术允许对于一些患者组降低死亡率和并发症的数量,然而,这种技术需要暂时改变跳动心脏位置,以暴露心脏的特定壁和冠状动脉,这种行为称为心脏操纵。在跳动心脏的操纵期间,需要进行非常精确的心电图监测,以快速地诊断所有心律失常、心脏血液供应,并采取适当的预防措施。对经历手术的患者的标准监测例如包括心电图记录(ecg)。
11.上文描述了心脏ecg监测的示例性标准技术,但它们不适用于使用opcab技术的手术。缺少一种解决方案,该解决方案在整个旁路手术期间从每个旁路冠状动脉区域之上顺序地实时检查心电图记录,并且ecg信号将从手术区域输出至位于手术室中的标准心脏监测仪。
12.所有上述现有技术解决方案以及临床实践中常规使用的解决方案都无法确保在心脏的自然位置发生变化的情况下对跳动心脏进行冠状动脉旁路移植手术期间进行正确、连续、诊断性的ecg监测。由于以下原因,在这种手术期间可能无法通过位于患者皮肤上的电极正确记录ecg:
[0013]-由于心脏的自然位置发生改变,心脏与周围组织失去接触;
[0014]-将材料引入至患者胸部,这将心脏与周围组织隔开。
[0015]
失去足以监测心脏状况的信号,就无法精确地监测潜在的心脏缺血,从而无法采取行动,解除对患者生命的危害。
[0016]
目前,没有直接从心脏表面测量ecg的可用解决方案(装置)。心脏手术采用临时驱
动到心脏组织(壁)中的电极,其作用是刺激心脏,而不是记录ecg信号。这种电极穿透心脏组织。这种电极用于可选的ecg信号读取的用途将与反复刺穿心脏组织有关,这可能会引起出血。此外,电极在其梢端设置有针,在针从心脏组织中取出时可能会导致心脏组织破裂和进一步出血。其次,可能使用电极对心脏组织进行穿孔,然后在电极的应用之后切割针,这仍然有出血的风险,而且还需要使用许多电极——每个新位置都需要一个新电极。因此,这种变型同样会导致反复刺穿心脏组织并有出血的风险。
[0017]
本发明允许从心脏表面获取ecg信号,这对心脏是非侵入性且安全的,即使在手术期间心脏位置发生许多必要变化的情况下对心脏也是非侵入性且安全的,而且不会同时占用心脏的较大区域。
技术实现要素:
[0018]
一种用于心外膜ecg监测的测量探头,其特征在于,该测量探头包括用于测量来自心脏的电信号的测量元件以及布置成通过连接片段输出测得的心脏信号的连接元件,测量元件与连接元件电连接。测量元件是包括分布在测量元件的至少一部分上的信号采集层以及在测量元件的整个表面之上延伸的基底层的分层元件。连接元件是包括导电层、使导电层隔离的介电层、以及在连接元件的整个表面之上延伸的基底层的分层元件。设置在连接元件的与测量元件相反的端部处的连接片段是包括由导电层和基底层组成的分层元件。测量元件的垂直于厚度的最大尺寸为30mm。
[0019]
优选地,测量元件在信号采集层与基底层之间包括导电层,而在连接元件中,导电层布置在介电层之上,基底层位于导电层之上,测量元件的导电层和连接元件的导电层构成延伸跨越测量元件和连接元件的连续导电层。
[0020]
优选地,在测量元件中,基底层位于信号采集层之上,而在连接元件中,基底层位于布置在介电层之上的导电层之上。
[0021]
优选地,在测量元件中,基底层位于信号采集层之上,而在连接元件中,基底层位于布置在介电层之上的导电层之上,测量元件的信号采集层和连接元件的导电层构成延伸跨越测量元件和连接元件的连续层。
[0022]
优选地,在测量元件中,基底层位于信号采集层之上,而在连接元件中,导电层布置在介电层之上,基底层位于导电层之上,连接元件的导电层在邻近于测量元件的部段处由与测量元件的信号采集层相同的材料制成,其余部分由另一种导电材料制成。
[0023]
优选地,测量元件的信号采集层也是允许固定探头的粘合层。
[0024]
优选地,测量元件的信号采集层与连接元件的介电层部分地重叠。
[0025]
优选地,在测量元件中,信号采集层位于粘合层之上。
[0026]
优选地,测量元件包括位于测量元件的周缘处并且部分地覆盖信号采集层的粘合层。
[0027]
优选地,在测量元件中,粘合层是石墨烯tpu层。
[0028]
优选地,连接元件中的导电层是石墨烯pmma层。
[0029]
优选地,测量元件中的信号采集层是石墨烯层。
[0030]
优选地,连接元件中的导电层是石墨烯层。
[0031]
优选地,导电层至少部分地为银层。
[0032]
优选地,测量元件在垂直于测量元件的厚度的平面中具有圆形形状。
[0033]
优选地,连接元件垂直于连接元件的厚度的平面中具有矩形形状。
[0034]
优选地,测量元件和连接元件位于同一平面中。
[0035]
优选地,所有层都由柔性材料制成。
[0036]
优选地,介电层和基底层由相同材料制成。
[0037]
优选地,粘合层具有环形形状。
[0038]
优选地,连接元件通过连接片段连接至信号线缆。
[0039]
优选地,信号采集层包括至少一个载体、导电物质以及任选的至少一个粘合促进剂。
[0040]
优选地,粘合促进剂包含选自以下物质中的一种物质:羊毛脂、琼脂、海藻酸钠、胶原蛋白、明胶、淀粉和纤维素及其衍生物,比如羧甲基纤维素、羧甲基淀粉、羟丙基淀粉或其混合物。
[0041]
优选地,导电物质是选自au、ag、pdag、石墨、石墨烯、ruo2、iro2、bi2ru2o7、ito或其混合物中的至少一者。
[0042]
优选地,载体是具有溶剂的聚合物化合物或具有溶剂的树脂。
[0043]
优选地,聚合物是选自乙基纤维素、聚丙烯、聚乙烯、聚酯和聚苯乙烯、聚(甲基丙烯酸甲酯)(pmma)、热塑性聚氨酯弹性体(tpu)、聚乳酸(pla)或其混合物中的一者。
[0044]
优选地,溶剂是选自丙酮、二甲基甲酰胺(dmf)、丁基卡必醇乙酸酯(okb)、氯仿或其混合物中的一者。
[0045]
优选地,石墨烯tpu层包含石墨烯、羟丙基淀粉以及含于二甲基甲酰胺中的热塑性聚氨酯弹性体。
[0046]
优选地,石墨烯tpu层包含按重量计10%的石墨烯钠、按重量计10%的羟丙基淀粉以及80%的含于二甲基甲酰胺中的热塑性聚氨酯弹性体。
[0047]
优选地,石墨烯pmma层包含石墨烯以及含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。
[0048]
优选地,石墨烯pmma层包含按重量计13%的石墨烯以及按重量计87%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。
[0049]
优选地,石墨烯层包含海藻酸钠、石墨烯以及含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。
[0050]
优选地,石墨烯层包含按重量计10%的海藻酸钠、按重量计13%的石墨烯以及按重量计77%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。
[0051]
优选地,石墨烯层包含含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)、石墨烯和/或琼脂。
[0052]
优选地,银层包括基质中的银微片。
[0053]
优选地,银层包含按重量计70%的银微片以及按重量计30%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。
[0054]
优选地,基质是含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)溶液。
[0055]
优选地,介电层包括介电膏体。
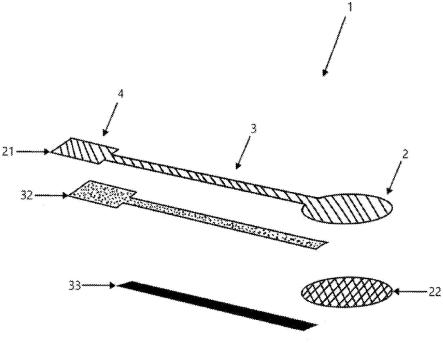
[0056]
优选地,粘合层包括聚合物和粘合促进剂。
[0057]
优选地,聚合物是选自乙基纤维素、聚丙烯、聚乙烯、聚酯和聚苯乙烯、聚(甲基丙烯酸甲酯)(pmma)、热塑性聚氨酯弹性体(tpu)、聚乳酸(pla)及其混合物中的一者。
[0058]
优选地,粘合促进剂是选自以下物质中的至少一种物质:羊毛脂、琼脂、海藻酸钠、胶原蛋白、明胶、淀粉和纤维素及其衍生物,比如羧甲基纤维素、羧甲基淀粉、羟丙基淀粉或其混合物。
[0059]
优选地,基底层包含选自以下材料中的一种材料:聚对苯二甲酸乙二醇酯(pet)、聚萘二甲酸乙二醇脂(pen)、聚醚醚酮(peek)、聚碳酸酯(pc)、聚醚砜(pes)、极性丙烯酸酯(par)、多环烯烃(pco)或聚降冰片烯(pnb)、聚酰亚胺(pi)、含氟聚酯或其共聚物。
[0060]
优选地,测量元件和连接元件的各个层通过在基底层上进行印刷的过程而制成。
[0061]
优选地,测量元件的直径在10mm与30mm之间。
[0062]
优选地,介电层、信号采集层、连接层的厚度在10μm至15μm范围内。
[0063]
优选地,基底层的厚度在40μm至75μm的范围内。
[0064]
优选地,含石墨烯层的厚度在10μm至30μm的范围内。
[0065]
一种用于心外膜ecg监测的测量系统,该测量系统包括根据上述示例中的一个示例的探头。
[0066]
优选地,该系统包括将探头与显示装置连接的信号线缆。
[0067]
优选地,在探头的连接元件的与探头的测量元件相反的端部处,连接片段布置成用于与信号线缆连接。
[0068]
优选地,显示装置包括心脏监测仪。
[0069]
由于根据本发明的探头,可以在手术期间对在放置在非自然位置中或被手术隔离材料包围的心脏上的具有诊断价值的ecg信号保持监控,可以在无需担心探头在任何位置中且从心脏的任何壁丢失信号的情况下提供心脏的最佳定位的可能性,并且允许医生在手术场中更自由地进行手术。此外,使用探头,即持续监测患者心脏的灌注,为手术团队提供持续信息。掌握这些信息可能会减轻手术团队尽快完成手术的压力。许多科学论文报道,这种压力可能会影响正在进行的手术的质量和冠状动脉搭桥的最佳次数。根据本发明的探头进一步允许监测除正在进行血管重建的心壁以外的心壁。此外,探头可以在任何时候重新卡在心脏上的另一个位置中,这在执行例如分流至冠状动脉期间发生心脏功能障碍的情况下是有用的,并且探头的先前位置并不表示心脏旁路区域的缺血。此时,探头可以快速重新卡在心脏的另一个位置(例如,相反壁)中,因此可以进行快速、精确的术中诊断。当为特定动脉的旁路移植准备的心脏位置会导致心脏的相反侧(另一侧)处冠状动脉的血流紊乱时,可能会出现这种情况。
[0070]
所有上述益处都允许采取预测冠状动脉旁路移植期间出现的心肌缺血的结果的动作,并且降低手术关键阶段中的循环停止的风险以及开始复苏和抢救转为体外循环的必要性,这显著降低了由低输出量综合征引起的诸如死亡、心力衰竭、心肌梗死、多器官衰竭之类的术后并发症的风险。
[0071]
根据本发明的探头还可以应用于冠状动脉旁路以外的手术,比如监测暴露于心脏停搏液中的心脏的电活动(在心脏瓣膜和先天性疾病的心内手术中),在每种类型的手术中对具有来自体表的非诊断性ecg记录的患者进行的术中急性心衰诊断,或使用心脏手术机器人进行的心脏手术。在后一种手术中,只有通过所谓的胸腔镜端口——即直径约1cm的切
口才能进入心脏。由于其特性(将在下文中描述),根据本发明的探头是灵活的,并且可以挤压而不会失去其特性,这使得即使通过小胸腔镜端口也可以放置探头。
[0072]
此外,应当认识到,上文指示和描述的探头应用仅是示例性的,并且根据本发明的探头还可以特别地通过检测由出现坏死的心脏区域(过去的心肌梗死区域)生成的电信号的特定特征而用于心肌坏死区的术中诊断,这可以用来决定在这样的区域中进行冠状动脉旁路手术。
[0073]
此外,由于探头的尺寸和灵活性以及探头布置的自由性,探头可以用作心外膜电极来电刺激心脏,用作研究来自心包内部分中的肺静脉的表面的电信号和传导电刺激的元件,或者用于包括左心耳的心脏心房的电标测,还用于本文中未描述的许多其他医疗和诊断用途。
[0074]
根据本发明的探头的主要功能包括:
[0075]-在不需要心内插入电极的情况下,从跳动和停止心脏的表面获取ecg信号,以消除刺穿或损伤心脏壁的风险;
[0076]-检测心脏缺血;
[0077]-在不提供额外固定装置的情况下基于粘合而无创地固定至心脏表面的可能性,其中,不需要额外的负压,也不需要破坏组织完整性,也不必使用额外的导管,换言之,由于粘附机构内置于探头中并且在与组织接触时自动发挥作用,并且激活粘合力的能量并非从外部传递,因而根据本发明的解决方案无需处理(提供)额外的粘合力,其中,在胸部开放的情况下,在视觉控制下固定至表面,从而避免损伤(损坏)心脏壁处的结构(例如,血管);
[0078]-适应从心脏和心房的每一个壁的表面获取ecg信号,以允许自由定位探头,这是因为探头不会与心外膜组织碰撞;
[0079]-在不增加心外膜组织损伤的风险的情况下,重复应用于心脏表面的可能性;
[0080]-将探头连接至任何商用心脏监测仪并在标准监测仪上连续地显示ecg信号的可能性;
[0081]-探头与被批准供人使用的任何类型(型号)的心脏稳定器配合使用的可能性,探头还可以在手术期间在没有心脏稳定器的情况下使用。
附图说明
[0082]
现在将参照附图中的图来描述根据本发明的探头,在附图中:
[0083]
图1是根据本发明的探头的等距分解图;
[0084]
图2图示了根据本发明定位探头的方法;
[0085]
图3是使用根据本发明的探头和测量系统进行手术期间的手术室以及医务人员和手术室中提供的医疗设备的视图;
[0086]
图4是根据本发明的探头的最优选实施方式的横截面图,其中,导电层在测量元件之上延伸;
[0087]
图5是带有两倍厚度的信号采集层的图4的探头的横截面图;
[0088]
图6是根据本发明的探头的一个实施方式的横截面图;
[0089]
图7是带有两倍厚度的信号采集层的图6的探头的横截面图;
[0090]
图8是根据本发明的探头的实施方式的横截面图,其中,导电层和信号采集层由相
同材料制成;
[0091]
图9是带有两倍厚度的连接层和信号采集层的图8的探头的横截面图;
[0092]
图10是根据本发明的探头的实施方式的横截面图,其中,导电层仅在导电元件的一部分之上延伸,并且信号采集层在连接元件之上部分地延伸;
[0093]
图11是带有两倍厚度的信号采集层的图10的探头的横截面图;
[0094]
图12是带有环形粘合层的图6的探头的横截面图;
[0095]
图13是带有环形粘合层的图7的探头的横截面图;
[0096]
图14是带有环形粘合层的图8的探头的横截面图;
[0097]
图15是带有环形粘合层的图9的探头的横截面图;
[0098]
图16是带有环形粘合层的图4的探头的横截面图;
[0099]
图17是带有环形粘合层的图5的探头的横截面图;
[0100]
图18是带有环形粘合层的图10的探头的横截面图;
[0101]
图19是带有环形粘合层的图11的探头的横截面图。
具体实施方式
[0102]
探头的不同结构
[0103]
根据图1中图示的本发明的实施方式的探头1呈长的、窄的、平的分层元件的形式,该探头1包括测量元件2,所述测量元件2例如是在垂直于其厚度的平面中具有直径在10mm至30mm的范围内、例如直径为15mm的圆形形状的元件。此外,探头1包括呈条带形式、例如呈矩形形状的连接元件3,并且在连接元件3的与测量元件2相反的端部处,连接片段4布置成与信号线缆5连接。测量元件2和连接元件3电连接并且位于同一平面中。测量元件2配置为测量来自心脏表面的电信号,并且连接元件3配置为输出从心脏表面测量的信号。测量元件2包括分布在测量元件2的至少一部分上的信号采集层22、以及在测量元件2的整个表面之上延伸的基底层21,基底层21包括基板,其余层施加到该基板上,并且如下所述,该基板用作信号采集层和连接层32相对于患者身体的外部环境的隔离件。连接元件3包括导电层32、隔离导电层32的介电层33、以及在连接元件3的整个表面之上延伸的基底层21。介电层33在探头1的连接元件3的整个长度上延伸,并且使布置在介电层33上的导电层32相对于外部环境、特别地相对于心脏表面在连接元件3的整个长度上完全电隔离。设置在连接元件3的所述端部处的连接片段4包括基底层21以及设置在基底层21上的导电层32。
[0104]
在对探头的各种模型进行测试期间,证明的是,在图4和图5中图示的最优选实施方式中,探头1在测量元件2中包括基底层21和同时为粘合层23的信号采集层22,并且在连接元件3中包括布置在导电层31之上的基底层21,导电层31设置在介电层33之上,其中,连接元件3的所述导电层32在测量元件2之上延伸,使得导电层32在该元件中布置在基底层21与信号采集层22之间。换言之,在测量元件2中,基底层21布置在导电层32之上,导电层32设置在信号采集层22之上。
[0105]
此外,测量元件2的导电层32和连接元件3的导电层32是由单一材料制成的一个部件,并且包括在元件2和元件3两者的全部长度上延伸的连续层。此外,测量元件2由覆盖导电层32的基底层21完全覆盖,并且信号采集层22的其余部分存在于测量元件2的边缘处。在下一部分中将结合对各个层的组合物的描述来更广泛地描述最优选实施方式。
[0106]
下面描述本发明的其他可能实施方式。
[0107]
在图6和图7中呈现的实施方式中,探头1在测量元件2中包括布置在信号采集层22之上的基底层21,并且在连接元件3中包括布置在导电层32之上的基底层22,导电层32又布置在介电层33之上,并且在连接片段4中包括布置在基底层21之上的导电层32。
[0108]
在图8和图9中呈现的另一个实施方式中,在测量元件2中,基底层21位于信号采集层22之上,并且在连接元件3中,基底层21位于布置在介电层33之上的导电层32之上。此外,测量元件2的信号采集层22和连接元件3的导电层32由相同材料制成并且构成延伸跨越测量元件2和连接元件3的连续层。此外,连接片段4中的连接元件3具有位于基底层21之上的导电层32。
[0109]
在图10和图11中呈现的本发明的另一个实施方式中,探头1在测量元件2中包括位于信号采集层22之上的基底层21,并且在连接元件3中包括位于导电层32之上的基底层22,导电层32又位于介电层33之上,而在连接片段4中包括位于基底层21之上的导电层32。在该实施方式中,连接元件3的导电层32在与测量元件2相邻的部段中由与测量元件2的信号采集层22相同的材料制成,其余部分由另一种导电材料制成。换言之,连接元件3的连接层32的一部分是信号采集层2,其与测量元件2的信号采集层22构成一个层。图11图示了其中具有两倍厚度的信号采集层22位于测量元件2和连接元件3的一部分中的实施方式,但是也可以实现其中具有两倍厚度的信号采集层22仅位于测量元件2中的实施方式。
[0110]
在上述实施方式中的每个实施方式的替代性变型中,测量元件2的信号采集层22与连接元件3的介电层33部分地重叠。
[0111]
在上述实施方式中的每个实施方式的另一中变型中,信号采集层22可以像在最优选实施方式中一样同时包括粘合层23。
[0112]
在上述实施方式中的每个实施方式的后续变型中,在测量元件2中,信号采集层22位于粘合层23之上,并且在另一个实施方式中,粘合层23位于测量元件2的周缘处,部分地覆盖信号采集层22。
[0113]
在本发明的实施方式的另一种变型中,上述实施方式的探头1在测量元件2中还包括位于测量元件2的周缘处的环形粘合层23,如图12至19中所图示的。
[0114]
在上述实施方式中,测量元件2的基底层21、连接元件3和连接片段4优选地由一个元件制成。
[0115]
探头的组合物
[0116]
在对根据本发明的探头的组合物的描述中,“衍生物”应当理解为通过用官能团(通过改变结构)或一组其他原子替换分子中的一个或更多个原子而制备的任何化学化合物。“基质”是功能相粒子悬浮于其中的连续相,其中,基质提供了与功能相粒子不同的对应物理参数,例如,悬浮有石墨烯片的聚合物,基质提供了灵活性,而包含功能相粒子的片提供了层的传导性。“载体”是在硬化之前处于液态的基质。
[0117]
在描述中,除非另有说明,否则描述的是在溶剂蒸发之前的膏体和层的组合物。在蒸发之后,膏体中的溶剂的量是可忽略不计的或者为零。在蒸发之前溶剂与聚合物的重量比在题为“探头的示例制造过程”的小节中描述。
[0118]
在上述探头1的结构的实施方式中,所有层均由柔性材料制成。
[0119]
在上述探头1的结构的实施方式中,基底层21例如由pet膜制成。
[0120]
在随后的实施方式中,介电层33和基底层21由相同材料制成。
[0121]
在图4和图5中图示的优选实施方式中,同时为粘合层23的信号采集层22是在描述中被进一步称为“石墨烯tpu”层的层,并且导电层32是在描述中被进一步称为“石墨烯pmma”层的层。最优选变型中的“石墨烯tpu”层包括热塑性聚氨酯弹性体(tpu)、用作导电物质的石墨烯、作为淀粉衍生物并用作粘合促进剂和溶剂的羟丙基淀粉(lycoat rs720淀粉)。在本实施方式中,优选比例为按重量计80%的热塑性聚氨酯弹性体tpu作为膏体(呈膏体的形式)、按重量计10%的lycoat rs720淀粉以及按重量计10%的作为石墨烯片的石墨烯。
[0122]
在图6、图7、图12、图13、图16和图17中呈现的实施方式中,测量元件2中的信号采集层22是在描述中被称为“石墨烯层”的层,并且在图8、图9、图14和图15中呈现的另一实施方式中,石墨烯层也是连接元件3中的导电层32。然而,在图10、图11、图18和图19中呈现的实施方式中,测量元件2中的信号采集层22和连接元件3中的连接层32的一部分是石墨烯层,并且在连接元件的导电层32的在测量元件2远侧的其余部分中例如是银层。显然,解决方案不限于信号采集层22是石墨烯层并且导电层32是银层的情况,如下所述。
[0123]
石墨烯层在另一种变型中包含海藻酸钠、石墨烯和含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。海藻酸钠含量在按重量计10%至20%的范围内,更具体地可以在按重量计10至%12%的范围内。在一个实施方式中,优选比例为按重量计10%的海藻酸钠、按重量计13%的石墨烯和按重量计77%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。在所述实施方式的替代性变型中,优选比例为按重量计12%的海藻酸钠、按重量计13%的石墨烯和按重量计75%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。
[0124]
在本实施方式的另一种变型中,石墨烯层包含琼脂、石墨烯和含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。
[0125]
在又一种变型中,石墨烯层包含石墨烯和含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。
[0126]
在图4至图7、图10至图13以及图16至图19中图示的上述实施方式中,导电层32可以至少部分地是在描述中被称为银层的层,银层例如由例如片直径为25μm且厚度小于10nm的银微片含于基质中而制成。基质是含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)溶液。示例性银层包含按重量计70%的银微片和按重量计30%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。在导电层中使用银微片显著地增强由探头传输的信号的强度,然而,在没有所述银层的情况下使用本发明的最优选实施方式保证达到本发明目的所需的足够导电性能。
[0127]
在实施方式中,介电层33、信号采集层22和连接层32的厚度为10μm至15μm,并且在其中信号采集层21是石墨烯层、石墨烯tpu层或石墨烯pmma层的实施方式中,介电层33、信号采集层22和连接层32的厚度在10μm至30μm的范围内,这是因为石墨烯、石墨烯tpu和石墨烯pmma层可以制成为单层或双层(具有两倍厚度)。
[0128]
该实施方式中的基底层21的厚度在40μm至75μm的范围内。
[0129]
在该实施方式中,信号采集层22包括至少一个载体、导电物质和任选的至少一个粘合促进剂,其中,粘合促进剂是选自以下物质中的一种物质:羊毛脂、琼脂、海藻酸钠、胶原蛋白、明胶、以及淀粉和纤维素及其衍生物,比如羧甲基纤维素、羧甲基淀粉或羟丙基淀
粉(lycoat rs720淀粉)或其混合物;导电物质是选自au、ag、pdag、石墨、石墨烯、ruo2、iro2、bi2ru2o7、ito或其混合物中的至少一种;并且载体是具有溶剂的聚合物化合物或具有溶剂的树脂。
[0130]
在其中信号采集层22和/或连接层32的载体是具有溶剂的聚合物化合物的实施方式中,聚合物是选自乙基纤维素、聚丙烯、聚乙烯、聚酯和聚苯乙烯、聚(甲基丙烯酸甲酯)(pmma)、热塑性聚氨酯弹性体(tpu)、聚乳酸(pla)或其混合物中的一者。
[0131]
在一些实施方式中,导电层32优选地为石墨烯pmma层,石墨烯pmma层由厚度在8nm与15nm之间且直径大于2μm的石墨烯微片含于基质中而构成。基质为含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)(pmma)溶液。在优选实施方式中,石墨烯pmma层包含按重量计13%的石墨烯和按重量计87%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)。使用石墨烯确保良好的传导性,其中,导电强度可以通过添加石墨烯的量进行调整。在优选实施方式中,导电石墨烯片的直径大于层的厚度,因此各个片能够跨层传导信号,以克服层的高电阻,并且因此不需要高浓度的石墨烯片来实现所需的传导。
[0132]
对于探头1的一些变型,对连接层32进行了电阻测试,并且发现:
[0133]-当导电层32(在测量元件2和连接元件3中)是约1mm宽(垂直于厚度的较短尺寸)的银层时,电阻值为30
±
1ω;
[0134]-当导电层32(在测量元件2和连接元件3中)是约5mm宽的宽石墨烯层(pmma聚合物+石墨烯)时,电阻值为2.4
±
0.5ω;
[0135]-当导电层32(在测量元件2和连接元件3中)是约1mm宽的薄/窄石墨烯层(pmma聚合物+石墨烯)时,电阻值为37
±
1.9ω。
[0136]
在实施方式中,连接层32和/或信号采集层22的载体中使用的溶剂是选自丙酮、二甲基甲酰胺(dmf)、丁基卡必醇乙酸酯(okb)、氯仿或其混合物中的一者。
[0137]
在实施方式中,介电层33可以是介电膏体。在实施方式中,探头1包括单独的粘合层23,所述粘合层23包括聚合物和粘合促进剂,其中,粘合层23的聚合物是选自乙基纤维素、聚丙烯、聚乙烯、聚酯和聚苯乙烯、聚(甲基丙烯酸甲酯)(pmma)、热塑性聚氨酯弹性体(tpu)、聚乳酸(pla)或其混合物中的一者,并且粘合层23的粘合促进剂是选自以下物质中的至少一种物质:羊毛脂、琼脂、海藻酸钠、胶原蛋白、明胶、淀粉和纤维素及其衍生物,比如羧甲基纤维素、羧甲基淀粉、羟丙基淀粉或其混合物。
[0138]
如上所述,在优选实施方式中,粘合层23与信号采集层22是一个层。
[0139]
在一个实施方式中,基底层21包括一种选自以下材料中的一种材料:聚对苯二甲酸乙二醇酯(pet)、聚萘二甲酸乙二醇脂(pen)、聚醚醚酮(peek)、聚碳酸酯(pc)、聚醚砜(pes)、极性丙烯酸酯(par)、多环烯烃(pco)或聚降冰片烯(pnb)、聚酰亚胺(pi)、含氟聚酯。
[0140]
探头的示例制造过程
[0141]
本发明的探头1可以通过诸如丝网印刷技术之类的印刷过程在柔性基底层上制造。
[0142]
当通过该技术进行印刷时,载体是溶解在溶剂中的聚合物,其中,溶剂在通过合适的筛网并将载体沉淀在基板、例如基底层21上之后蒸发,从而留下包括探头1的层的硬化膏体。
[0143]
在优选实施方式中,用于印刷的筛网是密度为77t至90t的聚酯筛网,通过该筛网
应用用于印刷的油墨,其中,筛网与基板之间的间隙优选地为约700μm,刮板的压力为约10n至50n,刮板的行进速度优选地为600mm/分钟,并且刮板斜度为45度。
[0144]
在通过丝网印刷技术制备形成探头1的层的膏体时,为了使层具有足够的品质,重要的是,膏体具有高粘度,以防止膏体在筛网上扩散,并允许印刷精确图案,这对于形成精确尺寸的探头是必要的,同时对主动剪切力敏感,其影响将降低膏体的粘度。换言之,随着剪切速率的增加,膏体的粘度显著降低,这种效应称为剪切变稀。在膏体通过筛网后,膏体沉淀在基底层上,剪切速率恢复至较低值。在丝网印刷过程的这个阶段,膏体的粘度迅速增加,并防止新印刷图案的扩散,并且在印刷之后的最初几毫秒期间,由于将丝网映射到新印刷层上而形成的任何不均匀都会变平。优选的是,膏体表现出足够的触变性(液体的记忆性),并且膏体中粘度增加的过程不是立即的。用于通过厚层技术来制造层的膏体应当在约10s-1的剪切速率下具有约50pa s至70pa s的粘度,并且粘度曲线的斜率应当在约-0.50至-0.65之间的范围内。
[0145]
相对于可变剪切速率,对形成探头1的上述组合物的复合材料进行粘度测量,并且在20℃的恒定温度下测定流动曲线。在整个剪切速率范围内,低粘度的、包含小于按重量计3%的石墨烯的膏体没有表现出剪切变稀的特性。仅在石墨烯含量较高的膏体中,发现粘度明显增加——石墨烯浓度高于按重量计10%的膏体显示出非常高的粘度,大大超过丝网印刷技术中所使用的膏体的可接受值。复合材料的粘度过高会阻碍膏体的应用,并导致所代表层的印刷较弱。因此,在最优选实施方式中,将“石墨烯tpu”层中的石墨烯含量设定为按重量计10%,其中,在溶剂蒸发之前,载体由按重量计10%至15%的热塑性聚氨酯弹性体(tpu)溶于占载体的85%至90%的二甲基甲酰胺(dmf)中而构成,在蒸发之后,热塑性聚氨酯弹性体占层的80%,而二甲基甲酰胺完全蒸发。
[0146]
在“石墨烯pmma”层中,由于与聚合物成比例的较大溶剂量,因此可以使用更多的石墨烯。在最优选实施方式中,将“石墨烯pmma”层中的石墨烯含量设定为按重量计13%,其中,在溶剂蒸发之前,载体由按重量计8%至10%的聚(甲基丙烯酸甲酯)(pmma)溶于占载体的按重量计90%至92%的丁基卡必醇乙酸酯(okb)中而构成,在蒸发之后,聚(甲基丙烯酸甲酯)占层的87%,而丁基卡必醇乙酸酯完全蒸发。
[0147]
为了确保各个层的适当特性,必须为印刷输出选择适当的硬化参数。
[0148]
在连接层32和信号采集层22的情况下,溶剂油墨适于印刷,因此溶剂的蒸发在热室干燥器中进行。最佳硬化期和温度为120℃,持续30分钟,所述参数防止套印劣化。
[0149]
在介电层33的情况下,最实用的印刷油墨是感光油墨,因此套印的硬化在uv干燥器中进行。在uv干燥器的情况下,选择合适的传送带前进速度和灯功率。传送带的最佳前进速度为50mm/分钟,并且灯功率为100w。
[0150]
探头的固定和信号的传输
[0151]
在手术过程中,通过将测量元件2的信号采集层22应用于心脏表面,将探头1固定至心脏。由于信号采集层22/粘合层23的组合物或者单独的粘合层23提供的粘合性能、以及探头1的亮度,探头1通过粘合而容易地粘附组织心脏,从而不会对器官表面造成损坏并且提供无创测量。
[0152]
由测量元件2的信号采集层22采集的信号通过连接元件3的导电层32传输至连接片段4,其中,探头1的测量元件2仅通过信号采集层21从心脏获取信号,而从另一侧通过基
底层21与手术场隔离。连接元件3通过一侧的基底层21和另一侧的介电层33与心脏和手术场完全隔离。从心脏表面采集的ecg信号由连接层32传输至从连接元件3延伸并适于与信号线缆5连接的连接片段4,信号线缆5适于与作为测量系统6的一部分的心脏监测仪连接。
[0153]
根据本发明的探头1适于通过所述专用信号线缆5与手术室中使用的任何心脏监测仪一起使用。探头1的端部连接至信号线缆5,在执行手术的标准技术中,信号线缆5通过连接片段4固定至ecg皮肤电极。
[0154]
相对于探头1的测量元件2,布置在另一端的连接片段4构成平台,标准信号线缆5可以附接至该平台,例如使用所谓的弹簧夹、即本领域已知的一种夹附接至该平台,而不会冲破和损坏连接片段4。连接片段4在垂直于其厚度的平面中优选地具有矩形形状,例如,基底层21的尺寸为7mm
×
22mm,并且连接层32的尺寸为5mm
×
20mm,或者连接片段4具有足以使上述标准夹附接至连接片段4以在夹与探头1的连接元件3的导电层32之间建立连接的任何其他任意形状和尺寸。如前所述,连接片段4由基底层21仅从一侧隔离,因此可以在信号线缆5与连接元件3的导电层32之间建立这种电气连接。
[0155]
这样的连接保证了从心脏表面直接采集的信号的读取和解译的可能性,就像从皮肤读取的标准测量值一样。以此方式,本发明的探头1将从皮肤表面进行ecg监测重新定位为从心脏表面进行监测。通过连接片段4将探头与心脏监测仪连接的方法保证了使用的通用性,并且不需要设置额外的测量系统6,即,电子电路和软件。此外,将本发明的探头1与心脏监测仪连接的这种方法保证了以医务人员7a、7b、7c已知的标准方式在心脏监测仪上显示ecg曲线,并且既不需要单独的监测仪,也不需要使用其他医疗设备8。此外,绘制包括st段移位的心电图曲线的心脏监测仪软件可以以不变的方式操作,并以与分析从皮肤表面传输的信号相同的方式执行st段分析。
[0156]
探头1具有电信号电阻,该电信号电阻调整成使从心脏表面采集的信号对于标准心脏监测仪是完全可读的。
[0157]
因此,探头1适用于根据临床实践中使用的监测标准通过利用带有标准软件的心脏监测仪所执行的ecg监测,标准软件允许自动调整所谓的ecg大小(或呈现曲线的大小),同时在显示器上呈现所获取的信号,并分析心脏缺血(ecg记录中的所谓的st段分析)。
[0158]
由于连接元件3足够长,因此将信号线缆5附接至探头1,以防止信号线缆5出现在手术场中(开放的胸腔——围心腔)。将信号线缆5在手术场的有重力作用的区域中附接至探头1可能导致仅由信号线缆重量5引起的探头1过度拉紧以及探头1从心脏表面脱离,或者可能带来线缆落入围心腔内部,这也可能导致患者受伤、将探头撕下或弄湿线缆。因此,探头1的连接元件3具有这样的长度,使得探头1的具有连接片段4的端部离开手术区域,并且仅在操作区域之外,自由放置的信号线缆5附接至连接片段4。优选地,长度大于10cm,更优选地,长度为约17cm。这允许将连接片段4引出患者开胸区域外部,并由此将从心脏表面采集的电信号输出到手术场外,而不管心脏位置和探头1的测量元件2的附接位置如何。
[0159]
信号采集层22和粘合层23的粘合特性允许在不损失其粘合特性的情况下通过将测量元件2脱离并重新应用于心脏表面来重复地改变探头在心脏表面上的位置和定位。
[0160]
探头1的层的导电特性和粘合特性两者在测试期间得到确认,其结果如下所示。
[0161]
应当认识到,探头1的上述制造过程仅出于说明而呈现,而不限制根据本发明的制造探头的过程。探头1可以通过将提供所呈现结构的探头1的任何等效过程来制造。
[0162]
在另一个实施方式中,从测量元件2传输信号的连接元件3可以由任何不同的材料制成,包括能够传输ecg信号且与手术区域隔离的非柔性材料。
[0163]
本文本中出现的诸如“圆形”、“矩形”、“椭圆形”等之类的所有术语仅作为示例给出,而不限制探头1的元件的形状及其构型。
[0164]
探头1的所有实施方式还涉及包括如上面的描述中所述的探头1的用于心外膜ecg监测的测量系统6。
[0165]
根据本发明的实施方式,系统6包括将探头1与显示装置、例如心脏监测仪连接的信号线缆5。
[0166]
关于模拟条件下的传输信号质量的探头测试
[0167]
对探头1的实施方式的不同变型进行测试,以确定在各种条件下传导采集信号的稳定性和质量,从而选择用于本发明的探头1的最佳连接层32。
[0168]
测试结果如下所示。
[0169]
为了以下各项,进行了关于传导性的测试:
[0170]
a)评估探头1的测量元件在刺激器电极上的位置变化时的传导稳定性,
[0171]
b)在探头1重复变形时保持探头1传导的能力,
[0172]
c)获得具有允许心脏监测仪处理信号的电压的信号(无过大传导阻力的标准),
[0173]
d)获得稳定信号(无噪声的标准,这会妨碍在心脏监测仪上获得连续的ecg记录)。
[0174]
实验
[0175]
电生理模拟器被编程为以每分钟80次的频率产生具有生理窦性心律特征的电信号。用于皮肤读出的标准ecg电极连接至带有信号输出电极的板。然后,电极中的一个电极替换为根据本发明的探头1的原型。原型然后在信号输出电极上旋转(移动),手动挤压并再次应用。
[0176]
以这种方式检查了图4所示的根据本发明的实施方式的探头1的若干变型,其中,信号采集层22和导电层32是石墨烯层或石墨烯pmma层,其组合物如下所示,其中,石墨烯是来自以下材料中的一种材料:
[0177]-来自cheap tube的石墨烯片,平均直径为25μm,并且厚度为10nm;
[0178]-来自xg science(美国)的m系列和h系列石墨烯片,厚度分别为2nm至8nm和15nm,并且平均直径为5μm至25μm;
[0179]-来自cheap tube的石墨烯片,平均直径超过2μm,并且厚度在8nm与15nm之间。
[0180]
电气测试表明,包含来自cheap tube的片的层表现出最佳电气参数,但替代品可以是层表面同样高度发达、或层表面粗糙度高并且电气参数仅略低的来自xg science的m-25系列片。
[0181]
结果
[0182]
根据本发明的探头1的所有测试原型均显示出在生理窦性心律模式下传导由模拟器生成的心电图信号的能力。无论使用哪种探头1,心电图监测仪都能正确显示信号。信号曲线由模拟器内置的心脏监测仪的系统(软件)自动正确校准。
[0183]
在所有测试模型中,由根据本发明的探头1传输的心电图信号最好,其中,信号采集层22是包含在基质中的浓度为按重量计12.5%至13%的来自cheaptube的石墨烯片的层,其中,含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)占载体的按重量计8%。
[0184]
此外,还发现:
[0185]
a)转动根据本发明的探头1在覆盖1至3个ecg演变的显示器中引起轻微干扰,并在停止运动之后稳定(金属模拟器电极与探头1摩擦)。由于在测试期间未使用心电图凝胶或其他传导增强剂,因此在跳动心脏的表面上可能根本不会出现干扰,或者干扰可完全忽略不计。
[0186]
b)在任何实验中,重复挤压探头1不会影响信号的传导能力。
[0187]
c)在探头1在固定位置操作的几分钟内,没有发现产生噪音或其他干扰。探头1正常操作,并显示诊断ecg记录。
[0188]
针对在使用不同粘合促进剂的情况下的粘合力的探头测试
[0189]
对根据本发明的探头1的不同变体进行测试,以确定探头1在探头1的位置改变时留在组织表面上的能力、从组织上撕下探头1所需的力、以及探头1对组织的宏观影响(断开连续性),从而应用和撕下探头1。通过手动和测力计对力进行评估,测力计的工作范围为0g至3g以及0g至30g。
[0190]
体外测试使用了反映心肌结构的鸡肉(室温下用水润湿的鸡胸)。
[0191]
研究了图4所示的探头1的实施方式的12个变型。
[0192]
模型a是图4所示的探头1的实施方式,其中,信号收集层22/粘合层23是石墨烯层,其中,石墨烯层的组合物在测试的模型变型之间不同。
[0193]
模型b是图4所示的探头1的实施方式,其中,信号收集层22/粘合层23是石墨烯tpu层,并且导电层32是石墨烯pmma层。
[0194]
测试了给定实施方式中的根据本发明的其中测量元件2的直径为20mm的探头1的模型a的11个原型以及各自之间在构成信号收集层22的石墨烯层的组合物上各不相同的原型、以及其中测量元件2的直径为20mm的探头1的模型b的一个原型。测试组合物如下所示:
[0195]
模型a:
[0196]
1.添加了按重量计1%的羊毛脂的聚(甲基丙烯酸甲酯)的膏体(按重量计1%的羊毛脂+按重量计13%的gnp(石墨烯)+按重量计86%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体);
[0197]
2.添加了按重量计2%的羊毛脂的聚(甲基丙烯酸甲酯)的膏体(按重量计2%的羊毛脂+按重量计13%的gnp(石墨烯)+按重量计85%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体),
[0198]
3.添加了按重量计5%的羊毛脂的聚(甲基丙烯酸甲酯)的膏体(按重量计5%的羊毛脂+按重量计13%的gnp(石墨烯)+按重量计82%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体),
[0199]
4.添加了按重量计1%的琼脂的聚(甲基丙烯酸甲酯)的膏体(按重量计1%的琼脂+按重量计13%的gnp(石墨烯)+按重量计86%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体),
[0200]
5.添加了按重量计2%的琼脂的聚(甲基丙烯酸甲酯)的膏体(按重量计2%的琼脂+按重量计13%的gnp(石墨烯)+按重量计85%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体),
[0201]
6.添加了按重量计5%的琼脂的聚(甲基丙烯酸甲酯)的膏体(按重量计5%的琼脂
+按重量计13%的gnp(石墨烯)+按重量计82%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体),
[0202]
7.添加了按重量计5%的琼脂的聚(甲基丙烯酸甲酯)的膏体(按重量计5%的琼脂+按重量计13%的gnp(石墨烯)+按重量计82%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体+2g温水),
[0203]
8.添加了按重量计1%的海藻酸钠的聚(甲基丙烯酸甲酯)的膏体(按重量计1%的海藻酸钠+按重量计13%的gnp(石墨烯)+按重量计86%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体),
[0204]
9.添加了按重量计2%的海藻酸钠的聚(甲基丙烯酸甲酯)的膏体(按重量计2%的海藻酸钠+按重量计13%的gnp(石墨烯)+按重量计85%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体),
[0205]
10.添加了按重量计5%的海藻酸钠的聚(甲基丙烯酸甲酯)的膏体(按重量计5%的海藻酸钠+按重量计13%的gnp(石墨烯)+按重量计82%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体),
[0206]
11.添加了按重量计5%的海藻酸钠的聚(甲基丙烯酸甲酯)的膏体(按重量计5%的海藻酸钠+按重量计13%的gnp(石墨烯)+按重量计82%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体+2g温水)。
[0207]
模型b:
[0208]
12.热塑性聚氨酯弹性体(tpu)的膏体,具有按重量计10%的gnp(石墨烯)+按重量计10%的lycoat rs720淀粉(羟丙基淀粉)+按重量计80%的含于二甲基甲酰胺(dmf)中的热塑性聚氨酯弹性体载体
[0209]
结果
[0210]
在评估探头1与组织的粘合性时,在将探头1应用于探头1的每个原型的组织表面之后,发现探头1粘合于组织。当组织相对于基板的位置改变90度并且不使用额外的牵引力时,探头1的所有原型都留在组织表面上。
[0211]
在手动评估粘合力时,当以接近心脏表面上的手术操纵的力撕下探头1时,发现使用羊毛脂的探头最容易折断,而不管羊毛脂含量是多少,但脱离进行得过于容易。使用琼脂和海藻酸钠制成的探头在主观上保持更强,其中,使用包含按重量计5%的海藻酸钠的膏体制成的探头1具有几乎理想的——预期的——粘合性和对手动牵拉的抵抗力。另一方面,包含按重量计10%的石墨烯和按重量计10%的lycoat rs720淀粉(12号样品)的探头1的模型b具有最佳粘合性,因此它是本发明的最优选实施方案。
[0212]
在对粘合力进行测力计评估后,尝试对探头进行进一步的撕下测试,获得的值如下所示。
[0213]
[0214][0215][0216]
表1.根据模型a和模型b对探头1进行的撕下测试的动力学结果。
[0217]
在评估应用和撕下探头1对组织的宏观影响时,发现在每个原型的情况下,均未发
现使用根据本发明探头1所造成的宏观组织损伤。在撕下力测试中,探头1的原型全都没有解体,信号采集层22保持其连续性。
[0218]
由于所进行的测试,可以确认,随着粘合添加剂重量百分比的增加,在整个测量区域中对肌肉组织的粘合力增加,并且即使作用粘合力的最大值也不会损坏应用了根据本发明的探头1的组织。在测试期间还发现,lycoat淀粉(羟丙基淀粉)的粘合性能最好,其是测试样品中最高效的粘合促进剂。
[0219]
关于在重复应用于组织时探头粘合性能耐久性的测试
[0220]
还测验了根据本发明的探头1的变型在随后应用于组织期间的粘合性能耐久性。
[0221]
在体外测试中,使用了反映心肌结构的鸡肉(室温下用水润湿的鸡胸)。
[0222]
探头1的测试变型中的一种变型是图4的探头的模型c,其中,导电层32是包含含于生物相容性基质中的银微片的层,基底层21是pet膜,并且信号采集层22/粘合层23是具有添加了按重量计10%的海藻酸钠的聚(甲基丙烯酸甲酯)的膏体组合物(按重量计10%的海藻酸钠+按重量计13%的gnp(石墨烯)+按重量计77%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体)的石墨烯层,其中,测量元件2的直径为20mm。
[0223]
探头1的另一个测试变型是探头1的最优选实施方案或者也如图4所示的探头的模型b,其中,导电层32是含有平均直径大于2μm且厚度在8nm与15nm之间的范围内的来自cheap tube的石墨烯片的、带有具有按重量计13%的gnp(石墨烯)+按重量计87%的含于丁基卡必醇乙酸酯中的聚(甲基丙烯酸甲酯)载体的聚(甲基丙烯酸甲酯)(pmma)的膏体组合物的“石墨烯pmma”层,基底层21为pet膜,并且也构成粘合层23的信号采集层22为具有添加了按重量计10%的石墨烯并且添加了按重量计10%的lycoat rs720淀粉(羟丙基淀粉)的热塑性聚氨酯弹性体(tpu)的膏体组合物的“石墨烯tpu”层,其中,测量元件2的直径为20mm。
[0224]
在测试时,将探头1以横向位置施加于组织表面——探头1的表面相对于基底垂直地布置并且相对于牵引力矢量平行地布置。该位置最佳地对应于在冠状动脉旁路移植过程中将探头1应用于心脏的外侧壁或底部壁的手术情况。通过使用测力计,评估探头1从组织表面撕下的力。接下来,将探头1在相同位置中再次应用于组织,并再次进行牵引。在实验中,使用了非常相同的探头1。作为对照测量,将缺少粘合层23但直径相同的探头1在组织一侧进行5次应用。以此方式,评估了仅由包含用于测量元件2和连接元件3的基板的基底层21和连接片段4产生的粘合力。
[0225]
基于上述先前测试的结果,确定等于或小于5g的粘合力是探头1预期保持在跳动心脏的表面上的阈值,在该值下,以最小的操纵将探头1从组织上撕下,并且在临床实践中没有使用该值。
[0226]
因此,假设达到5g值时,测试将停止,并且获得达到该值的时间的多次应用将表示相对于在一个探头1的最大应用次数的范围内的连续应用的探头1的强度。
[0227]
进行了三十次应用于组织表面。该次数超过了在一次冠状动脉旁路移植手术期间计划应用于心脏表面的次数的许多倍。在手术设置中,探头1对心脏的平均计划应用次数等于5次应用。
[0228]
结果
[0229]
在探头1的模型c的情况下,在前三次测量中,观察到粘合力从多于30g减少至25g。
然后,观察到在第9次应用时,粘合力进一步降低至初始值的约50%的趋势。然后,粘合力稳定在初始粘合力的约60%,直到第15次测量。在随后的应用中,发现24次应用时的粘合力降低至7克的最低水平。在随后的应用中,粘合力较高,并且在初始值的约50%振荡。在最后一次计划应用(第30次)中,获得的值为20g。根据协议,在30次应用之后完成探头的测试。在实验期间,探头1的粘合力没有一次下降到低于阈值5g。
[0230]
在其中将探头1与基底层21一起应用于心脏的对照研究中,在4次应用中的3次中,记录了低于阈值的粘合力。
[0231]
在探头1的模型b的情况下,在前3次测量中,粘合力值保持不变并在约25g振荡(精确结果见表3)。随后发现粘合力有降低的趋势,但观察到其下降速度比探头1的模型c慢——在探头1的模型b的情况下,粘合力保持在初始粘合力的50%以上,直到最后一次应用,并且仅在第20次应用时,粘合力下降到初始粘合力值的60%。此外,在整个假定的测试时间内且在所有心脏壁处,探头1的模型b稳定地保持在心脏表面上,并且探头1的测量元件2的边缘没有从心脏表面脱离。
[0232]
下面给出了在在针对使用信号采集层22应用于心脏的探头1的模型c以及使用信号采集层数22应用于心脏的探头1的模型b进行测试期间获得的值:
[0233]
[0234][0235]
表2.针对探头1的模型c对探头进行的撕下测试的动力学结果。
[0236]
[0237][0238]
表3.针对探头1的模型b对探头进行的撕下测试的动力学结果。
[0239]
在测试期间,发现根据本发明的探头1在30次应用于组织的序列中保持了预期的粘合力水平,而不管测试模型如何,其中,对于探头1的模型c,在第4至第5次应用之后,探头1的粘合力损失至初始值的约50%至60%的水平,但是,这些值仍然超过保持探头1所需的最小值,而探头1的模型b保持初始值50%以上的粘合力直至第30次应用,但在第4次至第5次应用时,观察到粘合力仅降低了初始值的20%,即,达到初始值的80%。此外,发现在随后的30次应用期间,在探头的实施方案的两种模型中,探头1的粘合力值也没有超过最低要求值,因此探头1没有失去其功能。此外,当将利用信号采集层22将探头1应用于组织的测试结果与利用基底层21将探头1应用于组织的测试结果进行比较时,观察到模型c的利用信号采集层22将探头1应用于组织的粘附值比利用基底层21将探头1应用于组织的粘附值高3至6倍。
[0240]
探头消毒之后的粘合耐久性的测试
[0241]
作为根据本发明的探头1的最优选实施方式,探头1的模型b用伽玛射线照射,以评估与之前给出的探头1在照射之前的粘合能力的结果相比探头1在照射之后的粘合能力的保持情况,结果如下表所示。
[0242][0243]
表4.针对探头的模型b对探头进行的撕下测试的动力学结果。
[0244]
测试结果明确表明,伽马辐射不会使根据本发明的探头1的模型b的粘合性能劣化。消毒之后,该模型在整个假设期内且在每个心脏壁上都稳定地留在心脏表面。没有注意到改变位置后模型的粘合能力的损失,也没有注意到探头1的模型b的灵活性的损失,并且这允许对根据本发明的探头进行适当消毒,以使探头适合医疗用途。此外,由于具有最佳粘合性能,它是根据本发明的探头1的优选实施方式。然而,应当理解,探头的最优选实施方式被称为强调变型的粘合性能,而并不排除使用探头的上述其他变型。
[0245]
在执行辐射之后,在相同条件下还进行了探头的粘合性能测试的一部分、信号传导测试和心脏监测仪上信号记录的呈现(检查探头1与心脏监测仪的配合)。之前用伽玛射线以用于医疗物品消毒的剂量照射的探头1的模型b从心脏表面正确传导电信号,在各个心脏壁处的测量元件2的不同后续位置之间的传导信号中没有发现差异,并且探头的传导能力不随时间或位置的改变而改变。此外,在辐射之后,探头1的模型b与心脏监测仪正确配合,其中,利用自动调整模式设定而呈现在监测仪上的信号被正确调整,而没有超出范围,因此它保持了ecg记录的诊断用途、评估心脏缺血所需的诊断特性。
[0246]
探头的生物相容性
[0247]
基于上述测试,被认为是根据本发明的探头1的实施方式的最优选变型的根据本发明的探头1的模型b还经历生物相容性测试,即,根据iso en iso10993-5和en iso 10993-10:2015标准执行的细胞毒性测试和刺激性测试。
[0248]
上述测试的所有结果表明,根据本发明的探头1的模型b安全地用于心脏表面,同时稳定地保持在其表面处,并证实了检测心脏缺血的可能性。
[0249]
其所有实施方式和变型仅作为关于本发明的非限制性指示给出,并且不会以任何方式限制由专利权利要求所限定的保护范围。应该理解,在根据本发明的探头中使用的任何技术方案可以通过等效技术来实现,而不超过所述保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1