用于治疗由传染性病原体引起的阴道或宫颈病症的云芝提取物的制作方法
用于治疗由传染性病原体引起的阴道或宫颈病症的云芝提取物
1.本技术要求于2020年4月28日提交的国际专利申请pct/cn2020/087445的权益。
技术领域
2.本发明涉及阴道或宫颈病症(阴道或宫颈疾病,vaginal or cervical disorder)领域,特别是由传染性病原体(传染剂,infectious agent)引起的妇科病症。本发明提供了用于预防和/或治疗此类病症的含有来自云芝(coriolus versicolor)的提取物的组合物及其施用方案。
背景技术:
3.妇科感染在所有年龄的女性中都是常见的。典型的妇科感染包括细菌性外阴阴道炎、阴道酵母菌感染、滴虫病、非特异性外阴阴道炎和病毒感染。病毒感染是其中最难治疗的。特别是,可能导致宫颈癌的人乳头瘤病毒(hpv)感染越来越受到关注,特别是在性活跃的女性中。
4.由hpv感染引起的宫颈癌已成为一些发达国家15-44岁女性中第2位最常见的女性癌症。超过30到40种类型的hpv通常通过性接触传播并且感染肛门阴道或宫颈区域。然而,大多数hpv类型不引起疾病。“高风险”hpv类型的持续感染可能发展为癌前病变和浸润性癌症。
5.hpv16型和18型共同导致全部宫颈癌中的约70%。然而,值得注意的是,绝大多数高危hpv感染被宿主免疫系统清除,并且在一年内退行为亚临床且在两年内退行90%。然而,少数受试者(5%至10%的受感染女性)无法控制病毒感染并且发展为hpv持续感染。如上所述,这种持续性感染有发展为外阴和子宫颈的癌前病变的风险,癌前病变可发展为浸润性癌症。
6.hpv病变被认为是由受感染的基底角质形成细胞的增殖引起。当宿主的基底细胞暴露于穿过紊乱的上皮屏障的传染性病毒时,通常发生感染,如在性交期间或轻微皮肤擦伤后将会发生的。hpv病毒粒子侵入细胞后,发生活动性感染,并且病毒可以被传播。在鳞状上皮内病变(sil)发展并且可在临床上检测到之前,可能需要数月至数年。紊乱的上皮屏障导致的持续感染有利于宫颈癌的发生。宫颈癌演变的综合方案如图1所示。
7.从亚临床感染到临床感染的进展可能需要数年,这为检测和治疗癌前病变提供了机会。如果早期检测到亚临床hpv感染并且进行定期检查,则可以预防进展为浸润性癌症。为此,使用帕帕尼科拉乌试验(pap)测试或基于液体的细胞学进行宫颈筛查,来检测可能发展成癌症的异常细胞。如果发现异常细胞,请女性进行阴道镜检查。在阴道镜检查期间,可以进行活组织检查并且通过简单的程序去除异常区域,通常使用烧灼环或者在发展中国家更常见的是通过冷冻(冷冻疗法)。以这种方式治疗异常细胞可以防止它们发展成宫颈癌。pap涂片检查已经降低了发达国家宫颈癌的发病率和死亡率,但即使如此,这些国家的宫颈癌发病率也没有下降。此外,在资源贫乏地区,大多数妇女通常无法进行pap筛查,在这些地
区子宫颈癌的死亡率也很高。
8.还应考虑到pap试验的结果通常不是结论性的,并且在这种情况下不建议进行外科干预,因为这意味着相关风险和增加的成本。当检测到cin1型——表明轻度宫颈上皮内瘤变——异常细胞时,非结论性pap试验发生。通常,当活组织检查检测到cin1时,该女性感染了hpv,这种感染可能在12-24个月内自行清除,因此随后需要进行后续检测而不是治疗。处于这种情况下的女性无法知道将发生什么并且可能不遵循经常导致心理压力和焦虑的预防或治疗策略。仅当后续分析显示恶性发展时(通常首先检测到2型宫颈上皮内瘤变cin2时),才开始治疗或外科策略。
9.预防hpv类型(16和18)感染的hpv疫苗(cervarix和gardasil)可进一步降低宫颈癌的发病率。然而,尽管这些预防性疫苗涵盖了两种最常见的高危hpv类型,但尚未涵盖导致其余30%的宫颈癌病例的其他高危病毒。此外,由于hpv是最常见的性传播疾病,大量个体已经被感染,因此无法从这种预防性疫苗接种中获益。
10.总之,目前需要提供替代策略来抗击hpv感染和宫颈癌,特别是是在hpv感染的早期阶段。
技术实现要素:
11.本发明人已经开发了抗击hpv和其他妇科感染的策略。本策略涉及通过阴道或宫颈施用包含云芝提取物的组合物来增强阴道或宫颈系统,特别是阴道和宫颈的局部免疫力。
12.云芝的提取物含有两种β-葡聚糖、多糖k(psk)和多糖肽(云芝糖肽,polysaccharide-peptide)(psp),它们已被描述为有效的免疫增强剂(kang sc等人,int j biol macromol.2013,vol.57,p.9-16;cui j,等人,biotechnol adv.2003,vol.21(2),p.109-22.)。
13.含有所述提取物的口服制剂在本领域中是已知的并且特别是在日本已经被用作癌症和各种传染病的化学疗法和放射疗法的辅助佐剂。然而,云芝提取物以前从未用于由传染性病原体引起的阴道或宫颈病症包括hpv感染和宫颈癌的局部治疗。发明人目前已经发现,包含云芝提取物的本发明的组合物在直接施用于阴道和/或子宫颈时,在对抗阴道或宫颈感染如阴道炎和hpv感染方面特别有效,并且已经进一步发现了包含云芝提取物的组合物的方便施用方案以提供最佳结果。
14.因此,本发明的一个方面提供了包含云芝提取物的组合物,用于通过阴道或宫颈施用预防和/或治疗由传染性病原体引起的阴道或宫颈病症。这可以改写为云芝提取物在制备用于预防和/或治疗的组合物中的应用,用于通过阴道或宫颈施用预防和/或治疗由传染性病原体引起的阴道或宫颈病症。本发明还考虑用于预防和/或治疗有需要的雌性动物(包括人)中由传染性病原体引起的阴道或宫颈病症的方法,该治疗包括经阴道或经宫颈施用包含云芝的组合物。术语“传染性病原体”被理解为广义上的微生物,如在其宿主中引起疾病的病毒、细菌、朊病毒、真菌或原生动物。在本发明中,术语“传染性病原体”和“病原体”的使用没有区别。在本发明意义上的传染性病原体通常选自人乳头瘤病毒(hpv)、白色念珠菌(candida albicans)、沙眼衣原体(chlamydia trachomatis)、阴道加德菌(gardnerella vaginalis)、动弯杆菌属(mobiluncus)、拟杆菌属(bacteroides)、支原体属(mycoplasma)、
淋病奈瑟菌(neisseria gonorrhoeae)、阴道毛滴虫(trichomonas vaginalis)、疱疹病毒(herpes virus)、金黄色葡萄球菌(staphylococcus aureus)、表皮葡萄球菌(staphylococcus epidermis)、大肠埃希氏菌(escherichia coli)、阿尔法链球菌(streptococus alfa)、芽孢杆菌属(bacillus)、肠杆菌属(enterobacter)、变形菌(proteus)、阴沟肠杆菌(enterobacter cloacae)、克雷白菌属(klebsiella)、表皮葡萄球菌(s.epidermidis)、肺炎克雷白杆菌(klebsiella pneumoniae)和皮肤真菌(dermatophytes)。
15.目前对抗hpv和其他阴道或宫颈感染的策略提供了一些优势。首先,通过将云芝的活性成分(特别是psk和psp)直接施用于作用部位,实现局部免疫增强。由于阴道或宫颈系统,主要是阴道和宫颈,对传染病非常敏感,因此在这种特殊环境中增强免疫力非常有益。局部增强阴道或宫颈免疫力有助于身体抵抗各种阴道或宫颈感染,从非特异性阴道炎和念珠菌病到hpv感染。因为可以更容易地调整组合物中的活性成分以实现期望的效果,同时可以实现最佳剂量应答,所以可以最小化次要副作用。进一步,通过阴道/宫颈途径施用使得施加容易并且规避了保护活性化合物免受恶劣环境如胃肠道的影响的需要。
16.发明人进一步已经发现了用于治疗上述阴道或宫颈病症例如宫颈癌的最合适的施用方案。当根据以下方案经阴道或经宫颈向女性人类施用组合物时,根据本发明的阴道或宫颈病症的预防和/或治疗是最好的:
17.(a)21-24天期间每天一剂量组合物,随后
18.(b)在3到7天期间无剂量,随后
19.(c)在21-24天期间每天或每两天一剂量组合物,随后
20.(d)在3到7天期间无剂量,并且
21.(e)依次重复(c)和(d)四次,
22.其中每剂量包含0.5至5mg云芝提取物。
23.如以下实例所示,临床试验已证明了根据该施用方案使用本发明的组合物治疗由hpv引起的低度宫颈病变以及清除hpv感染的有效性。除了有效之外,本发明的不连续治疗方案具有不施用剂量的时间段,还提高了患者对治疗的顺从性,从而导致增加的患者依从性和治疗效果。
24.将如下文所述,可优选将其他成分包括其他活性成分以及作为载体的赋形剂添加到组合物。
附图说明
25.图1.宫颈癌的致癌方案。n代表正常的、未感染的上皮细胞。女性感染了hpv并且发展为低度鳞状上皮内病变(lsil)。在感染的头几个月期间,上皮细胞中可能没有发现变化。最终,可能会观察到1级宫颈上皮内瘤变(cin1)。12至24个月后,患者可能发展为高度鳞状上皮内病变(hsil)。首先,可能观察到2级宫颈上皮内瘤变(cin2)。多年来,该病变可能演变为3级宫颈上皮内瘤变(cin3),并且最终演变为浸润性癌(c)。百分比表示hpv感染将达到这些阶段的患者的估计数量。标有“t”的箭头代表时间增加。标有“1”的箭头表示预防和筛查策略开始的阶段。标有“2”的箭头表示受影响患者开始治疗的阶段。
26.图2.阴道施用对照、gel 1(0.05%云芝提取物)或gel 2(0.25%云芝提取物)后,
rt-qpcr确定的小鼠阴道上皮细胞中细胞因子表达。a:tnfα,b:il-1β,c:il-12,d:il-6,e:il-17。1:对照,2:gel 1,10天期间,3:gel 2,6天期间,4:gel 2,10天期间。y轴表示相对于基线的细胞因子倍数增加。
27.图3.用papilocare gel治疗12天前后上皮形成(epithelization)参数的变化。
28.图4.3名患者在papilocare gel施加之前(a列)和papilocare gel施加12天之后(b列)的阴道镜检查照片。
29.图5.通过pap涂片结果和一致的阴道镜检查图像所测量的高危hvp人群中用papilocare gel治疗的功效。
30.图6.用papilocare gel治疗后高危hvp人群中的hpv清除率。
31.图7.papilocare gel治疗期间患者宫颈再上皮形成的图像。
32.图8.用papilocare gel治疗后根据李克特(likert)量表的上皮形成的程度。
33.图9.用papilocare gel治疗期间患者报告的压力水平。
具体实施方式
34.在本技术中,术语“提取物”以常规意义使用,是指通过用合适的方法从来源(通常是植物来源)中去除活性成分而获得的化合物的浓缩制剂。所述提取物含有一种或多种活性成分并且可以多种形式——包括纯或半纯组分、固体或液体提取物或固体植物物质——掺入药物或化妆品组合物中。
35.通常植物提取物不仅含有一种成分,而且包含多种成分,其中许多是活性的。有时,有益效果来源于许多这些活性化合物的组合。在其他情况下,有一个特定的化合物主要负责大部分活动。
36.如本文所用的提取物还包括“合成”提取物,即被组合以基本上模拟天然来源的植物提取物的组成和/或活性的已知组分和/或成分的各种组合。合成提取物将具有两种或更多、三种或更多、或四种或更多与天然来源的活性成分相同的活性成分。富含一种或几种成分的天然或合成提取物也被认为是本发明的一部分。
37.云芝(下文简称云芝(c.versicolor),也称为变色栓菌(trametes versicolor))是常见的多孔菌,属于担子菌亚门(basidiomycotina),在世界各地均有发现。云芝的可见形式是扇形蘑菇,具有波浪形边缘和彩色同心区。云芝是专性需氧微生物,全年常见于死木、树桩、树干和树枝上。
[0038]“云芝提取物”理解为,如前文所定义的,从云芝获得的化合物的浓缩制剂。云芝提取物中的主要活性化合物是β-葡聚糖云芝糖肽(多糖肽,polysaccharopeptide)krestin(psk)和云芝糖肽(psp)。这两种化合物都是从云芝菌丝体的提取物中获得的。
[0039]
如本文所用,“云芝提取物”通常是指含有从云芝中分离的生物活性化学成分和/或化合物的制剂,优选云芝糖肽krestin(psk)和/或云芝糖肽(psp)。这包括云芝全提取物,但也包括从云芝获得的上述生物活性化合物的纯或半纯制剂。
[0040]
含有生物活性化合物的云芝提取物和含有纯化化合物的制剂可商购,例如通过symrise公司。大多数云芝糖肽的商业制剂仅使用从伞菌或深层培养菌丝体中回收的细胞内聚合物。云芝提取物的典型组成和提取方法描述于cui j等人,同上)。
[0041]
psp和psk是与许多蛋白质相连的化学相似的β-葡聚糖多糖(kf cheng,等人.,
cancer therapy 2008,vol.6,p.117-130)并且它们具有相似的生理活性特征。这些化合物被称为有效的免疫增强剂和癌症增殖抑制剂(kang sc等人,同上;cui j等人,同上)。
[0042]
广义上的术语“β-葡聚糖”是指通过β-糖苷键连接的d-葡萄糖单体的多糖。β-葡聚糖是一组不同的分子,其分子质量、溶解度、粘度和三维构型可能不同。几种β-葡聚糖已被描述为具有多种生物活性。在本发明中,术语“β-葡聚糖”被理解为是指这些生物活性β-葡聚糖,特别是来源于酵母和生物伞菌的那些,包括来自云芝的云芝糖肽。本发明考虑了更多生物活性β-葡聚糖,例如,来自其他伞菌如灵芝、香菇、白桦茸(chaga)和灰树花的β-葡聚糖,来自面包酵母的β(1,3)d-葡聚糖,来自燕麦和大麦的β(1,3)(1,4)-葡聚糖。还考虑了β-葡聚糖衍生物,如羧甲基β-葡聚糖。据报道,这些β-葡聚糖还具有免疫调节特性。羧化β-葡聚糖也被描述为具有伤口愈合特性。β-葡聚糖的方便来源是naturalis life technologies公司的产品含有由niosomal囊泡携带的羧甲基β-葡聚糖、厚朴酚(木兰醇,magnolol)以及和厚朴酚(honokiol)。
[0043]
在一个优选的实施方式中,预防和/或治疗包括增强阴道或宫颈对传染性病原体的免疫力。
[0044]
提供包含治疗有效量的云芝提取物的组合物,该组合物通过阴道或宫颈施用用于增强阴道或宫颈对传染性病原体的免疫力被认为是本发明的一部分。这可以重新表述为包含治疗有效量的云芝提取物的组合物在制备用于通过阴道或宫颈施用增强阴道或宫颈对传染性病原体的免疫力的药物中的用途。本发明还提供了在有需要的动物(包括人)中增强阴道或宫颈对传染性病原体的免疫力的方法,该方法包括经阴道或经宫颈施用包含治疗有效量的云芝提取物的组合物。施用方案优选如上所限定的。
[0045]
本发明的用于阴道或宫颈施用的组合物包含云芝提取物。本发明的组合物可以另外并入其他活性成分,这些活性成分通过进一步增强免疫力、减少炎症、有利于有益的阴道菌群、修复紊乱的上皮屏障或对抗不期望的传染性病原体,来增强云芝提取物的有益效果。在这个意义上,发明人已经发现在云芝提取物和选自保湿剂、益生菌、益生元、消炎剂(intiinflamatory agent)、组织再生剂和抗病毒剂的活性化合物之间发生协同相互作用。因此,在一个实施方式中,根据本发明的组合物,除了云芝提取物之外,进一步包含至少一种选自保湿剂、益生菌、益生元、组织再生剂、消炎剂和抗病毒剂的活性化合物。
[0046]
云芝提取物刺激保护性免疫应答,同时抑制可能导致疾病的不需要的免疫应答。例如,云芝提取物可以恢复或改善由例如施用抗癌剂引起的抑制的免疫系统功能。云芝提取物可以刺激抵抗病毒、细菌和/或微生物感染的保护性免疫应答。此外,云芝提取物可以抑制不需要的免疫应答,如tnf-a的产生及其金属蛋白酶产生的诱导,某些肿瘤细胞利用这些来促进转移。
[0047]
当直接施用于阴道或宫颈区域,特别是施用于阴道或宫颈时,根据本发明的组合物增强局部免疫应答以对抗可能存在于该区域中的典型病原体,如人乳头瘤病毒(hpv)、白色念珠菌、沙眼衣原体、阴道加德菌、动弯杆菌属、拟杆菌属、支原体属、淋病奈瑟菌、阴道毛滴虫、疱疹病毒、金黄色葡萄球菌、表皮葡萄球菌、大肠埃希氏菌、阿尔法链球菌、芽孢杆菌属、肠杆菌属、变形菌、阴沟肠杆菌、克雷白菌属、表皮葡萄球菌、肺炎克雷伯杆菌和皮肤真菌。这些病原体导致一系列病症,包括但不限于阴道炎、外阴阴道炎、皮肤真菌病、念珠菌病、阴道或宫颈疱疹、淋病、直肠炎、不孕症、宫颈炎、盆腔炎症性疾病、异位妊娠、急性或慢
性骨盆疼痛、滴虫病和宫颈癌。因此,在一个实施方式中,本发明的用于阴道或宫颈施用的组合物用于预防和/或治疗任何上述病症。
[0048]
在另一特定的实施方式中,本发明的组合物要预防或治疗的阴道或宫颈病症是阴道炎。“阴道炎”是指通常由感染引起的阴道炎症,可导致分泌物、瘙痒和疼痛,并且经常与外阴的刺激或感染有关。在后一种情况下,该病症被称为“外阴阴道炎’。
[0049]
已知几种类型的阴道炎通常影响女性,其中包括细菌性阴道炎、霉菌性阴道炎、滴虫病、非特异性阴道炎和病毒性阴道炎。
[0050]
霉菌性阴道炎是由真菌感染引起的,通常是由念珠菌属的酵母菌过度生长引起的,但也可由皮肤真菌感染引起的。它最常见的是由称为白色念珠菌的真菌类型引起的。真菌的念珠菌(candida species)天然存在于阴道中,并且通常无害。然而,如果阴道内的情况变化,白色念珠菌可引起念珠菌阴道炎(thrush)的症状。
[0051]
滴虫病,有时称为“毛滴虫病(trich)”,是阴道炎的另一种常见原因。它是性传播疾病,并且由对宿主细胞产生机械应力,然后在细胞死亡后摄取细胞碎片的单细胞原生动物寄生虫阴道毛滴虫引起。症状包括宫颈(宫颈炎)、尿道(尿道炎)和阴道(阴道炎)的炎症,它们产生瘙痒或灼热感。
[0052]
非特异性阴道炎是由自然产生的细菌菌群失衡引起的阴道疾病。与细菌性阴道炎有关的微生物非常多样,但包括阴道加德菌、动弯杆菌属、拟杆菌属和支原体属。可能由于抗生素的使用、激素变化或ph值失衡导致的正常细菌菌群的变化包括乳酸杆菌属(lactobacilli)的减少,使得这些有害细菌得以立足并繁殖。这种类型的阴道炎极为常见,尤其是在育龄妇女中。
[0053]
病毒也是阴道炎的常见原因。由单纯疱疹病毒(hsv)引起的一种形式通常简称为“疱疹”感染。这些感染也通过性接触传播。疱疹性阴道炎的主要症状是与病变或“疮”相关的疼痛。这些疮通常在外阴或阴道上可见,但偶尔在阴道内,并且只能在妇科检查中才能看到。
[0054]
病毒性阴道感染的另一来源是人乳头瘤病毒(hpv)。hpv,有时称为阴道或宫颈疣,也可以通过性交传播。这种病毒导致疼痛的疣在阴道、直肠、外阴或腹股沟中生长。
[0055]
如上所述,hpv的持续感染也可能导致宫颈癌。在优选的实施方式中,本发明的组合物用于增强针对hpv的阴道或宫颈免疫力。在另一个优选的实施方式中,本发明的组合物用于预防和/或治疗宫颈癌。
[0056]
特别地,本发明的组合物有利于预防hpv的持续感染,从而提供在没有其他治疗策略可用的早期阶段对抗宫颈癌的有效策略。
[0057]
如上所述,迄今为止,治疗干预发生在检测到hsil(高度鳞状上皮内病变)的阶段。显示只是lsil(低度鳞状上皮内病变,与cin1型细胞一致)的患者在12至24个月的时间范围内未接受治疗,直到重复测试并确认hsil(见图1)。本发明的组合物特别适用于表现出lsil/cin1阳性测试但目前未接受治疗的患者。本发明的组合物可以在这个阶段施用,并且在通过局部增加免疫力和避免持续性hpv感染来帮助身体清除hpv感染方面,以及在通过增强受影响区域的上皮形成来治愈上述lsil/cin1病变方面提供益处。因此,在一个特定的实施方式中,本发明的组合物用于阴道或宫颈(阴道或宫颈)施用至显示低度鳞状上皮内病变(lsil)或轻度宫颈上皮内瘤变(cin1)的女性。该实施方式也可以表述为通过在表现出lsil
或cin1的女性中阴道或宫颈施用本发明的组合物来预防或治疗hpv感染或宫颈癌的方法。
[0058]
在此阶段有效清除hpv感染通常称为“阴性化”。因此,本发明的一个实施方式涉及本发明的组合物在通过阴道或宫颈施用对显示lsil或cin1的hpv阳性女性进行阴性化中的用途。该实施方式也可以表述为通过阴道或宫颈施用本发明的组合物来阴性化显示lsil或cin1的hpv阳性女性的方法。
[0059]
在另一具体的实施方式中,本发明的组合物用于治疗由传染性病原体引起的阴道上皮损伤,特别是由hpv引起的lsil或cin1损伤。换句话说,本发明的组合物可用于因传染性病原体而受损的阴道组织的再上皮形成,特别是用于由hpv引起的lsil或cin1损伤的再上皮形成。
[0060]
无论上述情况如何,本发明的组合物可用于其他病理阶段。例如,本发明的组合物可以经阴道或经宫颈施用给处于低度鳞状上皮内病变阶段(hvp或cin1)的女性,用于防止持续的hpv感染和/或阴道病变的再上皮形成。本发明的组合物还可以用作辅助疗法来治疗患有hsil或癌症的女性。
[0061]
对于患有hpv感染的患者,典型的施用方案包括在6个月期间经阴道或经宫颈施用本发明的组合物21至75次。因此,在一个特定的实施方式中,该组合物用于治疗hpv感染,其中治疗方案包括在6个月期间经阴道或经宫颈施用本发明的组合物21至75次。对于患有其他阴道或宫颈感染,特别是复发性阴道或宫颈感染的患者,典型的施用方案包括在6个月期间经阴道或经宫颈施用本发明的组合物21至75次。
[0062]
发明人发现最佳施用方案包括:(a)21-24天期间每天一剂量本发明的组合物,随后(b)3到7天期间无剂量,随后(c)在21-24天期间每天或每两天一剂量本发明的组合物,随后(d)在3到7天内无剂量,并且(e)依次重复(c)和(d)四次。
[0063]
在本案中,术语“剂量”一般是指一次服用的本发明组合物的特定药物量。在大多数实施方式中,每剂量包含0.5至5mg云芝提取物。
[0064]
在特定的实施方式中,施用方案包括:a)在21-24天期间每天一剂量本发明的组合物,随后(b)在3到7天期间无剂量,随后(c)在21-24天期间每两天一剂量本发明的组合物,随后(d)在3到7天期间无剂量,并且(e)依次重复(c)和(d)四次,其中每剂量包含0.5至5mg云芝提取物。
[0065]
在另一特定的实施方式中,施用方案包括:(a)在21至24天期间每天一剂量组合物,随后(b)在3到7天期间无剂量,随后(c)依次重复(a)和(b)两次,随后(d)在21-24天期间每两天一剂量组合物,随后(e)在3到7天期间无剂量,并且(f)依次重复(d)和(e)两次,其中每剂量包含0.5至5mg云芝提取物。
[0066]
在另一特定的实施方式中,施用方案包括:(a)在21至24天期间每天一剂量组合物,随后(b)在3到7天期间无剂量,随后(c)依次重复(a)和(b)5次,其中每剂量包含0.5至5mg云芝提取物。
[0067]
上述为期6个月的施用方案可以依次重复一次、两次、三次或四次,优选一次,使得整个治疗长达一年。如果需要,上述治疗可以重复一次、两次、三或四次,优选一次,但在每次施用方案之间休息一到两个月(无治疗月)。
[0068]
在具体的实施方式中,在21天期间施用上述方案中的剂量并且在7天期间不施用。
[0069]
在具体的实施方式中,上述施用方案中的每剂量包含1至4mg ml的云芝提取物。优
04。
[0076]
上述益生菌乳杆菌菌株可商购,由nutris ingredients sl公司销售。例如,nu-06、nu-02、nu-09、nu-03、nu-04菌株包含在该公司销售的产品nuprobi 中。已经发现云芝提取物与上述益生菌的组合对于预防/治疗阴道或宫颈病症如由hpv感染引起的病症特别有效。
[0077]
在一个实施方式中,本发明的组合物进一步包含组织再生剂。“组织再生剂”理解为可以促进身体组织,特别是受损身体组织的更新、恢复和/或生长的化合物。该术语以非限制性方式包括促进伤口愈合(“伤口愈合剂”)、瘢痕形成(“瘢痕形成剂”)的化合物和增强血管生成的化合物(“血管生成剂”)。
[0078]
在优选的实施方式中,组织再生剂是积雪草(centella asiatica)的提取物。积雪草(也称为雷公根(gotu kola)和indian pennywort)是生长在印度洋周围的多年生匍匐植物。在当地传统上用于管理皮肤状况,它用于支持小伤口、划痕和浅表烧伤的更快愈合,以及对湿疹、轻微瘙痒和昆虫叮咬的消炎。积雪草的组织再生活性与修复阴道和/或宫颈中紊乱的上皮屏障(主要伤口和/或微磨损)特别相关,以避免和/或对抗持续性病毒感染(例如hpv)。从这个意义上讲,组织再生剂(如积雪草提取物)与云芝以及任选的其他活性成分的组合特别有效。因此,在特定的实施方式中,本发明提供了包含云芝提取物和积雪草提取物的组合物,用于通过阴道或宫颈施用修复紊乱的阴道或宫颈上皮屏障。另一个具体的实施方式提供了包含云芝提取物和积雪草提取物的组合物,用于通过阴道或宫颈施用预防和/或清除由如上定义的传染性病原体引起的阴道和/或宫颈持续感染,特别是持续性hpv感染。
[0079]“积雪草提取物”是指从积雪草获得的提取物,其含有高浓度的生物活性化合物,特别是五环三萜类化合物。这些提取物中含有的三萜类化合物是积雪草酸、羟基积雪草酸和积雪草苷。如本文所用,“积雪草提取物”包括可获得的积雪草提取物、以及来自积雪草的生物活性化合物或从积雪草获得的特定生物活性化合物的纯化或半纯化制剂中的任何。
[0080]
已发表的临床研究描述了以下积雪草提取物的用途:ttfca、teca以及提及商业提取物名称的地方,(积雪草的滴定提取物)或(积雪草的总三萜类成分)(ema/hmpc/291177/200,2010.“assessment report on centella asiatica(l.)urban,herba”)。研究已经表明,积雪草的主要成分增加胶原蛋白的合成,从而有利于组织修复和血管生成。
[0081]
在一个实施方式中,本发明的组合物进一步包含抗病毒剂。“抗病毒剂”在其一般概念中被理解为可以破坏或抑制病毒发展的化合物。
[0082]
在优选的实施方式中,抗病毒剂是印度苦楝树(azadirachta indica)提取物。“印度苦楝树”,也被称为印楝(neem)、印楝树(nimtree)和印度紫丁香(indian lilac),是楝科(family meliaceae)桃花心木(mahogany)的一种树。
[0083]
已发现从印楝的不同部分获得的各种制剂发挥抗菌、抗病毒、抗疟疾、抗氧化、抗真菌、抗突变、抗癌、避孕和抗溃疡活性。先前的报告已经记载,印楝提取物显著抑制了处于病毒基因组复制早期阶段的脊髓灰质炎病毒、hiv、柯萨奇b组病毒和登革热病毒(tiwari v,等人phytother res.2010,vol.24(8),p.1132
–
1140)。
[0084]
主要化学成分是印苦楝素、印苦楝素烯(nimbinene)、印苦楝子素、印苦楝子酚
(azadirachtol)、印苦楝子醇(azadirachnol)、去乙酰印苦楝素烯(desacetynimbinene)、印苦楝二醇(nimbandiol)、印苦楝内酯、槲皮素、β-谷甾醇、正二十六烷醇、印苦楝酚、尼莫星(nimocin)。如本文所用,“印度苦楝树提取物”包括可获得的印度苦楝树提取物,以及来自印度苦楝树的生物活性化合物或从印度苦楝树获得的一种特定生物活性化合物的纯化或半纯化制剂中的任何。这些提取物是可商购的(例如可以从symrise公司获得)。
[0085]
在一个实施方式中,本发明的组合物进一步包含抗炎剂。“抗炎剂”在其一般概念中被理解为减少炎症的化合物。优选地,本发明的组合物包含源自天然来源的抗炎剂。在特定的实施方式中,抗炎剂来源于木兰树。在优选的实施方式中,抗炎剂是厚朴酚(magnolol)、和厚朴酚(honoliol)或其混合物。厚朴酚(4-烯丙基-2-(5-烯丙基-2-羟基-苯基)苯酚)(magnolol(4-allyl-2-(5-allyl-2-hydroxy-phenyl)phenol))以及和厚朴酚(2-(4-羟基-3-丙基-2-烯基-苯基)-4-丙基-2-烯基-苯酚))(honokiol(2-(4-hydroxy-3-prop-2-enyl-phenyl)-4-prop-2-enyl-phenol)))是源自木兰树的木脂素,其已被描述为抑制活化b细胞的核因子κ(kappa)-轻链增强剂(nf-kb),并且还下调重要炎症介质如白细胞介素-8(il-8)和肿瘤坏死因子α(tnf-α)的产生。
[0086]
在一个实施方式中,根据本发明的组合物除了云芝提取物之外还包含益生菌、保湿剂、益生元、消炎剂、组织再生剂和任选的抗病毒剂和/或抗炎剂。在特定的实施方式中,本发明的组合物除了云芝提取物之外还包含透明质酸、nuprobi和积雪草提取物。在另一特定的实施方式中,本发明的组合物除了云芝提取物之外还包含透明质酸、nuprobi积雪草提取物和印度苦楝树提取物。在另一特定的实施方式中,本发明的组合物除了云芝提取物之外还包含透明质酸、nuprobi积雪草提取物、印度苦楝树提取物厚朴酚以及和厚朴酚。在另一实施方式中,本发明的组合物另外包含羧甲基β-葡聚糖。
[0087]
在某些实施方式中,本发明的组合物包含云芝提取物和印度苦楝树提取物。本发明的组合物还可方便地包含益生菌。在某些实施方式中,本发明的组合物包含云芝提取物和至少一种选自益生菌、印度苦楝树提取物、另外的β-葡聚糖(不同于云芝提取物中包含的psp和pskβ-葡聚糖)的活性化合物及其组合。在一些实施方式中,组合物包含云芝提取物、印度苦楝树提取物、另外的β-葡聚糖(如羧甲基β-葡聚糖)、益生菌和至少一种选自保湿剂、益生元、抗炎剂、组织再生剂和芦荟的另外的活性成分。在一些实施方式中,组合物包含云芝提取物、印度苦楝树提取物、另外的β-葡聚糖(如羧甲基β-葡聚糖)、益生菌和至少一种选自透明质酸、α-葡聚糖低聚糖、厚朴酚、和厚朴酚、积雪草提取物和芦荟的另外的活性成分。在特定的实施方式中,本发明的组合物包含云芝提取物、印度苦楝树叶提取物、羧甲基β-葡聚糖、益生菌、厚朴以及和厚朴酚。在非常特定的实施方式中,本发明的组合物包含云芝提取物、印度苦楝树叶提取物、羧甲基β-葡聚糖、益生菌、透明质酸、α-葡聚糖低聚糖、厚朴酚、和厚朴酚、积雪草提取物和芦荟。另外的β-葡聚糖可以选自来自几种天然来源的羧化β-葡聚糖、β(1,3)d-葡聚糖和β(1,3)(1,4)-葡聚糖。在特定的实施方式中,另外的β-葡聚糖是羧甲基β-葡聚糖。益生菌可以选自胚芽乳杆菌nu06、副干酪乳杆菌nu133、副干酪乳杆菌nu653、嗜酸乳杆菌nurf-2、鼠李糖乳杆菌nurf-1及其组合。
[0088]
上述组合物中化合物的协同组合决定了它们用于治疗和/或预防由传染性病原体引起的阴道或宫颈病症,特别是针对阴道炎和由hpv感染引起的病症如宫颈癌,特别有效。
在特定的实施方式中,如上定义的组合物用于通过阴道或宫颈施用来修复紊乱的阴道或宫颈上皮屏障。另一特定的实施方式提供了用于通过阴道或宫颈施用治疗由传染性病原体引起的阴道病变,特别是由hpv引起的lsil或cin1病变的如上定义的组合物。另一特定的实施方式提供了用于通过阴道或宫颈施用预防和/或清除由传染性病原体引起的阴道和/或宫颈持续感染,特别是持续hpv感染的如上定义的组合物。
[0089]
除了云芝提取物之外,可以掺入本发明的组合物中的其他成分是绿茶叶提取物(或其众所周知的生物活性化合物中的任何)、互生叶白千层(melaleuca alternifolia)提取物(或其众所周知的生物学活性化合物中的任何)和芦荟。
[0090]
本发明提供包含有效量的云芝提取物和/或有效量的从云芝分离的生物活性化学成分和/或化合物,优选云芝糖肽psk和/或psp的组合物。在特定的实施方式中,本发明的组合物还含有有效量的至少一种上述附加活性成分(益生菌、保湿剂、益生元、消炎剂、组织再生剂和/或抗病毒剂)。本文所用的术语“有效量”是指当施用时,足以预防所针对的病症的发展、治疗或在一定程度上减轻所针对的病症的化合物的量,所针对的病症在本发明中是由传染性病原体引起的阴道或宫颈病症。在本发明的意义上,“有效量”也被理解为足以增强阴道或宫颈免疫力的化合物的量。例如,组合物中云芝提取物的有效量可以包含0.005至5%、或0.01至1%、或0.01至0.5%,例如0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3或0.4%。组合物中病毒剂如印楝属提取物的有效量可以包含0.001至5%、或0.005至1%、或0.005至0.1%,例如0.006、0.007、0.008、0.009、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08或0.09%。组合物中其他β-葡聚糖如羧甲基β-葡聚糖的有效量可以包含0.01至10%、或0.025至1%、或0.05至0.5%,例如0.08、0.08、0.09、0.1、0.2、0.3或0.4%。组合物中益生元如α-葡聚糖低聚糖的有效量可以包含0.01至10%、或0.05至5%、或0.1至1%,例如0.2、0.3、0.4、0.5、0.6、0.7、0.8或0.9%。组合物中保湿剂如透明质酸的量可包含0.01至10%、或0.05至5%、或0.1至1%,例如0.2、0.3、0.4、0.5、0.6、0.7、0.8或0.9%。组合物中抗炎剂如厚朴酚和/或和厚朴酚的有效量可以包含0.005至5%、或0.01至2%、或0.05至1%,例如0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8或0.9%。组合物中组织再生剂如源自积雪草提取物的成分(compounts),特别是积雪草苷、羟基积雪草酸和/或积雪草酸的有效量可以包含0.001至5%,或0.005至1%、或0.005至0.1%,例如0.006、0.007、0.008、0.009、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08或0.09%。该组合物可以包含芦荟,其量包含0.1至10%、或0.5至5%,例如0.8、1、1.5、2、3或4%。组合物中益生菌的有效量可为0.05%至10%、或0.1%至5%、或0.2%至3%,例如3%、2%、1.5%、1%、0.5%或0.25%。
[0091]
根据本发明施用的化合物的具体剂量当然将围绕病情的具体情况确定,包括施用的化合物、包封效率、施用途径和类似的考虑。
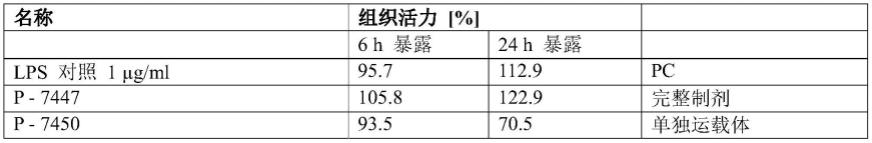
[0092]
如上所述,为了通过阴道或宫颈途径治疗由传染性病原体如hpv引起的状况,方便的剂量可包含0.5至5mg云芝提取物,优选地1至4mg或1.5至3.5mg。更优选地,剂量包含2至3mg云芝提取物。当组合物中存在其他活性成分时,印度苦楝树提取物(如果存在)在每剂量中的量可为0.1-1mg,羧甲基β-葡聚糖(如果存在)在每剂量中的量可为1.8-18mg,α-葡聚糖低聚糖(如果存在)在每剂量中的量可为5-50mg,透明质酸(如果存在)在每剂量中的量可为0.24
–
2.4mg,积雪草提取物(如果存在)在每剂量中的量可为0.3322
–
3.322mg,而芦荟(如果
存在)在每剂量中的量可为0.05
–
0.5mg。益生菌(如果存在)在每剂量中的总量可为30至100mg(每克益生菌来自106至108个细胞)
[0093]
本发明的组合物用于阴道或宫颈施用。因此,本发明的组合物优选是局部组合物。
[0094]
可以根据本领域众所周知的方法制备局部(包括宫颈或阴道)制剂。合适的载体及其量可由本领域技术人员根据所制备制剂的类型容易地确定。根据本发明的用于阴道或宫颈施用的示例性组合物可以包含:水、库拉索芦荟叶汁、甘油、丙二醇、羟乙基纤维素、水解透明质酸、羧甲基β-葡聚糖钠、α-葡聚糖、低聚糖、云芝提取物、印度苦楝树叶提取物、西瓜籽油聚甘油-6酯、榛子油聚甘油-6酯、杏仁油聚甘油-6酯、山奈酚、聚甘油-10二月桂酸酯、卵磷脂、厚朴酚、和厚朴酚、聚甘油-10油酸酯、脱水山梨醇油酸酯、脱水山梨糖醇、棕榈酸酯、双十六烷基磷酸、苯甲酸钠、山梨酸钾、乳酸。
[0095]
优选地,本发明的组合物包含用于局部施用的适当赋形剂和/或载体,其可以是本领域一般已知的局部可接受的药物或化妆品赋形剂和载体。本文所用的“局部可接受的”指在合理的医学判断范围内,适用于与人类和/或非人类动物皮肤和/或粘膜接触,没有过度毒性、不相容性、不稳定性和过敏反应等的化合物、材料、组合物和/或剂型。每种“局部可接受的”载体、赋形剂等,在与配方的其他成分相容的意义上也必须是“可接受的”。此类赋形剂和载体包括但不限于修复皮肤屏障功能的试剂、水合剂、润肤剂、乳化剂、增稠剂、湿润剂、ph调节剂、抗氧化剂、防腐剂、运载体(vehicles)或它们的混合物。使用的赋形剂和/或载体对皮肤或粘液具有亲和力,耐受性良好,稳定,并且以足以提供所期望稠度的量使用,以及易于施加。此外,组合物可以包含其他成分,如香料、着色剂和本领域已知的用于局部制剂的其他成分。
[0096]
所述局部组合物可以适于以以下形式施加于皮肤和粘膜:非离子小泡分散体、乳剂、乳膏、乳液、凝胶、气溶胶、乳膏-凝胶、凝胶-乳膏、悬浮液、分散体、粉末、固体棒、擦拭物、泥敷剂、泡沫、喷雾、油、软膏、液体、肥皂、卫生巾、胚珠、子宫托卫生棉条、阴道栓剂或化妆品和药学领域已知的任何其他形式。在特定的实施方式中,本发明的组合物被配制成凝胶并通过插管经阴道或经宫颈施用。在其他实施方式中,本发明的组合物被配制为胚珠。在其他实施方式中,本发明的组合物被配制成阴道栓剂。
[0097]
本发明的组合物可适用于药物产品、化妆品或卫生产品。
[0098]
可以通过将活性化合物包封到脂质体中来增强本发明组合物的有效性。
[0099]
术语“脂质体”应被理解为自组装结构,其包含一个或多个由双层组成的膜,双层中的每个包括两个包含相反取向的两亲性分子的单层。两亲性分子可以是聚合物或脂质,其包含与一个或多个非极性(疏水)链共价连接的极性(亲水)头基区域。疏水性酰基链与周围水性介质之间的能量(积极,energetically)不利接触诱导两亲性脂质分子自行排列,使其极性头基朝向双层表面定向,而酰基链重新定向到双层内部。因此形成能量稳定的结构,其中有效地保护酰基链不与水性环境接触。
[0100]
脂质体将水溶液区域包封在疏水膜内;溶解的亲水性溶质不能轻易穿过脂质。疏水性化学物质可以溶解到膜中,并且以这种方式脂质体既可以携带疏水性分子,也可以携带亲水性分子。为了将分子递送到作用位点,脂质双层可以与其他双层(如细胞膜)融合,从而递送脂质体内容物。脂质体的应用在化妆品和制药方面具有广泛的优势,包括提高生物降解性、生物相容性,以及延长释放和降低包封活性剂的毒性和副作用。进一步优点是包含
脂质体包封的活性剂的组合物通常表现出延长的保存期,因为脂质体保护所述活性剂不被降解。
[0101]
因此,在特定的实施方式中,在本发明的组合物中的云芝提取物和/或另外的活性化合物(如果存在)中的一种或多种被包封到脂质体中。
[0102]
本领域已知的任何类型的脂质体都可以包封本发明组合物中的活性化合物。特别合适类型的脂质体是类脂囊泡(niosomes)、磷脂复合物(phytosomes)和超微粒子(纳米质体,nanosomes)。因此,在另一特定的实施方式中,来自云芝的提取物和/或包含在本发明的组合物中的另外的活性化合物中的一种或多种被包封到类脂囊泡、磷脂复合物和超微粒子中。
[0103]“类脂囊泡”是基于非离子表面活性剂的脂质体。类脂囊泡主要是通过胆固醇掺入作为赋形剂形成,但也可以使用其他赋形剂。它们是微观尺寸的层状结构,由烷基或二烷基聚甘油醚类的非离子表面活性剂和胆固醇构成,随后在水性介质中水合。用于制备类脂囊泡的材料使它们更稳定,因此类脂囊泡具有许多优点,例如,类脂囊泡具有非常高的穿透能力。含有几种生物活性化合物的类脂囊泡是可商购的。例如,由naturalis life technologies公司销售的透明质酸类脂囊泡(nio-oligo)。同一家供应商销售nio-glucan类脂囊泡,其含有羧甲基β-葡聚糖(水溶性葡聚糖衍生物)、厚朴酚以及和厚朴酚的混合物。
[0104]“磷脂复合物”是适当摩尔比的天然活性成分和磷脂,优选地磷脂酰胆碱,通常还含有多酚的复合物。磷脂复合物是天然活性成分或活性天然成分的混合物(例如植物提取物)在膳食磷脂基质(例如来自大豆的卵磷脂)中的固体分散体。当包封在磷脂复合物内时,活性成分可以某种方式相当于脂质膜的组成部分。几种天然活性成分以磷脂复合物的形式市售,例如,很容易从indena获得含有来自积雪草的三萜的centella同一供应商还销售其含有来自绿茶叶的多酚。
[0105]“超微粒子”是含有高百分比磷脂酰胆碱(pc)的纳米级单双层脂质体。超微粒子通过局部施加有效地渗透到皮肤中,促进将其包封的活性化合物递送到皮肤细胞。
[0106]
根据本发明,活性化合物可以直接包含在组合物中或可以脂质体的形式添加。本发明还考虑到一些活性化合物以脂质体的形式包括在组合物中,而其他的活性化合物则不是。在以脂质体形式包括在组合物中的活性化合物中,考虑了任何类型的方便的脂质体,例如类脂囊泡、磷脂复合物或超微粒子,或其混合物。
[0107]
在特定的实施方式中,本发明的组合物包含云芝提取物、nio-oligocentella和任选地,印度苦楝树提取物和/或
[0108]
在整个说明书和权利要求书中,“包含”一词及其变体并不意在排除其他技术特征、添加剂、组分或步骤。此外,“包含”一词涵盖“由......组成”的情况。本发明的其他目的、优点和特征对于本领域技术人员阅读说明书后将变得明显,或者可以通过本发明的实践获知。下列附图是以示例的方式提供的,它们不意在限制本发明。此外,本发明涵盖本文所述的特定和优选实施方式的所有可能组合。
[0109]
实施例
[0110]
1.包含云芝提取物的用于阴道或宫颈施用的组合物
[0111]
配制了用于阴道或宫颈施用的凝胶,其包含0.5%α-葡聚糖低聚糖、0.18%羧甲基β-葡聚糖钠、0.24%水解透明质酸、0.05%云芝提取物、0.01%印度苦楝树提取物、1%库拉索芦荟叶汁。
[0112]
该组合物为凝胶形式,并且可通过插管在阴道或宫颈内施用。
[0113]
2.体外研究
[0114]
该研究被设计为在限定的治疗期后通过评估组织释放到基底室中的细胞因子,来研究本发明的组合物是否能够调节阴道上皮组织的免疫应答。还使用了3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide)(mtt)测量来评估组织的活力。
[0115]
测试系统
[0116]
使用重建的三维人阴道上皮模型epivaginal
tm
vlc-100-ft(mattek)进行了测试。rhve模型epivaginal vlc-100-ft(mattek)由在含有成纤维细胞和树突细胞(dc)的固有层样胶原基质上培养的正常人源性vec上皮细胞组成。因此,该测试系统代表了目的物种的体外靶器官,并且紧密模拟了生化和生理特性。
[0117]
材料
[0118]
测试了以下凝胶:
[0119]
实施例1的papilocare gel组合物(p-7447)
[0120]
实施例1的vehicle凝胶组合物不含以下活性成分:云芝提取物、印度苦楝树提取物、羧甲基β-葡聚糖、厚朴酚以及和厚朴酚(p-7450)。
[0121]
vehicle+0.05%云芝提取物(p-7451)
[0122]
vehicle+0.01%印度苦楝树提取物(p-7452)
[0123]
vehicle+0.18%羧甲基β葡聚糖钠、0.075%厚朴酚、0.075%和厚朴酚(p-7453)
[0124]
lps对照(1μg/ml脂多糖,sigma目录号:l4391)
[0125]
epivaginal
tm
组织以试剂盒(vlc-100-ft,mattek)提供,试剂盒由与本研究相关的以下组分组成:
[0126]
1x密封的24孔板,其含有24个在琼脂糖上带有组织的插入物
[0127]
1瓶测定培养基(基于dmem的培养基)
[0128]
5.其他试剂
[0129]
mtt溶液:
[0130]
——mtt储备溶液:在磷酸盐缓冲盐水(pbs)中的3mg/ml mtt
[0131]
——mtt培养基:将mtt储备溶液用dmem基培养基稀释1+9(最终浓度0.3mg/ml)
[0132]
异丙醇
[0133]
方法
[0134]
a)预实验
[0135]
为检验供试品的非特异性mtt减少能力,每2ml mtt培养基中混合50mg供试品,并且在37
±
1℃下避光温育3h。如果混合物变成蓝色/紫色,则假定供试品的mtt降低。对于结果的定量校正,通过使用杀死的组织确定了由于mtt的非特异性减少引起的吸收部分。如果相对于活表皮的阴性对照,非特异性mtt降低》30%,则认为供试品与测试方法不相容。
[0136]
为了检查供试品的着色潜力,在透明容器中每90μl蒸馏水(aqua dest)混合50mg
供试品15分钟。遵循的标准是,如果通过肉眼评估检测到着色,则检查了供试品的组织着色潜力,用于通过使用没有mtt染色的其他活组织来定量校正结果。如果由于显色引起的非特异性od相对于阴性对照》30%,则认为该供试品与测试方法不相容。
[0137]
b)实验程序
[0138]
收到后,将组织转移到每孔含有0.6ml预热的维持培养基的24孔板中。将24孔板在37
±
1℃、5.0%co2下的加湿培养箱中温育至少1小时并且最多24h。然后用0.6ml新鲜培养基替换培养基。称量50
±
2mg(131.5mg/cm2)的量的供试品并且将其施加在每个单独组织的上皮表面。通过移液管的反复圆周移动轻轻地施加供试品,以均匀地覆盖组织表面但避免与移液管尖端有任何直接接触。最终尼龙网可用于摊开。
[0139]
6h实验:从阴性对照开始,用每个剂量组处理组织。将随着第一个组织的给药记录开始时间。然后将组织在37
±
1℃、5.0%co2下温育6h
±
10min。
[0140]
24h实验:从阴性对照开始,用每个剂量组处理组织。随着第一个组织的给药记录开始时间。然后将组织在37
±
1℃、5.0%co2下温育24h
±
1h。
[0141]
在各自的温育期后,保存与组织基底表面接触的培养基并且储存在-80℃下以用于进一步的细胞因子释放分析。
[0142]
然后使用例如洗涤瓶洗涤组织,用25ml pbs轻轻冲洗洗涤瓶约15次,以去除任何残留的供试品。通过轻轻振荡插入物并且用吸墨纸吸干底部来去除多余的pbs。所有插入物均以相同方式处理。
[0143]
然后将处理过的组织转移到含有2ml预热的mtt培养基的准备好的24孔板中,并且进一步在37
±
1℃、5.0%co2下温育3h
±
5min。
[0144]
在3小时mtt温育期后,将组织置于吸墨纸上以干燥组织。之后,通过使用穿孔的特殊活组织检查对上皮细胞进行总活组织检查。将所有组织部分转移到合适的管中且并加入500μl异丙醇。整个周末在2-8℃下避光,或者在室温下至少4小时进行提取,其中在温育期的中间对每个试管进行涡旋。
[0145]
如果任何可见的细胞/组织碎片处于悬浮状态,则将管以300xg离心以消除碎片并且避免对吸光度读数的可能干扰。
[0146]
每个组织的提取物的2x200μl等分试样转移到96孔板中,并且将在平板分光光度计中在没有参考波长的情况下在570nm处测量od。
[0147]
根据试剂盒(v-plex proinflammatory panel1(huam)kit,meso scale discovery,目录号:k15049d-1)的制造商进行细胞因子测定,评估的细胞因子为ifn-γ、ifn.β、il-2、il-4、il-6、il-8、il-10、il-12p70、il-13和tnf-α。
[0148]
结果
[0149]
a)供试品的刺激性潜力
[0150]
在6h和24h的暴露时间后,当用papilocare gel处理组织时,没有观察到细胞毒性作用(见表1)。处理过的组织的活力》用pbs处理的阴性对照的50%(在6和24分别105%和122%)。与papilocare gel相比,用p-7450(vehicle)处理的组织在6h和24h时显示出较低的处理组织的活力,但它被认为没有刺激性,因为活力也》阴性对照的50%(在6和24分别为93%和70%)。
[0151]
这些结果可能表明,papilocare gel和vehicle均未表现出刺激作用。
[0152]
表1.人阴道上皮细胞的活力
[0153][0154]
b)免疫调节作用
[0155]
评估的细胞因子是促炎组,其包括ifn-γ、ifn.β、il-2、il-4、il-6、il-8、il-10、il-12p70、il-13和tnf-α。
[0156]
如表2中所示,在用两种测试浓度(1和10μg/ml)下的阳性对照lps处理后,观察到细胞因子水平增加。在大多数情况下,papilocare gel诱导的细胞因子水平与在1μg/ml下的阳性对照lps相似。在所有情况下,用p-7450(vehicle)处理的组织中的细胞因子水平都较低。
[0157]
表2.人阴道上皮中的细胞因子水平
[0158][0159][0160][0161]
[0162][0163][0164][0165][0166][0167][0168]
结论
[0169]
在用papilocare gel p-7447和阳性对照lps处理的组织中,与6小时相比,在24小
时观察到细胞因子水平明显增加,表明免疫刺激作用随着处理时间而增加,上至24小时。在6小时和24小时之间没有观察到p-7450vehicle的变化。在papilocare gel的测定活性成分之间观察到协同相互作用。
[0170]
3.安全性概述
[0171]
3.1阴道刺激性试验
[0172]
根据iso 10993-10:2010-医疗器械的生物学评价第10部分:刺激和皮肤致敏试验,测定了实施例1的组合物的阴道刺激性。结果表明该组合物的阴道刺激指数为0.00。因此,实施例1的组合物被认为对阴道粘膜没有刺激性。
[0173]
3.2细胞毒性试验
[0174]
根据iso 10993-5:2009医疗器械的生物学评价第5部分:体外细胞毒性试验,测定了实施例1的组合物的体外细胞毒性。结果表明,用包含云芝提取物的实施例1的组合物处理的哺乳动物成纤维细胞atcc balbc 3t3显示出97.92%的细胞活力降低。因此,该组合物被认为具有细胞毒性。
[0175]
3.3.超敏反应试验
[0176]
按照iso 10993-10:2010医疗器械的生物学评价-第10部分:刺激和皮肤致敏试验,测定了实施例1的组合物对豚鼠的皮肤超敏作用。在用包含云芝提取物的实施例1的组合物激发后,在动物中没有观察到皮肤反应。这些结果表明实施例1的组合物可被认为是不致敏的。
[0177]
4.体内研究
[0178]
4.1.小鼠免疫调节
[0179]
该研究的目的是评估包含云芝提取物的组合物在小鼠阴道中局部施用后的免疫调节特性。这是在健康小鼠中进行的。评估了局部和全身免疫应答。使用了两种不同的组合物,gel1(papilocare凝胶,具有如实施例1中公开的完整最终配方)和gel 2(配方不同于实施例1中公开的,不同之处在于云芝提取物的浓度为0.25%)。
[0180]
本研究是根据美国国立卫生研究院(national institute of health)颁布的“guide for the care and use of laboratory animals”进行的,并且实验方案将得到格拉纳达大学地方伦理委员会(local ethic committee of the university of granada)的批准。
[0181]
在健康小鼠中进行该研究,健康小鼠从janvier(st berthevin cedex,法国)获得,并且被饲养在模克隆(makrolon)笼子(每笼5只小鼠)中,并且保持在具有12-h光暗循环的空调气氛中,并且可以自由使用自来水和食物。小鼠被随机分配到不同的实验组。不同组(n=7)的雌性cba/j(j-2α)健康小鼠(8至10周龄)每天在阴道内接种50μl的gel 1或gel 2。对照组(n=6)接种pbs(对照)。治疗6天和10天后处死小鼠以评估治疗效果。
[0182]
切除阴道用于生化测定,通过rt-qpcr测定不同细胞因子(tnfα、il-1β、il-6、il-12、il-17)来评估局部免疫应答(strum j等人,curr protoc pharmacol.,2002,chapter 6:unit 6.9),其将检测每个目的基因的mrna拷贝量。该技术包括使用目标基因的dna模板扩增mrna,以检测所分析基因的不同转录模式。mrna首先被逆转录为cdna,然后被扩增。这在反应“实时”进行时被检测到。为了使测量标准化,与称为标准化基因的另一基因关联研究目标基因,标准化基因因其几乎恒定的表达水平而被选择。组成型表达的甘油醛-3-磷酸
脱氢酶(gapdh)被用作管家基因。由此生成的数据通过计算机软件进行分析,以计算几个样本中的相对基因表达(或mrna拷贝数)。
[0183]
结果:
[0184]
qpcr的结果显示,在接种gel 1的小鼠和接种gel 2第10天和第6天的小鼠中,与对照组相比,所有测试的细胞因子(tnfα、il-1β、il-6、il-12、il-17)显著增加(p<0.05)(图2)。这表明包含在0.05%和0.25%浓度下的云芝提取物的组合物激活健康小鼠阴道上皮细胞的免疫应答。
[0185]
由云芝提取物(单独或与其他β-葡聚糖组合)引起的免疫应答是非特异性的。非特异性免疫系统,也称为先天免疫系统,提供针对感染的即时防御,并且包括体液免疫组分和细胞介导的免疫组分。先天免疫系统的主要功能包括通过产生化学因子(包括细胞因子)将免疫细胞募集到感染部位。从这个意义上说,虽然是非特异性的,但由本发明的组合物在健康个体/组织中引起的局部非特异性免疫应答可以外推到遭受感染的个体/组织。
[0186]
4.2.女性的阴道状况和宫颈上皮形成。
[0187]
目的是评估凝胶施加12天后papilocare gel对以下方面的影响:a)阴道微生物状态的变化,b)宫颈粘膜再上皮形成的程度和c)阴道健康状况。
[0188]
方法
[0189]
设计:在马德里和巴塞罗那(西班牙)的两家妇科诊所,在日常实践条件下进行了一项开放试验、非比较性、前瞻性和试点临床研究。该研究的目的是评估papilocare gel对以下参数的影响:a)宫颈病变的上皮形成(宫颈外翻的逆转),b)阴道微生物群的组成,和c)阴道健康。这些研究是根据赫尔辛基宣言(declaration of helsinki)保护人类受试者的原则进行的,并获得了所有参与者的口头知情同意。根据西班牙法规,具有以下特征的研究不需要伦理批准:真实生活、试点研究、i类医疗器械(非药物)已经上市并在批准的适应症范围内使用,并且由主要研究者而不是由私人制药公司赞助。
[0190]
参与者:参加了常规妇科检查,没有阴道疾病的体征和症状并且帕帕尼科拉乌涂片正常的年龄在18至45岁之间的女性被包括在研究中。4和1之间的上皮形成评分也是纳入标准。排除标准包括阴道感染、使用研究化合物以外的阴道产品以及怀孕或哺乳。有研究者认为不合格的病史或合并症的女性也被排除在研究之外。
[0191]
研究程序:根据随凝胶提供的制造商信息手册,指导同意并符合纳入标准的女性正确使用papilocare阴道凝胶。建议在经期之间、每天一次并且连续12天在睡前使用该医疗器械。对包括使用安全套在内的性活动没有任何限制。不允许使用冲洗液或阴道除臭剂。在整个治疗期间,阴道凝胶免费提供给所有女性。在基线(就诊1,纳入研究)和治疗12天后(就诊2)问诊参与者。在两次就诊中,评估了上皮形成程度、阴道微生物群组成、乳杆菌属(lactobacillus spp.)浓度、阴道ph值和阴道健康指数。
[0192]
评估:宫颈粘膜的上皮形成程度通过标准阴道镜检查进行评估,并且由研究者使用异位上皮形成评分进行评级,其中5为无异位,4:轻度(《25%的外口),3:中度(25
–
50%的外口),2:严重(》50%的外口)和1:严重异位和出血。
[0193]
阴道微生物群使用vaginastatus-diagnostic测试(insti
ü
t f
ü
r herborn,germany)进行评估,并且由研究人员使用5分李克特量表进一步评级,其中1为阴道微生物群非常严重恶化(所有评估的物种都发生了改变);2:严重恶化(检测到念珠菌属
(candida spp.)或支原体属或超过三个物种但不是所有物种的改变);3:中度恶化(三个物种的改变,但没有念珠菌属、支原体属、阴道阿托波氏菌(atopobium vaginae)、大肠埃希氏菌和阴道加德菌可能存在);4:轻度恶化(有1或2个物种改变,但没有念珠菌属、支原体属、阴道阿托波氏菌、大肠埃希氏菌和阴道加德菌可能存在);5:正常。还测量了乳杆菌属浓度和ph值。
[0194]
还评估了阴道健康指数(bachmann g.u”rovaginal or cervical ageing:an old problem newly recognized”,maturitas 1995,dec;22suppl:s1-s5;bachman g.“a new option for managing urovaginal or cervical atrophy in post menopausal women”,contemp obstet gynecol 1997,vol.42,p.13-28)。阴道健康指数是用于评估阴道弹性、液体体积、ph值、上皮完整性和湿度的系统,其评分范围为1到5。出于物流和经济原因,仅在巴塞罗那调查点的11名患者中评估了阴道健康指数和阴道微生物群。
[0195]
统计分析:由于研究的探索性特征,样本量计算不是强制性的。分类变量表示为数字和百分比,并且定量变量表示为均值和标准差(sd)。wilcoxon符号秩检验用于比较连续数据的成对样本。使用2011版power analysis and sample size软件程序分析数据。
[0196]
结果
[0197]
宫颈的上皮形成:共有21名平均年龄为32.6岁(范围20-43岁)的女性参与了外宫颈的上皮形成的评估。用基于云芝的阴道凝胶治疗显示出改善宫颈粘膜再上皮形成的积极作用,与基线时的3.09相比,最后一次就诊时的平均得分为4.42(p《0.0001),并且整体改善43%(图3)。此外,在研究结束时,95.3%的女性表现出上皮形成程度的改善,其中11名女性(52.4%)中观察到得分为5(表3)。图4中显示治疗前后阴道镜检查图像变化。
[0198]
表3a.阴道镜检查上皮形成评估结果(cer评分)
[0199]
[0200]
阴道健康:共有11名年龄在25至43岁之间(平均年龄32.6岁)的女性被纳入阴道健康评估。治疗12天后,阴道健康指数从基线时的平均值19.0显著增加到最后一次就诊时的22.3(p=0.007)(图3)。在6名患者(54.5%)中乳杆菌属的浓度也增加,并且在1名患者中没有观察到变化。在其余3名女性中,发现乳杆菌浓度降低。平均阴道ph值显示下降趋势(4.32vs.4.09,p=ns)(表3b)。
[0201]
表3b.阴道微生物群的结果
[0202][0203]
阴道健康:共有11名年龄在25至43岁之间(平均年龄32.6岁)的女性被纳入阴道健康评估。治疗12天后,阴道健康指数从基线时的平均值19.0显著增加到最后一次就诊时的22.3(p=0.007)(图3)。在6名患者(54.5%)中乳杆菌属的浓度也增加,并且在1名患者中没有观察到变化。在其余3名女性中,发现乳杆菌浓度降低。平均阴道ph值显示下降趋势(4.32vs.4.09,p=ns)。
[0204]
总之,结果显示基于云芝的papilocare阴道凝胶对外宫颈的上皮形成、阴道微生物群和阴道健康具有明显的有益作用。
[0205]
4.3.女性宫颈上皮形成。
[0206]
已对5名健康女性(即没有临床阴道症状)进行了这项研究。每位患者接受为期12天的papilocare gel,每天晚上一次。通过标准阴道镜检查评估对宫颈粘膜上皮形成的影响。使用cer评分(见上文)对阴道镜检查病变进行评级。
[0207]
表5中的结果显示papilocare gel改善宫颈粘膜再上皮形成的积极作用,其中cer评分提高75%(基线vs最终:2.4vs 4.2)。5名女性中共有2名表现出完全康复(cer分数=5)。
[0208]
表5.阴道镜检查评估的结果(cer评分)
[0209][0210]
图4显示在宫颈粘膜中观察到的变化。暗区对应于上皮形成区域。
[0211]
4.4.临床试验papilocare gel
[0212]
这是一项多中心、随机、前瞻性、开放试验、平行组和常规临床实践对照临床试验,以用hpv相关的巴氏涂片检查改变和一致的阴道镜检查图像,来评估实施例1中定义的根据本发明的组合物(papilocare gel)修复女性宫颈粘膜的功效。
[0213]
入组患者被随机分为(1:1:1)三组:
[0214]
a.papilocare,剂量学a:
[0215]
第1个月:21天期间1次插管+7天休息
[0216]
第2至第6个月:隔天1次(月经日除外)插管
[0217]
b.papilocare,剂量学b
[0218]
第1至3个月:21天期间1次插管+7天休息
[0219]
第4至第6个月:隔天1次(月经日除外)插管
[0220]
c.标准临床实践(无特殊治疗)
[0221]
计划纳入研究的患者数量为每组96.32人。这是为主要终点计算的样本量。
[0222]
研究持续时间为12个月:用papilocare治疗6个月和长达1年的随访。
[0223]
在整个研究期间,患者在5次就诊中接受监测:v1筛选、v2随机化、v3 3个月治疗、v4 6个月治疗和v5 6个月随访。
[0224]
在此预最终分析中,疗效的结果测量如下:
[0225]
主要终点
[0226]
·
在6个月时宫颈-阴道粘膜病变的消退,测量为正常巴氏涂片并且阴道镜检查图像一致的患者的百分比。
[0227]
次要终点
[0228]
·
在3个月时宫颈-阴道粘膜病变的消退,测量为正常巴氏涂片和一致的阴道镜检查图像的患者的百分比。
[0229]
·
在6个月时hpv清除。当hpv检测呈阴性或阳性,但清除了基线基因型中的一些(部分清除)以及巴氏涂片和阴道镜检查正常化时,认为hpv清除。
[0230]
·
在3个月和6个月时宫颈阴道粘膜的再上皮形成程度。通过标准阴道镜检查评估宫颈上皮形成的变化(并且由研究者使用李克特量表从0=严重异位+出血到5=正常进行评级)。
[0231]
·
在3个月和6个月时患者感受到的压力水平。使用经过验证的pss14问卷。
[0232]
·
在3个月和6个月时papilocare的安全性和耐受性
[0233]
·
在3个月和6个月时患者的满意度
[0234]
通过pcr(hpv4)进行的hpv检测和鉴定以及研究的巴氏涂片样本(液体细胞学)评估是在“第三方盲评估”的条件下进行的,集中在institute of cellular and molecular studies(icm)of lugo,西班牙。
[0235]
对于此分析,组合了a组和b组,并且进行了组内(最终vs基线)和组间(a+b组vs c组)的比较。此外,已经分析了高风险hpv患者亚组的病变消退(主要目标)和hpv清除(次要目标)。
[0236]
表6包括该预最终分析中纳入的人群的患者数量和治疗持续时间。
[0237]
表6:分析中包括的人群,包括按检测到的hpv风险进行的分层
[0238]
患者数量(n)最初就诊3个月6个月总计1019187papilocare(a+b组)685955标准护理(c组)333232高危hpv患者797068papilocare(a+b组)534442标准护理(c组)262626
[0239]
表7包括用于在此预最终分析中评估疗效终点而评估的患者数量。
[0240]
表7:包括在疗效终点预最终分析中的人群。
[0241][0242]
疗效结果
[0243]
宫颈粘膜的修复
[0244]
在6个月时,用papilocare治疗的患者中的84.9%的患者显示了正常巴氏涂片与一致的阴道镜检查图像vs对照组中64.5%的患者(主要终点)(p=0.031a+b vs c)。3个月后,78.0%接受治疗的患者显示了正常巴氏涂片与一致的阴道镜检查图像vs对照组中54.8%的患者;差异也是显著的(表8)。
[0245]
表8.总人群的疗效结果
[0246][0247]
在高危人群中,在6个月时a+b vs c的差异分别为87.8%vs 56.0%(p=0.0034)。在3个月时,a+b vs c的结果分别为79.5%vs 52%。差异也是显著的(表9)。这些结果也在图5中以图形方式说明。
[0248]
表9:高危hvp人群的疗效结果
[0249][0250]
hpv清除
[0251]
如表10中所示,6个月后,用papilocare治疗总患者中的59.6%显示hvp清除vs对照组中的41.9%。在接受治疗的高危hpv人群患者中观察到了更高hpv清除的统计趋势:papilocare组中62.5%vs.对照组中40.0%,p=0.0767(表11)。表11的结果也在图6中以图形方式说明。
[0252]
表10:总人群中的hpv清除
[0253][0254]
表11:高危hvp人群中的hpv清除
[0255][0256]
上皮形成的程度
[0257]
在3个月时(v3)对总共91名患者和在6个月时(v4)84名患者已经进行了分析。在6个月时用papilocare治疗的患者中的上皮形成程度vs基线观察到显著差异。在3个月的患者中,观察到与基线相比改善的趋势。对照组中的患者在3个月时vs基线和在6个月时vs基线没有显示出显著改善。再上皮形成结果显示在表12中。患者宫颈再上皮形成的图像显示于图7中。
[0258]
表12:规定时间的再上皮形成结果
[0259]
[0260][0261]1曼-惠特尼u(umann-whitney)检验(独立样本)
[0262]2威尔科克森(wilcoxon)检验(相关样本:h0:差异=0vs h1:差异≠0)
[0263]
在3个月和6个月时,再上皮形成量表vs基线改善的治疗患者百分比分别为20.3%和32.1%,而对照组中在3个月和6个月时分别为25.0%和25.8%。在任何时间治疗组中均未发现统计学显著性(表13)。
[0264]
表13:显示再上皮形成变化的患者的百分比
[0265][0266]
在3个月时,papilocare中88.1%的患者没有显示异位或轻度异位vs对照组中的65.6%,其中组间具有统计学显著性(p=0.012,fisher检验)。在6个月时,显示出趋势:接受治疗的患者中的90.6%vs对照组中的80.7%。结果显示在表14和图8中。
[0267]
表14:根据李克特量表的上皮形成程度
[0268][0269]
患者报告的压力水平
[0270]
在用papilocare治疗的组中,pss14个月的测量水平显示从21.13(sd 8.77)到3个月时的19.71(sd 9.04)和到6个月时的18.98(sd 9.11)(3个月和6个月分别为-1.42和-2.15点)。在对照组中,报告的水平从17.72(sd 7.18)至3个月时的17.42(sd 6.33),和到6个月时的20.68(sd 9.77)(同时分别为+0.3点和+2.96点)。尽管不显著,但与对照组相比,papilocare组中显示出压力减轻的积极趋势。结果显示在表15和图9中。
[0271]
表15:患者报告的压力
[0272]
[0273][0274]
对产品的满意度
[0275]
在治疗3个月或6个月后,分别有71.2%和76.9%的患者报告对papilocare完全满意或中度满意。与此同时,分别有83.1%和86.5%的人提到了某种程度的满意度。在3个月时,只有一名患者在报告的就诊时报告对产品略有不满意。患者报告的对产品的满意度结果如表16中所示。
[0276]
表16:患者报告的对产品的满意度
[0277][0278][0279]
安全性
[0280]
可评估91位患者用于安全性分析。有关安全性分析中纳入的患者的治疗组和随访
期的详细信息包含在表17中。
[0281]
表17:纳入安全性分析的患者
[0282]
人群安全性分析3个月6个月总共9184papilocare(a组+b组)5953护理标准(c组)3212
[0283]
11例患者共报告22例不良事件,其中21例不严重,并且只有1例被分级为严重,但该事件与目前的治疗无关。
[0284]
分别只有1例和6例不良事件非常可能(probably)和可能(possibly)与治疗相关。90%的不良事件为轻度/中度强度,并且只有2例导致治疗退出。详情见18。
[0285]
表18:研究中报告的详细不良事件
[0286][0287][0288]
分析结果表明:
[0289]-在总hpv基因型人群和高危hpv基因型人群中,在3个月和6个月时在修复hpv宫颈病变方面与对照组相比有显著差异
[0290]-在6个月时hpv清除呈积极趋势,这在高危hpv基因型人群中几乎是显著的
[0291]-在6个月时宫颈上皮形成与对照组有显著差异,和压力减轻的积极趋势
[0292]-使用满意度高
[0293]-良好的治疗安全性和耐受性。瘙痒、灼热和念珠菌病是与治疗相关的不良事件。
[0294]
4.5.临床试验papilocare凝胶+益生菌
[0295]
这是一项多中心、随机、前瞻性、开放试验、平行组和对照的(papilocare凝胶)试验性临床试验,以评估根据本发明的组合物(papilocare凝胶+益生菌)在3个月时提高乳杆菌浓度和修复具有hpv相关巴氏涂片改变和一致的阴道镜检查图像的女性的宫颈粘膜的功效。papilogel凝胶组合物如实施例1中所限定。papilocare凝胶+益生菌组合物除了含有papilogel凝胶的成分外,还含有浓度为0.5%的卷曲乳杆菌100b(nuris ingredients sl,非活菌)。
[0296]
入组患者被随机(1:1)分为两组:
[0297]
a.papilocare凝胶:
[0298]
第1个月:21天期间1次插管+7天休息
[0299]
第2至第6个月:隔天1次(月经日除外)插管
[0300]
b.papilocare凝胶+益生菌
[0301]
第1个月:21天期间1次插管+7天休息
[0302]
第2至第6个月:隔天1次(月经日除外)插管
[0303]
计划纳入研究的患者人数为每组40人。这是为主要终点计算的样本量。
[0304]
研究持续时间为6个月:用papilocare治疗6个月和长达1年的随访。在整个研究期间,患者在4次就诊中接受监测:v1筛选、v2随机化、v3 3个月治疗、v4 6个月治疗。
[0305]
在此预最终分析中,疗效的结果测量如下:
[0306]
主要终点
[0307]
·
在3个月和6个月时vs基线,乳杆菌浓度以百分比增加
[0308]
次要终点
[0309]
·
在3个月和6个月时宫颈-阴道粘膜病变消退,测量为正常巴氏涂片和一致的阴道镜检查图像的患者的百分比。
[0310]
·
在3个月和6个月时的hpv清除率。当hpv检测呈阴性或阳性,但清除了基线基因型中的一些(部分清除)以及巴氏涂片和阴道镜检查正常化时,认为hpv清除。
[0311]
通过pcr(hpv4)进行的hpv检测和鉴定、巴氏涂片样本的评估(液体细胞学)以及阴道乳杆菌种群的实时pcr测定(确定了卷曲乳杆菌、詹氏乳杆菌(l.jensenii)、惰性乳杆菌(l.iners)、加氏乳杆菌(l.gasseri))都是在“第三方盲评估”的条件下进行的。
[0312]
表19包括该预最终分析中纳入的人群的患者数量和治疗持续时间。
[0313]
表19:纳入分析的人群
[0314][0315]
疗效结果
[0316]
阴道粘膜中乳杆菌浓度增加
[0317]
在3个月时,在用papilocare凝胶+益生菌治疗的患者(b组)中,与基线相比,乳杆菌浓度的平均增加百分比为53%,而在用papilocare凝胶治疗的患者(a组)中,这一增加为27%。这相当于在3个月时两组之间96%的显著改善。在6个月时,在用papilocare凝胶+益生菌治疗的患者(b组)中,乳杆菌浓度的平均增加百分比为76%,而在用papilocare凝胶治疗的患者(a组)中为55%,这相当于38%的显著改善(表20)。
[0318]
表20:乳杆菌浓度改善的主要标准的功效结果
[0319]
在三个月时的主要标准
ꢀꢀ
乳杆菌浓度的改善(改变vs基线)3个月6个月a组27%55%b组53%76%改善a vs b96%38%
[0320]
宫颈粘膜的修复
[0321]
在3个月时,用papilocare凝胶+益生菌治疗的患者(b组)中的78%显示正常的巴氏涂片和一致的阴道镜检查图像,而用papilocare凝胶的患者(a组)中为58%,这相当于在3个月时两组之间74%的显著改善。6个月后,用papilocare凝胶+益生菌治疗的患者(b组)中的95%显示正常的巴氏涂片和一致的阴道镜检查图像,而用papilocare凝胶治疗的患者(a组)中为78%,这相当于在6个月时两组之间65%的显著改善(表21)。
[0322]
表21:疗效结果
[0323][0324]
hpv清除
[0325]
如表22所示,3个月后,用papilocare凝胶+益生菌治疗的患者(b组)中的73%显示hvp清除,而在用papilocare凝胶的患者(a组)中为48%。在治疗的患者中观察到更高hpv清除的统计学显著差异。在6个月时,用papilocare凝胶+益生菌治疗的患者中的83%(b组)显示hvp清除,而用papilocare凝胶的患者(a组)中为63%。在治疗的患者中观察到更高hpv清除的统计学显著差异。
[0326]
表22:hpv清除
[0327][0328][0329]
总而言之,将益生菌掺入papilocare凝胶提供了根据本发明的组合物的功效的令人惊讶的增加作为措施,特别是通过修复宫颈粘膜和hpv清除。有趣的是,3个月的治疗后,粘膜修复和清除已得到显著改善。这意味着益生菌的加入不仅改善了治疗,而且还显著加速了治疗。
[0330]
5.用于本发明组合物的提取物和其他产品的组合物
[0331]
下面列出了本发明组合物中使用的活性成分的合适来源。
[0332]
来自德之馨(symrise)的云芝提取物(coriolus)具有以下组成:水(》50%)、甘油(25-50%)、云芝提取物(1-5%)、苯甲酸钠(0.5%)、乳酸(0.215%)和山梨酸钾(0.2%)。
[0333]
来自德之馨(symrise)的印度苦楝树提取物(neem)具有以下组成:水(》50%)、甘油(25-50%)、印度苦楝树提取物(0.1-1%)、苯甲酸钠(0.5%)、乳酸(0.36%)和山梨酸钾(0.2%)。
[0334]
来自naturalis life technologies的益生元具有以下组成:羧甲基β-葡聚糖钠:2.0-6.0%,厚朴酚/和厚朴酚:1.0-3.0%,聚甘油-10二月桂酸酯:10.0-15.0%,西瓜籽油聚甘油-6酯:10.0-15.0%,榛子油聚甘油-6酯:10.0-15.0%,脱水山梨糖醇油酸酯:4.0-6.0%,卵磷脂:3.0-5.0%,水:45.0-50.0%。
[0335]
益生菌胚芽乳杆菌nu06、副干酪乳杆菌nu-09、副干酪乳杆菌nu-02、嗜酸乳杆菌nu-03和鼠李糖乳杆菌nu-04以及卷曲乳杆菌100b可从nutris ingredients sl获得。
[0336]
申请中引用的参考文献
[0337]
kang sc等人.“effects ofβ-glucans from coriolus versicolor on macrophage phagocytosis are related to the akt and ck2/ikaros”,int j biol macromol.2013,vol.57,p.9-16.
[0338]
cui j,等人.“polysaccharopeptides of coriolus versicolor:physiological activity,uses,and production”.biotechnol adv.2003,vol.21(2),p.109-22.
[0339]
kf cheng,等人.“general review of polysaccharopeptides from.c.versicolor:pharmacological and clinical studies”,cancer therapy 2008,vol.6,p.117-130.
[0340]
ema/hmpc/291177/200,2010.“assessment report on centella asiatica(l.)
urban,herba”.
[0341]
tiwari v,等人.“in vitro antiviral activity of neem(azardirachta indica l.)bark extract against herpes simplex virus type-1infection”.phytother res.2010,vol.24(8),p.1132
–
1140
[0342]
iso 10993-10:2010-biological evaluation of medical devices part 10:tests for irritation and skin sensitization
[0343]
iso 10993-5:2009biological evaluation of medical devices part 5:tests for in vitro cytotoxicity
[0344]
strum j等人.“tissue expression profiling using real-time pcr”,curr protoc pharmacol.2002,chapter 6:unit 6.9,doi:10.1002/0471141755.ph0609s18.
[0345]
bachmann g.“urovaginal or cervical ageing:an old problem newly recognized”,maturitas1995,dec;22suppl:s1-s5
[0346]
bachman g.“a new option for managing urovaginal or cervical atrophy in post menopausal women”,contemp obstet gynecol 1997,vol.42,p.13-28
[0347]
vaginastatus-diagnostic test,insti
ü
t f
ü
rherborn,germany.available at.http://www.mikrooek.de.accessed date 24feb 2016.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1