用于用选择性组胺H1-受体拮抗剂左卡巴斯汀及其衍生物预防和治疗近视的方法和组合物
用于用选择性组胺h1-受体拮抗剂左卡巴斯汀及其衍生物预防和治疗近视的方法和组合物
1.相关申请的交叉引用
2.本技术要求2020年6月2日提交的美国专利申请序列号63/033,291的优先权,该美国专利申请据此以引用方式全文并入。
技术领域
3.本公开涉及用于预防和/或治疗眼部疾病的方法和组合物。特别地,本公开涉及通过全身或局部施用作为选择性组胺h1受体拮抗剂的盐酸左卡巴斯汀及其衍生物来预防和/或治疗近视。
背景技术:
4.近视(近视眼)是世界上最常见的眼部病症。在过去的40年里,美国的近视患病率从25%上升到48%。
1,2
在亚洲部分地区,超过80%的人口受到近视的影响。3全球近视患病率预计将从2020年的25%增加到2050年的50%。4近视每年导致全球生产力损失2500亿美元。
5.近视常常导致严重的病理并发症,如脉络膜视网膜萎缩、视网膜劈裂、视网膜裂孔、视网膜脱离和近视性黄斑变性,这些并发症常常导致失明。
5,6
它也是诸如白内障和青光眼等许多其他严重眼部疾病的主要风险因素,这些眼部疾病也常常导致视力障碍和视力丧失。
7,8
由于患病率不断上升,近视正迅速成为视力丧失的主要原因之一,并且世界卫生组织将近视列为五大优先健康状况之一。
5,9
6.近视的发展受环境和遗传因素的控制。
10
人口研究揭示,导致人类近视的主要环境因素是近距离用眼和阅读,
11-13
这与调节滞后产生的远视散焦有关,即当受试者执行近距离用眼任务时,对近处物体的调节反应不够强。
14,15
远视散焦产生的光学模糊被认为是驱动眼睛过度生长并导致近视的信号。
16,17
例如,对正统犹太学生(其一天大部分时间阅读)和世俗犹太学生(其阅读时间较少)的近视发生率的分析发现,与世俗学生相比,正统学生的近视发生率和程度要高得多,
18
这揭示了阅读是导致近视的因素。此外,有多项流行病学研究表明,近视在城市地区,在专业人士、受过教育的患者、计算机用户、大学生中更为常见,并且与智力提高有关。
19-23
执行需要更多用眼任务的个体(例如显微镜工作者)的近视也会增加。
24
光学散焦和近视之间的关联得到大量动物研究支持,这些研究发现使用漫射器或负透镜的视觉输入退化会导致鱼、鸡、树鼩、猴子、豚鼠和小鼠等多种物种的眼睛过度生长和近视。
25
7.虽然近几十年来近视患病率的增加主要归因于幼儿的近距离用眼的迅速增加,
26
但据估计,遗传因素对近视发展的贡献在60%和80%之间。
27
当父母双方都患有近视时,近视的发生率会增加。
20
大量研究表明,父母的屈光不正是近视发展的最重要预测因素。
28,29
对遗传因素在近视发展中的作用的有力支持也来自比较同卵
30
和双卵双胞胎的研究。
31,32
近视是一种复杂的遗传病,由数百个基因控制;类似于身高和体重。
27,33
遗传研究表明900多个基因与人类近视的发展有关。
27,33
8.因此,已证明环境和遗传因素都促进近视的发展。
10
此外,最近的一项研究证实存在可以调节近视源性(myopiagenic)环境因素对屈光眼发展的影响的基因。
34
基因表达谱分析研究进一步支持近视发展中的基因-环境相互作用,该研究发现近视的发展伴随着眼睛中基因表达的大规模变化,这揭示了近距离用眼激活了眼睛中刺激眼睛过度生长从而导致近视的发展的分子信号传导通路。
33,35-37
数项研究表明,眼睛会对光学散焦的局部变化和生长速率的局部变化做出反应,因此揭示了有关光学散焦的信息在整个视网膜表面汇总,并且整合后的信号调节眼睛的生长。
38,39
重要的是,即使视神经被切断,眼睛也能够对近视源性光学散焦做出反应,
39
这表明调节屈光眼发展的信号传导级联位于眼睛本身,并且不需要来自大脑的反馈。
9.近视似乎在6-16岁之间的易感期期间进展最快,然后开始减慢。
40,41
在前几代人中,人们认为近视进展会在20岁左右结束。然而,由于更多的学生进入研究生院,随后从事需要8小时持续计算机工作的工作,情况发生了变化。
42
这一猜想最近在平均年龄为35岁的大学毕业生的队列中进行了研究。
43
结果发现,在大约10%的长时间在电脑前的队列中出现近视进展。那些没有花时间在电脑前的受试者进展不大。
10.目前批准的近视治疗选项仅限于使用眼镜或接触透镜进行光学矫正。使用单视矫正透镜的光学矫正是近视的最广泛使用的治疗选项,它不能阻止近视进展,也不能预防与该疾病相关的致盲病理并发症。
44,45
数种用于减慢近视进展的基于光学的实验性临床干预,诸如具有双焦透镜、多焦和角膜塑形(ortho-k)接触透镜的眼镜,已显示出一定的前景;然而,这些治疗选项的功效较低。
46
11.具有双焦透镜的眼镜是第一个用于控制近视进展的眼镜。多中心comet研究旨在确定与单视眼镜透镜相比,双焦透镜眼镜是否可以减缓近视的进展,结果表明双焦透镜眼镜在第一年将近视的进展减缓了20%;然而,这种影响在第2-4年显著降低。
47
12.两项独立的元分析分析了角膜塑形透镜减缓近视进展的能力,
48、49
并且发现近视进展可被减少约45%;然而,一项研究发现,当角膜塑形透镜停用时,会出现相当大的反弹效应。
50
13.最近,人们越来越关注使用软性多焦接触透镜来复制角膜塑形镜的光学特性。
51-53
一项包含来自8项研究的587名受试者的元分析发现,同心环和以距离为中心的多焦接触透镜在24个月内将近视进展减慢了30-38%。
54
14.目前可用的近视控制药理学选项基本上仅限于两种药物,阿托品和7-甲基黄嘌呤,它们具有显著的副作用和/或相对较低的功效。
15.阿托品是一种非选择性毒蕈碱拮抗剂,是一种由颠茄(atropa belladonna)产生的生物碱,传统上在眼科实践中用作散瞳和睫状肌麻痹药物。几项临床试验已经评估了不同浓度的阿托品对儿童近视进展的影响以及其对儿童视功能的长期影响。第一项试验,阿托品治疗近视1(atom1),揭示1%阿托品滴眼剂在2年治疗期间可延缓近视进展约76%。
55
然而,随访研究发现,停止治疗导致强烈的反弹效应,导致在停用阿托品后的前12个月内近视进展率比安慰剂增加300%,这消除了大约60%的2年治疗效果。
56
此外,1%阿托品引起不舒服的副作用,如畏光、调节幅度降低和视力模糊。随访试验atom2评估了0.5%、0.1%、和0.01%阿托品对儿童近视进展的影响,发现0.5%阿托品可遏抑近视进展75%,而0.1%和0.01%的阿托品分别延缓了68%和59%的进展。
57
停止治疗导致在停止施用该药物后的前
12个月内,与安慰剂组相比,用0.5%阿托品治疗的组的进展率反弹增加218%,而接受0.1%阿托品治疗的组则增加170%。
58
然而,在接受0.01%阿托品治疗的组中,进展率下降了约30%。
58
最近的5年随访研究证实了这些发现,所述5年随访研究表明较高的初始阿托品剂量使儿童在停止治疗后易发生更大的近视进展,并揭示0.01%阿托品可提供最佳的长期结果,具有大约30%的遏抑作用。
59
最近的一项试验“用于近视控制的低浓度阿托品(lamp)”研究进一步完善了这些发现,该研究揭示低剂量阿托品对近视进展具有剂量依赖性遏抑作用
60
。这项研究发现,0.01%阿托品在1年期间延缓了27%的近视进展,而0.025%和0.05%阿托品分别达到了43%和67%。然而,最近的一项研究发现,在幼年灵长类动物中使用阿托品会对眼部成分的发育和正视化产生长期的不良影响,这使阿托品作为抗近视药物的效用受到质疑。
61
16.7-甲基黄嘌呤(7-mx)是一种非选择性腺苷受体拮抗剂,是咖啡因和可可碱的天然代谢物,咖啡因和可可碱是多种植物产生的两种生物碱,也是可可、咖啡和茶的主要成分。7-mx可能是控制近视的潜在药物的第一个迹象来自一项观察,即7-mx会导致巩膜增厚和巩膜胶原纤维直径增加,
62
即,它会导致巩膜发生与近视眼中观察到的相反的变化。一项小型随访临床试验分析了每天口服400mg(~15mg/kg)7-mx对儿童近视进展的影响,并表明7-mx可以潜在地遏抑近视进展缓慢的受试者的近视约22%,而对进展速度高的受试者的近视进展没有影响。
63
在豚鼠中,300mg/kg剂量的7-mx被证明可遏抑近视49%。
64
同样,30mg/kg剂量的7-mx可使家兔的经诱发的近视的程度降低约67%。
65
来自一项猴子研究的最新数据还揭示,7-mx可以遏抑灵长类动物的近视,但效果在很大程度上取决于特定受试者的遗传背景。
66
因此,初步数据表明7-mx对近视进展缓慢的受试者的近视控制具有治疗潜力,但在人类中的有效剂量和功效问题仍有待澄清。目前尚不清楚儿童每天口服7-mx的安全性谱和长期影响。
17.其他几种化合物也被建议在不同程度上遏抑近视。毒蕈碱受体拮抗剂哌仑西平和喜巴辛被证明可以抑制树鼩、恒河猴和鸡的实验性近视的发展。
67,68
虽然哌仑西平被发现可以遏抑儿童近视的进展40%,但由于严重的副作用,最终停止了临床试验。
69
几种gabab和gabac受体拮抗剂,如(1,2,5,6-四氢吡啶-4基)甲基次膦酸(tpmpa)、cgp46381和(3-氨基环戊基)丁基次膦酸(3-acpbpa)被证明可以遏抑鸡和豚鼠的近视发展。
70-72
进一步地,α-肾上腺素能激动剂,如可乐定和胍法辛,被证明可以抑制实验诱发的鸡近视,
73
而溴莫尼定遏抑鸡
73
和豚鼠的近视。
74
此外,阿扑吗啡是一种多巴胺受体激动剂,被发现可以抑制几种动物模型,诸如鸡、小鼠和非人类灵长类动物的近视发展,
75,76
并且降眼压药物拉坦前列素被发现可以减少豚鼠近视的进展。
77
最后,最近在近视小鼠模型中进行的药物筛选鉴定出了藏花酸是一种潜在的抗近视剂,藏花酸是一种在番红花花和栀子(gardenia jasminoides)果实中发现的天然类胡萝卜素。
78
18.近年来,全世界近视的患病率呈指数级增长,并且在许多国家已达到流行病的比例。预计到2050年近视患病率将增加到世界人口的50%,世界将很快面临视力丧失的公共卫生危机,因为8%的低度至中度近视和29%的高度近视会发展为近视性黄斑变性并失明。
79
目前可用的近视的基于光学的治疗选项功效低下,并且只能减缓近视的进展,而不能阻止它。目前可用的药理学选项具有低功效和/或严重副作用。显然,医疗界迫切需要开发一种这样的用于近视控制的产品,该产品与目前可用的产品相比,可以达到大得多的功效,并且
可以安全地用于儿童。
技术实现要素:
19.本公开提供了一种预防和/或治疗有需要的受试者的近视的方法,该方法通过使用包含利用用于抗近视药物开发的药物基因组学管道(pharmacogenomic pipeline)鉴定的药物化合物或剂的口服组合物、延长药物释放制剂或组合物、延长药物接触递送透镜(extended drug delivery by contact lenses),或滴眼剂来遏抑近视发展的潜在眼部信号传导通路来实现。
20.因此,一个实施方案是一种预防和/或治疗有需要的受试者的近视的方法,其包括向受试者施用治疗有效量的组合物,所述组合物包含使用用于抗近视药物开发的药物基因组学管道鉴定的活性药物化合物。
21.在一个实施方案中,活性药物化合物是具有以下结构的选择性组胺h1-受体拮抗剂盐酸左卡巴斯汀:
[0022][0023]
或其衍生物。
[0024]
在一些实施方案中,本公开提供了预防和/或治疗近视的方法,该方法通过在近视发展的易感期期间向受试者施用治疗有效量的呈口服组合物、延长药物释放制剂或组合物、延长药物接触递送透镜,或滴眼剂的形式的盐酸左卡巴斯汀或其衍生物来实现。
[0025]
在一些实施方案中,本公开提供了预防和/或治疗近视的方法,该方法通过在近视发展的易感期期间向受试者施用重复剂量的治疗有效量的呈口服组合物、延长药物释放制剂或组合物、延长药物接触递送透镜或滴眼剂的形式的盐酸左卡巴斯汀或其衍生物来实现。
[0026]
在进一步的实施方案中,活性药物化合物是选择性组胺h1-受体拮抗剂。
[0027]
在一些实施方案中,选择性组胺h1-受体拮抗剂包括但不限于氮卓斯汀、阿卡他定、安他唑啉、卡比沙明、依匹斯汀、奥洛他定和酮替芬,以及它们的衍生物。
[0028]
因此,在进一步的实施方案中,本公开提供了预防和/或治疗近视的方法,该方法通过在近视发展的易感期期间向受试者施用治疗有效量的呈口服组合物、延长药物释放制剂或组合物、延长药物接触递送透镜或滴眼剂的形式的选择性组胺h1-受体拮抗剂来实现。
[0029]
在一些实施方案中,本公开提供了预防和/或治疗近视的方法,该方法通过在近视发展的易感期期间向受试者施用重复剂量的治疗有效量的呈口服组合物、延长药物释放制剂或组合物、延长药物接触递送透镜或滴眼剂的形式的选择性组胺h1-受体拮抗剂来实现。
[0030]
在一些实施方案中,所述组合物每天一次施用于受试者。在一些实施方案中,所述组合物每周施用一次。在一些实施方案中,所述组合物每周施用两次。在一些实施方案中,所述组合物每周施用三次。在一些实施方案中,所述组合物连续或间歇地施用于受试者约5年至约10年。
[0031]
在一些实施方案中,受试者是年轻的成年人,即30岁以下。在一些实施方案中,受试者是儿童,即18岁以下。在一些实施方案中,受试者为约4岁至约30岁。在一些实施方案中,受试者为约6岁至约20岁。在一些实施方案中,受试者为约8岁至约15岁。在一些实施方案中,受试者为约10岁至约12岁。
[0032]
在一些实施方案中,受试者患有近视。在一些实施方案中,受试者有患近视的风险。在一些实施方案中,受试者易患近视。
[0033]
在一些实施方案中,监测受试者的近视遏抑情况,并根据遏抑程度调整药物化合物的治疗有效量和/或施用频率。可以使用本领域已知的方法监测近视的遏抑。
[0034]
本公开的进一步实施方案是包括用于实施所公开的方法的组合物和剂的药剂盒。
附图说明
[0035]
出于说明本发明的目的,在附图中描绘了本发明的某些实施方案。然而,本发明不限于附图中描绘的实施方案的精确布置和手段。
[0036]
图1小鼠的实验诱发的近视具有人类近视的特征。图1a示出了用-25d透镜诱发近视的小鼠。图1b是示出在用-25d透镜处理21天的小鼠眼部观察到的具有统计学意义的近视屈光偏移的图表。图1c显示小鼠中由透镜诱发的近视与人类近视一样是由于玻璃体腔深度在统计学上显著增加而引起的。图1d示出了功率模拟,该功率模拟展示了用于诱发近视实验的统计功率与动物数目之间的关系。acd,前房深度;crc,角膜曲率半径;lt,透镜厚度;vcd,玻璃体腔深度;od,右(近视)眼;os,左(对照)眼。误差线,sd.p,显著性值。
[0037]
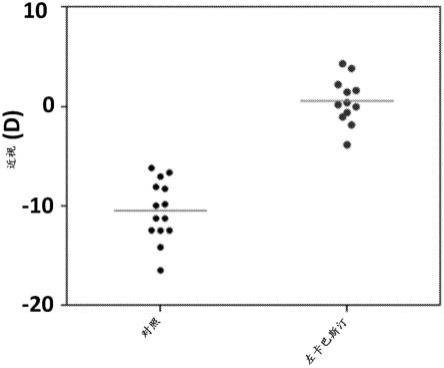
图2显示5mg/kg盐酸左卡巴斯汀的全身施用完全遏抑实验诱发的近视小鼠的近视发展。
具体实施方式
[0038]
定义
[0039]
以下定义和解释意在并旨在在任何构造中具有控制性,除非在以下实例中明确和明白地加以修改或当含义的应用使任何构造无意义或基本上无意义时。在术语的构造使其变得无意义或基本上无意义的情况下,定义应取自韦伯斯特词典(webster's dictionary)或本领域技术人员已知的词典,诸如牛津生物化学和分子生物学词典(oxford dictionary of biochemistry and molecular biology)或类似词典。
[0040]
贯穿本专利说明书引用的任何专利、专利申请和参考文献的内容据此以引用方式全文并入。
[0041]
如本文所用且除非另有说明,术语“一(a,an)”意指“一个/种”、“至少一个/种”或“一个/种或多个/种”。除非上下文另有要求,否则本文所用的单数术语应包括复数并且复数术语应包括单数。
[0042]
术语“近视”或“近视的”是指这样的眼睛疾病状况,其中眼睛的后段对于眼睛的光学功率来说太大并且焦点位于视网膜前方;因此,产生模糊的远视力。
[0043]
术语“远视”或“远视的”是指这样的眼睛状况,其中眼睛的后段对于眼睛的光学功率来说太小并且焦点位于视网膜后面;因此,产生模糊的近视力。
[0044]
术语“负透镜”意指使眼睛的焦点移向眼睛后部,因此使眼睛远视的透镜。
[0045]
术语“遗传网络”意指调节生理或生物过程的相互连接的基因网络。
[0046]
术语“差异表达”意指由环境因素、遗传背景变化或其他内部或外部侵害或影响诱发的基因表达水平的变化。
[0047]
术语“实验诱发的近视”在本文用来描述通过实验操作(诸如在眼睛上施加负透镜)在动物模型中诱发的近视。
[0048]
术语“全基因组基因表达谱分析”是指在整个基因组水平上分析差异基因表达,因此提供关于由基因组编码的所有基因的表达的信息的方法。
[0049]
术语“基于基因的全基因组关联研究”是指一项遗传学研究,该研究在先前被其他实验方法(诸如全基因组基因表达谱分析)发现参与疾病过程的特定基因的水平上分析基因组中的遗传变异与疾病之间的统计关联。
[0050]
术语“正光学散焦’是指眼睛的焦点位于视网膜前方的状况。
[0051]
术语“负光学散焦”是指眼睛的焦点位于视网膜后面的状况。
[0052]
术语“衍生物”是指通过化学反应衍生自化合物的化合物的结构类似物。结构类似物是具有与另一种化合物的结构相似的结构,但在某些组分方面与另一种化合物有所不同的化合物。它可以在一个或多个原子、官能团或亚结构上不同,该一个或多个原子、官能团或亚结构被其他原子、基团或亚结构取代。结构类似物还可以在被添加到另一种化合物或从另一种化合物中减去的一个或多个原子、官能团或亚结构上不同于另一种化合物。至少在理论上,本领域技术人员可以设想从其他化合物形成结构类似物。
[0053]
如本技术中所用的术语“患者”意指人受试者。在本发明的一些实施方案中,“受试者”患有近视、有患近视风险或易患近视。
[0054]
术语“治疗(treat,treatment)”等是指在疾病发作后减缓、缓解、改善或缓和疾病的症状中的至少一种症状或者逆转疾病的手段。
[0055]
术语“预防(prevent,prevention)”等指的是在明显的疾病发作之前采取行动,以预防疾病发展或使疾病的程度最小化或减缓疾病的发展过程。
[0056]
术语“有需要”是指已知患有或怀疑患有近视的受试者。
[0057]
需要治疗的受试者将是已经患上所述疾病或病状的受试者。需要预防的受试者将是具有疾病或病状的风险因素的受试者。
[0058]
如本文所用的术语“剂”意指产生或能够产生作用的物质,并且将包括但不限于化学物质、药物、生物制剂、小有机分子、抗体、核酸、肽和蛋白质。
[0059]
短语“治疗有效量”在本文中用于意指足以导致受试者的临床上显著的病状的改善,或者延迟或最小化或减轻一种或多种与所述疾病相关的症状,或在受试者中产生所需有益生理变化的量。
[0060]
使用药物基因组学管道鉴定抗近视药物
[0061]
本文示出了使用由发明人开发的药物基因组学管道来鉴定能够遏抑近视发展的药物化合物的结果。
80
使用系统遗传学方法来鉴定屈光眼发展和近视发展的潜在基因、遗传网络和信号传导通路。系统遗传学方法包括使用全基因组基因表达谱分析鉴定患有实验诱发的近视的动物眼睛中差异表达的基因,以及使用基于基因的全基因组关联研究鉴定与人类近视相关的基因。发明人的一项研究发现,眼睛对正光学散焦(其遏抑近视)和负光学散焦(其促进近视发展)的反应的潜在信号传导通路经由两个在很大程度上截然不同的信号
传导级联传播,如美国临时申请号62/730,301中所述。
[0062]
发明人将这一观察扩展到几种脊椎动物物种,并证明了近视发展的潜在信号传导级联在包括人类在内的脊椎动物物种之间是高度进化保守的。发明人随后使用了他们的描述在tkatchenko等人2019,
81
中的庞大的近视相关基因数据集(其包括超过3,500个基因)和计算工具重建控制近视发展的遗传网络,并鉴定可以遏抑促进近视发展的信号传导通路并且刺激抑制近视发展的通路的药物化合物。
[0063]
共鉴定出138种具有抗近视潜力的药物化合物。使用基因通路和z分数,这些药物化合物基于它们的预测的遏抑近视的潜力和已知或预测的副作用被分配到前10、前20、前40、前80和低优先级类别。然后在近视小鼠模型上测试这些药物化合物(实施例1)。
[0064]
用于使用选择性组胺h1-受体拮抗剂左卡巴斯汀及其衍生物预防和/或治疗近视的方法和组合物
[0065]
本公开在一些方面提供了预防和/或治疗近视的方法,其包括向有需要的受试者施用治疗有效量的盐酸左卡巴斯汀或其衍生物。
[0066]
在某些实施方案中,盐酸左卡巴斯汀或衍生物是全身施用的。在某些实施方案中,盐酸左卡巴斯汀或衍生物是口服施用的。在某些实施方案中,盐酸左卡巴斯汀或衍生物是局部施用的。在一些实施方案中,盐酸左卡巴斯汀或衍生物被直接施用至眼或者施用至眼中。在一些实施方案中,盐酸左卡巴斯汀或衍生物是经由注射施用。在其他实施方案中,盐酸左卡巴斯汀或衍生物是作为延长药物释放制剂或组合物、延长药物接触递送透镜或滴眼剂施用。
[0067]
在某些实施方案中,盐酸左卡巴斯汀直接用作药物中的活性成分。在其他实施方案中,可以对盐酸左卡巴斯汀进行化学改性以提高其功效、减少副作用、提高通过眼部组织的穿透性、增加稳定性或提高生物利用度。
[0068]
在某些实施方案中,盐酸左卡巴斯汀(或其衍生物)是药物的唯一组分。在其他实施方案中,本文所述的方法和组合物包括使用包含盐酸左卡巴斯汀(或其衍生物)的药物制剂。
[0069]
术语“药物制剂”是指包含盐酸左卡巴斯汀(或其衍生物)和另外的成分(诸如其他能够遏抑近视的药物)或赋形剂(媒介物、添加剂、防腐剂、缓冲剂)的制备物,所述赋形剂可以合理地施用至受试者以改善一种或多种活性成分的功效或增加一种或多种活性成分的稳定性。如果一种或多种活性成分在室温(15-30℃)下至少一周,或在2-8℃下3个月至1年基本上保留它们的物理特性和/或化学特性和/或生物活性,则制剂是稳定的。
[0070]
如果在目视检查颜色和/或清晰度时或者如通过光散射或其他合适的本领域认可的方法所测量,盐酸左卡巴斯汀(或其衍生物)满足规定的降解和/或聚集和/或沉淀的规范,则认为它在药物制剂中保留了它的物理特性。
[0071]
如果盐酸左卡巴斯汀(或其衍生物)含量在药物制剂被制备时的量的约90%以内,则认为该活性成分在药物制剂中保留了它的化学稳定性。一些类型的化学降解包括氧化和水解,这可以例如通过基于lc-ms/ms的方法评估。
[0072]
如果在给定时间时盐酸左卡巴斯汀(或其衍生物)在如例如通过体内测试确定的在药物制剂被制备时表现出的生物活性的约90%以内,则认为该活性成分在药物制剂中保留了它的生物稳定性。
[0073]
在本公开的上下文中,盐酸左卡巴斯汀(或其衍生物)的治疗有效剂量是足以至少部分预防和/或治疗近视的量。如果治疗有效剂量甚至可以使与疾病相关的症状或病状产生递增的变化,那么治疗有效剂量就足够了。治疗有效剂量不必完全治愈疾病或完全消除症状。优选地,治疗有效剂量可以显著减缓患有近视的受试者的近视进展。对这种用途有效的药物施用剂量和频率将取决于疾病的严重程度(即,低度进展性近视还是高度进展性近视)、近视类型(即,综合征性近视还是普通近视)、受试者年龄、受试者体重和施用途径等因素。可以使用在验光和眼科实践中充分理解和常用的现有技术来调整药物施用的剂量和频率。
[0074]
本文所述的盐酸左卡巴斯汀可与其他剂共同施用,该其他剂包括用于预防和/或治疗近视的另外的剂。剂的共同施用可以通过本文所述的任何施用进行。此外,所述另外的剂可以与盐酸左卡巴斯汀在同一组合物中。所述另外的剂可以与盐酸左卡巴斯汀在不同的组合物中。多于一种组合物的施用可以是同时施用、并行施用或依序施用。
[0075]
本公开在一些方面还提供了预防和/或治疗近视的方法,其包括向有需要的受试者施用治疗有效量的选择性组胺h1受体拮抗剂。
[0076]
在一些实施方案中,选择性组胺h1-受体拮抗剂包括但不限于氮卓斯汀、阿卡他定、安他唑啉、卡比沙明、依匹斯汀、奥洛他定、酮替芬,或它们的衍生物。
[0077]
在某些实施方案中,选择性组胺h1-受体拮抗剂是全身施用的。在某些实施方案中,选择性组胺h1-受体拮抗剂是口服施用的。在某些实施方案中,选择性组胺h1-受体拮抗剂是局部施用的。在一些实施方案中,选择性组胺h1-受体拮抗剂是直接施用至眼或施用至眼中。在一些实施方案中,选择性组胺h1-受体拮抗剂是经由注射施用。在其他实施方案中,选择性组胺h1-受体拮抗剂是作为延长药物释放制剂或组合物、延长药物接触递送透镜或滴眼剂施用。
[0078]
在进一步的实施方案中,选择性组胺h1-受体拮抗剂直接用作药物中的活性成分。在其他实施方案中,可以对选择性组胺h1-受体拮抗剂进行化学改性以提高其功效、减少副作用、提高通过眼部组织的穿透性、增加稳定性或提高生物利用度。
[0079]
在某些实施方案中,选择性组胺h1-受体拮抗剂是药物的唯一组分。在其他实施方案中,本文所述的方法和组合物包括使用包含选择性组胺h1-受体拮抗剂的药物制剂。
[0080]
术语“药物制剂”是指包含选择性组胺h1-受体拮抗剂和另外的成分(诸如其他能够遏抑近视的药物)或赋形剂(媒介物、添加剂、防腐剂、缓冲剂)的制备物,所述赋形剂可以合理地施用至受试者以改善一种或多种活性成分的功效或增加一种或多种活性成分的稳定性。如果一种或多种活性成分在室温(15-30℃)下至少一周,或在2-8℃下3个月至1年基本上保留它们的物理特性和/或化学特性和/或生物活性,则制剂是稳定的。
[0081]
如果在目视检查颜色和/或清晰度时或者如通过光散射或其他合适的本领域认可的方法所测量,选择性组胺h1-受体拮抗剂满足规定的降解和/或聚集和/或沉淀的规范,则认为它在药物制剂中保留了它的物理特性。
[0082]
如果选择性组胺h1-受体拮抗剂含量在药物制剂被制备时的量的约90%以内,则认为该活性成分在药物制剂中保留了它的化学稳定性。一些类型的化学降解包括氧化和水解,这可以例如通过基于lc-ms/ms的方法评估。
[0083]
如果在给定时间时选择性组胺h1-受体拮抗剂在如例如通过体内测试确定的在药
物制剂被制备时表现出的生物活性的约90%以内,则认为该活性成分在药物制剂中保留了它的生物稳定性。
[0084]
在本公开的上下文中,选择性组胺h1-受体拮抗剂的治疗有效剂量是足以至少部分预防和/或治疗近视的量。如果治疗有效剂量甚至可以使与疾病相关的症状或病状产生递增的变化,那么治疗有效剂量就足够了。治疗有效剂量不必完全治愈疾病或完全消除症状。优选地,治疗有效剂量可以显著减缓患有近视的受试者的近视进展。对这种用途有效的药物施用剂量和频率将取决于疾病的严重程度(即,低度进展性近视还是高度进展性近视)、近视类型(即,综合征性近视还是普通近视)、受试者年龄、受试者体重和施用途径等因素。可以使用在验光和眼科实践中充分理解和常用的现有技术来调整药物施用的剂量和频率。
[0085]
本文所述的选择性组胺h1-受体拮抗剂可与其他剂共同施用,该其他剂包括用于预防和/或治疗近视的另外的剂。剂的共同施用可以通过本文所述的任何施用进行。此外,另外的剂可以与选择性组胺h1-受体拮抗剂在同一组合物中。所述另外的剂可以与选择性组胺h1-受体拮抗剂在不同的组合物中。多于一种组合物的施用可以是同时施用、并行施用或依序施用。
[0086]
药物的口服组合物可为胶囊、片剂、粉剂、颗粒剂、溶液、糖浆、混悬液(于非水性或水性液体中)或乳状液形式。片剂或硬质明胶胶囊可包含乳糖、淀粉或其衍生物、硬脂酸镁、糖精钠、纤维素、碳酸镁、硬脂酸或其盐。软质明胶胶囊可包含植物油、蜡、脂肪、半固体或液体多元醇。溶液和糖浆可包含水、多元醇和糖。意图用于口服施用的活性剂可用使活性剂在胃肠道中的崩解和/或吸收延迟的物质包覆或与所述物质掺混。因此,可历经许多小时实现持续释放,并且如果必要,那么活性剂可被保护以免遭在胃内的降解。用于口服施用的药物组合物可被配制成促进活性剂由于特定ph或酶条件而在特定胃肠位置处释放。
[0087]
应当理解,除了上面特别提到的成分之外,所述组合物还可以包含本领域中考虑到所讨论的制剂的类型的其他常规剂,例如适合于口服施用的那些可以包含调味剂。
[0088]
延长药物释放制剂或组合物可以是纳米海绵、贴剂、凝胶或其他能够在延长的时间段内逐渐释放药物的装置的形式,其被注射到眼睛的前段或后段或者被施用或施加到眼睛的前表面或后表面。
[0089]
延长药物接触递送透镜可以是平光接触透镜、单视矫正接触透镜或多焦接触透镜的形式,其中透镜的内表面涂有药物,或透镜的整个体积都加载有药物。
[0090]
滴眼剂可以是本领域技术人员熟知和常用的传统滴眼剂的形式,或者是将严格控制量的药物递送至眼睛的微剂量给药装置的形式。
[0091]
在一些实施方案中,所述组合物每天一次施用于受试者。在一些实施方案中,所述组合物每周施用一次。在一些实施方案中,所述组合物每周施用两次。在一些实施方案中,所述组合物每周施用三次。在一些实施方案中,所述组合物连续或间歇地施用于受试者约5年至约10年。
[0092]
在一些实施方案中,所述组合物施用多于一次。
[0093]
使用本发明的方法和组合物的治疗可以根据需要持续进行。
[0094]
在一个实施方案中,每3-6个月评估一次治疗对患有近视的受试者的功效,并且根据近视遏抑程度调整药物施用的剂量和/或频率。一旦受试者没有表现出任何进一步的近
视进展,就停止治疗,这可以通过暂时停止治疗并使用验光和眼科实践中众所周知的现有技术测量1-6个月内屈光不正的变化来评估。
[0095]
在一些实施方案中,受试者是儿童,即18岁以下。在一些实施方案中,受试者是年轻的成年人,即30岁以下。在一些实施方案中,受试者为约4岁至约30岁。在一些实施方案中,受试者为约6岁至约20岁。在一些实施方案中,受试者为约8岁至约15岁。在一些实施方案中,受试者为约10岁至约12岁。
[0096]
在一些实施方案中,受试者患有近视。在一些实施方案中,受试者有患近视的风险。在一些实施方案中,受试者易患近视。
[0097]
近视的风险因素包括但不限于父母中有一位或多位患有近视。
[0098]
药剂盒
[0099]
同样在本公开的范围内的是用于实施所公开的方法的药剂盒。
[0100]
在一些实施方案中,药剂盒可包括针对在本文所述的任何方法中的使用的说明。所包括的说明可以包含对将剂施用至受试者以在受试者中实现预期活性的描述。药剂盒还可以包括基于鉴定受试者是否需要治疗来选择适合于治疗的受试者的描述。
[0101]
与本文描述的药物的使用有关的说明通常包括有关预期治疗的剂量、给药方案和施用途径的信息。容器可以是单位剂量、散装包装(例如,多剂量包装)或亚单位剂量。本公开的药剂盒中提供的说明通常是标签或包装插页上的书面说明。标签或包装插页指示所述药物组合物用于治疗受试者的疾病或病症、延迟受试者的疾病或病症的发作,和/或缓和受试者的疾病或病症。
[0102]
本文提供的药剂盒处在合适的包装中。合适的包装包括但不限于小瓶、瓶子、广口瓶、软包装等。
[0103]
药剂盒可以任选地提供另外的组分,诸如缓冲液和解释信息。通常,药剂盒包括容器和在所述容器上或与所述容器相关联的标签或一个或多个包装插页。在一些实施方案中,本公开提供了包含上述药剂盒的内容物的制品。
[0104]
实施例
[0105]
纳入以下实施例是为了展示本发明的优选实施方案。鉴于本公开,本领域技术人员应理解,在不脱离本发明的精神和范围的情况下可对公开的具体实施方案进行许多改变并且仍可获得相同或相似的结果。
[0106]
实施例1.使用负眼镜透镜可以在哺乳动物中诱发近视
[0107]
在24天龄的c57bl/6j(b6)小鼠中,通过将-25屈光度(d)透镜放置在右眼上方的塑料3d打印框架中来诱发近视。对侧眼用作对照。小鼠佩戴着透镜被饲养3周。3周后,取下透镜,比较经透镜处理的眼和对侧对照眼的屈光不正。相对于对照眼(平均屈光不正=+0.6
±
0.6d),透镜处理在经透镜处理的眼中产生了近视(平均屈光不正=-14.6
±
0.3d)(图1);屈光不正的眼间差异(-15.2
±
0.7d)非常显著(p《0.0001)。高分辨率mri显示经处理的眼睛的眼睛和玻璃体腔扩大。经透镜处理的眼睛的直径比对照对侧眼平均要大65
±
8μm(p《0.0001;图1c),经透镜处理的眼睛的玻璃体腔深度比对照对侧眼长61
±
4μm(p《0.0001;图1d)。在前房深度、角膜曲率半径和晶状体厚度方面没有观察到明显的眼间差异(图1d),这表明用负透镜处理的小鼠眼中诱发的变化类似于人类的近视主要局限于眼睛的后段。统计功率分析表明,在22只小鼠的样本量下,可以用90%的统计功率鉴定眼睛之间小至0.5屈光
度的屈光不正差异。
[0108]
实施例2.左卡巴斯汀遏抑患有经透镜诱发的近视的受试者的近视
[0109]
使用用于开发抗近视药物的药物基因组管道,将盐酸左卡巴斯汀鉴定为前10名候选药物之一。发现盐酸左卡巴斯汀的全身性口服施用将近视遏抑了》100%。
[0110]
b6小鼠的实验组在被饲养时右眼上方具有-25d透镜(如实例1中所述),以补充有5mg/kg左眼盐酸左卡巴斯汀的饮食被饲养3周,而b6小鼠的对照组在右眼上方具有-25d透镜,按常规无药物饮食饲养。在透镜处理3周后,左卡巴斯汀治疗动物的经透镜处理眼和对照眼之间屈光不正的眼间差异为+0.55
±
2.32d,而在对照组中为-10.47
±
3.02d,p值=2.83
×
10-10
。参见图2。
[0111]
参考文献
[0112]
1.kempen jh,mitchell p,lee ke,et al.the prevalence of refractive errors among adults in the united states,western europe,and australia.arch ophthalmol 2004;122:495-505.
[0113]
2.vitale s,sperduto rd,ferris fl,3rd.increased prevalence of myopia in the united states between 1971-1972 and 1999-2004.arch ophthalmol 2009;127:1632-1639.
[0114]
3.lin ll,shih yf,hsiao ck,chen cj.prevalence of myopia in taiwanese schoolchildren:1983 to 2000.ann acad med singapore 2004;33:27-33.
[0115]
4.holden ba,fricke tr,wilson da,et al.global prevalence of myopia and high myopia and temporal trends from 2000 through 2050.ophthalmology 2016;123:1036-1042.
[0116]
5.saw sm,gazzard g,shih-yen ec,chua wh.myopia and associated pathological complications.ophthalmic physiol opt 2005;25:381-391.
[0117]
6.verhoeven vj,wong kt,buitendijk gh,hofman a,vingerling jr,klaver cc.visual consequences of refractive errors in the general population.ophthalmology 2015;122:101-109.
[0118]
7.qiu m,wang sy,singh k,lin sc.association between myopia and glaucoma in the united states population,invest ophthalmol vis sci 2013;54:830-835.
[0119]
8.praveen mr,vasavada ar,jani ud,trivedi rh,choudhary pk.prevalence of cataract type in relation to axial length in subjects with high myopia and emmetropia in an indian population.am j ophthalmol 2008;145:176-181.
[0120]
9.pizzarello l,abiose a,ffytche t,et al.vision 2020:the right to sight:a global initiative to eliminate avoidable blindness.arch ophthalmol 2004;122:615-620.
[0121]
10.wojciechowski r.nature and nurture:the complex genetics of myopia and refractive error.clin genet 2011;79:301-320.
[0122]
11.parssinen o,lyyra al.myopia and myopic progression among schoolchildren:a three-year follow-up study.invest ophthalmol vis sci 1993;
and axial length:the genes in myopia(gem)twin study.invest ophthalmol vis sci 2008;49:4336-4339.
[0140]
29.jones-jordan la,sinnott lt,manny re,et al.early childhood refractive error and parental history of myopia as predictors of myopia.invest ophthalmol vis sci 2010;51:115-121.
[0141]
30.dirani m,shekar sn,baird pn.adult-onset myopia:the genes in myopia(gem)twin study.invest ophthalmol vis sci 2008;49:3324-3327.
[0142]
31.tsai my,lin ll,lee v,chen cj,shih yf.estimation of heritability in myopic twin studies.japanese journal of ophthalmology 2009;53:615-622.
[0143]
32.lyhne n,sjolie ak,kyvik ko,green a.the importance of genes and environment for ocular refraction and its determiners:a population based study among 20-45 year old twins.br j ophthalmol 2001;85:1470-1476.
[0144]
33.tkatchenko tv,shah rl,nagasaki t,tkatchenko av.analysis of genetic networks regulating refractive eye development in collaborative cross progenitor strain mice reveals new genes and pathways underlying human myopia.bmc med genomics 2019;12:113.
[0145]
34.tkatchcnko av,tkatchenko tv,guggenheim ja,et al.aplp2 regulates refractive error and myopia development in mice and humans.plos genet 2015;11:e1005432.
[0146]
35.shelton l,troilo d,lerner mr,gusev y,brackett dj,rada js.microarray analysis of choroid/rpe gene expression in marmoset eyes undergoing changes in ocular growth and refraction.mol vis 2008;14:1465-1479.
[0147]
36.tkatchenko av,walsh pa,tkatchenko tv,gustincich s,raviola e.form deprivation modulates retinal neurogenesis in primate experimental myopia.proc natl acad sci u s a 2006;103:4681-4686.
[0148]
37.tkatchenko tv,troilo d,benavente-perez a,tkatchenko av.gene expression in response to optical defocus of opposite signs reveals bidirectional mechanism of visually guided eye growth.plos biology 2018;16:e2006021.
[0149]
38.smith el,3rd.prentice award lecture 2010:a case for peripheral optical treatment strategies for myopia.optom vis sci 2011;88:1029-1044.
[0150]
39.troilo d,gottlieb md,wallman j.visual deprivation causes myopia in chicks with optic nerve section.curr eye res 1987;6:993-999.
[0151]
40.fan ds,lam ds,lam rf,et al.prevalence,incidence,and progression of myopia of school children in hong kong.invest ophthalmol vis sci 2004;45:1071-1075.
[0152]
41.donovan l,sankaridurg p,ho a,naduvilath t,smith el,3rd,holden ba.myopia progression rates in urban children wearing single-vision spectacles.optom vis sci 2012;89:27-32.
atropine.ophthalmology 2009;116:572-579.
[0168]
57.chia a,chua wh,cheung yb,et al.atropine for the treatment of childhood myopia:safety and efficacy of 0.5%,0.1%,and 0.01%doses(atropine for the treatment of myopia 2).ophthalmology 2012;119:347-354.
[0169]
58.chia a,chua wh,wen l,fong a,goon yy,tan d.atropine for the treatment of childhood myopia:changes after stopping atropine 0.01%,0.1%and 0.5%.am j ophthalmol 2014;157:451-457 e451.
[0170]
59.chia a,lu qs,tan d.five-year clinical trial on atropine for the treatment of myopia 2:myopia control with atropine 0.01% eyedrops.ophthalmology 2016;123:391-399.
[0171]
60.yam jc,jiang y,tang sm,et al.low-concentration atropine for myopia progression(lamp)study:a randomized,double-blinded,placebo-controlled trial of 0.05%,0.025%,and 0.01% atropine eye drops in myopia control.ophthalmology 2019;126:113-124.
[0172]
61.whatham ar,lunn d,judge sj.effects of monocular atropinization on refractive error and eye growth in infant new world monkeys.invest ophthalmol vis sci 2019;60:2623-2630.
[0173]
62.trier k,olsen eb,kobayashi t,ribel-madsen sm.biochemical and ultrastructural changes in rabbit sclera after treatment with 7-methylxanthine,theobromine,acetazolamide,or l-ornithine.br j ophthalmol 1999;83:1370-1375.
[0174]
63.trier k,munk ribel-madsen s,cui d,brogger christensen s.systemic 7-methylxanthine in retarding axial eye growth and myopia progression:a 36-month pilot study.j ocul biol dis infor 2008;1:85-93.
[0175]
64.cui d,trier k,zeng j,et al.effects of 7-methylxanthine on the sclera in form deprivation myopia in guinea pigs.acta ophthalmol 2011;89:328-334.
[0176]
65.nie hh,huo lj,yang x,et al.effects of 7-methylxanthinc on form-deprivation myopia in pigmented rabbits.international journal of ophthalmology 2012;5:133-137.
[0177]
66.hung lf,arumugam b,ostrin l,et al.the adenosine receptor antagonist,7-methylxanthine,alters emmetropizing responses in infant macaques.invest ophthalmol vis sci 2018;59:472-486.
[0178]
67.cottriall cl,mcbrien na.the m1 muscarinic antagonist pirenzepine reduces myopia and eye enlargement in the tree shrew.invest ophthalmol vis sci 1996;37:1368-1379.
[0179]
68.cottriall cl,truong ht,mcbrien na.inhibition of myopia development in chicks using himbacine:a role for m(4)receptors?neuroreport 2001;12:2453-2456.
[0180]
69.siatkowski rm,cotter sa,crockett rs,et al.two-year multicenter,randomized,double-masked,placebo-controlled,parallel safety and efficacy study of 2%pirenzepine ophthalmic gel in children with myopia.journal of aapos:the official publication of the american association for pediatric ophthalmology and strabismus/american association for pediatric ophthalmology and strabismus 2008;12:332-339.
[0181]
70.stone ra,liu j,sugimoto r,capehart c,zhu x,pendrak k.gaba,experimental myopia,and ocular growth in chick.invest ophthalmol vis sci 2003;44:3933-3946.
[0182]
71.cheng zy,wang xp,schmid kl,han xg.inhibition of form-deprivation myopia by a gabaaor receptor antagonist,(1,2,5,6-tetrahydropyridin-4-yl)methylphosphinic acid(tpmpa),in guinea pigs.graefes arch clin exp ophthalmol 2014;252:1939-1946.
[0183]
72.cheng zy,wang xp,schmid kl,et al.gabab receptor antagonist cgp46381 inhibits form-deprivation myopia development in guinea pigs.biomed research international 2015;2015:207312.
[0184]
73.carr bj,nguyen ct,stell wk.alpha2-adrenoceptor agonists inhibit form-deprivation myopia in the chick.clin exp optom 2019;102:418-425.
[0185]
74.liu y,wang y,lv h,jiang x,zhang m,li x.alpha-adrenergic agonist brimonidine control of experimentally induced myopia in guinea pigs:a pilot study.mol vis 2017;23:785-798.
[0186]
75.iuvone pm,tigges m,stone ra,lambert s,laties am.effects of apomorphine,a dopamine receptor agonist,on ocular refraction and axial elongation in a primate model of myopia.invest ophthalmol vis sci 1991;32:1674-1677.
[0187]
76.yan t,xiong w,huang f,et al.daily injection but not continuous infusion of apomorphine inhibits form-deprivation myopia in mice.invest ophthalmol vis sci 2015;56:2475-2485.
[0188]
77.el-nimri nw,wildsoet cf.effects of topical latanoprost on intraocular pressure and myopia progression in young guinea pigs.invest ophthalmol vis sci 2018;59:2644-2651.
[0189]
78.mori k,kurihara t,miyauchi m,et al.oral crocetin administration suppressed refractive shift and axial elongation in a murine model of lens-induced myopia.sci rep 2019;9:295.
[0190]
79.wong yl,sabanayagam c,ding y,et al.prevalence,risk factors,and impact of myopic macular degeneration on visual impairment and functioning among adults in singapore.invest ophthalmol vis sci 2018;59:4603-4613.
[0191]
80.tkatchenko tv,tkatchenko av.pharmacogenomic approach to antimyopia drug development:pathways lead the way.trends pharmacol sci 2019;40:834-853.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1