用于治疗丁型肝炎病毒感染的组合物和方法与流程
本公开一般涉及包含rna干扰(rnai)组分和/或抗hbv剂和/或抗hdv剂,更特别是抗hbv剂的组合物和试剂盒,其中所述hbv剂是核苷(酸)类似物(nuc)或干扰素(ifn),以及它们在治疗丁型肝炎病毒感染中的用途。
背景技术:
1、丁型肝炎病毒(hdv)是一种小型球形病毒。它具有包含三种乙型肝炎病毒(hbv)包膜蛋白(即,大、中和小乙型肝炎表面抗原)和宿主脂质的外壳,围绕着内部核衣壳。核衣壳包含单链、环状rna和每个基因组约200个分子丁型肝炎抗原(hdag)。已证明hdag的中心区域结合rna。一些相互作用还由hdag氨基-末端的卷曲螺旋区域介导。
2、丁型肝炎环状基因组在动物病毒中是独特的,因为它的gc核苷酸含量很高。hdv基因组以反义、单链、闭合环状rna的形式存在。核苷酸序列是70%自互补的,允许基因组形成部分双链、棒状rna结构。hdv的基因组有大约1700个核苷酸,是已知感染动物的最小病毒。
3、感染hdv导致慢性肝病,目前尚无批准的有效治疗方法。hdv感染只发生在与hbv共感染的情况下,因为hdv需要hbsag的存在以形成感染性病毒颗粒。
4、共感染hbv和hdv的患者有很高的医疗需求尚未得到满足,因为共感染与肝硬化的早期发展、肝细胞癌(hcc)发展的风险增加以及肝脏相关和总体死亡率的增加有关。目前,还没有批准用于治疗慢性hdv感染的药物。目前可用的丁型肝炎治疗方案是次优的,未经治疗的患者疾病进展迅速。
5、本文提到的所有出版物、专利、专利申请和已公布的专利申请的公开内容均整体援引加入本文。
技术实现思路
1、本文提供一种治疗有此需要的受试者,优选有此需要的人受试者的治疗丁型肝炎病毒(hdv)感染的方法,其中所述方法包括向所述受试者给药有效量的包含rnai组分的药物组合物,所述rnai组分具有:
2、(i)第一rnai剂,其包含:
3、反义链,其包含以下任一个的核苷酸序列:seq id no:1、seq id no:2、seq idno:3、seq id no:4、seq id no:5、seq id no:6和seq id no:7,以及
4、正义链,其包含以下任一个的核苷酸序列:seq id no:10、seq id no:11、seq idno:12、seq id no:13、seq id no:14和seq id no:15;以及
5、(ii)第二rnai剂,其包含:
6、反义链,其包含以下任一个的核苷酸序列:seq id no:8和seq id no:9,以及
7、正义链,其包含以下任一个的核苷酸序列:seq id no:16、seq id no:17、seq idno:18和seq id no:19,
8、其中所述rnai组分通过静脉内或皮下注射向受试者给药。
9、在某些实施方案中,rnai组分每月给药一次(或q4w)、每两个月给药一次(或q8w)或每三个月给药一次(或q12w),更特别是每月一次。在某些实施方案中,rnai组分以约40-200mg的剂量给药,更特别是100mg、150mg或200mg,更特别是100mg。
10、本文还提供一种药物组合物,其用于治疗有此需要的受试者,优选有此需要的人受试者的丁型肝炎病毒感染,其中所述药物组合物包含有效量的rnai组分,其中所述rnai组分包含:
11、(i)第一rnai剂,其包含:
12、反义链,其包含以下任一个的核苷酸序列:seq id no:1、seq id no:2、seq idno:3、seq id no:4、seq id no:5、seq id no:6和seq id no:7,以及
13、正义链,其包含以下任一个的核苷酸序列:seq id no:10、seq id no:11、seq idno:12、seq id no:13、seq id no:14和seq id no:15;以及
14、(ii)第二rnai剂,其包含:
15、反义链,其包含以下任一个的核苷酸序列:seq id no:8和seq id no:9,以及
16、正义链,其包含以下任一个的核苷酸序列:seq id no:16、seq id no:17、seq idno:18和seq id no:19,
17、其中所述rnai组分配制为通过静脉内或皮下注射向受试者给药。
18、在某些实施方案中,rnai组分配制为每月给药一次(或q4w)、每两个月给药一次(或q8w)或每三个月给药一次(或q12w),更特别是每月一次。在某些实施方案中,rnai组分以约40-200mg的剂量给药,更特别是100mg、150mg或200mg,更特别是100mg。
19、本技术的另一个一般方面涉及一种组合或试剂盒,其包含:
20、(1)药物组合物,其包含有效量的rnai组分,所述rnai组分具有:
21、(i)第一rnai剂,其包含:
22、反义链,其包含以下任一个的核苷酸序列:seq id no:1、seq id no:2、seq idno:3、seq id no:4、seq id no:5、seq id no:6和seq id no:7,以及
23、正义链,其包含以下任一个的核苷酸序列:seq id no:10、seq id no:11、seq idno:12、seq id no:13、seq id no:14和seq id no:15;以及
24、(ii)第二rnai剂,其包含:
25、反义链,其包含以下任一个的核苷酸序列:seq id no:8和seq id no:9,以及
26、正义链,其包含以下任一个的核苷酸序列:seq id no:16、seq id no:17、seq idno:18和seq id no:19;以及
27、(2)一种药物组合物,其包含有效量的抗hbv剂和/或抗hdv剂,更特别是抗hbv剂,其中所述抗hbv剂是核苷(酸)类似物(nuc)或干扰素(ifn),
28、其中所述组合或试剂盒用于治疗有此需要的受试者,优选有此需要的人受试者的丁型肝炎病毒(hdv)感染。
29、本技术的另一个一般方面涉及一种组合或试剂盒,其包含:
30、(1)药物组合物,其包含有效量的rnai组分,所述rnai组分具有:
31、(i)第一rnai剂,其包含:
32、反义链,其包含以下任一个的核苷酸序列:seq id no:1、seq id no:2、seq idno:3、seq id no:4、seq id no:5、seq id no:6和seq id no:7,以及
33、正义链,其包含以下任一个的核苷酸序列:seq id no:10、seq id no:11、seq idno:12、seq id no:13、seq id no:14和seq id no:15;以及
34、(ii)第二rnai剂,其包含:
35、反义链,其包含以下任一个的核苷酸序列:seq id no:8和seq id no:9,以及
36、正义链,其包含以下任一个的核苷酸序列:seq id no:16、seq id no:17、seq idno:18和seq id no:19;以及
37、(2)药物组合物,其包含有效量的抗hbv剂和/或抗hdv剂,更特别是抗hdv剂,其中所述抗hdv剂是hdv进入抑制剂和/或法尼基转移酶抑制剂,
38、其中所述组合或试剂盒用于治疗有此需要的受试者,优选有此需要的人受试者的丁型肝炎病毒(hdv)感染。
39、本文还提供有效量的rnai组分和任选存在的抗hbv剂和/或抗hdv剂,更特别是任选存在的抗hbv剂,其中所述抗hbv剂是核苷(酸)类似物(nuc)或干扰素(ifn),用于制备用于治疗有此需要的受试者,特别是有此需要的人受试者的丁型肝炎病毒(hdv)感染的药物,其中:
40、(a)所述rnai组分包含:
41、(i)第一rnai剂,其包含:
42、反义链,其包含以下任一个的核苷酸序列:seq id no:1、seq id no:2、seq idno:3、seq id no:4、seq id no:5、seq id no:6和seq id no:7,以及
43、正义链,其包含以下任一个的核苷酸序列:seq id no:10、seq id no:11、seq idno:12、seq id no:13、seq id no:14和seq id no:15;以及
44、(ii)第二rnai剂,其包含:
45、反义链,其包含以下任一个的核苷酸序列:seq id no:8和seq id no:9,以及
46、正义链,其包含以下任一个的核苷酸序列:seq id no:16、seq id no:17、seq idno:18和seq id no:19;以及
47、(b)所述核苷类似物或核苷酸类似物优选恩替卡韦、富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺、拉米夫定、替比夫定或其组合,
48、其中所述rnai组分用于通过静脉内或皮下注射向有此需要的受试者给药。在某些实施方案中,rnai组分用于每月给药一次(或q4w)、每两个月给药一次(或q8w)或每三个月给药一次(或q12w),更特别是每月给药一次。在某些实施方案中,rnai组分以约40-200mg的剂量给药,更特别是100mg、150mg或200mg,更特别是100mg。
49、在本文的任何方法或其他公开内容中,治疗进一步包括给药有效量的抗hbv剂和/或抗hdv剂,更特别是有效量的抗hbv剂,其中所述抗hbv剂是核苷(酸)类似物(nuc)或干扰素(ifn),更特别是有效量的核苷类似物或核苷酸类似物。在一些实施方案中,核苷类似物或核苷酸类似物可以是例如恩替卡韦、富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺、拉米夫定、替比夫定或其组合,更特别是恩替卡韦、富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺或其组合。
50、在本文的任何方法或其他公开内容中,至少一种其他抗乙型肝炎病毒(hbv)剂或化合物是本技术的rnai组分以外的至少一种抗hbv剂或化合物,更特别是抗hbv sirna以外的,更特别是至少一种选自以下的抗hbv剂:直接作用的抗病毒药物(如核苷(酸)类似物,更特别是恩替卡韦、富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺、拉米夫定、替比夫定或其组合)、细胞因子(如干扰素,更特别是干扰素α、干扰素λ、聚乙二醇化干扰素、聚乙二醇化干扰素α)、hbv dna聚合酶抑制剂;免疫调节剂;toll样受体调节剂(例如,toll样受体7调节剂;toll样受体8调节剂;toll样受体3调节剂;toll样受体9调节剂);干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,如il12;衣壳组装调节剂,核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸-诱导基因1的刺激剂;nod2的刺激剂;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;免疫检查点抑制剂,如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂、ctla-4抑制剂;在免疫细胞(更特别是t细胞)上表达的共刺激受体的激动剂,如cd27和cd28;btk抑制剂;用于治疗hbv的其他药物;ido抑制剂;精氨酸酶抑制剂;以及kdm5抑制剂。
51、在本文的任何方法或其他公开内容中,至少一种其他抗hdv剂或化合物是本技术的rnai组分以外的至少一种其他抗hdv剂或化合物,更特别是hdv进入抑制剂(例如,myrrcludex(布乐韦肽(bulevirtide)))和/或法尼基转移酶抑制剂(例如,洛那法尼(lonafarnib))。在一些实施方案中,在rnai组分之前给药至少一种其他抗hdv剂(例如,hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或法尼基转移酶抑制剂(例如,洛那法尼))。在一些实施方案中,在rnai组分之前给药至少一种其他抗hdv剂(例如,hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或法尼基转移酶抑制剂(例如,洛那法尼)),并且一旦开始rnai组分给药就停止。
52、在本文的任何方法或其他公开内容中,核苷(酸)类似物(nuc)或干扰素(ifn)不在rnai组分之前给药。在一些实施方案中,rnai组分在核苷(酸)类似物(nuc)或干扰素(ifn)之前或同时给药。
53、在本文的任何方法或其他公开内容中,受试者包括hdv/乙型肝炎病毒(hbv)共感染。在一些实施方案中,受试者进一步包括肝硬化,更特别是代偿性肝硬化。在一些实施方案中,受试者是没有肝硬化的患者。
54、在本文的任何方法或其他公开内容中,在一个变化中,第一或第二rnai剂包含至少一个修饰的核苷酸或至少一个修饰的核苷间连接。在另一个变化中,第一和第二rnai剂中基本上所有的核苷酸都是修饰的核苷酸。在另一个变化中,第一或第二rnai剂进一步包含与第一或第二rnai剂缀合的靶向配体。在一方面,靶向配体包含n-乙酰基-半乳糖胺。在一特定方面,靶向配体选自(nag13)、(nag13)s、(nag18)、(nag18)s、(nag24)、(nag24)s、(nag25)、(nag25)s、(nag26)、(nag26)s、(nag27)、(nag27)s、(nag28)、(nag28)s、(nag29)、(nag29)s、(nag30)、(nag30)s、(nag31)、(nag31)s、(nag32)、(nag32)s、(nag33)、(nag33)s、(nag34)、(nag34)s、(nag35)、(nag35)s、(nag36)、(nag36)s、(nag37)、(nag37)s、(nag38)、(nag38)s、(nag39)和(nag39)s。在一个变化中,靶向配体是(nag25)、(nag25)s、(nag31)、(nag31)s、(nag37)或(nag37)s。在另一个变化中,靶向配体与第一或第二rnai剂的正义链缀合。在另一个变化中,靶向配体与第一或第二rnai剂正义链的5’端缀合。在另一个变化中,第一和第二rnai剂独立地包含选自以下的双链体:包含seq id no:1的反义链和包含seq id no:10的正义链;包含seq id no:2的反义链和包含seq id no:11的正义链;包含seq id no:3的反义链和包含seq id no:11的正义链;包含seq id no:4的反义链和包含seq id no:12的正义链;包含seq id no:8的反义链和包含seq id no:16的正义链;包含seq id no:8的反义链和包含seq id no:17的正义链;包含seq id no:2的反义链和包含seq id no:13的正义链;以及包含seq id no:8的反义链和包含seq id no:18的正义链。在一个特定变化中,第一和第二rnai剂各自独立地与包含n-乙酰基-半乳糖胺的靶向配体缀合,并且第一和第二rnai剂独立地包含选自以下的双链体:包含seq id no:2的反义链和包含seq id no:11的正义链;包含seq id no:4的反义链和包含seq id no:12的正义链;包含seq id no:8的反义链和包含seq id no:16的正义链;包含seq id no:2的反义链和包含seq id no:13的正义链;以及包含seq id no:8的反义链和包含seq id no:18的正义链。在另一个变化中,第一rnai剂与第二rnai剂的重量比在约1:2至约5:1的范围中。在另一个变化中,第一rnai剂与第二rnai剂的重量比为约2:1。在某些方面,第一和第二rnai剂各自独立地与(nag37)s缀合,第一rnai剂包括含有seq id no:2的反义链和含有seq id no:11的正义链,并且第二rnai剂包括含有seq id no:8的反义链和含有seq id no:16的正义链。
55、在本文的任何方法或其他公开内容中,rnai组分包含在注射器中,例如玻璃注射器,并且其中注射器任选地适合由患者自行给药rnai组分或由未经培训的人员向患者给药rnai组分。
56、在本文的任何方法或其他公开内容中,注射器适合由患者自行给药rnai组分,并且其中注射器放置在符合人体工程学的外壳或手柄中,以稳定注射器供患者自行注射,或者在自动注射器装置中提供。
57、本发明的其他方面、特征和优点从以下公开显而易见,包括本发明的详细描述及其优选实施方案和所附权利要求书。
58、具体实施方式
59、提出以下描述以使本领域普通技术人员能够制备和使用各种实施方案。特定组合物、技术和应用的描述仅作为实例提供。对本文所述实例的各种修改对于本领域普通技术人员会显而易见,并且在不背离各种实施方案的精神和范围的情况下,本文中定义的一般原理可以应用于其他实例和应用。因此,各种实施方案不是为了限制本文描述和示出的实例,而是与符合权利要求的范围一致。
60、在背景和整个说明书中引用或描述了各种出版物、文章和专利;这些参考文献每个整体援引加入本文。本说明书中已包括的文件、条例、材料、装置、文章等的讨论仅为了提供本发明的上下文的目的。这样的讨论不是承认任何或全部这些材料形成关于公开或要求保护的任何发明的现有技术的部分。
61、除非另有定义,本文使用的所有技术和科学术语均具有与本发明所属领域的普通技术人员通常理解的相同的含义。否则,本文使用的某些术语具有如说明书中示出的含义。本文引用的所有专利、公开的专利申请和出版物均援引加入本文,如同在本文中完全阐述一样。
62、必须注意,当用于本文和所附权利要求时,除非上下文另有明确规定,单数形式“一个(a)”、“一个(an)”和“这个(the)”包括复数指代。
63、除非另有说明,否则一系列元素之前的术语“至少”应当理解为指该系列中的每个元素。本领域技术人员会认识到或者能够利用不超过常规实验确定本文描述的本发明的具体实施方案的许多等同物。本发明意图涵盖这类等同物。
64、在整个说明书和所附权利要求书中,除非上下文另有要求,否则词语“包含(comprise)”及其变体如“包含(comprises)”和“包含(comprising)”应当理解为意指包括所述的整数或步骤或者整数或步骤的组但不排除任何其他整数或步骤或整数或步骤的组。当在本文中使用时,术语“包含”可以用术语“含有”或“包括”替代,或者有时当在本文中使用时用术语“具有”替代。
65、当在本文中使用时,“由…组成”排除权利要求元素中未指明的任何元素、步骤或成分。当在本文中使用时,“基本上由…组成”不排除不实质上影响权利要求的基本和新颖特征的材料或步骤。在本技术的方面或实施方案的上下文中无论何时在本文中使用时,任何上述术语“包含”、“含有”、“包括”和“具有”可以用术语“由…组成”或“基本上由…组成”替代以改变本公开的范围。如本文所用,多个引用元素之间的连接术语“和/或”理解为涵盖单独和组合选项。例如,当两个元素通过“和/或”连接时,第一选项是指没有第二元素的第一元素的适用性。第二选项是指没有第一元素的第二元素的适用性。第三元素是指第一和第二元素一起的适用性。这些选项中的任一种均理解为落在含义内,因此满足如本文所用的术语“和/或”的要求。一个以上选项的并发适用性也理解为落在含义内,因此满足术语“和/或”的要求。
66、除非另有说明,否则任何数值,如本文描述的浓度或浓度范围,应当理解为在所有情况下均被术语“约”修饰。因此,数值通常包括所述值的±10%。例如,1mg/ml的浓度包括0.9mg/ml至1.1mg/ml。同样地,1mg/ml至10mg/ml的范围包括0.9mg/ml至11mg/ml。如本文所用,除非上下文另有明确指示,否则数值范围的使用明确包括所有可能的子范围,该范围内的所有单个数值,包括这类范围内的整数和值的分数。
67、“任选的”或“任选地”表示其后描述的事件可能发生或可能不发生。这个术语涵盖事件可能发生或可能不发生的情况。
68、术语“药学可接受的载体”或“药学可接受的赋形剂”包括任何和所有溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等。这类介质和物质用于药学活性物质的使用是本领域公知的。除了与活性成分不相容的任何常规介质或物质,考虑其在药物组合物中使用。还可以将补充活性成分掺入药物组合物。
69、术语“药学可接受的盐”是指本文中任何化合物的盐,其已知是无毒的,并且常用于药学文献。在一些实施方案中,化合物的药学可接受的盐保留本文所述化合物的生物有效性,并且在生物学上或其他方面并非不期望的。药学可接受的盐的实例可以在berge etal.,pharmaceutical salts,j.pharmaceutical sciences,january 1977,66(1),1-19中找到。药学可接受的酸加成盐可以与无机酸和有机酸形成。可以衍生盐类的无机酸包括例如盐酸、氢溴酸、硫酸、硝酸和磷酸。可以衍生盐类的有机酸包括例如乙酸、丙酸、乙醇酸、丙酮酸、乳酸、草酸、苹果酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、2-羟乙基磺酸、对甲苯磺酸、硬脂酸和水杨酸。药学可接受的碱加成盐可以与无机和有机碱形成。可以衍生盐类的无机碱包括例如钠、钾、锂、铵、钙、镁、铁、锌、铜、锰和铝。可以衍生盐类的有机碱包括例如伯胺、仲胺和叔胺;取代胺,包括天然存在的取代胺;环胺;以及碱性离子交换树脂。有机碱的实例包括异丙胺、三甲胺、二乙胺、三乙胺、三丙胺和乙醇胺。在一些实施方案中,药学可接受的碱加成盐选自铵、钾、钠、钙和镁盐。
70、根据本发明的药学可接受的盐可以通过常规程序从含有酸性或碱性基团的母体化合物制备。一般来说,这类盐可以通过游离酸或碱形式的化合物与化学计量适当的碱或酸在水、有机溶剂或其混合物中的反应来制备。通常,非水介质如醚、乙酸乙酯、乙醇、异丙醇、乙腈等是优选的。
71、术语“患者”和“受试者”是指动物,如哺乳动物、鸟或鱼。在一些实施方案中,患者或受试者是哺乳动物。如本文所用的术语“哺乳动物”涵盖任何哺乳动物。哺乳动物的实例包括但不限于牛、马、绵羊、猪、猫、狗、小鼠、大鼠、兔、豚鼠、非人灵长类(nhp)如猴或猿、人等,更优选人。在一些实施方案中,患者或受试者是人,例如已经或将要成为治疗、观察或实验对象的人。本文描述的化合物、组合物和方法可以用于人治疗和兽医应用。
72、术语“治疗有效量”或“有效量”是指本文公开和/或描述的rnai组分、核苷(酸)类似物(nuc)或药物组合物的量,当向需要这种治疗的受试者给药时,如本文定义的,足以影响治疗。治疗有效量会根据例如治疗的受试者和疾病状况、受试者的体重和年龄、疾病状况的严重程度、特定化合物、遵循的剂量给药方案、给药时间、给药方式等变化,所有这些都可以由本领域普通技术人员容易地确定。治疗有效量可以通过实验来确定,例如通过测定化合物的血液浓度,或者从理论上说,由本领域普通技术人员根据本公开计算生物利用度来确定。
73、在本技术的特定实施方案中,治疗有效量是指组合物或治疗组合的量,其足以实现1、2、3、4种或更多种以下效果:(i)减少或改善hdv感染或与其相关症状的严重程度;(ii)减少hdv感染或与其相关症状的持续时间;(iii)防止hdv感染或与其相关症状的进展;(iv)使得hdv感染或与其相关症状消退;(v)防止hdv感染或与其相关症状发展或发作;(vi)防止hdv感染或与其相关症状复发;(vii)减少患有hdv感染的受试者的住院治疗;(viii)减少患有hdv感染的受试者的住院长度;(ix)增加患有hdv感染的受试者的存活率;(x)消除受试者中的hdv感染;(xi)抑制或减少受试者中的hdv复制;和/或(xii)增强或改进另一疗法的预防或治疗效果。
74、治疗有效量也可以是足以降低血清hdv rna水平的药物组合物的量,更特别地,足以将血清hdv rna水平降低至不可检测的血清hdv rna水平。目标指标的可选或补充实例包括但不限于:如果受试者是雄性受试者,40u/l或更低的血清alt浓度,或者如果受试者是雌性受试者,30u/l或更低的血清alt浓度,或者血清alt浓度相对减少(从基线(或从治疗开始时的水平))至少40%,更特别是至少50%;hbeag阴性血清;100iu/ml或更低的血清hbsag水平,更特别是10iu/ml或更低,更特别是hbsag血清清除;以及hbs血清转换。如本文所用,术语“血清alt”可以涵盖来自任何血液制品或组分的alt,例如,血液alt或血浆alt。
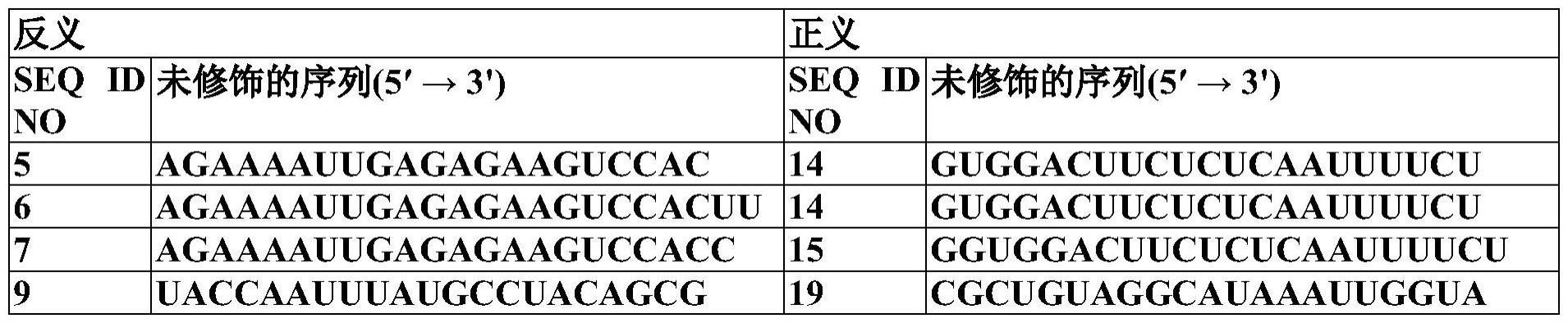
75、如本文所用,术语和短语“联合”、“与…联合”、“共递送”和“与…一起给药”在向受试者给药两种或更多种疗法或组分的上下文中是指同时给药或次序(subsequent)给药两种或更多种疗法或组分,如两种载体,例如,dna质粒、肽或者治疗组合和佐剂。“同时给药”可以是至少在同一天内给药两种或更多种疗法或组分。当两种组分“一起给药”或“联合给药”时,它们可以在短时间内,如24、20、16、12、8或4小时,或者在1小时内,以单独的组合物顺序给药,或者它们可以在同一时间以单一组合物给药。“次序给药”可以是两种或更多种疗法或组分在同一天或不同的日子给药。术语“与…联合”的使用不限制向受试者给药疗法或组分的顺序。例如,第一疗法或组分(例如rnai组分)可以在给药第二疗法或组分(例如,核苷(酸)类似物(nuc)或干扰素(inf))之前(例如,之前5分钟至1小时)、伴随或同时、或者之后(例如,之后5分钟至1小时)给药。在一些实施方案中,第一疗法或组分(例如rnai组分)以及第二疗法或组分(例如,核苷(酸)类似物(nuc)或ifn)在同一组合物中给药。在其他实施方案中,第一疗法或组分(例如rnai组分)以及第二疗法或组分(例如,核苷(酸)类似物(nuc)或ifn)在不同组合物中给药,如两种单独的组合物。
76、为了帮助本技术的读者,已将本说明书分为不同段落或部分,或者针对本技术的各种实施方案。这些分隔不应当认为是将一个段落或部分或实施方案的实质与另一段落或部分或实施方案的实质切断。与此相反,本领域技术人员会理解本说明书具有广泛应用,并且涵盖可以考虑的各个部分、段落和句子的所有组合。任何实施方案的讨论仅是示例性的,并不意图表示包括权利要求书在内的本公开的范围限于这些实例。例如,虽然本文所述rnai组分的实施方案可以包含以特定顺序排列的特定组分,但是本领域普通技术人员会理解,本文公开的概念可以同样适用于可以用于本技术的rnai的以其他顺序排列的其他组分。本技术考虑使用可以用于本技术的任何组合的任何适用组分,无论是否明确描述特定组合。本发明一般涉及包含一种或多种hbv rnai以及核苷(酸)类似物(nuc)或干扰素(inf)的治疗组合。
77、组合
78、本文提供有效量的rnai组分以及有效量的至少一种抗乙型肝炎病毒(hbv)剂和/或至少一种抗hdv剂,更特别是至少一种抗hbv剂的组合,其中所述抗hbv剂选自核苷(酸)类似物(nuc)或干扰素。
79、rnai组分
80、在一方面,rnai组分包含一种或多种rnai剂。本文公开的每种rnai剂包括至少一条正义链和反义链。正义链和反义链可以部分、基本上或完全互补。本文所述rnai剂正义和反义链的长度可以独立地为16-30个核苷酸。在一些实施方案中,正义和反义链的长度独立地为17-26个核苷酸。在一些实施方案中,正义和反义链的长度独立地为19-26个核苷酸。在一些实施方案中,正义和反义链的长度独立地为21-26个核苷酸。在一些实施方案中,正义和反义链的长度独立地为21-24个核苷酸。正义和反义链可以长度相同,也可以长度不同。本文公开的hbv rnai剂设计为包括与hbv基因组中的序列至少部分互补的反义链序列,所述序列在大多数已知的hbv血清型中是保守的。本文所述rnai剂在递送至表达hbv的细胞时,在体内或体外抑制一个或多个hbv基因的表达。
81、rnai剂包括含有第一序列的正义链(也称作过客链(passenger strand))和含有第二序列的反义链(也称作引导链)。本文所述hbv rnai剂的正义链包括核心区段,其与hbvmrna中至少16个连续核苷酸的核苷酸序列具有至少约85%相同性。在一些实施方案中,与hbv mrna中的序列具有至少约85%相同性的正义链核心核苷酸区段的长度为16、17、18、19、20、21、22或23个核苷酸。hbv rnai剂的反义链包含与hbv mrna中的序列和相应的正义链在至少16个连续核苷酸的核心区段上有至少约85%互补的核苷酸序列。在一些实施方案中,与hbv mrna中的序列或相应的正义链具有至少约85%互补性的反义链核心核苷酸序列的长度为16、17、18、19、20、21、22或23个核苷酸。
82、在一些实施方案中,rnai组分包含第一rnai剂,其包含反义链,其包含以下任一个的核苷酸序列:seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seqid no:6和seq id no:7,以及正义链,其包含以下任一个的核苷酸序列:seq id no:10、seqid no:11、seq id no:12、seq id no:13、seq id no:14和seq id no:15,或者第二rnai剂,其包含反义链,其包含以下任一个的核苷酸序列:seq id no:8和seq id no:9,以及正义链,其包含以下任一个的核苷酸序列:seq id no:16、seq id no:17、seq id no:18和seqid no:19。在一些实施方案中,rnai组分包含第一rnai剂,其包含反义链,其包含以下任一个的核苷酸序列:seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6和seq id no:7,以及正义链,其包含以下任一个的核苷酸序列:seq id no:10、seq id no:11、seq id no:12、seq id no:13、seq id no:14和seq id no:15,以及第二rnai剂,其包含反义链,其包含以下任一个的核苷酸序列:seq id no:8和seq id no:9,以及正义链,其包含以下任一个的核苷酸序列:seq id no:16、seq id no:17、seq id no:18和seq id no:19。
83、在一些实施方案中,本文公开的第一和第二rnai剂包含表1中的任何序列。
84、表1.第一和第二rnai剂的示例性序列
85、
86、靶向基团
87、在一些实施方案中,使用本领域已知的任何寡核苷酸递送技术将rnai剂递送至靶细胞或组织。核酸递送方法包括但不限于通过包裹在脂质体中,通过离子导入(iontophoresis),或者通过掺入其他媒介物,如水凝胶、环糊精、生物可降解的纳米胶囊和生物粘附性微球、蛋白质载体或动态多聚复合物(polyconjugate)(dpc)(参见,例如wo2000/053722、wo 2008/0022309、wo 2011/104169和wo 2012/083185,其中每个都援引加入本文)。在一些实施方案中,通过将rnai剂共价连接至靶向基团来将rnai剂递送至靶细胞或组织。在一些实施方案中,靶向基团可以包括细胞受体配体,如脱唾液酸糖蛋白受体(asgpr)配体。在一些实施方案中,asgpr配体包括或由半乳糖衍生物簇组成。在一些实施方案中,半乳糖衍生物簇包括n-乙酰基-半乳糖胺三聚体或n-乙酰基-半乳糖胺四聚体。在一些实施方案中,半乳糖衍生物簇是n-乙酰基-半乳糖胺三聚体或n-乙酰基-半乳糖胺四聚体。
88、靶向基团可以与rnai剂的正义链或反义链的3′或5′端连接。在一些实施方案中,靶向基团与正义链的3′或5′端连接。在一些实施方案中,靶向基团与正义链的5′端连接。在一些实施方案中,靶向基团通过接头与rnai剂连接。
89、在一些实施方案中,rnai组分包括具有不同核苷酸序列的第一和第二rnai剂的组合或混合物(cocktail)。在一些实施方案中,第一和第二rnai剂各自单独和独立地连接至靶向基团。在一些实施方案中,第一和第二rnai剂各自连接至包含n-乙酰基-半乳糖胺的靶向基团。在一些实施方案中,当第一和第二rnai剂包括在组合物中时,每种rnai剂连接至相同的靶向基团。在一些实施方案中,当第一和第二rnai剂包括在一个组合物中时,每种rnai剂连接至不同的靶向基团,如具有不同化学结构的靶向基团。
90、在一些实施方案中,将靶向基团与第一和第二rnai剂相连而不使用额外的接头。在一些实施方案中,靶向基团设计为具有接头,易于促进与第一或第二rnai剂连接。在一些实施方案中,当第一和第二rnai剂包括在组合物中时,第一和第二rnai剂可以使用相同的接头连接至靶向基团。在一些实施方案中,当第一和第二rnai剂包括在组合物中时,第一和第二rnai剂使用不同的接头连接至靶向基团。
91、靶向基团和连接基团的实例在表2中提供。非核苷酸基团可以共价连接至正义链和/或反义链的3′和/或5′端。在一些实施方案中,第一或第二rnai剂包含连接至正义链的3′和/或5′端的非核苷酸基团。在一些实施方案中,非核苷酸基团连接至第一或第二rnai剂正义链的5′端。非核苷酸基团可以直接或通过接头/连接基团间接连接至第一或第二rnai剂。在一些实施方案中,非核苷酸基团通过不稳定的、可切割的或可逆的键或接头连接至第一或第二rnai剂。
92、靶向基团和连接基团包括以下基团,其化学结构在下文表2中提供:(paz)、(nag13)、(nag13)s、(nag18)、(nag18)s、(nag24)、(nag24)s、(nag25)、(nag25)s、(nag26)、(nag26)s、(nag27)、(nag27)s、(nag28)、(nag28)s、(nag29)、(nag29)s、(nag30)、(nag30)s、(nag31)、(nag31)s、(nag32)、(nag32)s、(nag33)、(nag33)s、(nag34)、(nag34)s、(nag35)、(nag35)s、(nag36)、(nag36)s、(nag37)、(nag37)s、(nag38)、(nag38)s、(nag39)、(nag39)s。每条正义链和/或反义链可以具有上文列出的任何靶向基团或连接基团,以及其他靶向或连接基团,缀合至序列的5′和/或3′端。
93、表2.代表各种修饰的核苷酸、靶向基团和连接基团的结构
94、
95、
96、
97、
98、
99、
100、
101、
102、
103、
104、
105、
106、
107、修饰的核苷酸
108、在一些实施方案中,第一或第二rnai剂含有一个或多个修饰的核苷酸。如本文所用,“修饰的核苷酸”是核糖核苷酸(2′-羟基核苷酸)以外的核苷酸。在一些实施方案中,至少50%(例如,至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少98%、至少99%或100%)的核苷酸是修饰的核苷酸。如本文所用,修饰的核苷酸包括但不限于脱氧核糖核苷酸、核苷酸模拟物、无碱基核苷酸(abasic nucleotide)(在本文中表示为ab)、2′-修饰的核苷酸、3′至3′连接(反向)核苷酸(在本文中表示为invdn、invn、invn、invab)、包含非天然碱基的核苷酸、桥接核苷酸、肽核酸(pna)、2′,3′-开环(seco)核苷酸模拟物(未锁定的核碱基类似物,在本文中表示为nuna或nuna)、锁核苷酸(在本文中表示为nlna或nlna)、3′-o-甲氧基(2′核苷间连接的)核苷酸(在本文中表示为3′-omen)、2'-f-阿拉伯糖核苷酸(在本文中表示为nfana或nfana)、5'-me、2'-氟核苷酸(在本文中表示为5me-nf)、吗啉代核苷酸、乙烯基膦酸酯脱氧核糖核苷酸(在本文中表示为vpdn)、含有乙烯基膦酸酯的核苷酸以及含有环丙基膦酸酯的核苷酸(cprpn)。2′-修饰的核苷酸(即在五元糖环的2′位上具有羟基以外的基团的核苷酸)包括但不限于2′-o-甲基核苷酸(在本文中表示为核苷酸序列中的小写字母'n')、2′-脱氧-2′-氟核苷酸(在本文中表示为nf,在本文中还表示为2′-氟核苷酸)、2′-脱氧核苷酸(在本文中表示为dn)、2′-甲氧基乙基(2′-o-2-甲氧基乙基)核苷酸(在本文中表示为nm或2′-moe)、2′-氨基核苷酸和2′-烷基核苷酸。对于给定化合物中的所有位置不必进行均匀修饰。相反地,在第一或第二rnai剂中,甚至在其单个核苷酸中,可以掺入一个以上的修饰。rnai剂正义链和反义链可以通过本领域已知的方法合成和/或修饰。一个核苷酸上的修饰独立于另一个核苷酸上的修饰。
109、修饰的核碱基包括合成和天然的核碱基,如5-取代的嘧啶,6-氮杂嘧啶以及n-2、n-6和o-6取代的嘌呤,(例如,2-氨丙基腺嘌呤、5-丙炔基尿嘧啶或5-丙炔基胞嘧啶),5-甲基胞嘧啶(5-me-c),5-羟甲基胞嘧啶,黄嘌呤,次黄嘌呤,2-氨基腺嘌呤,腺嘌呤和鸟嘌呤的6-烷基(例如,6-甲基、6-乙基、6-异丙基或6-正丁基)衍生物,腺嘌呤和鸟嘌呤的2-烷基(例如,2-甲基、2-乙基、2-异丙基或2-正丁基)和其他烷基衍生物,2-硫尿嘧啶,2-硫代胸腺嘧啶,2-硫代胞嘧啶,5-卤代尿嘧啶,胞嘧啶,5-丙炔基尿嘧啶,5-丙炔基胞嘧啶,6-偶氮尿嘧啶,6-偶氮胞嘧啶,6-偶氮胸腺嘧啶,5-尿嘧啶(假尿嘧啶),4-硫代尿嘧啶,8-卤代、8-氨基、8-巯基、8-硫代烷基、8-羟基和其他8-取代的腺嘌呤和鸟嘌呤,5-卤代(例如,5-溴)、5-三氟甲基和其他5-取代的尿嘧啶和胞嘧啶,7-甲基鸟嘌呤和7-甲基腺嘌呤,8-氮杂鸟嘌呤和8-氮杂腺嘌呤,7-脱氮鸟嘌呤,7-脱氮腺嘌呤,3-脱氮鸟嘌呤以及3-脱氮腺嘌呤。
110、在一些实施方案中,第一或第二rnai剂的所有或至少90%的核苷酸是修饰的核苷酸。如本文所用,其中至少90%的核苷酸是修饰的核苷酸的rnai剂是在正义链和反义链中均有4个或更少(即,0、1、2、3或4)核苷酸是核糖核苷酸的rnai剂。如本文所用,其中至少90%的核苷酸是修饰的核苷酸的正义链是在正义链中有2个或更少(即,0、1或2)核苷酸是核糖核苷酸的正义链。如本文所用,其中至少90%的核苷酸是修饰的核苷酸的反义链是在正义链中有2个或更少(即,0、1或2)核苷酸是核糖核苷酸的反义链。在一些实施方案中,rnai剂的一个或多个核苷酸是核糖核苷酸。
111、修饰的核苷间连接
112、在一些实施方案中,第一或第二rnai剂的一个或多个核苷酸通过非标准连接或骨架(即,修饰的核苷间连接或修饰的骨架)连接。在一些实施方案中,修饰的核苷间连接是不含磷酸酯的共价核苷间连接。修饰的核苷间连接或骨架包括但不限于5’-硫代磷酸酯(5’-phosphorothioate)基团(在本文中表示为小写字母“s”),手性硫代磷酸酯,硫代磷酸酯(thiophosphate),二硫代磷酸酯,磷酸三酯,氨基烷基-磷酸三酯,烷基膦酸酯(例如,膦酸甲酯或3′-亚烷基膦酸酯),手性膦酸酯,次膦酸酯,磷酰胺酯(phosphoramidate)(例如,3′-氨基磷酰胺酯、氨基烷基磷酰胺酯或硫代磷酰胺酯),硫代烷基-膦酸酯,硫代烷基磷酸三酯,吗啉基(morpholino)连接,具有正常3′-5′连接的硼磷酸酯,2′-5′连接的硼磷酸酯类似物,或者具有反转极性的硼磷酸酯,其中相邻的核苷单元对3′-5′至5′-3′或2′-5′至5′-2′连接。在一些实施方案中,修饰的核苷间连接或骨架缺少磷原子。缺少磷原子的修饰的核苷间连接包括但不限于短链烷基或环烷基糖间连接,混合杂原子以及烷基或环烷基糖间连接,或者一个或多个短链杂原子或杂环糖间连接。在一些实施方案中,修饰的核苷间骨架包括但不限于硅氧烷骨架、硫化物骨架、亚砜骨架、砜骨架、甲酰基(formacetyl)和硫代甲酰基(thioformacetyl)骨架、亚甲基甲酰基和硫代甲酰基骨架、含烯骨架、氨基磺酸骨架、亚甲基亚氨基和亚甲基肼基骨架、磺酸和磺酰胺骨架、酰胺骨架以及其他具有混合的n、o、s和ch2组分的骨架。
113、在一些实施方案中,第一或第二rnai剂的正义链可以含有1、2、3、4、5或6个硫代磷酸酯连接,第一或第二rnai剂的反义链可以含有1、2、3、4、5或6个硫代磷酸酯连接,或者正义链和反义链都可以独立地含有1、2、3、4、5或6个硫代磷酸酯连接。在一些实施方案中,第一或第二rnai剂的正义链可以含有1、2、3或4个硫代磷酸酯连接,第一或第二rnai剂的反义链可以含有1、2、3或4个硫代磷酸酯连接,或者正义链和反义链都可以独立地含有1、2、3或4个硫代磷酸酯连接。
114、在一些实施方案中,第一或第二rnai剂正义链含有至少两个硫代磷酸酯核苷间连接。在一些实施方案中,至少两个硫代磷酸酯核苷间连接在正义链3'端位置1-3的核苷酸之间。在一些实施方案中,至少两个硫代磷酸酯核苷间连接在正义链5'端位置1-3、2-4、3-5、4-6、4-5或6-8的核苷酸之间。在一些实施方案中,第一或第二rnai剂反义链含有四个硫代磷酸酯核苷间连接。在一些实施方案中,四个硫代磷酸酯核苷间连接在正义链5'端位置1-3的核苷酸之间以及5'端位置19-21、20-22、21-23、22-24、23-25或24-26的核苷酸之间。在一些实施方案中,第一或第二rnai剂在正义链中含有至少两个硫代磷酸酯核苷间连接,在反义链中含有三个或四个硫代磷酸酯核苷间连接。
115、在一些实施方案中,第一或第二rnai剂含有一个或多个修饰的核苷酸以及一个或多个修饰的核苷间连接。在一些实施方案中,2′-修饰的核苷与修饰的核苷间连接组合。
116、在一些实施方案中,本文公开的第一和第二rnai剂包含表3中的任何修饰的序列。
117、表3.第一和第二rnai剂的示例性修饰的序列
118、
119、a=腺苷-3′-磷酸;
120、c=胞苷-3′-磷酸;
121、g=鸟苷-3′-磷酸;
122、u=尿苷-3′-磷酸
123、n=任何2′-ome修饰的核苷酸
124、a=2′-o-甲基腺苷-3′-磷酸
125、as=2′-o-甲基腺苷-3′-硫代磷酸
126、c=2′-o-甲基胞苷-3′-磷酸
127、cs=2′-o-甲基胞苷-3′-硫代磷酸
128、g=2′-o-甲基鸟苷-3′-磷酸
129、gs=2′-o-甲基鸟苷-3′-硫代磷酸
130、t=2′-o-甲基-5-甲基尿苷-3′-磷酸
131、ts=2′-o-甲基-5-甲基尿苷-3′-硫代磷酸
132、u=2′-o-甲基尿苷-3′-磷酸
133、us=2′-o-甲基尿苷-3′-硫代磷酸
134、nf=任何2′-氟修饰的核苷酸
135、af=2′-氟腺苷-3′-磷酸
136、afs=2′-氟腺苷-3′-硫代磷酸
137、cf=2′-氟胞苷-3′-磷酸
138、cfs=2′-氟胞苷-3′-硫代磷酸
139、gf=2′-氟鸟苷-3′-磷酸
140、gfs=2′-氟鸟苷-3′-硫代磷酸
141、tf=2′-氟-5′-甲基尿苷-3′-磷酸
142、tfs=2′-氟-5′-甲基尿苷-3′-硫代磷酸
143、uf=2′-氟尿苷-3′-磷酸
144、ufs=2′-氟尿苷-3′-硫代磷酸
145、dn=任何2′-脱氧核糖核苷酸
146、dt=2′-脱氧胸苷-3′-磷酸
147、nuna=2′,3′-开环核苷酸模拟物(未锁定的核碱基类似物)
148、nlna=锁核苷酸
149、nfana=2'-f-阿拉伯糖核苷酸
150、nm=2′-甲氧基乙基核苷酸
151、am=2′-甲氧基乙基腺苷-3′-磷酸
152、ams=2′-甲氧基乙基腺苷-3′-硫代磷酸
153、tm=2′-甲氧基乙基胸苷-3′-磷酸
154、tms=2′-甲氧基乙基胸苷-3′-硫代磷酸
155、r=核糖醇
156、(invdn)=任何反向脱氧核糖核苷酸(3′-3′连接的核苷酸)
157、(invab)=反向(3′-3′连接的)无碱基脱氧核糖核苷酸,见表6
158、(invab)s=反向(3′-3′连接的)无碱基脱氧核糖核苷酸-5′-硫代磷酸,见表6
159、(invn)=任何反向2′-ome核苷酸(3′-3′连接的核苷酸)
160、s=硫代磷酸酯连接
161、在一些实施方案中,第一rnai剂包含seq id no:5和seq id no:14。在一些实施方案中,第一rnai剂包含seq id no:6和seq id no:14。在一些实施方案中,第一rnai剂包含seq id no:7和seq id no:15。在一些实施方案中,第一rnai剂包含seq id no:1以及seqid no:10、11或13。在一些实施方案中,第一rnai剂包含seq id no:2以及seq id no:10、11或13。在一些实施方案中,第一rnai剂包含seq id no:3以及seq id no:10、11或13。在一些实施方案中,第一rnai剂包含seq id no:4和seq id no:12。在一些实施方案中,第二rnai剂包含seq id no:9和seq id no:19。在一些实施方案中,第二rnai剂包含seq id no:8以及seq id no:16、17或18。
162、在一些实施方案中,rnai组分包括含有seq id no:5和seq id no:14的第一rnai剂以及含有seq id no:9和seq id no:19的第二rnai剂。在一些实施方案中,rnai组分包括含有seq id no:6和seq id no:14的第一rnai剂以及含有seq id no:9和seq id no:19的第二rnai剂。在一些实施方案中,rnai组分包括含有seq id no:7和seq id no:15的第一rnai剂以及含有seq id no:9和seq id no:19的第二rnai剂。
163、在一些实施方案中,rnai组分包括含有seq id no:1和seq id no:10、11或13的第一rnai剂以及含有seq id no:8和seq id no:16、17或18的第二rnai剂。在一些实施方案中,rnai组分包括含有seq id no:2和seq id no:10、11或13的第一rnai剂以及含有seq idno:8和seq id no:16、17或18的第二rnai剂。在一些实施方案中,rnai组分包括含有seq idno:3和seq id no:10、11或13的第一rnai剂以及含有seq id no:8和seq id no:16、17或18的第二rnai剂。在一些实施方案中,rnai组分包括含有seq id no:4和seq id no:12的第一rnai剂以及含有seq id no:8和seq id no:16、17或18的第二rnai剂。
164、在一些实施方案中,rnai组分包含第一和第二rnai剂,其比例约为1:1、2:1、3:1、4:1或5:1。在一些实施方案中,两种hbv rnai剂以约2:1的比例给药。
165、在一些实施方案中,第一和第二rnai剂各自独立地与(nag37)s缀合,第一rnai剂包括含有seq id no:2的反义链和含有seq id no:11的正义链,第二rnai剂包括含有seqid no:8的反义链和含有seq id no:16的正义链。
166、抗乙型肝炎病毒(hbv)剂
167、在一些实施方案中,有效量的rnai组分与有效量的至少一种抗hbv剂联合使用,更特别是有效量的至少一种抗hbv化合物,更特别是本技术的rnai组分以外的至少一种抗hbv剂或化合物,更特别是抗hbv sirna以外的,更特别是选自以下的至少一种抗hbv剂或化合物:直接作用的抗病毒药物(如核苷(酸)类似物,更特别是富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺、恩替卡韦、拉米夫定、替比夫定、这些核苷(酸)类似物中至少两种的任何组合)、细胞因子(如干扰素,更特别是干扰素α、干扰素λ、聚乙二醇化干扰素、聚乙二醇化干扰素α);hbv dna聚合酶抑制剂;免疫调节剂;toll样受体调节剂(例如,toll样受体7调节剂;toll样受体8调节剂;toll样受体3调节剂;toll样受体9调节剂);干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,如il12;衣壳组装调节剂,核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸-诱导基因1的刺激剂;nod2的刺激剂;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;免疫检查点抑制剂,如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂、ctla-4抑制剂;在免疫细胞(更特别是t细胞)上表达的共刺激受体的激动剂,如cd27和cd28;btk抑制剂;用于治疗hbv的其他药物;ido抑制剂;精氨酸酶抑制剂;以及kdm5抑制剂,更特别是选自直接作用的抗病毒药物(如核苷(酸)类似物)、细胞因子(如干扰素)、免疫调节剂、疫苗、衣壳组装调节剂(cam)、toll样受体调节剂(例如,tlr7/tlr8/tlr9调节剂),更特别是选自核苷(酸)类似物和干扰素,更特别是选自富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺、恩替卡韦、拉米夫定、替比夫定、这些核苷(酸)类似物中至少两种的任何组合、干扰素α、干扰素λ、聚乙二醇化干扰素、聚乙二醇化干扰素α。
168、干扰素
169、人干扰素根据其信号通过的受体类型分为三大类。在各种实施方案中,i-iii型中的任何一种干扰素与rnai组分联合使用以治疗hdv感染。所有i型ifn均结合至称作ifn-α受体(ifnar)的特异性细胞表面受体复合物,其由ifnar1和ifnar2链组成。人中存在的i型干扰素有ifn-α、ifn-β、ifn-ε和ifn-ω。ii型ifn结合至ifn-γ受体(ifngr),其由ifngr1和ifngr2链组成。人中的ii型干扰素有ifn-γ。最近分类的iii型干扰素组由3种ifn-λ分子组成,称作ifn-λl、ifn-λ2和ifn-λ3(也分别称作il29、il28a和il28b)。这些ifn通过由il10r2(也称作crf2-4)和ifnlr1(也称作crf2-12)组成的受体复合物传导信号。
170、在一方面,本发明提供联合疗法,其中干扰素-α或干扰素-λ与rnai组分和任选存在的核苷(酸)类似物(nuc)联合使用。如本文所用的术语“干扰素-α”或“ifn-a”以及“干扰素-λ”或“ifn-λ”是指抑制病毒复制和细胞增殖并调节免疫应答的相关多肽家族。为了本发明的目的,合适的干扰素包括但不限于聚乙二醇化ifn-a-2a、聚乙二醇化ifn-a-2b、共有ifn、ifn-λ(例如,ifn-λι,如ifn-xla)或聚乙二醇化ifn-λ(例如,聚乙二醇化ifn-λι如聚乙二醇化ifn-xla)。
171、干扰素α
172、术语“ifn-a”包括天然存在的ifn-a;合成的ifn-a;衍生的ifn-a(例如,聚乙二醇化ifn-a、糖基化ifn-a等);以及天然存在或合成的ifn-a的类似物。术语“ifn-a”还涵盖共有ifn-a。因此,基本上任何具有抗病毒特性的ifn-a或ifn-λ,如对天然存在的ifn-a描述的,都可以用于本发明的联合疗法。
173、术语“ifn-a”涵盖ifn-a的衍生物,它们被衍生化(例如,相对于天然存在的肽进行化学修饰)以改变某些特性,如血清半衰期。因此,术语“ifn-a”包括用聚乙二醇衍生的ifn-a(“聚乙二醇化ifn-a”),等等。聚乙二醇化ifn-a及其制备方法在例如美国专利号5,382,657;5,951,974;和5,981,709中讨论。聚乙二醇化ifn-a涵盖peg和任何上述ifn-a分子的缀合物,包括但不限于与干扰素α-2a(roferon,hoffman la-roche,nutley,n.j.)、干扰素α-2b(intron,schering-plough,madison,n.j.)、干扰素α-2c(berofor alpha,boehringeringelheim,ingelheim,germany)缀合的peg;以及通过确定天然存在的干扰素α的共有序列定义的共有干扰素(intermune,inc.,brisbane,ca.)。因此,在本发明的联合疗法的一些实施方案中,ifn-a已用一个或多个聚乙二醇部分修饰,即,聚乙二醇化。两种形式的聚乙二醇化干扰素,聚乙二醇干扰素α-2a(40kd)(genentech)和聚乙二醇干扰素α-2b(12kd)(merck)可商购,它们在药代动力学、病毒动力学、耐受性方面不同,因此剂量给药不同。
174、聚乙二醇干扰素α-2a由干扰素α-2a(~20kd)与40kd支化聚乙二醇(peg)共价连接组成。peg部分通过与赖氨酸的稳定酰胺键在单个位点与干扰素α部分连接。聚乙二醇干扰素α-2a的分子量约为60,000道尔顿。聚乙二醇干扰素-α-2a的生物活性源自其干扰素α-2a部分,该部分影响针对某些病毒的适应性和先天性免疫应答。这种α干扰素结合并激活肝细胞上的人1型干扰素受体,其激活多种细胞内信号转导途径,最终导致干扰素刺激的基因表达,产生一系列抗病毒作用,如阻断病毒蛋白合成和诱导病毒rna突变。与天然干扰素α-2a相比,聚乙二醇干扰素α-2a具有持续吸收、延迟清除的特点。聚乙二醇干扰素α-2a作为每周固定剂量使用。聚乙二醇干扰素α-2a在注射后具有相对恒定的吸收,并且主要分布在血液和器官中。
175、聚乙二醇干扰素α-2b由干扰素α-2b与12kd线性聚乙二醇(peg)共价连接组成。该分子的平均分子量约为31,300道尔顿。聚乙二醇干扰素α-2b主要包括单聚乙二醇化物质(一个peg分子连接至一个干扰素分子),仅有少量的二聚乙二醇化物质。已经鉴定出干扰素分子上的14个不同peg附着位点。聚乙二醇干扰素α-2b的生物活性源自其干扰素α-2b部分,该部分影响针对某些病毒的适应性和先天性免疫应答。这种α干扰素结合并激活肝细胞上的人1型干扰素受体,其激活多种细胞内信号转导途径,最终导致干扰素刺激的基因表达,产生一系列抗病毒作用,如阻断病毒蛋白合成和诱导病毒rna突变。与天然干扰素α-2b相比,聚乙二醇干扰素α-2b具有持续吸收、延迟清除和半衰期延长的特点。聚乙二醇干扰素α-2b根据患者的体重作为每周剂量使用。聚乙二醇干扰素α-2b具有快速吸收和在体内更广泛的分布。
176、聚乙二醇化ifn-a多肽的peg分子与ifn-a多肽的一条或多条氨基酸侧链缀合。在一实施方案中,聚乙二醇化ifn-a仅在一个氨基酸上含有peg部分。在另一实施方案中,聚乙二醇化ifn-a在两个或更多个氨基酸上含有peg部分,例如,ifn-a含有连接至2、3、4、5、6、7、8、9、10、11、12、13或14个不同氨基酸残基的peg部分。ifn-a可以通过氨基、巯基、羟基或羧基直接偶联至peg(即,没有连接基团)。
177、术语“ifn-a”还涵盖共有ifn-a。共有ifn-a(也称作“cifn”和“ifn-con”和“共有干扰素”)包括但不限于美国专利号4,695,623和4,897,471中公开的指定为ifn-conl、ifn-con2和ifn-con3的氨基酸序列;以及通过确定天然存在的干扰素α的共有序列而定义的共有干扰素(例如,three rivers pharmaceuticals,warrendale,pa)。ifn-conl是alfacon-1产品中的共有干扰素剂。共有干扰素产品在本文中由其品牌名称或其通用名称(干扰素alfacon-1)来指代。编码ifn-con的dna序列可以如上文提到的专利或其他标准方法所述合成。在一实施方案中,至少一种额外的治疗剂是cifn。
178、在本发明的联合疗法的各种实施方案中,使用包含ifn-a和异源多肽的融合多肽。合适的ifn-a融合多肽包括但不限于albuferon-alphatm(人白蛋白和ifn-a的融合产物;人类基因组科学;参见,例如,osborn et al.,2002,j.pharmacol.exp.therap.303:540-548)。同样适用于本方法的是ifn-a的基因改组形式。参见,例如,masci et al.,2003,curr.oncol.rep.5:108-113。合适的干扰素包括multiferon(viragen)、medusa干扰素(flamel technology)、locteron(octopus)和omega干扰素(intarcia/boehringeringelheim)。
179、干扰素λ
180、术语“ifn-λ”涵盖ifn-λ-1(其包括ifn-λ-la)、ifn-λ-2和ifn-λ-3。这些蛋白又分别称作白介素-29(il-29)、il-28a和il-28b。总的来说,这3种细胞因子包含ifn的iii型亚群。它们不同于i型和ii型ifn的原因有很多,包括它们通过异源二聚体受体复合物发出信号,这与i型或ii型ifn使用的受体不同。尽管i型ifn(ifn-α/β)和iii型ifn(ifn-λ)通过不同的受体复合物发出信号,但是它们在各种靶细胞中激活相同的胞内信号传导途径和许多相同的生物活性,包括抗病毒活性。干扰素λ可以以任何治疗适当的剂量给药,包括但不限于80、120或180mcg qw。在一些实施方案中,成年人的剂量是每周一次120微克。
181、在一些实施方案中,干扰素λ是干扰素λ的聚乙二醇化形式(例如,聚乙二醇化干扰素-1或聚乙二醇化干扰素-la)。在一些实施方案中,干扰素λ是美国专利号7,157,559中公开的干扰素,其援引加入本文。
182、虽然不希望受理论束缚,但是据信干扰素,如干扰素α或干扰素λ,诱导干扰素刺激的基因(isg),和/或刺激免疫应答,更特别是th1应答,如tbet转录因子的表达或激活增加,和/或cd4+t细胞产生的ifnγ增加(例如ifnγ/il4的比值高于1)。因此,根据本发明的实施方案,干扰素的给药增强rnai组分和/或核苷(酸)类似物(nuc)的治疗效果。
183、抗丁型肝炎病毒(hdv)剂
184、在一些实施方案中,有效量的rnai组分与有效量的至少一种抗hdv剂联合使用,更特别是有效量的至少一种抗hdv化合物,更特别是有效量的本技术的rnai组分以外的至少一种抗hdv剂或化合物,更特别是有效量的hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或有效量的法尼基转移酶抑制剂(例如,洛那法尼)。
185、在一些实施方案中,在rnai组分之前给药至少一种其他抗hdv剂(例如,hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或法尼基转移酶抑制剂(例如,洛那法尼))。在一些实施方案中,在rnai组分之前给药至少一种其他抗hdv剂(例如,hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或法尼基转移酶抑制剂(例如,洛那法尼)),并且一旦开始rnai组分给药就停止。
186、本文所述的组合可以用于下文所述的任何方法或试剂盒。
187、组合物
188、本文还提供药物组合物,用于治疗有此需要的受试者,优选有此需要的人受试者的丁型肝炎病毒感染,其中所述药物组合物包含有效量的rnai组分,其中所述rnai组分包含:
189、(i)第一rnai剂,其包含:
190、反义链,其包含以下任一个的核苷酸序列:seq id no:1、seq id no:2、seq idno:3、seq id no:4、seq id no:5、seq id no:6和seq id no:7,以及
191、正义链,其包含以下任一个的核苷酸序列:seq id no:10、seq id no:11、seq idno:12、seq id no:13、seq id no:14和seq id no:15;以及
192、(ii)第二rnai剂,其包含:
193、反义链,其包含以下任一个的核苷酸序列:seq id no:8和seq id no:9,以及
194、正义链,其包含以下任一个的核苷酸序列:seq id no:16、seq id no:17、seq idno:18和seq id no:19,
195、其中所述rnai组分配制为通过静脉内或皮下注射向受试者给药。在某些实施方案中,rnai组分配制为每月给药一次(或q4w)、每两个月给药一次(或q8w)或每三个月给药一次(或q12w),更特别是每月一次。在某些实施方案中,rnai组分以约40-200mg的剂量给药,更特别是100mg、150mg或200mg,更特别是100mg。
196、在一些实施方案中,治疗进一步包括给药有效量的至少一种抗hbv剂或化合物,更特别是本技术的rnai组分以外的至少一种抗hbv剂或化合物,更特别是抗hbv sirna以外的,更特别是选自以下的至少一种抗hbv剂:直接作用的抗病毒药物(如核苷(酸)类似物,更特别是富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺、恩替卡韦、拉米夫定、替比夫定、这些核苷(酸)类似物中至少两种的任何组合)、细胞因子(如干扰素,更特别是干扰素α、干扰素λ、聚乙二醇化干扰素、聚乙二醇化干扰素α)、hbv dna聚合酶抑制剂;免疫调节剂;toll样受体调节剂(例如,toll样受体7调节剂;toll样受体8调节剂;toll样受体3调节剂;toll样受体9调节剂);干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,如il12;衣壳组装调节剂,核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸-诱导基因1的刺激剂;nod2的刺激剂;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;免疫检查点抑制剂,如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂、ctla-4抑制剂;在免疫细胞(更特别是t细胞)上表达的共刺激受体的激动剂,如cd27和cd28;btk抑制剂;用于治疗hbv的其他药物;ido抑制剂;精氨酸酶抑制剂;以及kdm5抑制剂,更特别是选自直接作用的抗病毒药物(如核苷(酸)类似物)、细胞因子(如干扰素)、免疫调节剂、疫苗、衣壳组装调节剂(cam)、toll样受体调节剂(例如,tlr7/tlr8/tlr9调节剂),更特别是选自核苷(酸)类似物和干扰素,更特别是选自富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺、恩替卡韦、拉米夫定、替比夫定、这些核苷(酸)类似物中至少两种的任何组合、干扰素α、干扰素λ、聚乙二醇化干扰素、聚乙二醇化干扰素α。
197、在一些实施方案中,治疗进一步包括给药有效量的至少一种抗hdv剂或化合物,更特别是有效量的本技术的rnai组分以外的至少一种其他抗hdv剂或化合物,更特别是有效量的hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或有效量的法尼基转移酶抑制剂(例如,洛那法尼)。在一些实施方案中,在rnai组分之前给药至少一种其他抗hdv剂(例如,hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或法尼基转移酶抑制剂(例如,洛那法尼))。在一些实施方案中,在rnai组分之前给药至少一种其他抗hdv剂(例如,hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或法尼基转移酶抑制剂(例如,洛那法尼)),并且一旦开始rnai组分给药就停止。
198、本文还提供一种包含rnai组分以及核苷(酸)类似物(nuc)或ifn的组合物,其中(a)所述rnai组分包含
199、(i)第一rnai剂,其包含:
200、反义链,其包含以下任一个的核苷酸序列:seq id no:1、seq id no:2、seq idno:3、seq id no:4、seq id no:5、seq id no:6和seq id no:7,以及
201、正义链,其包含以下任一个的核苷酸序列:seq id no:10、seq id no:11、seq idno:12、seq id no:13、seq id no:14和seq id no:15;以及
202、(ii)第二rnai剂,其包含:
203、反义链,包含以下任一个的核苷酸序列:seq id no:8和seq id no:9,以及
204、正义链,包含以下任一个的核苷酸序列:seq id no:16、seq id no:17、seq idno:18和seq id no:19。
205、rnai剂药物组合物
206、在另一方面,本文描述的是有此需要的受试者,优选有此需要的人受试者中丁型肝炎病毒(hdv)感染的治疗性和/或预防性治疗的方法,所述方法包括给药包含一种或多种rnai剂的药物组合物,其可以根据是否需要局部或全身治疗以各种方式给药。给药可以是但不限于静脉内、动脉内、皮下、腹腔内、真皮下(例如,通过植入装置)和实质内给药。在一些实施方案中,本文所述药物组合物通过皮下注射给药。
207、在另一方面,本文所述方法包括一种或多种rnai剂,其中所述一种或多种rnai剂制备为药物组合物或制剂。在一些实施方案中,药物组合物包括至少一种rnai剂。这些药物组合物在抑制靶细胞、细胞组、组织或生物体中靶mrna的表达方面特别有用。药物组合物可以用于治疗患有疾病或病症的患者,其会受益于靶mrna水平的降低或靶基因表达的抑制。药物组合物可以用于治疗有发展疾病或病症风险的患者,其会受益于靶mrna水平的降低或靶基因表达的抑制。在一实施方案中,所述方法包括向待治疗的受试者给药如本文所述与靶向配体连接的rnai剂。在一些实施方案中,将一种或多种药学可接受的赋形剂(包括媒介物、载剂、稀释剂和/或递送聚合物)添加至包括rnai剂的药物组合物,从而形成适合体内递送至人的药物制剂。
208、包括rnai剂的药物组合物和本文公开的方法可以降低细胞、细胞组、多种细胞组、组织或受试者中靶mrna的水平,包括:向受试者给药治疗有效量的本文所述rnai剂,从而抑制受试者中靶mrna的表达。
209、在一些实施方案中,包括rnai剂的药物组合物用于治疗或管理与hdv感染相关的临床表现,例如,hdv/hbv共感染。在一些实施方案中,向需要这种治疗、预防或管理的受试者给药治疗或预防有效量的一种或多种药物组合物。在一些实施方案中,任何公开的rnai剂的给药都可以用于减少受试者中疾病症状的数量、严重程度和/或频率。
210、包括rnai剂的药物组合物可以用于治疗患有疾病或病症的受试者的至少一种症状,其会受益于靶mrna表达的减少或抑制。在一些实施方案中,向受试者给药治疗有效量的一种或多种包括rnai剂的药物组合物,从而治疗症状。在其他实施方案中,向受试者给药预防有效量的一种或多种rnai剂,从而预防至少一种症状。
211、给药途径是使rnai剂与身体接触的途径。一般来说,给药用于治疗哺乳动物的药物和核酸的方法是本领域公知的,并且可以应用于本文所述组合物的给药。本文公开的rnai剂可以通过任何合适的途径在适合特定途径的制剂中给药。因此,本文所述药物组合物可以通过注射给药,例如,静脉内注射、肌肉内注射、皮内注射、皮下注射、关节内注射或腹腔内注射。在一些实施方案中,本文所述药物组合物通过皮下注射。
212、在某些实施方案中,rnai组分包含在注射器中,例如玻璃注射器,并且其中注射器任选地适合由患者自行给药rnai组分或由未经培训的人员向患者给药rnai组分。
213、在某些实施方案中,注射器适合由患者自行给药rnai组分,并且其中注射器放置在符合人体工程学的外壳或手柄中,以稳定注射器供患者自行注射,或者在自动注射器装置中提供。
214、本文所述包括rnai剂的药物组合物可以使用本领域已知的寡核苷酸递送技术递送至细胞、细胞组、肿瘤、组织或受试者。一般来说,本领域公认的用于递送核酸分子(体外或体内)的任何合适方法都可以适用于本文所述的组合物。例如,递送可以通过局部给药,(例如,直接注射、植入或体表给药),全身给药,或者皮下、静脉内、腹腔内或肠胃外途径,包括颅内(例如,脑室内、脑实质内和鞘内)、肌肉内、透皮、气道(气溶胶)、鼻腔、口服、直肠或体表(包括口腔和舌下)给药。在某些实施方案中,组合物通过皮下或静脉内输注或注射给药。
215、因此,在一些实施方案中,本文所述的药物组合物可以包含一种或多种药学可接受的载剂、药学可接受的稀释剂、药学可接受的赋形剂或上述任何一种的组合。在一些实施方案中,本文所述的药物组合物可以配制为向受试者给药。
216、如本文所用,药物组合物或药物包括药理学上有效量的至少一种所述治疗化合物以及一种或多种药学可接受的赋形剂。药学可接受的赋形剂(赋形剂)是除活性药物成分(api,治疗产品,例如,rnai剂)以外有意包括在药物递送系统中的物质。赋形剂在预定剂量下不发挥或不意图发挥治疗作用。赋形剂可以起到以下作用:a)在制造过程中帮助药物递送系统的加工;b)保护、支持或增强api的稳定性、生物利用度或患者可接受性,c)协助产品鉴定,和/或d)在储存或使用期间增强api递送的整体安全性、有效性的任何其他属性。药学可接受的赋形剂可以是或可以不是惰性物质。
217、赋形剂包括但不限于:吸收促进剂、抗粘附剂、消泡剂、抗氧化剂、粘合剂、缓冲剂、载剂、包衣剂、着色剂、递送促进剂、递送聚合物、葡聚糖、葡萄糖、稀释剂、崩解剂、乳化剂、扩展剂、填充剂、香料、助流剂、保湿剂、润滑剂、油、聚合物、防腐剂、盐水、盐、溶剂、糖、悬浮剂、缓释基质、甜味剂、增稠剂、张度剂、媒介物、拒水剂(water-repelling agent)和湿润剂。
218、适合注射使用的药物组合物包括无菌水性溶液(如果是水溶性的)或分散液,以及用于即时制备无菌可注射的溶液或分散液的无菌粉末。对于静脉内给药,合适的载剂包括生理盐水、抑菌水、cremophor eltm(basf,parsippany,nj)或磷酸缓冲盐水。其应当在制备和储存条件下稳定,并且应当受到保护以免于微生物如细菌和真菌的污染作用。载剂可以是溶剂或分散介质,其包含例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇),以及它们的合适混合物。例如,可以通过使用包衣如卵磷脂,在分散剂的情况下通过保持所需的粒径以及通过使用表面活性剂来保持适当的流动性。在许多情况下,会优选在组合物中包括等渗剂,例如糖,多元醇如甘露醇、山梨醇和氯化钠。可注射组合物延长的吸收可以通过在组合物中包括延迟吸收的物质来实现,例如,单硬脂酸铝和明胶。
219、无菌可注射溶液可以这样制备,将需要量的活性化合物与需要的上文所列的一种成分或多种成分的组合加入适当的溶剂,然后过滤除菌。一般来说,通过将活性化合物加入无菌媒介物来制备分散剂,所述无菌媒介物包含基本的分散介质和来自上文所列那些的所需其他成分。在用于制备无菌注射溶液的无菌粉末的情况下,制备方法包括真空干燥和冷冻干燥,从先前无菌过滤的溶液获得活性成分的粉末加上任何额外的期望成分。
220、适合关节内给药的制剂可以是药物的无菌水性制品形式,所述药物可以是微晶形式,例如,水性微晶混悬剂的形式。脂质体制剂或生物可降解聚合物系统也可以用于呈递药物,用于关节内和眼部给药。
221、活性化合物可以用保护化合物免于体内快速消除的载剂制备,如控释制剂,包括植入物和微囊递送系统。可以使用生物可降解的生物相容性聚合物,如乙烯乙酸乙烯酯、聚酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。制备这类制剂的方法对于本领域技术人员是显而易见的。脂质体悬浮液也可以用作药学可接受的载剂。这些可以根据本领域技术人员已知的方法制备,例如,如美国专利号4,522,811所述。
222、为了易于给药和剂量的均匀性,可以将rnai剂配制在剂量单位形式的组合物中。剂量单位形式是指适合作为单位剂量用于待治疗的受试者的物理上分离的单位;每个单位含有预定量的活性化合物,与所需的药物载剂一起计算产生期望的治疗效果。本公开的剂量单位形式的规格受限于并直接取决于活性化合物的独特特征和待实现的治疗效果,以及复合这样的活性化合物用于治疗个体的领域中固有的限制。
223、药物组合物可以含有在药物组合物中常见的其他额外组分。这类额外组分包括但不限于:止痒剂、收敛剂、局部麻醉剂或抗炎剂(例如,抗组胺剂、苯海拉明等)。还设想表达或包含本文定义的rnai剂的细胞、组织或分离器官可以用作“药物组合物”。如本文所用,“药理有效量”、“治疗有效量”或简单的“有效量”是指产生药理、治疗或预防结果的rnai剂的量。
224、一般来说,活性化合物的有效量会在约0.1至约100mg/kg体重/天的范围内,例如,约1.0至约50mg/kg体重/天。在一些实施方案中,活性化合物的有效量会在每剂量约0.25至约5mg/kg体重的范围内。在一些实施方案中,活性化合物的有效量会在每1-18周或1-6个月25-400mg的范围内。在一些实施方案中,活性化合物的有效量会在每4周(q4w)或每一个月(q1m)或每两个月(q2m)或每三个月(q3m)40-250mg的范围内。术语“q4w”和“q1m”、“每4周”和“每一个月”以及它们的变化可以在本技术中互换使用。术语“q8w”和“q2m”、“每8周”和“每两个月”以及它们的变化可以在本技术中互换使用。术语“q12w”和“q3m”、“每12周”和“每三个月”以及它们的变化可以在本技术中互换使用。在一些实施方案中,活性成分的有效量会在每剂量约0.5至约3mg/kg体重的范围内。在一些实施方案中,活性成分的有效量会在每剂量约25-400mg的范围内。在一些实施方案中,活性成分的有效量会在每剂量约50-125mg的范围内。在一些实施方案中,活性成分的有效量是每剂量约100mg、约150mg或约200mg。给药的量还可能取决于这类变量如患者的整体健康状况、所递送的化合物的相对生物效力、药物的制剂、制剂中赋形剂的存在和类型以及给药途径。而且,应当理解,为了快速达到所需的血液水平或组织水平,可以将给药的初始剂量增加至超过上述上限,或者初始剂量可以小于最佳剂量。
225、在一些实施方案中,rnai组分的有效量在每剂量约25-600mg的范围内。在一些实施方案中,rnai组分的有效量在每剂量约25-50mg、约50-75mg、约75-100mg、约100-150mg、约150-200mg、约200-250mg、约250-300mg、约300-400mg、约400-500mg或约500-600mg的范围内。在一些实施方案中,rnai组分的有效量是每剂量约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约125mg、约150mg、约175mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg或约600mg。在一些实施方案中,rnai组分的有效量是每剂量约25mg、约35mg、约40mg、约50mg、约100mg、约150mg或约200mg。
226、本文所述的一种或多种(例如,至少两种)rnai剂可以配制在一个单一组合物或不同的单独组合物中。在一些实施方案中,不同的单独组合物中的rnai剂可以用相同或不同的赋形剂和载剂配制。在一些实施方案中,不同的单独组合物中的rnai剂可以通过相同或不同的给药途径进行给药。在一些实施方案中,rnai剂皮下给药。
227、为了治疗疾病或者形成治疗疾病的药物或组合物,本文所述包括rnai剂的药物组合物可以与赋形剂或者第二治疗剂或治疗组合,包括但不限于:第二或其他rnai剂、抗hbv剂、抗hdv剂、小分子药物、抗体、抗体片段和/或疫苗。
228、当添加至药学可接受的赋形剂或佐剂时,rnai剂可以包装在试剂盒、容器、包装或分配器中。本文所述的药物组合物可以包装在预先填充的注射器或小瓶中。
229、在一些实施方案中,组合物包含每剂量约25-600mg范围内的有效量的rnai组分以及约0.1-600mg范围内的有效量的核苷(酸)类似物(nuc)。在一些实施方案中,组合物包含每剂量约40-200mg范围内的有效量的rnai组分以及约0.1-600mg范围内的有效量的核苷(酸)类似物(nuc)。在一些实施方案中,组合物包含每剂量约25mg、约35mg、约40mg、约50mg、约100mg、约150mg或约200mg的有效量的rnai以及约0.1mg、约5.0mg、约50mg、约100mg、约150mg、约300mg或约600mg的核苷(酸)类似物(nuc)。
230、干扰素药物组合物
231、任何合适的干扰素药物组合物,包括本领域已知和/或本文所述的那些,都可以用于本技术的联合治疗。组合物可以每剂量约25-500mcg的范围内给药,更特别是每剂量25-360mcg。
232、试剂盒
233、本文提供一种试剂盒,其包含有效量的rnai组分以及有效量的至少一种抗hbv剂和/或至少一种抗hdv剂。
234、在一些实施方案中,试剂盒包含有效量的rnai组分以及有效量的至少一种抗hbv剂或化合物,更特别是本技术的rnai组分以外的至少一种抗hbv剂或化合物,更特别是抗hbv sirna以外的,更特别是选自以下的至少一种抗hbv剂:直接作用的抗病毒药物(如核苷(酸)类似物,更特别是富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺、恩替卡韦、拉米夫定、替比夫定、这些核苷(酸)类似物中至少两种的任何组合);细胞因子(如干扰素,更特别是干扰素α、干扰素λ、聚乙二醇化干扰素、聚乙二醇化干扰素α);hbv dna聚合酶抑制剂;免疫调节剂;toll样受体调节剂(例如,toll样受体7调节剂;toll样受体8调节剂;toll样受体3调节剂;toll样受体9调节剂);干扰素α受体配体;透明质酸酶抑制剂;il-10的调节剂;hbsag抑制剂;亲环蛋白抑制剂;hbv预防性疫苗;hbv治疗性疫苗;hbv病毒进入抑制剂;内切核酸酶调节剂;核糖核苷酸还原酶的抑制剂;乙型肝炎病毒e抗原抑制剂;靶向乙型肝炎病毒表面抗原的hbv抗体;hbv抗体;ccr2趋化因子拮抗剂;胸腺素激动剂;细胞因子,如il12;衣壳组装调节剂,核蛋白抑制剂(hbv核心或衣壳蛋白抑制剂);核酸聚合物(nap);视黄酸-诱导基因1的刺激剂;nod2的刺激剂;乙型肝炎病毒复制抑制剂;pi3k抑制剂;cccdna抑制剂;免疫检查点抑制剂,如pd-l1抑制剂、pd-1抑制剂、tim-3抑制剂、tigit抑制剂、lag3抑制剂、ctla-4抑制剂;在免疫细胞(更特别是t细胞)上表达的共刺激受体的激动剂,如cd27和cd28;btk抑制剂;用于治疗hbv的其他药物;ido抑制剂;精氨酸酶抑制剂;以及kdm5抑制剂,更特别是选自直接作用的抗病毒药物(如核苷(酸)类似物)、细胞因子(如干扰素)、免疫调节剂、疫苗、衣壳组装调节剂(cam)、toll样受体调节剂(例如,tlr7/tlr8/tlr9调节剂),更特别是选自核苷(酸)类似物和干扰素,更特别是选自富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺、恩替卡韦、拉米夫定、替比夫定、这些核苷(酸)类似物中至少两种的任何组合、干扰素α、干扰素λ、聚乙二醇化干扰素、聚乙二醇化干扰素α。
235、在一些实施方案中,试剂盒包含有效量的rnai组分以及有效量的至少一种抗hdv剂或化合物,更特别是有效量的本技术的rnai组分以外的至少一种抗hdv剂或化合物,更特别是有效量的hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或有效量的法尼基转移酶抑制剂(例如,洛那法尼)。在一些实施方案中,在rnai组分之前给药至少一种其他抗hdv剂(例如,hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或法尼基转移酶抑制剂(例如,洛那法尼))。在一些实施方案中,在rnai组分之前给药至少一种其他抗hdv剂(例如,hdv进入抑制剂(例如,myrrcludex(布乐韦肽))和/或法尼基转移酶抑制剂(例如,洛那法尼)),并且一旦开始rnai组分给药就停止。
236、在另一方面,试剂盒进一步包括包装插页,其包括但不限于制备和给药制剂的适当说明、制剂的副作用以及任何其他相关信息。说明可以是任何合适的形式,包括但不限于印刷品、录像带、计算机可读磁盘、光盘或基于互联网的说明的指示。
237、在另一方面,提供用于治疗患有本文所述疾病状况或易受其影响的个体的试剂盒,包括含有本文公开的组合物或制剂的剂量的第一容器,以及关于使用的包装插页。容器可以是本领域已知的任何容器,适合静脉内制剂的储存和递送。在某些实施方案中,试剂盒进一步包括第二容器,其包括药学可接受的载剂、稀释剂、佐剂等,用于制备向个体给药的制剂。
238、在一些实施方案中,试剂盒包含一个或多个剂量的rnai组分,在每剂量约25-600mg的范围内。在一些实施方案中,试剂盒包含一个或多个剂量的rnai组分,在每剂量约25-50mg、约50-75mg、约75-100mg、约100-150mg、约150-200mg、约200-250mg、约250-300mg、约300-400mg、约400-500mg或约500-600mg的范围内。在一些实施方案中,试剂盒包含一个或多个剂量的rnai组分,每剂量约25mg、约30mg、约35mg、约40mg、约45mg、约50mg、约55mg、约60mg、约65mg、约70mg、约75mg、约80mg、约85mg、约90mg、约95mg、约100mg、约125mg、约150mg、约175mg、约200mg、约250mg、约300mg、约350mg、约400mg、约450mg、约500mg、约550mg或约600mg。在一些实施方案中,试剂盒包含一个或多个剂量的rnai组分,每剂量约25mg、约35mg、约40mg、约50mg、约100mg、约150mg或约200mg。
239、在一些实施方案中,试剂盒包含一个或多个剂量的核苷(酸)类似物(nuc),范围约为0.1-600mg。在一些实施方案中,核苷(酸)类似物(nuc)是恩替卡韦,并且提供一个或多个剂量,在约0.1-5mg、约0.1-4mg、约0.1-3mg、约0.1-2mg、约0.1-1mg、约0.5-5mg、约0.5-4mg、约0.5-3mg、约0.5-2mg、约1-5mg、约1-4mg、约1-3mg、约1-2mg、约2.5-5mg、约2.5-4mg或约2.5-3mg的范围内。在一些实施方案中,核苷(酸)类似物(nuc)是替诺福韦艾拉酚胺,并且提供一个或多个剂量,在约5-50mg、约5-40mg、约5-30mg、约5-20mg、约5-10mg、约10-50mg、约10-40mg、约10-30mg、约10-20mg、约15-50mg、约15-40mg、约15-30mg、约20-50mg、约20-40mg、约20-30mg、约25-50mg、约25-40mg、约30-50mg或约30-40mg的范围内。在一些实施方案中,核苷(酸)类似物(nuc)是替诺福韦二吡呋酯,并且提供一个或多个剂量,在约200-500mg、约200-400mg、约200-300mg、约300-500mg或约300-400mg的范围内。在一些实施方案中,核苷(酸)类似物(nuc)是拉米夫定,并且以约100mg、约150mg或约300mg提供一个或多个剂量。在一些实施方案中,核苷(酸)类似物(nuc)是替比夫定,并且以约600mg提供一个或多个剂量。
240、在一些实施方案中,试剂盒包含一个或多个剂量的干扰素,在每剂量约10-25mcg、约25-100mcg、约50-100mcg、约100-150mcg、约150-200mcg、约200-250mcg、约250-300mcg、约300-400mcg或约400-500mcg的范围内。在一些实施方案中,试剂盒包含一个或多个剂量的聚乙二醇化ifnλ-la、聚乙二醇化干扰素α-2a或聚乙二醇化ifnλ-la,每剂量约75mcg、约80mcg、约85mcg、约90mcg、约95mcg、约100mcg、约125mcg、约150mcg、约175mcg、约200mcg、约250mcg、约300mcg。
241、在一些实施方案中,试剂盒含有可用于本发明的rnai组分,如本文所述的那些,用于每月一次(或每四周(q4w))、每两个月一次(或每八周(q8w))或每三个月一次(或每十二周(q12w))向受试者给药,剂量为约40-250mg,更特别是40-200mg,更特别是100mg、150mg或200mg;更特别是100mg;以及核苷(酸)类似物(nuc),如本文所述的那些,以约0.1-600mg、约0.1-5mg、约5-50mg、约200-500mg、约100mg、约150mg、约300mg或约600mg的每日剂量向受试者给药,更特别地恩替卡韦的每日剂量约0.1-5mg,替诺福韦艾拉酚胺的每日剂量约5-50mg,替诺福韦二吡呋酯的每日剂量约200-500mg,拉米夫定的每日剂量约100mg、约150mg或约300mg,或者替比夫定的每日剂量约600mg。
242、在一些实施方案中,试剂盒进一步包括使用其中包含的rnai组分以及核苷(酸)类似物(nuc)或ifn给药治疗感染hdv的受试者,特别是患有hdv/hbv共感染的受试者的说明书。在一些实施方案中,试剂盒进一步包括使用其中包含的rnai组分以及核苷(酸)类似物(nuc)或ifn向患有代偿性肝硬化的受试者给药的说明书。
243、在另一方面,还提供含有足够剂量的本文所述组合物(包括其药物组合物)的试剂盒,以便为个体提供长时间的有效治疗,如1–3天、1–5天、1周、2周、3周、4周、6周、8周、12周、16周、20周、24周、28周、32周、36周、40周、44周、48周、52周、2年、3年、4年、5年、6年、7年、8年、9年、10年、1周期、2周期、3周期、4周期、5周期、6周期、7周期、8周期或更长。在一些实施方案中,一个治疗周期为约1-24个月、约1-3个月、约3-6个月、约6-9个月、约9-12个月、约12-18个月、约18-21个月或约21-24个月。在一些实施方案中,一个治疗周期为约1个月、约2个月、约3个月、约4个月、约5个月、约6个月、约7个月、约8个月、约9个月、约10个月、约11个月、约12个月、约15个月、约18个月、约21个月或约24个月。
244、在一些实施方案中,试剂盒还可以包括多个剂量,并且可以包装成足以在药房(例如,医院药房和复合药房)储存和使用的数量。在某些实施方案中,试剂盒可以包括本文公开的至少一种组合物的剂量。
245、方法
246、本文还提供一种治疗有此需要的受试者,优选有此需要的人受试者的丁型肝炎病毒(hdv)感染的方法,其中所述方法包括向受试者给药有效量的rnai组分以及至少一种抗hbv剂(除rnai组分以外,例如,核苷(酸)类似物(nuc)、ifn)和/或至少一种抗hdv剂(除rnai组分以外,例如,myrrcludex或洛那法尼),更特别是有效量的至少一种抗hbv剂(除rnai剂以外),其中所述抗hbv剂是核苷(酸)类似物(nuc)或ifn,如本文所述的那些。
247、在一些实施方案中,核苷(酸)类似物(nuc)或干扰素在rnai组分之前不给药。在一些实施方案中,rnai组分在核苷(酸)类似物(nuc)之前或同时给药。
248、在一些实施方案中,hdv感染是hdv/hbv共感染。在一些实施方案中,受试者进一步包括肝硬化,更特别是代偿性肝硬化。在一些实施方案中,受试者是没有肝硬化的患者。
249、在一些实施方案中,向受试者给药有效量的包含rnai组分的药物组合物以及有效量的包含核苷(酸)类似物(nuc)或ifn的药物组合物,至少直至受试者满足以下五个特征中的至少一个、至少两个、至少三个、至少四个或五个:(i)血清hdv rna水平下降至少2log或血清hdv rna水平检测不到;(ii)如果受试者是雄性受试者,血清alt浓度为40u/l或更低,或者如果受试者是雌性受试者,血清alt浓度为30u/l或更低,或者血清alt浓度(从基线)相对减少至少40%,更特别是至少50%;(iii)hbeag-阴性血清,(iv)血清hbsag水平为100iu/ml或更低,更特别是10iu/ml或更低,更特别是hbsag血清清除;以及(v)hbs血清转换。在一些实施方案中,在治疗结束后六(6)个月仍然满足特征(i)、(ii)、(iii)、(iv)和(v)中的至少一个、至少两个、至少三个、至少四个或五个。
250、在一些实施方案中,向受试者给药有效量的包含rnai组分的药物组合物和/或有效量的包含核苷(酸)类似物(nuc)或ifn的药物组合物,至少直至受试者满足以下四个特征中的至少一个、至少两个、至少三个或四个:(i)血清hdv rna水平下降至少2个log或血清hdv rna水平检测不到;(ii)如果受试者是雄性受试者,血清alt浓度为40u/l或更低,或者如果受试者是雌性受试者,血清alt浓度为30u/l或更低,或者血清alt浓度(从基线)相对减少至少40%,更特别是至少50%;(iii)hbeag-阴性血清;以及(iv)血清hbsag水平为100iu/ml或更低,更特别是10iu/ml或更低,更特别是hbsag血清清除。在一些实施方案中,在治疗结束后六(6)个月仍然满足特征(i)、(ii)、(iii)和(iv)中的至少一个、至少两个、至少三个或四个。
251、在一些实施方案中,所述方法包括给药有效量的包含rnai组分的药物组合物和/或有效量的包含核苷(酸)类似物(nuc)或ifn的药物组合物,至少直至血清hdv rna水平下降2log或至少直至受试者体内血清hdv rna水平检测不到。在一些实施方案中,所述方法包括给药有效量的包含rnai组分的药物组合物,至少直至受试者的血清hbsag水平下降至100iu/ml或更低,更特别是下降至10iu/ml或更低,更特别是hbsag血清清除。在一些实施方案中,在受试者的hbsag水平达到100iu/ml或更低,更特别是10iu/ml或更低之后,停止给药有效量的包含rnai组分的药物组合物。可选地或补充地,在hdv rna被抑制之后,更特别是检测不到或低于lloq之后,停止给药有效量的包含rnai组分的药物组合物。
252、在一些实施方案中,向受试者给药包含rnai组分的药物组合物1年(48周)或者至少1年(至少48周)、至少2年、至少3年、至少4年、至少5年、至少6年、至少7年、至少8年、至少9年或至少10年。
253、在一些实施方案中,在受试者体内检测到hbs血清转换之后停止给药包含rnai组分的药物组合物。在一些实施方案中,在停止给药有效量的rnai组分之后继续给药核苷(酸)类似物(nuc)或干扰素。
254、在一些实施方案中,hdv治疗方案可以是有限的hdv治疗方案(例如,1、2、3、4、5、6、7、8、9或10年)或慢性抑制性hdv治疗方案。
255、在一些实施方案中,rnai组分包含:(i)第一rnai剂,其包含:反义链,其包含以下任一个的核苷酸序列:seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6和seq id no:7,以及正义链,其包含以下任一个的核苷酸序列:seq id no:10、seq id no:11、seq id no:12、seq id no:13、seq id no:14和seq id no:15;以及(ii)第二rnai剂,其包含:反义链,其包含以下任一个的核苷酸序列:seq id no:8和seq id no:9,以及正义链,其包含以下任一个的核苷酸序列:seq id no:16、seq id no:17、seq idno:18和seq id no:19。
256、在一些实施方案中,第一rnai剂包含seq id no:5和seq id no:14。在一些实施方案中,第一rnai剂包含seq id no:6和seq id no:14。在一些实施方案中,第一rnai剂包含seq id no:7和seq id no:15。在一些实施方案中,第一rnai剂包含seq id no:1以及seqid no:10、11或13。在一些实施方案中,第一rnai剂包含seq id no:2以及seq id no:10、11或13。在一些实施方案中,第一rnai剂包含seq id no:3和seq id no:10、11或13。在一些实施方案中,第一rnai剂包含seq id no:4和seq id no:12。在一些实施方案中,第二rnai剂包含seq id no:9和seq id no:19。在一些实施方案中,第二rnai剂包含seq id no:8和seqid no:16、17或18。
257、在一些实施方案中,rnai组分包括含有seq id no:5和seq id no:14的第一rnai剂以及含有seq id no:9和seq id no:19的第二rnai剂。在一些实施方案中,rnai组分包括含有seq id no:6和seq id no:14的第一rnai剂以及含有seq id no:9和seq id no:19的第二rnai剂。在一些实施方案中,rnai组分包括含有seq id no:7和seq id no:15的第一rnai剂以及含有seq id no:9和seq id no:19的第二rnai剂。
258、在一些实施方案中,rnai组分包括含有seq id no:1和seq id no:10、11或13的第一rnai剂以及含有seq id no:8和seq id no:16、17或18的第二rnai剂。在一些实施方案中,rnai组分包括含有seq id no:2和seq id no:10、11或13的第一rnai剂以及含有seq idno:8和seq id no:16、17或18的第二rnai剂。在一些实施方案中,rnai组分包括含有seq idno:3和seq id no:10、11或13的第一rnai剂以及含有seq id no:8和seq id no:16、17或18的第二rnai剂。在一些实施方案中,rnai组分包括含有seq id no:4和seq id no:12的第一rnai剂以及含有seq id no:8和seq id no:16、17或18的第二rnai剂。
259、在一些实施方案中,rnai组分包括含有seq id no:2和seq id no:11的第一rnai剂以及含有seq id no:16和seq id no:8的第二rnai剂。
260、在一些实施方案中,两种rnai剂以约1:1、2:1、3:1、4:1或5:1的比例给药。在一些实施方案中,两种rnai剂以约2:1的比例给药。
261、在一些实施方案中,两种rnai剂以约25-75mg/剂量给药的组合量并以约2:1、约3:1、约1:1、约4:1、约5:1或约1:2的比例给药。在一些实施方案中,两种rnai剂以约35-40mg/剂量给药的组合量并以约2:1、约3:1、约1:1、约4:1、约5:1或约1:2的比例给药。在一些实施方案中,两种rnai剂以约50-125mg/剂量给药的组合量并以约2:1、约3:1、约1:1、约4:1、约5:1或约1:2的比例给药。在一些实施方案中,两种rnai剂以约75-150mg/剂量给药的组合量并以约2:1、约3:1、约1:1、约4:1、约5:1或约1:2的比例给药。在一些实施方案中,两种rnai剂以约100-200mg/剂量给药的组合量并以约2:1、约3:1、约1:1、约4:1、约5:1或约1:2的比例给药。在一些实施方案中,两种rnai剂以约150-250mg/剂量给药的组合量并以约2:1、约3:1、约1:1、约4:1、约5:1或约1:2的比例给药。在一些实施方案中,两种rnai剂以约200-300mg/剂量给药的组合量并以约2:1、约3:1、约1:1、约4:1、约5:1或约1:2的比例给药。在一些实施方案中,两种rnai剂以约300-400mg/剂量给药的组合量并以约2:1、约3:1、约1:1、约4:1、约5:1或约1:2的比例给药。在一些实施方案中,两种rnai剂以约50-100mg/剂量给药的组合量并以约2:1、约3:1、约1:1、约4:1、约5:1或约1:2的比例给药。在一些实施方案中,两种rnai剂以约25-400mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约25-75mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约35-40mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约50-125mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约75-150mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约100-200mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约125-225mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约150-250mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约200-300mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约300-400mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约100mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约25mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约35mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约40mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约50mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约75mg/剂量给药的组合量并以约2:1的比例给药。在一些实施方案中,两种rnai剂以约200mg/剂量给药的组合量并以约2:1的比例给药。
262、在一些实施方案中,第一rnai剂以约3-650mg/剂量给药的量给药,第二rnai剂以约2-325mg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约15-150mg/剂量给药的量给药,第二rnai剂以约5-75mg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约35-265mg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约50-75mg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约15-75mg/剂量给药的量给药。在一些实施方案中,第二rnai剂以约20-125mg/剂量给药的量给药。在一些实施方案中,第二rnai剂以约25-50mg/剂量给药的量给药。在一些实施方案中,第二rnai剂以约5-40mg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约17mg/剂量给药的量给药,第二rnai剂以约8mg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约23mg/剂量给药的量给药,第二rnai剂以约12mg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约27mg/剂量给药的量给药,第二rnai剂以约13mg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约33mg/剂量给药的量给药,第二rnai剂以约17mg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约67mg/剂量给药的量给药,第二rnai剂以约33mg/剂量给药的量给药。
263、在一些实施方案中,两种rnai剂以25-400mg/剂量给药的组合剂量给药。在一实施方案中,两种rnai剂以25-400mg的组合剂量给药,并且第一rnai剂与第二rnai剂以1:1的比例给药。在一实施方案中,第一和第二rnai剂中每种的剂量为约12mg的量,组合剂量为约25mg。在一实施方案中,第一和第二rnai剂中每种的剂量为约17mg的量,组合剂量为约35mg。在一实施方案中,第一和第二rnai剂中每种的剂量为约20mg的量,组合剂量为约40mg。在一实施方案中,第一和第二rnai剂中每种的剂量为约25mg的量,组合剂量为约50mg。在一实施方案中,第一和第二rnai剂中每种的剂量为约50mg的量,组合剂量为约100mg。在一实施方案中,第一和第二rnai剂中每种的剂量为约100mg的量,组合剂量为约200mg。在一实施方案中,第一和第二rnai剂中每种的剂量为约150mg的量,组合剂量为约300mg。在一实施方案中,第一和第二rnai剂中每种的剂量为约200mg的量,组合剂量为约400mg。
264、在一实施方案中,两种rnai剂以25-400mg/剂量的组合剂量给药,并且第一rnai剂与第二rnai剂以2:1的比例给药。在一实施方案中,第一rnai剂的剂量为约16mg的量,第二rnai剂的剂量为约8mg的量,组合剂量为约25mg。在一实施方案中,第一rnai剂的剂量为约24mg的量,第二rnai剂的剂量为约12mg的量,组合剂量为约35mg。在一实施方案中,第一rnai剂的剂量为约27mg的量,第二rnai剂的剂量为约13mg的量,组合剂量为约40mg。在一实施方案中,第一rnai剂的剂量为约33mg的量,第二rnai剂的剂量为约17mg的量,组合剂量为约50mg。在一实施方案中,第一rnai剂的剂量为约65mg的量,第二rnai剂的剂量为约35mg的量,组合剂量为约100mg。在一实施方案中,第一rnai剂的剂量为约133mg的量,第二rnai剂的剂量为约67mg的量,组合剂量为约200mg。在一实施方案中,第一rnai剂的剂量为约200mg的量,第二rnai剂的剂量为约100mg的量,组合剂量为约300mg。在一实施方案中,第一rnai剂的剂量为约270mg的量,第二rnai剂的剂量为约135mg的量,组合剂量为约400mg。
265、在一实施方案中,两种rnai剂以25-400mg/剂量的组合剂量给药,第一rnai剂与第二rnai剂以3:1的比例给药。在一实施方案中,第一rnai剂的剂量为约18mg的量,第二rnai剂的剂量为约6mg的量,组合剂量为约25mg。在一实施方案中,第一rnai剂的剂量为约27mg的量,第二rnai剂的剂量为约9mg的量,组合剂量为约35mg。在一实施方案中,第一rnai剂的剂量为约30mg的量,第二rnai剂的剂量为约10mg的量,组合剂量为约40mg。在一实施方案中,第一rnai剂的剂量为约36mg的量,第二rnai剂的剂量为约12mg的量,组合剂量为约50mg。在一实施方案中,第一rnai剂的剂量为约75mg的量,第二rnai剂的剂量为约25mg的量,组合剂量为约100mg。在一实施方案中,第一rnai剂的剂量为约150mg的量,第二rnai剂的剂量为约50mg的量,组合剂量为约200mg。在一实施方案中,第一rnai剂的剂量为约225mg的量,第二rnai剂的剂量为约75mg的量,组合剂量为约300mg。在一实施方案中,第一rnai剂的剂量为约300mg的量,第二rnai剂的剂量为约100mg的量,组合剂量为约400mg。
266、在一些实施方案中,第一rnai剂和第二rnai剂以约25-400mg/剂量给药的组合量给药。在一些实施方案中,第一rnai剂和第二rnai剂以约25-50mg、50-75mg、75-100mg、100-125mg、125-150mg、150-175mg、175-200mg、200-225mg、225-250mg、250-275mg、275-300mg、300-325mg、325-350mg、350-375mg、375-400mg、25-75mg、50-100mg、100-150mg、150-200mg、200-250mg、250-300mg、300-350mg、350-400mg、25-100mg、50-150mg、100-200mg、150-250mg、200-300mg、300-400mg、25-200mg或200-400mg/剂量给药的组合量给药。在一些实施方案中,第一rnai剂与第二rnai剂以约25mg、约50mg、约100mg、约125mg、约150mg、约175mg、约200mg、约225mg、约250mg、约275mg、约300mg、约325mg、约350mg、约375mg或约400mg/剂量给药的组合量给药。在一些实施方案中,第一rnai剂和第二rnai剂以约50mg、约75mg、约100mg或约125mg/剂量给药的组合量给药。在一些实施方案中,第一rnai剂和第二rnai剂以约25mg、约35mg、约40mg或约200mg/剂量给药的组合量给药。
267、在一些实施方案中,两种rnai剂以约1-10mg/kg/剂量给药的组合量给药。在一些实施方案中,两种rnai剂以约1-5mg/kg/剂量给药的组合量给药。在一些实施方案中,两种rnai剂以约1-1.5mg/kg、约1.5-2.0mg/kg、约2.0-2.5mg/kg、约2.5-3.0mg/kg、约3.0-3.5mg/kg、约3.5-4.0mg/kg、约4.0-4.5mg/kg、约4.5-5.0mg/kg、约5.0-5.5mg/kg、约5.5-6.0mg/kg、约6.0-6.5mg/kg、约6.5-7.0mg/kg、约7.0-7.5mg/kg、约7.5-8.0mg/kg、约8.0-8.5mg/kg、约8.5-9.0mg/kg、约9.0-9.5mg/kg、约9.5-10mg/kg、约1-2.5mg/kg、约2.5-5.0mg/kg、约5.0-7.5mg/kg、约7.5-10mg/kg、约1-5.0mg/kg或约5.0-10mg/kg/剂量给药的组合量给药。
268、在一些实施方案中,第一rnai剂以约0.6-7mg/kg/剂量给药的量给药,第二rnai剂以约0.3-5mg/kg/剂量给药的量给药。在一些实施方案中,第二rnai剂以约0.5-2.5mg/kg/剂量给药的量给药。在一些实施方案中,第二rnai剂以约0.3-1.5mg/kg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约0.6-5mg/kg/剂量给药的量给药。在一些实施方案中,第一rnai剂以约1-2.5mg/kg/剂量给药的量给药。
269、在一些实施方案中,第一rnai剂和第二rnai剂的给药时间为约1-12个月、约2年、约3年、约4年、约5年、约6年、约7年、约8年、约9年或约10年。在一些实施方案中,第一rnai剂和第二rnai剂的给药时间为至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月、至少约12个月、至少约2年、至少约3年、至少约4年、至少约5年、至少约6年、至少约7年、至少约8年、至少约9年或至少约10年。在一些实施方案中,第一rnai剂和第二rnai剂的给药时间为约1-18周。在一些实施方案中,第一rnai剂和第二rnai剂的给药时间为至少约1周、至少约5周、至少约10周、至少约15周、至少约20周、至少约25周、至少约30周、至少约35周、至少约40周、至少约45周、至少约50周、至少约55周、至少约60周、至少约65周、至少约70周、至少约75周、至少约80周、至少约90周或至少96周。
270、在一些实施方案中,第一rnai剂和第二rnai剂以25-400mg/剂量给药的组合剂量给药。在一实施方案中,第一rnai剂和第二rnai剂以25-400mg的组合剂量给药,并且第一rnai剂与第二rnai剂以1:1的比例给药。在一实施方案中,与第二rnai剂一起给药的第一rnai剂的剂量为约12mg的量,组合剂量为约25mg。在一实施方案中,第一rnai剂和第二rnai剂中每种的剂量为约17mg的量,组合剂量为约35mg。在一实施方案中,第一rnai剂和第二rnai剂中每种的剂量为约20mg的量,组合剂量为约40mg。在一实施方案中,第一rnai剂和第二rnai剂中每种的剂量为约25mg的量,组合剂量为约50mg。在一实施方案中,第一rnai剂和第二rnai剂中每种的剂量为约50mg的量,组合剂量为约100mg。在一实施方案中,第一rnai剂和第二rnai剂中每种的剂量为约100mg的量,组合剂量为约200mg。在一实施方案中,第一rnai剂和第二rnai剂中每种的剂量为约150mg的量,组合剂量为约300mg。在一实施方案中,第一rnai剂和第二rnai剂中每种的剂量为约200mg的量,组合剂量为约400mg。
271、在一实施方案中,第一rnai剂和第二rnai剂以25-400mg/剂量的组合剂量给药,并且第二rnai剂与第一rnai剂以1:2的比例给药。在一实施方案中,第一rnai剂的剂量为约16mg的量,第二rnai剂的剂量为约8mg的量,组合剂量为约25mg。在一实施方案中,第二rnai剂的剂量为约12mg的量,第一rnai剂的剂量为约24mg的量,组合剂量为约35mg。在一实施方案中,第一rnai剂的剂量为约27mg的量,第二rnai剂的剂量为约13mg的量,组合剂量为约40mg。在一实施方案中,第一rnai剂的剂量为约33mg的量,第二rnai剂的剂量为约17mg的量,组合剂量为约50mg。在一实施方案中,第二rnai剂的剂量为约35mg的量,第一rnai剂的剂量为约65mg的量,组合剂量为约100mg。在一实施方案中,v的剂量为约67mg的量,第一rnai剂的剂量为约133mg的量,组合剂量为约200mg。在一实施方案中,第二rnai剂的剂量为约100mg的量,第一rnai剂的剂量为约200mg的量,组合剂量为约300mg。在一实施方案中,第二rnai剂的剂量为约135mg的量,第一rnai剂的剂量为约270mg的量,组合剂量为约400mg。
272、在一实施方案中,第一rnai剂和第二rnai剂以25-400mg/剂量的组合剂量给药,第二rnai剂与第一rnai剂以1:3的比例给药。在一实施方案中,第一rnai剂的剂量为约18mg的量,第二rnai剂的剂量为约6mg的量,组合剂量为约25mg。在一实施方案中,第二rnai剂的剂量为约9mg的量,第一rnai剂的剂量为约27mg的量,组合剂量为约35mg。在一实施方案中,第一rnai剂的剂量为约30mg的量,第二rnai剂的剂量为约10mg的量,组合剂量为约40mg。在一实施方案中,第一rnai剂的剂量为约36mg的量,第二rnai剂的剂量为约12mg的量,组合剂量为约50mg。在一实施方案中,第二rnai剂的剂量为约25mg的量,第一rnai剂的剂量为约75mg的量,组合剂量为约100mg。在一实施方案中,第二rnai剂的剂量为约50mg的量,第一rnai剂的剂量为约150mg的量,组合剂量为约200mg。在一实施方案中,第二rnai剂的剂量为约75mg的量,第一rnai剂的剂量为约225mg的量,组合剂量为约300mg。在一实施方案中,第二rnai剂的剂量为约100mg的量,第一rnai剂的剂量为约300mg的量,组合剂量为约400mg。
273、在一些实施方案中,向有此需要的受试者给药约1mg/kg(mpk)的第一rnai剂和约1mg/kg的第二rnai剂。在一些实施方案中,向有此需要的受试者给药约1.5mg/kg的第一rnai剂和约1.5mg/kg的第二rnai剂。在一些实施方案中,向有此需要的受试者给药约2.0mg/kg的第一rnai剂和约1.0mg/kg的第二rnai剂。在一些实施方案中,向有此需要的受试者给药约3.0mg/kg的第一rnai剂和约1.0mg/kg的第二rnai剂。在一些实施方案中,向有此需要的受试者给药约3.2mg/kg的第一rnai剂和约0.8mg/kg的第二rnai剂。在一些实施方案中,向有此需要的受试者给药约2.7mg/kg的第一rnai剂和约1.3mg/kg的第二rnai剂。在一些实施方案中,向有此需要的受试者给药约4.0mg/kg的第一rnai剂和约1.0mg/kg的第二rnai剂。在一些实施方案中,向有此需要的受试者给药约3.3mg/kg的第一rnai剂和约1.7mg/kg的第二rnai剂。在一些实施方案中,向有此需要的受试者给药在约0.05和约5mg/kg之间的第一rnai剂以及在约0.05和约5mg/kg之间的第二rnai剂。在一些实施方案中,关于第一rnai剂和关于第二rnai剂分开给药(例如,在不同的注射中)。在一些实施方案中,各自剂量的第一rnai剂和各自剂量的第二rnai剂一起给药(例如,在相同的注射中)。在一些实施方案中,各自剂量的第一rnai剂和各自剂量的第二rnai剂制备在单一药物组合物中。
274、在一些实施方案中,rnai组分每月一次(或q4w)、每两个月一次(或q8w)或每三个月一次(或q12w)向受试者给药,剂量为约40-200mg,更特别是100mg、150mg或200mg,更特别是100mg。
275、在一些实施方案中,第一和第二rnai剂各自独立地与(nag37)s缀合,第一rnai剂包括含有seq id no:2的反义链和含有seq id no:11的正义链,第二rnai剂包括含有seqid no:8的反义链和含有seq id no:16的正义链。
276、在一些实施方案中,将rnai组分配制为固体形式,如片剂或胶囊。在一些实施方案中,配制rnai组分用于皮下注射。在一些实施方案中,将rnai组分配制为液体形式,如悬浮液、溶液、乳剂或糖浆,或者可以将其冻干。
277、在一些实施方案中,rnai组分以及核苷(酸)类似物(nuc)或ifn同时或间歇给药。在一些实施方案中,rnai组分以及核苷(酸)类似物(nuc)或ifn分别给药和配制,并且以不同的剂量给药频率给药。在一些实施方案中,rnai组分以及核苷(酸)类似物(nuc)或ifn配制为一个或不同的组合物。在一些实施方案中,将rnai组分配制为溶液,并且通过皮下注射每月一次或每四周一次、每两个月一次或者每三个月一次给药。在一些实施方案中,配制核苷(酸)类似物(nuc)用于每天口服给药。
278、在一些实施方案中,所述方法进一步包括给药核苷(酸)类似物(nuc)。在一些实施方案中,核苷类似物是恩替卡韦(entecavir)、富马酸替诺福韦二吡呋酯(tenofovirdisoproxil fumarate)、替诺福韦艾拉酚胺(tenofovir alafenamide)、拉米夫定(lamivudine)、替比夫定(telbivudine)或其组合,更特别是恩替卡韦、富马酸替诺福韦二吡呋酯、替诺福韦艾拉酚胺或其组合。在一些实施方案中,核苷类似物是恩替卡韦,并且以约0.01-5mg、约0.01-0.05mg、约0.05-0.1mg、约0.1-0.5mg、约0.5-1mg、约1-2mg、约2-3mg、约3-4mg或约4-5mg的每日剂量给药。在一些实施方案中,核苷类似物是恩替卡韦,并且以约0.5mg的每日剂量给药。在一些实施方案中,核苷类似物是富马酸替诺福韦二吡呋酯,并且以约100-500mg、约100-150mg、约150-200mg、约200-250mg、约250-300mg、300-400mg、约400-500mg的每日剂量给药。在一些实施方案中,核苷类似物是富马酸替诺福韦二吡呋酯,并且以约300mg的每日剂量给药。在一些实施方案中,核苷类似物是替诺福韦艾拉酚胺,并且以约5-100mg、约5-25mg、约25-50mg、约50-75或约75-100mg的每日剂量给药。在一些实施方案中,核苷类似物是替诺福韦艾拉酚胺,并且以约25mg的每日剂量给药。在一些实施方案中,核苷类似物是拉米夫定,并且以约50-600mg、约50-300mg、约100-300mg、约100-500mg、约150-400mg、约200-350或约250-300mg的每日剂量给药。在一些实施方案中,核苷类似物是拉米夫定,并且以100mg、150mg或300mg.的每日剂量给药。在一些实施方案中,核苷类似物是替比夫定,并且以约300-800mg、约400-700mg、约300-600mg、约300-400mg、约400-500mg或约500-600mg的每日剂量给药。在一些实施方案中,核苷类似物是替比夫定,并且以600mg的每日剂量给药。在一些实施方案中,患者在联合治疗之前已暴露于核苷类似物。在一些实施方案中,患者在接受联合治疗之前已给药核苷类似物至少1个月、至少3个月、至少6个月或至少1年。
279、在一些实施方案中,干扰素是聚乙二醇化ifn-α(例如,聚乙二醇化ifn-α2a或聚乙二醇化ifn-α2b)或聚乙二醇化ifn-λ,更特别是ifn-α2a或聚乙二醇化ifn-α2b。ifn-α或ifn-λ,更特别是聚乙二醇化ifn-α(2a或2b)或聚乙二醇化ifn-λ,更特别是聚乙二醇化ifn-α(2a或2b)的合适剂量包括但不限于9-75×106单位每周,更特别是15-35×106单位每周(例如,5-10×106单位,每周三次,或5×106单位qd,或10×106单位,每周三次),或0.25-4.0mcg/kg/周(例如,1.0-1.5mcg/kg/周),或25-360mcg/qw或25-360mcg/biw,或25-360qd(例如,100-200mcg/kg/qw或biw或qd,例如,120-180mcg/kg/qw或biw或qd)。
280、在一些实施方案中,干扰素α(例如,genentech)每周给药。在一些实施方案中,干扰素α以120mcg qw或180mcg qw的剂量给药。在一些实施方案中,聚乙二醇化干扰素以180微克每周的剂量给药。
281、在这些联合治疗的一个实施方案中,聚乙二醇化干扰素α-2a(pegasys)每周以180微克(mcg)或120mcg或135mcg(用于对较高剂量阴性反应的患者)的剂量皮下(sq)给药。
282、在这些联合治疗的另一个实施方案中,聚乙二醇化干扰素α-2b(peglntron)每周以1.5mcg/kg/wk的剂量sq给药。
283、在这些方法的其他实施方案中,α-干扰素使用如下:共有干扰素(infergen)以9mcg-15mcg sq每日或每周三次给药;干扰素-α2a重组物以3ml u-9ml u sq每周三次给药;干扰素-α2b(intron a)重组物以3miu-25miu sq每周三次给药;以及聚乙二醇化干扰素λ(il-28)以80mcg-240mcg sq每周给药。
284、在一些实施方案中,干扰素通过静脉内或皮下注射向受试者给药,剂量为约25-500mcg,优选80-300mcg,每周,优选每周一次,更特别是100-200mcg每周,更特别是180mcg每周。
285、在一些实施方案中,干扰素是聚乙二醇化ifnλ-la。聚乙二醇化ifnλ-la的合适剂量包括但不限于180mcg qw;120mcg qw;180mcg/biw;120mcg/biw。
286、在一些实施方案中,干扰素λ(例如,聚乙二醇化λ,例如,聚乙二醇化λ-la)每周给药。在一些实施方案中,干扰素λ以120mcg qw或180mcg qw的剂量给药。在一些实施方案中,干扰素λ以120微克每周的剂量给药。
287、在一些实施方案中,干扰素λ以120微克每周的剂量给药。在一些实施方案中,干扰素λ以180微克每周的剂量给药。在一些实施方案中,干扰素λ皮下给药。
288、在一些实施方案中,干扰素α或λ治疗与rnai和任选存在的核苷(酸)类似物(nuc)联合给药,用于治疗患者的hdv感染,时间为至少1个月、2个月、3个月、4个月、5个月、6个月或更长。
289、在一些实施方案中,一旦停止给药有效量的包含rnai组分的药物组合物,继续给药核苷(酸)类似物(nuc)。
290、在一些实施方案中,患者为hbeag阳性。在一些实施方案中,患者为hbeag阴性。
291、在一些实施方案中,患者的hbsag水平从治疗开始时(第1天)的水平至少降低约log10 0.5、约log10 0.75、约log10 1、约log10 1.25、约log10 1.5、约log10 1.75、约log10 2或约log10 2.5。在一些实施方案中,患者的hbeag水平从治疗开始时(第1天)的水平至少降低约log10 0.5、约log10 0.75、约log10 1、约log10 1.25、约log10 1.5、约log10 1.75、约log10 2或约log10 2.5。在一些实施方案中,患者的hbcrag水平从治疗开始时(第1天)的水平至少降低约log10 0.5、约log10 0.75、约log10 1、约log10 1.25、约log10 1.5、约log101.75、约log102或约log10 2.5。在一些实施方案中,患者的hbv dna水平从治疗开始时(第1天)的水平至少降低约log10 0.5、约log10 1、约log10 1.5、约log10 2、约log10 3、约log10 4、约log10 5或约log10 7.5。在一些实施方案中,患者的hbv rna水平从治疗开始时(第1天)的水平至少降低约log10 0.5、约log10 0.75、约log10 1、约log10 1.25、约log10 1.5、约log10 1.75、约log10 2或约log10 2.5。
292、本技术还涉及有效量的rnai组分以及任选存在的至少一种抗hbv剂(除rnai组分以外)和/或至少一种抗hdv剂(除rnai组分以外),更特别是至少一种抗hbv剂,其中所述至少一种抗hbv剂是核苷(酸)类似物(nuc)或ifn,其中每种如本文所述,用于制备用于治疗受试者,优选人受试者的丁型肝炎病毒(hdv)感染的药物。在一些实施方案中,rnai组分用于每月一次(或q4w)、每两个月一次(或q8w)或每三个月一次(或q12w)向受试者给药,剂量为约40-200mg,更特别是100mg、150mg或200mg,更特别是100mg;核苷(酸)类似物(nuc)用于向受试者给药,每日剂量为约0.1-600mg、约0.1-5mg、约5-50mg、约200-500mg、约100mg、约150mg、约300mg或约600mg,更特别地恩替卡韦的每日剂量约0.1-5mg,替诺福韦艾拉酚胺的每日剂量约5-50mg,替诺福韦二吡呋酯的每日剂量约200-500mg,拉米夫定的每日剂量约100mg、约150mg或约300mg,或者替比夫定的每日剂量约600mg。在一些实施方案中,所述药物用于向感染hdv的受试者,特别是患有hdv/hbv共感染的患者给药。
- 还没有人留言评论。精彩留言会获得点赞!