一种药物组合物及其在治疗癌症中的用途的制作方法
本发明属于生物医学领域,尤其涉及用于治疗或抑制癌症、降低其严重性、降低其风险或抑制其在个体中的转移的方法。该方法包括向个体施用治疗有效量的alk抑制剂和治疗有效量的一种或多种其他抗癌试剂。本发明还涉及包含alk抑制剂和一种或多种其他抗癌试剂的药物组合物或试剂盒。
背景技术:
1、增殖性疾病对现代社会构成严重威胁。癌症的生长由于其独特的特性,包括不可控制的细胞增殖、侵袭局部甚至远处组织的能力、缺乏分化、缺乏可检测的症状以及缺乏有效的治疗和预防,给现代医学带来了严峻的挑战。全世界每年有1000多万人被诊断出患有癌症,癌症每年造成600万人死亡,占全世界死亡人数的12%。
2、小分子alk抑制剂可以被设计成靶向alk突变体,从而治疗包括癌症在内的相关疾病。alk突变的靶向药物包括:第一代靶向药克唑替尼,第二代靶向药色瑞替尼、阿来替尼和布加替尼,第三代劳拉替尼等。然而,靶向药物通常在给药后1年左右出现耐药性。因此,克服靶向药物以及其他抗癌药物的耐药性,提高疗效是药物研发的主要目标之一。
3、发明简述
4、一方面,本发明提供一种用于治疗或抑制癌症、降低其严重性、降低其风险或抑制其在个体中的转移的方法,所述方法包括向个体施用治疗有效量的alk抑制剂,以及治疗有效量的一种或多种抗癌试剂,所述一种或多种抗癌试剂选自cdk4/6抑制剂、mek抑制剂、braf抑制剂、化疗剂、mdm2抑制剂、hdac抑制剂、pd-1抑制剂、parp抑制剂、vegf抑制剂和bcr-abl抑制剂。
5、在另一方面,本发明提供alk抑制剂与选自cdk4/6抑制剂、mek抑制剂、braf抑制剂、化疗剂、mdm2抑制剂、hdac抑制剂、pd-1抑制剂、parp抑制剂的一种或多种抗癌试剂组合在药物制备中的用途,一种用于治疗或抑制癌症、降低其严重性、降低其风险或抑制其在个体中的转移的vegf抑制剂和bcr-abl抑制剂。
6、在另一方面,本发明提供一种药物组合物用于治疗或抑制癌症、降低其严重程度、降低其风险或抑制其在个体中的转移的用途,所述药物组合物包含alk抑制剂以及选自cdk4/6抑制剂的一种或多种抗癌试剂,mek抑制剂、braf抑制剂、化疗剂、mdm2抑制剂、hdac抑制剂、pd-1抑制剂、parp抑制剂、vegf抑制剂和bcr-abl抑制剂。
7、在另一方面,本发明提供一种alk抑制剂,其与选自cdk4/6抑制剂、mek抑制剂、braf抑制剂、化疗剂、mdm2抑制剂、hdac抑制剂、pd-1抑制剂、parp抑制剂,以及一种用于治疗或抑制癌症、降低其严重性、降低其风险或抑制其在个体中的转移的vegf抑制剂和bcr-abl抑制剂的一种或多种抗癌试剂组合使用。
8、在另一方面,本发明提供了一种试剂盒,其包括:
9、(a)第一容器中的第一组分,该第一组分包含alk抑制剂和任选的药学上可接受的载体;
10、(b)第二容器中的第二组分,该第二组分包含一种或多种选自cdk4/6抑制剂,mek抑制剂、braf抑制剂、化学治疗剂,mdm2抑制剂,hdac抑制剂,pd-1抑制剂的抗癌剂,
11、parp抑制剂,vegf抑制剂和bcr-abl抑制剂,以及任选的药学上可接受的载体;
12、和
13、(c)可选部件。
技术实现思路
1、除非下文另有定义,本文中使用的所有技术和科学术语与本领域普通技术人员通常理解的含义相同。对本文所用技术的引用旨在指代本领域普遍理解的技术,包括本领域技术人员对这些技术的明显改变或等效替换。虽然相信以下术语为本领域技术人员所熟知,但提出以下定义以更好地解释本发明。
2、如本文所用,术语“包括”、“包含”、“具有”、“包含”或“包含”及其其他变体是包括性或开放性的,并且不排除其他未列出的要素或方法步骤。
3、如本文所用,“alk”是指间变性淋巴瘤激酶,而“alk抑制剂”是指对alk具有抑制作用的药剂。在一些实施方案中,alk抑制剂还对一个或多个其他靶标(例如,fak(粘着斑激酶)和/或ros1(由人的ros1原癌基因编码的酪氨酸蛋白激酶))具有抑制作用。
4、如本文所用,“cdk4/6抑制剂”是指选择性和有效抑制细胞周期蛋白依赖性激酶4或细胞周期蛋白依赖性激酶6(cdk4/6)的药剂。
5、如本文所用,“mek抑制剂”是指抑制丝裂原活化蛋白激酶(mek)的药剂,并且mek是ras/raf/mek信号通路中的主要蛋白质,其向细胞增殖和存活发出信号,并且经常在在ras或raf癌基因或生长受体酪氨酸激酶中有突变的肿瘤。
6、如本文所用,braf抑制剂是指能够抑制braf的制剂,例如dabrafenib,sorafenib,regorafenib,pazopanib,vemurafenib等。
7、如本文所用,“化疗剂”是指能够杀死肿瘤细胞的化疗药物,这些药物可以作用于肿瘤细胞生长和繁殖的不同阶段,从而抑制或杀死肿瘤细胞。
8、如本文所用,“mdm2抑制剂”是指鼠双微体2(mdm2)抑制剂,其干扰mdm2癌蛋白与肿瘤抑制p53蛋白的结合,并充当药理学p53激活剂。
9、如本文所用,“hdac抑制剂”是指抑制组蛋白脱乙酰酶(hdac)的药剂,并且已被描述为引起生长停滞,随后肿瘤细胞分化或凋亡,而正常细胞不受影响。
10、如本文所用,“pd-1抑制剂”是指靶向程序性死亡1(pd-1)信号通路的药剂,并且可以是抗pd-1抗体。抗pd-1抗体可以是单克隆抗体或双特异性抗体,也可以是全长抗体或抗体片段,只要能阻断pd-1与pd-l1的结合即可。
11、如本文所用,“parp抑制剂”是指抑制聚adp核糖聚合酶(parp)的药剂。
12、如本文所用,“vegf抑制剂”是指靶向血管内皮生长因子(vegf)信号通路的药剂,其中vegf是血管生成的主要调节因子,并且在大多数人类肿瘤中参与肿瘤生长和转移。
13、如本文所用,“bcr-abl抑制剂”是指靶向abelson鼠白血病(abl)和断点簇区(bcr)融合基因的药剂。
14、如本文所用的术语“烷基”,单独或作为另一基团的一部分,是指含有1至12个碳原子(即,c 1-12烷基)或指定数目的碳原子的未取代的直链或支链脂肪烃,例如例如,c1烷基如甲基,c2烷基如乙基,c3烷基如正丙基或异丙基,c1-3烷基如甲基、乙基、正丙基或异丙基等。在一个实施例中,烷基是c1-4烷基。c 1-12烷基的非限制性实例包括甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基、异丁基、3-戊基、己基、庚基、辛基、壬基和癸基。c1-4烷基的实例包括甲基、乙基、正丙基、异丙基、正丁基、仲丁基、叔丁基和异丁基。
15、如本文所用,单独或作为另一基团的一部分使用的术语“环烷基”是指饱和或部分不饱和(含有一个或两个双键)环状脂肪烃,其包含1或2个具有3至12个碳原子的环或表示碳原子数(即,c3-12环烷基)。在一实施例中,环烷基具有两个环。在一实施例中,环烷基具有一个环。在另一个实施方案中,环烷基选自c3-8环烷基。在另一个实施方案中,环烷基选自c3-6环烷基。环烷基的非限制性实例包括环丙基、环丁基、环戊基、环己基、环庚基、环辛基、降冰片基、十氢萘基、金刚烷基、环己烯基和环戊烯基。
16、如本文所用的术语“杂环”或“杂环基”,单独或作为另一基团的一部分,是指饱和或部分不饱和(例如,包含一个或两个双键)环状基团,其包含1、2或3个具有以下特征的环:3至14个环成员(即,3至14元杂环基),其中环之一的至少一个碳原子被杂原子取代。每个杂原子独立地选自氧原子、硫原子(包括亚砜和砜)和/或氮原子(可以被氧化或季铵化)。术语“杂环基”旨在包括其中环中的-ch2-被-c(=o)-取代的基团,例如环状脲基(例如2-咪唑烷酮)和环状酰胺基(例如β-内酰胺)、γ-内酰胺、δ-内酰胺、ε-内酰胺)和哌嗪-2-一。在一个实施方案中,杂环基是包含1个环和1或2个氧和/或氮原子的3至8元环状基团。在一个实施方案中,杂环基是包含1个环和1或2个氧和/或氮原子的4-、5-或6-元环状基团。在一个实施方案中,杂环基是包含1个环和1或2个氧和/或氮原子的4-或6-元环状基团。杂环基可以通过任何可用的碳或氮原子连接到分子的其余部分。杂环基的非限制性实例包括二氧杂环己烷、四氢吡喃基、2-氧代吡咯烷-3-基、哌嗪-2-酮、哌嗪-2,6-二酮、2-咪唑烷酮、哌啶基、吗啉基、哌嗪基、吡咯烷基和二氢吲哚基。
17、如本文所用,术语“对映体过量”或“ee”是指一种对映体相对于另一种对映体存在多少的量度。对于r和s对映体的混合物,对映体过量百分比定义为|r-s|*100,其中r和s分别代表混合物中的摩尔数或重量份数,r+s=1。已知手性物质的旋光度,对映体过量百分比定义为([α]obs/[α]max)*100,其中[α]obs代表对映体混合物的旋光度,[α]max代表纯对映体的旋光度。可以使用多种分析技术确定对映体过量,包括nmr光谱、手性柱色谱或旋光度。本发明的化合物可具有约70%或更高的ee,例如约80%或更高、90%或更高、91%或更高、92%或更高、93%或更高、94%或更高,95%或更高、96%或更高、97%或更高、98%或更高、或99%或更高。
18、如本文所用,术语“药学上可接受的盐”包括化合物的酸加成盐和碱加成盐。
19、合适的酸加成盐由形成无毒盐的酸形成。实例包括乙酸盐、己二酸盐、天冬氨酸盐、苯甲酸盐、苯磺酸盐、碳酸氢盐/碳酸盐、硫酸氢盐/硫酸盐、硼酸盐、樟脑磺酸盐、柠檬酸盐、环己基氨基磺酸盐、乙二磺酸盐、乙磺酸盐、甲酸盐、富马酸盐、葡庚糖酸盐、葡糖酸盐、六氟氯磷酸盐、氢氯酸盐、氢溴酸盐/溴化物、氢碘化物/碘化物、羟乙磺酸盐、乳酸盐、苹果酸盐、马来酸盐、丙二酸盐、甲磺酸盐、硫酸甲酯、萘酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、乳清酸盐、草酸盐、棕榈酸盐、pamo酸盐、磷酸盐/磷酸氢盐、焦磷酸二氢盐醛糖酸盐、硬脂酸盐、琥珀酸盐、鞣酸、酒石酸盐、甲苯磺酸盐、三氟乙酸盐和新叶酸盐。
20、合适的碱加成盐由形成无毒盐的碱形成。实例包括铝盐、精氨酸盐、苄星青霉素盐、钙盐、胆碱盐、二乙胺盐、二乙醇胺盐、甘氨酸盐、赖氨酸盐、镁盐、葡甲胺盐、乙醇胺盐、钾盐、钠盐、氨丁三醇盐和锌盐.
21、有关合适盐类的综述,请参见stahl和wermuth撰写的“药用盐类手册:特性、选择和使用”(wiley-vch,2002年)。制备本发明化合物的药学上可接受的盐的方法是本领域技术人员已知的。
22、如本文所用,术语“溶剂化物”是通过本发明的化合物与溶剂分子例如二溶剂化物、单溶剂化物或半溶剂化物的组合、物理结合和/或溶剂化形成的物质,其中溶剂分子的比例与本发明化合物的比例分别为约2:1、约1:1或约1:2。这种物理键合在不同程度上涉及电离和共价键合(包括氢键合)。在某些情况下(例如,当一种或多种溶剂分子结合到结晶固体的晶格中时),可以分离溶剂化物。因此,溶剂化物包括溶液相和可分离的溶剂化物。本发明的化合物可以与药学上可接受的溶剂(例如水、甲醇和乙醇)呈溶剂化形式,并且本技术旨在包括本发明化合物的溶剂化和非溶剂化形式。
23、一种溶剂化物是水合物。“水合物”涉及溶剂合物的特定子集,其中溶剂分子是水。溶剂化物通常以药理学等价物的形式起作用。溶剂化物的制备是本领域已知的,参见例如m.caira等,j.pharmaceut.sci.,93(3):601-611(2004),其中描述了氟康唑与乙酸乙酯和水的溶剂化物的制备。van tonder等人,aaps pharm描述了用于制备溶剂化物、半溶剂化物、水合物等的类似方法。science.tech.,5(1):article 12(2004)and a.l.bingham etal,chem.commun.603-604(2001)。制备溶剂化物的代表性和非限制性方法包括在高于20℃至约25℃的温度下将本发明的化合物溶解在所需溶剂(有机溶剂、水或其混合物)中,然后将溶液溶解以足以形成晶体的速度冷却,并通过已知方法如过滤分离晶体。分析技术如红外光谱可用于确认溶剂化物晶体中溶剂的存在。
24、在本发明的上下文中,“药学上可接受的载体”是指与治疗剂一起施用的稀释剂、佐剂、赋形剂或媒介物,并且其适用于在以下范围内接触人和/或其他动物的组织合理的医学判断,并且没有过度的毒性、刺激、过敏反应或其他与合理收益/风险比相对应的问题或并发症。
25、可用于本发明的药物组合物或药盒的药学上可接受的载体包括但不限于无菌液体,例如水和油,包括那些源自石油、动物、植物或合成来源的油,例如,花生油、大豆油、矿物油、芝麻油等。当静脉内施用药物组合物时,水是示例性载体。也可以使用生理盐水和葡萄糖和甘油的水溶液作为液体载体,特别是用于注射。合适的药物赋形剂包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽糖、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙二醇、水、乙醇等。根据需要,药物组合物还可以含有少量的润湿剂、乳化剂或ph缓冲剂。口服制剂可含有标准载体,例如医药级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。合适的药学上可接受的载体的实例如remington’spharmaceuticalsciences(1990)中所述。
26、本发明试剂盒的药物组合物和组分可以全身和/或局部地起作用。为此,它们可以通过合适的途径给药,例如通过注射(例如,静脉内、动脉内、皮下、腹膜内、肌肉内给药,包括滴注)或透皮给药;或通过口服、口腔、鼻腔、经粘膜、局部给药、眼科制剂或吸入给药。
27、对于这些给药途径,本发明的药物组合物和试剂盒的组分可以以合适的剂型给药。
28、剂型包括但不限于片剂、胶囊剂、锭剂、硬糖、粉剂、喷雾剂、乳膏剂、软膏剂、栓剂、凝胶剂、糊剂、洗剂、软膏剂、水悬浮液、注射液、酏剂、糖浆剂。
29、如本文所用,术语“容器”是指用于容纳药物成分的容器。该容器可用于制备、储存、运输和/或独立/批量销售,包括瓶、罐、小瓶、烧瓶、注射器、管(例如,用于奶油产品的那些)或任何其他用于制备、容纳、储存或分配药品的容器。
30、如本文所用,术语“规格/说明”是指插入物、标签、标签等,其记录关于位于容器中的药物成分的信息。记录的信息通常由管理产品销售区域的监管机构(例如,美国食品和药物管理局)确定。优选地,包装传单具体列出了药物成分的使用被批准的适应症。包装传单可以由任何材料制成,从其中可以读取包含在其中或上面的信息。优选地,包装传单是可印刷材料(例如,纸、塑料、纸板、箔、粘合纸或塑料等),在其上可以形成(例如,印刷或施加)所需信息。
31、如本文所用,术语“有效量”是指在施用后将在一定程度上缓解所治疗病症的一种或多种症状的活性成分的量。
32、如本文所用,“个体”包括人或非人动物。示例性的人类个体包括患有疾病(例如本文所述的疾病)的人类个体(称为患者)或正常个体。本发明中的“非人动物”包括所有脊椎动物,例如非哺乳动物(例如鸟类、两栖动物、爬行动物)和哺乳动物,例如非人灵长类动物、家养动物和/或驯养动物(例如绵羊、狗、猫、牛、猪等)。
33、如本文所用,“癌症转移”是指从其原始部位扩散(转移)到身体另一区域的癌症。几乎所有的癌症都有转移的可能性。是否会发生转移取决于多种肿瘤细胞因素(包括癌症类型、肿瘤细胞的成熟(分化)程度、癌症的位置和年龄以及其他尚未完全了解的因素)之间复杂的相互作用。有三种转移方式:从肿瘤局部扩散到周围组织,通过血流到达远处部位,或通过淋巴系统到达相邻或远处淋巴结。每种癌症都可以具有代表性的扩散途径。肿瘤根据其原发部位命名(例如,已经转移到大脑的乳腺癌称为转移到大脑的转移性乳腺癌)。
34、如本文所用,“抗性”是指癌细胞对化学疗法有抗性。癌细胞可能通过一系列机制获得对化疗的抗性,包括药物靶点的突变或过度表达、药物的失活或药物从细胞中的消除。
35、治疗用途和方法
36、在一个实施方案中,本发明提供一种药物组合物,其包含alk抑制剂和一种或多种的抗癌试剂选自cdk4/6抑制剂、mek抑制剂、braf抑制剂、化疗剂、mdm2抑制剂、hdac抑制剂、pd-1抑制剂、parp抑制剂、vegf抑制剂和bcr-abl抑制剂。
37、在一个优选的实施方案中,alk抑制剂是式i化合物或其药学上可接受的盐或溶剂化物:
38、
39、其中:
40、r1a和r1b独立地选自氢、c1-6烷基和c3-8环烷基;
41、r2a和r2b独立地选自氢、c1-6烷基和c3-8环烷基;
42、r3选自由氢、c1-6烷基、c3-6环烷基和4-至8-元杂环基组成的组,r4选自c1-4烷基和c3-6环烷基;
43、r5是氢;
44、r6选自c1-4烷基和c3-6环烷基;和
45、r7选自氢、c1-4烷基和c3-6环烷基,
46、条件是当r1a、r1b、r2a和r2b各自为氢时,则r3选自c3-6环烷基和4至8元杂环基。
47、在一个优选的实施方案中,alk抑制剂是式ii化合物或其药学上可接受的盐或溶剂化物:
48、
49、其中:
50、r1a和r1b独立地选自氢、c1-4烷基和c3-6环烷基;
51、r2a和r2b独立地选自氢、c1-4烷基和c3-6环烷基;和
52、r3选自由氢、c1-4烷基、c3-6环烷基和4-至8-元杂环基组成的组。
53、在一个优选的实施方案中,alk抑制剂是式iii化合物或其药学上可接受的盐或溶剂化物:
54、
55、其中:
56、r1a和r2a各自独立地选自c1-4烷基和c3-6环烷基;和
57、该化合物具有约90%或更多的对映体过量。在一些实施方案中,化合物具有约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%的对映体过量或更多、约98%或更多、或约99%或更多。
58、在一个优选的实施方案中,alk抑制剂是式iv化合物或其药学上可接受的盐或溶剂化物:
59、
60、其中:
61、r1a和r2a各自独立地选自c1-4烷基和c3-6环烷基;和
62、该化合物具有约90%或更多的对映体过量。
63、在一些实施方案中,化合物具有约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%的对映体过量或更多、约98%或更多、或约99%或更多。
64、在一个优选的实施方案中,alk抑制剂是式v化合物或其药学上可接受的盐或溶剂化物:
65、
66、其中:
67、r1a和r2a各自独立地选自c1-4烷基和c3-6环烷基;和
68、该化合物具有约90%或更多的对映体过量。在一些实施方案中,化合物具有约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、或约99%或更多的对映体过量。
69、在一个优选的实施方案中,alk抑制剂是式vi化合物或其药学上可接受的盐或溶剂化物:
70、
71、其中:
72、r1a和r2a各自独立地选自c1-4烷基和c3-6环烷基;和
73、该化合物具有约90%或更多的对映体过量。在一些实施方案中,化合物具有约91%或更多、约92%或更多、约93%或更多、约94%或更多、约95%或更多、约96%或更多、约97%或更多、约98%或更多、或约99%或更多的对映体过量。
74、在一个优选的实施方案中,alk抑制剂为下表中的化合物或其药学上可接受的盐或溶剂化物:
75、
76、
77、
78、
79、
80、
81、
82、在一个优选的实施方案中,alk抑制剂是5-氯-n2-(2-异丙氧基-5-甲基-4-(1-(四氢-2h-吡喃-4-基)-1,2,3,6-四氢吡啶)-4-基)苯基)-n4-(2-(异丙基磺酰基)苯基)嘧啶-2,4-二胺,或其药学上可接受的盐或水合物。
83、在一个优选的实施方案中,cdk4/6抑制剂是式(vii)或(viii)的化合物或其药学上可接受的盐:
84、
85、其中在式(vii)或(viii)中,
86、r1选自氢、c1-c4烷基和c3-c6环烷基;
87、r2选自氢、c1-c4烷基、cor5和conr5r6;
88、r3为c3-c6环烷基;
89、r4是4-至6-元杂环基;
90、r5和r6独立地选自氢和c1-c4烷基。
91、在一个优选的实施方案中,cdk4/6抑制剂是帕博西尼、瑞博西尼或其药学上可接受的盐。
92、在一个优选的实施方案中,mek抑制剂是式(ix)或(x)的化合物或其药学上可接受的盐:
93、
94、其中在式(ix)中,
95、r1选自氢、c1-c4烷基和c3-c6环烷基;
96、r2是nhc(o)r7;
97、r3、r4、r5和r7独立地选自氢和c1-c4烷基;
98、r6选自氢、c6-c10芳基,其中芳基任选地被一个或两个卤素基团取代;
99、其中在式(x)中,
100、r1选自c1-c4烷基和卤素;
101、r2选自-ocf3和卤素;
102、r3选自氢和卤素;
103、r4选自c1-c4烷基和c3-c6环烷基;
104、r5为nr6or7,其中r6和r7独立地选自氢和c1-c4烷基,当r7为c1-c4烷基时,其任选被羟基取代。
105、在一个优选的实施方案中,mek抑制剂是曲美替尼、司美替尼或其药学上可接受的盐。
106、在一个优选的实施方案中,所述化疗剂包括铂或属于萜类生物碱。
107、在一个优选的实施方案中,化疗剂是卡铂或紫杉醇。
108、在一个优选的实施方案中,mdm2抑制剂是式(xi)的化合物或其药学上可接受的盐:
109、
110、其中,
111、
112、b是
113、是氢、ch3、ch2ch3、c3烷基或c4烷基;
114、r2是氢;r3为卤素;r4和r5是氢;
115、r6是
116、r7卤素;r8、r9和r10中的每一个为h;
117、re is-c(o)oh,-c(o)nh2,or-c(o)nhso2ch3.
118、在较佳实施例中,mdm2抑制剂系具有以下结构之化合物33,其包含任何互变异构体形式或其医药上可接受之盐:
119、
120、在较佳实施例中,hdac抑制剂系式(xii)化合物或其医药上可接受之盐:
121、
122、其中,
123、r1和r4独立地选自氢和c1-c4烷基;
124、r2选自氢、-ch2oh、-ch2ch2oh和-ch2ch2ch2oh;
125、r3选自氢、c1-c4烷基和c3-c6环烷基;
126、p等于1-3,q等于1-3。
127、在一个优选的实施方案中,hdac抑制剂是帕比司他或其药学上可接受的盐。
128、在一个优选的实施方案中,pd-1抑制剂是抗pd-1抗体。
129、在一个优选的实施方案中,parp抑制剂是式(xiii)的化合物或其药学上可接受的盐:
130、
131、其中,
132、r1选自氢、c1-c4烷基和卤素;
133、r2是4-至8-元杂环基,其任选地被-c(o)r3取代,其中r3是c3-c6环烷基。
134、在一个优选的实施方案中,parp抑制剂是奥拉帕利或其药学上可接受的盐。
135、在一个优选的实施方案中,vegf抑制剂是式(xiv)的化合物或其药学上可接受的盐:
136、
137、其中,
138、r1选自c1-c4烷基和c1-c4烷氧基;
139、r2、r4和r5独立地选自氢和c1-c4烷基;
140、r3选自卤素和c1-c4烷基;
141、r6选自c1-c4烷基和c3-c6环烷基。
142、在一个优选的实施方案中,vegf抑制剂是乐伐替尼或其药学上可接受的盐。
143、在一个优选的实施方案中,bcr-abl抑制剂是式(xv)化合物或其药学上可接受的盐:
144、
145、其中,
146、r1是氢、c1-c4烷基、c3-c6环烷基、c1-c4烷氧基或苯基;r2是氢、c1-c4烷基、c3-c6环烷基或卤素。
147、在一个优选的实施方案中,bcr-abl抑制剂是具有以下结构的化合物34,包括任何互变异构体形式,或其药学上可接受的盐:
148、
149、在一个优选的实施方案中,所述药物组合物用于治疗或抑制个体中的癌症、降低其严重性、降低其风险或抑制其转移,并且所述癌症选自膀胱癌、乳腺癌、宫颈癌、结肠癌(包括大肠癌)、食管癌、食管鳞癌、头颈癌、肝癌、肺癌(包括小细胞肺癌和非小细胞肺癌)、黑色素瘤、胶质母细胞瘤、骨髓瘤、横纹肌肉瘤、炎性肌纤维母细胞瘤,神经涡轮电荷瘤,胰腺癌,前列腺癌,肾癌,肾细胞癌,肉瘤(包括骨肉瘤),皮肤癌(包括鳞状细胞癌),胃癌,睾丸癌,甲状腺癌,子宫癌,间皮瘤,神经母细胞瘤,胆管癌,平滑肌肉瘤、脂肪肉瘤、鼻咽癌、神经内分泌癌、卵巢癌、唾液腺癌、转移由梭形细胞癌、间变性大细胞淋巴瘤、甲状腺未分化癌、非霍奇金淋巴瘤、霍奇金淋巴瘤和血液系统恶性肿瘤引起,如急性髓性白血病(aml)、急性淋巴细胞白血病(all)、弥漫性大b细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤(fl)、慢性淋巴细胞白血病(cll)、慢性粒细胞白血病(cml)、葡萄膜黑色素瘤、胶质母细胞瘤;
150、在一个优选的实施方案中,alk抑制剂与一种或多种抗癌试剂的重量比为0.005-5000:0.005-5000,例如0.05-1500:0.005-5000、0.1-6:0.005-4:0.5000 -400、100:1-350、100:2-300、100:5-200、100:10-150、100:20-100、100:30-90、100:20-80。
151、在一些优选的实施方案中,癌症是间皮瘤、神经母细胞瘤、非小细胞肺癌、肺腺癌(luad)、卵巢癌、葡萄膜黑色素瘤、胶质母细胞瘤、结肠癌和肝癌。
152、在一个优选的实施方案中,alk抑制剂以约0.005mg/天至约5000mg/天的量施用,例如约0.005、0.05、0.5、5、10、20、30、40、50的量,100,150,200,250,300,350,400,450,500,550,600,650,700,750,800,850,900,950,10004,0,05,0500,4500或5000毫克/天。
153、在一个优选的实施方案中,alk抑制剂以约1ng/kg至约200mg/kg、约1μg/kg至约100mg/kg、或约1mg/kg至约50mg/kg的量施用。kg/单位剂量,例如,以约1μg/kg、约10μg/kg、约25μg/kg、约50μg/kg、约75μg/kg、约100μg/kg、约125μg/kg、约150μg/kg、约175μg/kg、约200μg/kg、约225μg/kg、约250μg/kg、约275μg/kg、约300μg/kg、约325μg/kg、约350μg/kg、约375μg/kg、约400μg/kg、约425μg/kg、约450μg/kg、约475μg/kg、约500μg/kg、约525μg/kg、约550μg/kg、约575μg/kg、约600μg/kg、约625μg/kg、约650μg/kg、约675μg/kg、约700μg/kg、约725μg/kg、约750μg/kg、约775μg/kg、约800μg/kg、约825μg/kg、约850μg/kg、约875μg/kg、约900μg/kg、约925μg/kg、约950μg/kg、约975μg/kg、约1mg/kg、约5mg/kg、约10mg/kg、约15mg/kg、abo ut20mg/kg、约25mg/kg、约30mg/kg、约35mg/kg、约40mg/kg、约45mg/kg、约50mg/kg、约60mg/kg、约70mg/kg、约80mg/kg、约90mg/kg、约100mg/kg、约125mg/kg、约150mg/kg、约175mg/kg、约200mg/kg每单位剂量,和每天以一个或多个(例如,1、2、3、4、5、6、7、8、9或10个)单位剂量给药。
154、在优选的实施方案中,一种或多种抗癌试剂以0.005mg/天至约5000mg/天的量施用,例如约0.005、0.05、0.5、5、10、20、30、40、50,100,150,200,250,300,350,400,450,500,550,600,650,700,750,800,850,900,950,10004,0,05,0500,4500或5000毫克/天。
155、在优选的实施方案中,一种或多种抗癌试剂以约1ng/kg至约200mg/kg、约1μg/kg至约100mg/kg或约1mg/kg的量施用至每单位剂量约50mg/kg,例如以约1μg/kg、约10μg/kg、约25μg/kg、约50μg/kg、约75μg/kg、约100μg/kg、约125μg/kg、约150μg/kg、约175μg/kg、约200μg/kg、约225μg/kg、约250μg/kg、约275μg/kg、约300μg/kg、约325μg/kg、约350μg/kg、约375μg/kg、约400μg/kg、约425μg/kg、约450μg/kg、约475μg/kg、约500μg/kg,约525μg/kg、约550μg/kg、约575μg/kg、约600μg/kg、约625μg/kg、约650μg/kg、约675μg/kg、约700μg/kg、约725μg/kg、约750μg/kg、约775μg/kg、约800μg/kg、约825μg/kg、约850μg/kg、约875μg/kg、约900μg/kg、约925μg/kg、约950μg/kg、约975μg/kg、约1mg/kg、约5mg/kg、约10mg/kg、约15mg/kg、约20mg/kg、约25mg/kg、约30mg/kg、约35mg/kg、约40mg/kg、约45mg/kg、约50mg/kg、约60mg/kg、约70mg/kg、约80mg/kg、约90mg/kg、约100mg/kg、约125mg/kg、约150mg/kg、约175mg/kg,每单位剂量约200mg/kg,并且每天以一个或多个(例如,1、2、3、4、5、6、7、8、9或10个)单位剂量给药
156、在一个优选的实施方案中,alk抑制剂和一种或多种抗癌试剂一起、同时、依次或交替给药。
157、在一个优选的实施方案中,alk抑制剂和一种或多种抗癌试剂连续施用至少3天、至少4天、至少5天、至少6天、至少7天、至少8天、至少9天,至少10天,至少11天,至少12天,至少13天,至少14天,至少15天,至少16天,至少17天,至少18天,至少19天,至少20天,至少21天,至少22天,至少23天,至少24天,至少25天,至少30天,至少35天,至少40天,至少45天,或至少50天。
158、在一个优选的实施方案中,在一个或多个(例如,1、2、3、4、5、6、7、8、9或10个)疗程中施用alk抑制剂和一种或多种抗癌试剂,每个疗程持续至少3天,至少4天,至少5天,至少6天,至少7天,至少8天,至少9天,至少10天,至少11天、至少12天、至少13天、至少14天、至少15天、至少16天、至少17天、至少18天、至少19天、至少20天、至少21天、至少22天、至少23天、至少24天、至少25天、至少30天、至少35天、至少40天、至少45天或至少50天;每两个疗程的间隔为0、1、2、3、4、5、6、7、8、9、10天、两周、三周或四周。
159、在一个优选的实施方案中,当有多个疗程时,每个疗程中给予的alk抑制剂和/或抗癌试剂的量相同或不同。在更优选的实施方案中,前一疗程期间给予的alk抑制剂和/或抗癌试剂的量为1-10倍,优选1-5倍,例如在随后的治疗过程中给药的量为:1.5、2、2.5、3、3.5、4、4.5或5倍,。
160、在一个优选的实施方案中,alk抑制剂和一种或多种抗癌试剂通过相同(例如,口服)或不同途径(例如,分别口服和肠胃外(例如,注射))给药。
161、在一个优选的实施方案中,与单独施用或不施用一种或多种alk抑制剂时的抗癌试剂的剂量相比,抗癌试剂以较低的剂量施用。
162、在一个优选的实施方案中,alk抑制剂增强抗癌试剂在治疗癌症中的疗效和/或减少抗癌试剂在治疗癌症中的副作用。
163、在一个优选的实施方案中,本发明提供了alk抑制剂在制备用于增强抗癌试剂在治疗癌症中的功效和/或减少抗癌试剂在治疗癌症中的副作用的药物中的用途。
164、在一个优选的实施方案中,个体患有晚期癌症。
165、在一个优选的实施方案中,个体患有难治性癌症、复发性癌症或耐药性癌症。
166、在另一个实施方案中,本发明提供了一种在个体中治疗或抑制癌症、降低其严重性、降低其风险或抑制其转移的方法,包括向个体施用治疗有效量的alk抑制剂和治疗有效量的alk抑制剂。一种或多种选自cdk4/6抑制剂、mek抑制剂、化疗剂、mdm2抑制剂、hdac抑制剂、
167、pd-1抑制剂、parp抑制剂、vegf抑制剂和bcr-abl抑制剂的抗癌试剂;
168、在一个优选的实施方案中,alk抑制剂如上定义,并且抗癌试剂如上定义。
169、在另一个实施方案中,本发明提供了药物组合物在制备用于治疗或抑制癌症、降低其严重性、降低其风险或抑制其在个体中转移的药物中的用途,所述药物组合物包含alk抑制剂和一种或更多抗癌试剂,以及任选的药学上可接受的载体;
170、在一个优选的实施方案中,alk抑制剂如上定义并且抗癌试剂如上定义。
171、在另一个实施例中,本发明提供了一种试剂盒,包括:
172、(a)第一容器中的第一组分,该第一组分包含alk抑制剂(优选如上定义的alk抑制剂)和任选的药学上可接受的载体;
173、(b)第二容器中的第二组分,该第二组分包含抗癌试剂(优选如上定义的抗癌试剂)和任选的药学上可接受的载体;和
174、(c)可选组件。
175、实施例
176、为使本发明的目的和技术方案更加清楚,下面结合具体实施例对本发明作进一步说明。应当理解,这些实施例并非旨在限制本发明的范围。此外,以下实施例中未提及的具体实验方法按照常规实验方法进行。
177、实施例1.细胞活力wst测定——在nci-h2228细胞中用化合物5和化合物34联合处理
178、式(i)至(vi)的化合物或其药学上可接受的盐包括化合物5(5-氯-n2-(2-异丙氧基-5-甲基-4-(1-(四氢-2h-吡喃-4-yl)-1,2,3,6-四氢吡啶-4-基)苯基)-n4-(2-(异丙基磺酰基)苯基)嘧啶-2,4-二胺)根据wo 2018/044767中所述的生产方法合成,其全部内容通过引用并入本文并用于所有目的,或与其类似的方法。
179、包括化合物34的式(xv)化合物或其药学上可接受的盐可以根据2014年9月30日公开的美国专利号8,846,671b2中描述的制备方法获得,该专利通过引用以其整体并入本文中并且用于所有目的,或类似的方法。
180、细胞接种:通过基于水溶性四唑盐(wst)的cck-8(cell counting kit-8,shanghai life ilab,china)测定法检测抗增殖作用。细胞接种于96孔板中,每个阴性对照组仅加入95μl完全培养基。每孔加入完全培养基细胞悬液95μl,细胞密度为(5-10)×10^4/孔。
181、加药(避光):在96孔培养板中,根据不同细胞对不同药物的敏感性,选择最高浓度为3.7μm,按1:3的比例连续稀释得到6个浓度。每孔加入5μl化合物,每个浓度做2-3个重复孔。加入化合物后,将96孔板置于5% co2培养箱中37℃培养。使用6种不同浓度的化合物34和3种固定剂量的化合物5作用72小时后,测试化合物5和化合物34的组合效果。
182、读数:培养结束时,从待测孔中取出旧液,加入100μl/孔cck-8待测液(相应培养基中含10% cck-8、5% fbs)。将板在co2培养箱中在37℃下连续培养2-4小时。
183、使用酶标仪(spectramax plus 384,molecular devices,llc.,us)在a450 nm下测量od值。使用3个重复孔的平均od值,细胞活力百分比由下式计算:
184、(测试孔外径-空白对照孔外径)/(细胞对照孔外径-空白对照孔外径)×100%。
185、ic50值使用graphpad prism 6.0软件进行非线性回归数据分析方法计算。结果如图1和表1所示。
186、对于组合实验,通过对单一药物对照的3个重复孔的平均od值进行归一化来计算细胞活力。联合用药曲线和单药给药曲线得到的ic50值的比较表明,两种化合物具有协同作用(联合用药曲线左移)。
187、表1.化合物5和化合物34的组合增强对nci-h2228肿瘤细胞增殖的抑制作用
188、
189、注:三个组合的ic50值分别对应0.1μm、2μm和6μm的化合物5浓度,化合物34的浓度为1:3连续稀释得到的6个浓度最高的浓度3.7μm。
190、如表1所示,单独使用化合物34或化合物5和化合物34的组合用于处理nci-h2228细胞72小时,并且这种组合在该模型中显示协同抗增殖活性。
191、实施例2.细胞活力ctg测定——在葡萄膜黑色素瘤mp41细胞中用化合物5和化合物33联合处理
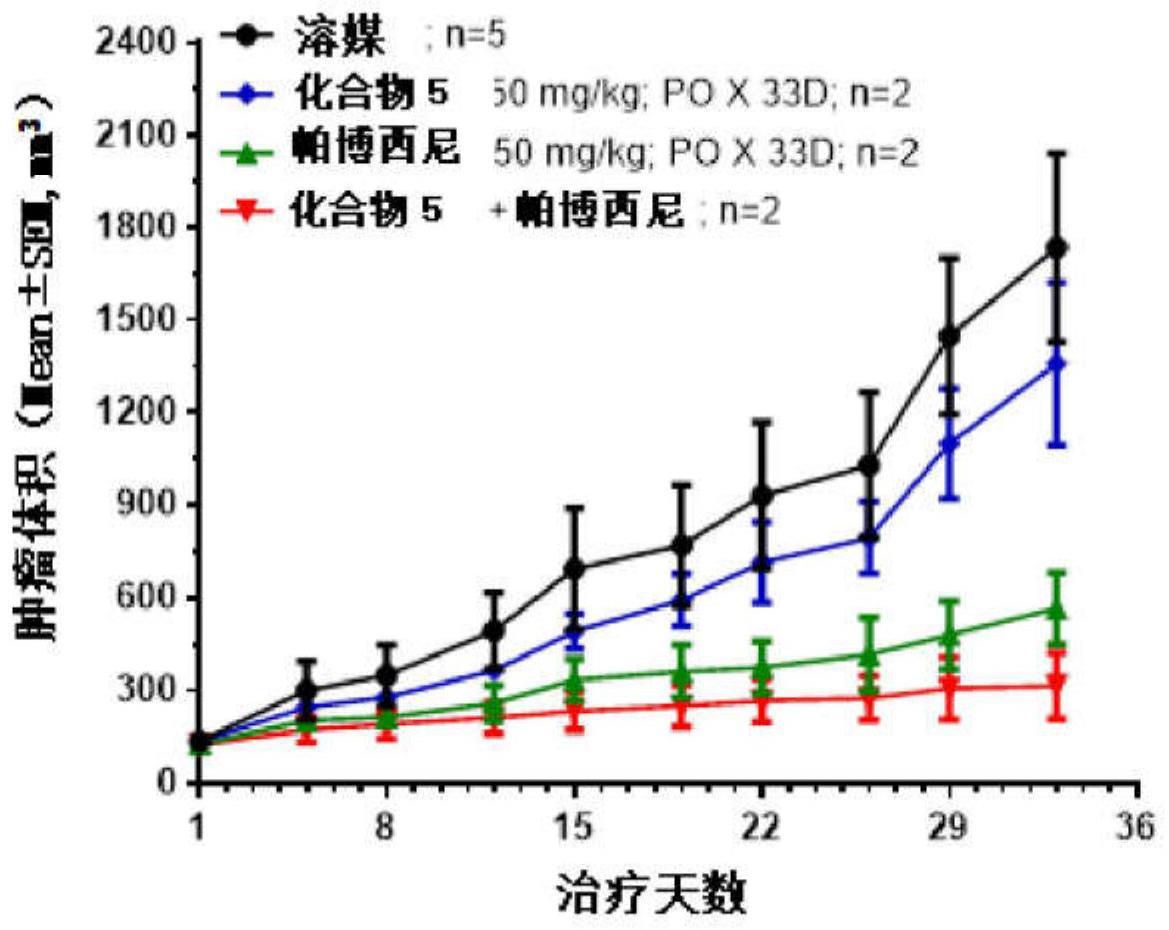
192、使用美国专利号9745314和aguilar等人(j.med.chem.2017(60),2819-2839)中描述的一种或多种方法制备式(xi)化合物或其药学上可接受的盐,包括化合物33和任何互变异构体形式。
193、按照制造商的说明,使用发光细胞活力测定(promega)确定细胞活力。细胞活力计算为细胞活力=(平均rlu样本-平均rlu空白)/(rlu细胞对照-rlu空白)×100。使用graphpad prism计算ic50值。通过calcusyn软件(biosoft,uk)计算组合指数(ci)值。ci<0.9表示协同组合效应。ci<0.1得分为5+表示非常强的协同组合效应,ci为0.1至0.3得分为4+表示强协同组合效应,ci为0.3至0.7得分为3+表示中等协同组合效应。
194、葡萄膜黑色素瘤mp41细胞(atcc)分别用化合物5、mdm2抑制剂化合物33或化合物5和化合物33的组合处理,其中培养物rpmi 1640+10% fbs(胎牛血清)+1% p/s(青霉素-链霉素)。
195、结果如图2所示,其中化合物5和化合物33在葡萄膜黑色素瘤mp41细胞中表现出增强的细胞活力抑制,ci=0.775。
196、实施例3.体内药效学实验评价方法
197、通过细胞接种建立人肿瘤免疫缺陷小鼠皮下移植瘤模型:收集对数生长期肿瘤细胞,计数,重悬于1×pbs中,调整细胞悬液浓度为2.5-5×107/ml。用1ml注射器(4号针头),5-10×106/0.2ml/小鼠皮下接种肿瘤细胞在免疫缺陷小鼠的右侧。所有动物实验均严格按照基因制药有限公司和苏州亚盛医药有限公司实验动物使用和管理规范进行,相关参数计算参照中国国家药监局《非临床试验指南》细胞毒性抗肿瘤药物的研究技术”。
198、在实验期间每周测量动物体重和肿瘤大小两次。每天观察动物的状态和有无死亡。定期监测肿瘤的生长和治疗对动物正常行为的影响,特别涉及实验动物的活动、摄食和饮水、体重增加或减少、眼睛、衣服毛发和其他异常。实验过程中观察到的死亡和临床症状记录在原始数据中。所有给药和测量小鼠体重和肿瘤体积的操作均在超净工作台上进行。根据实验方案要求,末次给药结束后,采集血浆和肿瘤组织,称重并拍照。血浆和肿瘤样品在-80℃下冷冻以备使用。
199、肿瘤体积(tv)计算公式为:tv=a×b2/2,其中a和b分别代表待测肿瘤的长度和宽度。
200、相对肿瘤体积(rtv)计算如下:rtv=vt/v1,其中v1为分组和给药开始时的肿瘤体积,vt为给药后t天测量的肿瘤体积。
201、抗肿瘤活性的评价指标为肿瘤相对增殖率t/c(%),其计算公式为:肿瘤相对增殖率t/c(%)=(trtv/crtv)×100%,trtv为治疗组的rtv,crtv为溶剂对照组的rtv。
202、肿瘤消退率(%)计算为:治疗后sd(病情稳定)、pr(部分消退)、cr(完全消退)的荷瘤小鼠数/本组小鼠总数×100%。
203、体重变化(%)=(实测体重-分组开始时体重)/分组开始时体重×100%。
204、疗效评价标准:根据中国国家药监局《细胞毒性抗肿瘤药物非临床研究技术指南》(2006年11月),当t/c(%)值≤40%,统计分析p<0.05,效率得到证实。如果小鼠体重减少超过20%或与药物相关的死亡人数超过20%,则认为一剂药物具有严重毒性。
205、根据clarke r.的描述,在乳腺癌和其他模型中体内实验性细胞毒性药物研究中的实验设计和终点分析问题[j].breast cancer research&treatment,1997,46(2-3):255-278,使用以下公式评估协同分析:协同因子=((a/c)×(b/c))/(ab/c);a=药物a单独组的rtv值;b=药物b单独组的rtv值;c=溶剂对照组的rtv值,ab=a和b组合组的rtv值。协同因子>1表示达到协同作用;协同因子=1表示达到了加成效果;协同因子<1表示达到拮抗作用。
206、使用mrecist(gao et al.,2015)测量的肿瘤反应包括疾病稳定(sd)、部分肿瘤消退(pr)和完全消退(cr),通过比较第t天的肿瘤体积变化与其基线来确定:肿瘤体积变化(%)=(vt-v1)/v1。bestresponse是t≥10时肿瘤体积变化的最小值(%)。对于每个时间t,还计算了从t=1到t的肿瘤体积变化的平均值。bestavgresponse定义为t≥10时该平均值的最小值。响应标准(mrecist)改编自recist标准(gao etal.,2015;therasse et al.,2000)并定义如下:mcr,bestresponse<-95%和bestavg响应<-40%;mpr、bestresponse<-50%和bestavgresponse<-20%;msd,bestresponse<35%和bestavgresponse<30%;mpd,未另分类。sd、pr和cr被视为响应者并用于计算响应率(%)。疾病控制率(dcr)是根据mrecist显示cr、pr或sd的动物比例计算的;总体反应率(orr)是根据mrecist用证明cr或pr的动物比例计算的。同时监测动物的体重。基于给药第一天(第1天)的动物体重计算体重变化。肿瘤体积和体重变化(%)表示为平均值±平均值的标准误差(sem)。
207、在实施例4-20中使用如实施例3中所述的评价方法。
208、实施例4.在皮下(s.c.)间皮瘤mt16036(tp53突变、fak amp和cdk4高)pdx异种移植肿瘤模型中用化合物5和帕博西尼联合治疗
209、本实验建立了人mt16036细胞源性异种移植物(tp53 mut、fak amp和cdk4 high)肿瘤模型(crown bioscience),以评价化合物5联合cdk4/6抑制剂帕博西尼(易世明(北京)医药化工科技有限公司)。给药方案如下:
210、化合物5:50mg/kg,口服,每天一次,共33天;
211、帕博西尼:50mg/kg,口服,每天一次,共33天;
212、组合给药方案中各药物的给药方案与单药给药方案相同。
213、如表2和图3a所示,给药33天后,化合物5、帕博西尼和帕博西尼与化合物5的组合的t/c(%)值分别为80.31%、34.24%和19.47%。给药33天后,联合组协同因子为1.41,显示协同效应。此外,来自组合物给药组的动物达到了1/2sd。
214、此外,如图3b所示,在研究期间在联合组中观察到很少的体重减轻(小于10%),并且在研究结束时体重恢复。
215、总之,化合物5单药显示出较小的抗肿瘤活性,帕博西尼单药显示出中等的抗肿瘤活性,而联合治疗在间皮瘤pdx模型中显示出增强的抗肿瘤活性、协同抗肿瘤作用和可接受的皮下毒性。
216、表2.化合物5联合帕博西尼在间皮瘤mt16036 pdx小鼠异种移植瘤模型中的协同抗肿瘤作用
217、
218、
219、实施例5.用化合物5和瑞博西尼联合治疗神经母细胞瘤sh-sy5y(alk f1174l)s.c.异种移植肿瘤模型
220、本实验建立神经母细胞瘤sh-sy5y(alk f1174l)异种移植瘤模型,评价化合物5联合cdk4/6抑制剂瑞博西尼(易世明(北京)医药化工科技有限公司)的抗肿瘤作用。给药方案如下:
221、化合物5:50mg/kg,口服,每天一次,共21天;
222、瑞博西尼:75mg/kg,口服,每天一次,共21天;
223、组合给药方案中各药物的给药方案与单药给药方案相同。
224、细胞来源为atcc,细胞培养为f12k:mem=1:1,丙酮酸钠(1x)和neaa(1x),90%;胎牛血清,10%;p/s,1%。
225、如表3和图4a所示,给药21天后,化合物5、瑞博西尼和瑞博西尼与化合物5的组合的t/c(%)值分别为6.74%、33.7%和0.37%。给药21天后,联合组协同因子为6.07,协同作用强。来自组合组的动物达到2/5cr、3/5pr、orr(总反应率)=100%。
226、此外,如图4b所示,在研究期间,在化合物5单药组和联合用药组中观察到很少的体重减轻(小于10%)。
227、综上所述,神经母细胞瘤sh-sy5y异种移植模型中,瑞博西尼单药显示出中等抗肿瘤活性,化合物5单药显示出较强的抗肿瘤活性,而联合治疗显示出显着增强的肿瘤消退、强协同抗肿瘤作用和可接受的皮下毒性。
228、表3.化合物5联合瑞博西尼在神经母细胞瘤sh-sy5y(alk f1174l)小鼠异种移植瘤模型中的协同抗肿瘤作用
229、
230、
231、实施例6.用化合物5和曲美替尼/司美替尼联合治疗皮下a549nsclc异种移植肿瘤模型
232、本实验建立了人a549细胞来源的异种移植肺肿瘤模型,以评价化合物5联合mek抑制剂曲美替尼/司美替尼(selleck)的抗肿瘤作用。给药方案如下:
233、化合物5:100mg/kg,口服,每天一次,共28天;
234、曲美替尼(trametinib):0.5mg/kg,口服,每天一次,共28天;
235、司美替尼(selumetinib):50mg/kg,口服,每天一次,共28天;
236、组合给药方案中各药物的给药方案与单药给药方案相同。
237、细胞来源为cobioer,细胞培养为rpmi 1640培养基,含有300mg/l(2mm)l-谷氨酰胺,调整为含有2.0g/l碳酸氢钠,90%;胎牛血清,10%;p/s 1%。
238、如表4和图5a所示,给药19天后,化合物5、曲美替尼、曲美替尼与化合物5的组合的t/c(%)值分别为72.2%、93.0%和34.9%。给药19天后,化合物5、司美替尼、司美替尼与化合物5的组合的t/c(%)值分别为72.2%、62.5%和35.8%,组合组的协同因子为1.26,表明具有协同效应。
239、此外,如图5b所示,在研究期间在组合组中观察到很少的体重减轻(小于10%),并且在研究结束时体重恢复。
240、总之,在a549 nsclc异种移植模型中,化合物5单药或mek抑制剂(曲美替尼或司美替尼)显示出较小的抗肿瘤活性,而化合物5与mek抑制剂(曲美替尼或司美替尼)联合治疗在a549 nsclc异种移植模型中显示出显着增强的抗肿瘤活性和协同抗肿瘤作用。
241、表4.化合物5联合曲美替尼/司美替尼在a549 nsclc小鼠异种移植瘤模型中的协同抗肿瘤作用
242、
243、实施例7.用化合物5和卡铂在皮下ptk2高表达nsclc pdx模型联合治疗lu-01-0604
244、本实验建立lu-01-0604(无锡医药科技)的ptk2高表达nsclc pdx模型,评价化合物5联合化疗药物卡铂(selleck)的抗肿瘤作用。
245、给药方案如下:
246、化合物5:50mg/kg,口服,每天一次,共29天;
247、卡铂:30mg/kg,腹腔注射,每周一次,共29天;
248、组合给药方案中各药物的给药方案与单药给药方案相同。
249、如表5和图6a所示,给药29天后,化合物5、卡铂、卡铂与化合物5的组合的t/c(%)值分别为94.50%、127.72%和62.77%。给药29天后,联合组协同因子为1.92,显示协同效应。
250、此外,如图6b所示,在研究期间在组合组中观察到很少的体重减轻(小于10%),并且在研究结束时体重恢复。
251、综上所述,化合物5单药和卡铂单药均未表现出抗肿瘤活性,而联合治疗在s.c.nsclc pdx中表现出增强的抗肿瘤活性和协同抗肿瘤作用。
252、表5.化合物5联合卡铂在ptk2高表达nsclc pdx小鼠异种移植肿瘤模型中的协同抗肿瘤作用
253、
254、实施例8.用化合物5和卡铂联合治疗皮下卵巢pa-1异种移植肿瘤模型
255、本实验建立卵巢pa-1异种移植瘤模型,评价化合物5联合化疗药物卡铂(selleck)的抗肿瘤作用。给药方案如下:
256、化合物5:100mg/kg,口服,每天一次,共21天;
257、卡铂:50mg/kg,第1天腹腔注射一次;
258、组合给药方案中各药物的给药方案与单药给药方案相同。
259、细胞来源为cobioer,细胞培养为含10%胎牛血清、p/s为1%的mem培养基。
260、如表6和图7a所示,在第22天,化合物5、卡铂、卡铂与化合物5的组合的t/c(%)值分别为62.89%、94.97%和30.82%,其协同因子为联合组为1.94,显示具有协同效应。
261、此外,如图7b所示,研究期间在组合组中观察到很少的体重减轻(不超过5%)。
262、总之,化合物5单药显示出中等的抗肿瘤活性,而联合治疗在s.c.pa-1卵巢癌异种移植物中显示出协同抗肿瘤作用。
263、表6.化合物5联合卡铂在卵巢pa-1小鼠异种移植瘤模型中的协同抗肿瘤作用
264、
265、实施例9.用化合物5和化疗药物联合治疗ov2423的ptk2高表达卵巢癌pdx模型
266、本实验建立了卵巢癌ov2423的ptk2高表达卵巢癌pdx模型,评价化合物5联合化疗药物卡铂和/或紫杉醇(哈药集团)的抗肿瘤作用。
267、给药方案如下:
268、化合物5:50mg/kg,口服,每日1次,共28天;
269、卡铂:30mg/kg,腹腔注射,每周1次,共28天;
270、紫杉醇:10mg/kg,静脉注射,每周1次,共28天;
271、联合给药方案中每种药物的给药方案与单一药物的给药方案相同。
272、如表7、图8a和图8b所示,给药28天后,化合物5、卡铂、卡铂与化合物5的组合的t/c(%)值分别为78.97%、47.76%和28.06%,协同因子为1.34,显示具有协同效应。
273、如表7、图8b和8c所示,给药28天后,化合物5、紫杉醇、紫杉醇与化合物5联合用药的t/c(%)值分别为78.97%、50.80%和38.07%,联合用药组的协同因子为1.05,显示具有协同效应。
274、此外,如图8d所示,在研究期间,联合用药组的体重几乎没有减轻(小于5%)。
275、表7.化合物5联合紫杉醇或化合物5联合卡铂在ptk2高表达卵巢pdx ov2423小鼠异种移植瘤模型中的协同抗肿瘤作用
276、
277、
278、综上所述,化合物5单药抗肿瘤活性较弱,卡铂单药或紫杉醇单药抗肿瘤活性中等,而化合物5与紫杉醇联合治疗或化合物5与卡铂联合治疗对s.c.卵巢癌pdx模型具有协同抗肿瘤作用。
279、实施例10.化合物5与化疗药物联合治疗卵巢癌pdx模型ov1658
280、本实验建立ov1658卵巢癌pdx模型,评价化合物5联合化疗药物卡铂和/或紫杉醇(哈药集团)的抗肿瘤作用。给药方案如下:
281、化合物5:50mg/kg,口服,每日1次,共19天;
282、卡铂:30mg/kg,腹腔注射,每周1次,共19天;
283、紫杉醇:10mg/kg,静脉注射,每周1次,共19天;
284、联合给药方案中每种药物的给药方案与单一药物的给药方案相同。
285、如表8、图9a和9b所示,给药19天后,化合物5、紫杉醇、紫杉醇与化合物5的联合用药的t/c(%)值分别为106.67%、86.31%和38.10%,联合用药组的协同因子为2.40,显示出协同效应。
286、如表8图9a和9c所示,给药19天后,化合物5与紫杉醇和卡铂组合的t/c(%)值为15.81%,协同因子为2.52,表明具有协同作用。
287、表8.化合物5联合紫杉醇或化合物5联合紫杉醇加卡铂在卵巢pdx ov1658小鼠异种移植肿瘤模型中的协同抗肿瘤作用
288、
289、
290、综上所述,卡铂单药或紫杉醇单药对s.c.卵巢癌pdx模型的抗肿瘤作用较小,而化合物5与紫杉醇联合或化合物5与紫杉醇和卡铂对s.c.卵巢癌pdx模型具有协同抗肿瘤作用。
291、实施例11.用化合物5和化疗药物联合治疗ov1385的ptk2高表达卵巢癌pdx模型
292、本实验建立了ov1385的ptk2高表达卵巢癌pdx模型,评价化合物5联合化疗药物卡铂和/或紫杉醇(哈药集团)的抗肿瘤作用。给药方案如下:
293、化合物5:50mg/kg,口服,每日1次,共35天;
294、卡铂:30mg/kg,腹腔注射,每周1次,共35天;
295、紫杉醇:10mg/kg,静脉注射,每周1次,共35天;
296、联合给药方案中每种药物的给药方案与单一药物的给药方案相同。
297、如表9、图10a和图10b所示,给药35天后,化合物5、紫杉醇及紫杉醇与化合物5的联合用药的t/c(%)值分别为101.49%、44.55%和11.34%,联合用药组的协同因子为3.97,显示出协同效应。
298、如表9图10a和10c所示,给药35天后,化合物5与紫杉醇和卡铂组合的t/c(%)值为7.18%,协同因子为1.57,显示出协同作用。
299、此外,如图10d所示,在研究期间,联合用药组的体重几乎没有减轻(小于5%)。
300、表9.化合物5联合紫杉醇或化合物5联合紫杉醇加卡铂在ptk2高表达卵巢癌pdxov1385小鼠异种移植肿瘤模型中的协同抗肿瘤作用
301、
302、综上所述,卡铂单药或紫杉醇单药对s.c.卵巢癌pdx模型具有中等的抗肿瘤活性,而化合物5与紫杉醇联合或化合物5与紫杉醇和卡铂联合对s.c.卵巢癌pdx模型具有协同抗肿瘤作用。
303、实施例12.化合物5与化疗药物联合治疗卵巢癌ptk2高表达卵巢癌pdx模型
304、本实验建立ov2018的ptk2高表达卵巢癌pdx模型,评价化合物5联合化疗药物紫杉醇(哈药集团)的抗肿瘤作用。给药方案如下:
305、化合物5:50mg/kg,口服,每日1次,共35天;
306、紫杉醇:10mg/kg,静脉注射,每周1次,共35天;
307、联合给药方案中每种药物的给药方案与单一药物的给药方案相同。
308、如表10和图11a所示,给药35天后,化合物5、紫杉醇、紫杉醇与化合物5联合用药的t/c(%)值分别为162.80%、118.60%和7.02%,协同因子为27.49,显示出较强的协同效应。
309、表10.化合物5联合紫杉醇在ptk2高表达卵巢pdx模型ov2018小鼠异种移植瘤模型中的协同抗肿瘤作用
310、
311、综上所述,化合物5单药和紫杉醇单药对s.c.卵巢癌pdx模型无抗肿瘤作用,而化合物5联合紫杉醇对s.c.卵巢癌pdx模型有协同抗肿瘤作用。
312、实施例13.化合物5与紫杉醇联合应用于ovcar3 s.c.卵巢异种移植模型中具有协同抗肿瘤活性
313、本实验建立了卵巢移植ovcar3皮下移植模型,评价化合物5联合化疗药物紫杉醇和卡铂(selleck)的抗肿瘤作用。给药方案如下:
314、化合物5:100mg/kg,口服,每日1次,共35天;
315、紫杉醇:10mg/kg,静脉注射,每周1次,共48天;
316、卡铂:30mg/kg,静脉注射,每周1次,共57天;
317、联合给药方案中每种药物的给药方案与单一药物的给药方案相同。
318、细胞来源为cctcc,细胞培养采用rpmi 1640培养基,调节300mg/l(2mm)l-谷氨酰胺,含1.5g/l碳酸氢钠、4.5g/l葡萄糖、10mm庚和1.0mm丙酮酸钠,80%;胎牛血清,20%;p/s1%。
319、如表11和图12a所示,给药35天后,化合物5、紫杉醇和紫杉醇与化合物5的t/c(%)值分别为85.04%、52.14%和4.99%,协同因子为7.06,具有较强的协同作用;化合物5与紫杉醇加卡铂的t/c(%)值为2.89%,协同因子为7.08,表明协同作用。化合物5与紫杉醇联合组或化合物5与紫杉醇联合卡铂组动物的pr均达到2/5,orr=40%。
320、此外,如图12b所示,化合物5与紫杉醇联合组或化合物5与紫杉醇加卡铂联合组在研究过程中体重下降(小于5%),显示出可接受的毒性。
321、表11.化合物5与紫杉醇组合或化合物5与紫杉醇加卡铂组合在ovcar3 s.c.卵巢小鼠异种移植肿瘤模型中的协同抗肿瘤作用
322、
323、
324、结论:化合物5单剂抗肿瘤活性较小,紫杉醇单剂抗肿瘤活性中等,化合物5与紫杉醇联合治疗或化合物5与紫杉醇联合卡铂联合治疗,在卵巢癌pdx模型中均表现出协同抗肿瘤作用。
325、实施例14.化合物5可克服对紫杉醇或对紫杉醇和卡铂在ovcar3s.c.卵巢异种移植模型中的耐药性
326、在本实验中,我们建立了ovcar3皮下异种卵巢移植模型,以评价化合物5克服紫杉醇和卡铂(selleck)耐药性的活性。给药方案如下:
327、紫杉醇(10mg/kg)每周静脉注射给小鼠一次,连续14天(n=8)。第15天将小鼠随机分为两组,一组(n=5)连续静脉注射紫杉醇单药(10mg/kg,每周1次)至第56天,另一组(n=3)联合紫杉醇(10mg/kg,每周1次)和化合物5(100mg/kg,口服,每天一次),从第15天到第56天。结果如表12和图13a所示。
328、紫杉醇(10mg/kg,静脉注射,每周1次)和卡铂(30mg/kg,静脉注射,每周1次)联合治疗小鼠14天(n=12)。在第15天将小鼠随机分为三组,一组(n=5)连续接受等量的紫杉醇和卡铂联合治疗直到第56天,另一组(n=4)接受紫杉醇加卡铂和化合物5(100mg/kg,口服,每天一次)联合治疗,第三组(n=3)采用化合物5号单药治疗。结果如表12和图13b所示。
329、细胞来源和细胞培养与实施例13相同。
330、如表12和图13a所示,紫杉醇和化合物5联合治疗与紫杉醇单药治疗组相比,抗肿瘤活性增强,与紫杉醇单药治疗组相比,达到2/3pr,orr=66.67%。
331、表12.化合物5可以克服ovcar3 s.c.卵巢小鼠异种移植肿瘤模型对化学治疗剂的抗性
332、
333、如表12和图13b所示,紫杉醇联合卡铂和化合物5联合治疗与紫杉醇和卡铂联合治疗或化合物5单药治疗组相比,抗肿瘤活性增强,与其他组相比,达到4/4pr,orr=100%。
334、实施例15.用化合物5和化合物33在联合治疗s.c.luad a549(kras、stk11、atrmut)异种移植模型
335、在这个实验中,建立一个s.c.luad a549(kras、stk11、atr mut)异种移植模型,评价化合物5与化合物33联合的抗肿瘤作用。给药方案如下:
336、化合物5:100mg/kg,口服,每天一次,共53天;
337、化合物33:50mg/kg,口服,每天一次,从第一天到第14天,第22天到第36天和从第44天到第53天;
338、组合给药方案中各药物的给药方案与单药给药方案相同。
339、细胞来源为cobioer,细胞培养为rpmi 1640培养基,含有300mg/l(2mm)l-谷氨酰胺,调整为含有2.0g/l碳酸氢钠,90%;胎牛血清,10%;p/s 1%。
340、如表13和图14a所示,给药53天后,化合物5、化合物33和化合物33与化合物5的组合的t/c(%)值分别为78.91%、71.66%和43.85%,并且协同因子为1.29,表明具有协同效应。
341、此外,如图14b所示,在研究期间在化合物5和化合物33的组合组中观察到很少的体重减轻(小于5%),表明具有可接受的毒性。
342、表13.化合物5与化合物33组合在a549 nsclc异种移植肿瘤模型中的协同抗肿瘤作用
343、
344、总之,化合物5单药和化合物33单药显示出较小的抗肿瘤活性,而化合物5和化合物33联合治疗在s.c.a549 nsclc异种移植模型中实现了协同抗肿瘤作用。
345、实施例16.用化合物5和化合物33在皮下sh-sy5y(alk f1174l)异种移植模型中联合治疗神经母细胞瘤
346、在这个实验中,建立一个s.c.神经母细胞瘤sh-sy5y(alk f1174l)异种移植模型,以评价化合物5与化合物33联合的抗肿瘤作用。
347、给药方案如下:
348、化合物5:50mg/kg,口服,每天一次,共21天;
349、化合物33:50mg/kg,口服,每日一次,第1天至第10天,第21天口服一次;
350、组合给药方案中各药物的给药方案与单药给药方案相同。
351、细胞来源为atcc,细胞培养为f12k:mem=1:1,丙酮酸钠(1x)和neaa(1x),90%;胎牛血清,10%;p/s,1%。
352、如表14和图15a所示,给药21天后,化合物5、化合物33和化合物33与化合物5的组合的t/c(%)值分别为6.74%、19.38%和1.49%。组合组的动物达到2/5cr、2/5pr、orr=80%。
353、此外,如图15b所示,在研究期间在化合物5和化合物33的组合组中观察到很少的体重减轻(小于10%),显示可接受的毒性。
354、表14.化合物5与化合物33组合在神经母细胞瘤sh-sy5y异种移植肿瘤模型中的协同抗肿瘤作用
355、
356、
357、综上所述,化合物5单药和化合物33单药均显示出较强的抗肿瘤活性,化合物5和化合物33联合治疗显示了增强的抗肿瘤作用。s.c.sh-sy5y神经母细胞瘤异种移植模型的orr达到80%,而其他组为0。
358、实施例17.化合物5和帕比司他联合治疗s.c.a549 nsclc肺癌
359、本实验采用皮下注射a549肺癌模型,观察化合物5与hdac抑制剂panobinostat(帕比司他)联合应用的抗肿瘤作用。给药方案如下:
360、化合物5:100mg/kg,口服,每日1次,共14天;
361、帕比司他:3mg/kg,腹腔注射,给药5d后休息2d,共14d;
362、联合给药方案中每种药物的给药方案与单一药物的给药方案相同。
363、细胞来源为cobioer,细胞培养基为rpmi 1640培养基,含300mg/l(2mm)l-谷氨酰胺,调整为含2.0g/l碳酸氢钠,90%;胎牛血清,10%;p/s 1%。
364、如表15和图16a所示,给药14天后,化合物5、帕比司他、帕比司他与化合物5的联合用药的t/c(%)值分别为89.54%、57.54%和33.79%,联合用药组的协同因子为1.82,表明有协同作用。
365、表15.化合物5联合帕比司他在a549 nsclc异种移植肿瘤模型中的协同抗肿瘤作用
366、
367、
368、综上所述,在s.c.a549非小细胞肺癌(nsclc)移植瘤模型中,化合物5单药的抗肿瘤活性较小,帕比司他单药的抗肿瘤活性中等,而化合物5与帕比司他联合治疗具有协同抗肿瘤作用。
369、实施例18.化合物5和抗pd-1抗体在s.c.结肠ct26的同基因肿瘤模型中的联合治疗
370、本实验建立了s.c.结肠ct26同源肿瘤模型,评价化合物5与抗pd-1抗体(bioxcell,品目号be0146,克隆号:rmp1-14)联合应用的抗肿瘤作用。给药方案如下:
371、化合物5:30mg/kg,口服,每日1次,共12天;
372、化合物5:100mg/kg,口服,每日1次,共12天;
373、抗pd-1抗体:10mg/kg,腹腔注射,每周2次,共12天;
374、联合给药方案中每种药物的给药方案与单一药物的给药方案相同。
375、细胞来源为cobioer,细胞培养为rpmi1640+10%fbs+1%p/s。
376、如表16和图17a所示,第12天,抗pd-1抗体与30mg/kg化合物5和抗pd-1抗体与100mg/kg化合物5组合的t/c(%)值分别为58.76%和56.36%,协同因子分别为2.10和1.64,表明具有协同效应。
377、此外,如图17b所示,在研究期间,化合物5和抗pd-1的组合组中观察到很少的体重减轻(小于5%),表明可接受的毒性。
378、表16.化合物5联合抗pd-1抗体在结肠ct26同源肿瘤模型中的协同抗肿瘤作用
379、
380、
381、综上所述,化合物5单药或抗pd-1单药对s.c.ct26同基因结肠癌模型均无抗肿瘤活性,而联合用药对s.c.ct26同基因结肠癌模型有增强的抗肿瘤活性和协同抗肿瘤作用。
382、实施例19.s.c.fak高表达nsclc lu-01-0751pdx(brca2 mut)中化合物5和奥拉帕利(olaparib)的联合治疗
383、本实验采用无锡医药科技有限公司生产的s.c.fak高表达非小细胞肺癌lu-01-0751pdx(brca2-mut)模型,评价化合物5联合parp抑制剂奥拉帕利(selleck)的抗肿瘤作用。给药方案如下:
384、化合物5:50mg/kg,口服,每日1次,共21天(给药周期为d7~d13);
385、奥拉帕利:50mg/kg,口服,每日2次,共21天;
386、联合给药方案中每种药物的给药方案与单一药物的给药方案相同。
387、如表17和图18a所示,在第28天,化合物5、奥拉帕利(olaparib)和奥拉帕利与化合物5的组合的t/c(%)值分别为104.83%、96.37%和62.25%,协同因子为1.62,表明具有协同效应。
388、表17.化合物5联合奥拉帕利在nsclc lu-01-0751pdx异种移植肿瘤模型中的协同抗肿瘤作用
389、
390、
391、综上所述,化合物5单药或奥拉帕利单药对s.c.nsclc-pdx模型均无抗肿瘤作用,而化合物5与奥拉帕利联合治疗对s.c.nsclc-pdx模型有协同抗肿瘤作用。
392、实施例20.ptk2高表达肝癌pdx li-03-1140模型中联合使用化合物5和lenvatinib(乐伐替尼)治疗
393、本实验建立了一个以li-03-1140为代表的ptk2高表达肝癌pdx模型(药明康德),评价化合物5联合vegf抑制剂lenvatinib(selleck)的抗肿瘤作用。给药方案如下:
394、化合物5:50mg/kg,口服,每日1次,共28天;
395、乐伐替尼(lenvatinib):20mg/kg,口服,每日一次,共28天;
396、联合给药方案中每种药物的给药方案与单一药物的给药方案相同。
397、如表18和图19a所示,28天,化合物5、lenvatib、lenvatib与化合物5的t/c(%)值分别为92.08%、23.40%和9.21%,协同因子为2.33,表明协同效应。
398、表18.化合物5与乐伐替尼组合在li-03-1140的ptk2-高表达肝癌pdx模型中的协同抗肿瘤作用
399、
400、
401、结论:化合物5单剂无抗肿瘤活性,lenvatinib单剂具有较强的抗肿瘤活性,联合治疗在s.c.肝癌pdx模型中均表现出协同抗肿瘤作用。
402、实施例21在tp53wt、brafv600e、nraswt、ptenwt、cdkn2amutc32皮肤黑色素瘤模型中使用化合物33或化合物5和brafi+meki的组合治疗
403、本实验建立了tp53wt、brafv600e、nraswt、ptenwt、cdkn2amut c32皮肤黑色素瘤模型(无锡医药科技有限公司),以评价化合物5联合brafi(dabrafenib/达拉非尼)+meki(trametinib/曲美替尼)(selleck)的抗肿瘤作用。给药方案如下:
404、化合物5:50mg/kg,每日一次,21天,共25天;
405、达拉非尼+曲美替尼:达拉非尼30mg/kg,每天一次,每天一次,共21天,共25天,曲美替尼1mg/kg
406、联合用药给药方案中每种药物的给药方案与单一药物的给药方案相同。
407、如表19和图20所示,在第25天,化合物5、达拉非尼+曲美替尼以及达拉非尼+曲美替尼与化合物5的组合的t/c(%)值分别为106.09%、35.39%和4.55%,协同因子为8.25,表明具有协同效应。
408、表19
409、
410、
411、综上所述,化合物5单药无抗肿瘤活性,达拉非尼+曲美替尼具有较强的抗肿瘤活性,联合治疗对tp53wt、brafv600e、nraswt、ptenwt、cdkn2amut c32皮肤黑色素瘤模型具有协同抗肿瘤作用。
412、实施例22用化合物5和帕博西尼/曲美替尼/tmz联合治疗u-87-mg皮下胶质母细胞瘤
413、在本实验中,建立了u-87-mg皮下胶质母细胞瘤模型(无锡医药科技有限公司),以评估化合物5与帕博西尼/曲美替尼/tmz(替莫唑胺/temozolomide)(selleck)联合使用的抗肿瘤作用。给药方案如下:
414、化合物5:100mg/kg,po qd 21d;
415、帕博西尼:20mg/kg,qd 21d,
416、曲美替尼:0.5mg/kg,qd 21d,
417、tmz:50mg/kg,qd 21d,
418、联合用药给药方案中每种药物的给药方案与单-药物的给药方案相同。
419、如表20和图21所示,在第15天,化合物5、帕博西尼和帕博西尼与化合物5的组合的t/c(%)值分别为120.7%、72.6%和22.0%,协同因子为3.988,表明上述化合物组合具有显著协同效应。
420、表20
421、
422、综上所述,化合物5单一药物没有抗肿瘤活性,而联合治疗在u-87-mg皮下胶质母细胞瘤模型中实现了协同抗肿瘤作用。
423、缩略语和专业术语
424、
425、
- 还没有人留言评论。精彩留言会获得点赞!