一种软骨修复支架及其制备方法与流程
1.本发明涉及医用组织修复材料,具体而言,本发明涉及一种自愈合软骨修复水凝胶支架及其制备方法。
背景技术:
2.创伤和退行性疾病引起的软骨组织损伤很难再生,随着科学技术、医学水平以及人民生活水平的不断提高,软骨损伤修复技术应运而生。典型的软骨损伤修复技术包括:骨髓刺激技术、软骨细胞移植技术、事先种植软骨细胞载体技术、以及自体或异体骨移植术。然而,上述这些技术均存在一定的弊端,并不能很好地解决软骨损伤的问题。例如,(1)骨髓刺激技术是临床上代表性的软骨损伤修复技术,其实质是进行软骨损伤微骨折手术,使骨髓血从手术微孔中流出并凝固形成血块,血块中骨髓干细胞在关节内特有环境下逐渐形成血痂,最后形成纤维软骨组织来修复软骨损伤,但是这种骨髓刺激技术中形成的纤维软骨的强度不高,在反复的日常活动压力下容易破碎;(2)软骨细胞移植技术需要两次手术,软骨细胞容易流失;(3)事先种植软骨细胞载体技术同样需要两次手术,患者痛苦较大;(4)自体或异体骨移植可造成供区部位损伤且供体难以获得,其临床应用受到很大限制。
3.为了解决目前软骨损伤修复中存在的上述问题,选用新的材料作为软骨修复支架的软骨修复工程应运而生,但是,现有的软骨修复支架材料的降解速率过快并且其负载的生长因子的释放速率也过快,不能有效地对软骨损伤进行修复。
技术实现要素:
4.针对现有的软骨修复支架所存在的问题,本发明提供一种可注射的水凝胶软骨修复支架及其制备方法。
5.在本发明的第一方面,本发明提供一种软骨修复支架,其包括:具有邻苯二酚官能团的聚乙二醇丙烯酸甲酯与具有苯硼酸官能团的聚乙二醇丙烯酸甲酯结合形成的具有多孔网络结构的水凝胶,以及负载在所述水凝胶中的生长因子,其中,所述水凝胶具有可注射的粘度。
6.在本发明第一方面的一种实施方式中,所述具有邻苯二酚官能团的聚乙二醇丙烯酸甲酯是聚(3-甲基丙烯酰胺基多巴胺-co-聚乙二醇甲醚甲基丙烯酸酯),所述具有苯硼酸官能团的聚乙二醇丙烯酸甲酯是乙烯基苯硼酸改性的聚乙二醇丙烯酸甲酯。
7.在本发明第一方面的一种实施方式中,所述水凝胶在37℃下的粘度为1,500,000mpa
·
s至2,400,000mpa
·
s。
8.在本发明第一方面的一种实施方式中,所述水凝胶在37℃下的粘度为1,800,000mpa
·
s至2,400,000mpa
·
s。
9.在本发明第一方面的一种实施方式中,所述生长因子为骨形成蛋白bmp-7,其浓度为5-10μg/ml。
10.在本发明第一方面的一种实施方式中,本发明的软骨修复支架在252小时内37℃
下能够降解79%至84%。
11.在本发明第一方面的一种实施方式中,本发明的软骨修复支架的孔隙率为80%至84%,孔径范围为3-40μm。
12.在本发明第一方面的一种实施方式中,本发明的软骨修复支架中所负载的生长因子在252小时内能够从该软骨修复支架中释放68%至74%。
13.在本发明的第二方面,本发明还提供一种制备软骨修复支架的方法,其包括:
14.(1)分别提供具有邻苯二酚官能团的聚乙二醇丙烯酸甲酯的水溶液和具有苯硼酸官能团的聚乙二醇丙烯酸甲酯的水溶液;
15.(2)将上述两种水溶液与生长因子进行混合并在碱性条件下使得邻苯二酚官能团与苯硼酸官能团发生相互结合,形成具有多孔网络结构的水凝胶,其中,该水凝胶具有可注射的粘度,并且在该水凝胶中负载了所述生长因子。
16.在本发明的第二方面的一种实施方式中,所述具有邻苯二酚官能团的聚乙二醇丙烯酸甲酯是聚(3-甲基丙烯酰胺基多巴胺-co-聚乙二醇甲醚甲基丙烯酸酯),所述具有苯硼酸官能团的聚乙二醇丙烯酸甲酯是乙烯基苯硼酸改性的聚乙二醇丙烯酸甲酯。
17.在本发明的第二方面的一种实施方式中,步骤(1)中的所述乙烯基苯硼酸改性的聚乙二醇丙烯酸甲酯的水溶液的浓度为30mg/ml至90mg/ml,所述聚(3-甲基丙烯酰胺基多巴胺-co-聚乙二醇甲醚甲基丙烯酸酯)的水溶液的浓度为30mg/ml至90mg/ml。
18.在本发明的第二方面的一种实施方式中,所述生长因子为骨形成蛋白bmp-7,在步骤(2)中,所述生长因子在混合溶液中的浓度为5-10μg/ml。
19.在本发明的第二方面的一种实施方式中,所述乙烯基苯硼酸改性的聚乙二醇丙烯酸甲酯由单体4-乙烯基苯硼酸和聚乙二醇丙烯酸甲酯以摩尔比为3:7至2:8进行自由基聚合反应制备得到,并且,所述二甲基乙酰胺改性的聚乙二醇丙烯酸甲酯由单体n,n-二甲基乙酰胺和聚乙二醇丙烯酸甲酯以摩尔比为3:7至2:8进行自由基聚合反应制备得到,其中,所述乙烯基苯硼酸改性的聚乙二醇丙烯酸甲酯的数均分子量为30,000g/mol至100,000g/mol,所述聚(3-甲基丙烯酰胺基多巴胺-co-聚乙二醇甲醚甲基丙烯酸酯)的数均分子量为30,000g/mol至100,000g/mol。
20.在本发明的第二方面的一种实施方式中,步骤(2)得到的水凝胶在37℃下的粘度为1,500,000mpa
·
s至2,400,000mpa
·
s,优选地,该水凝胶在37℃下的粘度为1,800,000mpa
·
s至2,400,000mpa
·
s。
21.在本发明的第三方面,本发明还提供由本发明的第二方面所述的方法制备得到的软骨修复支架。
22.本发明相对于现有技术具有如下有益技术效果:由于本发明的软骨修复支架中通过具有邻苯二酚官能团的聚乙二醇丙烯酸甲酯与具有苯硼酸官能团的聚乙二醇丙烯酸甲酯结合形成可注射的、具有多孔网络结构的水凝胶并在该水凝胶中负载有生长因子,因此,在该软骨修复支架充分填充待修复部位之后释放出所负载的生长因子,以促进软骨的生长。同时,由于邻苯二酚官能团和苯硼酸官能团结合形成多孔网络结构,使得软骨修复支架在注射至待修复位点之后不会过快地降解,其降解速率能够适应软骨细胞的生长周期(大约10天左右)对修复支架的要求,例如,本发明的软骨修复支架可逐步降解,在252个小时左右能够降解79%至84%,同时伴随逐步释放其中所负载的生长因子,由此可见,本发明的软
骨修复支架能够随着受损软骨的修复而逐渐释放其中负载的生长因子并同时逐渐降解。此外,本发明的软骨修复支架具有良好的自愈合性,在软骨损伤部位注射修复支架后,可以通过自愈合特性充分填充在软骨损伤处,提供稳定、连续且充分的软骨修复环境,避免修复支架发生位移。并且,由于本发明的软骨修复水凝胶支架具有可注射粘度,可通过注射器直接将水凝胶原位定点注射至待修复部位,不仅能够减小对周围组织的损伤,而且还可消除手术带来的痛苦。
附图说明
23.图1显示了聚合物1poly(4-vpba-co-pegma)的红外光谱图。
24.图2显示了聚合物2poly(dma-co-pegma)的红外光谱图。
25.图3显示了聚合物1poly(4-vpba-co-pegma)的分子量分布。
26.图4显示了聚合物2poly(dma-co-pegma)的分子量分布。
27.图5显示了本发明的实施例3的软骨修复支架#3的红外光谱图。
28.图6a显示了本发明的实施例3的软骨修复支架#3的扫描电镜显微图片。
29.图6b是图6a的局部放大图,其中显示了软骨支架的多孔网络结构和其中所负载的bmp-7。
30.图7显示了使用mtt比色法对实施例3的软骨修复支架#3进行细胞毒性测试的结果。
31.图8a、图8b和图8c显示了本发明实施例3的软骨修复支架#3的自愈合性试验过程。
具体实施方式
32.以下将结合具体实施例对本发明涉及的各个方面进行详细说明,这些具体实施例仅用于举例说明本发明,并不对本发明的保护范围和实质内容构成限定。
33.本发明的软骨修复支架包括:具有邻苯二酚官能团的聚乙二醇丙烯酸甲酯和具有苯硼酸官能团的聚乙二醇丙烯酸甲酯结合形成的具有多孔网络结构的水凝胶,以及负载在所述水凝胶中的骨形成蛋白-7(bmp-7)。在本发明的示例性实施例中,具有苯硼酸官能团的聚乙二醇丙烯酸甲酯是乙烯基苯硼酸改性的聚乙二醇丙烯酸甲酯(poly(4-vpba-co-pegma),简称聚合物1),具有邻苯二酚官能团的聚乙二醇丙烯酸甲酯是聚(3-甲基丙烯酰胺基多巴胺-co-聚乙二醇甲醚甲基丙烯酸酯)(poly(4-dma-co-pegma),简称聚合物2)。
34.实施例1
35.在本实施例中,分别举例说明了上述聚合物1和聚合物2的合成方法以及以聚合物1和聚合物2作为原料制备软骨修复支架的方法。本领域技术人员也可以使用本领域已知的其他方法制备聚合物1和聚合物2,并制备本发明的软骨修复支架。
36.1.1聚合物1:乙烯基苯硼酸改性的聚乙二醇丙烯酸甲酯(poly(4-vpba-co-pegma))的制备以及表征
37.1)将10ml的1,4-二氧六环溶剂加入装有磁力搅拌的单口烧瓶中,并向其中加入44.4mg的单体4-乙烯基苯硼酸(4-vpba)和755mg的聚乙二醇丙烯酸甲酯(pegma,分子量为1,079.27g/mol)(4-vpba和pegma的摩尔比为3:7)以及12mg引发剂偶氮二异丁腈(aibn);
38.2)向上述混合反应体系中通入氮气以除去反应体系中的氧,随后关闭氮气,在85
℃的油浴条件下反应大约40min,通过观察磁子的转动速度来判断聚合体系的流动性;
39.3)当聚合体系粘稠度适宜时,将聚合物和正己烷按照体积比1:5的比例进行沉淀,当聚合物完全沉淀之后用1,4-二氧六环重新溶解,重复上述步骤三次对聚合物产品进行纯化;
40.4)收集纯化后的聚合物产品,得到聚合物1,并在真空干燥箱中过夜干燥待用。
41.聚合物1的红外光谱表征
42.根据上述步骤制备的聚合物1通过傅里叶红外光谱仪进行表征,具体而言,红外表征是通过溴化钾压片法进行的,首先,将溴化钾压片后通过傅里叶红外光谱仪测试的光谱图作为样品的背景,然后将在四氢呋喃中溶解的聚合物滴加到溴化钾片上,将其烘干后重新在傅里叶红外光谱仪中测试的谱图作为样品的红外谱图。图1显示了聚合物1的红外光谱图。如图1所示,2877cm-1
为-ch
2-的特征峰,1610cm-1
为苯环的特征峰,1728cm-1
为酯键的特征峰,1349cm-1
为-c-b-的特征峰,并发现了pegma的特征峰,这表明成功合成了聚合物1poly(4-vpba-co-pegma)。
43.聚合物1的分子量以及分子量分布表征
44.以四氢呋喃为脱洗液,在速度为1毫升/分钟的条件下,用凝胶渗透色谱法(gpc)测试聚合物1的分子量大小和分布。聚合物1的数均分子量为61,245g/mol,其分子量分布(pdi)为1.53(如图3所示)。
45.1.2聚合物2:聚(3-甲基丙烯酰胺基多巴胺-co-聚乙二醇甲醚甲基丙烯酸酯)poly(dma-co-pegma)的制备以及表征
46.1)将10ml的1,4-二氧六环溶剂加入装有磁力搅拌的单口烧瓶中,并向其中加入140.6mg的单体n,n-二甲基乙酰胺(dma)和755.5mg的聚乙二醇丙烯酸甲酯(pegma,分子量为1,079.27g/mol)(dma和pegma的摩尔比为3:7))以及12mg引发剂偶氮二异丁腈(aibn);
47.2)向上述混合反应体系中通入氮气以除去反应体系中的氧,随后关闭氮气,在85℃的油浴条件下反应大约40min,通过观察磁子的转动速度来判断聚合体系的流动性;
48.3)当聚合体系粘稠度适宜时,将聚合物和正己烷按照体积比1:5的比例进行沉淀,当聚合物完全沉淀之后用1,4-二氧六环重新溶解,重复上述步骤三次对聚合物产品进行纯化,
49.4)收集纯化后的聚合物产品,获得聚合物2,并在真空干燥箱中过夜干燥待用。
50.聚合物2的红外光谱表征
51.聚合物2采用与聚合物1相同的方法通过傅里叶红外光谱仪进行表征,图2显示了聚合物2的红外光谱图。如图2所示,2877cm-1
为-ch
2-的特征峰,1651cm-1
为c=o的特征峰,1516cm-1
为n-h的特征峰,1730cm-1
为醚键的特征峰,1110cm-1
为醚键的特征峰,并发现了pegma的特征峰,这表明成功合成了聚合物2poly(4-dma-co-pegma)。
52.聚合物2的分子量和分子量分布表征
53.以四氢呋喃为脱洗液,在速度为1毫升/分钟的条件下,用凝胶渗透色谱法(gpc)测试了聚合物2的分子量大小和分布。聚合物2的数均分子量为57,482g/mol,其分子量分布(pdi)为1.94(如图4所示)。
54.1.3软骨修复支架#1的制备
55.1)将上述制备得到的聚合物1和聚合物2分别配制成浓度为30mg/ml的水溶液;
56.2)取100ml的聚合物1溶液和100ml的聚合物2溶液加入烧瓶中,然后向上述混合溶液中加入2mg的bmp-7,在37℃条件下将加入bmp-7的混合溶液超声5min以确保混合均匀,随后再加入2ml浓度为1mol/l的naoh,使得聚合物1的苯硼酸基团和聚合物2的邻苯二酚基团相互结合,从而得到负载了bmp-7的具有多孔网络结构的水凝胶软骨修复支架#1;
57.3)通过电子束或者co60辐照灭菌技术对制备得到的软骨修复支架进行灭菌,灭菌剂量18kgy-40 kgy。
58.实施例2
59.采用与实施例1相同的方法,但在制备软骨修复支架时改变聚合物1和聚合物2的浓度,两者浓度均改变为50mg/ml,得到负载有10μg/ml bmp-7的水凝胶软骨修复支架#2。
60.实施例3
61.采用与实施例1相同的方法,但在制备软骨修复支架时改变聚合物1和聚合物2的浓度,两者浓度均改变为70mg/ml,得到负载有10μg/ml bmp-7的水凝胶软骨修复支架#3。
62.实施例4
63.采用与实施例1相同的方法,但在制备软骨修复支架时改变聚合物1和聚合物2的浓度,两者浓度均改变为90mg/ml,得到负载有10μg/ml bmp-7的水凝胶软骨修复支架#4。
64.软骨修复支架#1至#4的性能表征
65.1.粘度表征
66.采用伯勒菲粘度计通过赛氏通用粘度法测试软骨修复支架#1至#4在37℃下的粘度,获得的粘度测试结果如下表1。从粘度测试结果可以看出,本发明制备得到的软骨修复支架具有可注射的粘度,可通过注射器进行原位定点注射修复。
67.表1.软骨修复支架#1至#4所使用的聚合物1和聚合物2的浓度以及所得到的软骨修复支架在37℃下的粘度
[0068][0069]
2.软骨修复支架的红外光谱表征
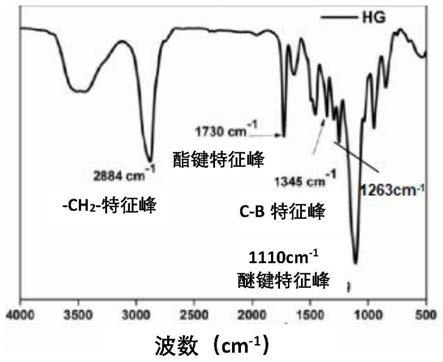
[0070]
采用与上述聚合物1的傅里叶红外光谱仪表征相同的方法,测试了制备得到的作为示例性实施例的软骨修复支架#3的红外光谱图,如图5所示。从图5中可以看出,聚合物1poly(4-vpba-co-pegma)和聚合物2poly(dma-co-pegma)的特征峰,包括2884cm-1
的-ch
2-特征峰,1730cm-1
的酯键特征峰,1345cm-1
的-c-b-特征峰,1110cm-1
的醚键特征峰,以及pegma的特征峰,并且,软骨修复支架#3的红外光谱图中酚氧基特征峰(1263cm-1
)相对于聚合物2的红外光谱图中1282cm-1
的酚氧基特征峰发生了偏移,这是由于邻苯二酚和苯硼酸的结合作用引起的,说明在本发明的软骨修复支架中邻苯二酚和苯硼酸发生结合,两者相互结合使软骨修复支架形成多孔网络结构,适于负载生长因子。
[0071]
3.软骨修复支架的扫描电子显微镜观察结果
[0072]
将软骨修复支架#3进行冷冻干燥处理,随后使用扫描电子显微镜观察其微观形貌,如图6a所示,其局部放大图6b中显示了软骨修复支架中负载了bmp-7。根据图6a和图6b可以看出,该修复支架水凝胶具有三维网络结构,其中具有适合软骨细胞修复的孔隙率和互相连通的孔洞,使这些孔洞内可容纳修复细胞并负载生长因子。对软骨修复支架#1、#2和#4也进行冷冻干燥处理,并使用扫描电子显微镜观察其微观形貌,估算每个软骨修复支架样品中的孔隙率和孔径,结果列于下表2。
[0073]
表2.软骨修复支架#1至#4的孔隙率和孔径
[0074]
样品编号孔隙率(%)孔径(μm)软骨修复支架#1808-40软骨修复支架#2817-35软骨修复支架#3845-30软骨修复支架#4833-28
[0075]
4.软骨修复支架的降解性能表征
[0076]
对上述实施例1-4制备的软骨修复支架#1-#4分别进行降解性能试验,试验方法如下:从各支架中分别取量1ml装入透析袋,将该装有1ml软骨修复支架的透析袋完全浸泡于装有100ml pbs缓冲溶液的锥形瓶中,并完全密封,密封完成后放入37℃的恒温培养箱中进行振荡,在降解试验过程中,按照如下时间间隔进行取样:在前12h内每隔2h取样一次,在12h后每隔24h取样一次,测试时长为252小时。每次取样时,取出缓冲液样品溶液1ml,然后向锥形瓶中补充1ml新鲜pbs缓冲液。对于在第一个取样时间点取出的样品溶液冻干称重乘以体积记录质量为m1,第二个取样时间点取出的样品溶液冻干称重乘以体积记录质量为m2,第三个取样时间点取出的样品溶液冻干称重乘以体积记录质量为m3,以此类推。同时,分别从实施例制备的软骨修复支架#1-#4中另外取量1ml进行冻干后称重,记录质量为m0。各软骨修复支架的降解百分比通过如下公式(1)计算得到。
[0077]
降解百分比=(mn/m0)x 100%
ꢀꢀꢀꢀ
(1)
[0078]
软骨修复支架#1至#4在pbs缓冲溶液中进行252小时降解试验的结果列于下表3。
[0079]
表3.本发明的软骨修复支架#1至#4的降解情况
[0080][0081]
从上表3所列出的降解情况可知,本发明的软骨修复支架在pbs缓冲液中随时间缓慢降解,而非刚放入缓冲液就开始快速降解,其降解速率能够很好地适应软骨细胞的生长需求,通常情况下软骨细胞生长周期为约10天左右,也就是说,受损软骨组织大致需要10天左右的修复时间。根据表2和表3可知,根据本发明的软骨修复支架#1至#4在pbs缓冲液中放置252小时,降解百分比分别为84%、82%、80%和79%,因此,本发明的软骨修复支架的降解速率能够很好地适应于软骨细胞的生长周期的要求,随着软骨细胞的逐渐生长以及受损部位组织的逐渐修复而逐渐降解,能够在软骨修复过程中保持足够的机械强度。
[0082]
5.bmp-7的释放情况表征
[0083]
为了模拟本发明的软骨修复支架在注射至待修复的体内位点之后释放其中所负载生长因子的情况,取1ml软骨修复支架#3加入装有100ml的pbs缓冲液的锥形瓶中,将试管放置于37℃下的恒温振荡水浴箱中进行体外模拟释放实验,水浴箱的振荡速率为60rad/min。按照如下时间间隔取样:在前12h每隔2h取样,12h后每隔24h取样,测试时长为252个小时,每次取样时,从上层清液中小心取出1ml释放液待测,然后将新鲜的1ml pbs缓冲液补加到锥形瓶中。使用酶标仪在450nm波长处通过elisa试剂盒测定第一个取样时间点取出的上
清液测得bmp-7浓度,乘以体积后记录释放量为y1,第二个取样时间点取出的上清液中测得bmp-7的浓度,乘以体积后记录释放量为y2,第三个取样时间点测定上清液中bmp-7的量为y3,以此类推。同时把1ml软骨修复支架中的bmp-7的量作为总量(y
总
)。通过如下公式(2)计算得到bmp-7释放百分比,
[0084]
bmp-7释放百分比=(yn/y
总
)x 100%
ꢀꢀꢀꢀꢀ
(2)
[0085]
采用相同的方法测试计算软骨修复支架#1、#2和#4在252小时内释放bmp-7的情况,软骨修复支架#1至#4的释放bmp-7的释放百分比结果如下表4所示。
[0086]
表4.本发明的软骨修复支架#1至#4的bmp-7的释放百分比
[0087][0088][0089]
从上表4所列出的释放情况来看,本发明的软骨修复支架中所负载的bmp-7在大约10天内能够释放出其初始载量的68%以上,通常,软骨组织中软骨细胞的生长周期为约10天左右,由此可见,将本发明的软骨修复支架给药于待修复位点之后,在软骨细胞的生长过程中,其逐步释放所负载的bmp-7,从而促进软骨的生长。
[0090]
6.软骨修复支架的细胞毒性测试
[0091]
采用mtt比色法对软骨修复支架#3进行细胞毒性测试,使用诸如生理盐水之类的
浸提液将软骨修复支架#3配置成100%、75%、50%和25%浓度的浸提液,评价这些浸提液在24h内对小鼠成纤维细胞l929细胞相对增殖率的影响,其测试结果如图7所示。与空白对照组(即,不含本发明的软骨修复支架的条件下)相比,不同凝胶质量浓度分数的凝胶浸提液都表现出良好的细胞相容性;不同浓度的样品细胞增殖无明显差异,这说明本发明的软骨修复支架的细胞毒性评价合格。
[0092]
7.软骨修复支架的皮内刺激测试
[0093]
根据《gb/t 16886.10-2017》中医疗器械生物学评价的第10部分“刺激与皮肤致敏试验”对软骨修复支架#3进行皮内刺激测试。以新西兰兔作为实验动物(体重不低于2kg),在每只兔脊柱一侧的5个点皮内注射0.2m软骨修复支架#3的生理盐水稀释液和棉籽油稀释液,另一侧注射0.2ml相应的空白生理盐水和棉籽油,共设1组,3只兔子,皮内刺激试验的计分标准在下表5中列出。
[0094]
表5.皮内刺激试验的计分标准
[0095]
反应(红斑和焦痂形成)计分无红斑0极轻微红斑(勉强可见)1清晰红斑2中度红斑3重度红斑(紫红色)至焦痂形成4反应(水肿形成)计分无水肿0极轻微水肿(勉强可见)1清晰水肿(肿起,不超过区域边缘)2中度水肿(肿起约1mm)3重度水肿(肿起超过1mm,并超过接触区)4
[0096]
注:刺激最高计分8分,记录并报告注射部位的其他异常情况。
[0097]
注:油类液体皮内注射常会引发炎症反应。
[0098]
按照上述计分系统,由生理盐水稀释的实施例1的软骨修复支架和由棉籽油稀释的实施例1的软骨修复支架的最终计分分别为0与0.04,均不大于1.0,这说明本发明的软骨修复支架的皮内反应合格,对皮肤没有刺激和致敏反应,具有皮内使用安全性。
[0099]
8、体外自愈合实验
[0100]
本发明以实施例3的软骨修复支架#3为例,对修复支架的自愈合性进行检测,具体步骤如下:
[0101]
取实施例3的软骨修复水凝胶支架#3两份,每份约重2.5g,将这两份软骨修复支架盛放于培养皿中,其中装有12ml的pbs缓冲液,温度为37℃,上述两份水凝胶支架起初在pbs缓冲溶液中为完全分开的块状水凝胶,如图8a所示。随后将这两个块状水凝胶相互接触,如果8b所示,保持3min后用镊子将其拎起来,可以观察到两块水凝胶连成一体,实现自愈合,如图8c所示。由此可以看出,本发明的软骨修复支架具有良好的自愈合特性。
[0102]
以上结合具体实施例对本发明进行了具体说明,这些具体实施例仅仅是示例性的,不能以此限定本发明的保护范围,本领域技术人员在不背离本发明的实质和范围的前
提下可对本发明进行各种修改、变化或替换。因此,依照本发明所作的各种等同变化仍属于本发明所涵盖的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1